Nefritis Intersticial. Sarcoidosis
INTRODUCCIÓN
La nefritis intersticial (NI) puede asociarse a un gran número de enfermedades sistémicas (NAD: Nefritis intersticial). Entre ellas la sarcoidosis, que afecta preferentemente a los pulmones y los ganglios linfáticos intratorácicos (90%). El compromiso extrapulmonar se observa en un 30 a 50% de los pacientes (NAD: Enfermedades sistémicas). El espectro de afectación renal en la sarcoidosis es variado e incluye: hipercalcemia e hipercalciuria, afectación glomerular, uropatía obstructiva y NI granulatomatosa no caseificante, siendo esta última la lesión a nivel renal más característica. Clínicamente, la NI puede producir piuria estéril, leve proteinuria de origen tubular y diferente grado de insuficiencia renal. El diagnóstico se basa en hallazgos clínicos e histológicos compatibles con sarcoidosis y la exclusión de otras enfermedades granulomatosas. Los corticoides son la base del tratamiento, generalmente con una adecuada respuesta y buen pronóstico.
CASO CLÍNICO
Varón de 66 años que acude a urgencias remitido desde la consulta de atención primaria por cuadro clínico de 5 días de evolución caracterizado por dolor abdominal inespecífico, cansancio y el hallazgo analítico de alteración de la función renal.
Entre sus antecedentes de interés, destacan tabaquismo 2 paquetes/día hasta el año 2020, dislipemia, síndrome de apnea del sueño y rizartrosis.
EF: 140/76 mmHg. Afebril. Sin hallazgos relevantes.
En las exploraciones complementarias destacan:
- Análisis: Hb 10.5 g/dl, Hto 29.8%, Glucosa 153 mg/dl, urea 104 mg/dl, Creatinina 3.47 mg/dl, CKD-EPI 17 ml/min, Na 142 mmol/l, K 4.8 mmol/l, pH 7.31, bicarbonato sérico 25.7 mEq/l.
- ECG: sin alteración en la repolarización.
- Radiografía de tórax: aumento del tamaño hiliar compatible con adenopatías hiliares bilaterales.
- Ecografía abdominal y radiografía de abdomen: Sin hallazgos patológicos.
Se completa estudio durante ingreso hospitalario, destacando Ca 10.4 mg/dl, P 4.1 mg/dl, elevación de reactantes de fase aguda (PCR 0.64 mg/dl, ferritina 650 ng/ml, beta-2 microglobulina 13,8 mg/l) y de enzima convertidora de angiotensina (ECA) (82 UI/l), con hipovitaminosis D (19.6 nmol/l).
- Orina de 24 horas: proteinuria 200 mg/24horas. Sedimento anodino.
- TAC torácico: adenopatías paratraqueales, subcarinales, mediastínicas e hiliares bilaterales y áreas de patrón en vidrio deslustrado en el parénquima pulmonar.
- Biopsia de adenopatía: linfadenitis granulomatosa no necrotizante con células gigantes. No se detectan BAAR. No se detecta DNA de Mycobacterium tuberculosis. Cultivo de micobacterias negativo.
- Lavado broncoalveolar (LBA): Celularidad a expensas de linfocitos T con ratio CD4/CD8 superior a 3.5 (6.02).
- PET-TAC: adenopatías mediastínicas e hiliares e infiltrado parenquimatoso pulmonar bilateral.
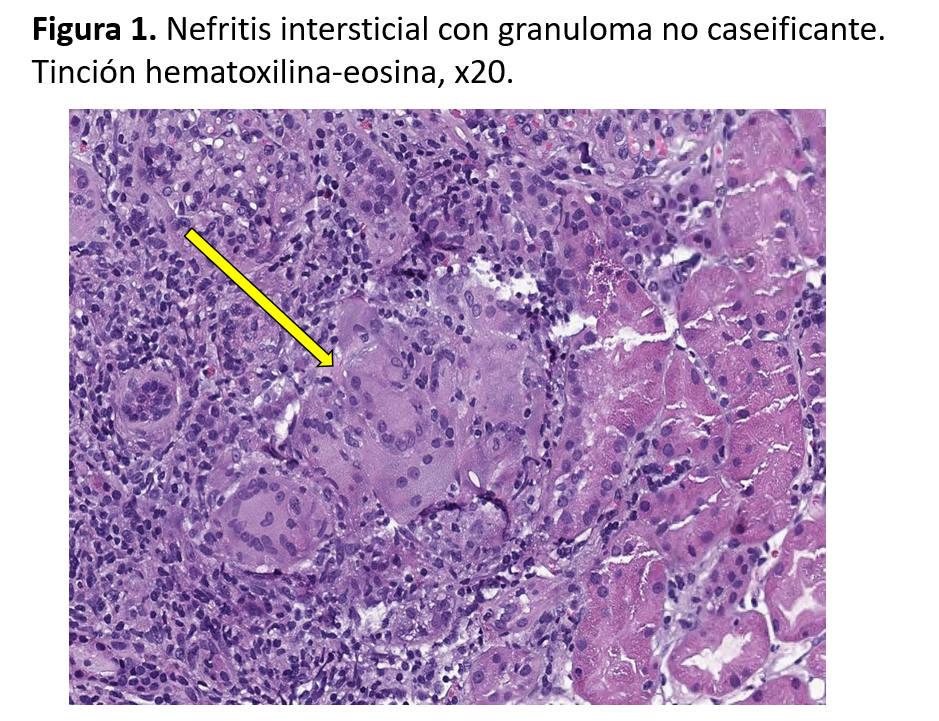
- Biopsia renal: NI con granulomas no caseificantes, sin presencia de microorganismos (en estudio histoquímico con PAS, Gram, Grocott y Ziehl Neelsen no se observan microorganismos) compatible con sarcoidosis. Esclerosis glomerular global en el 16.7% de los glomérulos presentes (36 glomérulos, 6 esclerosados). Atrofia tubular y fibrosis intersticial (Figura 1).
Comenzó tratamiento con corticoides y metotrexate con mejoría lenta progresiva de la función renal en tres meses de seguimiento, llegando hasta creatinina plasmática de 2.18 mg/dl, descenso de la calcemia hasta su normalización (9.7 mg/dl) y descenso de proteinuria a 31.84 mg en 24 horas.
Comentarios
La sarcoidosis es una enfermedad inflamatoria sistémica de etiología desconocida, caracterizada por desarrollar granulomas no necrotizantes (acúmulo de linfocitos T CD4+ activados y macrófagos) y capaz de infiltrar a cualquier órgano. Su patogénesis no está clara. Se considera que se desencadena una respuesta inflamatoria por un antígeno no identificado en un huésped genéticamente susceptible y, a diferencia de otras enfermedades granulomatosas, no se han identificado patógenos bacterianos asociados.
En la mitad de los pacientes, se diagnostica en fase asintomática, incidentalmente tras la realización de un estudio radiológico torácico. La presentación más característica asocia adenopatías hiliares bilaterales, opacidades reticulares pulmonares y/o manifestaciones cutáneas, articulares u oculares. El diagnóstico se basa en 3 criterios esenciales: hallazgos clínicos compatibles, detección histológica de granulomas en 1 o más órganos y exclusión de otras enfermedades granulomatosas [1]. En el estudio broncoscópico, en el LBA, el cociente linfocitos CD4+/CD8+ mayor de 3.5 se considera un marcador sensible que apoya el diagnóstico dada la respuesta inflamatoria inicial consistente en entrada de linfocitos T CD4+ (colaboradores) y acumulación monocitos activados, liberación de citocinas y formación de granulomas en el tejido inflamado. Históricamente, se ha descrito un aumento de la concentración de la ECA en el diagnóstico de la enfermedad. El origen de esta asociación no está del todo claro y podría estar relacionado con que algunos genotipos de la ECA confieren mayor riesgo de presentar la enfermedad. Su sensibilidad y especificidad es del 41,4% y 89,9%, respectivamente, con una tasa de falsos positivos alrededor del 10%, por lo que como prueba única en el diagnóstico de esta enfermedad su uso no es aconsejable [2].
En nuestro caso, ante la presencia de cuadro constitucional y el hallazgo radiológico de adenopatías hiliares bilaterales, ampliamos el estudio complementario para descartar patologías relacionadas con el cuadro descrito, como son, enfermedades granulomatosas, linfomas o infecciones por hongos entre otros. Presentó concentraciones altas de ECA que apoyaban la sospecha diagnóstica de sarcoidosis, y a pesar de ello continuamos ampliando el estudio. Así, la presencia del infiltrado pulmonar bilateral, LBA con ratio de linfocitos CD4/CD8 de 6.02 y granulomas en ganglio linfático y biopsia renal, además de la ausencia de microorganismos y de otras enfermedades granulomatosas, nos llevó a diagnosticar una sarcoidosis ganglionar, pulmonar y renal.
La prevalencia de la afectación renal en la sarcoidosis varía ampliamente debido a los diferentes diseños de los estudios publicados y a la heterogeneidad de las poblaciones incluidas y, a menudo por la presentación asintomática de la enfermedad renal. Asimismo, parte de la prevalencia subestimada de la afectación renal, se debe principalmente a la falta de un enfoque adecuado en la búsqueda de esta afectación, siendo necesario la biopsia renal para apoyar el diagnóstico. Se considera que en el 5% de los pacientes con sarcoidosis se produce afectación renal y que puede ocurrir como manifestación inicial de sarcoidosis [1], como en nuestro caso.
En el estudio realizado por Mahévas et al. de 47 pacientes con sarcoidosis renal (con NI confirmada por biopsia), 46 presentaron creatinina elevada en el momento del diagnóstico y 29 ya presentaban un estadio 4 ó 5 de enfermedad renal crónica [3]. En este mismo estudio, se observaron pocos casos de sedimento patológico (hematuria microscópica 21.7%, leucocituria 28.7%) y la mayoría presentaba proteinuria leve (media de 0.7 g/24 horas). En el caso presentado, el motivo principal por lo que se remitió para valoración a urgencias fue el fracaso renal agudo objetivado en el control analítico de la consulta en atención primaria, con un sedimento sin alteraciones, discreta hipercalcemia y con una proteinuria de 200 mg/24horas. Todos estos hallazgos son compatibles con el estudio citado. La biopsia renal mostró un infiltrado intersticial mononuclear, granulomas no caseificantes y daño tubular, hallazgos compatibles con NI granulomatosa no caseificante, aunque hay que recordar, que los hallazgos anatomopatológicos son sugestivos, pero no diagnósticos, por lo que tenemos que descartar otras enfermedades causantes de lesiones granulomatosas.
En cuanto al tratamiento, se recomienda comenzar con corticoides orales 0,5 – 1 mg/Kg durante 6-12 meses con descenso progresivo hasta los 5 mg/día, lo que en general logra una respuesta al tratamiento rápida con mejoría clínica, aunque se pueden producir recaídas y es posible que se requieran terapias de larga duración (la tasa de recaída oscila 20-80%) [1]. Así, el uso de otros inmunosupresores adicionales (metotrexate, azatioprina, leflunamida o micofenolato, anti-TNF alfa) puede ayudar a reducir la dosis acumulada y los efectos adversos, además de estar indicados cuando existe una respuesta insuficiente. Mahévas et al. describen una correlación entre la respuesta obtenida al mes del tratamiento con la respuesta completa al año del tratamiento, considerándola un factor pronóstico, así como también la puntuación inicial de la fibrosis histológica. La paciente evolucionó favorablemente a los 3 meses, indicando un buen pronóstico.
En resumen, presentamos un caso clínico que debuta con un cuadro constitucional, fracaso renal agudo sin alteraciones en el sedimento urinario y escasa proteinuria, en el que el hallazgo radiológico de adenopatías hiliares bilaterales y discreta hipercalcemia apuntaba a sarcoidosis, lo que se confirmó con los siguientes estudios y permitió un tratamiento dirigido.
Bibliografía:
1. Bergner R, Löffler C. Renal sarcoidosis: approach to diagnosis and management. Current opinion in pulmonary medicine. 2018 Septiembre, 24(5): p. 513-520, DOI: 10.1097/MCP.0000000000000504.
2. Ungprasert P, Carmona EM, Crowson CS, Matteson EL. Diagnostic Utility of Angiotensin-Converting Enzyme in Sarcoidosis: A Population-Based Study. Lung. 2016 Feb,194(1):91-5. DOI 10.1007/s00408-015-9826-3.
3. Mahévas M, Lescure FX, Boffa JJ, Delastour V, Belenfant X, Chapelon C, et al. Renal sarcoidosis: clinical, laboratory, and histologic presentation and outcome in 47 patients. Medicine. 2009 Marzo, 88(2): p. 98-106.