El síndrome cardiorrenal tipo 1 (SCR1) desde un punto de vista práctico
Introducción:
Se expone un caso clínico real de un SCR1 en el seno de una intervención quirúrgica en el que hubo que escalar progresivamente el tratamiento para lograr descongestionar al paciente. Para manejarlo se utilizaron de manera simultánea parámetros clínicos, analíticos y de imagen (ecografía); gracias a ellos, se logró el objetivo al alta: la euvolemia [1] [2].
Nuestra intención es trasladar la importancia de las diferentes herramientas diagnósticas con las que contamos hoy para optimizar el tratamiento del SCR1 y exponer cómo fue la evolución global de nuestro paciente gracias a ellas.
Caso clínico:
Varón de 73 años hipertenso, diabético y dislipémico. También entre sus antecedentes: fibrilación auricular permanente y miocardiopatía dilatada no isquémica con una fracción de eyección del ventrículo izquierdo del 20% en el último ecocardiograma realizado. Su creatinina (Cr) basal oscila entre 1-1,2 mg/dl, (correspondiente a filtrado glomerular entre 78-55 ml/min con cociente albúmina/creatinina en torno a 150 mg/g) lo que supone una enfermedad renal crónica (ERC) estadio 2-3a A2 en el seno de un probable síndrome cardiorrenal tipo 2 asociado a una enfermedad renal diabética. Además, presenta una arteriopatía periférica con un síndrome de isquemia crónica grado IV de la extremidad inferior izquierda (EII) pendiente de amputación mayor.
Su tratamiento habitual incluye furosemida 40 mg/8 horas (h), eplerenona 25 mg a la comida, ramipril 2,5 mg medio comprimido a la cena, hidroclorotiazida 25 mg en el desayuno y antidiabéticos orales (metformina/dapagliflozina 850/5 mg cada 12 h). El sacubitril/valsartan se retiró por hipotensión arterial.
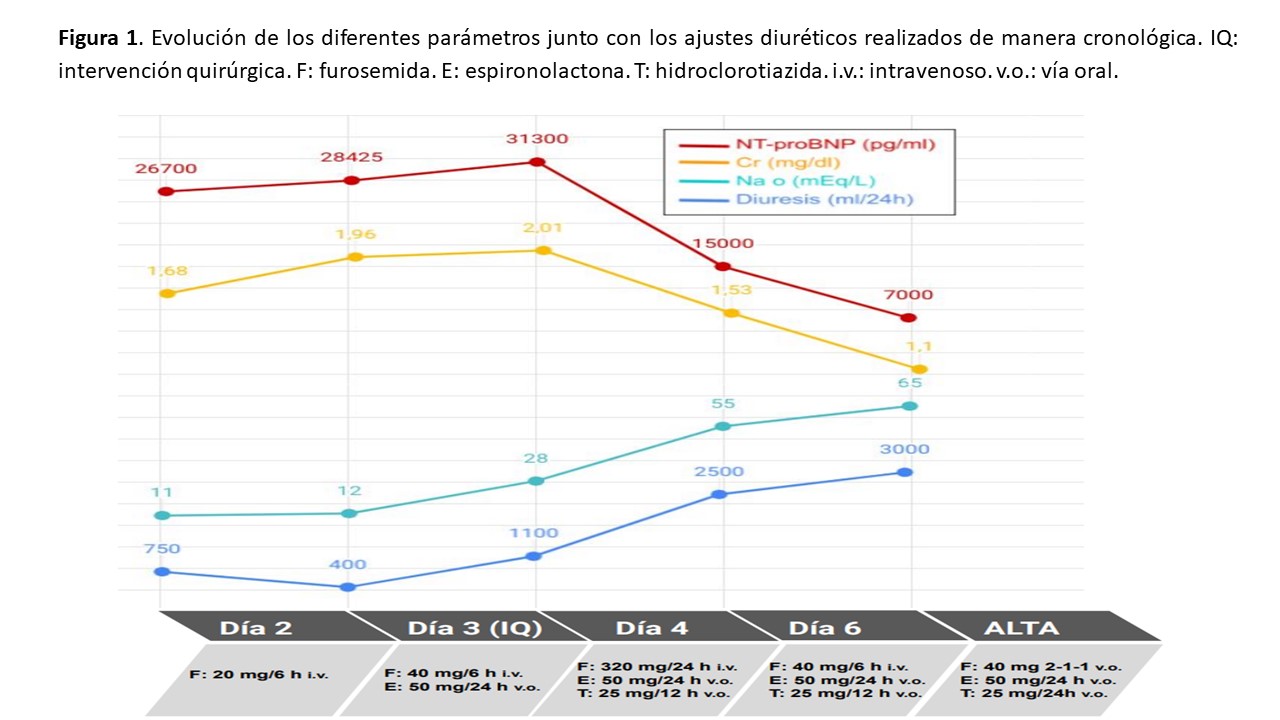
Ingresa desde urgencias por empeoramiento de las lesiones isquémicas de la EII y dolor mal controlado, para amputación preferente. Al ingreso (día 1), se retiran de su tratamiento los antidiabéticos orales según protocolo, así como la tiazida, el ramipril y el antagonista del receptor mineralocorticoide (ARM) por cifras bajas de tensión arterial (TA) que son de 91/52 mmHg. Clínicamente se encuentra eupneico, con una diuresis registrada en las primeras 12 horas de 425 ml, lo que equivaldría teóricamente a 750 ml/24h. Los análisis al ingreso muestran una reagudización de su ERC con Cr de 1,68 mg/dl, iones normales, NT-proBNP 26.700 pg/ml y sodio en orina (Nao) de 11 mEq/l. Con todo ello se solicita valoración por nefrología el día previo a la intervención (día 2).
Tras la valoración por nosotros, con estos datos se decide reiniciar diurético de asa a dosis de 20 mg de furosemida intravenosa (i.v.) cada 6 h, con lo que no se logra mejoría, ya que el tercer día (el día de la intervención quirúrgica mediante amputación supracondílea de la EII), se registra una diuresis de 400 ml/24 h con un empeoramiento de Cr a 1,96 mg/dl y del NT-proBNP (28.425 pg/ml); el Nao es de 12 mEq/l, siendo el potasio plasmático normal (4,6 mEq/l). Se realiza entonces ecografía a pie de cama que muestra una vena cava dilatada con diámetro máximo de 35 mm, no colapsable con la inspiración y suprahepáticas con diámetro superior a 10 mm; además, se objetiva derrame pleural bilateral de moderada cuantía (mayor en el lado derecho), líquido libre perihepático, periesplénico y en pelvis, confirmando la situación congestiva del paciente.
Se decide entonces progresar en el tratamiento diurético asociando espironolactona a dosis de 50 mg/24 h y aumentando nuevamente el diurético de asa (40 mg i.v. cada 6 h). Con ello al cuarto día se logra mejoría de la diuresis que llega a los 1100 ml en 24 h, con un Nao de 28 mEq/l; sin embargo, el paciente precisa oxigenoterapia a 2 lpm para mantener saturaciones de oxígeno superiores al 93% y los parámetros analíticos continúan empeorando (Cr 2,01 mg/dl, NTpro-BNP 31.300 pg/ml). Por ello, se reinicia hidroclorotiazida a dosis de 25 mg cada 12 h y se dobla nuevamente la dosis de diurético de asa (320 mg de furosemida i.v. cada 24 h en perfusión continua). Tras estos cambios, se produce una mejoría de todos los parámetros: la diuresis aumenta de manera progresiva logrando superar los 2500 ml/día, con una natriuresis que supera los 50 mEq/l, mejoría del estado general, retirada de oxigenoterapia y aumento de las cifras de TA que alcanzan los 115/70 mmHg. Analíticamente, la Cr desciende de manera gradual y también de forma paralela el NT-proBNP (1,53 mg/dl y 15.000 pg/ml respectivamente al sexto día). A partir de este momento, se comienza a disminuir paulatinamente el tratamiento diurético, pasando la furosemida a vía oral (v.o.) a las 72 h.
El paciente es dado de alta con una Cr de 1,1 mg/dl sin alteraciones iónicas y un NT-proBNP de 7.000 pg/ml, sin muestras de sobrecarga en la exploración física. En la ecografía abdominopélvica al alta, se objetiva un adecuado diámetro de la vena cava inferior (18 mm) así como de las suprahepáticas, persistiendo derrame pleural y líquido intraabdominal residual.
El tratamiento al alta es el siguiente: hidroclorotiazida 25 mg al desayuno, espironolactona 50 mg a la comida, furosemida 40 mg 2 comprimidos al desayuno y 1 a la comida y a la cena (2-1-1). Se reinician sus antidiabéticos orales (que incluyen ISGLT-2) y el ramipril tal y como los tomaba previamente.
El paciente se cita en 2 semanas en nuestras consultas para control de su estado de volemia, de función renal e hidroelectrolítico, así como para reajuste de su tratamiento en caso de precisarlo.
La (Figura 1) muestra de manera esquemática la evolución de los parámetros a lo largo del ingreso junto con las modificaciones terapéuticas.
Comentarios
Este caso muestra un ejemplo del manejo práctico de la insuficiencia cardiaca reagudizada en situaciones de oliguria y fracaso renal. El reto fue lograr descongestionar a un paciente que había ingresado con una descompensación cardiorrenal y que, en el seno de una arteriopatía periférica, necesitaba una amputación preferente.
En este complicado caso ya partíamos de una elevada necesidad diurética y tratamos de utilizar la mayor cantidad de herramientas diagnósticas para tomar la mejor actitud terapéutica, comenzando por las clínicas (exploración, constantes, diuresis) y las analíticas (cifra de Cr, péptidos natriuréticos). Dentro de estas últimas, merece hacer una mención principal al Nao, cuya monitorización nos guio de manera especial a la hora de ajustar las dosis diuréticas, persiguiendo como objetivo que la natriuresis superase los 50 mEq/l. En tercer lugar, la imagen ecográfica nos apoyó a confirmando tanto la situación de sobrecarga (y la necesidad de aumentar el tratamiento diurético) al inicio del cuadro, como de mejoría congestiva/euvolemia al alta, considerándola sin duda una parte más en el manejo del paciente congestivo.
Respecto a la escalada diurética, se siguió un esquema progresivo basado en las guías de la Sociedad Europea de Cardiología de cara a progresar en las dosis y número de diuréticos [3] [4]. Decidimos ser contundentes desde el inicio con el tratamiento diurético, apoyados en el hecho de que el empeoramiento de la función renal en situaciones de congestión al ingreso es indicativo de mal pronóstico [5].
Como preguntas nos planteamos la utilidad de los ISGLT-2 como adyuvantes diuréticos en casos agudos tendentes a la refractariedad o resistencia diurética como en nuestro caso, dado su conocido efecto glucosúrico y natriurético, cuya utilidad está por determinar y que podrían haber sido de utilidad. También nos preguntamos si el POCUS/VEXUS (en lugar de la ecografía básica de cava/suprahepáticas) nos hubiera arrojado mejores y más precoces datos sobre la nefropatía congestiva que hubiera podido contribuir a ser más agresivos inicialmente con la dosis diurética [6].
Concluimos que la adecuada valoración del paciente congestivo en situación aguda es compleja y, aunque hoy en día contamos cada vez con más herramientas que permiten valorar este tipo de casos, no hay que olvidar el valor de la información clínica y bioquímica básica que ayudan al manejo. Este tipo de situaciones suponen un desafío clínico y es preciso abordarlas desde un punto de vista integral y multidisciplinar, avanzando así a la hora de optimizar el tratamiento para los pacientes con síndrome cardiorrenal [1].
BIBLIOGRAFÍA EXTRA:
1.McCallum W. et al. Acute Kidney Function Declines in the Context of Decongestion in Acute Decompensated Heart Failure. J Am Coll Cardiol HF 2020, 8:537–547.
2. Wettersten N. et al. Decongestion discriminates risk for one-year mortality in patients with improving renal function in acute heart failure. European Journal of Heart Failure (2021) 23, 1122–1130.
3.Mullens W. et al. The use of diuretics in heart failure with congestion - a position statement from the Heart Failure Association of the European Society of Cardiology. European Journal of Heart Failure (2019) 21, 137–155.
4.Mullens W. et al. Evaluation of kidney function throughout the heart failure trajectory – a position statement from the Heart Failure Association of the European Society of Cardiology. European Journal of Heart Failure (2020) 22, 584–603.
5.Shirakabe A. et al. Worsening renal function definition is insufficient for evaluating acute renal failure in acute heart failure. ESC Heart Failure 2018; 5: 322–331.
6.González Delgado D, Romero González GF. Valoración ultrasonográfica de la congestión venosa: VExUS una herramienta de medicina de precisión a pie de cama. Rev Ecocar Pract (RETIC). 2021; 4: 52-54.