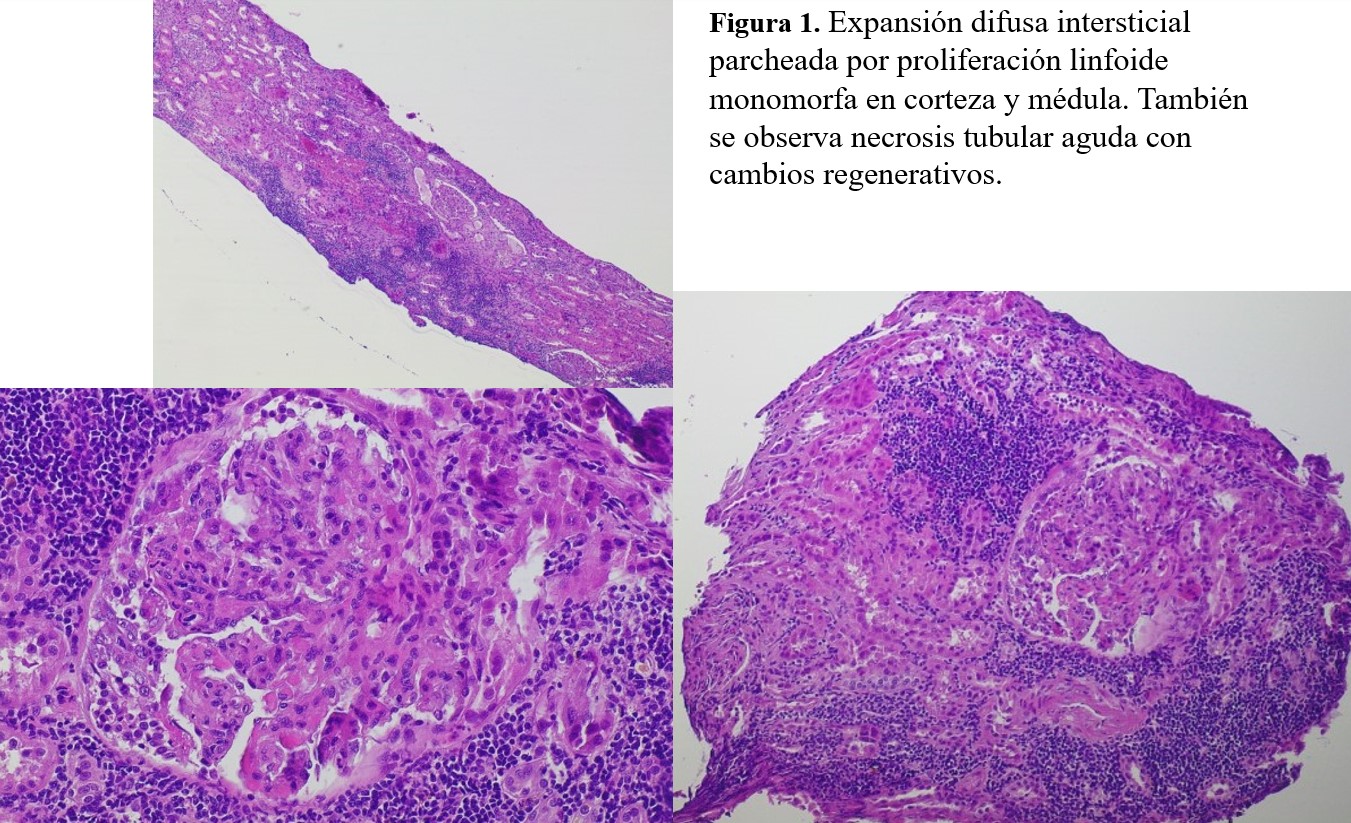
Insuficiencia renal aguda por infiltración linfocitaria
INTRODUCCIÓN
La afectación renal en las neoplasias hematológicas es frecuente, pudiendo presentarse como fracaso renal agudo (FRA) hasta en el 60% de los pacientes. La etiología es variada, la causa que vamos a tratar en este caso clínico es la infiltración renal por células neoplásicas, que ocurre en aproximadamente el 1% de linfomas o leucemias. La infiltración renal puede variar en su expresión desde asintomática hasta el FRA franco. El diagnóstico definitivo lo obtenemos del estudio anatomopatológico de la biopsia renal, siendo el hallazgo más frecuente la lesión tubulointersticial por infiltración linfoide. El tratamiento consiste en corticoterapia de inicio junto a un tratamiento dirigido contra la enfermedad de base, una vez diagnosticado el proceso hematológico subyacente. Con el tratamiento, la función renal suele mejorar rápidamente, por lo que aunque sea una causa infrecuente de FRA, hemos de pensar en ella para diagnosticarla y tratarla, pues es una causa potencialmente reversible.
CASO CLÍNICO
Varón de 78 años, derivado a consulta de Nefrología en febrero 2023 por hematuria macroscópica y FRA con creatinina de 2,2 mg/dl. En sus antecedentes personales destaca hipertensión arterial, obesidad, ex-tabaquismo; cardiopatía isquémica con enfermedad coronaria de un vaso revascularizada con stent farmacoactivo en 2020, cardiopatía valvular mitral leve y fibrilación auricular con cierre de orejuela; leucemia linfática crónica (LLC) con diagnóstico en 2014 y sin tratamiento por ausencia de criterios clínicos. Su función renal 4 meses antes de su derivación era normal, con creatinina de 1,1 mg/dl y sedimento anodino.
En la ecografía abdominal se evidenciaron riñones simétricos, de 11 cm de longitud, normoposicionados, con adecuada vascularización y diferenciación corticomedular, sin imágenes sugerentes de litiasis, ectasias ni masas. Se realizó estudio complementario por parte de Urología, realizándose cistoscopia sin hallazgos patológicos.
Durante el mes siguiente, el paciente continuó con deterioro progresivo de la función renal hasta creatinina de 5,4 mg/dl y episodios intermitentes de hematuria, en ocasiones con anemización. Ante el deterioro progresivo acelerado, se decidió ingreso hospitalario para biopsia renal.
Al ingreso, el paciente refería astenia, aumento de edema en miembros inferiores, sin disnea ni ortopnea. No observó disminución del ritmo de diuresis, la ingesta hídrica en las semanas previas fue de aproximadamente 1L diario. No refirió náuseas, ni vómitos, ni prurito. Tenía un aceptable control de la presión arterial ambulatoria (AMPA 120/70 mmHg). No tenía prescritos fármacos nefrotóxicos, estaba afebril y no refería disuria.
En la exploración física destacaba: PA 127/58mmHg, FC 78lpm, SpO2 94%, Tª 36.8ºC, diuresis 24h 900ml. Auscultación cardiopulmonar sin hallazgos. Extremidades inferiores con edema con fóvea hasta 1/3 superior de pierna.
Pruebas complementarias al ingreso:
- Analítica: creatinina 5.46 mg/dl, urea 150 mg/dl, calcio 9.1 mg/dl, fósforo 5.4 mg/dl, albúmina 3.1 g/dl, PCR 0.53 mg/dl, VSG 63 mm, ferritina 81 ng/ml, C3 y C4 en rangos normales, IgA 191 mg/dl, IgG levemente descendido 702 mg/dl (N 737-1607) e IgM no detectable < 5 mg/dl. Proteinograma sérico anodino. ANA, ANCA, ASLO, FR y crioglobulinas negativos.
- Hemograma: Hb 9.1 g/dl, leucocitosis de hasta 104,9x10*3/μl con 84.69x10*3/μl linfocitos, plaquetas 83x10*3/μl. Se realizó frotis que mostraba linfocitosis en contexto de su enfermedad de base, no sugerente de progresión a prolinfocítica.
- Orina: Sistemático de orina: proteinuria >300mg/dl. Sedimento: hematuria >2400/µL. 4% de hematíes dismórficos, sin acantocitos. Bioquímica de orina: Creatinina 32mg/dL, Sodio 101mg/dL.
- Orina de 24h: Diuresis 1750 ml. Proteinuria de 6.1 g/24h, Albuminuria 3365 mg/24h.
- Ecografía abdominal: sin obstrucción de la vía urinaria. Esplenomegalia de 16 cm.
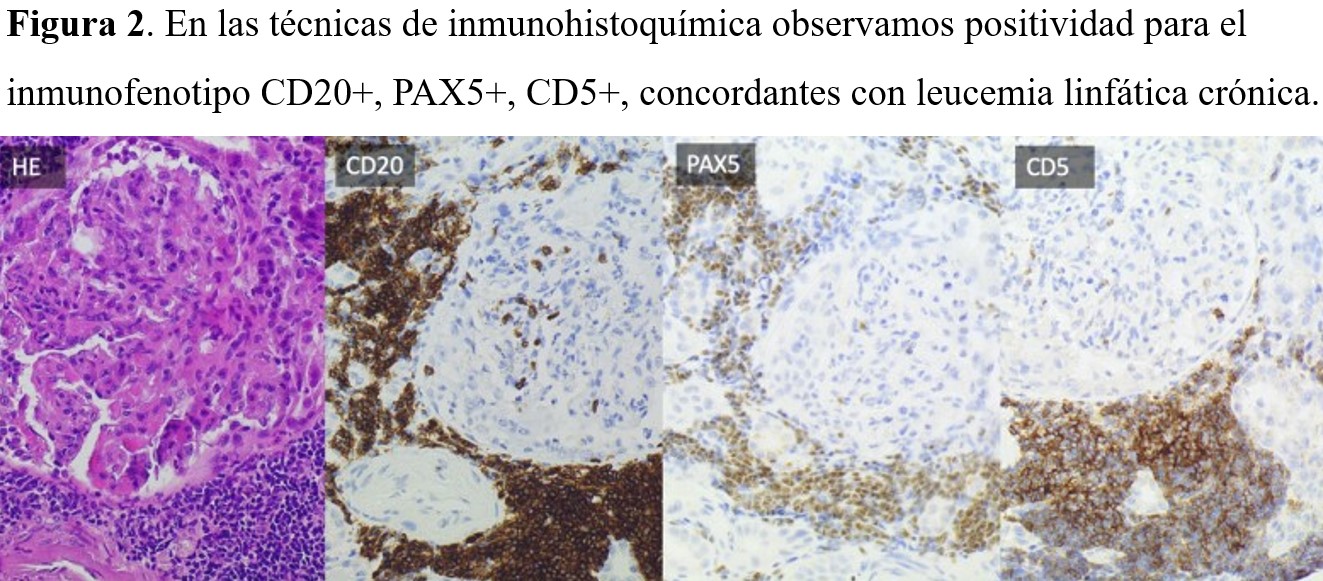
La biopsia renal arrojó el diagnóstico definitivo: expansión difusa intersticial parcheada por proliferación linfocítica de tamaño mediano, monomorfa, distribuida en cortical, medular y tejido perirrenal (Figura 1). El estudio inmunohistoquímico fue compatible con LLC (Figura 2).
Tras obtener el resultado de la biopsia en consenso con el servicio de Hematología se inician bolos vía intravenosa de Metilprednisolona 500mg durante 3 días, posteriormente Prednisona 40mg/día, seguido de una pauta corticoidea en descenso. El paciente presentó buena evolución, sin necesidad de utilización de terapia renal sustitutiva durante el ingreso, con progresiva mejoría de la función renal, manteniendo diuresis aceptables, con disminución de la congestión y de los edemas. Finalmente, fue dado de alta tras 3 semanas de hospitalización, con seguimiento en consulta externa. Tras mejoría de la función renal (FGe: >30 ml/min CKD-EPI), Hematología inició Acalabrutinib 100mg/12h, un inhibidor selectivo de la tirosina-quinasa de Bruton (BTK). Al momento de la publicación de este caso, el paciente se encuentra en tratamiento con dicho fármaco y en seguimiento en consulta de Nefrología con mejoría progresiva de la función renal, presentando una creatinina plasmática a los 7 meses del ingreso de 1.59 mg/dl.
COMENTARIOS
Presentamos el caso de un paciente con FRA de rápida progresión con hematuria y proteinuria. Desde un inicio descartamos diferentes etiologías mediante la exploración física y las pruebas complementarias, constatándose en el paciente un estado de hidratación adecuado y una vía urinaria permeable, quedando como principal sospecha la patología parenquimatosa. Siempre tuvimos en cuenta el antecedente de LLC del paciente, lo que nos hizo orientar el estudio y centrar el diagnóstico diferencial del caso en etiologías derivadas del proceso hematológico del paciente.
El FRA en pacientes con neoplasias hematológicas puede tener su origen en la propia neoplasia o en los tratamientos quimioterápicos, descartando esta última posibilidad en nuestro paciente ya que no había recibido tratamiento alguno para su neoplasia. Las causas más frecuentes de insuficiencia renal parenquimatosa a tener en cuenta en pacientes con antecedente de LLC son: lesiones vasculares, lesiones glomerulares (siendo las más habituales en este grupo la glomerulonefritis membranoproliferativa y la inmunotactoide, aunque también se han descrito casos de glomerulonefritis membranosa y de cambios mínimos), lesiones en túbulo proximal, en los túbulos colectores, microangiopatía trombótica y lesiones tubulointersticiales, como la infiltración linfocítica renal, que nos ocupa en este caso. (véase: Enfermedad renal en leucemias y linfomas)
La infiltración renal por linfocitos es frecuente, de hecho se puede observar en algunas series hasta en el 30-60% de las autopsias, aunque en raras ocasiones produce insuficiencia renal aguda. Se han llevado a cabo estudios para intentar discernir factores de riesgo que se relacionen con el desarrollo de infiltración renal e insuficiencia renal, sin encontrarse una relación con el valor absoluto de linfocitos, o la presencia de manifestaciones extrarrenales como las adenopatías o megalias [1]. El 72% de los pacientes recuperaron su función renal total o parcialmente [1], la posibilidad de que esta etiología sea reversible hace que planteárnosla como posibilidad etiológica, diagnosticarla mediante biopsia renal e instaurar con rapidez un tratamiento dirigido contra la neoplasia hematológica subyacente sean fundamentales, ya que la presencia de enfermedad renal limita las posibilidades terapéuticas y la supervivencia de los pacientes oncológicos.
REFERENCIA BIBLIOGRÁFICA
1.Uprety, D., Peterson, A., Shah, B.K. Renal failure secondary to leukemic infiltration of kidneys in CLL - a case report and review of literature. Ann Hematol 2013;92, 271–273. doi:10.1007/s00277-012-1547-6.