Glomerulonefritis focal y segmentaria colapsante de novo tras el trasplante renal
INTRODUCCIÓN:
La glomerulonefritis focal y segmentaria de tipo colapsante (GNFS colapsante) es una entidad muy agresiva que se ha relacionado tradicionalmente con los pacientes VIH [1]. En el trasplante renal (TR), la aparición de una GNFS colapsante de novo se ha asociado con el rechazo vascular, la microangiopatía trombótica (MAT), la recurrencia de enfermedades autoinmunes, las infecciones virales o el uso de determinados fármacos [2]. En este caso clínico, describimos una paciente trasplantada renal que desarrolló una GNFS colapsante tras la conversión a sirolimus (SRL).
CASO CLÍNICO:
Mujer de 31 años con enfermedad renal crónica (ERC) secundaria a Nefropatía IgA (NIgA), que recibió un TR en 2012 de donante vivo HLA idéntico. La inducción se realizó con basiliximab, seguida de prednisona, tacrolimus (TAC) y micofenolato mofetil (MMF). Presentó función renal inmediata con descenso progresivo de creatinina sérica (Crs) hasta alcanzar 0,7 mg/dl al alta.
En 2018, la paciente desarrolló condilomas a nivel de pubis, asociados al virus del papiloma humano (VPH) por lo que se disminuyeron los niveles de inmunosupresión, manteniendo TAC en torno a 6-7. En ese momento, la función renal se deterioró discretamente hasta alcanzar una Crs entre 1,4-1,5 mg/dl, sin proteinuria significativa, ni aparición de anticuerpos donante específico o virus BK. No se realizó biopsia renal (BR) por la ausencia de progresión y la escasa rentabilidad terapéutica.
Tres años después la enfermedad ginecológica empeoró hasta presentar aumento del número de condilomas con biopsia compatible con carcinoma escamocelular bien diferenciado en introito vulvar. Ante ese momento, se suspendió MMF y se inició SRL asociado a TAC, para mantener niveles en 5:5. Tras la conversión, 2 meses después, presentó deterioro progresivo de función renal hasta una Crs de 2,7 mg/dl y una proteinuria en ascenso hasta alcanzar rango nefrótico (4 g/24 horas). Clínicamente asoció tendencia a la hipertensión arterial y edemas. Por la posible toxicidad asociada a SRL se suspendió el fármaco. La presión arterial se controló y la proteinuria disminuyó hasta 1,5 g/g, sin embargo, la función renal no mejoró y se programó BR.
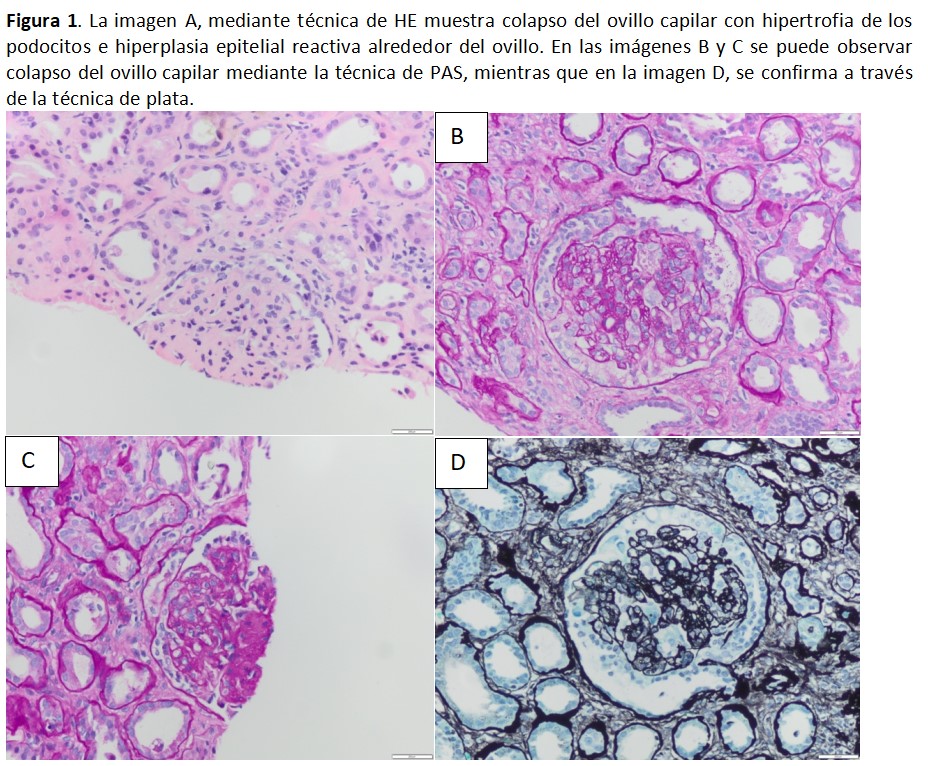
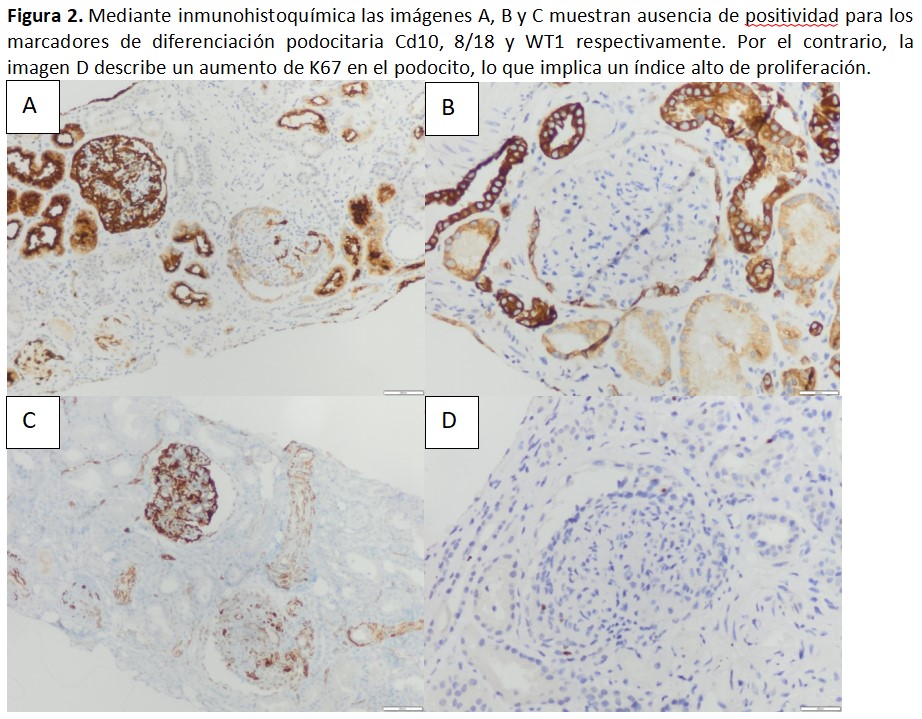
La BR mostró doce glomérulos, cuatro de ellos globalmente esclerosados, de los restantes, dos mostraban colapso del ovillo capilar con hipertrofia de los podocitos e hiperplasia epitelial reactiva alrededor del ovillo (Figura 1). Arterias con moderado engrosamiento fibroelástico intimal y arteriolas con focos de hialinosis subendtolelial. A nivel intersticial presentaba infiltrado mononuclear con frecuente tubulitis, así como moderada fibrosis intersticial y atrofia tubular. La inmunohistoquímica mostró ausencia de positividad para WT1, cd10 y cK 8/18, que son marcadores de diferenciación de los podocitos (Ki67 alto en podocitos) (Figura 2). La inmunofluorescencia resultó negativa, tanto para inmunoglobulinas como para C4d y la microscopía electrónica confirmó la presencia de zonas de fusión pedicelar.
Con estos datos clínicos y anatomopatológicos se diagnosticó de GNFS colapsante, junto con signos de atrofia tubular y fibrosis intersticial, probablemente asociada a SRL por la relación temporal. Se retiró definitivamente el SRL, manteniendo prednisona y TAC a dosis bajas, sin reinicio de MMF por la presencia activa de condilomas. La evolución no fue favorable con deterioro rápido y progresivo de la función renal hasta necesitar terapia renal sustitutiva un años después, en junio de 2022.
DISCUSIÓN:
La aparición de proteinuria tras el inicio de SRL en el TR es una afectación ampliamente conocida. Los principales factores de riesgo que se han relacionado con este hecho son la presencia de nefropatía crónica del injerto (NCI) previa y los niveles altos de SRL [2][3].
Por otro lado, la aparición de una GNFS colapsante de novo en el TR es una situación poco frecuente y grave, que suele implicar una pérdida rápida y progresiva del injerto renal [4]. Su asociación con el uso de SRL ha sido descrita en varias ocasiones, sin embargo, hasta la fecha se desconoce con exactitud cuales son los mecanismos implicados en su desarrollo.
En la GNFS colapsante, el daño principal ocurre en el podocito, donde se produce una pérdida de maduración y una activación de la proliferación celular [5] (ver Glomerulosclerosis Segmentaria y Focal en Nefrología al Día). Letavernier et al demostraron mediante inmunohistoquímica que algunos podocitos en la GNFS habían perdido o habían disminuido la expresión de synaptopodin y P57, reflejando desdiferenciación celular, y habían adquirido expresión de cytokeratin y PAX2, marcadores de inmadurez celular [6]. Por otro lado, Dogan et al describieron el caso de una paciente con enfermedad renal crónica secundaria a lupus eritematoso sistémico que recibió un trasplante renal que se complicó en primer lugar con una microangiopatía trombótica (MAT) y en un segundo tiempo con el desarrolló una GNFS colapsante tras la conversión a SRL. Observaron que a nivel anatomopatológico, en las zonas afectadas por MAT (primera biopsia) y en las zonas afectadas por GNFS (segunda biopsia), había pérdida de expresión de WT1, marcador de maduración podocitaria. Con este hecho hipotetizaban que las lesiones de MAT habían favorecido la pérdida de diferenciación celular y que SRL podría haber actuado como un “segundo hit” provocando la aparición de GNFS colapsante a través de su efecto antiangiogénico [7]. Siguiendo esta línea, algunos autores postulan que ese efecto antiangiogénico de SRL puede ser el verdadero causante del daño. Provocaría una alteración en la regulación de VEGF, aumentando su expresión a nivel del podocito y produciendo una alteración en la permeabilidad glomerular [8]. Sin poder establecer un solo mecanismo concreto causante del daño, si existe cierto consenso en afirmar que debe existir un daño previo, cierta susceptibilidad para que se produzca la toxicidad por SRL. Esto explicaría porqué numerosos pacientes que reciben SRL no desarrollan ninguna lesión [7][8].
En este caso, lo que probablemente propiciara el desarrollo de proteinuria y la aparición de una GNFS colapsante es la presencia de daño crónico del injerto renal previo, que se confirmaba en la biopsia renal con la aparición de atrofia tubular y fibrosis intersticial. Además, tampoco podemos olvidar que no hubo una suspensión total de TAC por lo que es posible un efecto sinérgico que potenciara la nefrotoxicidad.
Así, la ausencia de deterioro grave de la función renal o proteinuria, junto con el alto riesgo de progresión tumoral sirvieron como razones de peso para no realizar una biopsia renal y directamente realizar la conversión a SRL. A la vista de lo sucedido, una biopsia nos podría haber mostrado si ya existía o no daño crónico del injerto. Por ello, queremos enfatizar la necesidad de valorar la realización de una biopsia renal antes de modificar la inmunosupresión, siempre que la situación lo permita, para poder optimizar el tratamiento y evitar complicaciones.