Aféresis terapéutica en patología renal
INDICE
Principios y técnicas de aféresis
Indicaciones de aféresis
Aspectos técnicos de las técnicas de aféresis
Líquidos de sustitución en aféresis.
Accesos vasculares en aféresis.
Centrifugación versus Filtración
Efectos adversos relacionados con las técnicas de aféresis.
Aféresis terapéutica en trasplante de órgano sólido.
Tratamiento del rechazo mediado por anticuerpos.
Desensibilización para trasplante renal incompatible:
Desensibilización ABO.
Desensibilización HLA.
Recurrencia de Glomeruloesclerosis Focal y Segmentaria.
Otras indicaciones en trasplante de órgano sólido no renal.
Trasplante cardíaco
Trasplante hepático.
Trasplante pulmonar.
GLOSARIO
Acs: anticuerpos
AFT: aféresis terapéutica
FA: fotoaféresis
IA: inmunoadsorción
IgIv: imunoglobulina intravenosa
HFyS: hialinosis focal y segmentaria
RMA: rechazo mediado por anticuerpos
RP: recambio plasmático
TOS: trasplante de órgano sólido
TR: trasplante renal
TRDV: trasplante renal donante vivo
PRINCIPIOS DE AFÉRESIS Y TÉCNICAS
La aféresis, como modalidad terapéutica, tiene como principal fundamento pasar la sangre del paciente a través de un dispositivo extracorpóreo, con el fin de eliminar aquellos componentes patógenos que condicionan o perpetúan una enfermedad y así contribuir a su tratamiento. Con el término de aféresis terapéutica (AFT) se designa a todos aquellos procedimientos aferéticos cuya finalidad es puramente terapéutica [1] [2].
Se llama Plasmaféresis (PF) al procedimiento en el cual se elimina el plasma (<15% del volumen total de la sangre) sin utilizarse líquidos de sustitución o de reemplazo, a diferencia de los recambios plasmáticos (RP), en los que el plasma eliminado es sustituido normalmente por seroalbúmina 5% o plasma fresco congelado (PFC) en una proporción 1:1.
La eficacia dependerá del volumen de plasma extraído, según el volumen plasmático total del paciente, del volumen de distribución de la sustancia patógena, de la afinidad y unión de este mediador por las proteínas plasmáticas y del número de procedimientos [3].
Los recambios plasmáticos (RP) y/o plasmaféresis (PF) se utilizan en el tratamiento de aquellas patologías, en las cuales el mediador patógeno se encuentre en el plasma.
El tratamiento con RP y/o plasmaféresis se basa en los siguientes supuestos:
1. La enfermedad está causada por una sustancia que se encuentra en la sangre (anticuerpo u otro tipo de sustancia patógena).
2. Este patógeno puede ser eliminado de forma eficiente de la sangre.
3. La extracción o disminución de la sustancia patógena de la sangre producirá la resolución o mejoría de los síntomas clínicos de la enfermedad.
Los RP y PF son más efectivos en extraer o eliminar proteínas intravasculares y aquellas sustancias que se equilibran rápidamente entre los espacios intra y extravascular, además es importante tener en cuenta que cuanto menor sea el ratio de síntesis de esta sustancia patogéna, mayor será la eficacia de los RP [4] [5].
A continuación, describimos los principales procedimientos AFT [1] [6] [5] :
CITOAFÉRESIS: se utiliza para disminuir el recuento celular sanguíneo e incluye distintos procedimientos como, eritrocitoaféresis (depleción de células rojas o hematíes), leucocitoaféresis (depleción de células blancas o leucocitos) y trombocitoaféresis (depleción de plaquetas o trombocitos).
FOTOAFÉRESIS: también conocida como fotoaféresis extracorpórea, es una terapia inmunomoduladora en la que se recolectan células mononucleares periférica, se exponen de manera extracorpórea a psoraleno y luz UVA, siendo posteriormente reinfundidas al paciente. La fotoaféresis se utiliza de manera habitual en el tratamiento de linfoma cutáneo de células T (Síndrome de Sézàry) y la enfermedad de injerto contra huésped.
HEMOADSORCIÓN: procedimiento adsortivo que se caracteriza por la eliminación de una sustancia determinada de la sangre. No necesita plasmaseparación previa y diferentes procedimientos aferéticos se basan en este principio.
PLASMADSORCIÓN: procedimiento adsortivo que se caracteriza por la eliminación de una sustancia determinada del plasma filtrado, al hacer pasar éste a través de un cartucho de carbón activado no recubierto y de una columna de resina de intercambio aniónico.
LDL-AFÉRESIS: eliminación selectiva de las lipoproteínas de baja densidad de la sangre, aunque también elimina colesterol total y lipoproteína a [Lp(a)] [7]. Existen varios procedimientos con este fin, como doble filtración, DALI e inmunoadsorción [8].
DALI (direct adsortion of lipoproteins): adsorción selectiva de lipoproteínas desde sangre total a través de ligandos del ácido poliacrílico sobre una matriz de poliacrilamida.
DOBLE FILTRACION: procedimiento en el que tras plasmaseparación se usa un segundo filtro que eliminará sustancias según su peso molecular.
RHEOAFÉRESIS: semejante a la doble filtración, se utiliza un filtro para eliminar de manera selectiva los componentes de la sangre según su peso molecular.
INMUNOADSORCIÓN (IA): procedimiento en el cual el plasma del paciente, tras un proceso de plasmaseparación, se pasa a través de una columna que tiene la capacidad de eliminar inmunoglobulinas uniéndolas selectivamente a ligandos de la matriz de la columna. La mayor ventaja sobre los RP es que no es necesario usar líquido de sustitución ya que el plasma es devuelto al paciente.
MARS (molecular adsorbents recirculating system): procedimiento de depuración extracorpórea indicado en la insuficiencia hepática aguda o crónica; es un sistema que permite la eliminación de sustancias ligadas a la albúmina para lo cual se usa un equipo estándar de hemodiálisis o hemofiltración al que se adapta un circuito con albúmina 10-20% combinado con una membrana de alta selectividad. También permite la eliminación de sustancias hidrosolubles.
PROMETHEUS: misma indicación que el MARS, las toxinas unidas a albúmina se eliminan tras el fraccionamiento del plasma mediante un filtro de polisulfona y tras adsorción con una o dos columnas en el circuito del plasma (FPSA; fractionated plasma separation and adsortion). Una vez finalizado el circuito, el plasma depurado vuelve al paciente a través del mismo filtro de albúminas y las toxinas hidrosolubles se eliminan mediante hemodiálisis.
HEMOADSORCION CON POLIMIXINA: procedimiento de adsorción cuya finalidad es eliminar endotoxinas bacterianas en sepsis grave o shock séptico [9].
INTERCAMBIO DE HEMATÍES: procedimiento en el que se pasa la sangre a través de un dispositivo que separa los hematíes del resto de componentes de la sangre, estos se retiran y se sustituyen con hematíes de donantes y albúmina 5%.
INDICACIONES AFT
La AFT es un tratamiento utilizado en multitud de patologías diferentes aunque la evidencia científica que avala este tratamiento no sea de gran calidad.
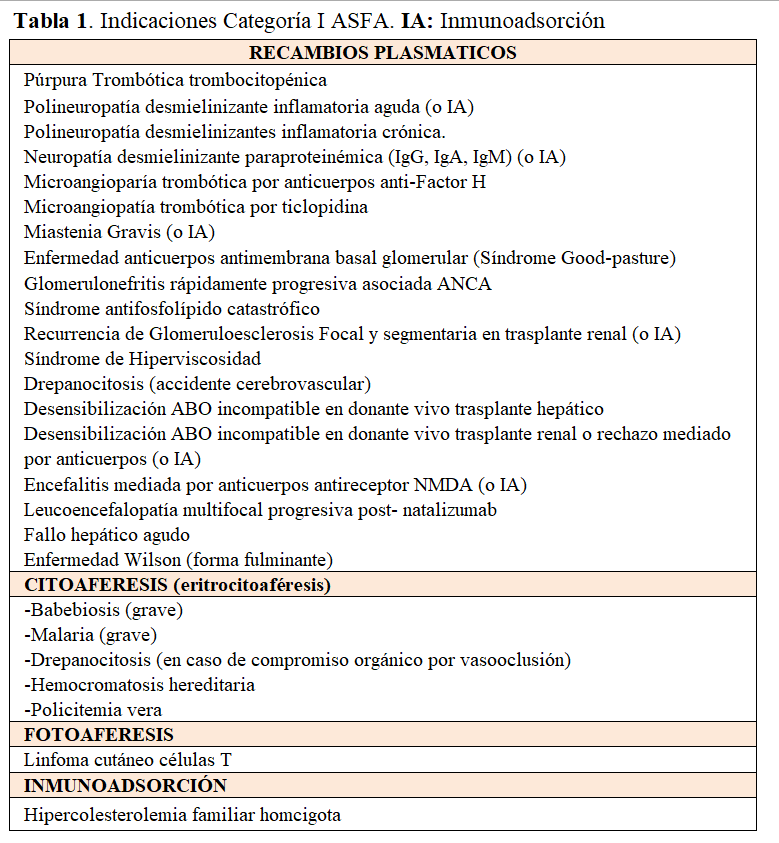
La Sociedad Americana de Aféresis (ASFA) publica y actualiza de manera periódica su guía terapéutica basada en la evidencia clínica existente tras una revisión exhaustiva y crítica de la evidencia científica disponible; recientemente ha publicado la última actualización [10] incorporando nuevas enfermedades a la Categoría I, incluidas en la (Tabla 1).
La Guía clínica ASFA describe las indicaciones, el tipo de líquido de sustitución, frecuencia y duración del tratamiento mediante AFT, de manera práctica y fácil, utilizando una edición tipo "ficha técnica" para cada enfermedad donde está resumida toda la información necesaria sobre una determinada enfermedad de manera rápida y visual [10].
Asimismo, se clasifican las enfermedades según categorías:
Categoría I: aquellas enfermedades para las cuales el tratamiento mediante AFT se considera como terapia de primera línea o como tratamiento coadyuvante válido.
Categoría II: incluye aquellas enfermedades para las cuales el tratamiento con AFT está indicado como terapia de segunda línea, bien sea de manera aislada o en combinación con otros tratamientos (pe, encefalomielitis diseminada aguda).
Categorías III y IV: incluyen aquellas enfermedades para las cuales el papel óptimo de la aféresis no ha sido establecido y debemos individualizar la indicación de estas y aquellas en las cuales la aféresis no ha demostrado ser efectiva, respectivamente.
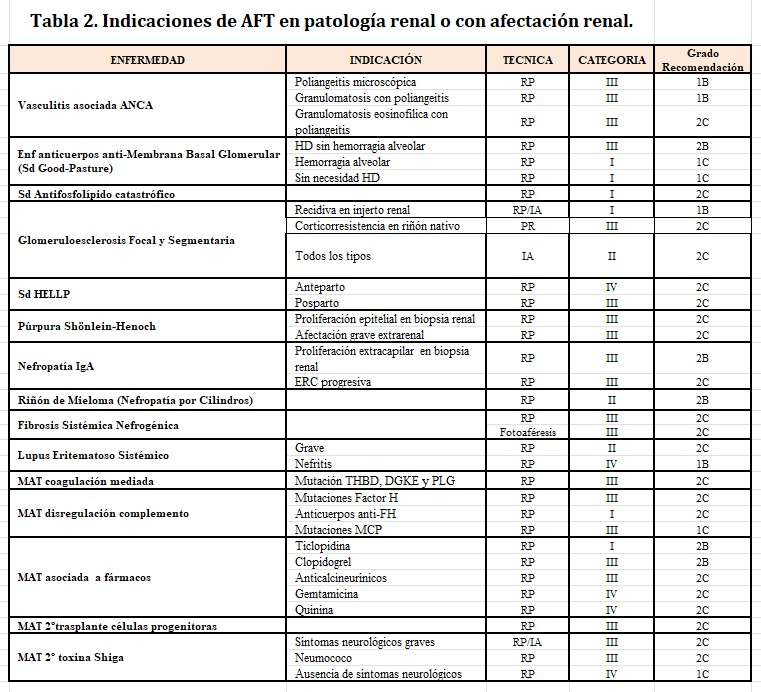
En la (Tabla 2) se resumen las indicaciones en patología renal o patologías con afectación renal, incluyendo el procedimiento, categoría y grado de evidencia. Aunque la última actualización de las guías ASFA [10] no ha modificado sus recomendaciones en el tratamiento de las vasculitis asociada ANCA, los resultados del ensayo clínico Pexivas [11], cuyos resultados demuestran que añadir RP al tratamiento de pacientes con vasculitis ANCA grave no disminuye la incidencia de muerte o enfermedad renal terminal, ha generado importante controversia.
ASPECTOS TÉCNICOS DE LAS TÉCNICAS AFT
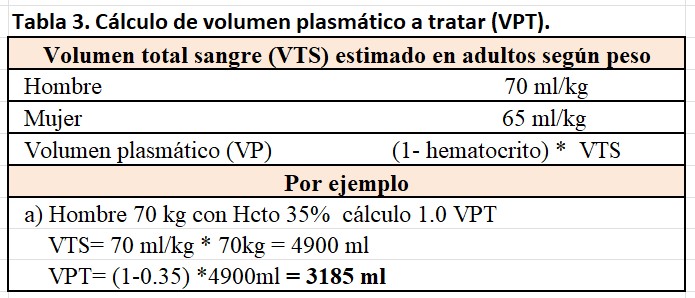
El volumen de plasma a tratar (VPT) o recambiar debe ser aproximadamente igual al volumen de plasma circulante, lo que se traduce en una extracción aproximada 65-80 % de los constituyentes del plasma.
El volumen plasmático podemos estimarlo mediante calculadoras on-line basadas en el método Nadler (https://www.easycalculation.com/medical/blood-volume.php) o bien calcularlo en base al sexo, peso y hematocrito basándonos en las fórmulas de Kaplan y Buffaloe (Tabla 3).
Es importante recordar que la extracción de los mediadores patógenos sigue un modelo compartimental, en el que recambios menores de 1L de volumen plasmático no producirán una extracción suficiente de mediadores y por tanto no obtendremos efectos terapéuticos, mientras que recambios mayores de 1,5 L requerirán sesiones de tratamiento largas, y elevadas cantidades de líquido de sustitución para obtener un mínimo beneficio terapéutico, lo que no se considera coste-efectivo [11] [12].
La frecuencia y duración de las sesiones de AFT dependerán tanto de la enfermedad como de la respuesta al tratamiento a la misma, siendo necesario alcanzar un equilibrio entre la necesidad de una extracción agresiva de mediadores y reequilibrar el espacio intravascular para minimizar complicaciones derivadas del tratamiento; por ejemplo, una pauta clásica de 4-6 sesiones en 10-14 días reduce la concentración plasmática de inmunoglobulina G (IgG) un 70-85% [11] [12].
LÍQUIDOS DE SUSTITUCIÓN EN AFT
En los tratamientos con RP se extraen normalmente entre 1.0-1.5 VP con lo cual es necesario la utilización de líquido de sustitución para reponer el espacio intravascular; los más utilizados son la seroalbúmina 5% y el plasma [4].
El plasma más utilizado es el PFC (plasma fresco congelado) aunque puede utilizarse plasma fresco, plasma sobrenadante de crioprecipitado ó plasma sometido a inactivación de patógenos mediante método solvente/detergente.
Algunos centros utilizan combinaciones de albúmina y plasma con suero salino o coloides, es importante recordar que la solución de sustitución debe generar una presión osmótica similar a la del plasma para evitar la generación de edema e hipotensión.
Las soluciones de sustitución tienen una serie de ventajas y desventajas, descritas a continuación:
* Albúmina (solución al 5%): utilizada en ratio 1:1 es un buen expansor de volumen con una vida media de 17 días. La albúmina está pasteurizada para prevenir la transmisión de infecciones y está normalmente bien tolerada. Las complicaciones incluyen fiebre, hipotensión en contexto de toma de fármacos inhibidores del enzima conversor de angiotensina e hipokaliemia.
* Plasma: repone factores de coagulación y gammaglobulinas, aunque se asocia a reacciones alérgicas y se han descrito casos de TRALI (lesión pulmonar aguda producida por transfusión). El uso de citrato como anticoagulante está asociado con hipocalcemia. Las bolsas de plasma contienen citrato que puede llegar a producir hipocalcemia.
* Plasma sobrenadante de crioprecipitado (CSP): se puede utilizar en pacientes con purpura trombótica trombocitopénica (PTT) u otras formas de microangiopatía ya que contiene elevadas cantidades de factor de von Willebrand pudiendo ser una ventaja sobre el tratamiento con PFC [13] [14].
* SDP (Solven Detergent Plasma): se trata de plasma fresco sometido a inactivación con solvente/detergente y tiene indicación en caso de antecedente de alergia documentada a PFC.
En general, el PFC se reserva para el tratamiento de pacientes con PTT, aunque su utilización también está indicada en pacientes con sangrado activo (hemorragia alveolar), pre y post procedimientos de cirugía mayor y en pacientes con coagulopatía.
ACCESOS VASCULARES EN AFT
Los accesos vasculares en las técnicas de AFT tienen que permitirnos obtener flujos sanguíneos óptimos para realizar el procedimiento AFT en un período de tiempo adecuado, con los mínimos efectos secundarios para los pacientes [15].
Las técnicas de filtración requieren la utilización de un acceso en vía venosa central lo que permite además la realización de hemodiálisis en caso de que sea necesario (plasmadiálisis), en caso de tratamientos crónicos, puede valorarse la colocación de una fístula arteriovenosa (FAV) o prótesis PTFE.
Respecto a la centrifugación, se utilizan 2 accesos venosos periféricos habitualmente insertados en los antebrazos (Abbocath® 18-20 G). Una de sus complicaciones es que ocasionalmente el extremo arterial de los catéteres periféricos se colapsa sin obtener flujos óptimos, en estas ocasiones podemos valorar el uso de catéteres venosos mediales (midlines) colocados en las venas del antebrazo, que tienen el mismo diámetro pero que debido a su longitud (20 cm) su punta alcanza la vena axilar consiguiendo así flujos sanguíneos óptimos sin colapso del extremo arterial. La colocación de estos catéteres mediales mediante ecografía asegura que el diámetro de la vena es el adecuado y evitamos las punciones repetidas con lo que ello representa para el paciente.
Las principales complicaciones del uso de catéteres mediales son la trombosis venosa y la infección del catéter; respecto al riesgo de trombosis se ha descrito una incidencia de 2-4% según las series, cuando se usan durante “períodos cortos”, definidos como inserción menor a 30 días el riesgo de infección de los catéteres mediales en el mismo período varía entre 0.4-1.6% según series [16][17].
CENTRIFUGACIÓN VERSUS FILTRACIÓN
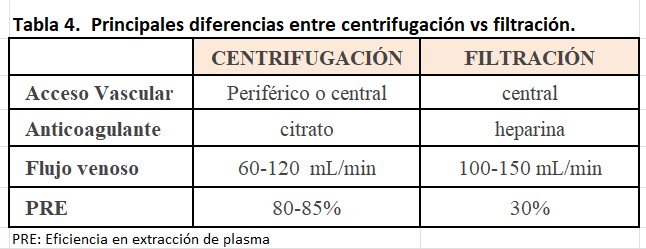
Las dos técnicas principales utilizadas en la separación del plasma durante la aféresis son la centrifugación y la filtración mediante membrana.
Las principales diferencias entre ambas técnicas son la eficiencia en la extracción del plasma (PRE), el acceso vascular, el anticoagulante y los flujos sanguíneos necesarios (Tabla 4).
PRE (plasma removal efficiency) es un parámetro que nos permite calcular la eficiencia en la extracción del plasma, esto es, nos da información sobre la cantidad de plasma procesado que es realmente extraído o eliminado. Se puede calcular fácilmente como:
PRE = (VOLRP/VOL PP) x 100
donde VOLRP = volumen de plasma y anticoagulante que es extraído; VOL PP = volumen de plasma y anticoagulante que es procesado y
VOL PP = (VIN - VAC ) x (1- HCT) + VAC
donde HCT = hematocrito medido como la media entre los valores pre y post procedimiento; VIN = volumen de sangre procesado y VAC = volumen de anticoagulante usado.
CENTRIFUGACIÓN
Puede utilizarse además de para plamaseparación, para separar los distintos componentes celulares de la sangre, por lo que su uso es habitual en los bancos de sangre. Esta técnica se caracteriza por alcanzar una elevada eficiencia en la plamaseparación con PRE 80-85%, es decir, que si procesamos 100 mL de plasma, entre 80-85 mL serán eliminados y 10-15 mL volverán a la circulación del paciente.
La duración del procedimiento se relaciona directamente con la eficiencia en la extracción del plasma.
La utilización de centrifugación para separación plasmática requiere flujos bajos de sangre (60-120 ml/min) y puede ser utilizada tanto a través de vía venosa central como de vía venosa periférica, en algunos monitores pueden incluso utilizarse catéteres venosos periféricos en modo "unipunción".
La aféresis mediante centrifugación utiliza normalmente como anticoagulación el citrato. La centrifugación puede usar flujo intermitente o continuo:
• Flujo Intermitente: se procesan pequeños volúmenes de sangre en ciclos, en cada uno de los cuales la sangre se extrae, se separa el plasma y es reinfundido el líquido de reposición, su ventaja es que solo precisa un único acceso venoso periférico, pero es un proceso largo con importante fluctuaciones en el volumen de sangre extracorpóreo.
• Flujo continuo: procesa de manera simultánea la sangre separando el plasma y reinfundiendo por lo cual debe usarse 2 accesos venosos o un acceso central con dos luces, pero el tiempo de tratamiento se acorta de manera importante comparando con la técnica que usa flujo intermitente.
FILTRACIÓN
Se basa en la utilización de membranas de alta permeabilidad por el gran tamaño de los poros (0.3-0.6 micrones), lo cual permite que todo el plasma y sus moléculas sea filtrado a su paso, reteniéndose solo el componente celular. Tiene la desventaja de no permitir la realización de procedimientos de citoaféresis, alcanza un PRE aproximados de 30%, utiliza heparina como anticoagulante y necesita una vía central como acceso vascular. Es la técnica más utilizada por los servicios de nefrología [4].
EFECTOS ADVERSOS RELACIONADOS CON AFT
La tasa de eventos adversos relacionados con AFT es 4-5% siendo ligeramente mayor en el primer tratamiento. Los efectos adversos pueden estar relacionados con el acceso vascular, el líquido de sustitución y el procedimiento en si mismo [18] [19].
El grupo Sueco de Aféresis revisó más de 20.000 procedimientos observando los siguientes efectos adversos: Grado 1 (leve) 1.5%, Grado 2 (moderada) 2.8%, Grado 3 (grave) 0.8% y Grado 4 (fatal) 0% [20]. Los efectos adversos relacionados con el acceso vascular fueron de 1% del total incluyendo sangrado, neumotórax, infecciones y trombosis.
Los efectos adversos relacionados con el líquido de sustitución incluyeron reacciones transfusionales como fiebre, reacciones alérgicas especialmente al sustituir con PFC, habiéndose descrito reacciones TRALI (lesión pulmonar aguda producida por transfusión).
Uno de los efectos adversos más frecuente relacionado con el procedimiento es el relacionado con el uso de citrato como anticoagulante [21]. Al utilizarlo es importante recordar que el citrato es un quelante del calcio, por lo que los efectos adversos más frecuentes son los derivados de la hipocalcemia: parestesias, náuseas, vómitos, tetania, sensación de frio, pudiendo llegar a producir arritmias cardíacas. En pacientes con insuficiencia renal la infusión de citrato puede producir alcalosis metabólica [22]. Además, la administración de citrato puede producir hipomagnesemia.
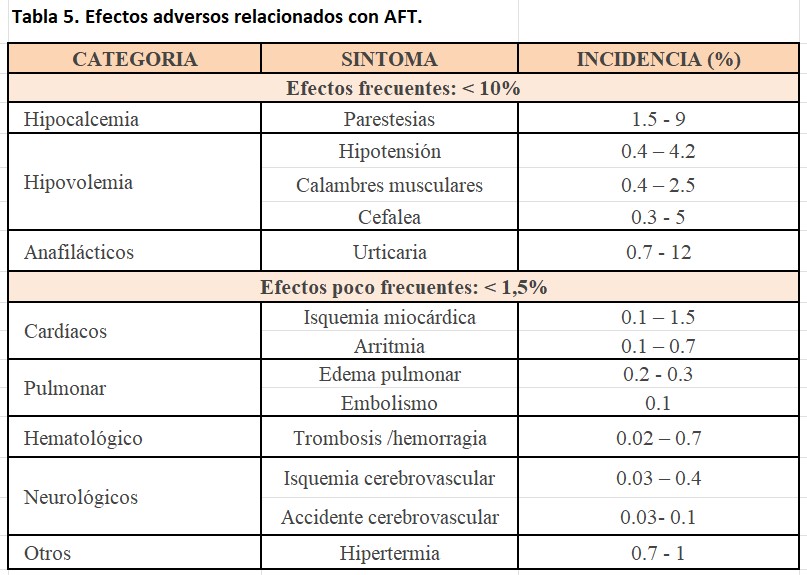
Otras complicaciones relacionadas con el procedimiento pueden ser hipotensión relacionada con la hipovolemia, reacciones vasovagales, en la (Tabla 5) se resumen tanto los síntomas como la incidencia de los efectos adversos más frecuentes [23][24].
El tratamiento de estos efectos adversos depende de la severidad de la reacción, los síntomas leves pueden tratarse de manera sintomática, las reacciones alérgicas con antihistamínicos o esteroides, pudiendo administrarlos de manera profiláctica en caso de conocerse o haber presentado en un procedimiento anterior la reacción alérgica.
Para prevenir los efectos relacionados con citrato deben corregirse previamente al inicio del tratamiento las concentraciones plasmáticas de calcio y magnesio, pudiendo administrarse comprimidos de calcio previo al tratamiento de manera profiláctica.
Al utilizarse seroalbúmina como líquido de sustitución pueden producirse coagulopatía debido a la extracción de factores de coagulación, incluyendo fibrinógeno. Normalmente los cambios en los factores de la coagulación se recuperan en 24-72 horas tras el tratamiento y no producen sangrados clínicamente significativos. Los tratamientos con múltiples sesiones de AFT producen hipogamamaglobulinemia aumentando el riesgo de infección, los niveles de gammaglobulinas se recuperan en 3-4 semanas.
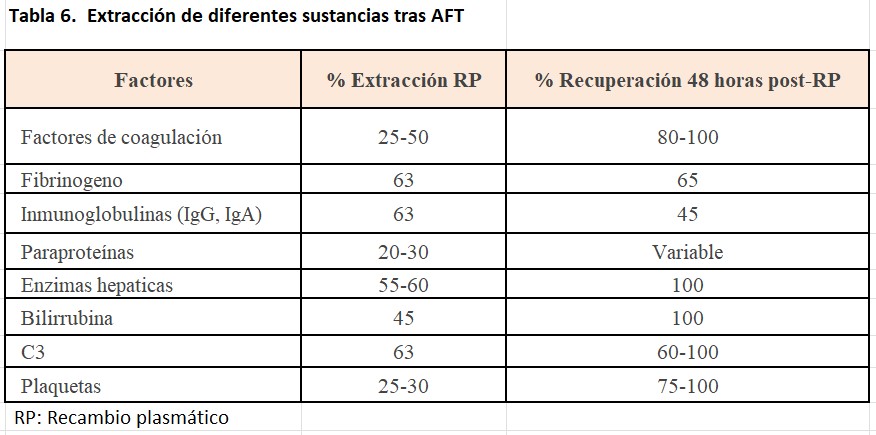
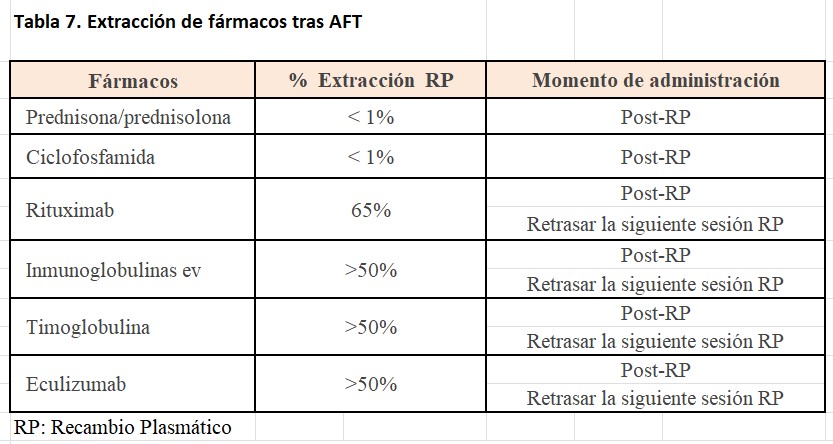
Además, la utilización de seroalbúmina como líquido de reposición produce déficit de otras sustancias fisiológicas como enzimas hepáticas, factores de complemento, etc. En la (Tabla 6) se describe el porcentaje de su eliminación y el tiempo de recuperación tras el procedimiento aferético, además es importante tener en cuenta que durante la AFT se extraen de igual manera los fármacos administrados (Tabla 7).
AFT EN TRASPLANTE DE ORGANO SÓLIDO. INDICACIONES
En el campo del trasplante de órgano sólido la AFT tiene beneficio claro y forma parte del tratamiento de algunas entidades como el rechazo mediado por anticuerpos, la recidiva de la Glomeruloesclerosis focal y segmentaria (GFyS) o trasplante ABO/HLA incompatibles que se desarrollarán a lo largo de los próximos puntos.
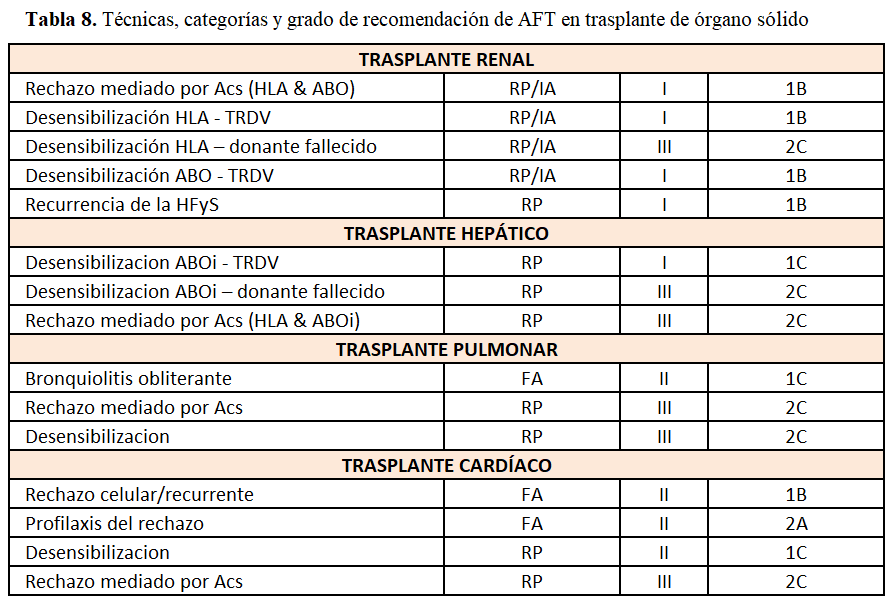
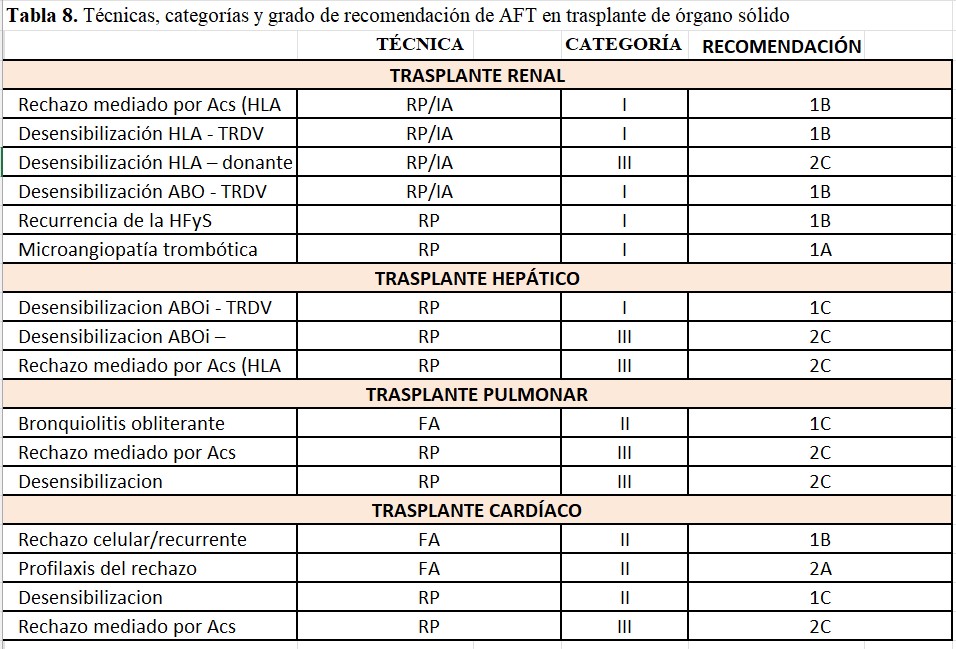
Las indicaciones de la AFT aceptadas por la ASFA [10] en trasplante renal (TR) y trasplante de órgano sólido (TOS) no renal se exponen en la (Tabla 8).
TRATAMIENTO DEL RECHAZO MEDIADO POR ANTICUERPOS EN TRASPLANTE RENAL
El rechazo mediado por anticuerpos (RMA) se produce como consecuencia de la interacción de los anticuerpos (Acs) con antígenos del injerto renal, fundamentalmente dirigidos a antígenos HLA del donante (ADE-anticuerpos donante específicos) [25] [26]
La presencia de lesiones histológicas específicas junto con depósito C4d o existencia de inflamación microvascular (glomerulitis más capilaritis peritubular) y la evidencia serológica de ADE definen, según la clasificación de Banff, el rechazo mediado por anticuerpos [27].
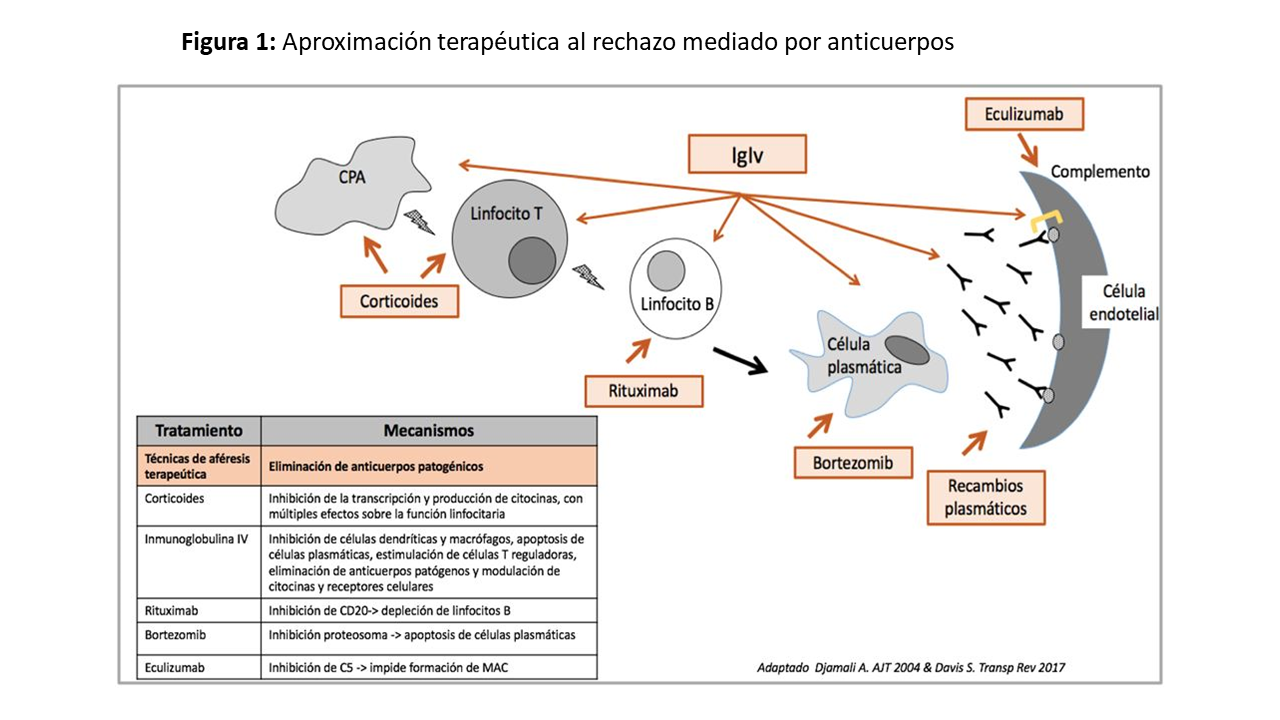
Los objetivos del tratamiento y posibles dianas terapéuticas en esta entidad se resumen en la (Figura 1).
No existe una sólida evidencia científica que avale qué tratamiento es más eficaz en el rechazo humoral, pero parece globalmente aceptado que el tratamiento de RMA con disfunción clínica aguda debe incluir recambios plasmáticos (RP) o inmunoadsorción (IA) junto con la administración de inmunoglobulina intravenosa (IgIv) [28][29]. El uso de otros fármacos como rituximab [30] [31] , eculizumab [32], bortezomib, tozilizumab o clazakizumab [33] como coadyuvantes no ha demostrado claramente su eficacia, aunque su uso es relativamente generalizado. Si bien algunas estrategias terapéuticas empleadas en el tratamiento del RMA con deterioro agudo de la función renal y lesiones histológicas de actividad tienen cierto éxito, el RMA crónico (con o sin actividad) sigue siendo una entidad que carece de tratamiento en la actualidad [34].
En los últimos años, numerosas publicaciones tratan de arrojar luz al tratamiento de esta entidad. Un estudio randomizado que de momento no ha publicado resultados propone evaluar la eficacia en el tratamiento del RMA crónico activo de la doble filtración comparada con los recambios plasmáticos convencionales combinados con rituximab (https://clinicaltrials.gov/show/NCT03436134).
Esperamos tener resultados concluyentes de este y otros estudios que avalen una estrategia terapéutica con buenos resultados para el rechazo mediado por Acs tanto agudo como crónico.
DESENSIBILIZACIÓN PARA TRASPLANTE RENAL INCOMPATIBLE
En la actualidad, hemos conseguido rebasar las barreras inmunológicas naturales realizando trasplantes renales incompatibles con el objetivo de expandir el pool de donantes y aumentar el acceso al trasplante de los pacientes con enfermedad renal crónica avanzada. Para ello, se han establecido diversas estrategias de desensibilización con el fin de minimizar los riesgos de rechazo hiperagudo mediado por anticuerpos. En la mayoría de estos protocolos, se incluye la AFT como parte fundamental del tratamiento desensibilizador para eliminar los anticuerpos anti-HLA o anti-ABO circulantes [35] [36].
Desensibilización ABO
Para realizar trasplantes ABO incompatible (ABOi) es necesaria la depleción de anticuerpos anti-ABO en el suero del receptor. La desensibilización para este tipo de trasplante se basa en [37]:
a) Eliminación de isoaglutininas circulantes mediante técnicas de aféresis.
b) Modulación del sistema inmune con el uso de inmunoglobulina intravenosa (IgIv)
c) Rituximab (en el pasado, esplenectomía) para depleción de linfocitos B.
d) Tratamiento inmunosupresor
Entre los diferentes procedimientos que se utilizan para la eliminación de los Acs anti-A/B circulantes se incluyen: recambios plasmáticos (más utilizado en USA), aféresis con doble filtración (preferido en Japón) y la Inmunoadsorción (IA) selectiva o no selectiva (más común en protocolos europeos). Las guías de la ASFA [10] incluyen los RP y la IA como categoría I (grado de recomendación 1B) en la desensibilización para TRDV ABOi [38].
Todas las técnicas de aféresis disponibles son eficaces para reducir el título de isoaglutininas, y este título será el que condicione el número de sesiones. Se considera que son relativamente seguros para realizar el trasplante títulos de isoaglutininas de 1:8 o menos; sin embargo, cuando estos títulos son de 1:512 o mayores no se recomienda la desensibilización por su dificultad y alto coste para reducir los Acs anti-A/B circulantes a niveles seguros para realizar el trasplante [39].
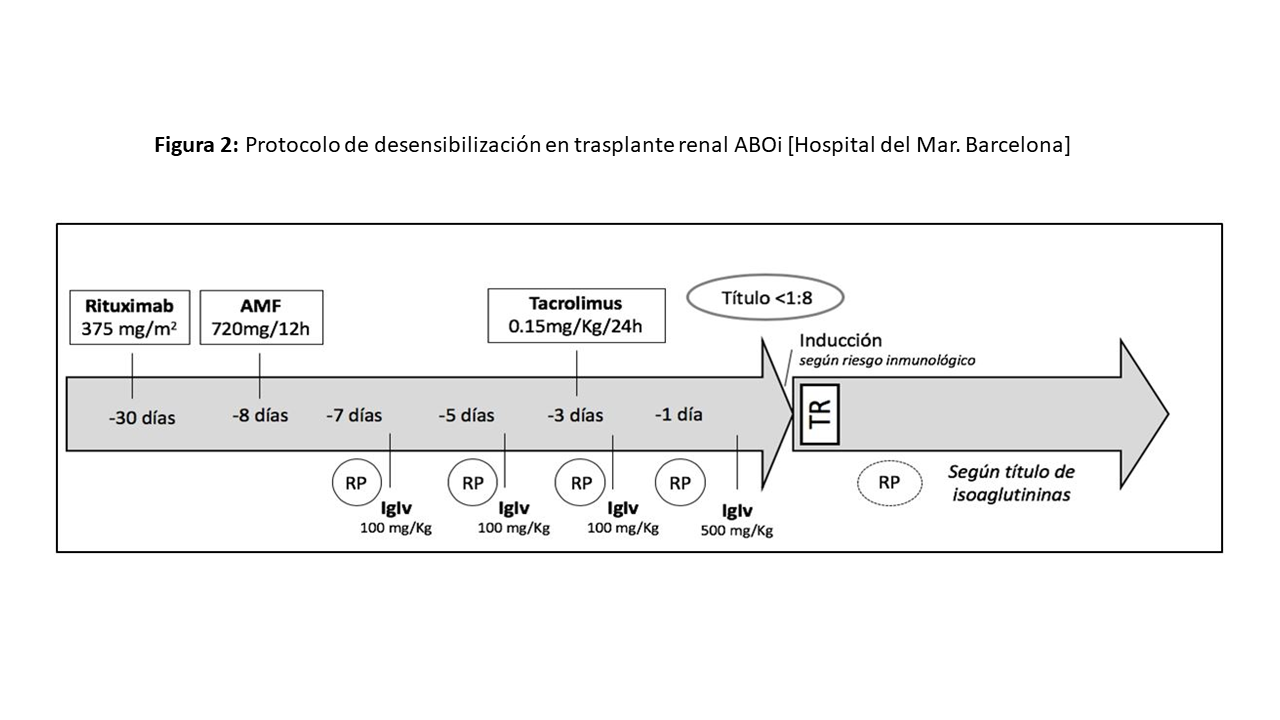
No existe un consenso o protocolo común para la desensibilización en el TRDV ABOi y se han publicado diferentes experiencias y estrategias para el acondicionamiento. La experiencia japonesa en la más amplia y con mayor tiempo de seguimiento [40] en España, el grupo del Hospital Universitario de A Coruña ha publicado recientemente su experiencia con muy buenos resultados [37]. En la (Figura 2) exponemos de forma esquemática nuestro protocolo clásico de acondicionamiento pretrasplante para TRDV ABOi del Hospital del Mar (Barcelona). La introducción de IA con columnas específicas A, B o AB actualmente, que admiten tratar hasta 6 volúmenes plasmáticos con un plasmafiltro o una centrifuga, permite reducir el número de sesiones e incluso realizar un tratamiento el día del trasplante al tener una influencia mínima sobre el estado de coagulación, aunque pueden presentar un coste más elevado [41].
Desensibilización HLA
La desensibilización HLA se utiliza para dar acceso al trasplante a aquellos pacientes hipersensibilizados que tienen una prueba cruzada positiva con su donante. El grupo de pacientes hipersensibilizados aumenta cada vez en las listas de espera, y los protocolos de desensibilización son una de las opciones para dar acceso al trasplante a este tipo de pacientes [42].
No existe un procedimiento universalmente aceptado que haya demostrado ser más eficaz o superior al resto para llevar a cabo la desensibilización HLA, pero en su mayoría se incluye la AFT (RP o IA) junto con la administración de gammaglobulina intravenosa [43].
El número de sesiones de RP/IA dependerá del grado de sensibilización y el objetivo será alcanzar una prueba cruzada negativa o un nivel de ADE circulantes relativamente seguro para evitar el RMA precoz que lleve a la pérdida del injerto [44].
Se han propuesto diferentes estrategias según el nivel de ADE circulantes [45]:
Niveles bajos de Acs (MFI <9000): uso de recambios plasmáticos: Pueden ser necesarias 5 o más sesiones preTR para conseguir una prueba cruzada negativa.
Niveles altos de Acs (MFI >9000): uso de inmunoadsorción: Suelen ser necesarias de 2-4 sesiones preTR para conseguir una prueba cruzada negativa.
A veces, se requiere la combinación de ambas técnicas
Puede ser necesario realizar varias sesiones después del trasplante y la monitorización estrecha de función renal y ADE será fundamental para establecer los requerimientos de RP/IA tras el trasplante. Recientemente se ha publicado un consenso europeo para el manejo del trasplante HLA incompatible recomendado que la estrategia más eficaz para la desensibilización HLA es el uso de recambios plasmáticos/IA junto con IgIv o depleción de células B con anticuerpos monoclonales anti-CD20 [26].
RECURRENCIA DE GLOMERULOESCLEROSIS FOCAL Y SEGMENTARIA
La glomerulosclerosis focal y segmentaria primaria (GFyS) es una enfermedad glomerular que clínicamente se manifiesta como síndrome nefrótico y que recurre con frecuencia después del trasplante renal con mal pronóstico en cuanto a supervivencia del injerto [40]. Actualmente, se estima que la tasa de recurrencia es aproximadamente del 30%, aunque parece que podría estar infraestimada por la dificultad en el diagnóstico de GFyS primaria en riñón nativo [46].
Su patogénesis no es del todo del todo conocida. Parecen existir diferentes potenciales factores circulantes que podrían alterar la permeabilidad podocitaria; sin embargo, no se ha logrado identificar un único factor responsable. Además, parece existir una disregulación inmune del podocito que podría contribuir al desarrollo de esta entidad [47].
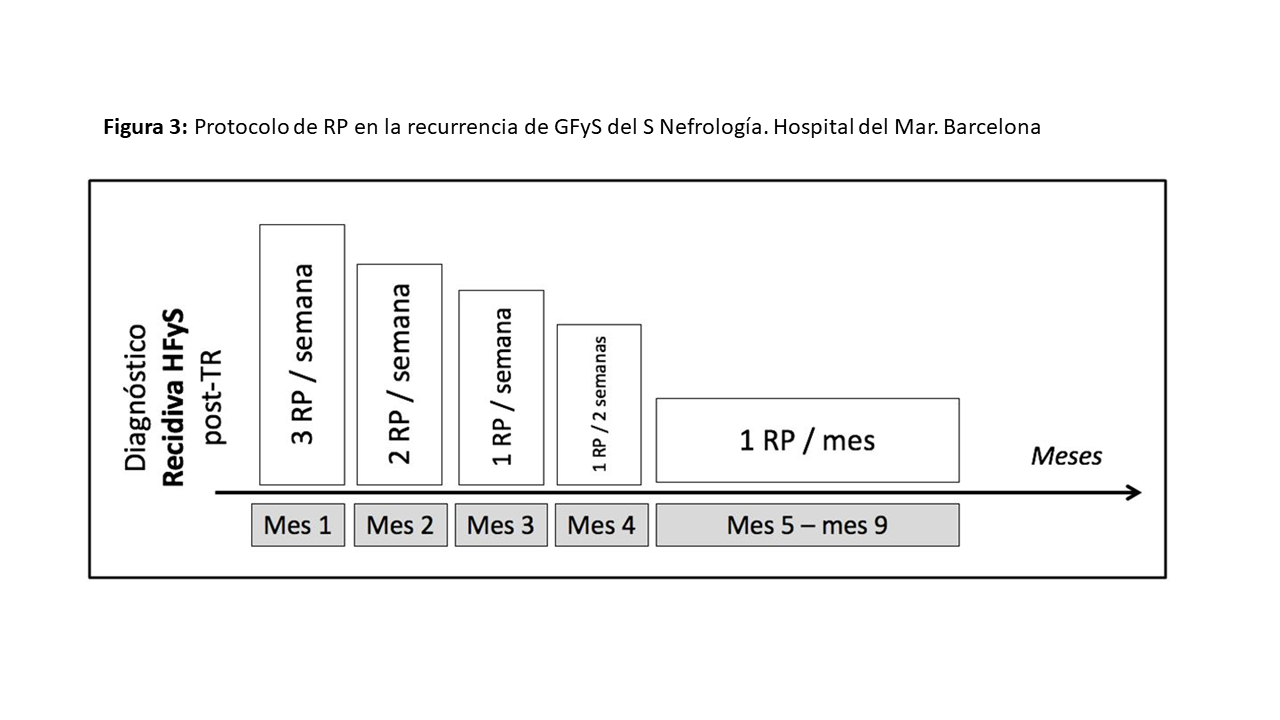
Uno de los pilares fundamentales dentro del tratamiento de la recurrencia de esta entidad en el postrasplante, que puede ocurrir muy precozmente, son los RP combinados con tratamiento inmunosupresor (esteroides y ciclosporina a altas dosis); además de IECAs o ARA2 como antiproteinúricos y rituximab en casos de falta de respuesta al tratamiento [48][49][50][51].
En la (Figura 3) se expone un esquema de tratamiento en caso de recidiva de GFyS tras el trasplante renal. Protocolo de RP en la recurrencia de GFyS del S Nefrología del Hospital del Mar (modificado de Canaud et al) [48]
Una revisión sistemática de 77 estudios observacionales no randomizados que incluyeron 423 pacientes con recidiva postrasplante de GFyS y que recibieron tratamiento con AFT concluye que el 71% de los pacientes tuvieron una remisión parcial o total de la proteinuria. El sexo masculino y el tratamiento con RP dentro de las 2 primeras semanas postrasplante fueron predictores de buena respuesta al tratamiento [52]. El proyecto TANGO (Post-Transplant Glomerular Disease) que es un proyecto observacional, multicéntrico e internacional para el estudio de la patología glomerular postrasplante ha publicado recientemente una cohorte de 176 pacientes trasplantados con diagnóstico de GFyS que presentan una recurrencia del 32%. El tratamiento más frecuente utilizado fue la plasmaféresis y rituximab (81%) consiguiendo remisión parcial en el 57% [51].
Sin embargo, son necesarios estudios randomizados con grupo control para darle solidez a los resultados del uso de la AFT en la recidiva de la GFyS.
OTRAS INDICACIONES EN TRASPLANTE DE ÓRGANO SÓLIDO NO RENAL
Trasplante cardíaco:
En el trasplante cardiaco la AFT tiene las siguientes indicaciones:
Rechazo celular/recurrente y profilaxis del rechazo
La fotoaféresis (FA) es utilizada en el trasplante cardiaco para el tratamiento del rechazo celular o recurrente, así como para su profilaxis; de hecho, tiene categoría 1B y 2A de en las guías ASFA, respectivamente. Parece que el mecanismo implicado sería un aumento en la actividad de las células T reguladoras [53]. De hecho, existe alguna experiencia reciente del uso de FA en trasplante cardiaco con el objetivo de reducir la inmunosupresión en pacientes de alto riesgo de infecciones o recidiva de cáncer con aparentes buenos resultados, aunque todavía los resultados son muy limitados [54] [55].
Desensibilización HLA y rechazo humoral.
La AFT forma parte de los protocolos en trasplante cardiaco en entidades que implican la respuesta humoral como terapia para eliminar Acs HLA circulantes, de forma similar a como ocurre en le TR.
Junto con el resto de inmunosupresión, los recambios plasmáticos se recomiendan como parte del tratamiento en casos de rechazo agudo mediado por Acs, aunque no existen estudios controlados randomizados en esta indicación [56]. También se incluye la AFT como parte del esquema de terapéutico en los casos de trasplante pediátrico [57].
Se han publicado series de casos de uso de RP para disminuir o eliminar los Acs HLA circulantes en caso de pacientes altamente sensibilizados con el objetivo de reducir el elevado riesgo de RMA en el postrasplante inmediato [58].
Trasplante hepático:
Desensibilización en trasplante ABO incompatible
De forma similar a como ocurre en otros trasplantes de órgano sólido, la incompatibilidad ABO históricamente se ha considerado como una contraindicación para el trasplante hepático. Sin embargo, en la actualidad el uso de técnicas de AFT combinadas con tratamiento inmunosupresor ha permitido realizar trasplantes hepáticos con incompatibilidad de grupo sanguíneo.
En el trasplante hepático se utiliza la misma estrategia de acondicionamiento descrita previamente en el TR: (1) técnicas de AFT (RP o IA) (2) gamma globulina intravenosa (3) rituximab [previamente, esplenectomía] y (4) fármacos inmunosupresores [58]. En las guías ASFA solo se recomiendan los recambios plasmáticos como técnica de aféresis. Sin embargo, existe también buena experiencia reportada con el uso de IA selectiva para eliminar los Acs anti-A/anti-B circulantes [59] [60].
Aunque no existe un consenso general sobre que el título ideal de isoaglutininas, en general, se consideran títulos 1:8 o 1:16 como seguros para llevar a cabo el trasplante hepático ABOi [61].
En la actualidad, el trasplante hepático ABOi (especialmente de donante vivo) se considera ya un procedimiento rutinario y relativamente seguro en términos de rechazo humoral por Acs ABO.
Rechazo mediado por anticuerpos
La AFT se ha utilizado en casos de RMA en trasplante hepático para disminuir el título de Acs circulantes. Los criterios de RMA en el trasplante hepático han evolucionado en los últimos años y asistimos a un número creciente de publicaciones con experiencias retrospectivas del uso de la AFT con inmunoglobulina IV junto con un aumento de la inmunosupresión para el tratamiento del RMA, especialmente el RMA agudo con ADS [62].
Trasplante pulmonar:
Síndrome de bronquiolitis obliterante
Es la forma más común de disfunción crónica del injerto en el trasplante pulmonar (afecta al 50% a los 5 años y 75% a los 10 años postrasplante) y sigue siendo la causa más frecuente de muerte más allá del primer año después del trasplante [63]. En esta entidad es consecuencia de una respuesta fibroproliferativa que se produce tras disregulación de la respuesta inmune. Por este motivo, se plantea la FA casi como única opción terapéutica por su efecto inmunomodulador: aumento de las células T reguladoras con una reducción de las citoquinas pro-inflamatorias. Existe evidencia clínica limitada basada en estudios retrospectivos (categoría II de ASFA) para el uso de FA en la bronquiolitis obliterante [64] [65].
Serán necesarios estudios randomizados para apoyar el uso de esta técnica en la bronquiolitis obliterante que se produce en los pacientes trasplantados pulmonares.
Rechazo mediado por anticuerpos
Igual que en el resto de órganos sólidos, en el trasplante pulmonar, la definición y clasificación del RMA está cambiando en los últimos años [66]. Los recambios plasmáticos para la disminución o eliminación de los Acs HLA donante específicos se incluyen en los esquemas de tratamiento tanto en el RMA definitivo como en el RMA probable o posible. La evidencia se basa en series pequeñas de casos retrospectivas (categoría III en guías ASFA) que combinan los recambios plasmáticos con IgIv y rituximab [67] [68]. Los resultados son dispares y se necesitan estudios con mayor número de pacientes para establecer la relevancia de esta entidad en el trasplante pulmonar y sus opciones terapéuticas [69].