Pacientes con ERC G4-G5 no en tratamiento sustitutivo (2018)
Abreviaturas
CKD G4+: Enfermedad renal crónica filtrado glomerular < 30 mil/min (G4 y G5, no en tratamiento renal sustitutivo)
KRT (kidney replacement therapy): terapia renal sustitutiva
CVD: enfermedad cardiovascular
RESUMEN
Pacientes con un descenso marcado del filtrado glomerular (GFR) (es decir, con enfermedad renal crónica (CKD) G4+) tiene un riesgo mayor de insuficiencia renal, enfermedad cardiovascular (CVD) eventos cardiovasculares (incluyendo insuficiencia cardíaca) y muerte. Sin embargo, se sabe poco sobre la variabilidad de los resultados clínicos (outcomes) y estrategias terapéuticas más optimas, incluyendo el inicio del la terapia renal sustitutiva (KRT). El Kidney Disease: Improving Global Outcomes (KDIGO) organizó en diciembre 2016 una conferencia con un grupo de expertos internacionales sobre controversias en estos temas en los que hay falta de conocimiento. En colaboración con El Consorcio de Pronóstico de CKD (CKD-PC) se realizo un metaanálisis de estudios de cohorte (n =264.515 individuos con CKD G4+) para saber el momento en que aparecen las alteraciones clínicas en pacientes con CKD G4+ y los factores de riesgo que establecen la aparición de determinados cuadros clínicos. Los resultados confirmaron el valor pronóstico de los factores de riesgo tradicionales de enfermedad cardiovascular (CVD) en individuos con marcado descenso del GFR, aunque el riesgo varía para los "outcomes" renales y de CVD. Se desarrolló un modelo de predicción de la probabilidad de necesitar KRT a 2 y 4 años. Las implicaciones de estos hallazgos para el manejo del paciente se discutió en el contexto de la Evidencia publicada bajo 4 temas clave: manejo de CKD G4+, desafíos diagnósticos y terapéuticos de la insuficiencia cardiaca, toma de decisiones compartida y optimización de los ensayos clínicos en pacientes con CKD G4+. Los participantes concluyeron que la variable pronóstico de pacientes con CKD avanzada requiere estrategias individualizadas y basada en el factores de riesgo del individuo, teniendo en cuenta riesgos que compiten entre sí y preferencias del paciente.
Enfermedad renal crónica (CKD), definida como la reducción persistente de la filtración glomerular (GFR) y / o la presencia de otros signos de daño renal, se clasifica basándose en los niveles de GFR y albuminuria [1]. El riesgo de resultados adversos, incluida la mortalidad y la insuficiencia renal, aumenta con la disminución del GFR y el aumento de la albuminuria [2].
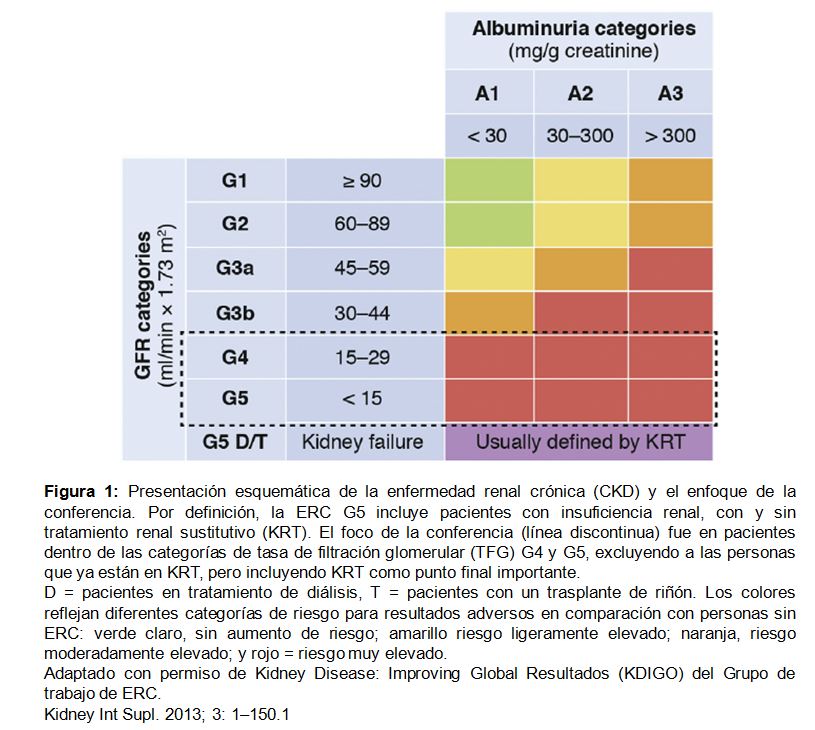
Individuos con un GFR inferior a 30 ml / min por 1.73 m2 (es decir, CKD G4 o G5) tienen un riesgo particularmente alto en toda las categorías de albuminuria (Figura 1). Además, las complicaciones específicas de la CKD aumentan notablemente con niveles bajos de GFR, siendo la enfermedad cardiovascular (CVD) una de las principales causas de morbilidad y mortalidad. De particular relevancia es la insuficiencia cardiaca (IC), una de las condiciones más comunes de CVD en pacientes con CKD G4 o superior.
La terapia renal sustitutiva (KRT) (es decir, diálisis o trasplante) puede atenuar las consecuencias de la insuficiencia renal y mejorar el pronóstico. Sin embargo, hay grandes variaciones en tasas de incidencia de KRT [3], y globalmente, solo aproximadamente la mitad de las personas con insuficiencia renal reciben KRT [4]. La desigualdad en el acceso al KRT juega un papel importante, pero también existen diferencias en los patrones de práctica clínica. Hay acuerdo en que con solo el nivel de GFR no se debe decidir el inicio de KRT; se deben considerar los signos y síntomas asociados con la insuficiencia renal. Sin embargo, definir el tiempo óptimo para iniciar la KRT sigue siendo un desafío [1]. Es importante destacar que los primeros meses en diálisis han sido identificados como período de muy alto riesgo, aunque no se conoce en qué medida los eventos adversos son desencadenados por el inicio de diálisis [5] [6]. Mandar los enfermos a los servicios de nefrología con poco tiempo antes del inicio de la diálisis se ha asociado con un mayor riesgo de resultados adversos en comparación con los que han tenido la ocasión de estar más tiempo en los servicios de nefrología antes de empezar la KRT [7] [8].
Por lo tanto, una bajo GFR (< 30 ml / min por 1,73 m2) que corresponde a CKD G4 o G5 (excluyendo a los pacientes en KRT y denominada posteriormente como "CKD G4+") refleja un estado crítico. Una mejor comprensión del pronóstico de los pacientes con CKD G4+ puede informar sobre estrategias de tratamiento, incluyendo toma de decisiones para el inicio de KRT. Por lo tanto, Kidney Disease: Improving Global Outcomes (KDIGO) colaboró con el CKD Prognosis Consortium (CKD-PC) para iniciar un metaanálisis global de estudios de cohortes (cohortes poblacionales, cohortes de CKD referidas y cohortes de investigación). El objetivo principal fue determinar el pronóstico de los pacientes con CKD avanzada con respecto al inicio de la KRT, los eventos de CVD, la mortalidad y el momento de estos eventos [9], con un segundo objetivo, determinar la variabilidad del pronóstico del paciente según la cohorte, la demografía o características de salud [10].
Los resultados del metaanálisis global se presentaron a un grupo internacional de expertos en una Conferencia de Controversias de KDIGO en diciembre de 2016, y se discutieron las implicaciones en el manejo del paciente. Se establecieron Grupos de trabajo enfocados a: (i) manejo de CKD G4+, (ii) diagnóstico y desafíos terapéutico de la IC en la CKD G4+, (iii) toma de decisiones compartida para el inicio de la KRT, y (iv) optimización de los ensayos clínicos en pacientes con G4+. Para reducir el alcance de la conferencia, no se abordaron aspectos específicos en niños y pacientes con un trasplante fallido.
Presentamos un resumen de la discusión y las principales conclusiones de la conferencia con respecto al manejo e investigación en pacientes con CKD G4+. Las presentaciones detalladas del metaanálisis se publican en los artículos complementarios [9] [10].
Pronóstico de pacientes con CKD G4+: nuevos conocimientos de un metaanálisis global de estudios de cohortes
En preparación para la conferencia, llevamos a cabo un metaanálisis con el objetivo de examinar los riesgos absolutos y relativos en una población grande y diversa de pacientes con CKD estadio G4. El metaanálisis de factores de riesgo para KRT, eventos de CVD y muerte incluyeron 28 cohortes (n 185.024) usando análisis de supervivencia estándar y regresión de Cox [10]. El metaanálisis de predicción del riesgo incluyó 29 cohortes (n. 264.296) [9].
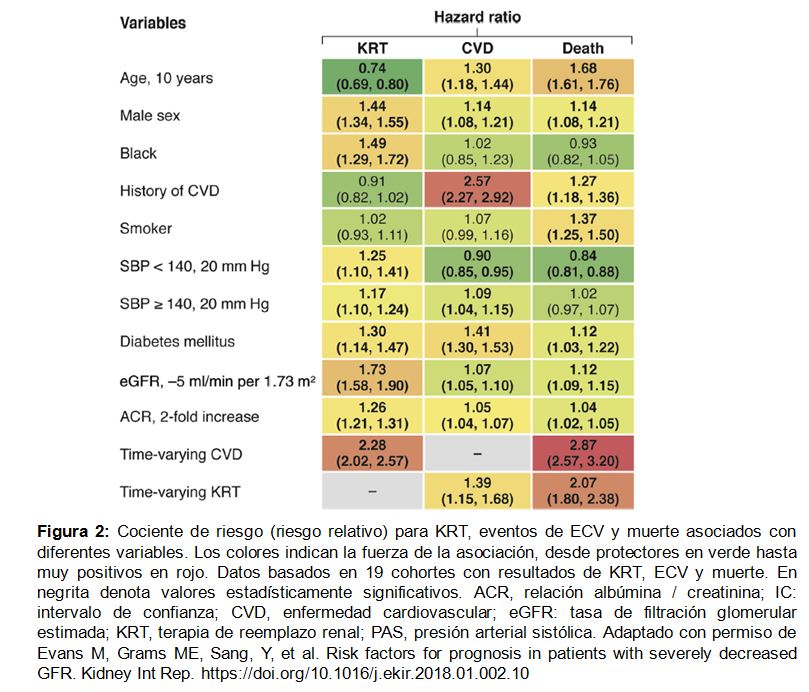
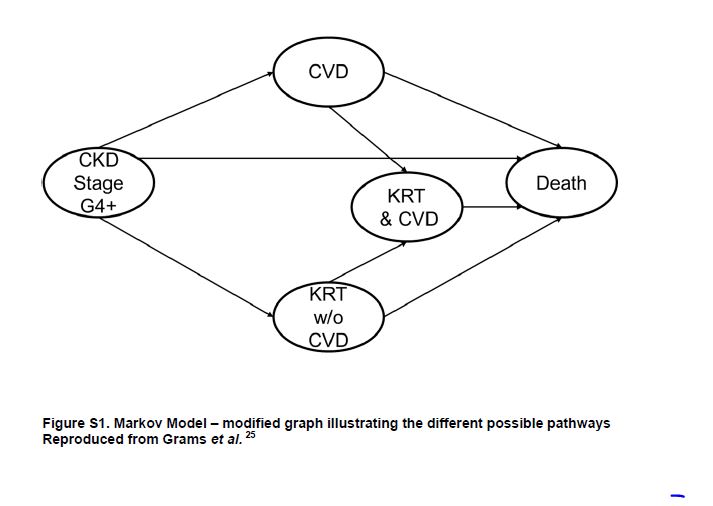
Los principales hallazgos fueron que los factores de riesgo para la CVD tenían gran relevancia en la CKD G4+, pero su importancia relativa difirió según el resultado clínico final (Figura 2). La edad y los antecedentes clínicos de CVD estaban relacionados negativamente con el riesgo de necesitar KRT, pero positivamente relacionado con CVD y riesgo de muerte. Fumar destaca como lo más fuertemente asociado con la muerte. La presión arterial estaba asociada positivamente con el riesgo de KRT pero mostró una asociación en forma de U con CVD y mortalidad. Diabetes y sexo masculino fueron factores de riesgo para todos los resultados clínicos adversos, pero sobre todo, para CVD y KRT respectivamente. La raza negra solo se relacionó positivamente con KRT. El filtrado glomerular estimado más bajo (eGFR) y la relación albúmina/creatinina (ACR) más alta se asociaron más robustamente con KRT que con otros resultados clínicos adversos. Finalmente, los eventos de CVD variables en el tiempo y el inicio de KRT se asociaron fuertemente con el desenlace posterior de muerte. El segundo metaanálisis se centró en el desarrollo de una nueva calculadora de riesgo para eventos CVD, KRT y muerte, como muestra en forma de diagrama la (Figura Suplementaria S1) (Figura 5) [9].
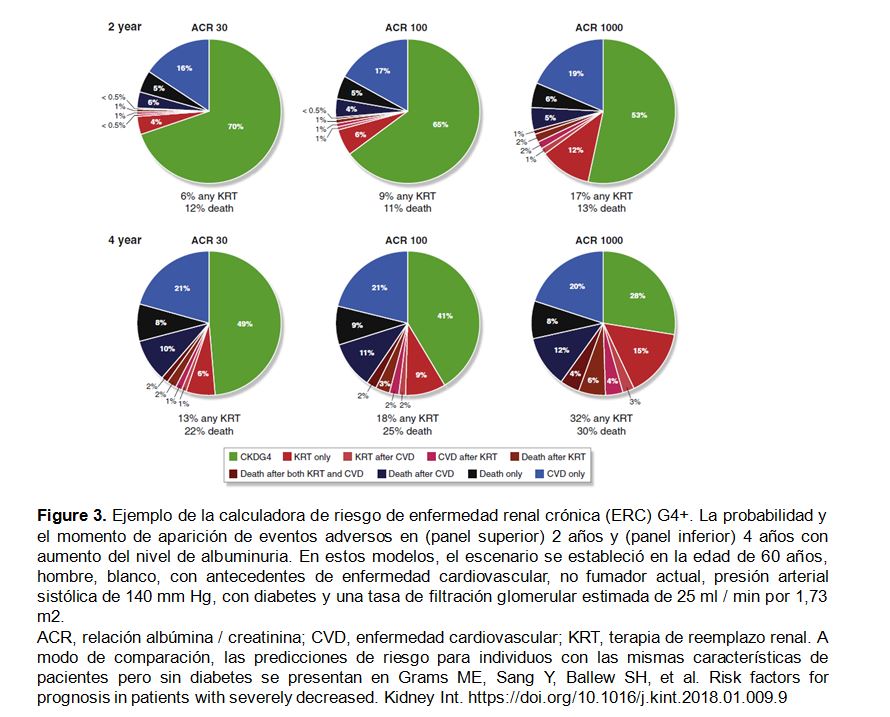
La calculadora de riesgo CKD G4+ utiliza un formato de gráfico circular (pie) para mostrar la probabilidad de que ocurran cualquiera de las evoluciones clínicas "outcomes" en un período de seguimiento dado (2 o 4 años) (calculadora en línea: http: //www.kdigo.org / ecuación /). Por ejemplo, como se ilustra en la (Figura 3), con un eGFR de 25 ml / min por 1,73 m2 y las covariables mencionadas en el leyenda de la figura, la proporción de participantes que se predice recibir KRT dentro de 4 años incrementa del 13% al 32% si aumenta albuminuria, mientras que el riesgo de muerte aumenta de 22% a 30%. En la población general examinada que tenía una mediana de eGFR de 24 ml / min por 1,73 m2 y ACR de 168 mg / g, se predijo que más del 50% de los participantes no tendrían eventos a los 4 años.
El riesgo previsto de permanecer libre de eventos durante 2 años varía de menos del 20% a más del 80%, lo que ilustra el poder predictivo de las características del paciente [9]. Este metaanálisis global de CKD-CP9 amplía la ecuación de riesgo de insuficiencia renal (ERIR) para la predicción de KRT [11] [12] y confirma su valor en CKD G4+. Junto con el ERIR, la nuevo calculadora de riesgo CKD G4+ proporciona herramientas de fácil acceso para médicos, pacientes y políticas para fabricantes que traducen las características del paciente en un poderoso instrumento de discriminación de riesgo. Es importante tener en cuenta que otras características adicionales, a menudo no medidas, influyen de forma adicional en el riesgo, y por lo tanto, parte de la individualización debe incluir el reconocimiento de las limitaciones de las estimaciones cuantitativas del riesgo.
Manejo de pacientes con CKD G4+.
Evaluación y gestión basada en riesgos.
Las personas con CKD G4+ tienen riesgo de insuficiencia renal, hospitalizaciones, enfermedades cardiovasculares eventos, muerte y, a menudo, resultados clínicos poco reconocidos, como discapacidad, deterioro cognitivo, caídas e infección. La ecuación ERIR [11] y la nueva calculadora de riesgo CKD G4+ proporcionan herramientas útiles en la predicción de riesgos y su coherencia es satisfactoria. Hay otros modelos similares publicados [13] [14]. Una tarea para futuras investigaciones sería conseguir mayor refinamiento en la predicción de resultados clínicos adicionales relevantes para el paciente. Sin embargo, los modelos disponibles parecen suficientes para proponer su implementación.
Incorporación de las preferencias y valores del paciente.
Hay un creciente reconocimiento de que los pacientes quieren participar en términos de igualdad en sus cuidados de salud [15]. La toma de decisiones compartida puede conducir a interacciones productivas entre pacientes, familiares, cuidadores y proveedores de atención médica, involucrando activamente a todos los socios en decisiones de tratamiento, proporcionando suficiente educación sobre opciones de tratamiento y sus atributos, utilizando estrategias para destapar los valores de los pacientes, identificando las preferencias del paciente y logrando un acuerdo sobre el curso del tratamiento [16] [17].
Es necesario trabajo adicional para desarrollar y evaluar estrategias y recursos para la toma de decisiones compartida como parte de los cuidados del enfermo con CKD.
Modelos de cuidados de pacientes
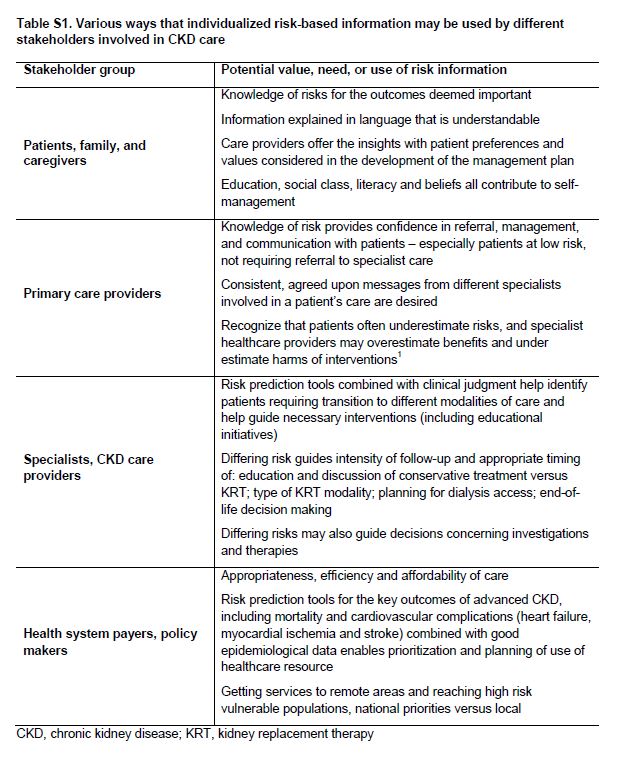
Hasta ahora, los datos sobre la implementación sistemática de modelos de atención a personas con CKD G4+ son relativamente escasos y las relaciones entre elementos específicos de la atención de la CKD y los resultados de los pacientes están por determinar. Sin embargo, hay una serie de consideraciones generales que parecen válidas (Tabla 1), y las cuestiones específicas de las partes interesadas deben ser tenidas en cuenta (Tabla Suplementaria S1) (Tabla 8). Además, se pueden señalar las competencias que parecen fundamentales para el éxito implementación de modelos de atención (Tabla Suplementaria S2) (Tabla 9).
Los beneficios potenciales de un enfoque por parte de equipo multidisciplinario esta descrito desde hace más de 20 años [18]. Una revisión sistemática reciente (18 estudios; 8.853 pacientes) encontró que la atención multidisciplinar de pacientes con CKD estaba asociada con menor riesgo de mortalidad de cualquier causa, diálisis y uso de catéter permanente como acceso para hemodiálisis [19]. Los estudios que revelan asociaciones con mejores resultados han sido observacionales y no se ha confirmado con ensayos aleatorizados [20], pero 2 ensayos recientes han aportado resultados alentadores. El ESCORT (Efectividad de la Atención Integrada en Retraso de la progresión de la enfermedad renal crónica en estadio 3-4 en Comunidades rurales de Tailandia), un estudio basado en la comunidad, ensayo controlado aleatorizado por aglomeraciones de pacientes revela un retraso en la progresión de la CKD asociada con mejorías en control de la presión arterial y la diabetes y bicarbonato sérico con la introducción de un programa integrado de atención de la CKD [21].
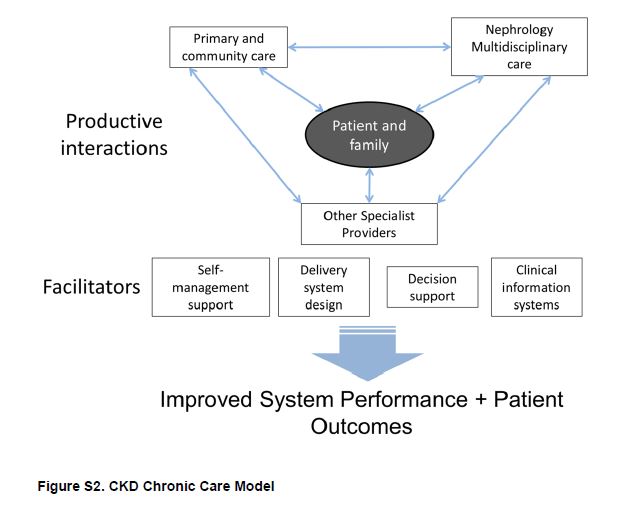
Además de la atención de rutina, la atención médica integral se proporcionó educación en temas de dieta, ejCKDicio y medicación como parte de la intervención. En otro ensayo controlado aleatorio por grupos, Lalonde y colaboradores introdujeron un programa de formación y redes de comunicación para farmacéuticos como parte de la atención multidisciplinar de las personas con CKD en Quebec, Canadá [22]. En una cohorte de pacientes que ya se beneficiaban de la atención multidisciplinaria, la introducción del programa mejoró la calidad del uso de medicamentos y redujo en un 15% el número de problemas relacionados con la medicación. Parece razonable que el acceso a proveedores de atención multidisciplinaria puede resultar atractivo para muchos pacientes; sin embargo aún no está claro cual: el grado de impacto en el paciente, el diseño óptimo o la participación de cada uno de los miembros del equipo [23]. Sugerimos que los modelos de atención deben poner a los pacientes en el centro de una estructura transparente y abierta que asegura una óptima comunicación y uso de los recursos disponibles (Figura Suplementaria S2) (Figura 6).
Se necesita más investigación para generar modelos que puedan abordar aspectos como la atención específica en personas en países con ingresos bajos y medios, con multimorbilidad e integración de proveedores de atención medica multidisciplinar y de los otros especialistas que atienden al paciente; desarrollo de nuevas tecnologías que pueden mejorar la comunicación entre las partes interesadas y estrategias para salvar las transiciones de atención entre el hospital y los centros extra-hospitalarios de la comunidad, así como entre fases de la CKD, diálisis y cuidados de trasplantes.
Incertidumbres sobre objetivos y terapias.
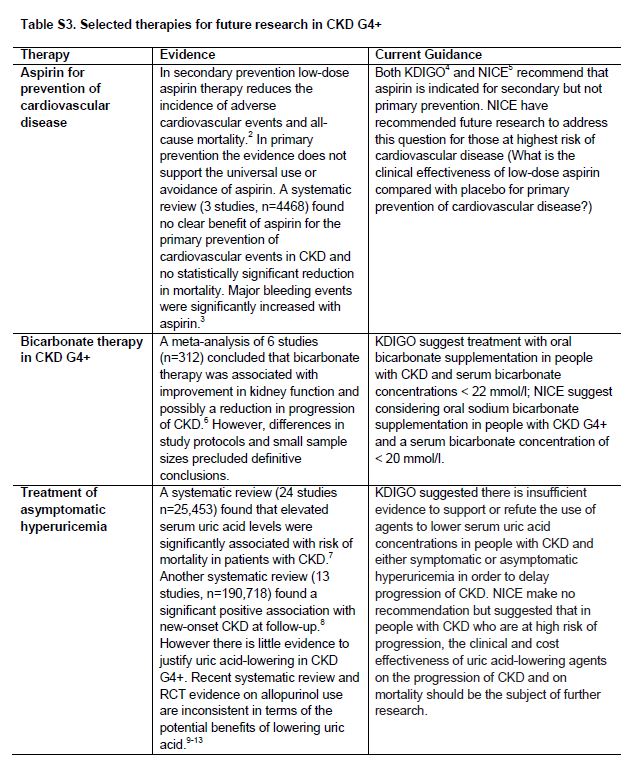
Existen incertidumbres importantes en el manejo de pacientes con CKD G4+ (Tabla 2). En general, estas incluyen intervenciones que están dirigidas a la enfermedad renal subyacente o tiene como objetivo primario y secundario la prevención de las complicaciones de las CVD. Con frecuencia, se ha extrapolado le evidencia obtenida en estudios en otras etapas de CKD o grupos de edad más jóvenes, o se basa en estudios observacionales. Por ejemplo, aunque algunos ensayos de bloqueo del sistema de renina-angiotensina-aldosterona (RAAS) han incluido pacientes con CKD G4+ [24], sigue la incertidumbre sobre la generalización de su eficacia en pacientes la CKD G4+ [25]. Estamos pendientes de resultados de un ensayo diseñado para probar el papel de interrumpir el tratamiento del bloqueo del RAAS en la estabilización de la función renal en pacientes con CKD progresiva o tardía G4 [26]. La evidencia actual y recomendaciones de guías sobre varios tratamientos terapéuticos importantes se muestran en la (Tabla Suplementaria S3) (Tabla 10). Dada la carga de fármacos y la alteración del metabolismo de fármacos en CKD G4+, es prioritaria la evaluación de interacciones medicamentosas y eventos adversos sobre la seguridad de medicamentos. Las recomendaciones de investigación para el manejo de pacientes con CKD G4+ se resumen en la (Tabla 3).
Complicaciones cardiovasculares durante la CKD G4+: insuficiencia cardíaca
Uno de los enfoques del manejo de CKD G4+ es prevenir CVD, que sigue siendo una de las principales causas de morbilidad y mortalidad en estos pacientes. La insuficiencia cardiaca (IC) es de especial relevancia en pacientes CKD G4+ ya que es una de las afecciones cardiovasculares más comunes y sin embargo, quedan muchas incertidumbres diagnósticas y terapéuticas en el manejo de la IC en la CKD G4+, particularmente en pacientes que se acercan a la KRT.
Definición, factores de riesgo y diagnóstico de insuficiencia cardíaca en la CKD G4+
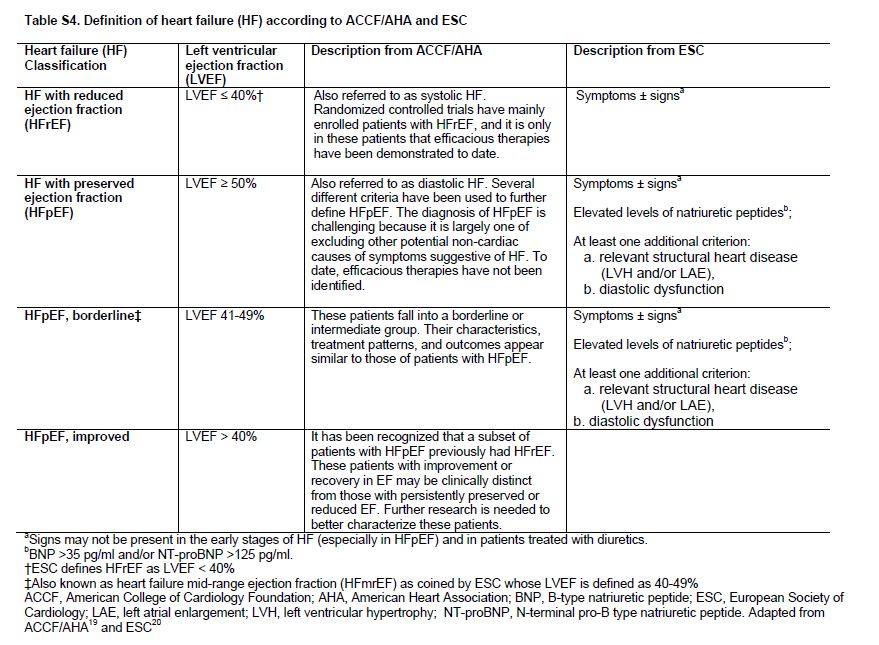
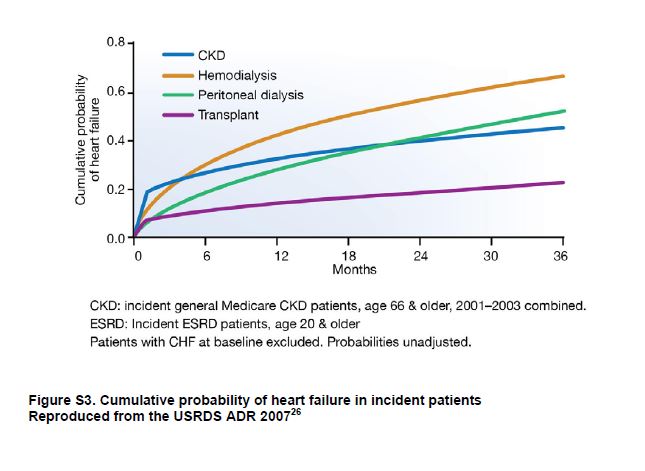
Los pacientes con CKD tienen un riesgo elevado de IC [27] [28] que aumenta con la gravedad de la CKD [29]. Entre los pacientes recibiendo KRT, el 40% tiene IC [30] con tasas de prevalencia más altas entre pacientes en hemodiálisis en comparación con peritoneal diálisis y los trasplantados de riñón [31]. La incidencia de IC también es alta entre los pacientes con CKD y aquellos que reciben KRT (Figura Suplementaria S3) (Figura 7) [32]. La IC se define como un síndrome de llenado inadecuado y / o bombeo insuficiente como para satisfacer las demandas sistémicas. Hay 2 tipos de IC, con fracción de eyección preservada (ICFEp) y con fracción de eyección reducida (ICFEr), y la definición de subtipos de IC ha sido una área de trabajo en curso de la ACCF / AHA [33] y ESC [34] (Tabla Suplementaria S4) (Tabla 11). La ICFEp es más común en pacientes con CKD [35].
El diagnóstico de IC sigue siendo difícil en pacientes con CKD, particularmente en CKD G4+, dada la dificultad para distinguirlo de causas de sobrecarga de volumen. La IC debe ser definida como la presencia de síntomas de IC y anomalías estructurales y/o funcionales en las imágenes cardíacas (Tabla Suplementaria S4) (Tabla 11) [33]. En los estudios observacionales, los datos por imágenes frecuentemente no están disponibles. De hecho, en el análisis CKD-PC, las definiciones de IC no se armonizaron suficientemente entre las cohortes para permitir un análisis válido de las tasas de incidencia y de la predicción de riesgos. Además, a pesar de la reconocida importancia de la IC, sigue sin conocerse si la detección de IC, ya sea por imágenes o biomarcadores cardíacos [36], conlleva a mejores resultados en pacientes con CKD G4+.
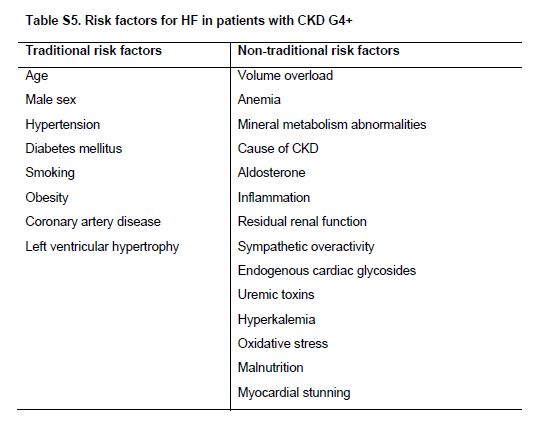
Los factores de riesgo, tradicionales y mas nuevos, incluyendo anormalidades metabólicas, toxinas urémicas e hiperactividad simpática, aceleran el desarrollo de IC en pacientes con CKD G4+ (Tabla Suplementaria S5) (Tabla 12) [37] [38].
Resultados asociados a insuficiencia cardíaca en CKD G4+.
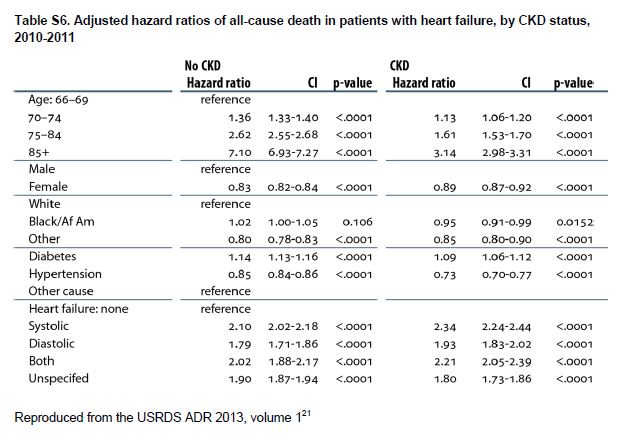
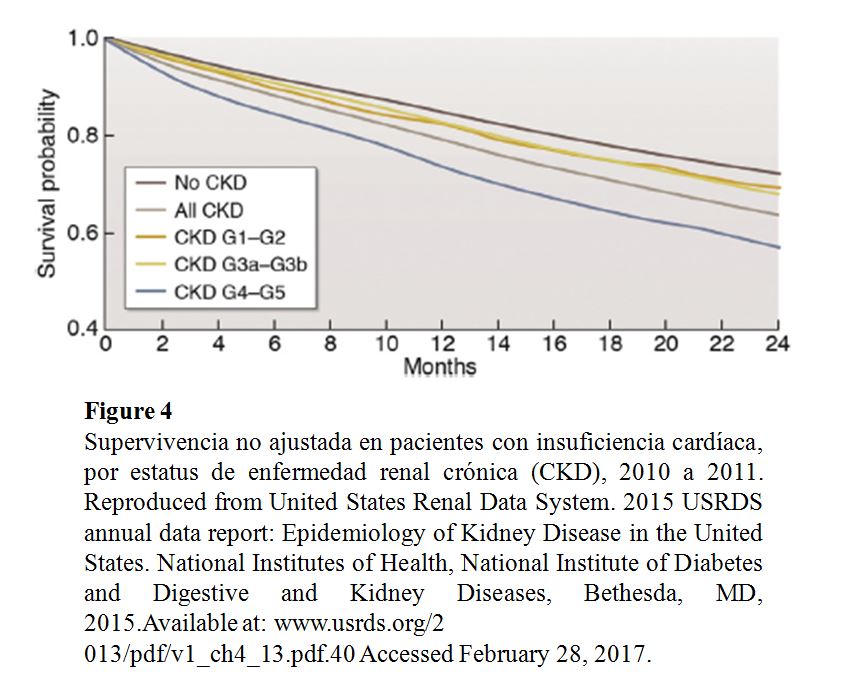
La IC esta asociada a una evolución clínica desfavorable en pacientes con CKD, incluyendo un mayor riesgo de muerte, particularmente en pacientes mayores, que tienen ICFEr (Tabla Suplementaria S6) (Tabla 13) [39] [40] o tienen una GFR muy disminuida (Figura 4). La IC contribuye significativamente a la morbilidad entre los pacientes con CKD, lo que lleva a frecuentes hospitalizaciones con rehospitalizaciones [41] [42] [43] [44]. La IC también se asocia con episodios de insuficiencia renal aguda [45] y progresión de la CKD [46] [47]. Entre los pacientes incidentes en diálisis, la sobrecarga de volumen, en comparación con otras indicaciones de diálisis, se asocia con mayor riesgo de mortalidad [48].
Progresión, clínica y subclínica, de la insuficiencia cardíaca después inicio de la diálisis.
Solo unos pocos estudios han evaluado mediante ecocardiogramas cambios subclínicos en la insuficiencia cardíaca en pacientes con CKD G4+, y los resultados no son consistentes. En el estudio CRIC, el índice de masa ventricular izquierdo medio no cambió después del inicio de KRT. Sin embargo, hubo un disminución modesta, pero estadísticamente significativa en la fracción de eyección del ventrículo izquierdo [49]. El estudio CASCADE examinó los ecocardiogramas de pacientes con CKD G3 [50] y mostró que el índice de masa ventricular y el volumen auricular izquierdo aumentaron en un año; sin embargo, la fracción eyección del ventrículo izquierdo no cambio significativamente. En el ensayo IDEAL, ecocardiogramas realizados con periodicidad de 12 meses no mostraron cambios en el índice de masa del ventrículo izquierdo, en el diámetro de la aurícula izquierda, en la disfunción diastólica o en la fracción de eyección del ventrículo izquierdo después inicio de la diálisis [51]. Sin embargo, cabe señalar que en este estudio, más del 40% estaban en diálisis peritoneal (DP) y el resto en hemodiálisis (HD). En otro estudio de 41 pacientes con IC, el índice de masa ventricular disminuyó tras el inicio de la HD [52].
Acceso vascular e insuficiencia cardíaca.
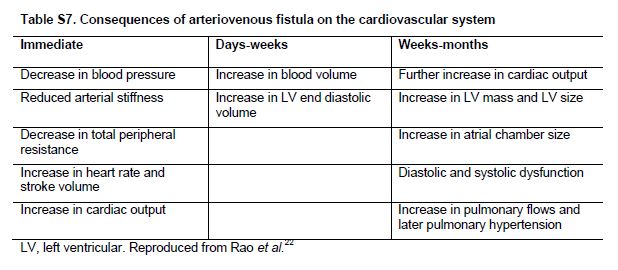
La preparación del acceso vascular es clave en el manejo de pacientes CKD G4+. Se ha postulado que existen numerosos cambios en el sistema cardiovascular después de la creación de una fístula arteriovenosa [53] (Tabla Suplementaria S7) (Tabla 14). Pequeños estudios o informes de casos clínicos han sugerido que la fístula arteriovenosa puede conducir al desarrollo de IC de alto gasto [54] [55] [56] [57] [58]. La creación de la fístula arteriovenosa puede causar empeoramiento de la hipertrofia del ventrículo derecho e hipertensión pulmonar [54] [59] que se asocia a dilatación significativa y aumento de remodelado del ventrículo derecho y un mayor riesgo de insuficiencia cardíaca [60]. Por otro lado, otros estudios encontraron una estabilización de la función renal después de la creación del acceso [61]. Se necesitan estudios prospectivos más extensos para comprender el manejo óptimo del acceso vascular en pacientes con CKD G4+ e IC.
Manejo de insuficiencia cardíaca en CKD G4+
Manejo de IC en pacientes con CKD, especialmente CKD G4+ es complicado (Tabla 4). Casi todos los ensayos de IC han excluido pacientes con CKD avanzada, y pocos han mostrado una mejoría en pacientes con ICFEp. Análisis post hoc han incluido algunos pacientes con CKD moderada, pero los efectos conseguidos después de terapias como los betabloqueantes y marcapasos implantables han sido son solo moderados [62] [63] [64]. Además, el riesgo de hiperpotasemia limita el uso de los IECAs y los ARA2 en la CKD G4+ [44] [65]. Entre los pacientes que recibieron KRT con insuficiencia cardíaca conocida, la proporción de pacientes con terapias inhibidoras del SRAA y los betabloqueantes siguen siendo bajos [31]. Son necesarios estudios de terapias de IC y dispositivos cardíacos específicamente en CKD G4+, particularmente en el caso de ICFEp, que es el tipo de IC mas frecuente en pacientes con CKD G4+ (Tabla 5) y (Tabla Suplementaria S4) (Tabla 11). Aunque esta reportado que las tasas incidentes (es decir, de novo) de IC recurrente es menor en pacientes en DP que en HD [66] [67] [68] en pacientes con IC establecida, la tasa de mortalidad puede que sea mayor en la DP que en HD [69]. Esto probablemente refleja el hecho de que a los pacientes frágiles con IC se les ofrece preferentemente DP, ya que provoca menos estrés hemodinámico agudo. Claramente se justifican ensayos clínicos prospectivos que comparen la DP con la HD.
Toma de decisiones para el tratamiento de la insuficiencia renal.
Predicción de resultados adversos después del inicio de la terapia renal sustitutiva.
Varios registros [70] [71] y estudios de cohorte [6] proporcionan información sobre riesgos de mortalidad basados en la población de pacientes que inician KRT. Una observación importante es que las tasas de mortalidad son más altas durante los primeros 4 meses después de iniciar la diálisis y disminuyen en los meses siguientes [6]. En el cohorte DOPPS, se observó una alta mortalidad temprana en los diferentes países, y las diferencias entre mortalidad temprana y tardía fueron más pronunciadas en los pacientes de más de 65 años en comparación con los más jóvenes [6]. Aunque la retirada de la diálisis explica parte de la mortalidad temprana, no es la única explicación. Los eventos de CVD también son mucho más altos en las primeras semanas después del inicio de KRT [5].
Los estudios también han mostrado que existe una alta cantidad de síntomas y síndromes geriátricos, como demencia y discapacidad y utilización de la atención médica entre los pacientes al comenzar la diálisis, especialmente en aquellos que son frágiles, con múltiples patologías crónicas y comienzan la diálisis en el contexto de una hospitalización prolongada [72] [73] [74] [75] [76]. Estos resultados son importantes para los pacientes y, a veces, más que la mortalidad. La alta morbilidad y mortalidad tempranas plantea interrogantes sobre las causas potenciales y las estrategias para reducir riesgos; en particular plantea preocupaciones de que para algunos pacientes, el inicio de KRT puede no ser la elección óptima de terapia. Se han desarrollado instrumentos para predecir a corto plazo la mortalidad entre los pacientes que han iniciado diálisis [77] [78] [79] [80]. Sin embargo, es difícil predecir con suficiente certeza cuales son los pacientes a los que les irá mal en diálisis [81].
La nueva calculadora de riesgo CKD-G4 puede facilitar la toma de decisiones, proporcionando estimaciones cuantitativas de riesgo de eventos de CVD al inicio del KRT y de mortalidad según características del paciente [9] (Figura 3). Es importante reconocer que una proporción significativa de pacientes CKD G4+ sobreviven sin eventos CV y ni necesidad de KRT durante períodos de observación de 2 y 4 años.
Asesoramiento óptimo para decisiones de modalidad de tratamiento.
El asesoramiento para la modalidad de KRT debe basarse en el riesgo, ser iterativo y centrado en el paciente. Además, debe adaptarse al entorno cultural, conocimientos en salud, necesidades psicosociales y emocionales, teniendo en cuenta si existe deterioro cognitivo. Las opciones disponibles una vez que hay insuficiencia renal incluyen la atención conservadora integral sin diálisis, HD en el centro o en su casa, PD y trasplante. Pueden existir circunstancias en las que una modalidad de KRT pueda estar contraindicada, pero cuando las opciones existen, un enfoque de toma de decisiones para la elección de modalidad de KRT optima debe ser compartida y con participación del paciente; esto puede mejorar los resultados. Las entrevistas y discusiones deben revisarse a intervalos regulares para garantizar que las circunstancias no han cambiado.
Hay dos situaciones que requieren consideraciones especiales: asesoramiento para el trasplante en adultos mayores y asesoramiento para renunciar a la diálisis. Se acepta que, entre los pacientes incluidos en lista de espera, el trasplante de riñón mejora la esperanza de vida y calidad de vida en comparación con los que permanecen en diálisis cualquiera que sea el rango de edad [82]. La edad avanzada en sí mismo no es una contraindicación para el trasplante [83]. Aunque sólo una proporción de los pacientes serán aptos para el trasplante, debe considerarse en todos aquellos que no tengan contraindicaciones obvias para KRT. La consideración y evaluación para el trasplante debe basarse en las características del paciente, preferencias y circunstancias regionales [84]. La variabilidad regional injustificada en el acceso al trasplante está bien documentada y los programas de trasplante deben establecer políticas transparentes para aceptar pacientes en espera lista.
El asesoramiento general sobre KRT también debe incluir información sobre la opción de renunciar a la diálisis y recibir tratamiento conservador. La "Renal Physicians Association" ha publicado pautas sobre las circunstancias en las que renunciar a la diálisis puede ser apropiado (Tabla Suplementaria S8) (Tabla 15) [85]. Aunque el beneficio de iniciar KRT disminuye con la edad [86], la edad avanzada per se no debe considerarse una contraindicación para KRT; de hecho, los participantes de la conferencia cuestionaron la recomendación de Renal Physicians Association de renunciar en general diálisis en pacientes de > 75 años con mal pronóstico y recomendaron un enfoque más individualizado, teniendo en cuenta las preferencias y valores del paciente junto con el pronóstico.
Incertidumbres sobre el inicio de terapias renal sustitutiva y prioridades de investigación
Un metaanálisis reciente de estudios de cohorte y ensayos ha demostrado que aquellos que comienzan la diálisis con una mayor eGFR pueden tener una mayor mortalidad [87]. Es probable que esto se deba a una causalidad inversa, de modo que se presiona al paciente y al médico para que se inicie tratamiento con diálisis en pacientes con fragilidad y comorbilidades acumuladas, en particular IC. Existen diferencias en cómo se ha planificado la iniciación de la KRT. Existe el enfoque de "DP primero", comenzar con una fístula arteriovenosa funcional y diferencias en el sitio de colocación de la fístula y comienzo de diálisis "incremental" ya sea con tasas de flujo sanguíneo reducidas, horas reducidas o limitados intercambios de DP. No esta claro en qué medida todos estos factores influyen en los resultados. La indicación de inicio de la diálisis debe registrarse de forma rutinaria en el historial del paciente, además de dejar información sobre el comienzo electivo versus no planificado de la diálisis. En el estudio IDEAL, la mayoría de los pacientes asignados a un comienzo tardío pero que comenzaron temprano tenía la indicación de comienzo identificada como "uremia" [88]. Por lo tanto, sería útil comprender el espectro de síntomas que provocaron el inicio temprano de la diálisis para proporcionar una mayor claridad con respecto al comienzo óptimo. Las recomendaciones de investigación se resumen en la (Tabla 6).
Necesidades, oportunidades y desafíos para los ensayos clínicos en pacientes con CKD G4+.
Dificultades para realizar ensayos clínicos en pacientes con CKD G4+ y estrategias para superarlos.
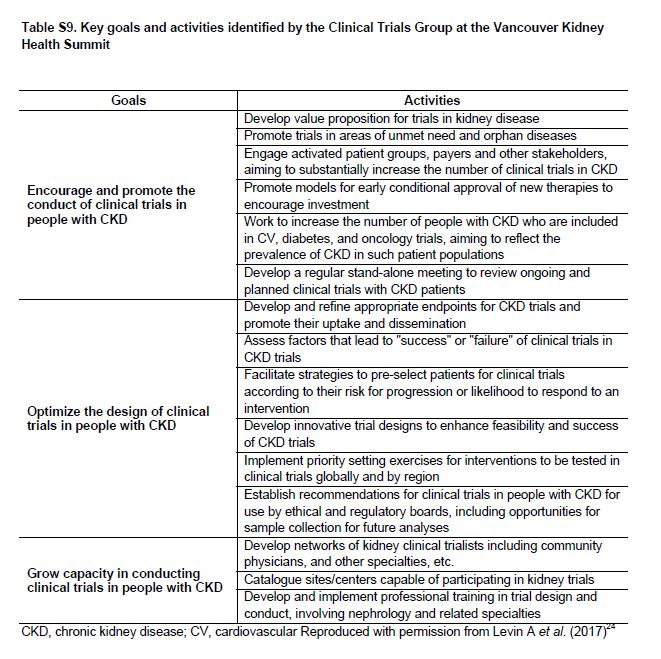
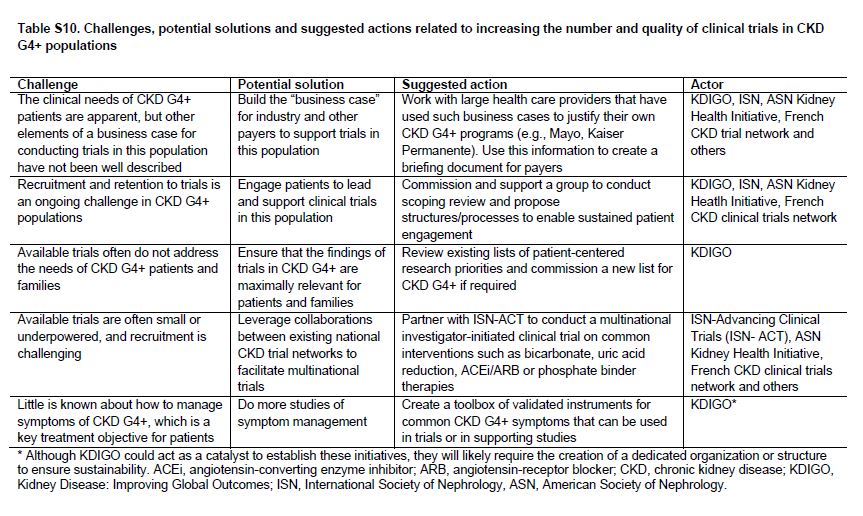
Hay una necesidad urgente de aumentar el número y la calidad de los ensayos clínicos en pacientes con CKD, incluidas las pacientes con CKD G4+ (Tabla Suplementaria S9) (Tabla 16) [89] [90]. Un resumen de las dificultades que han sido identificadas y las soluciones propuestas se muestran en la (Tabla 7) y la (Tabla suplementaria S10) (Tabla 17). Para la industria, el potencial económico de los beneficios de un ensayo clínico exitoso debe compensarse frente a los posibles riesgos financieros y no financieros. El lento reclutamiento, las tasas de eventos adversos superiores al promedio, una pequeña población total de pacientes (es decir, de posibles usuarios), y varios ensayos clínicos recientes nulos en poblaciones con CKD pueden entre todos aumentar el riesgo económico pCKDibido. Sin embargo, los ensayos en poblaciones con CKD G4+ también tienen ventajas que son clave, incluido el gran potencial de beneficios económicos de prevenir la insuficiencia renal y eventos CV, un paciente relativamente cautivo y muy motivado y es una población con altas tasas de eventos (que se traduce en poder reducir el tamaño de la muestra o duración del seguimiento). Los ensayos iniciados por investigadores tienen diferentes desafíos: La comunidad de nefrología comprende la necesidad clínica y las oportunidades en la población CKD G4+, pero a menudo, le es difícil completar estudios con un número adecuado de pacientes [91]. Un análisis de los ensayos en curso indica que ciertos temas (por ejemplo, el tratamiento con bicarbonato de sodio en la CKD G4+) está siendo estudiado de forma independiente por múltiples grupos en diferentes países. Una posible solución podría ser vincular varias redes nacionales de prueba para aumentar el poder estadístico, ya sea uso de protocolos comunes o mediante la combinación de resultados de protocolos similares aunque no idénticos mediante la realización de metaanálisis [92].
Elección de intervenciones y resultados relevantes para el paciente
Como para la mayoría de las disciplinas médicas, la evidencia de ensayos disponible en poblaciones CKD G4+ refleja los intereses y prioridades de los médicos e investigadores en lugar de pacientes y familias. Corregir esta desalineación es fundamental para mejorar la utilidad de los resultados del ensayo y potencialmente para facilitar el llevar a cabo el ensayo aumentando el reclutamiento y la retención de participantes. Existen formas de identificar la investigación centrada en prioridades y resultados relevantes para el paciente (por ejemplo, aquellos identificados utilizando la metodología James Lind Alliance). Esto podría ser útil para lograr este objetivo. Una lista de tales prioridades para los pacientes con CKD G3a a G5 están ya disponibles [93] [94] y podría ser utilizado específicamente como base para pacientes con CKD G4+. El momento de iniciar la KRT tiene significancia clínica y, por lo tanto, es importante basarse en resultados de ensayos de terapias dirigidas a ralentizar la pérdida de la función renal. Sin embargo, la iniciación de KRT está determinada por muchos factores, como directrices y hábitos locales, preferencias de médicos y pacientes, y el bienestar y las comorbilidades de los pacientes. La evolución de los síntomas y capacidad funcional, antes y después del inicio de KRT, son importantes para determinar seguridad y eficacia, y obviamente son relevantes para la paciente. Un conjunto de herramientas que ayude a evaluar los síntomas ayudará a interpretar los resultados de los ensayos clínicos con resultados funcionales. Es crítico aumentar y mantener la participación de los pacientes en los ensayos y otras investigaciones clínicas, pero no se logró un consenso sobre cómo debe alcanzarse o abordarse este objetivo. Un punto de partida clave podría ser describir las lecciones aprendidas de iniciativas centradas en el paciente (por ejemplo, SONG-HD95 y NICE) y establecer una organización que sea responsable en promocionar específicamente la participación en la investigación sobre CKD G4+.
Incrementar el éxito de los ensayos clínicos en CKD G4+ optimizando otros aspectos del diseño del ensayo
Además de los resultados, se podrían optimizar otros aspectos del diseño de los ensayos clínicos. Así, el KFRE y el instrumento predictivo recientemente desarrollado específico para CKD G4+ podría usarse en posibles participantes del ensayo para informar sobre la influencia que supone la participación o enriquecer la contratación de participantes con un riesgo superior al promedio [11]. Métodos alternativos (por ejemplo, ensayos pragmáticos, diseños escalonados o basados en registros) también podrían utilizarse para facilitar la realización del ensayo [96]. Los ensayos pragmáticos son adecuados para pacientes con CKD G4+ porque tales ensayos pueden inscribir a personas de poblaciones en desventaja social (generalmente excluidas de las ensayos controlados), son directamente aplicables a la atención del paciente, permiten evaluación de una variedad de intervenciones, que incluyen resultados centrados en el paciente, y son más baratos que los tradicionales ensayos controlados aleatorios. También existen algunos desafíos, como la falta de experiencia, la recopilación y verificación de resultados y procedimiento de consentimiento informado, que puede plantear desafíos dado el uso creciente de historias clínicas electrónicas.
Conclusiones y perspectivas
Los pacientes con CKD G4+ representan una población de alto riesgo que requiere atención especializada y experiencia que idealmente debería ser coordinado por nefrólogos. A pesar de la marcada reducción de la GFR, el pronóstico de los pacientes con CKD G4+ es variable, con una proporción sustancial de hasta más de 50% sobreviviendo a eventos CV y sin KRT durante al menos varios años. La herramienta de predicción de riesgos desarrollada recientemente, específica para CKD G4+ puede ayudar a establecer un análisis cuantitativo de posibles resultados adversos, incluidos los eventos CV, insuficiencia renal y mortalidad y, por tanto, orientar la terapia. La información sobre el pronóstico puede tenerse en cuenta en las decisiones para vigilancia, reducción del riesgo de eventos CV y eventual preparación para KRT. Otro hallazgo importante del metaanálisis es que los factores de riesgo de CVD tradicionales parecen ser relevantes en CKD G4+, así como en estadios anteriores de CKD y en ausencia de CKD. Aunque tales asociaciones no prueban la eficacia de focalización de factores de riesgo, parece racional aplicar tales estrategias siempre que no se disponga de pruebas contrarias. Finalmente, hubo acuerdo general en que las complejas comorbilidades de personas con CKD G4+, particularmente aquellas con discapacidad, edad avanzada y esperanza de vida limitada, exigen un enfoque centrado en el paciente con toma de decisiones conjunta tanto en práctica de rutina, así como durante el diseño de ensayos para optimizar la gestión y los resultados.
MATERIAL SUPLEMENTARIO
Tablas y Figuras en inglés
Tabla S1. Varias formas en que la información individualizada basada en riesgos puede ser utilizado por diferentes partes interesadas involucradas en el cuidado de la CKD.
Tabla S2. Competencias clave necesarias para la prestación de cuidados de CKD G4+.
Tabla S3. Terapias seleccionadas para futuras investigaciones en CKD G4+.
Tabla S4. Definición de HF según ACCF / AHA y ESC.
Tabla S5. Factores de riesgo de IC en pacientes con CKD G4+.
Tabla S6. Razones de riesgo ajustadas de muerte por todas las causas en pacientes con insuficiencia cardíaca, por estado de CKD, 2010-2011.
Tabla S7. Consecuencias de la fístula arteriovenosa en el sistema cardiovascular.
Tabla S8. Recomendaciones de la Asociación de Médicos Renales con respecto a renunciar a la diálisis.
Tabla S9. Objetivos y actividades clave identificados por los ensayos clínicos Grupo en el Vancouver Kidney Health Summit.
Tabla S10. Desafíos, posibles soluciones y acciones sugeridas relacionados con el aumento del número y la calidad de los ensayos clínicos en CKD G4+.
Figura S1. Modelo de Markov: gráfico modificado que ilustra los diferentes posibles vías.
Figura S2. Modelo de atención crónica de la CKD.
Figura S3. Probabilidad acumulada de insuficiencia cardíaca en pacientes incidentes.
Referencias complementarias.
El material complementario está vinculado a la versión en línea del documento en www.kidney-international.org.
1. Hoffmann TC, Del Mar C. Clinicians' Expectations of the Benefits and Harms of Treatments, Screening, and Tests: A Systematic Review. JAMA Intern Med 2017; 177: 407-419.
2. Berger JS, Brown DL, Becker RC. Low-dose aspirin in patients with stable cardiovascular disease: a meta-analysis. Am J Med 2008; 121: 43-49.
3. Major RW, Oozeerally I, Dawson S, et al. Aspirin and cardiovascular primary prevention in non-endstage chronic kidney disease: A meta-analysis. Atherosclerosis 2016; 251: 177-182.
4. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter., Suppl. 2013; 3: 1-150.
5. National Institute for Health and Care Excellence. Chronic kidney disease in adults: assessment and management. Clinical guideline. http://nice.org.uk/guidance/cg182. Accessed April 7, 2017.
6. Susantitaphong P, Sewaralthahab K, Balk EM, et al. Short- and long-term effects of alkali therapy in chronic kidney disease: a systematic review. Am J Nephrol 2012; 35: 540-547.
7. Xia X, Luo Q, Li B, et al. Serum uric acid and mortality in chronic kidney disease: A systematic review and meta-analysis. Metabolism 2016; 65: 1326-1341.
8. Li L, Yang C, Zhao Y, et al. Is hyperuricemia an independent risk factor for new-onset chronic kidney disease?: A systematic review and meta-analysis based on observational cohort studies. BMC Nephrol 2014; 15: 122.
9. Bose B, Badve SV, Hiremath SS, et al. Effects of uric acid-lowering therapy on renal outcomes: a systematic review and meta-analysis. Nephrol Dial Transplant 2014; 29: 406-413.
10. Fleeman N, Pilkington G, Dundar Y, et al. Allopurinol for the treatment of chronic kidney disease: a systematic review. Health Technol Assess 2014; 18: 1-77.
11. Kanji T, Gandhi M, Clase CM, et al. Urate lowering therapy to improve renal outcomes in patients with chronic kidney disease: systematic review and meta-analysis. BMC Nephrol 2015; 16: 58.