Arritmias y ERC. Conclusiones (2018)
Introducción
Los pacientes con enfermedad renal crónica (ERC) están predispuestos a sufrir alteraciones del ritmo cardiaco, incluidas la fibrilación auricular (FA) / flutter auricular, taquicardias supraventriculares, arritmias ventriculares y muerte súbita cardiaca (MSC). A pesar de que están disponibles diferentes opciones de tratamiento, incluyendo fármacos, dispositivos y terapias intervencionistas, su utilización en el contexto de la ERC es complejo y limitado. Los pacientes con ERC y enfermedad renal crónica avanzada (ERCA) han sido históricamente escasamente representados o excluidos en los estudios randomizados de estrategias de tratamiento de arritmias [1], aunque esta situación está cambiando [2]. Los documentos de consenso de diferentes sociedades cardiovasculares han identificado evidentes lagunas en el tratamiento de pacientes con ERC y alteraciones del ritmo cardiaco [3] [4] [5] [6] [7].
Para identificar los temas clave referentes a una óptima prevención, manejo y tratamiento de las arritmias y sus complicaciones en pacientes con enfermedad renal, KDIGO convocó, en octubre de 2016, una Conferencia Internacional y Multidisciplinaria de Controversias en Berlín (Alemania) titulada ERC y arritmias.
El programa y cuestiones debatidas están disponibles en la página web de KDIGO (http://kdigo.org/conferences/ckd-arrhythmias/; 13 de febrero de 2018).
Fibrilación auricular e ictus en la enfermedad renal
Epidemiología
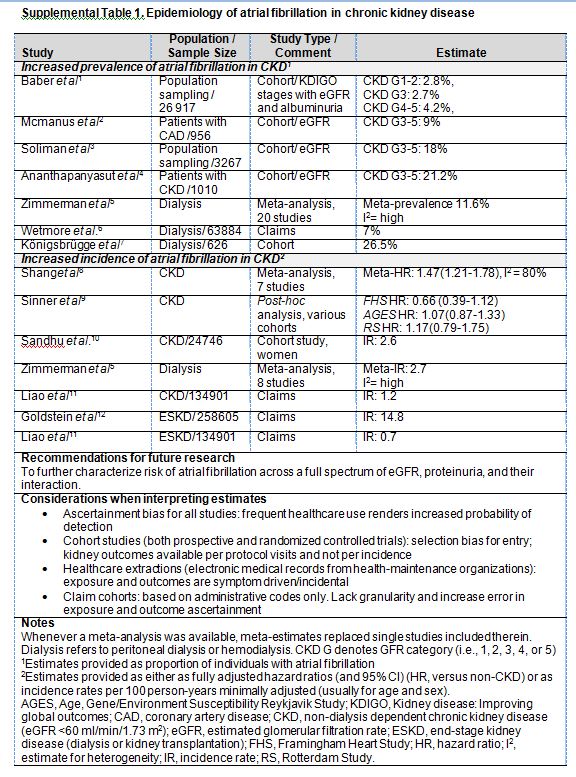
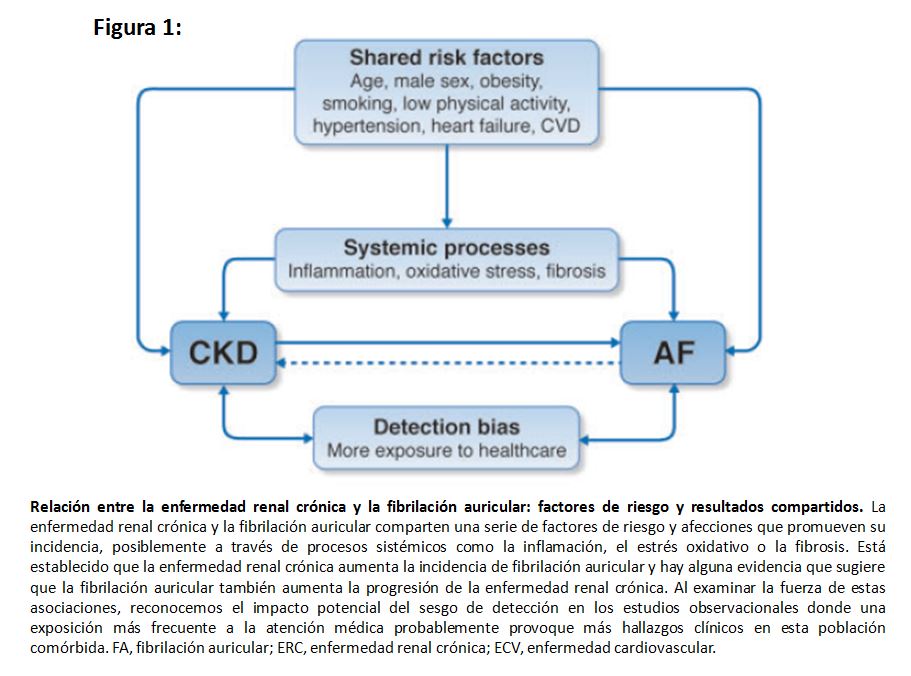
La fibrilación auricular constituye la arritmia sostenida más frecuente [8]. La ERC afecta al 10 % de los adultos en todo el mundo [9], y los pacientes con ERC tienen un mayor riesgo de FA comparados con aquellos sin ERC (Material suplementario online, Tabla S1) (Tabla 7). La prevalencia de FA es elevada: se estima entre 16-21 % en pacientes con ERC no dependientes de diálisis [10] [11] [12] y entre el 15-40 % en pacientes en diálisis (Material suplementario online, Tabla S1) (Tabla 7) [13] [14] [15] [16] [17] [18]. La ERC y la FA comparten muchos factores de riesgo, dificultando discernir la contribución de los factores individuales a cada entidad o al pronóstico conjunto (Figura 1). Para los pacientes con ERC no dializados, parece existir una relación independiente entre la ERC y el riesgo de FA [19] [20] [21] [22] [23] [24] [25], aunque dicha asociación no ha sido bien caracterizada a lo largo del espectro de la tasa de filtrado glomerular estimada (TFGe) y la proteinuria [13] [14] [26] [27]. En los Estados Unidos, tanto la incidencia como la prevalencia de FA están aumentando en la población en hemodiálisis [27] [28], lo cual puede explicarse por la avanzada edad de los pacientes, una mayor detección de esta entidad, y una mayor supervivencia después de sufrir eventos vasculares.
Consecuencias de la fibrilación auricular en la enfermedad renal crónica
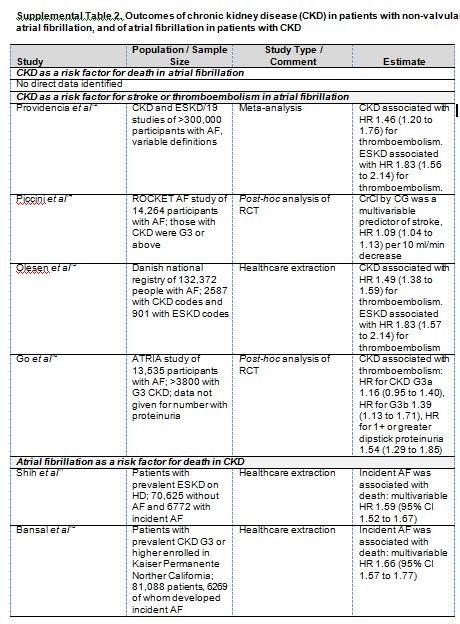
El riesgo de ictus es elevado tanto en los pacientes con ERC que no precisan diálisis [29] [30] [31] [32] como en los tratados con diálisis [29] [31] [33] (Material suplementario online, Tabla S2) (Tabla 8) y cont. (Tabla 9) . De forma separada, tanto la ERC como la FA son factores de riesgo para el ictus, pero es desconocido si el significado pronóstico de marcadores de ERC y FA es independiente o interdependiente. La asociación entre FA y ERC podría ser bidireccional [21]. En la ERC, el riesgo ajustado de ictus con FA varía considerablemente en las diferentes subpoblaciones de ERC, desde el 4,2 % en mujeres en la población general [34], 1,3 en pacientes en diálisis [33] [35] y una asociación significativa (1,4) en unos estudios [36] y no significativa en otros [37] después del trasplante renal. Estas diferencias podrían deberse a un mayor riesgo competitivo de muerte en fases más avanzadas de la ERC [35], a un mayor riesgo basal de ictus en pacientes con ERC sin FA o a una mayor prevalencia de FA no diagnosticada.
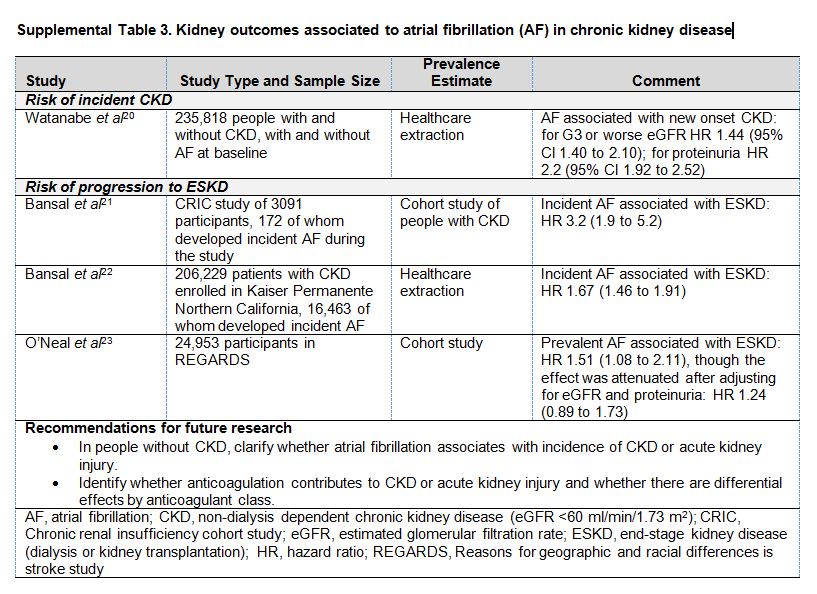
La FA aumenta el riesgo de ERC incidente y de progresión a ERCA [21] [38] [39] [40] (Material suplementario online, Tabla S3) (Tabla 10), e incrementa el riesgo de muerte en pacientes con ERC con o sin diálisis [13] [36] [41] [42]. Otras consecuencias relacionadas con la FA, incluyendo la insuficiencia cardiaca, la MSC, y el infarto agudo de miocardio (IAM), requieren más estudios. La contribución de la FA como mediador de ictus en la ERC, así como los subtipos de ictus observados, requiere igualmente un análisis adicional. El riesgo competitivo de muerte de la ERC podría reducir la importancia de la contribución de la FA al ictus, lo cual mitigaría la efectividad de algunas de sus estrategias de prevención [35].
Índices de riesgo de ictus
El valor predictivo y la calibración de los índices predictivos de ictus CHADS2 y el CHA2-DS2-VASc ha sido solo evaluados en pacientes en diálisis, en los cuales su comportamiento parece ser similar al de la población general [16] [33] [43] [44].
La inclusión de pacientes con ERC en los índices de riesgo para mejorar la predicción de ictus ha demostrado resultados variables. Añadiendo 2 puntos cuando el aclaramiento de creatinina es menor de 60 mL/min (llamado R2CHADS2) se objetivó una mejora en el denominado índice de mejoría de la reclasificación (NRI) pero no el denominado estadístico C (C-Statistic) en un gran estudio, utilizando validación externa [30], no mejorando ninguno de estos índices en otras series [45] [46]. El índice ATRIA, el cual incluye TFGe < 45 mL/min/1,73 m2 y la proteinuria, demostró mejoría del NRI y una mejora límite en el estadístico C, comparado con CHADS2 y el CHA2-DS2-VASc en la validación externa [47], aunque el NRI no sería clínicamente significativo [48]. Por estas razones y el papel que juegan estos índices en la recomendación de anticoagulación oral (ACO) en los pacientes con ERC, sin tener en cuenta riesgos competitivos, CHA2DS2-VASc sigue siendo el índice más comúnmente recomendado para la estratificación del riesgo [5] [49], habiendo demostrado los datos observacionales que valores de CHA2DS2-VASc mayor o iguales a 2 se asocian con un beneficio en el tratamiento con ACO, incluso en la ERC [50].
Índices de riesgo de sangrado
Los índices de riesgo de sangrado HAS-BLED, ORBIT, HEMORR2HAGES y ATRIA incluyen parámetros de ERC. Aunque el uso formal de estos índices de riesgo hemorrágico no ha sido recomendado por la mayoría de las guías de las sociedades profesionales [49] [51], el aumento del riesgo de sangrado con y sin OAC en la ERC está bien documentado y debe ser considerado en la toma de decisiones clínicas.
Prevención del ictus y anticoagulación oral
Los mecanismos fisiopatológicos responsables del ictus/tromboembolismo en pacientes con ERC y FA son multifactoriales y pobremente entendidos. La precisa contribución de factores cardioembólicos versus no cardioembólicos no está clara. La FA podría ser causa directa del ictus cardioembólico, un marcador de riesgo de ictus isquémico, incluyendo los subtipos aterotrombóticos, y en raros casos, una consecuencia del ictus [52].
Pacientes con enfermedad renal crónica con un aclaramiento de creatinina estimado entre 30-50 mL/min
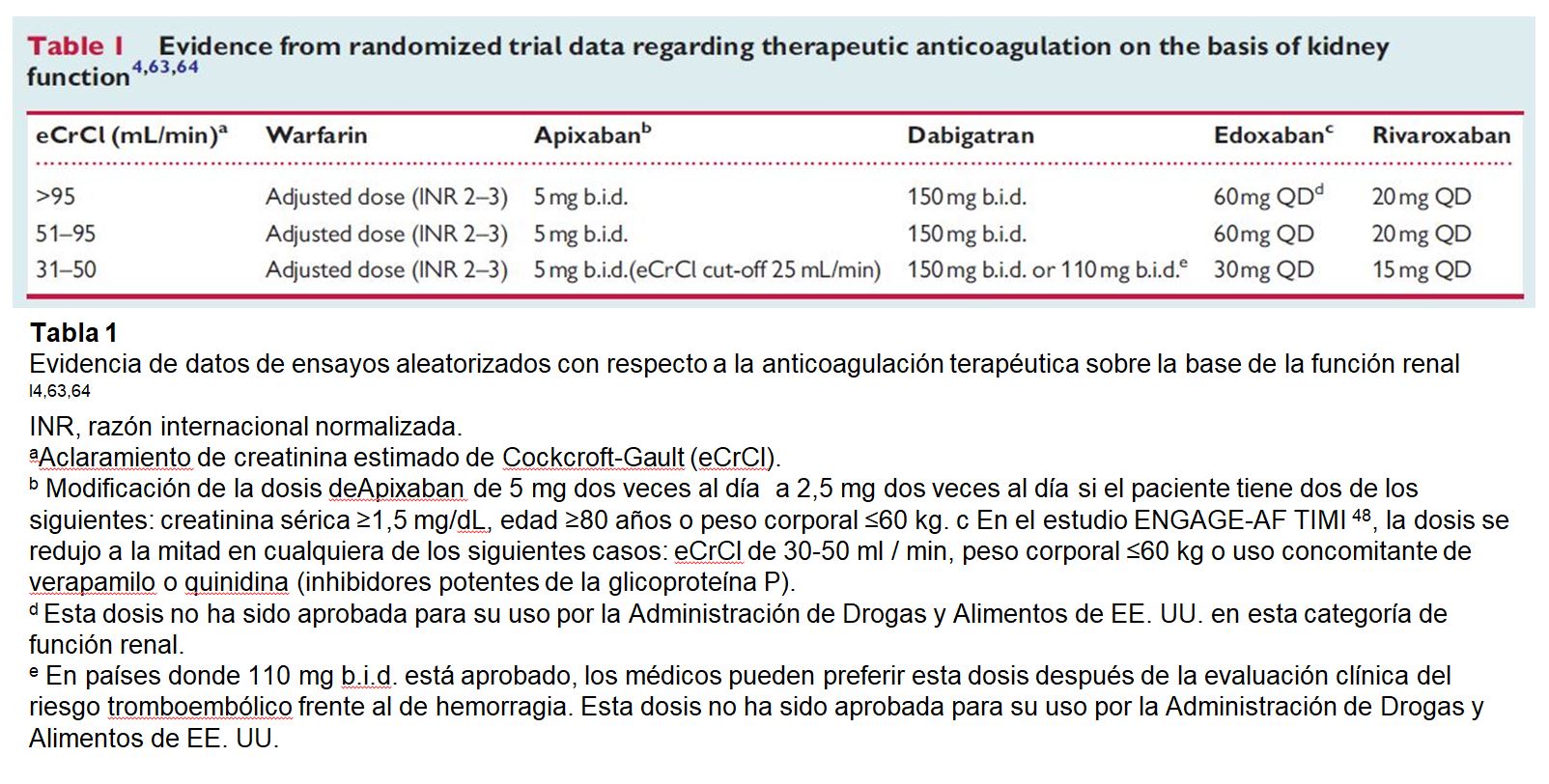
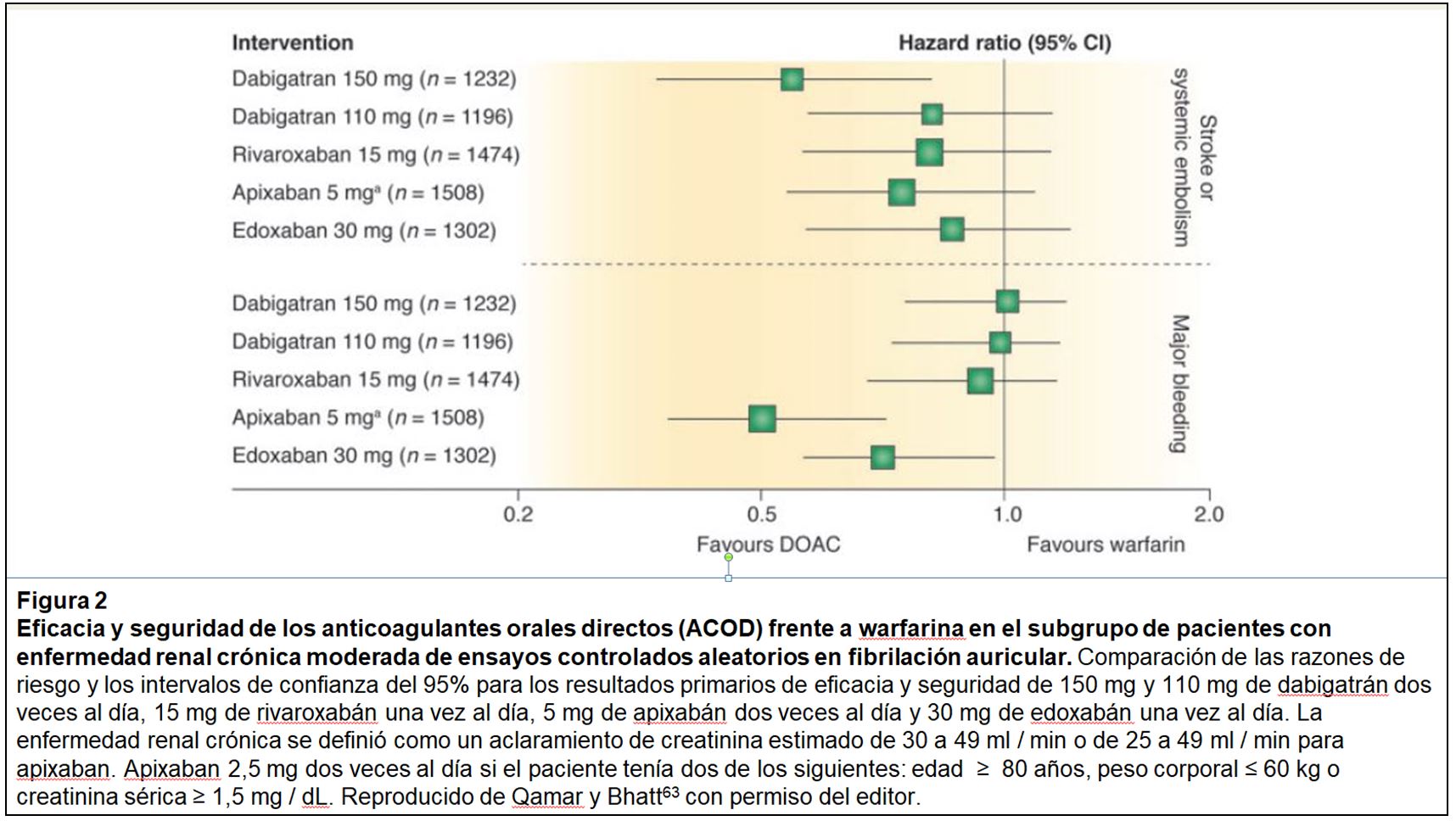
Los estudios randomizados y controlados pivotales han establecido que los anticoagulantes orales de acción directa (ACOD) no son inferiores a la warfarina entre pacientes con aclaramiento de creatinina estimado por Cockroft-Gault (ClCre) entre 30-50 mL/min (para apixabán, 25-50 mL/min) [53] [54] [55] [56]. Sin embargo, no hay evidencia suficiente para recomendar un ACOD específico sobre cualquier otro en esta población, al no existir estudios comparativos entre ellos [57] [58] [59] [60] [61] [62] (Tabla 1). Las comparaciones indirectas no son válidas porque estos estudios diferían en los criterios de inclusión y en las definiciones de objetivos.
Aunque la eficacia (prevención de ictus y embolia sistémica) puede no ser inferior a la warfarina, el perfil de seguridad de los ACOD, en comparación con la warfarina, parece ser superior. En todos los estudios randomizados y controlados pivotales, los ACOD se han asociado con una reducción significativa (aproximadamente 50 %) en el riesgo de hemorragia intracraneal en comparación con warfarina. Entre pacientes con CrCle entre 25 y 50 mL/min, el tratamiento con apixabán y edoxabán se asoció con un significativo menor riesgo de eventos hemorrágicos en comparación con warfarina (Figura 2) [63]. Aunque estos resultados no indican necesariamente la superioridad de apixabán y edoxabán en relación con otros ACOD, puede ser útil para los clínicos cuando se trata de pacientes con un alto riesgo de hemorragia o bajo tiempo de rango terapéutico (TRT) mientras reciben warfarina u otros antagonistas de la vitamina K (AVK).
Enfermedad renal crónica estadios 4, 5 y 5D
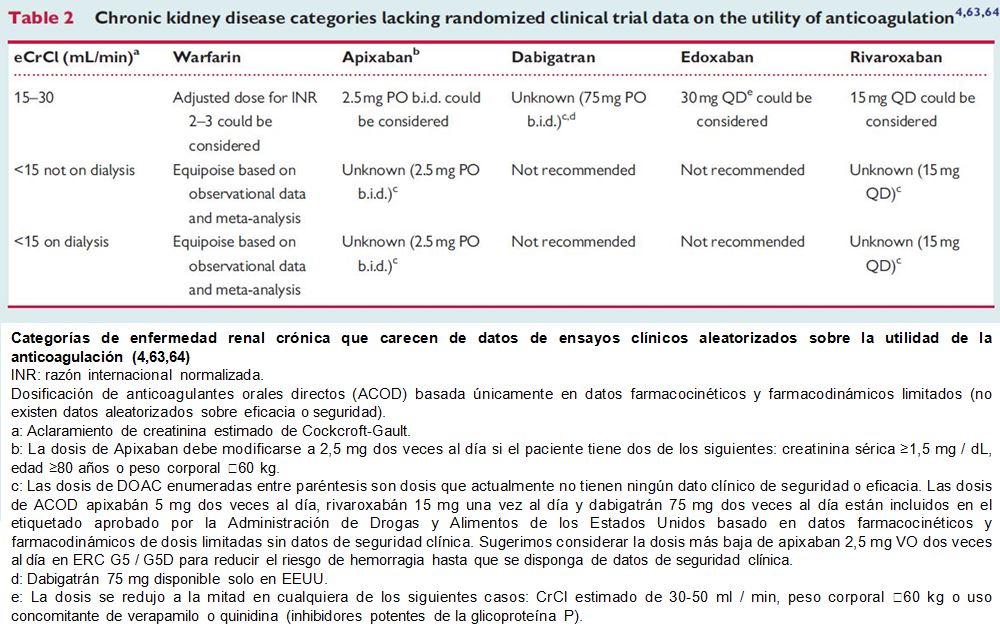
En ausencia de datos de ensayos clínicos, los resultados de los estudios observacionales sobre la eficacia y la seguridad de la anticoagulación para la prevención del ictus en pacientes con ERC con CrCle 75 %) probablemente contribuyó a estos hallazgos y ha sido difícil de replicar en estudios semejantes de otros sistemas de salud [68]. Un gran análisis del sistema sanitario de Estados Unidos encontró que la severidad de la ERC se asociaba con un TRT disminuido a pesar de una similar intensidad en la monitorización del INR [69]. Estos hallazgos sugieren que es más probable que el TRT sea bajo en la ERC y puede condicionar el aumento en el riesgo ictus y hemorragia en la ERC [70]. Asimismo, los AVK pueden condicionar hemorragias glomerulares subclínicas repetidas [71] o aceleración de las calcificaciones tisulares o vasculares [72]. La FDA aprobó recientemente la utilización de dosis de 5 mg de apixabán dos veces al día (con ajuste de dosis) y rivaroxabán a dosis de 15 mg diarios en pacientes con ERC estadios 5 y 5D, así como dabigatrán 75 mg por vía oral dos veces al día para CrCle entre 15-30 mL/min. Esto se basa en limitados datos farmacocinéticos y farmacodinámicos sin datos de seguridad clínica [73] [74] [75] [76]. Los participantes en la Conferencia de Controversias sugieren considerar la dosis más baja de apixabán de 2,5 mg por vía oral dos veces al día en pacientes con ERC estadios 5 y 5D para reducir el riesgo de hemorragia hasta que se encuentren disponibles datos de seguridad clínica, un enfoque respaldado por un reciente estudio farmacocinético que compara las dos dosis [77]. Debe tenerse presente que muchos pacientes con ERC probablemente se beneficiarían de todos modos de dicha reducción de dosis (aquellos con edad > 80 años o con un peso corporal > 60 Kg), obedeciendo al principio de -primum non nocere-, atendiendo a la falta de datos sobre eficacia y seguridad clínica (Tabla 2).
Los ensayos clínicos randomizados son particularmente necesarios para evaluar el uso de AVK en pacientes con ERC estadio 5D. Un ensayo clínico que evalúa los AVK versus no ACO está en curso (AVKDIAL, NCT02886962). No conocemos si los ACOD tienen ventajas frente a los ACO en pacientes con ERC estadio 5D con FA. Los estudios AXADIA (NCT02933697) y RENAL-AF (NCT02942407) que comparan apixabán frente a AVK en pacientes con ERCA están en periodo de reclutamiento en Alemania y Estados Unidos.
Consideraciones pragmáticas sobre la utilización de anticoagulación oral en la enfermedad renal crónica
En los estudios randomizados pivotales de los ACOD las dosis se ajustaron a la función renal utilizando el CrCle mediante la fórmula de Cockcroft-Gault. Sin embargo, en la práctica clínica, son utilizados otros métodos para evaluar la TFGe. Dada la diversidad de los diferentes métodos de estimación de la función renal, parece razonable individualizar la dosis de ACOD atendiendo a cada uno de estos métodos [78] [79] [80]. Importantes preocupaciones han surgido sobre la seguridad clínica, principalmente el incremento en complicaciones hemorrágicas fatales y no fatales, tras las primeras prescripciones de dabigatrán y rivaroxabán, fuera de indicación, en pacientes con ERC estadio 5D [81] [82] [83].
Es necesario establecer medidas centradas en la seguridad del paciente para guiar a los clínicos sobre la utilización de ACOD [85].
El trabajo multidisciplinar con comunicación activa entre nefrólogos, cardiólogos (o electrofisiólogos), médicos de atención primaria y, cuando sea posible, farmacólogos clínicos, puede ser útil para evaluar el riesgo-beneficio de cualquier decisión sobre la elección entre AVK o ACOD [5] [85].
Para los pacientes con ERC que reciben tratamiento con ACOD, se recomienda monitorizar periódicamente la función renal, porque la disminución de esta puede requerir el ajuste de la dosis [86]. No existen datos que nos indiquen la frecuencia óptima de monitorización de la función renal, pero puede ser clínicamente razonable evaluarla cada 6 a 12 meses (o al menos anualmente, atendiendo a las guías de las sociedades científicas) [5]. La frecuencia de dicha monitorización se adaptará al grado de ERC, a su curso y al tiempo transcurrido desde el inicio del tratamiento con ACOD. Para todos los pacientes diagnosticados de ERC en tratamiento anticoagulante, se debe reevaluar anualmente los objetivos del tratamiento, debatiéndose los pros y contras de la terapia.
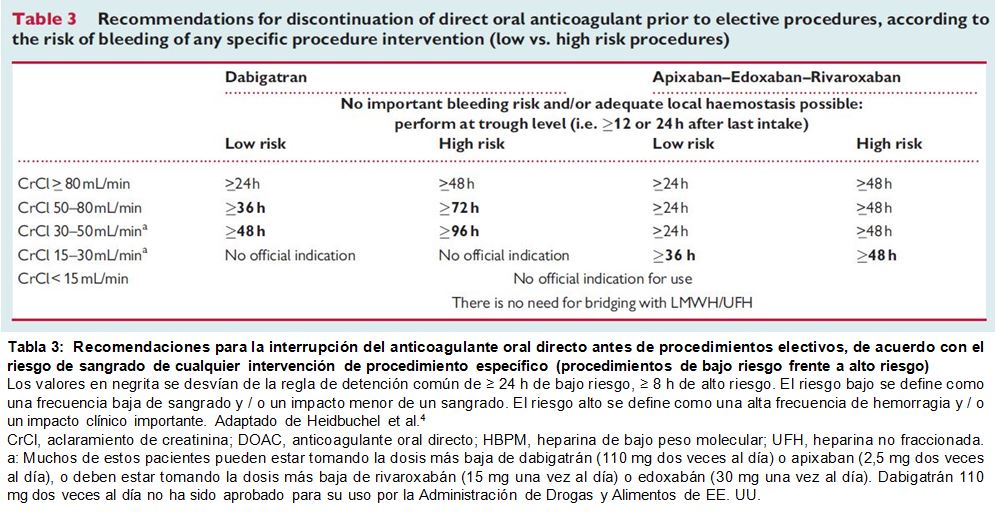
El manejo periprocedimiento o perioperatorio de los ACOD debe individualizarse atendiendo al fármaco y CrCle (Tabla 3) [4] [87]. Es necesario buscar estrategias que permitan reducir el riesgo de sangrado en pacientes con ERC estadio 5D tratados con anticoagulantes. En esta línea, se puede minimizar la heparina en diálisis, utilizar citrato para el sellado de los catéteres [88], considerar la profilaxis del sangrado gastrointestinal cuando esté indicada, debe implementarse un estricto control de la presión arterial y valorar la interrupción de agentes antiplaquetarios si es clínicamente razonable. Los protocolos de reversión de la anticoagulación están bien establecidos para la warfarina y para los AVK. Idarucizumab ha sido aprobado para revertir el dabigatrán, y andexanet alfa ha sido desarrollado para revertir los agentes anti-Xa. Sin embargo, debemos conocer que los datos específicos son escasos en pacientes con ERC [89].
Tratamiento antiagregante para la prevención del ictus por fibrilación auricular en la enfermedad renal crónica
El ensayo AVERROES de aspirina vs apixabán, desarrollado en población general, en su mayoría sin ERC, fue interrumpido precozmente debido a un mayor riesgo de accidente cerebrovascular con aspirina, pero con riesgo de hemorragia similar en ambos grupos [90]. Sin embargo, no existen suficientes evidencias para recomendar un antiagregante plaquetario simple o doble terapia para la prevención del ictus / tromboembolismo en la FA entre pacientes con ERC estadios 4, 5 o 5D, incluso cuando la ACO se considera peligrosa. Del mismo modo, estos pacientes no deberían recibir terapia antiplaquetaria mientras toman anticoagulantes, a menos que haya una indicación secundaria (p. ej., la implantación reciente de un stent coronario). La duración de la terapia antiplaquetaria concomitante, simple o doble, en aquellos pacientes que reciben anticoagulantes debe minimizarse e individualizarse en función de factores clínicos y tipo de stent [91].
Oclusión de la orejuela izquierda en la enfermedad renal crónica
Se cree que la orejuela auricular izquierda (OAI) es el lugar de formación de trombos para la mayoría de los ictus relacionados con la FA. La exclusión de la circulación de la OAI mediante un dispositivo no farmacológico para la prevención del ictus podría ser posiblemente una opción a valorar en situaciones de riesgo moderado a alto en la ERC, particularmente en aquellos pacientes con contraindicaciones a largo plazo para ACO. Los resultados de dos ensayos aleatorizados a cinco años utilizando el dispositivo de oclusión Watchman® demostraron una reducción en el riesgo de accidente cerebrovascular comparable a warfarina pero con reducción adicional de episodios hemorrágicos graves [92]. Sin embargo, la prevalencia o gravedad de la ERC no fue reportada y podría haber sido infrarrepresentada. La mayoría de los pacientes que reciben el dispositivo en ensayos clínicos y en la práctica continúan en terapia doble o única, asociada con un mayor riesgo de hemorragia en la ERC. Asimismo, los pacientes enrolados no presentaban contraindicaciones. El registro de datos del Amplatzer Cardiac Plug, un dispositivo similar, ha mostrado resultados de seguridad comparables en pacientes con ERC versus aquellos con función renal normal [93]. Un ensayo aleatorizado de oclusión de OAI versus tratamiento con AVK en pacientes con ERC estadios 4 y 5 está en la actualidad en curso (https://clinicaltrials.gov/ct2/show/NCT02039167; 13 de febrero de 2018).
Control de frecuencia versus control del ritmo de la fibrilación auricular
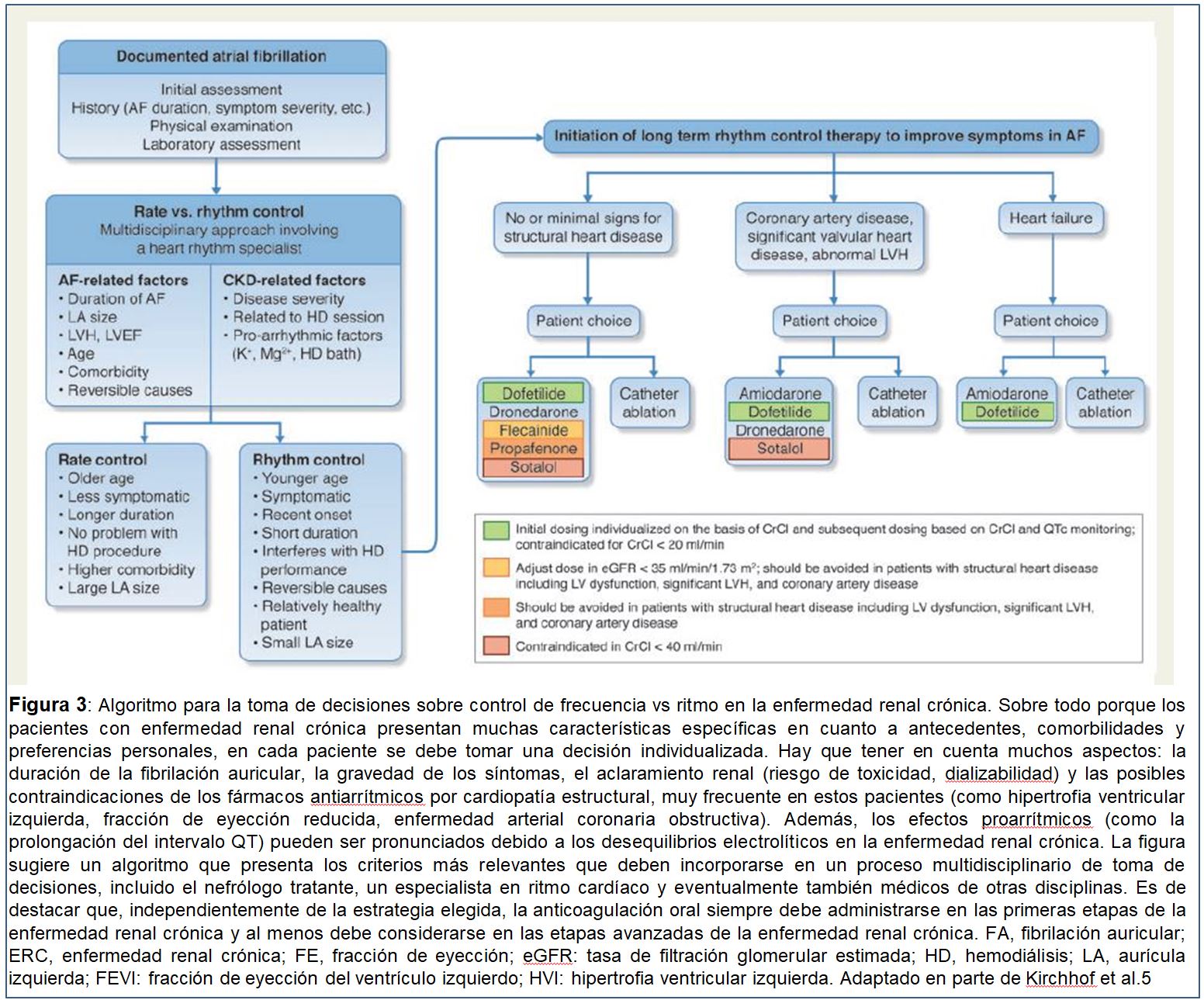
Las indicaciones para la estrategia de control del ritmo en la ERC reflejan las de la población general. La principal indicación basada en la evidencia para una estrategia de control del ritmo para la FA es la reducción de los síntomas, aunque muchos pacientes son asintomáticos [5] [49]. Los estudios randomizados más antiguos han demostrado que las estrategias de control de frecuencia y ritmo son equivalentes en relación a sus efectos sobre los riesgos de insuficiencia cardíaca, accidente cerebrovascular y supervivencia [94] [95] [96] [97]. Los análisis retrospectivos han sugerido que el control del ritmo mediante la ablación proporciona resultados superiores, pero la evidencia es limitada. Independientemente de la estrategia que se siga, la anticoagulación debería ser también continuada atendiendo al riesgo de ictus (como lo indican los índices el CHADS2 o CHA2DS2-VASc), a menos que esté contraindicado por otro motivo. Los factores adicionales que pueden favorecer los intentos de control del ritmo incluyen dificultad para lograr un control de frecuencia adecuado, pacientes jóvenes, miocardiopatía mediada por taquicardia, primer episodio de FA, FA que se precipita por una enfermedad o cirugía aguda, y la preferencia del paciente (Figura 3) [5] [49]. Los pacientes en hemodiálisis con inestabilidad hemodinámica debido a la FA durante las sesiones de diálisis pueden beneficiarse del control del ritmo. El impacto de su tratamiento sobre el pronóstico es desconocido [98]. En pacientes sin indicaciones claras para una estrategia de control del ritmo debería utilizarse, por defecto,una estrategia de control de frecuencia. En la población general, en pacientes con FA permanente y fracción de eyección preservada, un control de frecuencia no estricto (es decir, una frecuencia cardíaca en reposo < 110 latidos por minuto) se ha demostrado ser equivalente a un control estricto para un objetivo combinado que incluya accidente cerebrovascular, insuficiencia cardíaca, muerte y necesidad de marcapasos o desfibrilador implantable (ICD) [99]. Ningún estudio randomizado controlado ha comparado específicamente el control de frecuencia vs control de ritmo o control de frecuencia estricto vs lábil en pacientes con ERC o ERCA. En un análisis post hoc del ensayo GUSTO III, donde se analizaba control de ritmo vs frecuencia, la estrategia de control no tuvo un impacto significativo en la mortalidad a corto o largo plazo, independientemente del estadio de la enfermedad renal [100].
Consideraciones sobre el control de frecuencia
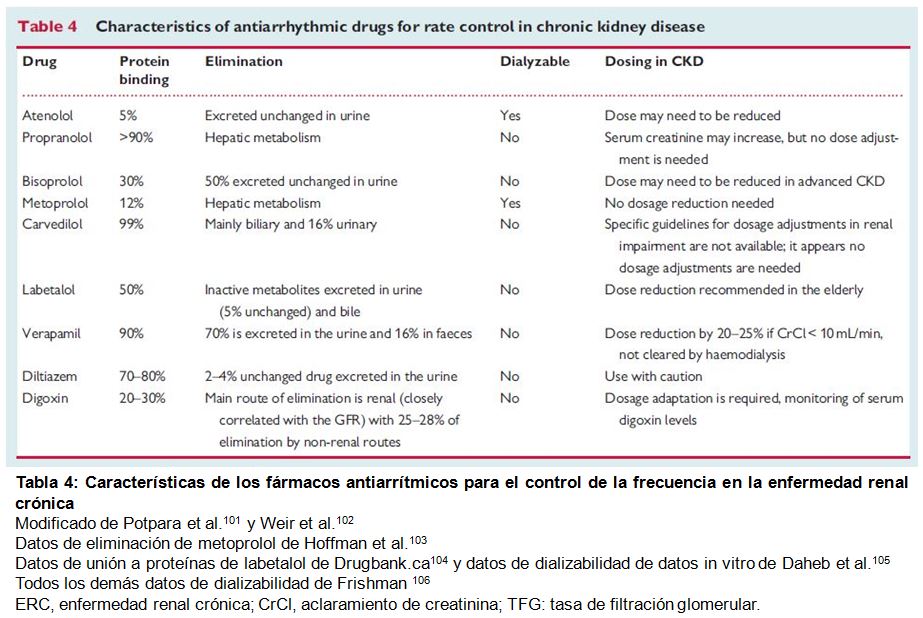
Deben señalarse algunas consideraciones especiales en la ERC, incluyendo la sintomatología y una propensión potencialmente mayor a desarrollar cardiomiopatía mediada por taquicardia, dada la elevada prevalencia de alteraciones estructurales cardiacas. Además, la farmacocinética y la dializabilidad de los fármacos indicados para el control de la frecuencia en la ERC debe ser tenido en cuenta (Tabla 4). Cuando la frecuencia ventricular no puede controlarse solo con terapias médicas, debe valorarse la ablación del nodo auriculoventricular y la implantación de marcapasos. Sin embargo, la alta tasa de complicaciones de los dispositivos transvenosos en los pacientes en hemodiálisis debe valorarse a la hora de tomar la decisión. Si los marcapasos sin cables pudieran jugar un rol en esta situación debe ser todavía determinado.
Consideraciones sobre el control del ritmo
La cardioversión eléctrica (CVE) es el método más utilizado para la restauración del ritmo en pacientes con FA persistente. Se ha evidenciado que la tasa de éxito de la CVE es similar independientemente de la función renal [108]. Sin embargo, el riesgo de recurrencia de FA aumenta a medida que la TFGe disminuye, aunque pacientes con ERC leve-moderada, en quienes se mantiene el ritmo sinusal, pueden experimentar una mejoría de la función renal [109]. La CVE por si sola es generalmente insuficiente para mantener el ritmo sinusal normal y habitualmente es necesario a largo plazo mantener tratamiento antiarrítmico o la ablación para el control del ritmo.
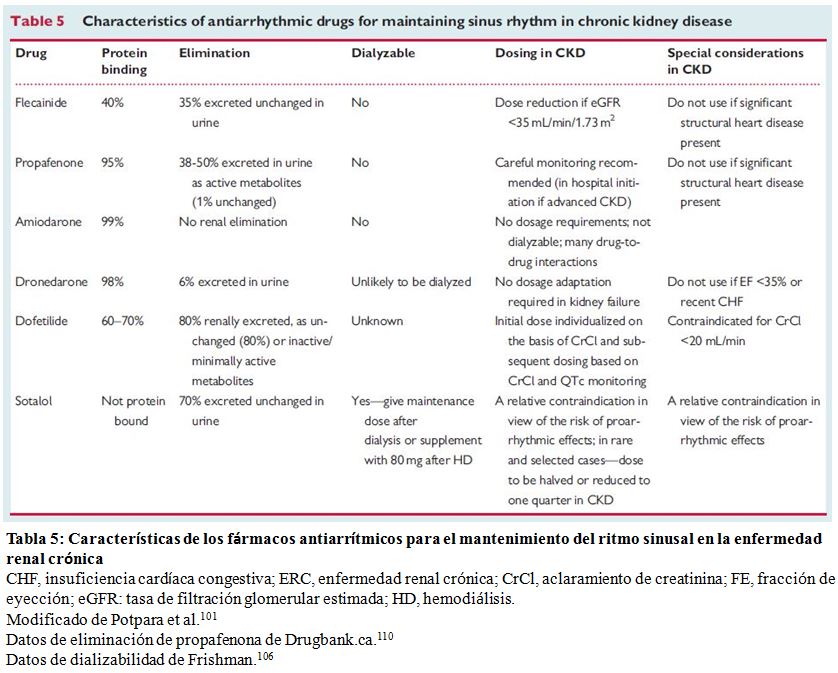
La utilización de fármacos antiarrítmicos para el control del ritmo se encuentra limitado en pacientes con ERC debido a la disminución del aclaramiento renal y el riesgo proarrítmico en individuos con cardiopatía estructural (Tabla 5). No se han evidenciado efectos negativos en la supervivencia con la amiodarona, el fármaco antiarrítmico más comúnmente utilizado para tratar la FA, independientemente de la TFGe, incluso en pacientes con ERCA [111]. Si los pacientes con ERC tratados con amiodarona tienen un mayor riesgo de toxicidad tisular se desconoce.
La ablación con catéter es más efectiva por si sola que las drogas antiarrítmicas para el mantenimiento del ritmo sinusal. La seguridad y eficacia de la ablación en la ERC se evaluó en 21.091 ablaciones, en las cuales 1.593 casos (7,6 %) tenían ERC y 60 estaban en diálisis [112]. Entre los pacientes seleccionados para la ablación, aquellos con y sin ERC tuvieron tasas similares de complicaciones posteriores al procedimiento y posterior hospitalización por FA, CVE y ablación repetida, aunque los pacientes con ERC fueron más frecuentemente reingresados por insuficiencia cardíaca. Un metaanálisis de cuatro estudios de ablación de venas pulmonares por radiofrecuencia en pacientes con ERC mostró un riesgo casi dos veces mayor de recurrencia de la FA, posiblemente como resultado de los mayores volúmenes auriculares izquierdos preablación, lo cual podría servir como un marcador de desencadenantes no dependientes de venas pulmonares [113]. En un estudio de pacientes con ERC sometidos a ablación por criobalón, los pacientes con ERC estadio 3 tuvieron tasas significativamente más altas de recurrencia de FA en comparación con aquellos con ERC estadio 1 y 2 [114]. No se describieron casos de nefrotoxicidad por contraste. En general, mantenimiento del ritmo sinusal a través de la ablación se asocia con una mejoría de la TFGe, mientras que el fracaso del procedimiento se relaciona con deterioro de la TFGe [115].
La ablación de la FA puede proporcionar beneficios de supervivencia en el escenario de pacientes con fracción de eyección ventricular izquierda (FEVI) reducida e insuficiencia cardiaca. Un estudio randomizado de ablación con catéter en comparación con el tratamiento estándar en FA y FEVI < 35 %, demostró recientemente una mejoría en la supervivencia asociada con la ablación [116] [117] (https://clinicaltrials.gov/ct2/show / NCT00643188; 13 de febrero de 2018).
En contraste con la FA, la ablación por radiofrecuencia para el control del ritmo en el flutter auricular debe considerarse como terapia de primera línea en la ERC, dado el alto éxito y las bajas tasas de complicaciones de la ablación. Los pacientes con ERC tienen un mayor riesgo a largo plazo de FA después de la ablación del flutter auricular y podrían requerir monitorización a largo plazo para evaluar las recurrencias de FA, especialmente si se considera la retirada de la anticoagulación [118].
Modificaciones del estilo de vida
La pérdida de peso y el ejercicio pueden reducir el riesgo de FA en la población general [119] [120], al igual que el tratamiento para la apnea obstructiva del sueño [121] [122]. Los pacientes en hemodiálisis tienen cuatro veces más riesgo de trastornos respiratorios del sueño en comparación con los pacientes control macheados por edad, sexo, raza e índice de masa corporal [123] [124]. Sin embargo, en un estudio de pacientes mayores en los Estados Unidos, estos trastornos no fueron asociados con FA en la población en hemodiálisis [125].
Prevención de la muerte súbita cardiaca
Incidencia y etiología de la muerte súbita cardiaca en la población con enfermedad renal crónica y en la enfermedad renal crónica avanzada
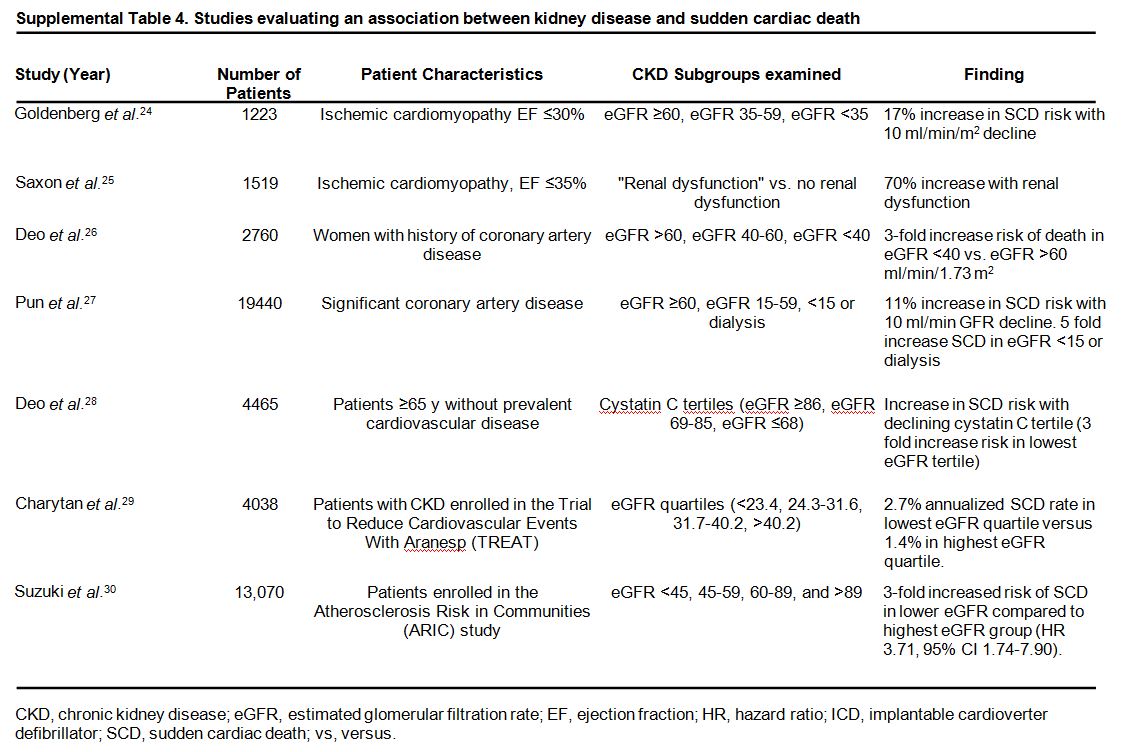
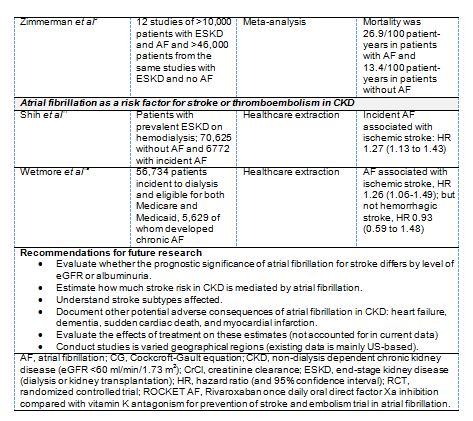
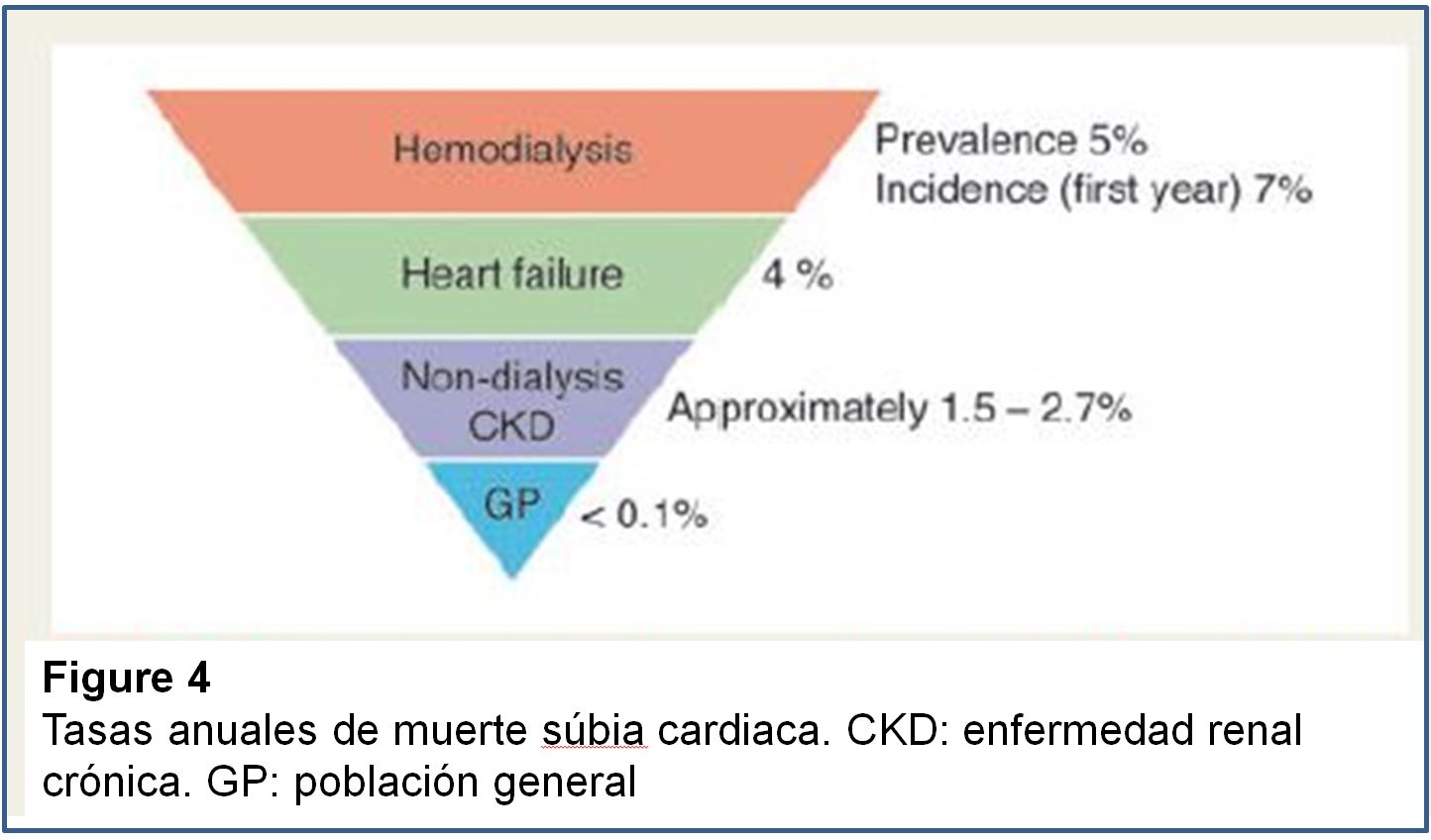
Existe un mayor riesgo de MSC en la ERC (Material complementario online, Tabla S4) (Tabla 11) [126] [127] [128] [129] [130] [131] [132]. La MSC representa el 25-29 % de todas las causas de muerte en pacientes en hemodiálisis y alrededor del 30-35 % en pacientes incidentes en diálisis [133] [134] [135] [136] [137] [138] [139]. Recientes datos indican que, aunque las tasas de mortalidad de cualquier causa en población en hemodiálisis han ido disminuyendo, las de MSC siguen siendo las mismas, indicativas de un aumento de la proporción de pacientes que mueren a causa de esta patología [140]. El riesgo de muerte de cualquier causa es sustancialmente mayor en diálisis (15-20% a 1 año) que en pacientes con insuficiencia cardíaca o post-infarto (3-8% al año) [140] [141] [142] [143]. El riesgo anual de MSC es mayor en la población de hemodiálisis en comparación con otras poblaciones (Figura 4): 5-7 % en pacientes en hemodiálisis; 4 % en pacientes con insuficiencia cardíaca; y 1,5-2,7 % en pacientes con ERC sin diálisis, comparable con la de pacientes post-infarto [126] [132] [136] [140] [142] [143] [144]. Se debe alentar a los nefrólogos para debatir los riesgos y posibles opciones terapéuticas en estos pacientes, animando a su participación en los ensayos clínicos.
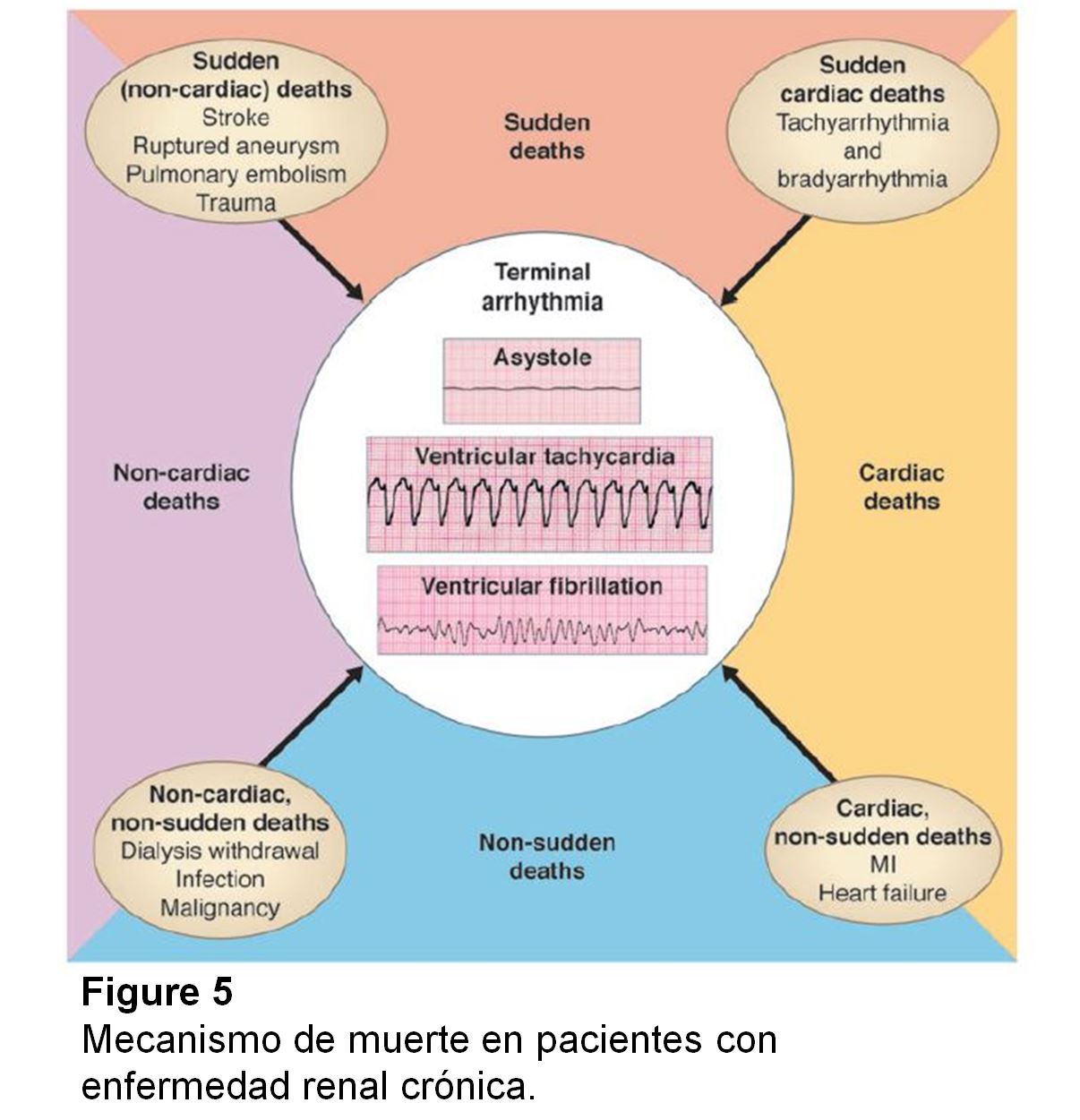
Existen significativas lagunas de conocimiento en la comprensión de los mecanismos eléctricos y hemodinámicos subyacentes a la MSC (Figura 5). En un estudio retrospectivo de pacientes en hemodiálisis a quienes fue implantado un desfibrilador, el 80 % de los paros cardíacos se registraron como taquiarritmias ventriculares (taquicardia ventricular o fibrilación ventricular) en comparación con un 20 % de bradiarritmias [145]. En un reciente estudio de monitorización electrocardiográfica continua, las bradiarritmias y la asistolia, en lugar de taquiarritmias ventriculares, fueron los principales determinantes de MSC en pacientes con ERCA [146].
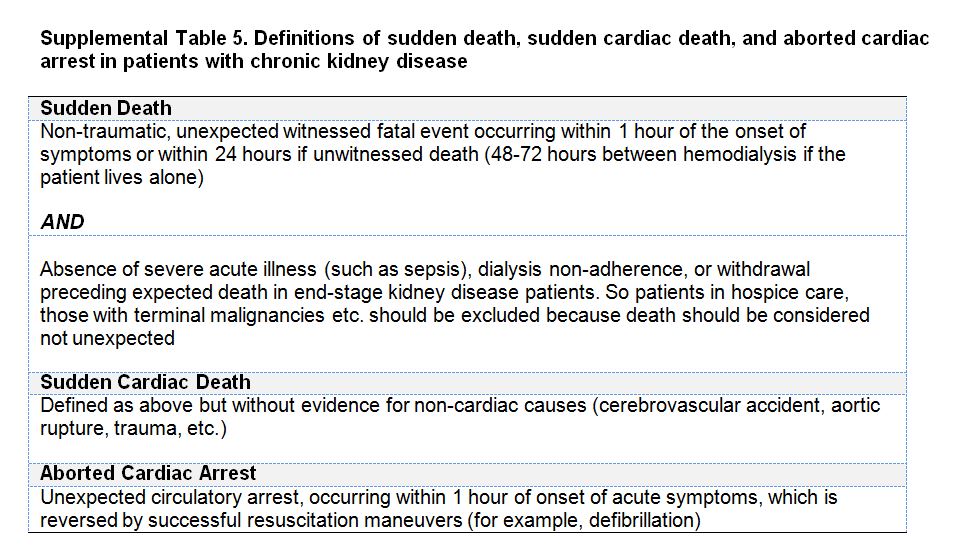
Las definiciones de muerte súbita y MSC en pacientes con ERCA deben ser afinadas. La naturaleza inesperada de la muerte súbita debe ser enfatizada para evitar clasificaciones erróneas (Material complementario online, Tabla S5) (Tabla 12) propone definiciones pertinentes de muerte súbita, MSC y paro cardiaco recuperado para pacientes con ERCA.
Factores de riesgo de muerte súbita cardíaca en pacientes con enfermedad renal crónica y en enfermedad renal crónica avanzada
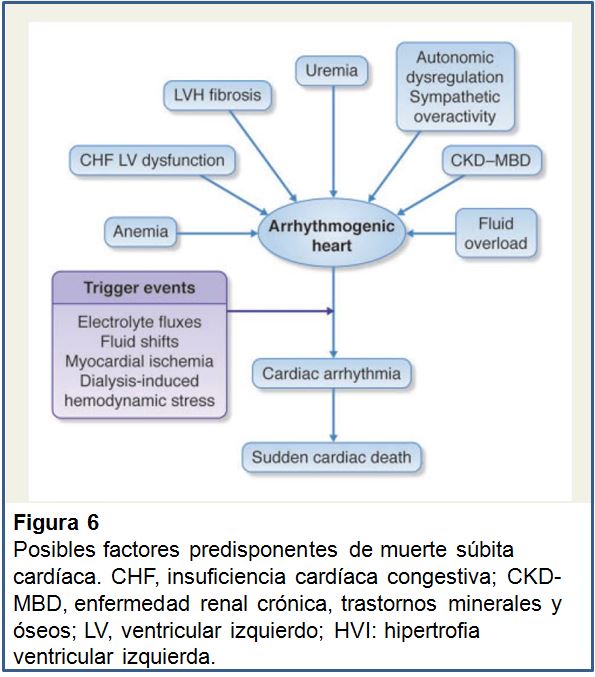
Los mecanismos de la MSC en la ERC y en la ERCA incluyen anomalías fisiopatológicas de larga evolución que predisponen a condiciones arritmogénicas, así como mecanismos desencadenantes que pueden precipitar episodios arrítmicos (Figura 6). El papel de la isquemia miocárdica, los electrolitos, los cambios de volumen con inestabilidad hemodinámica, la hipertrofia ventricular izquierda, la fibrosis y disfunción miocárdica, así como la desregulación autonómica e hiperactividad simpática pueden conducir a la MSC y necesitarán ser más profundamente evaluadas.
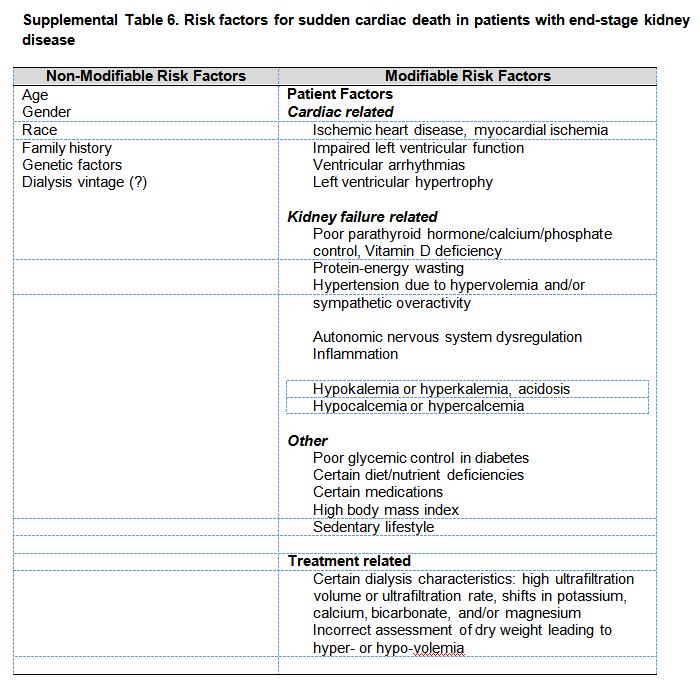
Se han identificado diversos factores de riesgo que predisponen a la MSC en pacientes con ERCA (Material complementario online, Tabla S6) (Tabla 13) y generalmente sus interacciones contribuyen a la MSC [136] [147]. Son necesarios futuros estudios para identificar los factores de riesgo específicos de MSC7. Dado que es difícil identificar factores de riesgo específicos de MSC en pacientes sin ERCA, se deberían tener en cuenta los factores de riesgo específicos de muerte cardiaca para evaluar intervenciones preventivas en pacientes con ERCA [148]. El principal enfoque debería centrarse en los factores de riesgo modificables como objetivos de la intervención (Material complementario online, cuadro S6) (Tabla 13) [147].
El papel de los biomarcadores modificables (definidos como pruebas de laboratorio que son medibles en sangre, orina o saliva) ha sido investigado en la estratificación del riesgo en la ERC y ERCA, siendo necesarios más estudios [149]. Las troponinas y los péptidos natriuréticos cerebrales podrían tener un valor aditivo y debe explorarse más a fondo su papel en una evaluación de riesgos para la MSC [150] [151] [152] [153]. Existen muy pocos datos sobre la trascendencia pronóstica de las arritmias asintomáticas detectadas incidentalmente en la ERC y ERCA. La identificación de episodios de taquicardia ventricular no sostenida, extrasístoles ventriculares complejos frecuentes, bradiarritmias y pausas puede ser útil para identificar pacientes con riesgo de MSC [154]. Existen estudios en curso y planificados con dispositivos de monitorización electrocardiográfica continua (dispositivos implantables o parches externos de monitorización utilizados durante días o semanas) que proporcionarán datos sobre la incidencia y la importancia pronóstica de estas arritmias.
El síncope es otro importante y no infrecuente evento observado en pacientes con ERC y ERCA, pero su trascendencia pronóstica es incierta [155]. La pérdida transitoria de la conciencia debido a hipovolemia o hipotensión debe clasificarse como síncope y considerarse como tal para pronóstico y tratamiento.
El papel de los desfibriladores en la prevención primaria y secundaria de la muerte súbita cardíaca en la enfermedad renal crónica avanzada
Los datos sobre la prevención secundaria de la terapia con desfibriladores implantables (ICD) indica algunos beneficios, pero se necesitan más estudios para evaluar el balance riesgo-beneficio a largo plazo referido a la mortalidad [7] [156] [157]. La prevención primaria con ICD está indicada en pacientes con FEVI < 35 %, aunque los datos relativos a su beneficio en pacientes con ERCA no son alentadores [158] con alto riesgo de complicaciones. Los pacientes con FEVI 35 %. Los datos disponibles parecen sugerir que el beneficio de los ICD disminuye con la reducción de la TFGe, en relación con un alto riesgo de complicaciones, tal y como se comentó anteriormente [129] [161]. Estudios con desfibriladores subcutáneos, que carecen de hardware transvenoso, son necesarios ya que podrían asociarse con una menor incidencia de complicaciones y menor gravedad de las mismas, como las infecciones [162]. Los desfibriladores portátiles pueden proporcionar protección por un período limitado de tiempo de alto riesgo [145]. Son necesarias evaluaciones adicionales de los dispositivos indicados para bradiarritmias (incluidos marcapasos sin cables) [146].
Homeostasis del potasio y su manejo en la enfermedad renal crónica y en diálisis
Alteraciones electrolíticas y riesgo de eventos cardiovasculares o arrítmicos
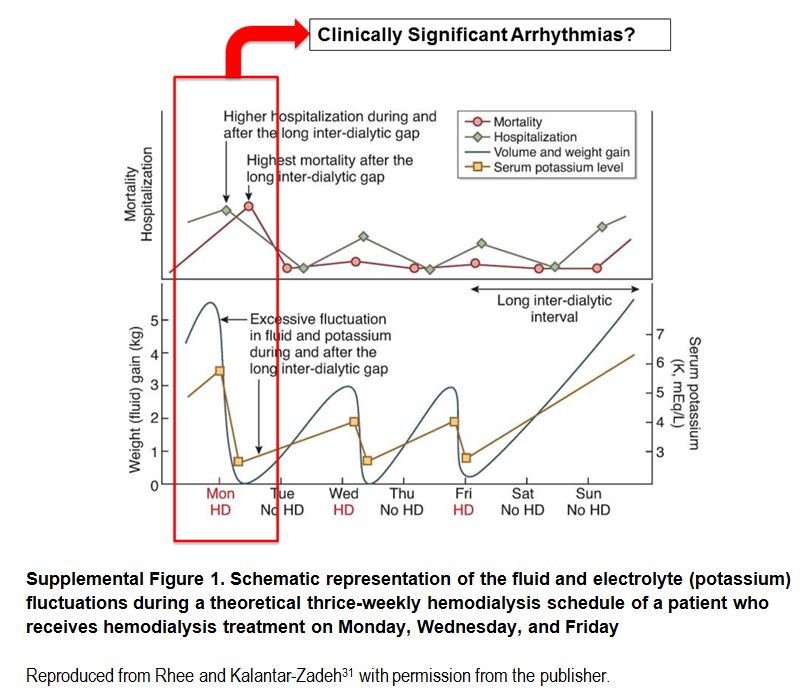
Aunque falta una evidencia definitiva de causalidad, tanto la hiperkalemia como la hipokalemia se han asociado con un mayor riesgo de mortalidad de cualquier causa y de origen cardiovascular en pacientes con ERCA. En pacientes en hemodiálisis, cuando los valores de potasio sérico prediálisis (es decir, valores de potasio al inicio del procedimiento de hemodiálisis, de acuerdo con la práctica clínica) suben o bajan de 5 mEq/L, el riesgo de MSC aumenta [147]. Entre los pacientes incidentes en hemodiálisis, se han documentado tasas más altas de mortalidad y hospitalización inmediatamente después del periodo largo interdiálisis [163] [164]. Un factor que contribuye a ello puede ser la mayor sobrecarga de volumen seguida de un exceso ultrafiltración y fluctuaciones bruscas en las concentraciones de potasio sérico (Material complementario online, Figura S1) (Figura 7) [165]. En contraste, la hipokalemia es más común en pacientes en diálisis peritoneal, asociándose con un mayor riesgo de muerte de cualquier causa, mortalidad cardiovascular e infecciosa en este subgrupo de pacientes [166].
Opciones de tratamiento para mejorar la homeostasis de potasio
Los tratamientos de la hiperkalemia incluyen restricción dietética, corrección de la acidosis, aumento de la carga distal de sodio y diuréticos de asa. Por su parte, en el caso de la hipokalemia se podrían utilizar diuréticos ahorradores de potasio y suplementos de potasio [167]. Puede ser posible reducir la dosis o suspender los medicamentos que interfieren con la homeostasis del potasio, como los antiinflamatorios no esteroideos, sulfametoxazol-trimetoprim, inhibidores de la calcineurina y betabloqueantes no selectivos. Tratamientos farmacológicos para controlar la hiperkalemia incluyen las resinas de intercambio catiónico, como kayaexalato [168] y resincalcio [169]; la unión de potasio al patiromer [170]; y el ZS-9 (ciclosilicato de zirconio) [167]. Más allá del tratamiento de la hiperkalemia, estos agentes también podrían permitir utilizar en pacientes con ERC concomitantemente bloqueantes del sistema renina-angiotensina-aldosterona (BSRAA), posibilidad que se está estudiando en la actualidad [167]. Asimismo, el patiromer, además de reducir el potasio sérico, se ha demostrado que reduce los niveles séricos de aldosterona en pacientes con ERC e hiperkalemia que toman BSRAA [171]. Otras preguntas importantes sobre los quelantes de potasio se relacionan con su seguridad y eficacia en pacientes trasplantados, pacientes con acidosis tubular renal tipo IV o pacientes que toman inhibidores de la calcineurina.
Los datos de tres ensayos clínicos han indicado que el bloqueo dual del sistema renina-angiotensina-aldosterona aumenta el riesgo de hiperkalemia en pacientes con ERC [172] [173] [174]. Datos de metaanálisis han señalado que los mineralocorticoides pueden mediar la hiperpotasemia en pacientes sometidos a diálisis, pero son necesarios grandes ensayos para una mejor evaluación de este hecho y su significado clínico [175]. En pacientes con diabetes tipo 2, los inhibidores del cotransportador sodio-glucosa tipo 2 (I-SGLT2) se han asociado con pequeños cambios electrolíticos y menor hiperkalemia en comparación con placebo, especialmente en pacientes que toman antihipertensivos que pueden interferir con la excreción de potasio [176].
Dializado y parámetros de diálisis
Para los pacientes sometidos a hemodiálisis, tanto la concentración de potasio en el dializado como la programación semanal de la hemodiálisis se han relacionado con el riesgo de muerte súbita (Figura 6). Posibles factores de confusión, como la nutrición, el cumplimiento del tratamiento y las comorbilidades, no han sido completamente evaluados. Tampoco está claro si la presión venosa central, la hipervolemia e hipertensión pulmonar pueden predisponer a los pacientes a eventos arrítmicos. Tres estudios han señalado que concentraciones bajas de potasio en el baño de diálisis (5 mEq/L, los riesgos asociados con concentraciones bajas de potasio en el dializado no han sido estadísticamente significativas. En el estudio DOPPS, las tasas de mortalidad fueron similares entre los pacientes a los que se prescribieron 2 y 3 mEq / L de potasio en el dializado [179]. La rápida corrección rápida de la acidemia, concentraciones bajas de calcio en suero o en el dializado, y las altas tasas de ultrafiltración pueden contribuir al potencial arritmogénico del dializado bajo en potasio [147] [180]. En un estudio de 50 pacientes sometidos a diálisis tres veces por semana, el riesgo de MSC y el riesgo significativo de arritmias fueron mayores durante los descansos interdiálisis de 72 h frente a 48 h. No hubo análisis específicamente relacionados con los niveles de potasio en estos estudios [146]. Si reducir el intervalo entre las sesiones de hemodiálisis pudiera dar lugar a reducciones clínicamente significativas en los episodios de paro cardiaco y su relación con los niveles de potasio no está aclarado y justifica estudios futuros. Las concentraciones en el dializado de bicarbonato, calcio, magnesio y el ácido glutámico también son probablemente relevantes en el riesgo de eventos arrítmicos. Es posible que la individualización de los parámetros de diálisis pudiera reducir el riesgo de MSC, pero ello no está demostrado y sería logísticamente difícil de implementar en la práctica clínica.
Control de líquidos durante la diálisis
Se ha asociado las tasas de ultrafiltración superiores a 10 mL/h/kg con una mayor probabilidad de hipotensión intradiálisis y riesgo de mortalidad [181]. El estrés hemodinámico durante la diálisis induce aturdimiento cardíaco, que con el tiempo puede progresar hacia el desarrollo de alteraciones permanentes en la función sistólica, con hibernación miocárdica y fibrosis [182]. Un análisis retrospectivo ha indicado que un mayor aumento de peso interdiálisis está asociado con un mayor riesgo de eventos cardiovasculares [183]; por lo tanto, deben estudiarse aquellas estrategias que mitiguen el aumento de peso interdiálisis.
Conclusión
Las personas con ERC tienen un mayor riesgo de FA en relación con aquellas sin ERC y un riesgo elevado de accidentes cerebrovasculares. Para prevenir los ictus en pacientes con CrCle 30-50 mL/min, los ACOD han demostrado no ser inferiores a la warfarina y tener un perfil de seguridad más favorable. Para pacientes con ERC estadio 5D con FA, no hay datos clínicos suficientes de eficacia y seguridad para recomendar rutinariamente el tratamiento con AVK en la prevención del ictus.
La evidencia de los más antiguos ensayos clínicos randomizados indica que las estrategias farmacológicas de control de ritmo y frecuencia son equivalentes en términos de eficacia, referente al riesgo de insuficiencia cardíaca, ictus y supervivencia. Sin embargo, la ablación con catéter, que es superior al tratamiento farmacológico antiarrítmico para evitar la recurrencia de FA, tiene una seguridad comparable en la población con ERC y sin ERC. El papel de la ablación en la FA puede continuar evolucionando, particularmente en otras condiciones comórbidas como la insuficiencia cardíaca. Independientemente de si se aplica una estrategia de control de ritmo o frecuencia, la anticoagulación también debe prescribirse, atendiendo al riesgo de ictus, a menos que esté contraindicada.
El riesgo de MSC aumenta en pacientes con ERC y para aquellos con ERCA en diálisis, habiendo sido identificados varios factores que aumentan su riesgo. Son necesarios más estudios para identificar los factores de riesgo de MSC en pacientes con ERC no sometidos a diálisis. Para prevenir la MSC en la ERCA, la implantación de ICD en prevención primaria está indicada en pacientes con FEVI < 35 %, aunque los datos sobre sus beneficios en estos pacientes no son alentadores. En prevención secundaria, los datos de referentes a los ICD indica algunos beneficios, pero son necesarios más estudios para evaluar la relación riesgo-beneficio a largo plazo en estos pacientes. Los datos disponibles parecen sugerir que el beneficio de esta terapia se reduce con la disminución de la TFGe.
Para pacientes sometidos a hemodiálisis, tanto la concentración de potasio en el dializado como el esquema temporal semanal de las sesiones de hemodiálisis afecta el riesgo de muerte súbita. Si el acortamiento del periodo interdiálisis puede resultar clínicamente significativo en la reducción del riesgo de MSC aún no están claro, siendo precisos futuros estudios. Es posible que la individualización de los parámetros de diálisis pudiera reducir el riesgo de MSC, pero esto no se ha probado y sería logísticamente muy dificultoso de implementar.
Recientes guías clínicas incluyen detalles prácticos y científicos sobre el manejo de estas arritmias en la ERC [3] [4] [5] [6] [7] [85] [184]. Sin embargo, quedan evidentes lagunas de evidencia, que requerirán ensayos clínicos y, cuando no sea posible, potentes estudios observacionales. Hemos esbozado recomendaciones con la esperanza que futuras investigaciones pueden mejorar la base de evidencia en esta área (Tabla 6). Un enfoque multidisciplinar es vital para comprender los mecanismos de las arritmias en la ERC, así como para evaluar tratamientos y mejorar la atención clínica. Nefrólogos y cardiólogos deben iniciar y proseguir conjuntamente el diseño y la realización de ensayos clínicos, así como el tratamiento individual de pacientes con ERC y FA.
MATERIAL SUPLEMENTARIO
El material suplementario está disponible online en European Heart Journal.
Referencias Suplementarias
1. Baber U, Howard VJ, Halperin JL, Soliman EZ, Zhang X, McClellan W, Warnock DG, Muntner P. Association of chronic kidney disease with atrial fibrillation among adults in the United States: REasons for Geographic and Racial Differences in Stroke (REGARDS) Study. Circ Arrhythm Electrophysiol 2011;4(1):26-32.
2. McManus DD, Corteville DC, Shlipak MG, Whooley MA, Ix JH. Relation of kidney function and albuminuria with atrial fibrillation (from the Heart and Soul Study). Am J Cardiol 2009;104(11):1551-5.
3. Soliman EZ, Prineas RJ, Go AS, Xie D, Lash JP, Rahman M, Ojo A, Teal VL, Jensvold NG, Robinson NL, Dries DL, Bazzano L, Mohler ER, Wright JT, Feldman HI, Chronic Renal Insufficiency Cohort Study G. Chronic kidney disease and prevalent atrial fibrillation: the Chronic Renal Insufficiency Cohort (CRIC). Am Heart J 2010;159(6):1102-7.
4. Ananthapanyasut W, Napan S, Rudolph EH, Harindhanavudhi T, Ayash H, Guglielmi KE, Lerma EV. Prevalence of atrial fibrillation and its predictors in nondialysis patients with chronic kidney disease. Clin J Am Soc Nephrol 2010;5(2):173-81.
5. Zimmerman D, Sood MM, Rigatto C, Holden RM, Hiremath S, Clase CM. Systematic review and meta-analysis of incidence, prevalence and outcomes of atrial fibrillation in patients on dialysis. Nephrol Dial Transplant 2012;27(10):3816-22.
6. Wetmore JB, Mahnken JD, Rigler SK, Ellerbeck EF, Mukhopadhyay P, Spertus JA, Hou Q, Shireman TI. The prevalence of and factors associated with chronic atrial fibrillation in Medicare/Medicaid-eligible dialysis patients. Kidney Int 2012;81(5):469-76.
7. Konigsbrugge O, Posch F, Antlanger M, Kovarik J, Klauser-Braun R, Kletzmayr J, Schmaldienst S, Auinger M, Zuntner G, Lorenz M, Grilz E, Stampfel G, Steiner S, Pabinger I, Saemann M, Ay C. Prevalence of Atrial Fibrillation and Antithrombotic Therapy in Hemodialysis Patients: Cross-Sectional Results of the Vienna InVestigation of AtriaL Fibrillation and Thromboembolism in Patients on HemoDIalysis (VIVALDI). PLoS One 2017;12(1):e0169400.
8. Shang W, Li L, Huang S, Zeng R, Huang L, Ge S, Xu G. Chronic Kidney Disease and the Risk of New-Onset Atrial Fibrillation: A Meta-Analysis of Prospective Cohort Studies. PLoS One 2016;11(5):e0155581.
9. Sinner MF, Stepas KA, Moser CB, Krijthe BP, Aspelund T, Sotoodehnia N, Fontes JD, Janssens AC, Kronmal RA, Magnani JW, Witteman JC, Chamberlain AM, Lubitz SA, Schnabel RB, Vasan RS, Wang TJ, Agarwal SK, McManus DD, Franco OH, Yin X, Larson MG, Burke GL, Launer LJ, Hofman A, Levy D, Gottdiener JS, Kaab S, Couper D, Harris TB, Astor BC, Ballantyne CM, Hoogeveen RC, Arai AE, Soliman EZ, Ellinor PT, Stricker BH, Gudnason V, Heckbert SR, Pencina MJ, Benjamin EJ, Alonso A. B-type natriuretic peptide and C-reactive protein in the prediction of atrial fibrillation risk: the CHARGE-AF Consortium of community-based cohort studies. Europace 2014;16(10):1426-33.
10. Sandhu RK, Kurth T, Conen D, Cook NR, Ridker PM, Albert CM. Relation of renal function to risk for incident atrial fibrillation in women. Am J Cardiol 2012;109(4):538-42.
11. Liao JN, Chao TF, Liu CJ, Wang KL, Chen SJ, Lin YJ, Chang SL, Lo LW, Hu YF, Tuan TC, Chung FP, Chen TJ, Chen SA. Incidence and risk factors for new-onset atrial fibrillation among patients with end-stage renal disease undergoing renal replacement therapy. Kidney Int 2015;87(6):1209-15.
12. Goldstein BA, Arce CM, Hlatky MA, Turakhia M, Setoguchi S, Winkelmayer WC. Trends in the incidence of atrial fibrillation in older patients initiating dialysis in the United States. Circulation 2012;126(19):2293-301.
13. Providencia R, Marijon E, Boveda S, Barra S, Narayanan K, Le Heuzey JY, Gersh BJ, Goncalves L. Meta-analysis of the influence of chronic kidney disease on the risk of thromboembolism among patients with nonvalvular atrial fibrillation. Am J Cardiol 2014;114(4):646-53.
14. Piccini JP, Stevens SR, Chang Y, Singer DE, Lokhnygina Y, Go AS, Patel MR, Mahaffey KW, Halperin JL, Breithardt G, Hankey GJ, Hacke W, Becker RC, Nessel CC, Fox KA, Califf RM, Committee RAS, Investigators. Renal dysfunction as a predictor of stroke and systemic embolism in patients with nonvalvular atrial fibrillation: validation of the R(2)CHADS(2) index in the ROCKET AF (Rivaroxaban Once-daily, oral, direct factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation) and ATRIA (AnTicoagulation and Risk factors In Atrial fibrillation) study cohorts. Circulation 2013;127(2):224-32.
15. Olesen JB, Lip GY, Kamper AL, Hommel K, Kober L, Lane DA, Lindhardsen J, Gislason GH, Torp-Pedersen C. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012;367(7):625-35.
16. Go AS, Fang MC, Udaltsova N, Chang Y, Pomernacki NK, Borowsky L, Singer DE, Investigators AS. Impact of proteinuria and glomerular filtration rate on risk of thromboembolism in atrial fibrillation: the anticoagulation and risk factors in atrial fibrillation (ATRIA) study. Circulation 2009;119(10):1363-9.
17. Shih CJ, Ou SM, Chao PW, Kuo SC, Lee YJ, Yang CY, Tarng DC, Lin CC, Huang PH, Li SY, Chen YT. Risks of Death and Stroke in Patients Undergoing Hemodialysis With New-Onset Atrial Fibrillation: A Competing-Risk Analysis of a Nationwide Cohort. Circulation 2016;133(3):265-72.
18. Bansal N, Fan D, Hsu CY, Ordonez JD, Go AS. Incident atrial fibrillation and risk of death in adults with chronic kidney disease. J Am Heart Assoc 2014;3(5):e001303.
19. Wetmore JB, Ellerbeck EF, Mahnken JD, Phadnis M, Rigler SK, Mukhopadhyay P, Spertus JA, Zhou X, Hou Q, Shireman TI. Atrial fibrillation and risk of stroke in dialysis patients. Ann Epidemiol 2013;23(3):112-8.
20. Watanabe H, Watanabe T, Sasaki S, Nagai K, Roden DM, Aizawa Y. Close bidirectional relationship between chronic kidney disease and atrial fibrillation: the Niigata preventive medicine study. Am Heart J 2009;158(4):629-36.
21. Bansal N, Xie D, Tao K, Chen J, Deo R, Horwitz E, Hsu CY, Kallem RK, Keane MG, Lora CM, Raj D, Soliman EZ, Strauss L, Wolf M, Go AS, Study C. Atrial Fibrillation and Risk of ESRD in Adults with CKD. Clin J Am Soc Nephrol 2016;11(7):1189-96.
22. Bansal N, Fan D, Hsu CY, Ordonez JD, Marcus GM, Go AS. Incident atrial fibrillation and risk of end-stage renal disease in adults with chronic kidney disease. Circulation 2013;127(5):569-74.
23. O'Neal WT, Tanner RM, Efird JT, Baber U, Alonso A, Howard VJ, Howard G, Muntner P, Soliman EZ. Atrial fibrillation and incident end-stage renal disease: The REasons for Geographic And Racial Differences in Stroke (REGARDS) study. Int J Cardiol 2015;185:219-23.
24. Goldenberg I, Moss AJ, McNitt S, Zareba W, Andrews ML, Hall WJ, Greenberg H, Case RB, Multicenter Automatic Defibrillator Implantation Trial III. Relations among renal function, risk of sudden cardiac death, and benefit of the implanted cardiac defibrillator in patients with ischemic left ventricular dysfunction. Am J Cardiol 2006;98(4):485-90.
25. Saxon LA, Bristow MR, Boehmer J, Krueger S, Kass DA, De Marco T, Carson P, DiCarlo L, Feldman AM, Galle E, Ecklund F. Predictors of sudden cardiac death and appropriate shock in the Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Trial. Circulation 2006;114(25):2766-72.
26. Deo R, Lin F, Vittinghoff E, Tseng ZH, Hulley SB, Shlipak MG. Kidney dysfunction and sudden cardiac death among women with coronary heart disease. Hypertension 2008;51(6):1578-82.
27. Pun PH, Smarz TR, Honeycutt EF, Shaw LK, Al-Khatib SM, Middleton JP. Chronic kidney disease is associated with increased risk of sudden cardiac death among patients with coronary artery disease. Kidney Int 2009;76(6):652-8.
28. Deo R, Sotoodehnia N, Katz R, Sarnak MJ, Fried LF, Chonchol M, Kestenbaum B, Psaty BM, Siscovick DS, Shlipak MG. Cystatin C and sudden cardiac death risk in the elderly. Circ Cardiovasc Qual Outcomes 2010;3(2):159-64.
29. Charytan DM, Lewis EF, Desai AS, Weinrauch LA, Ivanovich P, Toto RD, Claggett B, Liu J, Hartley LH, Finn P, Singh AK, Levey AS, Pfeffer MA, McMurray JJ, Solomon SD. Cause of Death in Patients With Diabetic CKD Enrolled in the Trial to Reduce Cardiovascular Events With Aranesp Therapy (TREAT). Am J Kidney Dis 2015;66(3):429-40.
30. Suzuki T, Agarwal SK, Deo R, Sotoodehnia N, Grams ME, Selvin E, Calkins H, Rosamond W, Tomaselli G, Coresh J, Matsushita K. Kidney function and sudden cardiac death in the community: The Atherosclerosis Risk in Communities (ARIC) Study. Am Heart J 2016;180:46-53.
31. Rhee CM, Kalantar-Zadeh K. Implications of the long interdialytic gap: a problem of excess accumulation vs. excess removal? Kidney Int 2015;88(3):442-4.