Controversias en la Insuficiencia Renal Aguda (2020)
En 2012, KDIGO publicó una guía sobre la clasificación y tratamiento de la lesión renal aguda (IRA). La guía se derivó de la evidencia disponible hasta febrero de 2011. Desde entonces, han surgido nuevas evidencias con implicaciones importantes para la práctica clínica en el diagnóstico y manejo de la IRA. En abril de 2019, KDIGO celebró una conferencia sobre controversias titulada Insuficiencia renal aguda con los siguientes objetivos: determinar las mejores prácticas y áreas de incertidumbre en el tratamiento de la IRA; revisar la literatura clave relevante publicada desde la guía KDIGO AKI de 2012; discutir temas controvertidos en curso; identificar nuevos temas o problemas de la actualidad para ser revisados en la próxima guía KDIGO AKI; y describir la investigación necesaria para mejorar la práctica clínica de la IRA. A continuación, presentamos los resultados de esta conferencia y las áreas clave que deben cubrir las futuras guías.
Kidney International (2020) 98, 294-309; https://doi.org/10.1016/ j.kint.2020.04.020KEYWORDS: acute kidney disease; acute kidney injury; fluid management; nephrotoxicity; renal replacement therapy; risk stratificationCopyright ª 2020, International Society of Nephrology. Published by Elsevier Inc. This is an open access article under the CC BY-NC-ND license(http://creativecommons.org/licenses/by-nc-nd/4.0/).
See Appendix for list of Conference Participants.
Received 3 January 2020; revised 31 March 2020; accepted 9 April 2020; published online 26 April 2020
En 2012, KDIGO (Kidney Disease: Improving Global Outcomes) publicó una guía sobre la clasificación y tratamiento de la lesión renal aguda (IRA o AKI) [1]. Desde entonces, hay nuevas evidencias de la importancia para la práctica clínica. Grandes estudios epidemiológicos y perfiles de riesgo para AKI están ya disponibles en adultos y niños, tales como la investigación prospectiva epidemiológica de AKI (AKI-EPI) [2], la Iniciativa 0by25, [3], el estudio del Sudeste Asiático - AKI (SEAAKI) [4], la Evaluación de la Lesión Renal Aguda Mundial, angina renal y epidemiología (AWARE) [5] y los estudios de Evaluación de la epidemiología mundial de la lesión renal aguda en neonatos (AWAKEN) [6]. La efectividad de las recomendaciones de KDIGO para prevenir la IRA ha sido confirmado en pequeños ensayos controlados aleatorios (RCT) de un solo centro como la Prevención de la IRA (PrevAKI) [7] y la Intervención guiada por biomarcadores para la prevención de la IRA (BigpAK) [8].
Además, los resultados de los RCT han proporcionado nuevos datos relevantes para varios aspectos de la prevención y la gestión de IRAe que incluyen reanimación temprana, fluidoterapia, prevención de IRA asociada al contraste y momento del inicio del tratamiento de reemplazo renal agudo [9] [10] [11] [12] [13] [14] [15]. Finalmente, ahora hay evidencia de grandes estudios en diferentes países que el uso de los criterios KDIGO para AKI, como parte de los sistemas informáticos de apoyo a las decisiones, pueden mejorar los resultados clínicos [16] [17]. Sin embargo, también ha habido importantes avances en el desarrollo de nuevas herramientas para diagnosticar y gestionar la IRA, incluidos los biomarcadores, programas de apoyo de decisiones y alertas electrónicas que van más allá de los criterios actuales de definición / estadificación de KDIGO, y merecen consideración para su inclusión en las guías de IRA [17] [18] [19] [20] [21] [22] [23] [24]. Estos avances no están exentos de controversia. La adopción de nuevos biomarcadores ha sido heterogéneo [25] y hay llamadas para revisar la estadificación de KDIGO AKI basada en creatinina y flujo de orina [26], e incluso llamadas para descartar el estadiaje de KDIGO completamente [27]. Por ello, en abril de 2019, KDIGO celebró una conferencia de controversia titulada Lesión Renal Aguda, en Roma, Italia. Los participantes examinaron y resumieron las pruebas publicadas desde 2012 en lo que se refiere a la evaluación de riesgos, diagnósticos y manejo de pacientes con IRA y añadieron comentarios sobre áreas de controversia y acuerdo. Los objetivos finales fueron proporcionar a las comunidades clínicas y de investigación una instantánea del estado actual del arte para el diagnóstico y manejo de la IRA y prepararse para la revisión futura de las guías 2012.
NOMENCLATURA Y CRITERIOS DIAGNOSTICOS
Definiciones relacionadas con AKI
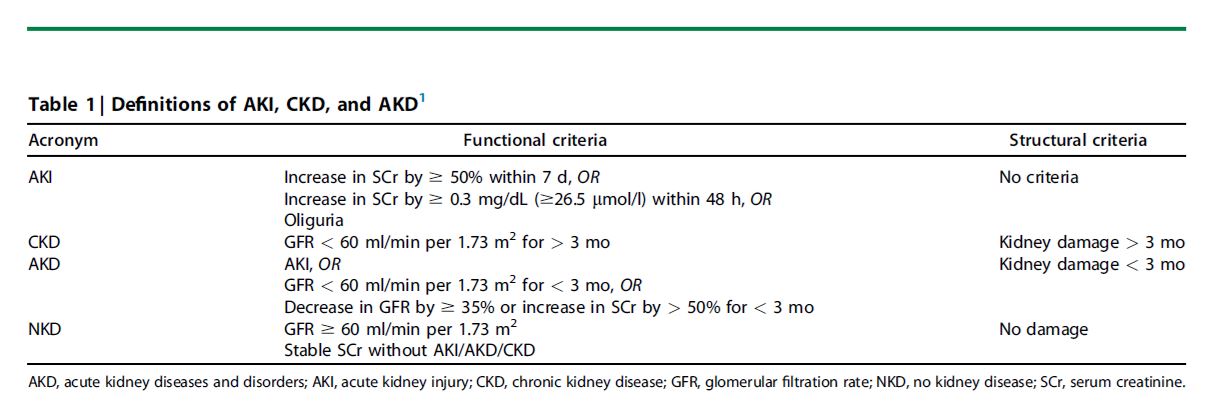
La IRA y la enfermedad renal crónica (ERC) son cada vez más reconocidas como entidades relacionadas que representan una enfermedad renal continua La guía 2002 de la National Kidney Foundation Kidney Disease Outcomes Quality Initiative (NKF-KDOQI) y la guía 2012 KDIGO AKI definen la ERC como tasa de filtración glomerular medida o estimada (TFG) 90 días [1]. La guía KDIGO 2012 definió la IRA como una disminución abrupta de la función renal, que ocurre durante 7 días o menos (Tabla 1) [1]. Para completar el continuo, la directriz de 2012 propuso el término enfermedades y trastornos renales agudos (AKD) para definir las condiciones de insuficiencia renal que no cumplen los criterios para IRA o ERC, pero con resultados adversos y requiriendo atención clínica. Sin embargo, es necesario un consenso sobre los criterios exactos y los indicadores de gravedad.
Ya que el diagnóstico de IRA debe estar ligado al manejo de decisiones, y que cambiar las definiciones de enfermedad puede tener importantes implicaciones para la epidemiología, el caso de la revisión de la definición de KDIGO 2012 de AKI debe ser muy sólido antes de que se propongan cambios. Además, en el contexto de una revisión de AKI, hay que definir rigurosamente los sistemas de clasificación y los estadios. Estos se relacionan con las diferencias entre persistente, transitorio, recidivante y AKI recuperado; diversas etiologías de AKI; y AKI iniciado en la comunidad versus AKI de inicio hospitalario. Además, hay evidencia emergente de que los marcadores de daño estructural renal pueden estar asociados con resultados clínicamente relevantes y, por tanto, identificar entidades potencialmente manejables. Para una revisión de la guía AKI, es necesario revisar la evidencia para determinar si los marcadores de daño renal constituyen factores de riesgo de IRA, definir una nueva entidad (como IRA subclínica o preclínica), o si deben incorporarse en la definición de IRA. Finalmente, la directriz futura debería utilizar una nomenclatura precisa y centrada en el paciente.
La importancia clínica de la enfermedad renal aguda (AKD o ERA) debe ser mejor definida. Datos de cohorte retrospectivos basados ??solo en cambios en los valores de creatinina sérica y con un contexto clínico limitado sugieren una relevancia para ERA: la población de pacientes en que se encuentran criterios de laboratorio para ERA pero no ERC o IRA es relativamente grande, y estas personas tienen mayores riesgos de incidencia y ERC progresiva, insuficiencia renal (denominada formalmente "etapa terminal enfermedad renal "), y muerte [28], lo que confirma la necesidad de definir mejor y clasificar la ERA. Además, una definición revisada y una clasificación de la ERA podrían armonizarse mejor con las definiciones y clasificaciones de IRA y ERC vinculados al manejo clínico. Como en los adultos, el espectro IRA / ERC /ERA se debe unificar en los niños y las definiciones deben ser igual para niños y adultos. Una consideración especial en niños, así como en adultos con masa muscular baja, es una concentración reducida de creatinina sérica lo que puede afectar al diagnóstico de IRA.
La evaluación de la recuperación renal sigue siendo controvertida y su definición es fundamental dadas las implicaciones para los pacientes y médicos. Los problemas relacionados con la evaluación de la recuperación incluyen cambios en la generación de creatinina debido a la reducción de la masa muscular entre otros.
Avances en el diagnóstico de AKI (IRA)
La creatinina sérica y la producción de orina siguen siendo la base de las medidas para el diagnóstico de IRA aunque sus limitaciones son bien conocidas. En el futuro, los biomarcadores de daño renal, la biopsia y las imágenes pueden ser útiles para la estadificación, clasificación de la causa, el pronóstico y tratamiento. Sin embargo, actualmente no hay información suficiente sobre cualquiera de estas medidas para justificar la adición a la definición de AKI. Dado que la disponibilidad global de nuevos biomarcadores es limitada, incorporarlos a las definiciones será un desafío. Las mediciones de la cinética del filtrado glomerular (FG) o en tiempo real, son herramientas de investigación en la actualidad, pero se necesitan más pruebas en cuanto a su aplicabilidad clínica (Tabla 2).
Tanto la diuresis como el nivel de creatinina sérica deben seguir utilizándose [29]; idealmente, la nueva directriz AKI debe proporcionar más aclaraciones sobre el papel de estas mediciones. Si es posible, deben evaluarse ambos. Sin embargo, si las mediciones de creatinina sérica no están disponibles de inmediato, se deben utilizar los criterios de producción de orina.
No está claro cuál es la mejor manera de determinar la función renal basal. Lo que constituye un nivel basal de creatinina sérica es controvertido y definido de manera inconsistente. Sería ideal tener mediciones previas de creatinina sérica o FG ampliamente disponible a través de registros médicos electrónicos, pero esto no es práctica actual en muchas partes del mundo. Las medidas de creatinina o FG previos también pueden aclarar aún más el riesgo de IRA en pacientes considerados de alto riesgo sobre la base de ya sea comorbilidad o de una intervención. Hay controversia sobre si una disminución aguda en el nivel de creatinina sérica indica AKI que ya ha ocurrido y y se están realizando más investigaciones necesarias en esta área.
Por ejemplo, pequeñas disminuciones en la creatinina sérica deben interpretarse con precaución porque pueden ser el resultado de cambios agudos en la producción de creatinina o en el volumen de distribución. Después de un insulto reciente (por ejemplo, angiografía coronaria, cirugía electiva, exposición a fármaco nefrotóxico), el nivel de creatinina sérica debe medirse en tiempo apropiado, permitiendo que la IRA se manifieste. Después del comienzo de la IRA, el nivel de creatinina sérica debe medirse durante el seguimiento para decisiones sobre el manejo clínico y sobre traslados (por ejemplo, traslado hacia y desde cuidados intensivos) y para determinar cambios en la estadificación y clasificación de la IRA (IRA vs. ERA), incluida la aparición de ERC a los 90 días. La forma en que se debe evaluar la producción de orina también es un área que necesita más investigación para evitar la variabilidad en los informes de Incidencia de IRA (es decir, uso del peso corporal real o ideal, valor en tiempo estricto versus valores promediados en el tiempo) [30]. Las directrices futuras deben abordar cómo las diferencias en la composición corporal (sobrepeso, sobrecarga de fluidos) afectan la interpretación de la producción de orina, y si estas diferencias deben ser consideradas con respecto a la umbrales para IRA. De manera similar, se debe considerar el estado de hidratación al evaluar la IRA. La sobrecarga de líquidos está asociada con aumento de la mortalidad e IRA, y puede afectar el diagnóstico de IRA por su impacto en el volumen de distribución de la creatinina sérica. Aunque existen métodos de investigación para definir la sobrecarga de fluidos, estos no se utilizan de forma rutinaria en la práctica clínica, y no está claro si hay evidencia suficiente para definir un nivel clínico de sobrecarga de fluido. En la próxima guía AKI, la sobrecarga de líquido debe definirse mediante una rigurosa revisión de la literatura.
ESTRATIFICACIÓN Y EVALUACIÓN DEL RIESGO DE AKI
Estratificación del riesgo
En entornos comunitarios y hospitalarios, la estratificación del riesgo de pacientes que utilizan una combinación de riesgos iniciales y exposiciones agudas es importante [31]. En el futuro, la estratificación del riesgo deberá incorporar varios contextos clínicos: región geográfica, inicio en entornos comunitarios u hospitalarios, y ubicación dentro de los hospitales.
Aunque la guía de 2012 discutió modelos de riesgo y puntuaciones clínicas, estas se limitaron a modelos para cirugía cardiotorácica, exposición al contraste y administración de aminoglucósidos. Muchos otros escenarios y contextos clínicos, como sepsis e insuficiencia cardíaca, requieren orientación para la evaluación de riesgos. En la práctica clínica, los modelos de riesgo pueden adaptarse para ubicación y contexto. Se necesitan estudios multicéntricos para validación externa de modelos, así como estandarización y correlación con los resultados. Además, desde 2012, los biomarcadores para la estratificación del riesgo de IRA han sido aprobados por la FDA. (Https: //www.accessdata. fda.gov/cdrh_docs/reviews/DEN130031.pdf) e integrado en recomendaciones de guías recientes para cirugía cardíaca [32].
Determinar la causa y el pronóstico
La determinación de la etiología de la IRA es fundamental para el tratamiento; sin embargo, esto puede ser difícil, especialmente en presencia de mecanismos multifactoriales. Nuevos desarrollos relacionados con el seguimiento y la evaluación de la progresión del riesgo incluyen sistemas de alerta electrónica, algoritmos de aprendizaje automático e inteligencia artificial para el reconocimiento y seguimiento de la IRA [20] [33] [34] [35] [36], así como modelos basados en el índice de angina renal [37] [38], estrés test de furosemida (FST) [39] o biomarcadores [40] [41] [42] [43]. Al revisar la pauta para la IRA, la gravedad debe basarse no solo en la elevación de la creatinina sérica y la producción de orina, sino también según la duración, y posiblemente con la inclusión de biomarcadores.
La necesidad de aumentar la atención para la IRA persistente (> 48 horas) también debe tenerse en cuenta [44]. La guía KDIGO de 2012 sugiere realizar biopsia renal cuando la causa de la IRA no está clara. Los beneficios potenciales de la biopsia en AKI son controvertidos y es necesaria investigación adicional [45]. Desde la guía de 2012, que recomendaba la ecografía para evaluar el tamaño del riñón y la presencia de obstrucción, se han puesto a disposición nuevas técnicas de imagen, como ecografía con contraste, ecografía Doppler, Resonancia magnética funcional dependiente de oxigenación sanguínea [46] [47] [48]. El papel de estas técnicas en cuanto a la evolución de la IRA aún no se ha determinado.
La guía KDIGO de 2012 recomendó sedimento de orina para diagnóstico diferencial en pacientes con IRA, especialmente cuando se espera enfermedad glomerular. En opinión de muchos de los participantes el análisis de sedimentos de orina no se realiza de forma rutinaria en muchos centros a pesar de su papel potencial en el diagnóstico de IRA [49] [50]. Además, el valor del análisis bioquímico de la orina ha sido muy discutido, especialmente en la sepsis [51].
El test de estrés de furosemida (FST) puede ser útil para identificar pacientes con IRA que es probable que padezcan una enfermedad progresiva y necesiten diálisis [52]. También hay evidencia de que el FST es útil para predecir función retardada del injerto tras trasplante de cadáver [53]. Esta prueba no se incluyó en la guía 2012 pero ahora debe considerarse. Es importante destacar que regular estas pruebas de diagnóstico como FST o sedimento de orina requiere una cuidadosa estandarización y control de calidad. Su introducción en la práctica clínica debe incluir evaluación local para el correcto desarrollo e interpretación.
El enfoque tradicional para clasificar la IRA como prerrenal, renal y postrenal todavía se encuentra en muchos libros de texto médicos. Se necesita un marco diferente, porque estos términos se consideran poco útiles, especialmente el término prerrenal, que a menudo se malinterpreta como "hipovolémico" y puede fomentar administración indiscriminada de líquidos. Para clasificar IRA, puede ser más beneficioso distinguir entre las condiciones que reducen la función glomerular, condiciones que resultan en lesiones de túbulos y / o glomérulos, y condiciones que hacen ambas cosas.
Los criterios de valoración para ensayos clínicos e iniciativas de mejora de la calidad para la IRA incluyen mortalidad, nueva aparición o progresión de ERC y dependencia de diálisis. Son necesarios objetivos adicionales tanto para la gestión clínica como para la investigación, y estos pueden incluir la recuperación de la función, cambios máximos en concentración de creatinina, estadio de IRA / ERC, impacto en la reserva funcional renal y experiencia del paciente. Además, existe la necesidad de definir mejor la recuperación renal y sus dimensiones funcionales (filtración, tubular, endocrina) y anatómico / estructurales
Seguimiento
Un mayor riesgo de mortalidad, eventos cardiovasculares y progresión de la enfermedad renal son resultados evolutivos bien documentados de IRA [28,54-56]. Sin embargo, no todas las personas con IRA tienen una mala evolución y se han identificado predictores de mala evolución [57]. Se han propuesto recomendaciones de seguimiento (Figura 1) [31] que podrían integrarse en una revisión de la guía KDIGO. Aunque se ha sugerido que los pacientes sean examinados al alta del hospital o vistos dentro de 1 mes después del diagnóstico de IRA [58], no existe consenso sobre la estrategia óptima y duración del seguimiento para mejorar los resultados a corto y largo plazo.
GESTIÓN DE FLUIDOS Y SOPORTE HEMODINÁMICO
Ritmo de administración de líquidos
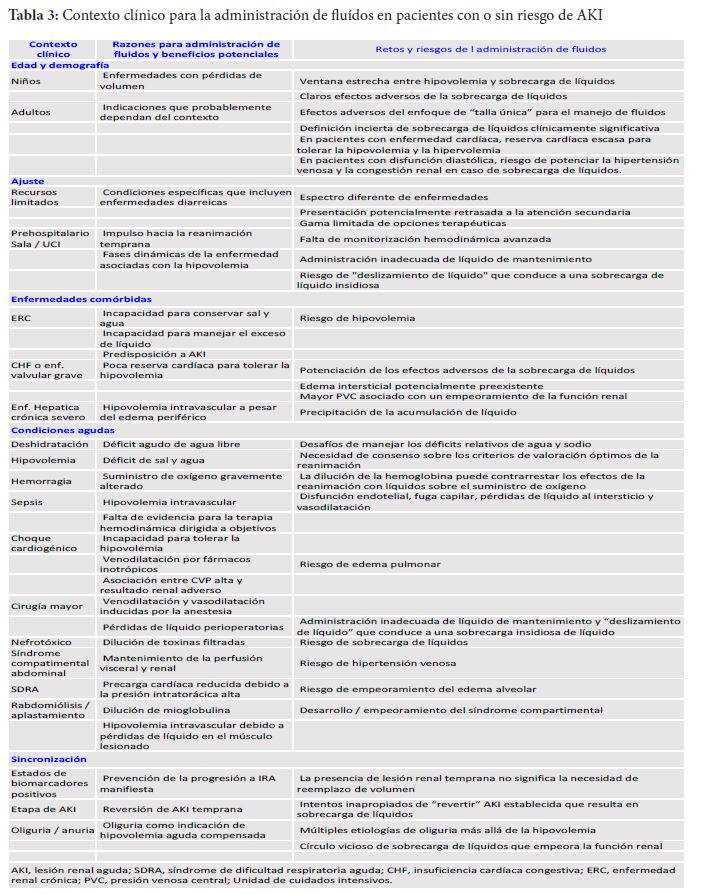
Asegurar una hidratación adecuada y un correcto estado de volumen es esencial en la prevención y tratamiento de la IRA. El líquido puede ser administrado por vía Oral o i.v. dependiendo del contexto del entorno local y clínico. La administración i.v. de líquidos debe ser guiada por la evaluación hemodinámica según indicaciones y contraindicaciones específicas. Al decidir sobre la fluidoterapia, hay que considerar el contexto y la historia clínica, incluido el momento del insulto que es crítico. La (Tabla 3) enumera los contextos clínicos en los que las indicaciones para la administración de líquidos deben ser balanceadas contra posibles condiciones coexistentes que requieren una decisión más cuidadosa. Porque tanto la respuesta fisiológica a los líquidos como la condición subyacente relacionada con la IRA son dinámicas en el tiempo, y la administración de líquidos debe basarse en evaluación repetida del estado general de líquidos y estado hemodinámico y tests dinámicos de respuesta a los líquidos [59] [60].
Sigue existiendo preocupación por el exceso de administración de líquido para la hipotensión y el uso temprano de medicaciones vasoactivas pueden ser apropiados para algunos pacientes [61] [62]. El efecto de estas estrategias sobre la función renal no está claramente definido y probablemente deban ser específicas del contexto en el que se produce [63]. Estudios multicéntricos prospectivos y aleatorizados en marcha que examinan los objetivos finales de valoración renal están evaluando la administración de líquidos y medicamentos vasoactivos, y es probable que los resultados afecten las recomendaciones de tratamiento de la IRA.
Métodos de administración de líquidos.
Nuevas evidencias significativas de grandes estudios multicéntricos prospectivos y aleatorizados sobre el uso de líquidos y sus resultados en objetivos protocolizados en el shock séptico temprano han sugerido una falta de beneficios para la supervivencia y evolución de la función renal [64] [65] [66]. Sin embargo, hay alguna evidencia que sugiere que los protocolos dirigidos a objetivos han sido beneficiosos en pacientes durante el proceso perioperatorio [67] [68]. Por lo tanto, las recomendaciones con respecto a la fluidoterapia dirigida por objetivos para prevenir o tratar la IRA surgirán para contextos más específicos. Además, los objetivos de la fluidoterapia clínica han evolucionado para incluir índices más dinámicos, incluidos la prueba pasiva de elevación de piernas, variación del volumen sistólico / presión del pulso, y parámetros derivados de la ecografía. Sin embargo, hay evidencia limitada de que los objetivos fisiológicos específicos para el tratamiento con líquidos, mejore los resultados renales.
Composición de i.v. preparaciones fluidas
Cristaloides. La evidencia de anomalías bioquímicas y resultados clínicos adversos asociados con solución salina al 0,9% en comparación con cristaloides más fisiológicos (por ejemplo, Ringer lactato) ha seguido acumulándose desde 2012 [11] [12] y se esperan resultados de dos grandes estudios (RCT) multicéntricos en curso (NCT02875873,NCT02721654). Esta evidencia requerirá una cuidada evaluación para brindar a la comunidad un nuevo consenso con respecto a la magnitud de los riesgos asociados con la solución salina al 0,9% en enfermedades agudas y cirugía, incluidas las consideraciones para entornos con recursos limitados en los que las alternativas pueden ser también limitadas.
Coloides sintéticos. En los últimos años ha surgido un consenso qué debido a la mayor incidencia de disfunción renal y mortalidad, los coloides sintéticos son dañinos en pacientes críticamente enfermos, especialmente aquellos con sepsis [69] [70]. Sin embargo, si estos riesgos también se aplican a los pacientes perioperatorios es controvertido, y esta cuestión está siendo examinada en ensayos en curso
Albúmina. En los RCT, el uso de albúmina (incluida las soluciones hiperoncóticas) no ha demostrado ser perjudicial para el riñón u otros resultados [71] [72]. Sin embargo, hay evidencia clara también de falta de un beneficio, y cualquier beneficio puede limitarse a poblaciones específicas de pacientes [73] [74] [75].
Eliminación de fluidos
La evidencia fisiológica y epidemiológica indica que la sobrecarga de volumen y la congestión venosa tienen efectos adversos sobre función renal y la evolución tanto en enfermedades agudas como crónicas [76] [77] [78]. En los niños, hay evidencia de que > 10% -15% de sobrecarga de líquidos por peso corporal se asocia con efectos adversos [79] [80]. Sin embargo, el método para determinar la sobrecarga liquida y el umbral de sobrecarga de líquido clínicamente significativo en adultos no están bien definidos, ni tampoco el papel preciso de la velocidad de la eliminación de líquidos en la función renal y otros aspectos. Por lo tanto, es necesario desarrollar un consenso en torno a métodos y umbrales para la evaluación de la sobrecarga de fluidos en adultos y establecer recomendaciones para su manejo (Tabla 2).
AGENTES NEFROTÓXICOS Y MEDICAMENTOS QUE AFECTAN LA FUNCIÓN RENAL
El uso de medicamentos asociados con daño o disfunción renal es común tanto en el ámbito hospitalario como en la comunidad para pacientes con enfermedades crónicas como hipertensión, insuficiencia cardíaca congestiva, diabetes mellitus, cáncer y ERC. Estos medicamentos a menudo se denominan "nefrotóxicos", aunque muchos de ellos conducen a disfunción renal sin daño celular glomerular o tubular. Además, algunas drogas que pueden provocar un aumento de la creatinina sérica en realidad son renoprotectoras y se asocian con mejores resultados (inhibidores de la enzima convertidora de angiotensina o inhibidores del cotransportador-sodio-glucosa [81] en la nefropatía diabética). Aunque sería ideal proponer un sencillo pero inclusivo término para abarcar los diversos mecanismos por los cuales las drogas interactúan con el riñón, los participantes de la reunión no pudieron identificar uno. Por tanto, aquí el término "fármacos nefrotóxicos" se mantiene en consistencia con la literatura. Una nueva clasificación también debe incluir medicamentos que no son directamente perjudiciales para la función renal, pero se eliminan por vía renal, y hay preocupación por el daño por acumulación del fármaco original o sus metabolitos en el contexto de la IRA y ERA. Del mismo modo, no aumentar las dosis y los intervalos de los medicamentos en fases de recuperación renal o con mayor eliminación a través de aclaramiento extracorpóreo puede conducir al fracaso terapéutico [82]. En los últimos 10 años, se han logrado avances significativos en materia de susceptibilidad, manejo y estrategias preventivas para evitar o mejorar el daño o disfunción renal por medicamentos (o combinación de medicamentos) de una forma más amplia. El marco general sobre el manejo de medicamentos nefrotóxicos es como sigue:
* Los pacientes deben recibir medicamentos potencialmente nefrotóxicos solo si es necesario y solo durante el tiempo que sea necesario.
* Los agentes potencialmente nefrotóxicos no deben suspenderse en condiciones que ponen en peligro la vida, debido a la preocupación por la IRA, incluyendo contraste intravenoso
* La función renal debe monitorizarse en pacientes que están expuestos a agentes que están asociados con disfunción o lesión renal, para limitar el riesgo y la progresión de la IRA y ERA.
* Los pacientes y los médicos necesitan una educación adecuada y eficaz en cuanto al potencial de daño y disfunción renal de agentes nefrotóxicos.
Clasificando medicamentos que afectan la función renal y / o son nefrotóxicos
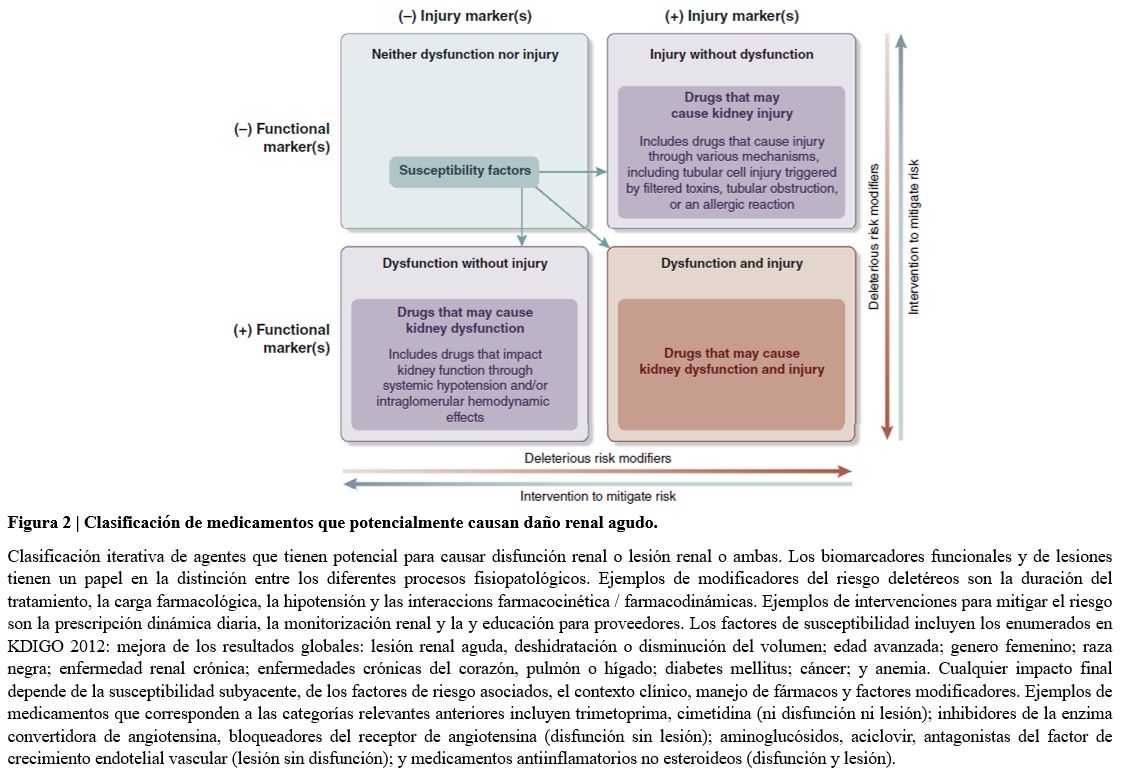
Existen múltiples mecanismos por los cuales las drogas afectan al riñón. Se resumen en 2 categorías principales: efectos hemodinámicos sistémicos o renal/glomerulares (es decir disfunción renal); y daño tubular o estructural (es decir, lesión renal). La disfunción renal puede resultar por drogas que conducen a hipotensión sistémica (por ejemplo, vasodilatación arterial sistémica) y / o hemodinámica intraglomerular alterada (como constricción de arteriola aferente, dilatación de arteriola eferente). Como resultado, la presión de perfusión renal disminuye y si esta disminución es sostenida o severa, puede conducir a una lesión isquémica. En comparación, la lesión renal asociada a drogas se caracteriza por lesión celular glomerular o tubular provocada por toxinas filtradas, obstrucción tubular y disfunción endotelial o una reacción alérgica [83] [84] [85]. Es importante tener en cuenta que un medicamento determinado puede conducir a ambos, disfunción y lesión renal
Un marco útil para clasificar los mecanismos de lesión o disfunción renal inducida por fármacos se representa en una tabla 2x2 para clasificar IRA funcional, estructural y combinada funcional / estructural [86] (Figura 2). Las drogas pueden afectar el riñón por cada uno de estos mecanismos, y la figura representa susceptibilidades de IRA, así como aceleradores para desarrollar disfunción o lesión y transición a disfunción y lesión. Un aspecto importante del marco es la consideración de estrategias de mitigación de riesgos. Actualmente, hay evidencia suficiente para clasificar los medicamentos que afectan la función renal o que son nefrotóxicos, de una manera clínicamente útil [87] [88].
Prevención y mitigación de la IRA asociada a fármacos
Han surgido varias estrategias para prevenir o mitigar lesión o disfunción renal asociada a fármacos. El más importante de estos es la correcta administración de fármacos [21] [89] [90], con el objetivo de equilibrar los riesgos y beneficios cambiantes en la utilización de medicamentos y dosificación en IRA/ ERA (Tabla 4) [82]. Específicamente, es fundamental equilibrar el riesgo de toxicidad causado por dosis excesivas o acumulación de fármaco / metabolito en IRA/ ERA versus el riesgo de fracaso terapéutico causado por una dosificación de un fármaco demasiado conservadoramente o con subdosificación, o el riesgo de no adaptarse a la recuperación o uso de tratamiento de reemplazo renal (TRR).
La literatura reciente ha demostrado que ciertas combinaciones y la carga general de fármacos se asocian con la IRA [91]. Estos incluyen el "triple impacto " de inhibidores del sistema renina-angiotensina, diuréticos y antiinflamatorios no esteroideos y un mayor riesgo de IRA cuando los pacientes reciben 3 o más fármacos nefrotóxicos al día [92]. Un solo centro ha utilizado registros de salud electrónicos para identificar a los niños expuestos a 3 o más fármacos nefrotóxicos, y el enfoque ha llevado a una disminución de la incidencia de IRA [21].
Prevención y manejo de la IRA asociada al contraste
El único agente nefrotóxico tratado en detalle en la guía KDIGO AKI de 2012 fue el radiocontraste yodado [1]. La guía de 2012 incluía varias recomendaciones para prevenir la IRA inducida por el contraste, incluido el uso de expansión de volumen con soluciones de bicarbonato de sodio y N-acetilcisteína oral. Resultados de ensayos como el de la prevención de efectos adversos graves posteriores a la angiografía (PRESERVE) y POSEIDON demostraron la falta de eficacia de estas intervenciones (y en cambio, encontró mejoría utilizando un enfoque personalizado dirigido a las presiones críticas de llenado cardíaco en POSEIDON) [93] [94]. Además, la evidencia reciente sugiere que los riesgos asociados con el contraste i.v. es mucho menor con los agentes modernos y patrones de práctica, y la lesión renal significativa es inusual en pacientes con función renal basal normal o levemente reducida [95]. El contraste iv no debe ser evitado debido a la preocupación por la IRA en condiciones potencialmente mortales en las que la información obtenida del estudio con contraste podría tener importantes implicaciones terapéuticas.
TRATAMIENTO DE REEMPLAZO RENAL (RRT ó TSR indistintamente)
Terminología e iniciación del RRT
En los últimos años, se ha sugerido que el término "renal" debe reemplazarse por "kidney " (riñón), porque este último es más familiar para la mayoría de los angloparlantes. Adicionalmente, el término "reemplazo" puede no ser suficiente, y términos tales como "soporte" o "reemplazo parcial" pueden ser más precisos. Las implicaciones de los cambios de nomenclatura no son insignificantes. Además, la distinción entre riñón (kidney) versus renal no se aplica en todos los idiomas. En consecuencia, KDIGO ha convocado una Conferencia sobre Consenso de Nomenclatura por separado con el propósito de recomendar nomenclatura de acuerdo con las guías para la enfermedad renal aguda y crónica [96]. Sobre todo, los pacientes deben ser el centro de comunicación y cuidados. Siempre que sea posible, todas las decisiones sobre el tratamiento deben compartirse con los pacientes, sus familias y / o parientes más cercanos, y si es necesario, todos los miembros del equipo multidisciplinario de cuidados paliativos. Toda la comunicación con los pacientes y sus familiares / amigos que los apoyan debe proporcionarse en un lenguaje laico simple a intervalos regulares, con la conciencia de que los pacientes pueden estar traumatizados. "Soporte vital", "máquina de riñón" o palabras similares se prefieren al término reemplazamiento de la función renal (RRT). Si el RRT se vuelve permanente, y el paciente comienza diálisis crónica, todo el personal médico o de enfermería debe cambiar su lenguaje para especificar el tipo de tratamiento sustitutivo renal (trasplante, hemodiálisis, o diálisis peritoneal).
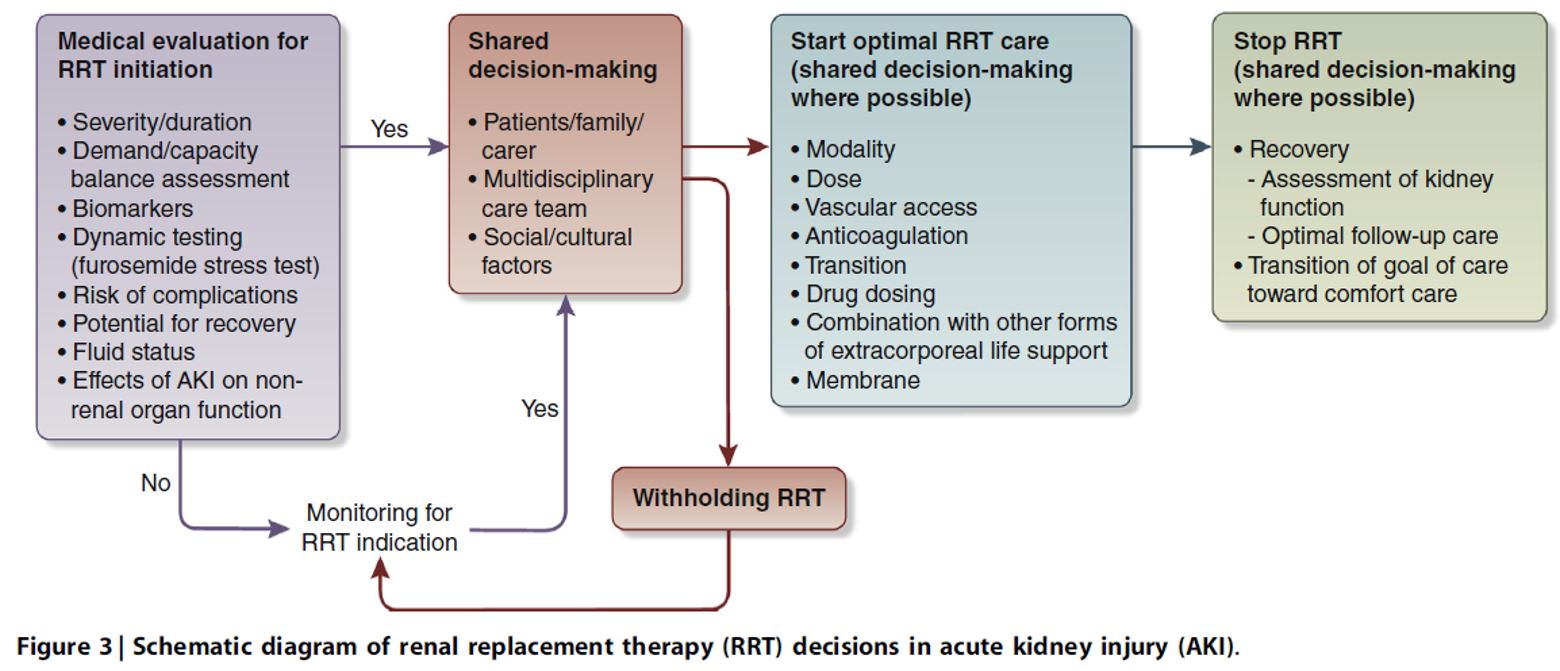
La guía KDIGO AKI de 2012 sugirió iniciar el tratamiento sustitutivo renal (TSR) urgente en presencia de cambios potencialmente mortales en el equilibrio de líquidos, electrolitos y ácido-base. Desde 2012, hay datos de varios estudios prospectivos aleatorizados (RCT) y observacionales [13] [15] [97] [98] [99] [100] [101] [102] [103] [104]. Sin embargo, el momento óptimo para el inicio del TSR sigue siendo desconocido. Se ha propuesto que el inicio debe considerarse cuando las demandas metabólicas y de líquido excedan la capacidad del riñón para satisfacerlos [105] [106] [107]. Este concepto reconoce la naturaleza dinámica de la enfermedad renal aguda y destaca la importancia de una evaluación periódica entre la demanda y la capacidad renal. Sin embargo, los métodos exactos para determinar la demanda y la capacidad se desconocen. No hay evidencia en el uso de biomarcadores para decidir el inicio del TSR [13] [97] [108]. El uso de un FST (furosemida stress test) estandarizado puede ser considerado en IRA, para cuantificar aún más la probabilidad de progresión de la IRA e integrarle en el espectro de información disponible al planificar y decidir iniciar el TSR [39] [52] [109] [110]. Al determinar si comenzar o no el TSR, hay que considerar el riesgo de complicaciones, pronóstico global, potencial de recuperación y las preferencias del paciente (Figura 3). Aunque algunas regiones del mundo tienen desafíos y limitaciones para proporcionar acceso universal al TSR [111], recomendamos que se adopte un enfoque similar para considerar quién y cuándo iniciar el TSR en todas las regiones [112] [114]. Además, debería adoptarse un enfoque similar tanto en la unidad de cuidados intensivos como en la de cuidados no intensivos.
Proporcionar TSR
Aunque el momento de inicio del TSR es controvertido, la provisión de TSR en sí misma se ha establecido bastante bien. Los pacientes con IRA que requieren TSR tienen una situación clínica en evolución que debe ser controlada por la modalidad apropiada disponible. La elección de la modalidad también debe ajustarse al estado clínico del paciente. . Como se sugiere en la guía KDIGO 2012 en pacientes hemodinámicamente inestables, el tratamiento continuo en lugar de hemodiálisis intermitente, es fisiológicamente más apropiado, pero los RCT no han demostrado mejores resultados con las técnicas continuas de TSR [1]. Tanto la modalidad continua como la intermitente pueden conducir a cambios en la presión intracraneal, pero el riesgo es mayor con TSR intermitente. La selección de las modalidades debe considerarse en el contexto de los recursos y experiencia del personal.
Para iniciar el TSR en pacientes con IRA debe utilizarse un catéter de diálisis no tunelizado sin brazalete (cuff) de apropiada longitud y calibre En pacientes en los que se espera una indicación prolongada de TSR, se puede considerar un catéter con cuff [115]. La primera opción para el sitio es la vena yugular derecha o la vena femoral, aunque la vía femoral es peor en pacientes con aumento de masa corporal. Las siguientes opciones serían la vena yugular izquierda seguida de la vena subclavia. Debe seleccionarse el tipo de anticoagulación basado en los recursos locales y la experiencia del personal. Las recomendaciones de 2012 para utilizar anticoagulación regional con citrato para TSR continuo en pacientes que no tienen una contraindicación sigue estando respaldada por los datos existentes [116] [117] [118]. La administración de TSR debe alcanzar los objetivos de electrolitos, ácido-base, balance de solutos y líquidos específicos para cada paciente [119]. Cuando se utiliza TSR intermitente o extendido, se debe administrar un Kt/V de al menos 1,2 en frecuencia de 3 veces a la semana [120]. Para la diálisis peritoneal, los estudios futuros deben centrarse en la dosificación en la IRA, aunque actualmente sugerimos una dosis de 0,3 Kt / V por sesión. Debe administrarse un volumen de efluente de 20 a 25 ml / kg por hora cuando se utiliza TSR continuo. Esto a veces requerirá mayor prescripción de volumen de efluente [121] [122]. La tasa de extracción de líquido para un paciente determinado con sobrecarga de líquidos es controvertida [123] [124] y se necesita más investigación. Hay que mejorar los métodos para evaluar mejor el manejo de líquidos durante el TSR. Finalmente, el TSR debe suspenderse cuando la función renal se ha recuperado o cuando el TSR se vuelve inconsistente en relación a los objetivos propuestos. La transición de modalidad de TSR continuo a hemodiálisis intermitente en pacientes en UCI debe considerarse cuando el soporte vasopresor se ha detenido, la hipertensión intracraneal se ha resuelto y el balance positivo de líquidos se puede controlar con hemodiálisis intermitente
Tratamiento sustitutivo renal en el fallo multiorgánico
La guía KDIGO AKI de 2012 no abordó la utilización de soporte vital extracorpóreo (ECLS) tales como la oxigenación con membrana extracorpórea (ECMO), la extracción extracorpórea de dióxido de carbono (ECCO2R) y el dispositivo de asistencia ventricular izquierda o derecha. Varios problemas siguen sin resolverse: el óptimo enfoque para la selección de pacientes, técnicas y tiempos / indicaciones; integración de circuitos; y monitoreo de ECLS y técnicas de purificación de sangre concomitantes. Varios estudios observacionales sobre este tema merecen análisis e interpretación [125] [126] [127] [128] [129] [130] [131]. Las decisiones sobre cómo combinar RRT con dispositivos ECLS dependerán de la experiencia, la tecnología y los recursos. Dicho tratamiento combinado debe basarse en un enfoque multidisciplinario de la atención al paciente y toma compartida de decisiones. Se necesitan más estudios para definir la mejor estrategia de entrenamiento y práctica. Aunque se pueden utilizar diferentes modalidades de TSR para tratar pacientes durante ECLS, y los estudios comparativos no están disponibles, debido al estado hemodinámico, el TSR continuo es lo más apropiado en este entorno. Sería útil desarrollar un registro centrado en pacientes que reciben ECLS- TSR, para comprender la epidemiología, tecnología, indicaciones y complicaciones asociadas con la práctica actual. No hay evidencia clara de que las indicaciones actuales del TSR deban variar de acuerdo con la presencia o ausencia de un Circuito ECMO / ECCO2R. No obstante, los pacientes que requieren ECMO o ECCO2R son muy sensibles a la sobrecarga de líquidos. Por tanto, es posible que se requiera un TSR más temprano para prevenir y manejar la sobrecarga de líquidos. Un registro de pacientes que combinen ECMO / ECCO2R y TSR podría mejorar la comprensión de la práctica actual para iniciar TSR en pacientes (adultos y niños) con ECMO / ECCO2R y manejo de líquidos. La diálisis respiratoria (ECCO2R y ECMO) con modificación de las soluciones de diálisis se limita actualmente a estudios in vitro y experimentales [132] [134] y son necesarias investigaciones centradas en estas técnicas
La anticoagulación de los circuitos de TSR cuando están ECMO / ECCO2R funcionando no está estandarizado. La administración de heparina puede depender de factores del paciente (por ejemplo, riesgo de sangrado), configuración del circuito (por ejemplo, conexión a paciente o a ECMO), y protocolos institucionales [128] [130] [135] [136] [137] [138] [139] [140] [141]. Es posible tener circuitos TSR sin heparina a menos que se observen coágulos excesivamente frecuentes. Se necesitan estudios para comparar diferentes estrategias anticoagulantes en este entorno. Es posible la anticoagulación con citrato durante TSR añadido a ECMO / ECCO2R [139] [140]. Su viabilidad y rendimiento en comparación con otras formas de anticoagulación permanecen sin probar, y por lo tanto son recomendables los estudios comparativos con citrato.
Resultados y seguimiento del TSR a largo plazo
Elección de la modalidad de TSR e impacto en la recuperación. La selección de la modalidad TSR no parece tener un mayor impacto en la recuperación de la función renal [141] [142] [143]. La selección por tanto de la modalidad de TSR debe basarse en la toma de decisiones compartida, experiencia local, factores logísticos y características del paciente. El FG estimado junto con los principales eventos renales adversos han sido utilizados para la evaluación a medio y largo plazo, pero tiene varias limitaciones. Hay incertidumbre acerca de la mejor manera de medir la recuperación renal después del TSR tanto a corto como a medio plazo. Sin embargo, la proteinuria se asocia con peores resultados a largo plazo y es fácil de medir.
Evaluación de la función renal para la recuperación renal. Además del desarrollo de ERC, los resultados centrados en el paciente (calidad de vida, recuperación funcional), junto con experiencia en pacientes después de IRA, deben ser una prioridad y deben ser evaluados. La proteinuria post-IRA se asocia con la pérdida futura de función renal y se considera una herramienta para estratificación de riesgo valiosa en el período post-IRA [144] [145] [146].
Seguimiento óptimo de los pacientes tras IRA en TSR
La toma de decisiones y comunicación compartida entre los cuidadores, el paciente y los miembros de la familia es crucial para la recuperación del paciente. Los pacientes que se recuperan de una enfermedad crítica y de una IRA son a menudo dados de alta a centros de rehabilitación con enfermería especializada y necesitan un seguimiento estrecho para garantizar una recuperación general adecuada de un estado básico de salud y bienestar. Tales pacientes deben recibir atención multidisciplinaria y centrada en la recuperación. Los pacientes con IRA que continúan requiriendo TSR al alta hospitalaria a menudo precisan recibir hemodiálisis en instalaciones de diálisis para pacientes ambulatorios. Los pacientes con insuficiencia cardíaca congestiva tienen menos probabilidades de recuperar la función renal [147]. Las altas tasas de ultrafiltración y los episodios de hipotensión intradiálisis están asociados con un mayor riesgo de no recuperación de la función renal [148] [149]. Para evaluar la recuperación renal, el estado hemodinámico, el volumen intravascular y la producción de orina durante la diálisis se deben controlar cuidadosamente.
Indicadores de calidad para TRS agudo
La importancia de medir y monitorizar la calidad del TSR agudo proporcionado a pacientes críticamente enfermos con IRA, incluida la "evaluación comparativa" óptima para los programas de TSR agudos, está recibiendo gran atención.[119] [150]. La calidad del TSR agudo debe ser monitorizada para asegurar la efectividad y la seguridad [151]. Como mínimo, las instituciones y los programas que proporcionan TSR deben integrar, monitorizar e informar la calidad y los indicadores de resultados en todas las formas de TSR agudo [31]. Estas medidas de resultados deben comprender una variedad de mediciones que incorporen la supervivencia del paciente, resultados del TSR agudo centrados en el paciente, seguridad, resultados relacionados con la supervivencia y experiencia con pacientes. Los indicadores de calidad deben incluir objetivos compartidos centrados en el paciente y en la clínica.
CONCLUSIONES
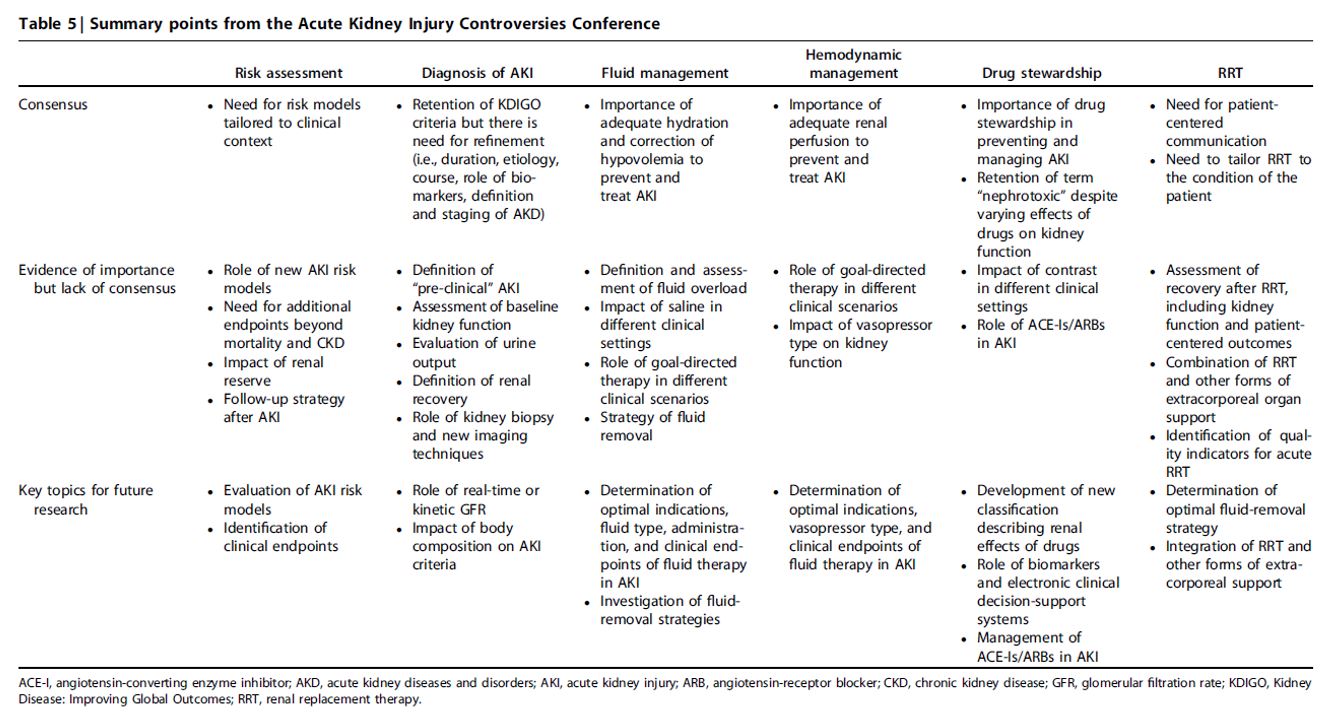
Aunque gran parte de la guía KDIGO AKI de 2012 permanece estado del arte, los avances de la última década han mejorado nuestro conocimiento de las mejores prácticas. Muchos de estos avances son ampliamente aceptados (por ejemplo, administración de medicamentos nefrotóxicos, toma de decisiones compartida para TSR), pero otros son más controvertidos (Tabla 5). Aunque algunos centros y programas específicos han adoptado nuevas tecnologías y formas de pensar, otros han adoptado un enfoque más conservador, de "esperar a ver". Incluso entre los participantes de la conferencia, hubo falta de unanimidad para varias perspectivas, y la práctica es variada, incluso entre los expertos. Quizás más que cualquier nuevo ensayo o descubrimiento, este este hecho proporciona una amplia justificación para revisar las guías AKI en el futuro cercano.
APÉNDICE
Otros participantes de la conferencia
Sean M. Bagshaw, Canadá; Erin F. Barreto, Estados Unidos; Azra Bihorac, Estados Unidos; Ilona Bobek,Hungría; Josée Bouchard, Canadá; Jorge Cerdá, Estados Unidos; Rajasekara Chakravarthi,India; Silvia De Rosa, Italia; Daniel T. Engelman, EstadosUnidos; Lui G. Forni, Reino Unido; UllaHemmilä, UK; Charles A. Herzog, USA; Eric A. Hoste, Belgium; Sarah C. Huen,USA; Kunitoshi Iseki, Japan; Michael Joannidis, Austria; Kianoush B. Kashani,USA; Jay L. Koyner, USA; Andreas Kribben, Germany; Norbert Lameire, Belgium;Andrew S. Levey, USA; Etienne Macedo, USA; Jolanta Ma?yszko, Poland; MelanieMeersch, Germany; Ravindra L. Mehta, USA; Irene Mewburn, Australia; OlgaMironova, Russia; Patrick T. Murray, Ireland; Mitra K. Nadim, USA; Jenny S. Pan,USA; Neesh Pannu, Canada; Zhiyong Peng, China; Barbara Philips, UK; DanielaPonce, Brazil; Patricio E. Ray, USA; Zaccaria Ricci, Italy; Thomas Rimmelé, France;Claudio Ronco, Italy; Edward D. Siew, USA; Paul E. Stevens, UK; Ashita J.Tolwani, USA; Marcello Tonelli, Canada; Suvi T. Vaara, Finland; Marjel van Dam,Netherlands; Anitha Vijayan, USA; Michael Wise, UK; Vin-Cent Wu, Taiwan;Alexander Zarbock, Germany.
DISCLOSURE
MO declared having received consultancy fees from NxStage, speakerhonoraria from Fresenius Medical Care, and research support from LaJollaPharma. RB declared having received speaker honoraria from AbbVie andresearch support from Baxter. EAB declared having received consultancy feesfrom AstraZeneca and Fresenius Medical Care, and research support fromFundação de Amparo à Pesquisa do Estado de São Paulo. ZHE declared havingreceived consultancy fees from AstraZeneca, and research support from HealthResearch Council of New Zealand and National University Hospital Singapore.SLG declared having received stock options from MediBeacon. KDL declaredhaving received consultancy fees from bioMérieux, speaker honoraria fromBaxter, and stock options from Amgen. JRP declared having receivedconsultancy fees from MediBeacon, Nikkiso Europe GmbH, and QuarkPharmaceuticals; speaker honoraria from Baxter, Fresenius Medical Care, andNikkiso Europe GmbH; and research support from bioMérieux. MJ declaredhaving received consultancy fees from Amgen, AstraZeneca,Mundipharma, MSD, and Vifor Fresenius Medical Care Renal Pharma;speaker honoraria from Amgen, Menarini, MSD, and Vifor FreseniusMedical Care Renal Pharma; and research support from Amgen, MSD, andOtsuka. WCW declared having received consultancy fees from Akebia,AstraZeneca, Bayer, Janssen, Merck, Relypsa, and Vifor Fresenius MedicalCare Renal Pharma; and research support from the National Institutes ofHealth. JAK declared having received consultancy fees from AstuteMedical, Baxter, bioMérieux, Davita, Fresenius Medical Care, Grifols,
NxStage, Potrero, and RenalSense; and research support from AstuteMedical, Baxter, bioMérieux, and RenalSense. All the other authorsdeclared no competing interests.
AGRADECIMIENTOS
This conference was sponsored by KDIGO and was in part supportedby unrestricted educational grants from Akebia Therapeutics, AMPharma,Angion, AstraZeneca, Astute Medical, Atox Bio, Baxter,bioMérieux, BioPorto, Boehringer Ingelheim, CytoSorbents, Edwards,Fresenius Medical Care, GE Healthcare, Grifols, Kyowa Kirin, Novartis,NxStage, Outset, and Potrero
We thank Jennifer King, PhD, for assistance with manuscriptpreparation. The conference agenda, discussion questions, andplenary session presentations are available on the KDIGO website:https://kdigo.org/conferences/aki-conference/.