Arritmias y ERC. Aspectos destacados (2018)
Los pacientes con enfermedad renal crónica (ERC) presentan predisposición a desarrollar trastornos del ritmo cardíaco, incluyendo fibrilación auricular (FA)/flutter auricular, taquicardia supraventricular, arritmias ventriculares y muerte súbita cardíaca (MSC). Por otro lado, los pacientes con ERC forman parte de una población infrarrepresentada en los ensayos clínicos de tratamiento para las arritmias cardíacas [1].
El grupo ¿Kidney Disease: Improving Global Outcomes¿ (KDIGO) ha desarrollado recientemente una Conferencia de Controversias Internacional y Multidisciplinar en la que trataron aspectos especiales en el manejo de la FA y la prevención de la muerte súbita en pacientes con ERC. El informe de la conferencia ha sido publicado en el European Heart Journal con el objetivo de aumentar la visibilidad de sus conclusiones, dirigiéndose así a un mayor número de lectores [2]. Las conclusiones más importantes se recogen a continuación, destacando especialmente las áreas de especial relevancia para los nefrólogos.
Fibrilación auricular: anticoagulación oral y terapias antiagregantes
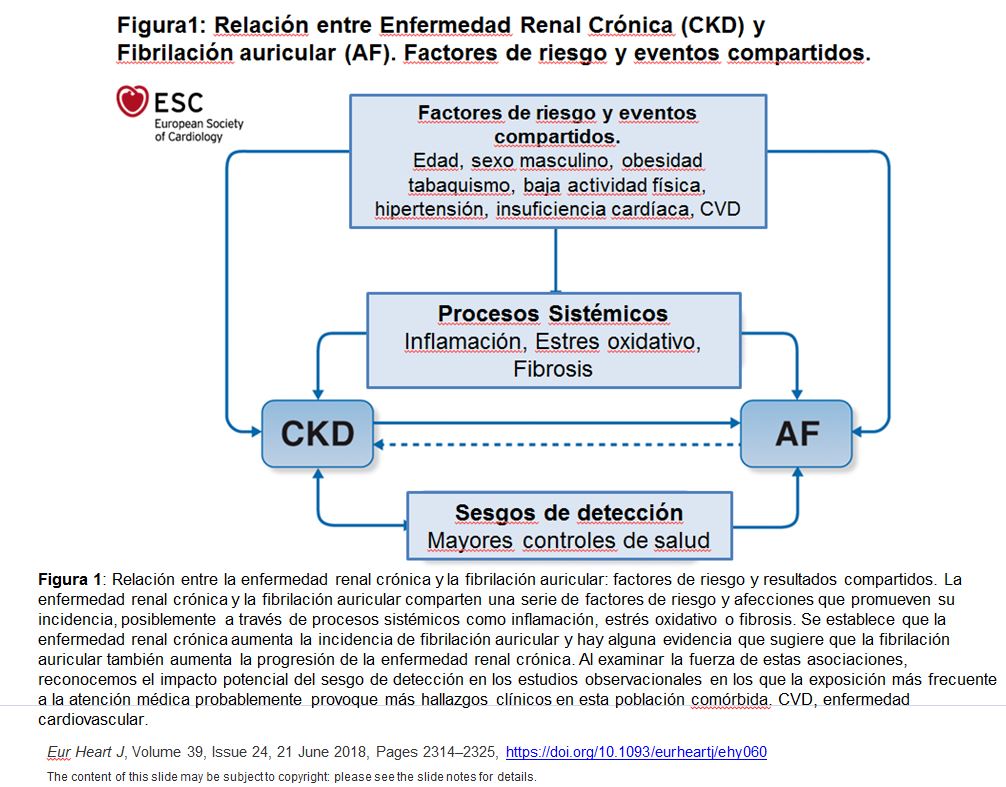
La fibrilación auricular es la arritmia crónica más frecuente, siendo asimismo más prevalente en pacientes con ERC: del 16% al 21% en pacientes con ERC-no en diálisis y de un 15% hasta un 40% en pacientes en diálisis. Ambos trastornos, la ERC y la FA, son a su vez factores de riesgo para el desarrollo de ictus, pero los mecanismos multifactoriales responsables del ictus y del tromboembolismo en los pacientes con ERC y FA aún no son bien conocidos. La FA puede comportarse como una causa directa de ictus cardioembólico, como marcador de riesgo de ictus isquémico y, más raramente, como una consecuencia derivada del propio ictus [3]. El grado de contribución de la FA como mediador de ictus en los pacientes con ERC, así como otros eventos relacionados con la FA en esta población, aún debe ser investigado.
El valor predictivo y la calibración de los índices de riesgo, ampliamente utilizados para la predicción de desarrollo de ictus en los pacientes en diálisis, son similares a los utilizados en la población general. El score CHA2DS2-VASc es el más recomendado para estratificar el riesgo en los pacientes con ERC [4]. Los estudios observacionales sugieren que se debe iniciar tratamiento con anticoagulantes orales (ACO) cuando la puntuación es ¿ 2, incluso en pacientes con ERC [5]. A pesar de que la mayoría de las guías clínicas no recomiendan el uso sistematizado de las escalas de riesgo de sangrado, se debe tener en cuenta el riesgo incrementado de hemorragia en los pacientes con ERC anticoagulados y no anticoagulados para guiar las decisiones terapéuticas.
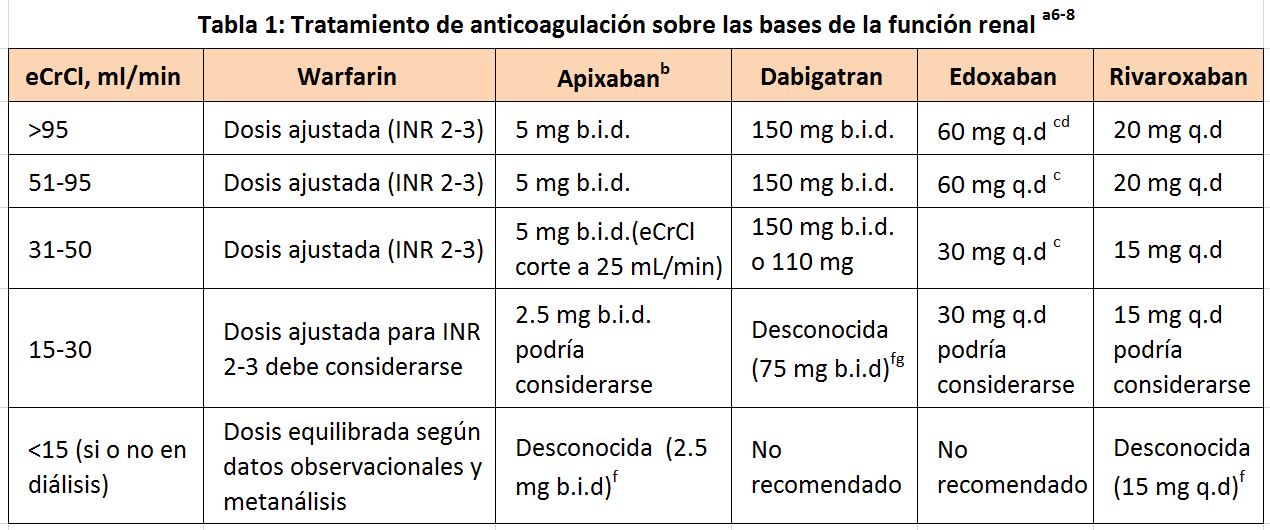
Los ensayos clínicos aleatorizados han establecido que los anticoagulantes de acción directa (ACOD) no son inferiores a la warfarina en los pacientes con aclaramiento de creatinina estimado por Cockroft-Gault de 30 a 50 mL/min (de 25 a 50ml/min para apixabán). El perfil de seguridad de estos fármacos es superior al de la warfarina. En los ensayos que compararon los ACOD con la warfarina, se demostró que los ACOD se asociaban con la reducción de un 50 % del riesgo de hemorragia intracraneal. Entre los pacientes con aclaramiento de creatinina estimado entre 25 y 50ml/min, el tratamiento con apixabán y edoxabán también demostró menos eventos hemorrágicos graves [6]. No existe suficiente evidencia para recomendar algún ACOD frente a otro en esta población, dado que no se han desarrollado estudios que los comparen directamente (Tabla 1).
No existen ensayos clínicos aleatorizados que examinen la eficacia ni la seguridad de la anticoagulación en pacientes con ERC y aclaramiento estimado < 30 mL/min, y no existe evidencia de suficiente calidad para recomendar la warfarina para la prevención del ictus en pacientes con FA y ERC en diálisis. Para reducir el riesgo de sangrado, se puede considerar reducir la dosis de apixaban (2.5 mg dos veces al día) o rivaroxabán (15 mg diarios) hasta que estén disponibles más datos sobre su seguridad. Se recomienda, para todos los pacientes con ERC y FA, la formación de equipos multidisciplinares para evaluar las decisiones sobre la anticoagulación en estos pacientes, recomendándose reevaluar anualmente los objetivos del tratamiento, así como el riesgo-beneficio del mismo.
Existe poca evidencia para recomendar la terapia antiagregante única o doble para la prevención del ictus/enfermedad tromboembólica en los pacientes con ERC estadios 4 a 5D con FA, incluso cuando el tratamiento anticoagulante no se considere indicado. Además, estos pacientes no deberían recibir tratamiento antiagregante y anticoagulante de forma concomitante, a no ser que estén indicados de forma específica por otros motivos. En los pacientes previamente anticoagulados que se hayan sometido recientemente a angioplastia coronaria con colocación de stent, se debe individualizar y minimizar la duración del tratamiento antiagregante, basándonos en otros factores de riesgo y en el tipo de stent utilizado.
Fibrilación auricular: control de ritmo versus control de frecuencia
Las indicaciones para optar por la estrategia de control de ritmo se asemejan a las de la población general (Figura 1). Los pacientes sin indicación clara de control de ritmo se deberían manejar con control de frecuencia. Independientemente de qué estrategia se considere, la anticoagulación deberá mantenerse basándose en el riesgo de ictus, salvo contraindicación. Deben señalarse algunas consideraciones especiales en las fases más avanzadas de la ERC, incluyendo la sintomatología y una propensión potencialmente mayor a desarrollar cardiomiopatía mediada por taquicardia, dada la elevada prevalencia de alteraciones estructurales cardiacas.
Si se persigue la estrategia de control de frecuencia, se debe conocer y valorar la farmacocinética y la depuración extracorpórea del fármaco en los pacientes en diálisis. La ablación del nodo auriculoventricular y la implantación de marcapasos es una opción a considerar cuando el tratamiento farmacológico aislado sea insuficiente, teniendo en cuenta que las complicaciones asociadas con la implantación de dispositivos por vía venosa central son elevadas en este tipo de pacientes.
La cardioversión eléctrica es el método más usado para restaurar el ritmo sinusal en los pacientes con FA persistente. Generalmente, la cardioversión aislada es insuficiente para mantener el ritmo sinusal por lo que suele ser necesario asociar fármacos antiarrítmicos al tratamiento, así como la ablación. El uso de antiarrítmicos es complejo en los pacientes con ERC por la disminución del aclaramiento renal, así como por el potencial arritmogénico en aquellos con cardiopatía estructural. La ablación con catéter es más eficaz que el tratamiento con antiarrítmicos para mantener el ritmo sinusal. En los pacientes con ERC y flutter auricular, la ablación por radiofrecuencia se considera una terapia de primera línea por su elevado éxito y por la baja tasa de complicaciones que presenta.
Muerte súbita cardíaca
El riesgo de muerte súbita cardíaca (MSC) es mayor en los pacientes en hemodiálisis comparados con otras poblaciones, representando hasta un 35 % de la mortalidad por todas las causas en los pacientes incidentes. La evidencia en cuanto a los mecanismos eléctricos y hemodinámicos que subyacen en la muerte súbita es limitada. Han sido reconocidos factores de riesgo para MSC en los pacientes en diálisis, pero son necesarios más estudios para identificar dianas de intervención.
Los datos recogidos sobre el uso de desfibriladores implantables (ICD) en la prevención secundaria muestran algunos beneficios, aunque se necesitan más estudios para evaluar el riesgo-beneficio de esta terapia a largo plazo. La implantación de ICD en prevención primaria está indicada en pacientes con fracción de eyección del ventrículo izquierdo (FEVI) ¿ 35 %, pero no existen datos sobre la utilidad del ICD en pacientes en diálisis con FEVI >35 %. Los datos disponibles sugieren que el beneficio obtenido con la implantación de estos dispositivos disminuye conforme progresa la insuficiencia renal. Los desfibriladores subcutáneos se podrían asociar con complicaciones menos frecuentes y menos graves, pero son necesarios más estudios para evaluar este procedimiento, así como el uso de desfibriladores automáticos portátiles (chaleco desfibrilador) y otros similares (incluyendo los marcapasos sin cables).
Potasio y equilibrio hídrico
Tanto la hiperpotasemia como la hipopotasemia se han asociado con un aumento del riesgo de mortalidad cardiovascular y por todas las causas en los pacientes en diálisis crónica. Los cambios abruptos en la concentración de potasio en los pacientes en hemodiálisis pueden contribuir a la mayor mortalidad y la necesidad de hospitalización de estos pacientes. Por el contrario, la hipopotasemia es más frecuente en los pacientes en diálisis peritoneal y se ha asociado con un aumento del riesgo de mortalidad cardiovascular y por todas las causas, así como un aumento de la mortalidad por causa infecciosa.
En los pacientes en hemodiálisis, tanto la concentración de potasio en el baño de diálisis como la pauta semanal de tratamiento modifican el riesgo de sufrir MSC. Los estudios al respecto indican que la utilización de baños con potasio bajo (< 2 mEq/L) se asocia con una mayor incidencia de muerte súbita [2].
La corrección rápida de la acidosis, la baja concentración de calcio en el líquido de diálisis y las tasas de ultrafiltración elevadas también pueden contribuir a aumentar el riesgo arritmogénico cuando se utilizan baños con potasio < 2 mEq/L.
Las tasas de ultrafiltración >10mL/kg/h se han asociado con mayor riesgo de hipotensión intradiálisis y un incremento de la mortalidad. El estrés hemodinámico que se produce durante la diálisis se asocia además con aturdimiento miocárdico, lo que puede promover disminución de la contractilidad segmentaria y disfunción sistólica. Es posible que la individualización de los parámetros de la pauta de diálisis pueda reducir el riesgo de MSC y de arritmias no fatales, aunque esta estrategia no ha sido evaluada y podría ser difícil de implementar de forma generalizada.
Dada la alta prevalencia de arritmias y la falta de estudios relevantes al respecto en los pacientes con ERC, los especialistas en Nefrología y Cardiología deberían formar equipos multidisciplinares para coordinar la atención y el manejo de estos pacientes. Una conclusión fundamental de la Conferencia ha sido poner de manifiesto la necesidad de diseñar ensayos clínicos aleatorizados incluyendo pacientes con ERC para proponer mejores estrategias de tratamiento en esta población.
Disclosure
CW declared having received consultancy fees from Boehringer Ingelheim, Glaxo Smith Kline, and Sanofi Genzyme; speaker honorarium from Boehringer Ingelheim, Merck Sharpe & Dohme, and Sanofi Genzyme; and research support from Sanofi Genzyme. CAH declared having received consultancy fees from AbbVie, FibroGen, KBP Biosciences, OxThera, and Relypsa; equity ownership/stock options on Boston Scientific, Bristol-Myers Squibb, General Electric, Johnson & Johnson, and Merck; and research support from Amgen, National Institutes of Health, Relypsa, and Zoll. CAH also expects future consultancy roles from AstraZeneca, Boehringer Ingelheim, Corvidia, and Sanifit. MPT declared having received consultancy fees from Abbott, iBeat, iRhythm, Medtronic, and Precision Health Economics; equity ownership/stock options on AliveCor and iBeat; speaker honorarium from Abbott and Medtronic; and research support from American Heart Association, Apple, Cardiva Medical, and Veterans Health Administration.
SUPPLEMENTARY MATERIAL (pendiente)
Figure S1. Algorithm for decision-making about rate control versus rhythm control in chronic kidney disease (CKD).
Supplementary material is linked to the online version of the paper at www.kidney-international.org.