Insuficiencia cardiaca en la ERC (2019)
La incidencia y prevalencia de la insuficiencia cardíaca (IC) y la enfermedad renal crónica (ERC) están aumentando y, como tal, una mejor comprensión de la interfaz entre ambas condiciones es imprescindible para desarrollar estrategias óptimas para su detección, prevención, diagnóstico y manejo. Con este fin, KDIGO convocó una Conferencia de Controversias internacional y multidisciplinaria titulada Insuficiencia cardíaca en la ERC. Las discusiones grupales incluyeron (i) IC con fracción de eyección preservada (IC-FEc) y ERC no en diálisis, (ii) IC con fracción de eyección reducida (IC-FEr) y ERC no en diálisis, (iii) IC-FEp y ERC dependiente de diálisis, (iv) IC-FEr y diálisis dependiente de ERC y (v) IC en pacientes con trasplante renal. Las preguntas que formaron la base de las discusiones están disponibles en KDIGO website http://kdigo.org/conferences/heart-failure-in-ckd/, and the deliberations from the conference are summarized here. Kidney International (2019) 95, 1304-1317; https://doi.org/10.1016/ j.kint.2019.02.022.
KEYWORDS: cardiovascular disease; chronic kidney disease; congestive heart failure; hemodialysis; transplantation Copyright ª 2019, The Authors. Published by Elsevier Inc. on behalf of the International Society of Nephrology. This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
Correspondence: Andrew A. House, Division of Nephrology, Department of Medicine, Western University and London Health Sciences Centre, 339 Windermere Road, London, Ontario, Canada N6A 5A5. E-mail: andrew. house&lhsc.on.ca or Peter A. McCullough, Department of Cardiology, Baylor Heart and Vascular Institute, 621 N. Hall Street, Suite H030, Dallas, Texas 75226, USA. E-mail: peteramccullough&gmail.com 25See Appendix for list of other conference participants.
Receive d 4 December 2018; revised 13 February 2019; accepted 21 February 2019; published online 30 April 2019
Insuficiencia cardíaca (IC) y enfermedad renal crónica (ERC) representan enfermedades crónicas epidémicas concurrentes [1] [2]. Ambas condiciones han aumentado su incidencia y prevalencia en los grupos de mayor edad así como en personas con hipertensión, diabetes u otros factores de riesgo renovasculares (3). La presencia de una condición parece acelerar la presentación y progresión de la otra, teniendo ambas condiciones un riesgo aumentado de hospitalización, rehospitalización, necesidad de cuidados intensivos o terapia renal sustitutiva, y muerte [4] [5] [6] [7] [8] [9]. Además, pacientes con IC y ERC pueden fallar en responder a terapias convencionales o aumento del riesgo de toxicidad a ellas [10] [11].
Definición, patofisiología y epidemiología
Las guías de las Sociedad Europea de Cardiología para el manejo de la IC lo definen sobre las bases de síntomas y signos debidos a anormalidades en la estructura y función cardíaca, resultando en una reducción del gasto cardiaco y/o una elevada presión intracardiaca en reposo o durante el estrés [12]. Los subgrupos de IC incluyen: IC con fracción de eyección conservada (=50%) (IC-FEc), con fracción de eyección reducida (<40%) (IC-FEr); y de rango medio (40-49%) (IC-FErm). Algunas condiciones comórbidas suponen un reto diagnóstico, tales como la ERC y la enfermedad renal terminal (ERT), así como la retención hidrosalina también contribuye a las manifestaciones de IC [13].
ERC es definida sobre la base de un descenso persistente del filtrado glomerular estimado (FGe) menor 60 ml/min/1,73 m2 o al menos un signo de daño renal superior a 3 meses [14]. Los signos de daño renal incluyen albuminuria, sedimento urinario anormal, y alteraciones estructurales o histológicas. La IC como síndrome primario puede experimentar ERC secundaria, y viceversa, o ambos pueden coexistir sobre las bases de factores de riesgo compartidos o desórdenes sistémicos. La distinción de cual enfermedad es primaria o cual es secundaria, pude ser un reto.
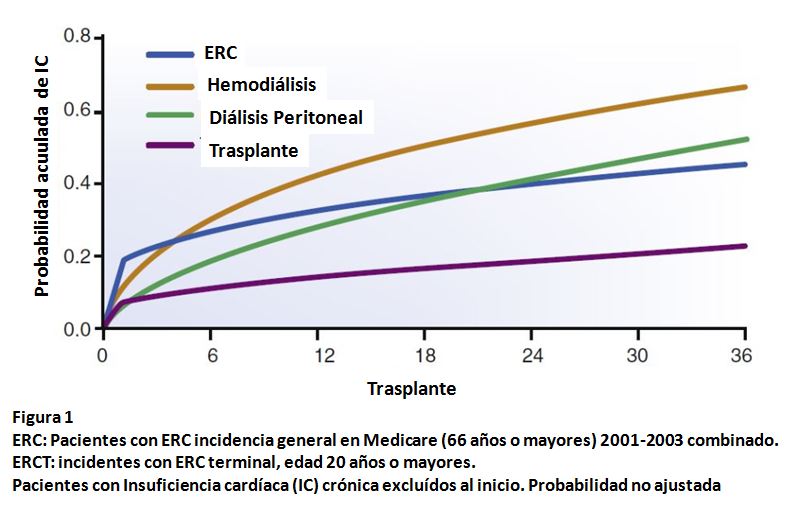
La incidencia de IC de novo en casos de ERC conocida esta en el rango del 17 al 21% [15]. La aparición de IC varía dependiendo del grado de ERC y de la modalidad del tratamiento sustitutivo renal, incluyendo el trasplante (Figura 1). El FGe descendido se asocia a incremento del riesgo de mortalidad de todas las causas, mortalidad cardiovascular, y hospitalización en pacientes con IC-FEc y IC-FEr [16] [17] [18]. La albuminuria elevada es un factor pronóstico de IC, aunque en menor grado que el FGe reducido. Ambos, descenso del FGe y albuminuria, pueden favorecer el desarrollo de IC. De esta forma, IC y ERC ocurren en un modo bidireccional con considerable solapamiento.
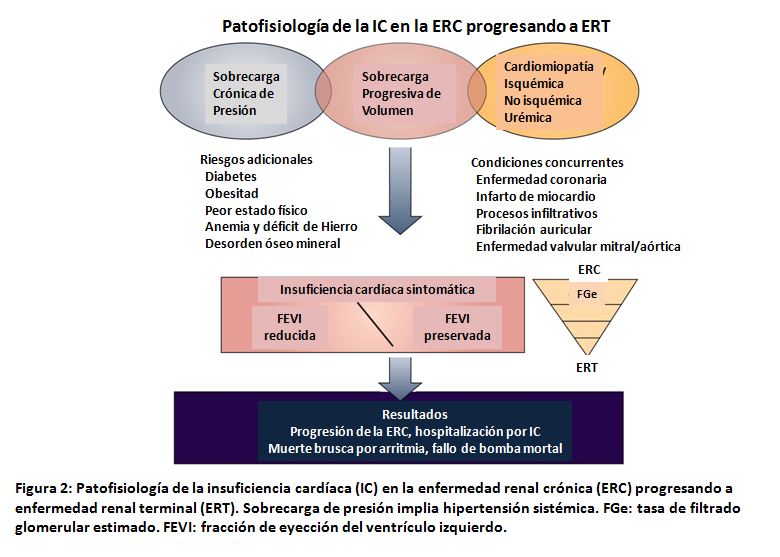
Un amplio metaanálisis de pacientes con IC-FEc y IC-FEr encontró que el 55% de ambos grupos tenías ERC G3a o mayor FGe< 60 ml/min/1,73 m2); con un incremento escalonado del riesgo de mortalidad según del estadio de ERC [19]. El incremento de severidad de ECR se asocia a mayor prevalencia de IC. Una estimación muestra que el 44% de los pacientes en hemodiálisis tienen IC (10% con IC-FEc, 13% con IC-FEr, y 21% no especificada) [20]. La fisiopatología compleja e integrada se ilustra en la Figura 2. En pacientes con ERC y ERC terminal, los factores de riesgo de IC incluyen hipertensión de largo tiempo, con peor control conforme empeora la ERC; retención hidrosalina causando excesiva sobrecarga, y factores cardiomiopáticos incluyendo hipertrofia ventricular izquierda y fibrosis.
Además, hay factores específicos de la ERC y ERC terminal que afectan la postcarga (aumento de la rigidez arterial, elevado gasto por las fístulas arteriovenosas o las prótesis vasculares) así como factores independientes de la carga (activación neurohormonal, mala utilización del hierro, anemia, isquemia, factores profibróticos [factor fibroblástico 23), inflamación, etc. [21].Las fístulas arteriovenosas y las prótesis afectan de forma desfavorable la hipertrofia del VI, aumentan la presión pulmonar, favorecen la dilatación del ventrículo derecho y reducen la función ventricular derecha, todos ellos relacionados con la supervivencia [22] [23].
La asociación de ERC con mortalidad en pacientes con IC-FEr es independiente de la edad, de la clase funcional, niveles de hemoglobina o diabetes [18]. Pacientes con ERC tienen menos probabilidades de recibir tratamiento médico recomendado por las guías, probablemente por la asociación frecuente con hipotensión, daño renal e hiperpotasemia [24]. La epidemiología de la IC-FEc parece diferir de la IC-FEr, donde dos tercios de los casos en la población general se deben a cardiopatía isquémica y los restantes a cardiopatía idiopática y/o no isquémica. En los pacientes con IC-FEc parece ser más relevante la influencia de la edad, obesidad, diabetes y peor condición física [25]. En aproximadamente el 25% de los casos de IC-FEc en la población general, hay isquemia cardíaca sobreimpuesta, sin embargo, su rol en el desarrollo de IC-FEc es desconocido [26] [27]. La mortalidad por cualquier causa en IC-FEc con ERC es elevada [16] [17] [28].
Diagnóstico
No hay definiciones o criterios aceptados para el diagnóstico de IC en la ERC, y la sobrecarga de volumen intra y extravascular, pueden ocurrir en ausencia de enfermedad cardíaca estructural, especialmente en pacientes en diálisis. El ecocardiograma puede ayudar al diagnóstico de IC proporcionando información de los volúmenes de las cámaras, función ventricular sistólica y diastólica, grosor de la pared, función valvular y presión de llenado [12].
IC-FEc en ERC no en diálisis
Así como en la población general sin ERC, el diagnóstico de IC-FEc en pacientes con ERC no en diálisis es difícil y debería ser avalado por múltiples medidas objetivas incluyendo la evaluación de la función cardíaca en reposo y tras el ejercicio. Debería realizarse una evaluación ecocardiográfica aplicando la gradación de la función diagnóstica propuesta por la Sociedad Americana de Ecocardiografía (grados 1-4). Biomarcadores como el péptido natriurético B (BNP) o el pro-BNP N-terminal tienen un elevado valor predictivo negativo [29]. El efecto del empeoramiento del FGe sobre los niveles de BNP y especialmente pro-BNP N-terminal se relaciona con aclaramiento renal empeorado y anormalidades cardíacas subyacentes [30] [31].
La obesidad puede dar lugar a niveles ligeramente más bajos de BNP y pro-BNP N-terminal en pacientes con IC [32]. La cistatina C puede aportar mejor estimación del FGe que la creatinina debido a su relativa independencia que el músculo, el hígado y la dieta afectan a la creatinina. Los biomarcadores pronósticos incluyen el péptido natriurético, troponinas cardíacas, ST2 soluble (Suppressor of Tumorgenicity 2), y la galectina-3 [33]. Los biomarcadores son complementarios, con valor pronóstico y pueden orientar al fenotipo de la IC. En pacientes críticos, la valoración hemodinámica invasiva, incluyendo la medición de la presión en la arteria pulmonar, presión capilar pulmonar, gasto cardíaco, y presión de fin de diástole del VI, pueden ser necesarios para distinguir la IC-FEc de otros diagnósticos tales como alteraciones asociadas a la obesidad, hipertensión pulmonar primaria, alto gasto cardíaco por shunt arteriovenoso y enfermedad pulmonar. El test de estrés cardiopulmonar con determinación de pico de consumo de oxígeno puede ser de ayuda adyuvante para valorar objetivamente el grado de empeoramiento funcional y discernir entre disnea cardíaca y pulmonar.
IC-FEr en ERC no en diálisis
El diagnóstico de IC-FEr en los pacientes con ERC no en diálisis es semejante al aplicado a la población sin ERC. La monitorización de la IC-FEr en la ERC incluye los estándares de cuidado: análisis de sodio, potasio, creatinina (FGe), cociente albúmina-creatinina, BNP o pro-BNP N-terminal, troponina I o Y, ST2, y galectina-3. Asimismo, como en la IC-FEc, algunos casos seleccionados pueden justificar mediciones fisiológicas avanzadas tales como presión en la arteria pulmonar y/o técnicas de bioimpedancia. Cambios hemodinámicos pueden ser detectados en el examen físico, radiografía de tórax ecografía pulmonar.
IC-FEc o IC-FEr en pacientes en diálisis
En pacientes en diálisis, los síntomas típicos de IC, tales como disnea paroxística nocturna, ortopnea, disnea, cansancio, ascitis y edemas pueden ser intermitentes. Es importante considerar otras causas de disnea, tales como enfermedad pulmonar obstructiva crónica, hipertensión pulmonar, anemia o apnea obstructiva del sueño. La Acute Dialysis Quality Initiative ha propuesto una clasificación funcional para los síntomas de IC en pacientes con ERC terminal [34]. Los pacientes en diálisis con IC deberían ser evaluados como pacientes con IC no en diálisis. Sin embargo pueden ser subsidiarios de condiciones adicionales.
Radiografía de tórax
En conjunto, los signos radiológicos son específicos, pero solo moderadamente sensibles en el diagnóstico de IC [35]. La radiografía de tórax puede ser usada para explorar otras causas de disnea, tales como anormalidades pulmonares o diafragmáticas. Dada la alta tasa de neumonía en las hospitalizaciones agudas de enfermos con ERC terminal, la radiografía de tórax es prudente. La resolución rápida de los hallazgos radiográficos de infiltrados intersticiales después de la diálisis y/o ultrafiltración, apoyan la sobrecarga de volumen extracelular como causa de los signos y síntomas de IC, pero si este es el resultado de anormalidades cardiacas estructurales o funcionales pueden ser necesarios test diagnósticos adicionales.
Ecocardiograma
La medición de la fracción de eyección e hipertrofia del VI, fracción de eyección del ventrículo derecho, dimensiones de las cámaras cardíacas, y la función valvular son fundamentales para el manejo de la ERC terminal. Aproximadamente el 87% de los pacientes con ERC terminal tienen un ecocardiogrma anormal antes de iniciar diálisis [36]. Cuando sea posible, las imágenes deberían ser tomadas cuando el paciente esté próximo a su peso seco, y preferiblemente en el día entre diálisis. Además, de una fracción de eyección del VI reducida, indicadores de disfunción del VI incluyen un índice de fin de diástole >86 ml/m2 o volumen sistólico > 37 ml/m2.
Electrocardiograma
La electrocardiografía puede ser usada para detectar alteraciones del ritmo, daño miocárdico previo o enfermedad pericárdica. En escenarios clínicos específicos, la evaluación puede complementarse con imágenes obtenidas por resonancia magnética, análisis de la deformación global del ventrículo izquierdo, técnicas de bioimpedancia de cuerpo total, y monitorización extendida del ritmo cardiaco a través de monitores implantables. Opciones diagnósticas emergentes incluyen la monitorización ambulatoria de la arteria pulmonar y la impedancia torácica. En el ámbito de la diálisis, el rol de los péptidos natriuréticos es confuso [37]. La aparición reciente de IC-FEr en pacientes en diálisis debería rápidamente estratificarse para una etiología isquémica o no isquémica. La revascularización en pacientes con IC-FEr en la población general ha proporcionado resultados para una década [38] pero no hay datos para pacientes con ERC terminal.
Tratamiento
Prevención de la incidencia de IC
Control de la hipertensión y la glucemia
El adecuado control de la tensión arterial (TA), definido como TA sistólica < 120 mmHg, reduce la incidencia de IC con FE ¿35%, aún en presencia de ERC [39] [40]. En el estudio RENAAL (Reduction in End Points in Non-insulin dependent diabetes mellitus with the Angiotensin II Antagonist Losartan) se observó una reducción del riesgo de primera hospitalización por IC del 32% en el grupo de pacientes con losartan versus el grupo placebo [41].
En pacientes con ERC y diabetes, el mal control glucémico es un factor de riesgo de IC [42]. En particular los inhibidores del cotrasportador 2 sodio-glucosa ha sido demostrado que no solo retrasan la progresión de la ERC sino también el riesgo de hospitalización por IC en pacientes con o sin historia de IC [43] [44].
En el estudio EMPA-REG OUTCOME (BI 10773 [Empagliflozin] Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients), la empaglifozina resultó en una reducción del riesgo de hospitalización del 39%, en pacientes con diabetes tipo 2 y ERC G3a o mayor, y/o cociente albumina/creatinina >300 mg/g [45] [46]. Un efecto similar fue observado con la canaglifozina [47] y la dapaglifozina [48]. No queda claro si el control glucémico ha tenido un efecto directo en la prevención de la IC, como si los inhibidores del cotrasportador 2 sodio-glucosa también reducen la TA y el peso corporal, aumentan la diuresis y tienen un fuerte efecto "off-target" (no deseado o no intencionado) sobre el intercambiador Na+/H+ cardiaco [49].
Tratamiento de la IC existente
No hay tratamientos demostrados para el manejo de la IC-FEr, incluido en el contexto de la ERC [50]. Los siguientes medicamentos pueden reducir los efectos adversos de la IC-FEr: inhibidores de la enzima de conversión de la angiotensina (IECA) [51], bloqueantes de los receptores de la angiotensina II (ARA), inhibidor de angiotensina neprisilina, beta bloqueantes y antagonistas del receptor de los mineralcorticoides (MRAs) [52]. Sin embargo, no se puede asumir que drogas con eficacia probada en IC-FEr aporten los mismos beneficios en la IC-FEc [51] [52] [53] [54] [55].
Aunque las estrategias para el tratamiento de la IC son las mismas en pacientes con y sin ERC, esta situación debe tener consideraciones especiales, particularmente en pacientes con FGe 2,5 mg/dl), que han sido excluidos de los ensayos clínicos, y en los que el riesgo de toxicidad puede complicar significativamente el tratamiento. El tratamiento de la IC-FEr puede causar variaciones en el FGe, así cuando el FGe cae por debajo de 60 ml/min (ERC G3a mayor) puede no estar claro si estamos frente a ERC real, o un deterioro transitorio debido a factores hemodinámicos y neurohumorales. Además, los niveles de creatinina no solamente reflejan la función renal, complicando así la interpretación de los valores de FGe. En este sentido, la medición de los niveles de cistatina C pueden ayudar en la interpretación de la variabilidad de los valores de creatinina. Es probable que biomarcadores del daño renal real junto a los marcadores funcionales sean importantes en el futuro. La identificación del daño renal real versus la azotemia transitoria podría ayudar en las decisiones del uso de diuréticos y otros agentes.
Beta bloqueantes
El estudio Metoprolol CR/XL Randomized Intervention Trial in Chronic HF (MERIT-HF) asignó aleatoriamente a pacientes sintomáticos con IC-FEr a metoprolol o placebo, e incluyó pacientes con FGe 60 ml/min/1,73 [56]. Un análisis similar fue realizado en el CIBIS-II (Cardiac Insufficiency Bisoprolol Study II) Study, el cual incluyó pacientes con niveles de creatinina superiores a 300 mmol/l (3,4 mg/dl) y demostró beneficios del bisoprolol en aquellos con deterioro renal [57]. Un pequeño estudio de carvedilol en pacientes en diálisis y IC-FEr también confirió beneficios de supervivencia [58]. Por lo tanto, parece razonable usar beta bloqueantes en el manejo IC-FEr en pacientes con ERC, excepto para aquellos que tengan significativa excreción renal tales como el atenolol, nadolol o sotalol [59]. El atenolol puede ser usado como parte del manejo de la hipertensión y enfermedad coronaria, prescribiéndolo 3 veces en semana en pacientes en diálisis, durante la sesión de hemodiálisis [60]. Consideraciones adicionales merece el caracter dializable de ciertos beta bloqueantes, tal que el grupo tratado con beta bloqueantes altamente dializables como el metoprolol, un 1,4 veces el incremento del riesgo de mortalidad [61].
Agentes bloqueantes de la angiotensina
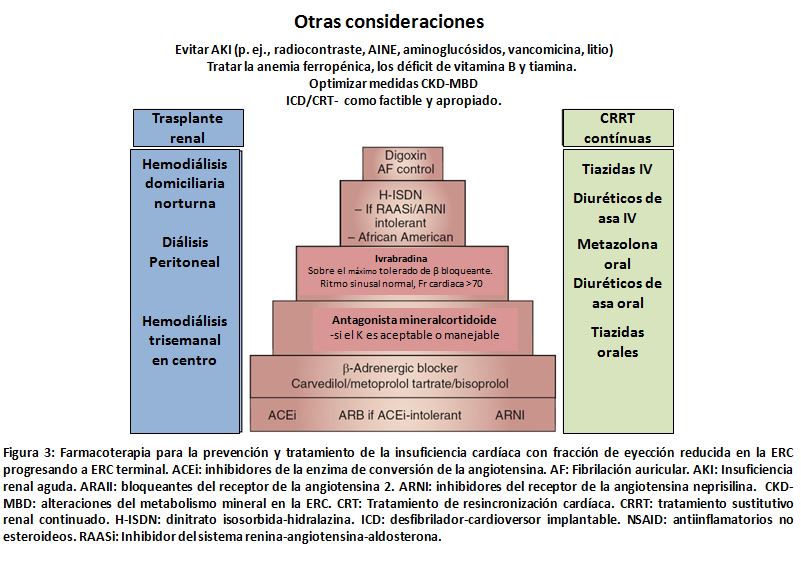
Ambos, los inhibidores de la enzima de conversión de la angiotensina (IECA) como los antagonistas del receptor de la angiotensina (ARA) pueden inducir un deterioro del FG en pacientes con IC-FEc o IC-FEr. En pacientes con IC-FEr, el beneficio de estos agentes en términos de mortalidad y otros importantes desenlaces se mantiene [62]; sin embargo, estudios observacionales en pacientes con IC-FEc y empeoramiento de la función renal debido a IECA o ARA han mostrado mayor riesgo de mortalidad sin mejora en los desenlaces [63] [64], aunque estos resultados no han sido consistentes [65]. Los ARA deben ser considerados para pacientes con intolerancia a los IECA. El estudio Survival And Ventricular Enlargement (SAVE) que compare captopril vs placebo post infarto de miocardio reclutó pacientes con IC-FEr y creatinina sérica > 2,5 mg/dl al inicio, de los cuales aproximadamente 1/3 y 1/10 de los pacientes tenía FGe < 60 ml/min/1,73, respectivamente. La superioridad del captopril se mantuvo en pacientes con ERC [66]. Otros ensayos de IECA y ARA reportaron resultados similares en pacientes con ERC G3a e IC-FEr [67]. El inhibidor del receptor angiotensina neprilisina LCZ696 también ha demostrado efectos hemodinámicos favorables para preservar el FG, con un estudio reportando menor perdida de FGe en pacientes con IC-FEc, comparando LCZ696 versus valsartán, después de 36 semanas de tratamiento [67]. Sin embargo, el cociente albumina/creatinina aumentó con LCZ696 versus valsartan. La (Figura 3) ilustra respecto al tratamiento individualizado de la IC en la ERC. La azotemia sola en el contexto de diuresis no debería necesariamente resultar en cambios o retirada de IECA o ARA, debido a que su supresión puede empeorar los desenlaces [69] [70].
Diuréticos
Los diuréticos tiazídicos son un pilar en el control de la TA en la población general y los diuréticos del asa en el contexto de la ERC. Es importante tener presente en pacientes hospitalizados por IC descompensada el uso dos veces al día de diuréticos de asa orales: dosis, duración o el cambio de pauta oral a IV. El incremento de dosis de furosemida y perfusiones continuas pueden ser empleadas para aliviar la congestión. El estudio Diuretic Optimization Strategies Evaluation (DOSE-AHF) ha demostrado que una estrategia de alta dosis podría mejorar la disnea, los cambios de peso y la pérdida neta de liquido en 72 hs, mientras que el grupo de baja dosis fue menos probable revertir a dosis oral, y necesitar incremento de dosis. Hubo un incremento precoz de creatinina de 0,3 mg/dl en el grupo de alta dosis, pero sin diferencias apreciables en la función renal a los 60 días en los grupos de estudio [71]. La torasemida puede tener ventaja sobre la furosemida, con mayor vida media, mayor biodisponibilidad y potencial reducción de la fibrosis miocárdica [72] [73], pero esto requiere confirmación.
MRAs (antagonistas del receptor de los mineralcorticoides)
En pacientes con IC y ERC G3a-G3b, MRAs son igual de eficaces que en pacientes sin ERC [74], pero los ensayos de MRAs en pacientes con IC, han excluído sistemáticamente a enfermos con ERC más avanzada. Por ejemplo, el estudio Randomized Aldactone Evaluation Study (RALES) examinó pacientes con FE 2,5 mg/dl o potasio serico > 5.0 mEq/l [75]. Sin embargo, un grupo amplio de pacientes en el estudio RALES tenían FGe 60 mil/min/1,73 m2 [76], aunque aquellos tuvieron con más frecuencia hiperpotasemia, reducción del FGe > 30%, y necesidad de reducción o discontinuación de dosis. Resultados similares se demostraron con eplerenona [67]. Los datos del uso de MRAs para el tratamiento de la IC (IC-FEr o IC-FEc) en pacientes con ERC G4-G5 o en diálisis son limitados [77]. Un estudio observacional identificó un aumento significativo ajustado del riesgo de muerte u hospitalización por IC en pacientes con CKD G5 tratados con espironolactona [78].
Un ensayo clínico aleatorizado en desarrollo (RCT) actualmente, de espironolactona en pacientes con IC-FEr en hemodiálisis podrá aportar información práctica en el futuro (ClinicalTrials.gov identifier: NCT01848639). En un estudio de pacientes con IC-FEr y diabetes tipo 2 y/o ERC G3a, fueron randomizados a 5 diferentes dosis de finerenona (MRA no esteroideo) versus eplerenona. Los pacientes randomizados a dosis más altas de finerenona experimentaron un descenso del "endpoint" secundario compuesto de muerte, hospitalización cardiovascular o frecuentación de urgencias por empeoramiento de la IC sin empeoramiento de la hiperpotasemia o función renal [79]. Sería muy importante confirmar estos prometedores resultados en series amplias con ERC G4.
Hiperpotasemia
Debido a la elevada preocupación que despierta la hiperpotasemia, hay una subutilización y discontinuación de los inhibidores del SRAA (IECA, ARA) en pacientes con IC y ERC [69] [80]. En un pequeño estudio de pacientes con ERC e IC, que fueron hiperpotasémicos y recibían IECA, 4 semanas de tratamiento con patiromer condujo a una reducción de 1,06-0,05 mEq/l del K serico y menores tasas de recurrencia de hiperpotasemia, comparado con placebo [81]. En otro estudio que incluyó 69% de pacientes con FGe < 60 ml/min, tras 48 hs de tratamiento abierto con ciclosilicato de sodio y zarconio resultó en normopotasemia en el 98% de los pacientes. En un posterior estudio, los niveles séricos de potasio fueron significativamente más bajos durante 8-29 días de tratamiento con este producto [82]. La aparición de edemas fue observada con el empleo de altas dosis (15 gr) [82] [83]. No está demostrado que el control farmacológico de los niveles de K faciliten la mayor utilización de IECA/ARA y MRA, resultando en beneficio para la IC o la ERC. También se desconoce si el descenso deliberado de los niveles de K, sería útil o peligrosos en el contexto de la IC. Se ha sugerido que los MTA pueden ser beneficiosos debido al aumento de los niveles séricos de K, mientras otros argumentan que los niveles elevados de K producen un aumento compensatorio de la aldosterona, lo cual está implicado en la fisiopatología de la IC y la ERC. Sólo ensayos clínicos prolongados determinarán si la reducción de K es beneficiosa en este contexto.
Dispositivos de asistencia ventricular izquierda
La disfunción renal es común en pacientes remitidos para dispositivos de asistencia ventricular (MCS), y no se dispone de test diagnósticos para diferenciar las formas reversibles, de las irreversibles de fallo renal. Aunque la mayoría de pacientes, incluyendo aquellos con fallo renal, experimentan una mejoría precoz de la función renal con MCS, esa mejoría es con frecuencia transitoria [84]. La congestión venosa, la disfunción ventricular derecha, y la reducida pulsatilidad son mecanismos potenciales de la reaparición del deterioro renal después de la implementación de MCS, Aunque no hay métodos de elección en el tratamiento sustitutivo renal, en pacientes con MCS, la diálisis peritoneal aporta ventajas en estos caos; y en casos de IC sin MCS con ultrafiltración diaria sostenida, proporcionando menos volumen de precarga, accesibilidad en casa, y reducido costo. Los pacientes con ERC terminal con dispositivos de asistencia ventricular tienen significativamente peores desenlaces que aquellos sin ERC terminal [85].
Abordajes adicionales emergentes
Aspectos como mejorar el diagnóstico y tratamiento de la apnea del sueño, manejo nutricional, actividad física, restricción de sodio (y posiblemente de líquidos), y valoración de la incompetencia cronotrópica pueden ser de ayuda para reducir los síntomas y mejorar la funcionalidad de los pacientes con IC y ERC. En el contexto de la fibrilación auricular, el control de la frecuencia y la cardioversión son estrategias razonables.
TRATAMIENTO DE LAS ALTERACIONES RELACIONADAS CON LA ERC
Deficiencia de hierro y anemia
Los agentes estimulantes de la eritropoyesis no tienen efecto sobre la prevención o tratamiento de la IC en pacientes con ERC [80] [86]. Para pacientes con IC crónica y déficit de hierro, con o sin anemia, el tratamiento con carboximaltosa férrica mejora los síntomas, la capacidad funcional, y la calidad de vida [87]. En el estudio CONFIRM-HF (Ferric CarboxymaltOse evaluatioN on perFormance in patients with IRon deficiency in coMbination with chronic Heart Failure) de pacientes con FE < 45%, el tratamiento del déficit de hierro con carboximaltosa férrica durante más de 1 año, se asoció a una reducción significativa del riesgo de hospitalización por empeoramiento de la IC [88]. En el estudio FAIR-HF (Ferinject Assessment in patients with IRon deficiency and chronic Heart Failure) en pacientes con IC y déficit de hierro, el tratamiento con carboximaltosa férrica se asoció a incremento del FGe, comparado con placebo [89]. Un reciente metaanálisis demostró que la hospitalización por IC y la mortalidad fueron significativamente menores en el grupo tratado con hierro, de los cuales más del 40% tenía FGe menor de 60 ml/min/1,73 m2 y déficit de hierro (ferritina sérica < 100 mg/l, o índice de saturación de la transferrina < 20%) independiente de los niveles de hemoglobina [90]. Pacientes con IC y ERC pueden ser considerados para recibir hierro parenteral dada la seguridad comprobada en pacientes con ERC avanzada [91]. Los inhibidores del factor inducible de hipoxia prolilhidroxilasa están siendo evaluados para el tratamiento de la anemia en la ERC, hay datos que sugieren un posible rol en la prevención o atenuación de la isquemia cardíaca [92].
Alteraciones minerales y óseas
La información de ensayos clínicos es muy limitada, el tratamiento con cinacalcet se ha asociado a una modesta reducción del tiempo del primer episodio de IC en pacientes en hemodiálisis [93].
Macro y micronutrientes
Una ingesta adecuada de proteínas, aminoácidos esenciales, ácidos grasos esenciales, es deseable para mantener el tejido magro. Asimismo, un adecuado nivel de micronutrientes, incluyendo agua, vitaminas liposolubles, oligoelementos, y cofactores también se considera relevante.
Modalidad de diálisis
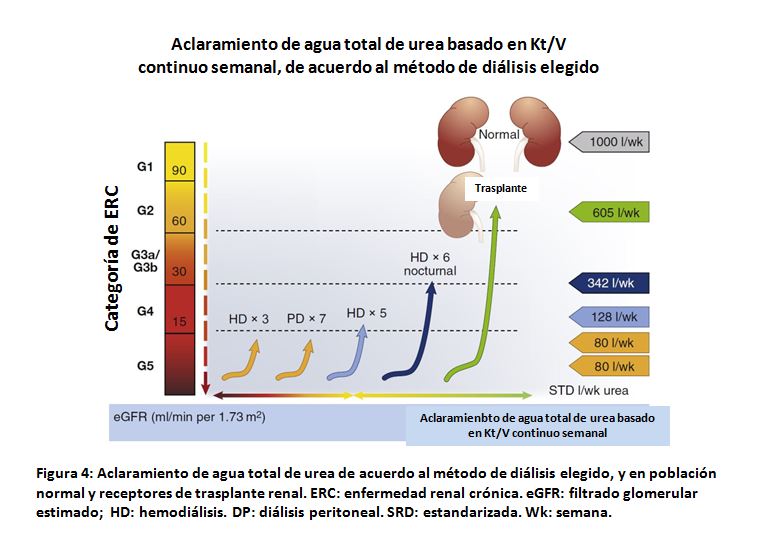
No hay estudios de intervención que empleen la IC-FEr o IC-FEc como eventos en la población en diálisis. Hasta la fecha, no ha sido posible randomizar pacientes según la modalidad de diálisis [94]. Aumentar la frecuencia de las sesiones de diálisis, así como las sesiones diarias cortas, reducen la masa VI y descienden el riesgo de hospitalización y de muerte cardiovascular [95]. Pacientes en programa de hemodiálisis domiciliaria tienen menor riesgo de hospitalización por IC y mortalidad cardiovascular (41% menor riesgo de IC, sobrecarga de volumen y cardiomiopatía) [95]. Como se muestra en la Figura 4, la hemodiálisis domiciliaria nocturna, 6 veces en semana es la siguiente mejor opción, después del trasplante renal y el normal funcionamiento renal. Estos beneficios, son yuxtapuestos a un mayor riesgo de daño en el acceso vascular e infección debida a hospitalización [96]. El daño isquémico recurrente inducido por la diálisis está asociado a anormal motilidad de la pared y el desarrollo y empeoramiento de la IC [97], por lo que condiciones asociadas al tratamiento dialítico mismo, pueden influir en la IC. Evidencias obtenidas de pequeños estudios sugieren que enfriar el líquido de diálisis puede retrasar la progresión de la cardiomiopatía asociada a la hemodiálisis por reducción del daño isquémico recurrente [98]. Tampoco, hay ensayos clínicos que informen de beneficios de la diálisis peritoneal versus la hemodiálisis. El manejo de la concentración de sodio en el líquido de diálisis requiere especial consideración en pacientes con IC, dado el riesgo de sobrecarga adicional de sodio. Estrategias para mantener, tanto como sea posible, la función renal residual es deseable, dado que puede mitigar eventuales alteraciones hemodinámicas que ocurren con los balances líquidos negativos durante las sesiones de diálisis.
Pacientes con trasplante renal
Incidencia y prevalencia de IC en receptores de trasplante renal
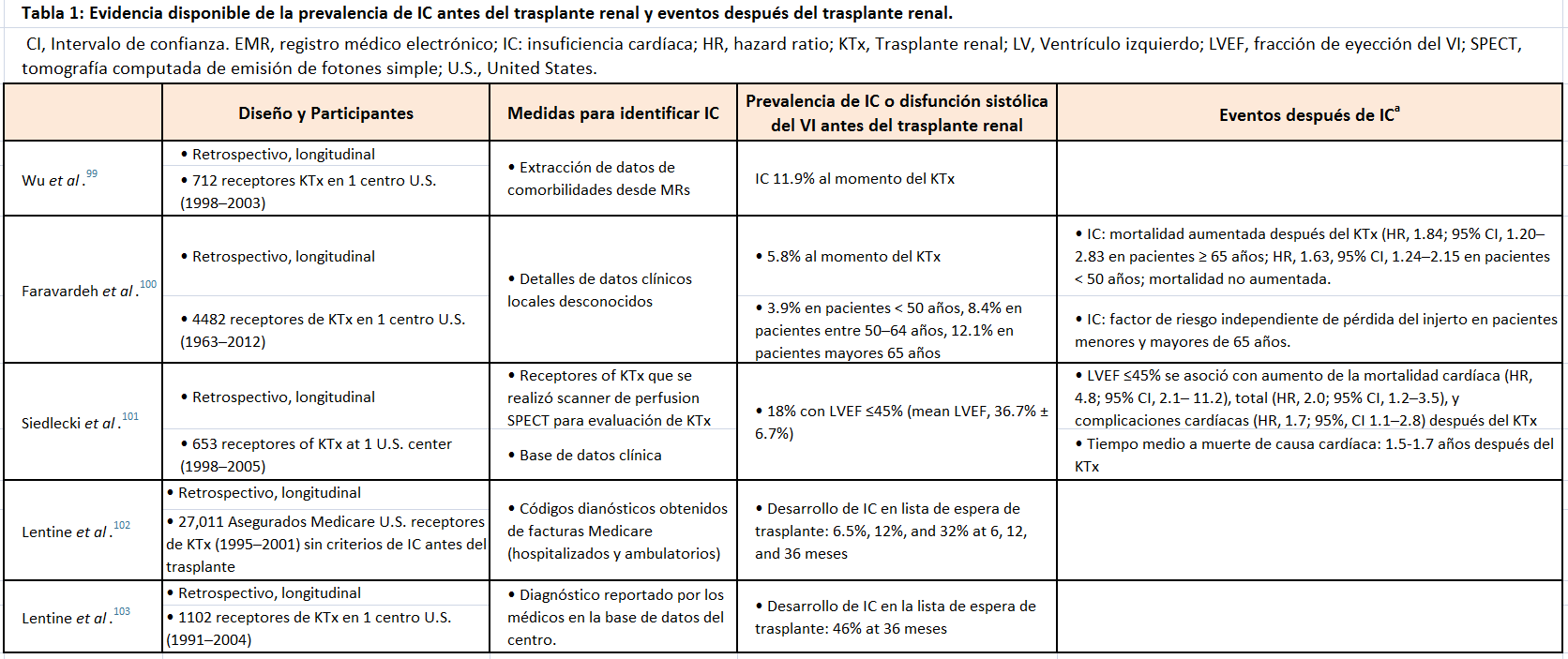
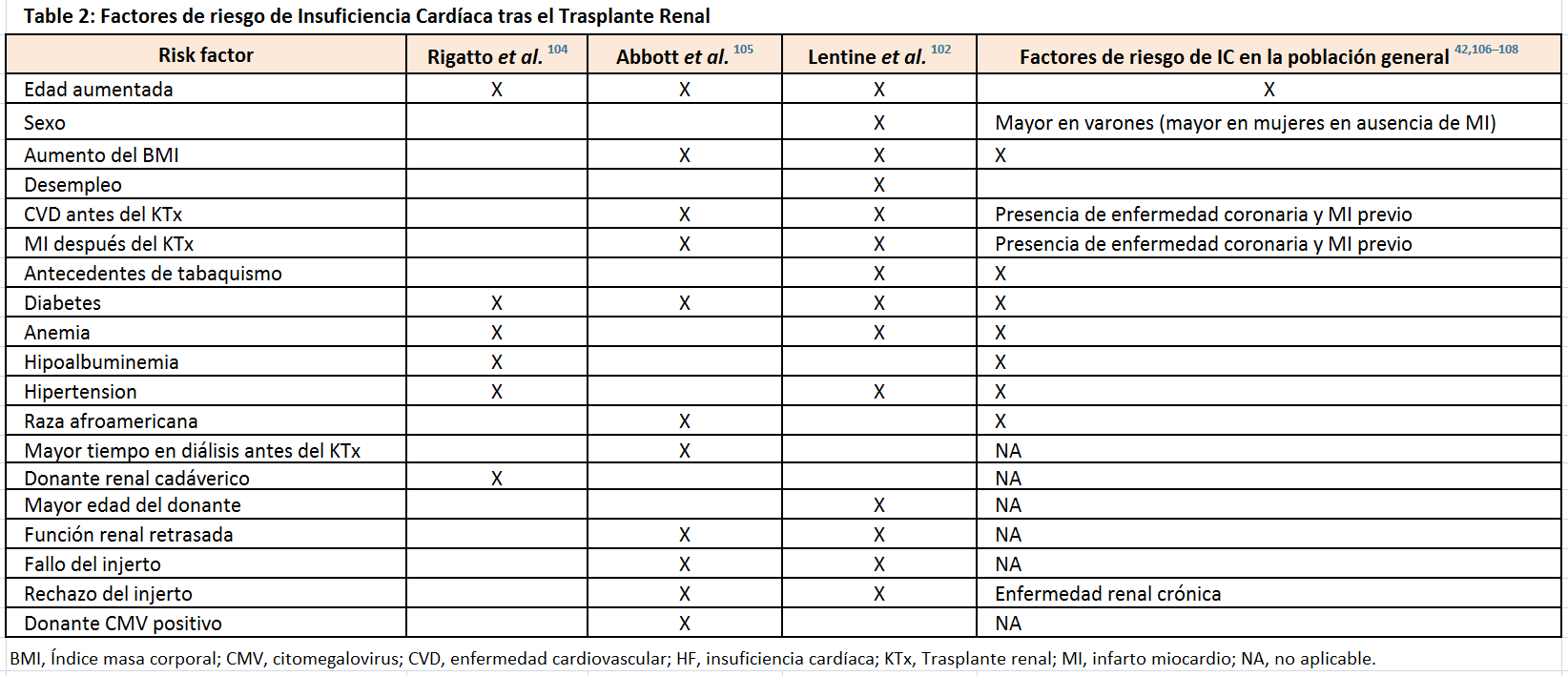
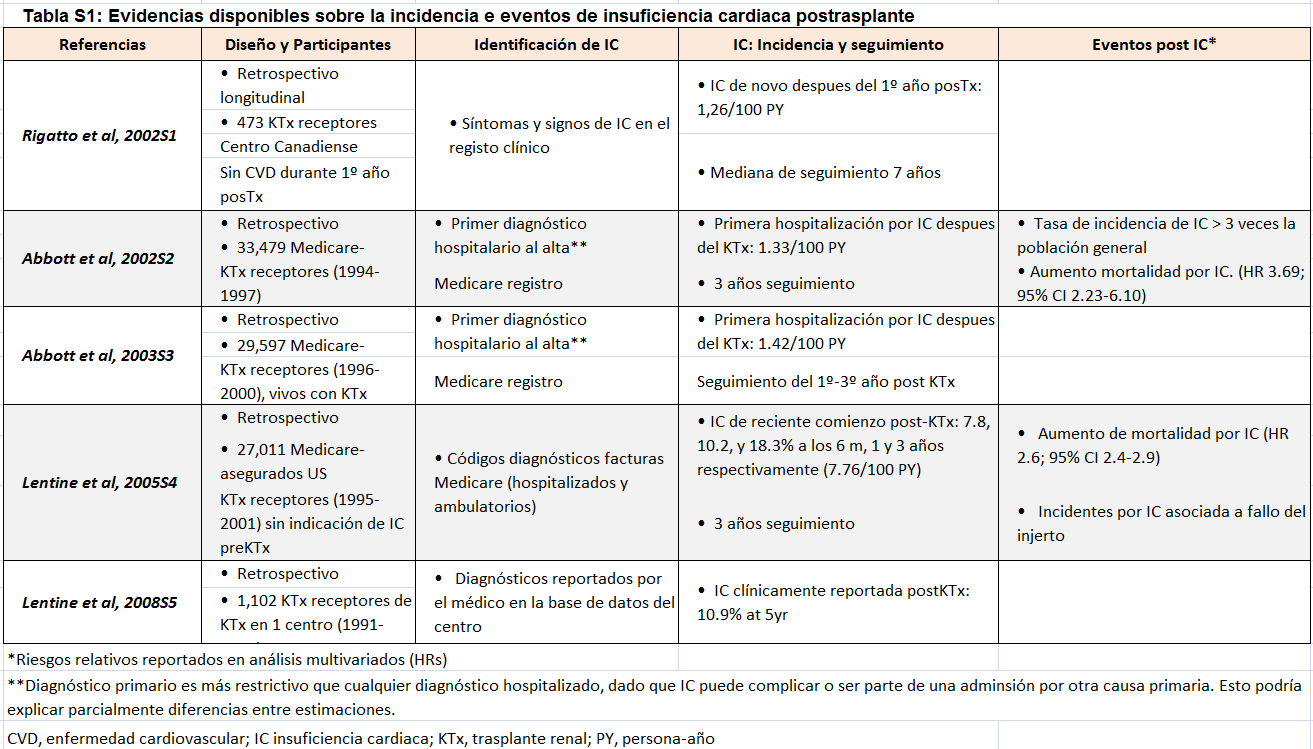
En pacientes trasplantados, la IC ha sido, en general, definida e identificada en bases de datos clinico-administrativas, pero menos frecuentemente identificada con test diagnósticos, tales como la ecocardiografía. Datos de la prevalencia y pronóstico de la IC pretrasplante son escasos, pero la prevalencia de IC/disfunción sistólica del VI en pacientes referidos o en lista de espera de trasplante puede alcanzar el 25% (Tabla 1) [99] [100] [101] [102] [103]. La IC al momento del trasplante se asocia a mayor riesgo de mortalidad, eventos cardiovasculares y fallo del injerto [100] [101] [102]. En base a los datos obtenidos a través de la facturación de Medicare, la incidencia de IC postrasplante de novo es aproximadamente del 18% a los 3 años. Algunos factores de riesgo se han visto asociados a la presencia de IC clínica después del trasplante (Tabla 2) [102] [104] [105] [106] [107] [108]. La IC de novo se asocia a peor supervivencia del injerto y del paciente: Tabla Suplementaria S1 (Tabla 4) [102] [103] [104] [105] [109].
Diagnóstico y cribado de IC en receptores de trasplante renal
Hay poca o nula evidencia para la valoración ecocardiográfica de la función del VI en los candidatos a trasplante renal. Sin embargo, es razonable realizar un ecocardiograma si hay síntomas de IC, historia de enfermedad cardiovascular o inestabilidad hemodinámica en diálisis. La aproximación diagnóstica a la IC de novo en receptores de trasplante, es la misma que la indicada para la población general, incluyendo la evaluación de la enfermedad coronaria [110]. El tratamiento de la IC en los receptores de trasplante debería ser igual al indicado en la población general. No hay estudios de intervención con IECA o ARA, MRA, beta bloqueantes, bloqueantes de los canales del calcio, nitratos, vasodilatadores, o inhibidores del receptor de la angiotensina neprilisina en el tratamiento de la IC en receptores de trasplante renal. En un ensayo clínico pequeño, en receptores de trasplante con hipertrofia del VI, el lisinopril redujo el índice de masa VI, en comparación con placebo [111]. No hay estudios de intervención que evalúen la posible prevención o el retraso en el desarrollo de IC de novo en pacientes trasplantados, ni ensayos en pacientes trasplantados que se halla incluido la IC como variable dependiente. En algunos pacientes trasplantados, el manejo de la IC es complicado por la persistencia de hiperpotasemia, la cual puede impedir el uso de los IECA, ARA y MRA. Terapias para contrarrestar la hiperpotasemia, como el patiromer o el ciclosilicato de zirconio sódico deberán ser evaluados en esta población, como también su potencial interferencia con la absorción de otros fármacos. La preocupación por el efecto adverso sobre el FGe no debería automáticamente conducir a su retirada, cuando es beneficiosa para el tratamiento de la IC-FEr. Un factor exacerbante puede ser el desarrollo de una fístula arteriovenosa "innecesaria", la ligadura de la cual debería ser considerada en receptores con síntomas de IC, elevado gasto cardíaco y fistula arteriovenosa de elevado flujo (1,5-2,0 l/min y un flujo mayor del 30% del gasto cardíaco) [11].
Efecto del trasplante renal sobre la estructura y función cardíaca
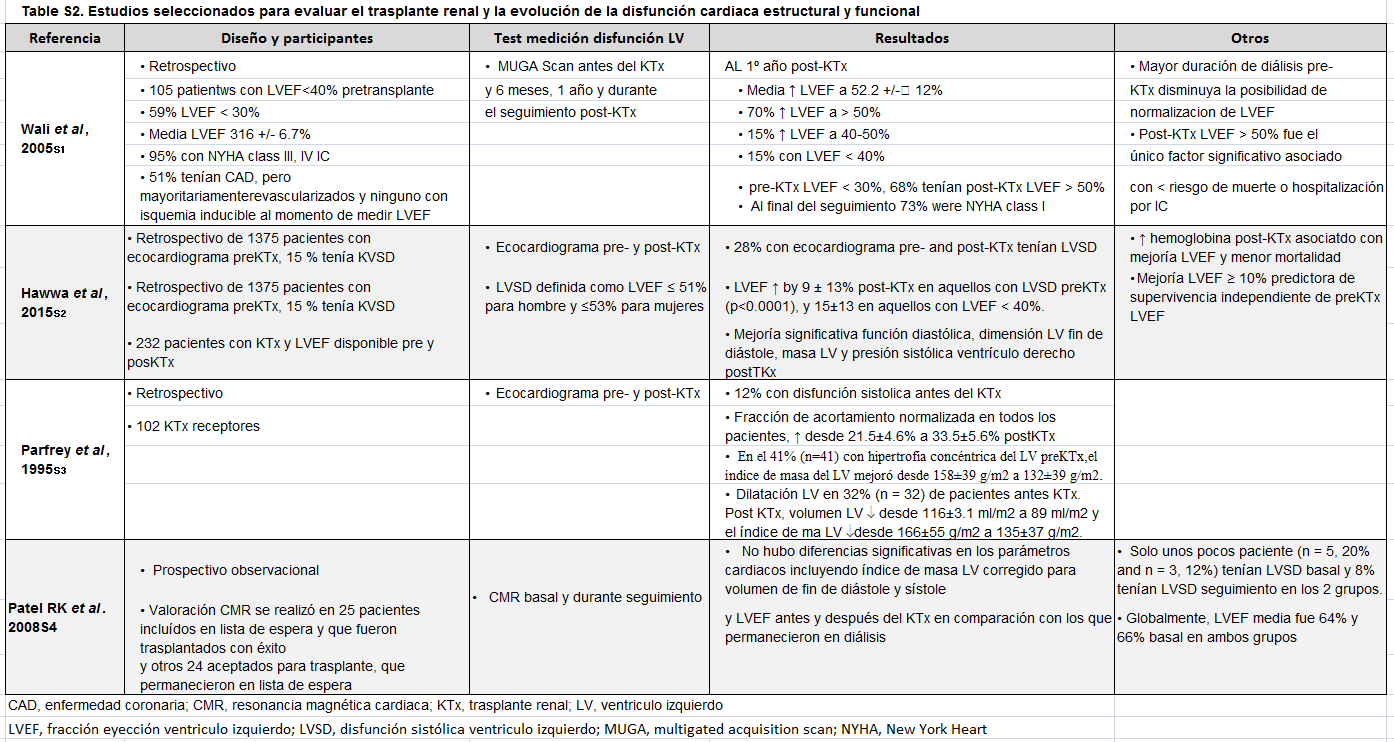
Se ha descrito la reversión clínica de la disfunción cardiaca y la mejoría de los parámetros ecocardiográficos, después del trasplante renal [113] [114] [115] [116] [117][118] [119] [120] [121] [122] [123] [124] [125] [126] [127], apoyando la idea de una "cardiomiopatía urémica" reversible: (tabla suplementaria S2) (Tabla 5). La reversión es menos probable en pacientes que han recibido diálisis durante largos períodos de tiempo [114]. Los candidatos a trasplante no deberían ser excluidos sobre la base de disfunción sistólica del VI, y en algunas circunstancias, deberían ser considerados prioritarios en las listas de espera. Sin embargo, se requieren estudios prospectivos, a largo plazo, de la estructura y función del VI antes y después del trasplante para evaluar pacientes consecutivos evitando sesgos.
Trasplante simultáneo de Riñón y Corazón
Pacientes con IC severa y dependientes de la diálisis crónica, pueden beneficiarse del trasplante simultáneo riñón-corazón. En un análisis del registro americano de datos, la supervivencia a 5 años postrasplante, fue superior en pacientes en diálisis con IC terminal, que recibieron un trasplante simultáneo riñon-páncreas, comparado con los que recibieron sólo trasplante cardíaco (75% vs 51%) [128]. Los beneficios de supervivencia, aunque en menor extensión, también se vieron en pacientes con disfunción renal e IC terminal no dependientes de diálisis, que recibieron trasplante de riñon-corazón [129]. Dada la ausencia de datos robustos en pacientes seleccionados para trasplante simultáneo de riñón-corazón, es razonable afirmar que el trasplante de ambos órganos debe ser sopesado ante la posibilidad de recuperar función renal con trasplante cardíaco sólo, y el sesgo de selección debe ser considerado a la hora de interpretar estos datos observacionales.
Prioridades a investigar
La (Tabla 3) ilustra las líneas de investigación prioritarias cuyos resultados deberían mejorar la práctica clínica futura.
Conclusión
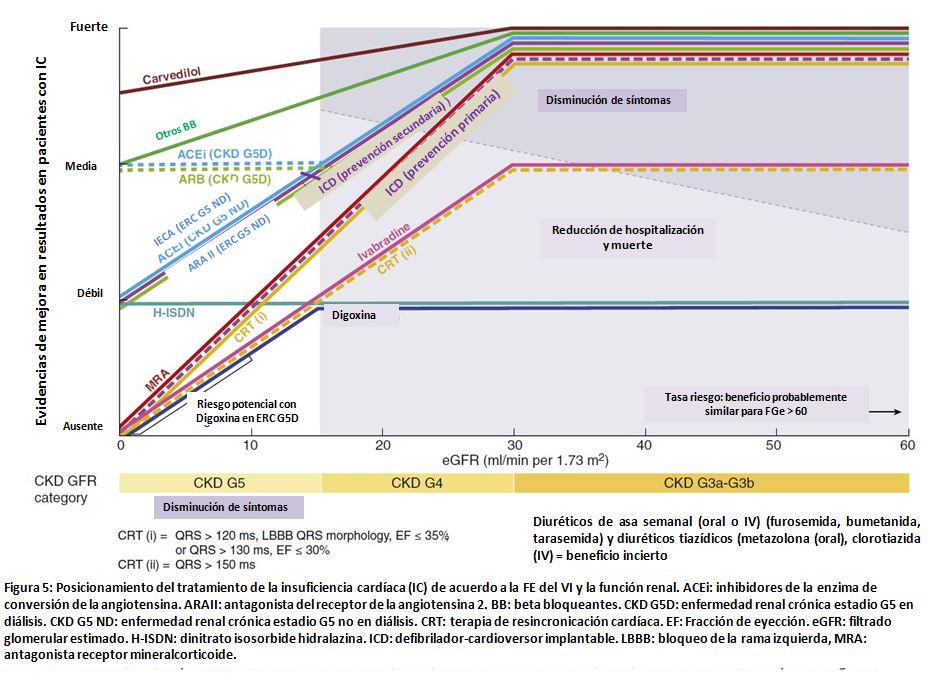
Una aproximación multidisciplinar es vital para comprender los datos clínicos y mecánicos que afectan la IC en la ERC. Es necesaria información de alta calidad en todos los aspectos de la IC (patofisiología, epidemiología, diagnóstico, prevención y tratamiento) específicos para la población con ERC avanzada, en diálisis o trasplantados. En la (Figura 5) se exponente los beneficios relativos basados en la evidencia del tratamiento de la IC a través de un continuo de función renal. Es recomendable la colaboración entre nefrólogos y cardiólogos para diseñar y conducir ensayos clínicos. Debido a que la IC en la ERC aparece como una enfermedad compleja o sindrómica, es prudente integrar la historia clínica, la valoración fenotípica con biomarcadores e imágines de alta calidad, y paradigmas terapéuticos comparables y sostenibles. Es importante evitar la toxicidad de medicamentos, y prevenir las complicaciones de procedimientos renales o cardiovasculares en el contexto de la IC y ERC. La interpretación de la azotemia como representación del daño renal versus el empeoramiento transitorio de la función renal es uno de los grandes retos que enfrentan los clínicos, siendo necesarios biomarcadores, más allá de la creatinina sérica y el nitrógeno urémico. En el futuro, será beneficioso incluir otras valoraciones orientadas a los pacientes, como preferencias del final de la vida, cuando se evalúen estrategias terapéuticas, particularmente en pacientes en diálisis.