Visión general e histórica de la diálisis peritoneal
Visión histórica de la técnica
La Diálisis Peritoneal (DP) forma parte integral del esquema de tratamiento integrado de la enfermedad renal crónica (ERC) terminal [1], y muestra resultados globalmente comparables a los de otras modalidades de diálisis. Para alcanzar este estatus, la DP ha pasado por numerosas vicisitudes que, de modo general, se pueden acompasar al curso de las últimas cinco décadas. Dejando de lado precedentes más o menos anecdóticos y su precursor más directo, la DP intermitente en medio hospitalario, la verdadera historia de la DP crónica comienza en los años 70 del siglo pasado, que fueron los del desarrollo de las bases teóricas de esta terapia (Moncrief, Popovich, Nolph, Pyle y otros) y de los sistemas y dispositivos (catéteres, contenedores flexibles para el dializado) que la hicieron viable (Tenckhoff, Oreopoulos y otros). Los años 80 fueron los de la irrupción de la DP en la práctica clínica, y estuvieron marcados por el problema de las infecciones peritoneales recurrentes [2], que generaban supervivencias inaceptablemente cortas de la técnica, y que sentaron las bases de la leyenda negra como terapia de segunda clase que la DP arrastró durante las dos décadas siguientes. En este período tampoco existía una buena aproximación a cuestiones como la adecuación de diálisis o el control de volumen (por ejemplo, se daba muy poca importancia a la función renal residual FRR), pero ya se empezaron a introducir conceptos relevantes, como la valoración de la función peritoneal mediante la prueba de equilibrio peritoneal [3] o la introducción de conceptos basados en la cinética de la urea y de la hipótesis de las concentraciones pico de toxinas urémicas [4], que aportó una posible explicación para la viabilidad clínica de la DP a pesar de una eficacia depuradora teóricamente muy inferior a la de la Hemodiálisis (HD). La segunda mitad de la década contempló la irrupción en la práctica clínica de los sistemas de DP en Y [5], que sentaron las bases de la mejora en las tasas de infección peritoneal que llegarían en la década siguiente.
Los años 90 representaron un período de transición, en el que se desarrollaron numerosos instrumentos de mejora, pero sin que existiera todavía una correcta interpretación de algunos de ellos. Así, a los sistemas en Y se unió el manejo protocolizado de los portadores de Staphylococcus aureus [6], dos medidas con gran impacto en la incidencia de infecciones asociadas a la técnica. También se produjeron avances técnicos de gran calado. Así, la introducción de cicladoras por presión, portátiles y programables facilitó mucho el desarrollo de la DP automatizada, que tanto ha ofrecido a los pacientes en términos de adecuación y calidad de vida. La introducción de soluciones de poliglucosa [7] complementó el avance anteriormente citado, al permitir ultrafiltraciones eficientes en cambios de más de 10 horas de duración, y se ha revelado como una herramienta fundamental en el control de volumen y la prevención del daño a la membrana y las consecuencias metabólicas negativas de la DP, al permitir una técnica menos dependiente de las soluciones de glucosa. Por otra parte, esta década contempló un avance decisivo en el conocimiento de la fisiología de la DP, como fue el desarrollo de la hipótesis (luego confirmada) de la membrana de tres poros [8], que permitió explicar algunas incongruencias aparentes en el funcionamiento del peritoneo. Por último, se consiguieron avances importantes en la valoración de la adecuación de DP, basados en la aplicación del modelo cinético de la urea, aunque desde un principio se hicieron visibles las limitaciones de esta estrategia [9]. En realidad, los estudios en adecuación y los avances conseguidos trajeron más dudas que certezas, en este período. Así, la equiparación de DP adecuada con correcta depuración de urea generaba aún más dudas que las surgidas en HD, alimentadas por la baja eficacia depuradora de la DP. Existía todavía una conciencia insuficiente de la importancia de la FRR y la ultrafiltración en DP. La DP automatizada complicó el diseño de los objetivos de adecuación, y el aumento de interés en otras facetas de ésta (nutrición, inflamación, calidad de vida) tardaría algún tiempo en cristalizar.
El año 1996 resultó desastroso para la DP. La aceptación en su literalidad de las conclusiones del estudio CANUSA [10], que ignoró de manera flagrante la diferente contribución de la FRR y la depuración por DP a la adecuación de la técnica, llevó a objetivos de adecuación inalcanzables para gran parte de los pacientes. La consecuencia fue una caída significativa de la utilización de la técnica en muchos países, especialmente en los EE.UU, en el quinquenio siguiente. El reanálisis de los resultados de este estudio [11] recondujo la situación, y dio paso a un período (vigente hasta la actualidad) en el que la preservación y aprovechamiento de la FRR se ha convertido en un elemento esencial del manejo del paciente en DP [12]. Los ensayos multicéntricos Ademex [13] y chino [14] establecieron objetivos de depuración de moléculas pequeñas más realistas, lo que permitió un cierto resurgimiento de la técnica.
La primera década del siglo XXIº resultó decisiva para el asentamiento de la DP. Además de consagrar la importancia de la FRR, se adquirió plena consciencia de la importancia del control de volumen para la supervivencia, y de que la DP no era particularmente eficiente para este cometido [15]. La DP se reveló también como una técnica con excelentes resultados a corto plazo, pero marcada por un incremento significativo del riesgo cardiovascular a medida que declina la FRR y la capacidad de ultrafiltración [16] [17] [18] [19]. También se definió más claramente el papel de la DP automatizada, especialmente en pacientes anúricos [20] y transportadores rápidos [21], así como su uso para el tratamiento en régimen asistido de pacientes incapaces de autocuidado [22]. Otro campo de gran progreso fue el del conocimiento de la fisiopatología de la membrana peritoneal. Aunque ya se conocían los efectos negativos de las soluciones convencionales de DP sobre el funcionalismo del peritoneo, en esta década se caracterizó el daño, tanto desde el punto de vista histológico [23] como fisiopatológico [24], y se refinó el conocimiento de los cambios funcionales asociados al fallo de ultrafiltración [25]. Esta década contempló también la introducción en la práctica clínica de las llamadas soluciones biocompatibles, bajas en productos de degradación de la glucosa PDGs y tamponadas parcial o totalmente con bicarbonato [26]. Estas soluciones han mostrado ser menos agresivas para la membrana peritoneal que las convencionales (tamponadas con lactato y ricas en PDGs) en estudios in vitro y ex vivo, pero sus efectos sobre la membrana peritoneal y la FRR en el ámbito clínico han sido menos concluyentes [27] [28].
La segunda década del siglo presenció pocas novedades en sus primeros años, aunque se podría destacar como período de desarrollo práctico de los conceptos ya existentes de tratamiento integrado domiciliario (HD domiciliaria como opción de continuación del tratamiento en autocuidado tras el abandono de DP) [29], y de la posible utilidad de la DP para el tratamiento de la insuficiencia cardíaca avanzada. En los últimos años de la década sí se han producido algunos avances de gran significación potencial. Así, aunque ya se conocía la relevancia de preservar el estilo de vida de los pacientes para el éxito de la técnica, las recomendaciones actuales sitúan este objetivo de prescripción incluso por encima de los de depuración (salvo el control de volumen, al que se sigue concediendo máxima relevancia), al menos en algunos contextos [30]. También se han hecho notables esfuerzos para analizar los resultados del tratamiento desde la perspectiva de los propios pacientes (Medidas de Experiencia y Pronóstico Relacionadas con los Pacientes) [31] cuestión que, durante largos años, fue esencialmente ignorada. Por otra parte, la caracterización genética de las propiedades de la membrana peritoneal [32] [33] ofrece importantes perspectivas en lo relativo a selección de pacientes, valoración pronóstica y manejo de la técnica. Un tercer avance reciente que debe ser mencionado es la introducción plena en la práctica clínica de procedimientos de telemonitorización, centrados sobre todo en la DP automatizada [34]. El impacto que éstas y otras novedades tengan en los resultados de la DP habrá de ser analizado con mayor perspectiva.
Aunque la DP ha experimentado múltiples avances y mejoras, la reducción de las tasas de peritonitis a niveles razonables y la constatación de que es capaz de competir (cada vez más ventajosamente en los primeros años) con la HD en términos de mortalidad han sido los principales factores que han permitido la plena integración de la DP como modalidad de tratamiento sustitutivo renal (TSR) en las últimas décadas. La evidencia de unos excelentes resultados en los primeros años ha dado gran impulso a estrategias bien conocidas, y tan relevantes para el desarrollo de la técnica, como el enfoque integrado del tratamiento renal sustitutivo [35], las políticas de “DP primero” [36], DP como modalidad preferible antes del trasplante renal [37] [38] [39] [40] y DP como modalidad de inicio no programado de TSR [41] [42]. Sin embargo, la DP no ha conseguido superar todavía algunas barreras, que incluyen una baja incidencia y prevalencia en muchos países, problemas para definir sus indicaciones y, sobre todo, la incapacida para mejorar las tasas de supervivencia de la técnica [43] [44]. Ésta última limitación se asienta en una combinación de factores que deben ser abordados de manera conjunta y sistemática, si se quiere alcanzar el éxito [45]. En el resto de este capítulo se analizará el estado actual de la DP como modalidad de TSR y las posibles tendencias a corto y medio plazo.
Uso de la DP y tendencias
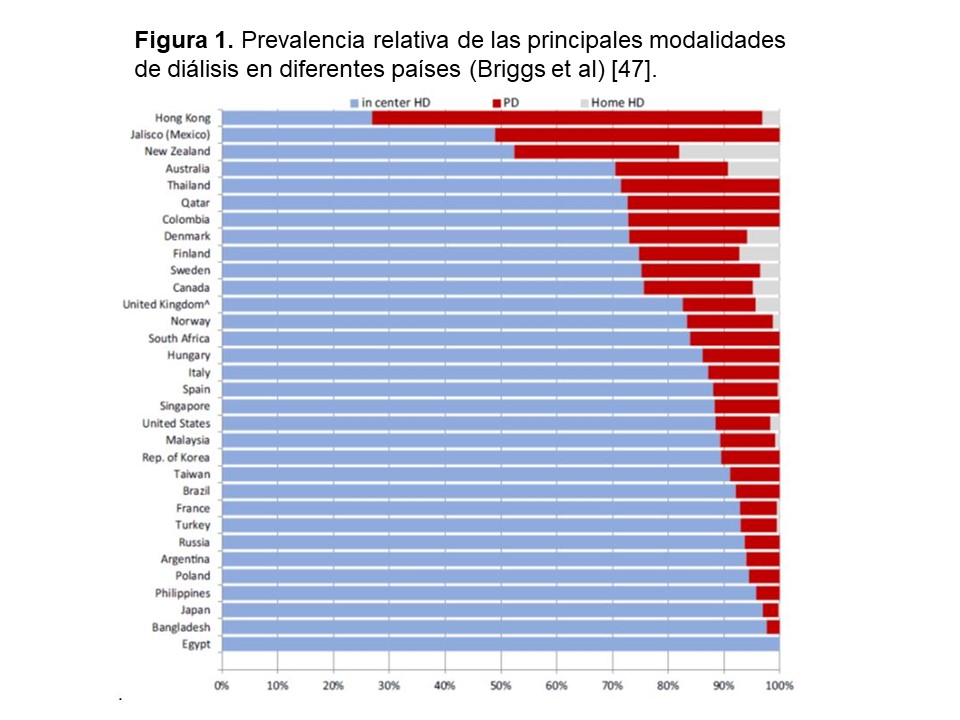
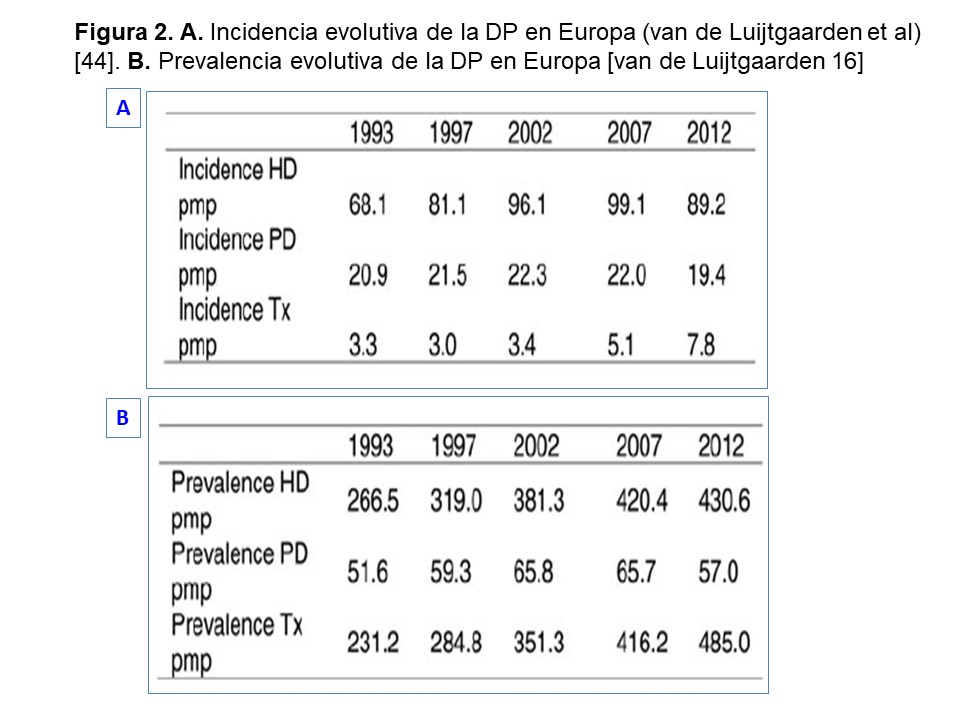
A pesar de unos resultados que resisten la comparación con la HD, y de su evidente coste-eficiencia, la penetración de la DP dista mucho de los objetivos deseables, a nivel global. Varias revisiones recientes [46] [47] ha mostrado prevalencias muy dispares de la técnica, tanto a nivel global como, en particular, en países desarrollados (Figura 1)[48]. En cuanto a las tendencias observadas, el panorama varía mucho según la estrategia de análisis. Así, si consideramos tasas absolutas, la tendencia global es a un aumento en la incidencia y prevalencia de la técnica pero, si se tiene en cuenta la población en TSR en su conjunto, la utilización relativa de la DP (porcentaje sobre el total de pacientes en diálisis) muestra un comportamiento mucho más variable [49] [50]. Por ejemplo, en Estados Unidos la incidencia de la DP se ha mantenido relativamente estable, con algunos altibajos, en las dos últimas décadas. La prevalencia de pacientes en la técnica aumentó un 87% entre 2000 y 2016 pero, en el mismo período, la prevalencia total en diálisis aumentó en un 86% (Informe USDRS 2018, https://www.usrds.org/adr.aspx). En el caso de Europa, la tendencia en los últimos años apunta claramente a un descenso moderado, pero consistente, en el uso de la DP (Figura 2) [44].
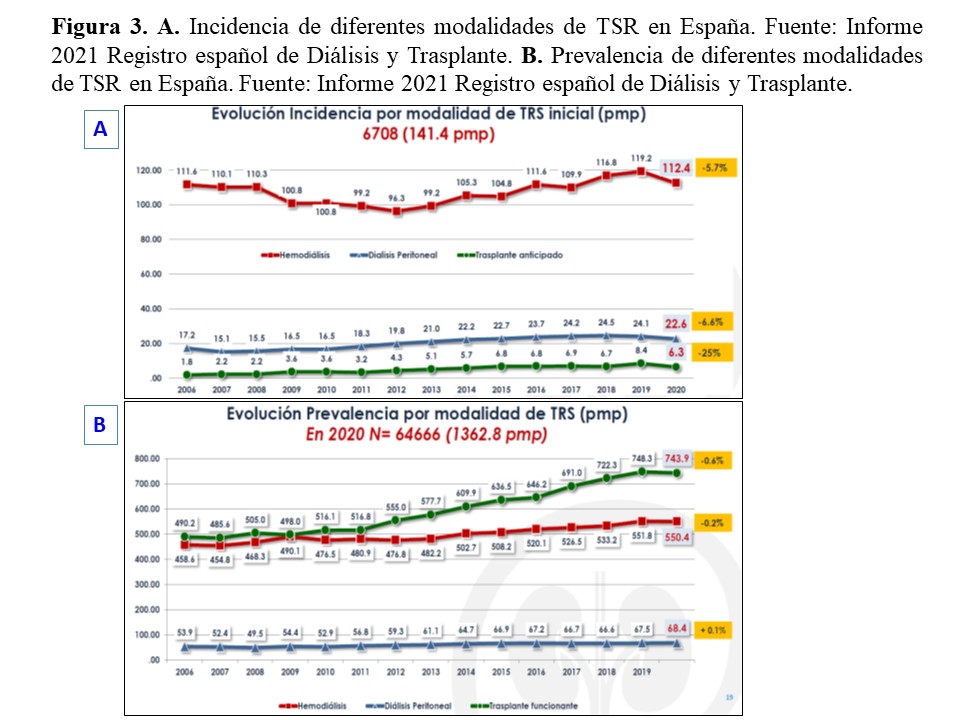
El caso concreto de España muestra una evolución destacable. Así, tras una fase previa de estancamiento, en el período 2009-2020 la incidencia de la DP aumentó en un 76% (6,3% por año) mientras que, en el mismo período, la HD apenas se incrementó en un 11,5% (0,9% por año). En el mismo período, la prevalencia de la DP aumentó un 25,7% (2,1% por año), frente a un 12,2% (1,1% por año) de la HD (Figura 3). Las causas de la evolución favorable a la DP se deben enmarcar en el modelo evolutivo general de la técnica, con dos consideraciones añadidas. En primer lugar, la incidencia y prevalencia de base de la DP en nuestro país son relativamente bajas, lo que magnifica cualquier mejora. Por otra parte, la actuación organizada y multidisciplinar del grupo GADDPE para la promoción de la técnica [49] podría haber jugado un papel destacado en esta evolución. La pandemia Covid-19 ha introducido distorsiones en las curvas evolutivas de las diferentes modalidades de TSR, que habrán de ser evaluadas con mayor perspectiva. Será interesante constatar si las técnicas de TSR en régimen domiciliario resultan potenciadas por esta circunstancia.
Factores que influyen en la utilización de la DP
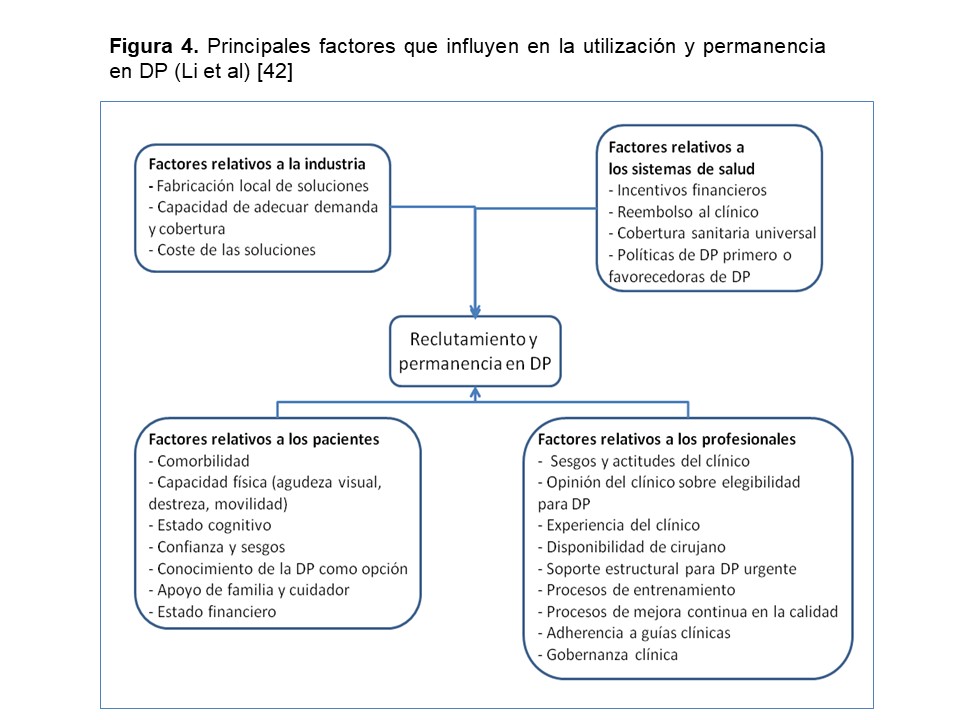
El análisis de los factores que determinan una mayor o menor utilización de la técnica de DP en diferentes partes del Mundo es sumamente complejo, dado su gran número y diferente capacidad de influencia en cada área. La (Figura 4) esquematiza los factores, de acuerdo a un reciente análisis [48]. En general, se puede afirmar que:
- Los sistemas de provisión pública favorecen más el uso de la DP, por motivos de coste-eficiencia [47] [48].
- La aplicación de políticas activas del tipo de DP primero y DP preferente tienen un gran impacto en el uso de la técnica. La situación en Hong Kong, a la cabeza de la prevalencia a nivel mundial, es un buen ejemplo de ello [36].
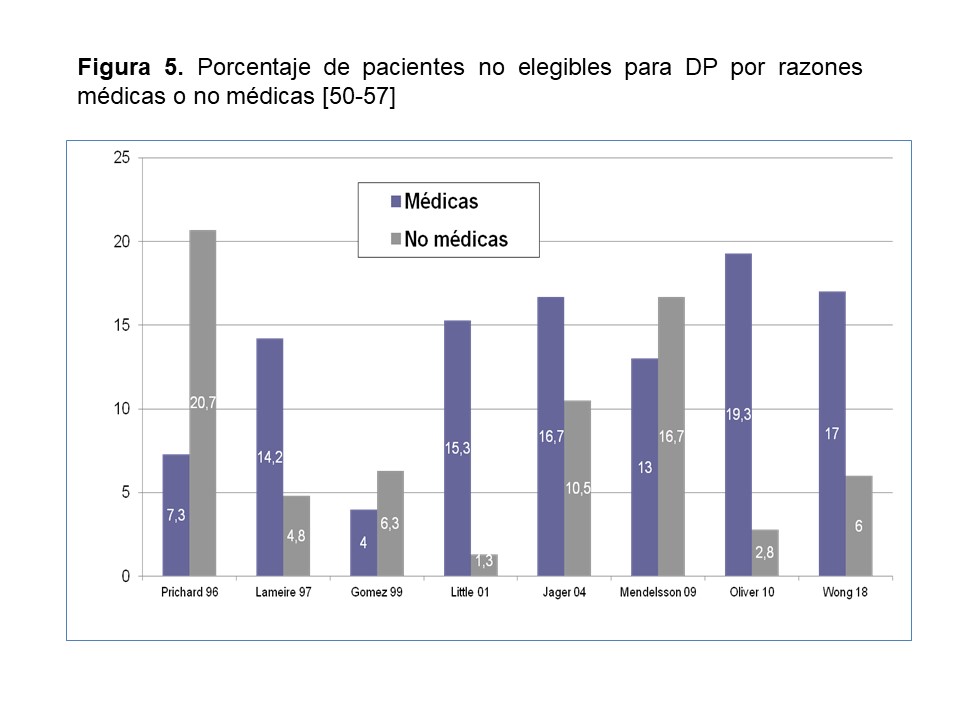
- Aproximadamente un 25% de los pacientes que inician TSR no son elegibles para DP, por razones médicas o sociales (Figura 5) [50] [51] [52] [53] [54] [55] [56] [57], lo que establece un límite esencial para la penetración de la técnica, en comparación con la HD, que es factible en más del 95% de los pacientes que inician TSR
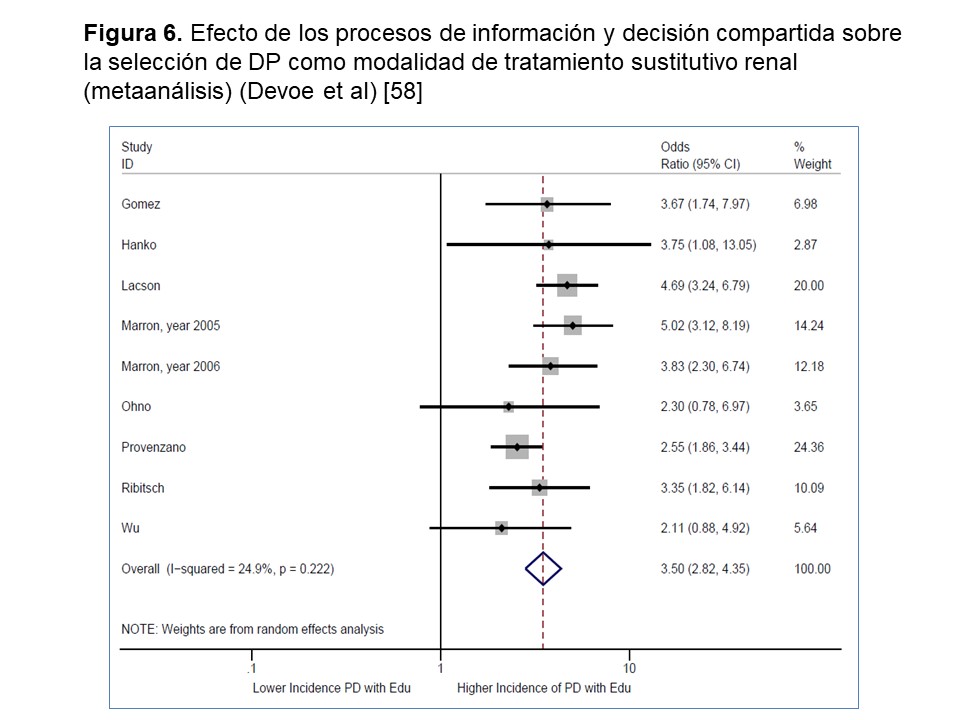
- La adherencia a recomendaciones vigentes sobre información, educación y decisión compartida de modalidad de TSR influye, de manera incontestable, en la utilización de la DP (y también en sus resultados clínicos) (Figura 6) [58].
- Una infraestructura y funcionamiento adecuados y unos buenos resultados clínicos en un centro o área determinados favorecen la utilización de la DP en ese centro o área [47].
- Los factores relacionados con la industria, y el coste de las soluciones en particular, impactan en las prácticas de DP más que en su prevalencia, y mucho más en los países en desarrollo que en los desarrollados [48]
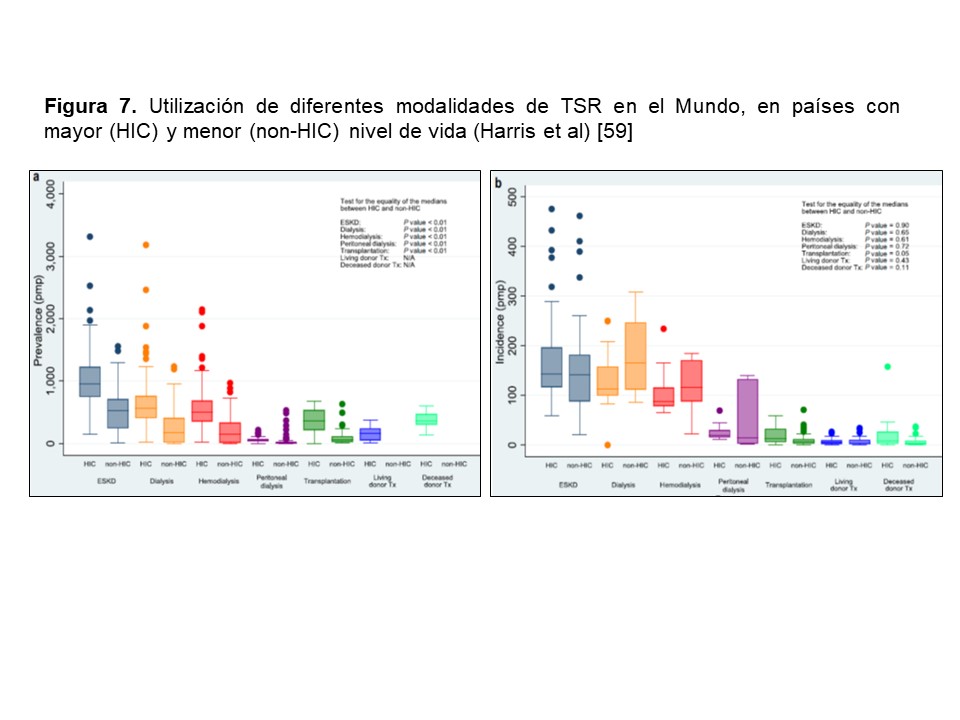
- El nivel de desarrollo socioeconómico tiene una relación global inconsistente con la utilización de la DP, mostrando incidencias y prevalencias muy variables, tanto en países desarrollados como en vías de desarrollo [59] (Figura 7).
En el caso concreto de España, el grupo GADDPE ha realizado sus propios análisis sobre los factores que determinan un mayor o menor uso de la DP en nuestro país. Los resultados se reflejan en la Tabla 1.
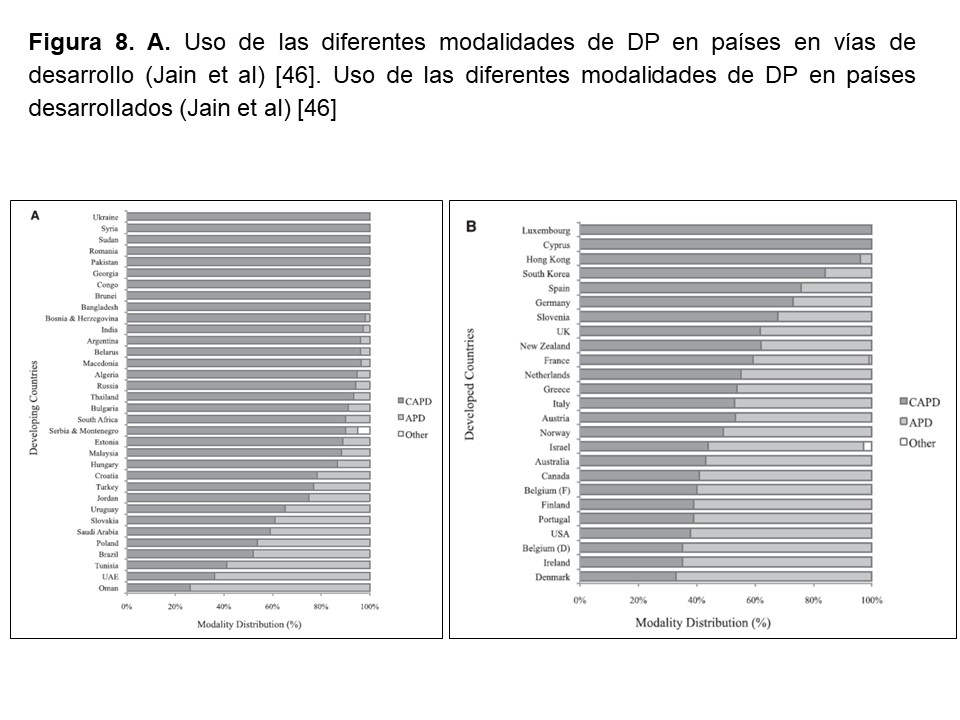
En lo que se refiere al uso de las diferentes modalidades de DP, la utilización de la DP automatizada está fuertemente ligada a los recursos económicos en cada país (Figura 8) [46].
Retos futuros y nuevas indicaciones de la DP
A pesar del mucho camino recorrido, la DP adolece todavía de limitaciones importantes, que lastran sus resultados, comparados con los de la HD. La supervivencia precoz (ya hasta el 4º año) es superior en DP que en HD pero, pasado este período, el paciente se ve amenazado por un incremento progresivo del riesgo cardiovascular, ligado en gran medida a la sobrecarga de volumen, la hipertensión y factores metabólicos [60]. La supervivencia de la técnica es, sin lugar a dudas, el talón de Aquiles actual de la DP [47] [61] [62] [63] [64] [65] [66], y se analiza en detalle en otro capítulo. Detrás de la incapacidad para mejorar esta faceta se encuentran algunos fracasos persistentes en nuestra práctica:
- Éxito limitado de los esfuerzos dedicados a realizar una selección adecuada de pacientes para DP, identificando y categorizando correctamente las barreras médicas y sociales
- Incapacidad práctica para implantar de manera universal medidas que podrían aumentar el uso de la DP y mejorar sus resultados (procedimientos de decisión informada y compartida, DP automatizada, DP asistida, inicio no programado)
- Biocompatibilidad insuficiente de la DP, con cierta decepción respecto a la capacidad de las nuevas soluciones para preservar la membrana peritoneal en la práctica clínica
- Incapacidad para reducir de manera consistente y drástica la incidencia de peritonitis, especialmente de las infecciones agresivas (entéricas y fúngicas)
- Incapacidad para regenerar una membrana peritoneal dañada
- Importantes dificultades en un porcentaje significativo de pacientes para proporcionar una depuración y ultrafiltración adecuadas, una vez que la FRR declina
- Limitaciones en el diseño, y técnicas de inserción y cuidados, de catéteres peritoneales, asociando incidencias inaceptablemente elevadas de complicaciones técnicas (malfunción, malposición, atrapamiento por epiplón, fugas…) e infecciosas
- Problemas persistentes de tipo estructural y funcional que retrasan el abordaje en tiempo y forma de las complicaciones técnicas y abdominales (hernias)
- Baja utilización práctica de estrategias estructuradas de mejora de los resultados (mejora continua en la calidad)
Todos estos retos habrán de ser abordados en años venideros, si se pretende una normalización plena de la DP. Una visión integrada e integradora del tratamiento de la enfermedad renal crónica [59], la aplicación sistemática de buenas prácticas, antes y después del inicio de diálisis [67], y las iniciativas de control continuo en la calidad de los resultados [67] son instrumentos generales esenciales para alcanzar objetivos y corregir limitaciones.
Un último aspecto a destacar es la necesidad de clarificar, en base a evidencia de calidad, la utilidad real de algunas indicaciones alternativas de la DP, incluyendo:
- Inicio no programado de TSR con DP [68] [69]
- Viabilidad y resultados de la DP tras el fallo del trasplante renal [70]
- Ultrafiltración peritoneal en pacientes con insuficiencia cardíaca avanzada [71]
- Ultrafiltración y drenaje peritoneal en pacientes con enfermedad renal no terminal y ascitis refractarias no cardíacas [72] [73]
- DP para el tratamiento del daño renal agudo [74]
- Posible papel de la DP en el tratamiento de accidentes cerebrovasculares [71]