Soluciones de diálisis peritoneal
Palabras clave
Diálisis peritoneal, líquidos, composición, ósmosis, biocompatibilidad, productos degradación de la glucosa, icodextrina, aminoácidos
INTRODUCCIÓN
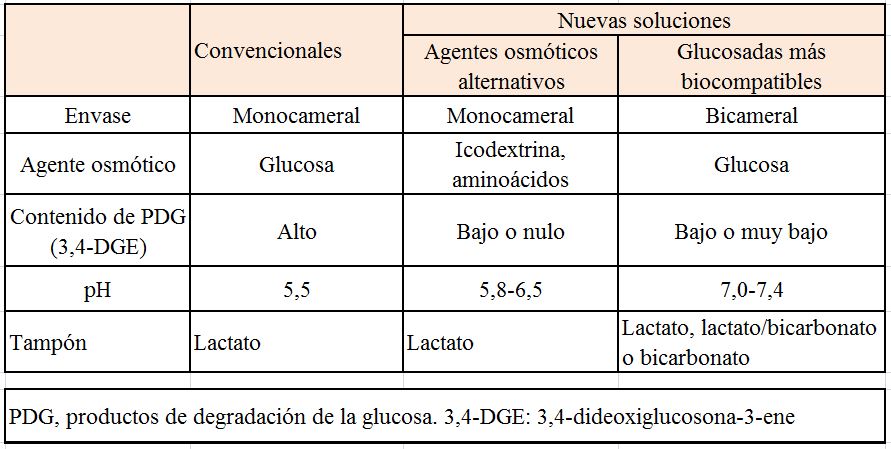
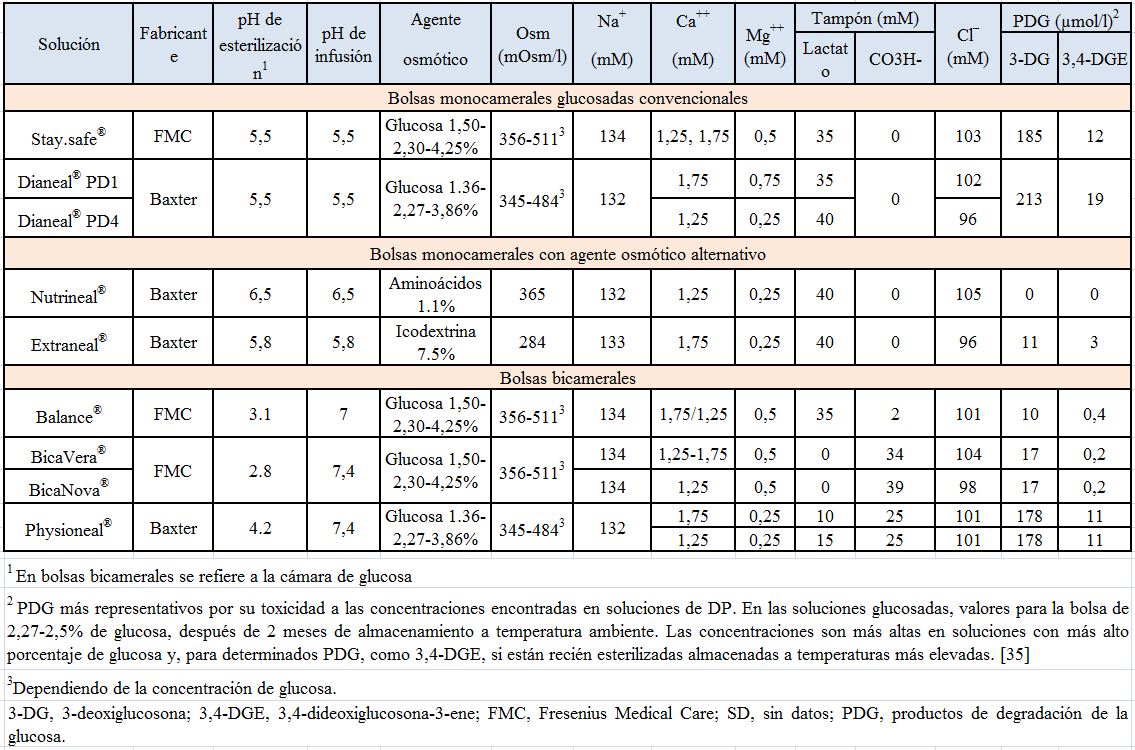
La composición de las soluciones de DP ha evolucionado con los años, aprovechando la mejor comprensión de los principales determinantes de la biocompatibilidad y los avances técnicos [1] [2]. Las soluciones de DP se presentan en bolsas monocamerales y bicamerales (Figura 1). Consideramos soluciones convencionales a las soluciones glucosadas monocamerales que se infunden a pH ácido. Frente a estas, se han desarrollado soluciones glucosadas bicamerales que se infunden a un pH entre 7,0 y 7,4, y son, en general, más biocompatibles, aunque no son un grupo homogéneo en cuanto a su contenido en productos de degradación de la glucosa (PDGs), uno de los principales factores de la biocompatibilidad. Además, hay soluciones monocamerales que contienen aminoácidos o poliglucosa como agente osmótico. Las nuevas solu-ciones suelen ser más caras que las convencionales en los países en los que coexisten ambas.
Composición de las soluciones de diálisis peritoneal
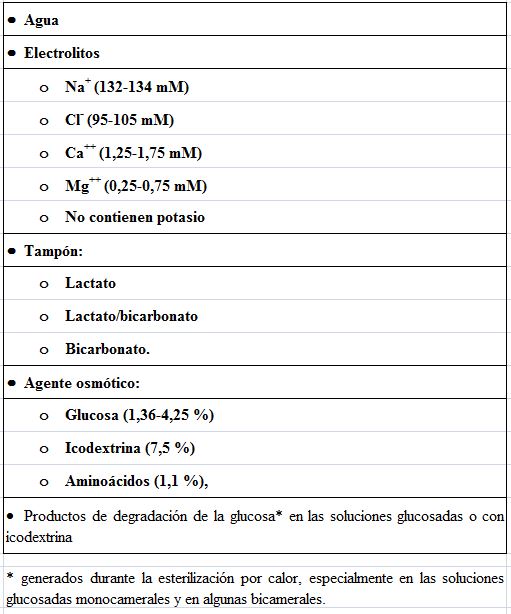
Las soluciones de DP son estériles y contienen agua, electrolitos, un tampón y un agente osmótico (Tabla 1).
Electrolitos
Las soluciones de DP en uso clínico comparten la ausencia de potasio y la concentración de sodio de 132-134 mM (Tabla 2). Concentraciones de sodio más altas limitarían el aclaramiento peritoneal de sodio por difusión y más bajas podrían favorecer la hiponatremia, aunque se han explorado para aumentar el balance negativo de sodio.
Existen soluciones con diferentes concentraciones de otros electrolitos, lo que permite individualizar el tratamiento. La concentración de calcio en las soluciones más habituales oscila entre 1,25 y 1,75 mM (Tabla 2). La concentración de 1,75 mM favorece un balance positivo de calcio. La concentración de 1,25 mM puede producir un balance negativo de calcio, especialmente con las soluciones que consiguen una mayor ultrafiltración [3]. Las soluciones con 1,25 mM de calcio fueron diseñadas para poder administrar quelantes del fósforo con calcio, sin riesgo de hipercalcemia. Estos quelantes aportan bases, por lo que la asociación de altas dosis de quelantes con un alto volumen de soluciones de DP de alto contenido en tampón puede causar alcalosis metabólica en algunos pacientes [4].
Las soluciones más bajas en calcio aumentan la concentración de hormona paratiroidea (PTH) sérica, lo que puede ser beneficioso en paciente con PTH baja, pero no deseado en pacientes con hiperparatiroidismo. Cuando se utilizan, es conveniente monitorizar el calcio iónico [5].
Resultan llamativas las amplias diferencias en la concentración de magnesio, que oscila entre 0,25 y 0,75 mM (Tabla 2). La concentración de 0,75 mM se ha asociado con hipermagnesemia [5], que puede bajar la PTH y, en teoría, proteger de la calcificación vascular [6]. Así, en estudios observacionales, los niveles más altos de magnesio sérico se han asociado a mayor supervivencia en pacientes en hemodiálisis [7]. La concentración de 0,25 mM también se ha asociado a hipomagnesemia [4] [5] [6] [7] [8]. La prescripción de medicación oral y soluciones de DP se puede individualizar en función de la concentración de magnesio de las bolsas y de la necesidad de prescribir quelantes del fósforo con magnesio o laxantes que contienen magnesio.
Tampón
El tampón puede ser lactato (el tampón convencional), lactato/bicarbonato o solo bicarbonato (Tabla 2). Los dos últimos tampones se presentan en envases bicamerales para separar el bicarbonato del calcio y del magnesio hasta antes de la infusión, evitando su precipitación (Figura 1) [9] [10] [11] [12] [13] [14] [15]. La separación de ambos compartimentos permite también la esterilización de la glucosa a bajo pH, para limitar la generación de productos de degradación de la glucosa (PDGs), y la infusión al peritoneo de la mezcla de las dos cámaras, a un pH entre 7,0 y 7,4. Estudios preclínicos sugieren que el bicarbonato es más biocompatible que el lactato. En el pasado, se utilizó acetato como tampón y fue abandonado por causar vasodilatación, disminución de la contractilidad miocárdica y peritonitis esclerosante.
Hay que prestar atención al contenido de tampón de las soluciones de DP y monitorizar el equilibrio ácido-base de estos pacientes, ya que están en riesgo tanto de acidosis metabólica por infradiálisis o alta ingesta proteica, así como de alcalosis metabólica, por baja ingesta de proteínas asociada a un alto volumen de DP con soluciones que tiene una alta concentración de tampón. Como se observa en la (Tabla 2), la concentración de tampón puede ser hasta de 40 mM cuando la concentración de bicarbonato en sangre en condiciones fisiológicas es entre 22 y 27 mM. Las soluciones con más alto contenido en tampón se diseñaron para ser usadas conjuntamente con soluciones que usan aminoácidos como agente osmótico, ya que estos producen una tendencia la acidosis metabólica. En cualquier caso, la disponibilidad de varias concentraciones de tampón en el mercado permite individualizar la prescripción, siempre que monitoricemos los niveles de bicarbonato en sangre para saber cómo adaptar dicha prescripción.
Si bien algunos autores enfatizaron los posibles beneficios de una alcalosis leve sobre el estado nutricional, sobre todo en los años 90 [16], este concepto ha sido criticado por poder favorecer la calcificación vascular [17] [18]. Hemos de recordar que los 90 fueron una década en la que los nefrólogos se caracterizaron por su inconsciencia con respecto a los riesgos de la calcificación vascular.
En la actualidad, no existen soluciones con alto contenido tanto de calcio (1,75 mM) como de tampón (39-40 mM). Esto limitaría el riesgo de calcificación vascular. Sin embargo, algunas nuevas soluciones carecen de flexibilidad en la combinación de diferentes concentraciones de calcio y de base (Tabla 2), lo que limita las posibilidades de individualizar el tratamiento y de seguir las recomendaciones de las guías internacionales más recientes, como se discute la final del capítulo.
Agente osmótico
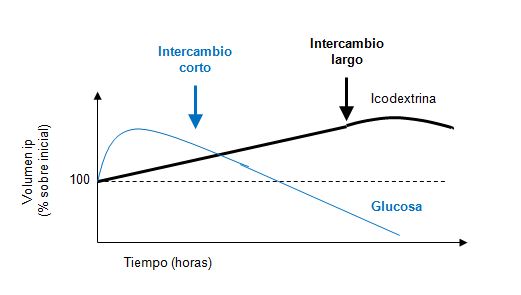
El agente osmótico es necesario para hacer un balance negativo de fluidos. En su ausencia, las soluciones de DP se reabsorberían en su mayor parte durante el curso de un intercambio estándar de DP. Los agentes osmóticos presentan diversos pesos moleculares: glucosa 180 Da, icodextrina 5.000-6.000 Da (rango 360-54.000), aminoácidos 126 Da (rango 75-204). A mayor peso molecular (por ejemplo, icodextrina), más larga es la permanencia de la molécula dentro del peritoneo y más tiempo se mantiene la ultrafiltración. Sin embargo, el aumento del volumen intraperitoneal es más lento con las moléculas de mayor peso molecular, por lo que estas no resultan interesantes para intercambios cortos.
La glucosa es el agente osmótico más usado. La icodextrina al 7,5% y los aminoácidos al 1,1% (Tabla 2) [19] [20] no evitan por completo el uso de glucosa, puesto que no se pueden utilizar en más de un inter-cambio diario.
Existen tres concentraciones diferentes de glucosa para adaptar la ultrafiltración a las necesidades del paciente. Las concentraciones más altas de glucosa obtienen mayor ultrafiltración, pero también potencian los efectos adversos de la glucosa y, en las soluciones convencionales, de los PDG. Por ello, en la actualidad su uso está muy limitado.
La concentración de glucosa varía según el fabricante (Tabla 2) y oscila entre 1,36 y 4,25%, o sea, entre 1.360 y 4.250 mg/dl, lo que genera una osmolaridad de 345 a 511 mOsm/l. La concentración de glucosa se expresa como concentración de dextrosa (glucosa monohidrato con un peso molecular de 198 Da) en EEUU y como concentración de glucosa (glucosa anhidra, peso molecular 180 Da) en Europa. De esta manera, concentraciones de dextrosa de 1,5, 2,5 o 4,25% corresponden a concentraciones de glucosa de 1,36, 2,27 y 3,86%, respectivamente; sin embargo, una concentración de glucosa del 1,5% corresponde a 1,65% de dextrosa. Esto puede generar confusión. En la (Tabla 2) presentamos las diferentes concentraciones de glucosa.
Biocompatibilidad
La biocompatibilidad es la capacidad de una técnica o sistema de cumplir su función sin generar una respuesta adversa clínicamente significativa en el huésped. En DP, este concepto se aplicó inicialmente a la influencia de las soluciones sobre las respuestas locales morfológicas y funcionales del peritoneo [21], pero las soluciones de DP pueden tener también efectos sistémicos [22]. Las soluciones convencionales son menos biocompatibles por la alta concentración de glucosa y de PDG. El pH bajo y las altas concentraciones de lactato también contribuyen a la pobre biocompatibilidad (Tabla 3) [23].
Distintas moléculas son responsables de distintos aspectos de la biocompatibilidad. Así, por ejemplo, el aporte continuo de glucosa tiene efectos metabólicos adversos, que discutimos más adelantes, pero los PDG parecen los principales responsables de la toxicidad para células y tejidos de las soluciones de DP. El lactato puede ser especialmente peligroso en pacientes con fallo hepático, puesto que es necesaria una buena función hepática para que se metabolice dicho lactato al tampón bicarbonato y en caso de no hacerlo, puede producir acidosis láctica.
Entre las consecuencias locales de la bioincompatibilidad se encuentran la disfunción y muerte de células mesoteliales y leucocitos, el empeoramiento de la defensa peritoneal frente a la infección, la lesión peritoneal con pérdida de mesotelio, la transformación epitelio-mesenquimal, su fibrosis, los cambios diabetiformes de los vasos y, eventualmente, la esclerosis peritoneal [24] [25] [26]. Entre las consecuencias sistémicas, se encuentran aumento de los productos de glucosilación avanzada (AGE) circulantes, efectos metabólicos de la glucosa y peor conservación de la función renal residual [10] [27] [28] [29] [30].
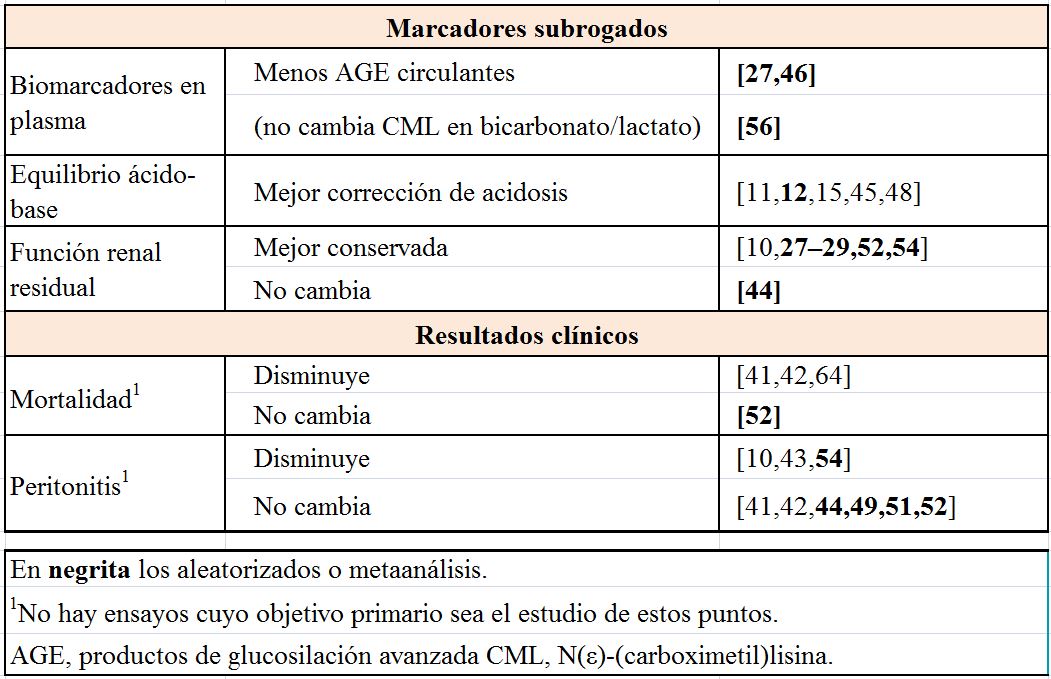
Las soluciones de DP más biocompatibles (Tabla 4) pueden tener pH neutro, ausencia de lactato o de glucosa o bajas o muy bajas concentraciones de PDG [1] [2]. La mayor biocompatibilidad de las nuevas soluciones está demostrada en estudios en células cultivadas y modelos animales. Ensayos clínicos y metaanálisis sugieren una mejor conservación de la función renal residual por las soluciones muy bajas en PDGs y, algunos de estos estudios observaron ventajas con respecto a la ocurrencia o gravedad de las peritonitis (Tabla 5).
Productos de degradación de la glucosa
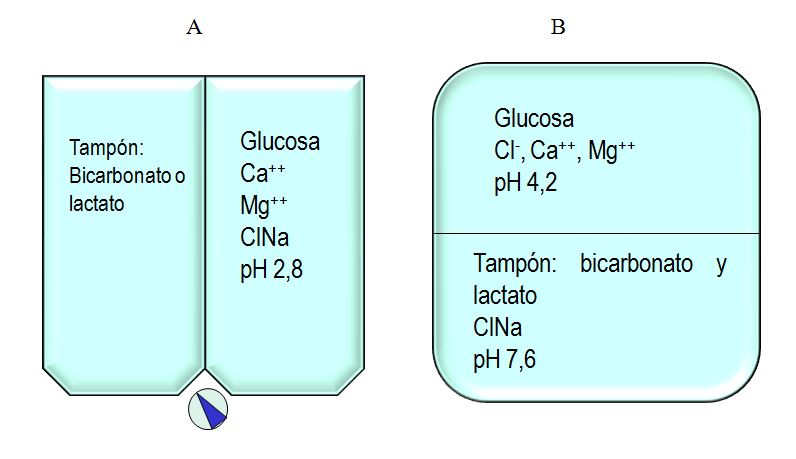
La esterilización por calor de las soluciones facilita la formación de PDG. Los PDG son moléculas pequeñas generadas a partir de la glucosa (Tabla 6) (Figura 2), muchas de ellas tóxicas y con mayor capacidad que la glucosa para reaccionar con proteínas, formando AGE (productos avanzados de la glicosilación), como pentosidina, N(e)-(carboximetil)lisina (CML) y otros. Los AGE causan disfunción de proteínas y activan el receptor para AGE (RAGE), que transmite señales intracelulares que modifican el comportamiento celular.
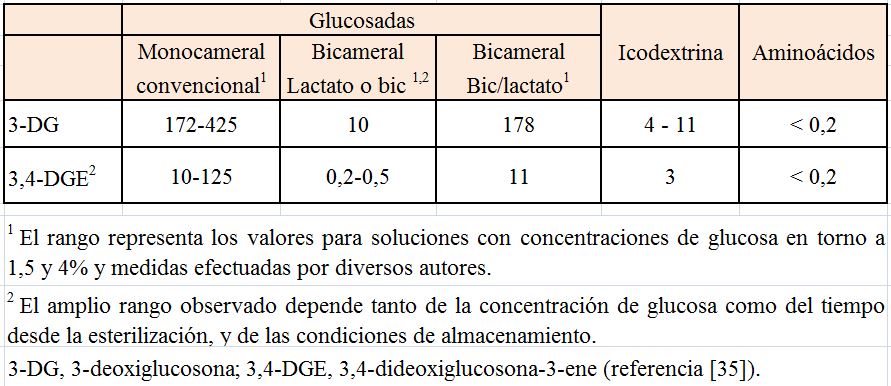
Varios PDG son tóxicos, pero solo 3,4-dideoxiglucosona-3-ene (3,4-DGE) ha demostrado ser letal para leucocitos, células mesoteliales y células renales (tubulares y podocitos) en las concentraciones habitualmente encontradas en las bolsas de DP [31] [32] [33] [34]. La 3-deoxiglucosona (3-DG), precursora de la 3,4-DGE, es también citotóxica, aunque en altas concentraciones (en torno a 500 µM), que no han sido encontradas por la mayoría de los autores en las soluciones empleadas (Tabla 6).
La concentración de PDG depende fundamentalmente del pH de esterilización de la glucosa y, también, de la concentración de glucosa (mayor en las soluciones de 4,25% de glucosa) y de la temperatura de almacenamiento [35] [36] [37]. A menor pH de esterilización de la glucosa, menos PDG, especialmente del más peligroso, 3,4-DGE. El pH óptimo de esterilización para disminuir la producción de PDG es 2,0-3,1 [35]. No es posible alcanzar este pH tan bajo en bolsas unicamerales, porque sería inviable infundirlas en el peritoneo. Por ello, las bolsas glucosadas convencionales unicamerales tienen un pH aproximado de 5,5 y una alta concentración de PDG. El problema se solucionó con bolsas tricamerales (hoy en desuso) o bicamerales, que permiten esterilizar la glucosa a un pH bajo, separada del tampón, y disminuir así la producción de PDG (Figura 1). Al mezclar el contenido de ambas cámaras antes de la infusión, la solución adquiere un pH más fisiológico [1] [2].
La concentración de PDG más tóxico identificado hasta el momento, 3,4-DGE, varía con la temperatura de almacenamiento: es más alta en soluciones recién esterilizadas por calor y más baja a los 2 meses de su almacenamiento a temperatura ambiente (25 °C), pero puede volver a elevarse si la bolsa queda expuesta durante horas a temperaturas más altas (Figura 3) [36]. Esto ha hecho renacer el interés por la temperatura de transporte y almacenaje de las soluciones, especialmente en los meses de verano. Este problema no existe con las soluciones bicamerales, que tienen un pH alrededor de 3 en la cámara de glucosa.
Soluciones glucosadas convencionales
Consideramos soluciones convencionales aquellas en bolsas unicamerales, con glucosa como agente osmótico y lactato como tampón. Estas soluciones tienen un pH bajo, un alto contenido de PDG y presentan los problemas de biocompatibilidad referidos en el apartado anterior, además de los secundarios al aporte de glucosa.
La glucosa es el único agente osmótico que se ha mostrado seguro y eficaz para su administración en múltiples intercambios en 24 h. Es económica y aporta calorías. No obstante, no es el agente osmótico ideal y puede facilitar o agravar la hiperglucemia e hiperinsulinemia, y provocar picos no detectados de hiperglucemia en diabéticos, hiperlipidemia y obesidad.
Las soluciones convencionales dañan la membrana peritoneal a largo plazo, aunque en la mayor parte de los estudios no es posible distinguir el efecto de la glucosa del efecto de los PDG, y los estudios preclínicos sugieren que los PDG son los principales responsables [38]. Además, en los pacientes con alto transporte peritoneal, la glucosa pierde eficacia para ultrafiltrar. La absorción de glucosa varía según el tipo de trans-porte peritoneal de solutos pequeños (los altos transportadores absorben más), con el tiempo de permanencia (se absorbe más a mayor prolongación del intercambio) y con la concentración de glucosa de la bolsa (Figura 4). Se ha calculado que, la absorción oscila entre 100-200 g de glucosa/24 h para un paciente promedio en DP continua ambulatoria (aprox. 8 kcal/kg/d) [39].
Las soluciones convencionales glucosadas tienen un pH de 5,5 (rango 5-6). El pH bajo previene la caramelización de la glucosa durante la esterilización por calor y disminuye, aunque no evita, la generación de PDG. Un mayor descenso del pH disminuye más la generación de PDG, pero provocaría dolor a la infusión y quizá otros efectos adversos a más largo plazo. De hecho, el pH de 5,5 produce dolor en algunos pacientes. Este pH es tamponado por bicarbonato que difunde desde la circulación al interior de la cavidad peritoneal, alcanzando 7 en media hora y por encima de 7,3 en 90-120 min [13]. Las nuevas soluciones de DP no producen dolor a la infusión, y el pH ya es fisiológico a la infusión o se normaliza más rápidamente.
Nuevas soluciones de diálisis peritoneal
Hay dos abordajes para diseñar nuevas soluciones de DP (Tabla 4) [1] [2]: a) el uso de bolsas bicamerales para mejorar las soluciones glucosadas, disminuyendo el contenido de PDG y acercando el pH al fisiológico (con o sin uso de bicarbonato), total o parcialmente, y b) la sustitución de la glucosa por otros agentes osmóticos como la icodextrina o los aminoácidos, conservando el lactato como tampón.
Soluciones glucosadas bicamerales
Las bolsas bicamerales permiten esterilizar la glucosa a pH bajo y separar el bicarbonato del calcio y del magnesio (Figura 1). Estas soluciones difieren entre sí en el pH de la infusión, el tampón y el contenido de PDG, que puede ser bajo o muy bajo, es decir no todas están desarrolladas con los mismos niveles de PDGs (Tabla 2). El contenido de PDG depende del pH de esterilización de la cámara con glucosa: a menor pH, menos PDG (Figura 1). El pH de infusión es más fisiológico (7,0-7,4) que en las convencionales, sobre todo en las tamponadas con bicarbonato.
Ventajas e indicaciones. La principal ventaja de estas soluciones es la mayor biocompatibilidad resultante de la baja concentración de PDG, pH más fisiológico y, en algunos casos, ausencia de lactato. La mayor biocompatibilidad sugiere que deberían ser las soluciones de elección si los recursos lo permiten, si bien no hay ensayos clínicos que hayan evaluado como resultado primario aspectos como la mortalidad. Entre las ventajas reportadas encontramos una menor tasa de apoptosis mesotelial en el efluente, menor concentración de AGE circulantes, mejor control de la acidosis metabólica, mejor conservación de la función renal residual, menor incidencia o gravedad de peritonitis, mejor conservación de la ultrafiltración y, en estudios de registros, menor mortalidad (Tabla 5) [10] [11] [27] [29] [41] [42] [43] [44] [45] [46] [47] [48] [49]. Es importante también señalar que no todos los estudios han encontrado estas ventajas. Esta variabilidad puede depender del diseño del estudio, pero también del tipo de solución estudiada. En este sentido, hay varios tipos de soluciones glucosadas biocompatibles no comparables en cuanto al contenido de PDG (Tablas 2) (Tabla 6). En general, los peores resultados se han reportado en los estudios y ensayos clínicos que usaron las soluciones con un contenido bajo (pero no muy bajo) de PDG (lactato/bicarbonato) [50] [51] o los ensayos clínicos utilizaron de forma indistinta soluciones con un contenido bajo o muy bajo de PDG.
Los metaanálisis disponibles analizaron todos los ensayos controlados y no tuvieron en cuenta las diferencias en el contenido de PDGs entre las diferentes soluciones bicamerales. Concluyeron que las nuevas soluciones aumentan la diuresis y conservan la función renal residual, pero no demostraban efectos significativos sobre peritonitis o supervivencia del paciente o de la técnica [52] [53]. Esta falta de evidencia se debe en parte a la falta de estudios con diseño adecuado [52].
El efecto sobre la función renal residual ha sido el objetivo principal de cuatro estudios aleatorizados a largo plazo (12-18 meses) con tres soluciones bicamerales o tricamerales (estas últimas en desuso en la actualidad) de diferentes características [28] [29] [44] [54]. Las soluciones muy bajas en PDG conservaron mejor la función renal residual [28] [29] [54]. Algunos ensayos que usaron soluciones con muy bajo contenido de PDG observaron menor tasa de incidencia y datos de menos gravedad de peritonitis [54], que en estudios farmacoeconómicos compensaron el mayor coste de las soluciones bicamerales [55]. Sin embargo, estas observaciones no se reprodujeron en los ensayos que mezclaron soluciones de varios proveedores con contenido bajo y muy bajo en PDGs [51].
El efecto sobre PDG circulantes tampoco fue homogéneo: los niveles del AGE CML bajaron solo en los ensayos clínicos que usaron las soluciones biocompatibles con niveles muy bajos de PDG [27] [56]. En ensayos clínicos, estas soluciones muy bajas en PDGs disminuyeron la inflamación sistémica [57].
Un ensayo clínico en niños objetivó similar corrección de la acidosis con soluciones biocompatibles con lactato y con bicarbonato puro, pero mejor conservación de la ultrafiltración con bicarbonato [58].
Inconvenientes. Las soluciones glucosadas bicamerales mantienen los efectos adversos de la propia glucosa. Las soluciones tamponadas con lactato, lactato/bicarbonato o bicarbonato en algunos pacientes ultrafiltran menos que las convencionales, lo cual podría estar en relación con un mayor transporte peritoneal de moléculas pequeñas [27] [59]. Este efecto es agudo (observable con un solo intercambio), reversible al dejar de usar la solución y no es indicativo de lesión peritoneal, ni del aumento progresivo de la permeabilidad a solutos que se observa durante los años en DP, como consecuencia de la lesión peritoneal inducida por soluciones convencionales. Sin embargo, puede facilitar la sobrecarga de volumen, especialmente al comienzo [57]. El interés en conocer las posibles diferencias en el comportamiento de las distintas soluciones radica en comprender mejor la causa de estas diferencias, que podrían estar relacionadas con las diferencias en pH, contenido de PDG y tampón (Tabla 2). De hecho, las soluciones bicamerales con lactato conservaron mejor la ultrafiltración a largo plazo que las convencionales [60]. Las soluciones tamponadas con altas concentraciones (39-40 mM) de bicarbonato o de lactato/bicarbonato pueden corregir excesivamente la acidosis en algunos pacientes, causando alcalosis metabólica [15] [18] [61]. Esto podría favorecer la calcifi-cación vascular [17].
Otros agentes osmóticos
La icodextrina y los aminoácidos son agentes osmóticos alternativos a la glucosa.
Icodextrina
La icodextrina o poliglucosa es un carbohidrato de alto peso molecular procedente de la hidrólisis del almidón de maíz. En las soluciones de DP se usa a una concentración única del 7,5% (Figura 4) [19]. Consiste en una mezcla de polímeros de glucosa de diferente tamaño (entre 2 y 300 moléculas de glucosa) con un peso molecular medio de 13.000 a 19.000 Da, con una mediana de 5.000 a 6.500 Da (rango 360-54.000).
Ventajas
Es una solución isoosmolar que induce ultrafiltración por presión oncótica. La icodextrina se absorbe por los vasos linfáticos, de forma mucho más lenta que la glucosa, por lo que la presión oncótica es duradera, y la ultrafiltración es lineal y más sostenida que la inducida por glucosa (Figura 5). Durante un intercambio de 10-16 h se absorbe un 40% de la icodextrina del intercambio [62] [63] (Figura 4). Estas características de la icodextrina sugieren sus indicaciones teóricas. Sin embargo, únicamente un metaanálisis reciente objetivó una mayor ultrafiltración [52], y un gran ensayo clínico objetivó que el uso de icodextrina y aminoácidos en diabéticos durante 6 meses se asoció a más efectos adversos graves y muertes, incluyendo los debidos a sobrecarga de volumen, aunque pudo demostrar el objetivo primario de mejor control metabólico de la diabetes [50]. Estos resultados de un ensayo clínico cuestionan los de estudios observacionales de registros [64]. Sin embargo, el ensayo alcanzó su objetivo primario de demostrar un mejor control glucémico al limitar la absorción de glucosa desde el peritoneo. En los pacientes randomizados a icodextrina, aminoácidos y glucosa también se objetivaron niveles más bajos de triglicéridos, pero no de LDL colesterol que en los pacientes que usaron solo glucosa como agente osmótico.
Indicaciones
Se contemplan tres escenarios principales:
• Intercambio largo diurno en DP automática (como última infusión) o nocturno en DPCA, para mantener la ultrafiltración y aumentar la eliminación de sodio [65] [66] [67] [68] [69]. En estudios aleatorizados controlados, la icodextrina mejoró el estado de hidratación de los pacientes [67] [68] [69]. La icodextrina permite una mayor ultrafiltración en intercambios largos que un solo intercambio con soluciones con 1,5 y 2,3% de glucosa, y una mayor ultrafiltración que la solución al 4,25% de glucosa en pacientes altos transportadores. Al no ser una pequeña molécula, la icodextrina obtiene ultrafiltración en pacientes con fallo de ultrafiltración por alto transporte de pequeños solutos. La capacidad para obtener ultrafiltración en este tipo de pacientes permite prolongar la vida de la técnica, retrasando el paso a hemodiálisis. La mayor ultrafiltración permite obtener un mayor aclaramiento de moléculas cuando se compara un intercambio prolongado (aprox. 12 h) de icodextrina con otro de glucosa [68]. Sin embargo, el aclaramiento es menor con un intercambio largo de icodextrina que con dos intercambios de glucosa más cortos (aprox. 6 h).
• Limitar la exposición a altas concentraciones de glucosa y PDG y la absorción de glucosa. Esto puede contribuir a conservar la funcionalidad de la membrana peritoneal [65]. Aunque existen menos diferencias en cuanto a la absorción de la cantidad total de carbohidratos, con la icodextrina se evitan los picos de absorción de glucosa, se gana menos peso, mejoran los triglicéridos (pero no el colesterol), el control glucémico y los niveles de HbA1C de diabéticos mal controlados [50] [68] [70] y la resistencia a la insulina en no diabéticos [71].
• Mantenimiento de la ultrafiltración durante episodios de peritonitis, ya que la capacidad de ultra-filtración de la icodextrina es independiente de la permeabilidad peritoneal a pequeños solutos [72].
Peculiaridades. La amilasa degrada la icodextrina. En el ser humano apenas hay amilasa en la cavidad peritoneal (a diferencia de algunos roedores, por lo que los estudios preclínicos no reflejan bien la situación humana), pero la amilasa circulante degrada la icodextrina absorbida, lo que aumenta los niveles de maltosa circulantes y disminuye la natremia y la amilasa (Figura 4).
La icodextrina produce un aumento hasta niveles no fisiológicos de la concentración plasmática de maltosa (aumento de maltosa 20-300 veces por encima de lo fisiológico, hasta 120 mg/dl o 3 mM, comparado con las concentraciones fisiológicas de glucosa de 3,3 a 5,5 mM), maltotriosa y otros polímeros de glucosa [62] [73] [74]. Estos metabolitos son normalmente excretados en la orina o degradados a glucosa por la maltasa tisular, fundamentalmente en el riñón. En la insuficiencia renal fallan estos mecanismos de eliminación, lo que facilita la acumulación de maltosa, y limita la utilización de icodextrina a un intercambio cada 24 h. Durante el intercambio de icodextrina se acumulan maltosa y otros multímeros de glucosa, y durante los otros intercambios se dializan. Hasta el momento no se han identificado efectos tóxicos de la acumulación de maltosa.
La maltosa y otros oligosacáridos acumulados en la sangre de pacientes tratados con icodextrina interfieren con ciertos lectores de glucosa y tiras reactivas, dando como resultado lecturas falsamente elevadas de glucemia [75] [76]. Se deben utilizar exclusivamente lectores de glucosa y tiras reactivas que utilicen los métodos específicos para la glucosa habituales en los laboratorios clínicos, como los basados en glucosa oxidasa (GO), hexoquinasa, glucosa deshidrogenasa con nicotina adenina dinucleótido (GDH-NAD) o glucosa deshidrogenasa con flavina adenina dinucleótida (GDH-FAD). No se deben usar aquellos con glucosa deshidrogenasa pirrolquinolinaquinona (GDH-PQQ) o glucosa-colorante-oxidorreductasa, que detectan tanto glucosa como maltosa. Tras interrumpir el uso de icodextrina, los niveles plasmáticos de icodextrina y sus metabolitos, tardan un mínimo de 14 días en volver a ser indetectables [69]. Durante este tiempo, el uso de lectores de glucemia inadecuados puede sugerir hiperglucemia, que podría inducir a prescribir tratamiento con insulina sin mejoría de la glucemia y, por lo tanto, exponer al paciente a dosis peligrosas de insulina u otros hipoglucemiantes.
La maltosa y otros oligosacáridos acumulados en la sangre de pacientes tratados con icodextrina pueden causar una disminución leve de la natremia, sin hipoosmolaridad, hasta valores en torno a 135-137 mmol/l, relacionados con un aumento del gap osmolal por la presencia de metabolitos circulantes de icodextrina (que justifican un incremento del gap osmolal de aproximadamente 8 mOsm/kg) [69] [74].
Los niveles medidos de amilasa en plasma disminuyen, debido a que los metabolitos circulantes de icodextrina interfieren con el ensayo [69]. Por ello, si se sospecha pancreatitis, hay que medir los niveles de lipasa.
Efectos adversos
El efecto adverso más frecuente de icodextrina en ensayos clínicos fue la hipersensibilidad cutánea (2,5-5%), que suele aparecer en las tres primeras semanas y suele requerir la interrupción del tratamiento, aunque en algunos pacientes desaparece a pesar del uso continuado de icodextrina [68].
A finales de los años noventa y principios del presente milenio se produjo una epidemia de peritonitis estériles en pacientes tratados con icodextrina. La causa fue la contaminación de algunas partidas con peptidoglicano, un componente de la pared de las bacterias gram positivas [77]. Nuevos sistemas de control de la producción han prácticamente eliminado el problema y no se ha objetivado que la icodextrina modifique la incidencia de peritonitis con cultivo positivo o negativo [78].
Aminoácidos
Las soluciones de aminoácidos permiten limitar el uso de glucosa y aportar aminoácidos con fines nutricionales [20]. La única solución comercializada contiene un 1,1% de aminoácidos (concentración de aminoácidos de 87 mM con un peso molecular medio de 126 Da de los que se absorbe el 65% (aproxima-damente 15 g/bolsa) durante un intercambio de 4-6 h (Figura 4). Esto reemplaza los aproximadamente 5-8 g/día de proteínas y 3 g/día de aminoácidos que se eliminan en las bolsas glucosadas [79]. El poder osmótico es comparable al de 1,5% de glucosa, con una osmolaridad ligeramente mayor (Tabla 2) y se ha reportado una ultrafiltración ligeramente mayor, de aproximadamente 100 ml a las 4 h, a pesar de una mayor absorción del agente osmótico. La mayor absorción viene probablemente determinada por su menor peso molecular medio y por vasodilatación inducida por ciertos aminoácidos [79] [80].
Ventajas
El uso de aminoácidos disminuiría la absorción de glucosa, especialmente en diabéticos y obesos. Además, tiene una eficacia moderada como suplemento nutricional en pacientes malnutridos. En estudios a corto plazo, mejoró la síntesis de proteínas cuando se administró con una fuente adecuada de calorías, es decir, administrándolo con la comida o en cicladora con bolsas de glucosa [20] [81] [82]. El efecto es menos consistente a largo plazo, probablemente porque hay otros factores que influyen en la albuminemia, como la inflamación, acidosis o aporte calórico insuficiente [83]. En un estudio de 3 años en pacientes malnutridos, el uso de aminoácidos al 1,1% mantuvo mejor la albuminemia [84]. Sin embargo, en el mayor ensayo clínico hasta la fecha, a los 6 meses la albúmina fue significativamente menor en los diabéticos con soluciones glucosadas, aminoácidos e icodextrina que en los que recibieron solo soluciones glucosadas [50].
También se ha comunicado un descenso del fósforo sérico atribuido al aporte de aminoácidos no acompañados de fosfato [83]. En este sentido, el aporte dietético de la misma cantidad de aminoácidos supone la ingesta de aproximadamente 300 mg de fosfato.
Inconvenientes
Se puede usar un único intercambio diario, ya que un mayor número de bolsas favorece la acidosis metabólica (que se puede compensar con tratamiento oral con bases o con soluciones de DP con más alto contenido de tampón) y aumenta la urea [82] [83] [85]. La tendencia a la acidosis y a la uremia es más acusada en pacientes catabólicos, por lo que se deben corregir los factores que condicionan hipercatabolismo y mantener un aporte calórico adecuado que frene el catabolismo de aminoácidos como fuente de energía. Esto se puede conseguir con un aporte calórico oral o mezclando Nutrineal® con soluciones glucosadas simultáneamente en intercambios de la cicladora.
Combinaciones e individualización del tratamiento
La combinación de soluciones glucosadas y no glucosadas (una bolsa de icodextrina y una de aminoácidos al día) permite disminuir la exposición a glucosa y PDG, y aprovechar la sinergia entre soluciones, como combinar aminoácidos con una fuente de calorías (glucosa) en cicladora o aminoácidos con soluciones que corrigen mejor la acidosis, como las basadas en lactato/bicarbonato [20] [85]. Sin embargo, como hemos comentado antes, los resultados de un gran ensayo clínico fueron decepcionantes: si bien la combinación de soluciones glucosadas y no glucosadas (una bolsa de icodextrina y una de aminoácidos al día) permitió mejorar el control glucémico en diabéticos y mejorar los niveles de triglicéridos, no modificó el LDL colesterol, y se asoció a una mayor disminución (disminución, no aumento) de la albumina sérica y a más acontecimientos adversos graves [50]. Como solo se puede usar un intercambio diario de icodextrina o aminoácidos, lo habitual es usarlas en combinación con soluciones glucosadas. Hay una experiencia limitada con el uso de dos intercambios diarios de icodextrina durante periodos cortos de tiempo para aumentar la ultrafiltración [86].
Otros factores a tener en cuenta para individualizar el tratamiento es el tiempo previsto de permanencia del paciente en la técnica (las consecuencias de la bioincompatibilidad se acumulan con el tiempo), la presencia de diabetes o dislipidemia, el balance de fluidos del paciente, PTH y la tendencia a trastornos de la concentración de calcio o magnesio, o a la acidosis o alcalosis.
¿Qué dicen las guías clínicas?
Las recientes guías cardiovasculares y metabólicas 2015 de la Sociedad Internacional de Diálisis Peritoneal (ISPD) hacen referencia a soluciones de DP [87] [88]. Lo que no dicen es casi tan importante como lo que dicen.
En el apartado de control glucémico en diabéticos, indican que:
“Sugerimos considerar un intercambio diario de icodextrina en el periodo largo en paciente diabéticos en DP para mejorar el control glucémico. (2C)”. Llama la atención lo matizada que está la sugerencia.
En el apartado de malnutrición proteico energética, no hacen ninguna recomendación o sugerencia sobre soluciones con aminoácidos. Tampoco mencionan las soluciones libres de glucosa en el apartado de control lipídico.
En el apartado de función renal residual, indican que:
“Sugerimos considerar usar soluciones de DP con pH neutro y bajo contenido en PDG para conservar mejor la función renal residual si se espera su uso durante 12 meses o más. (2B)”
Finalmente, en el apartado de enfermedad mineral y ósea indican:
“Sugerimos usar una concentración de calcio en la solución de DP de 1,25 mM a fin de evitar un balance positivo de calcio o hipercalcemia”
¿Esperamos nuevas soluciones de DP?
La introducción de una nueva solución de DP es un proceso muy costoso y no hay nuevas soluciones con un horizonte temporal inmediato. En los últimos 5 años se han evaluado en la clínica algunas alternativas a las soluciones actuales.
• Nuevos agentes osmóticos. En 15 pacientes se estudió la L-carnitina 0,1-0,25% asociada a glucosa al 1,5-2,5%. La L-carnitina aumentó la ultrafiltración obtenida con glucosa sola y, durante 4 meses, aumentó la sensibilidad a insulina [89] [90]. Esta solución continúa en desarrollo clínico.
• Se han ensayado soluciones más bajas en sodio para aumentar el aclaramiento de sodio, pero pueden causar hiponatremia y requerirían mayores concentraciones de glucosa para mantener la osmolaridad y ultrafiltración [91]. En un ensayo clínico reciente, una solución con una concentración de sodio de 125 mM consiguió un balance negativo de sodio 1,2 g/día mayor que las soluciones habituales con una concentración de sodio de 134 mM y esto se asoció a un descenso de la presión arterial, y también del Kt/Vurea renal, quizá relacionado con contracción de volemia [92].
Tablas
Figuras
![Figura 2. Formación de productos de degradación de la glucosa (PDG). Los PDG se forman inicialmente por deshidrataciones sucesivas de la molécula de glucosa para, posteriormente, originar moléculas más pequeñas. Existe un equilibrio entre 3-DG, 3-DA y 3,4-DGE, dependiente de la temperatura. El equilibrio se desplaza a la derecha, formando 3,4-DGE, que es más tóxico, al subir la temperatura. Las altas concentraciones de glucosa son citotóxicas y generan AGE, pero estos efectos son más evidentes con 3-DG y, sobre todo, con 3,4-DGE. El grosor de las líneas discontinuas representa la capacidad para inducir efectos biológicos. AGE, productos avanzados de glucosilación; 3-DA, 3-deoxialdos-2-ene; 3-DG, 3-deoxiglucosona; 3,4-DGE, 3,4-dideoxiglucosona-3-ene; HMF, hidroximetilfurfural. Otros PDG incluyen furaldehido, formaldehido, acetaldehído, metilglioxal y glioxal. Adaptado de referencia [23]. Figura 2. Formación de productos de degradación de la glucosa (PDG). Los PDG se forman inicialmente por deshidrataciones sucesivas de la molécula de glucosa para, posteriormente, originar moléculas más pequeñas. Existe un equilibrio entre 3-DG, 3-DA y 3,4-DGE, dependiente de la temperatura. El equilibrio se desplaza a la derecha, formando 3,4-DGE, que es más tóxico, al subir la temperatura. Las altas concentraciones de glucosa son citotóxicas y generan AGE, pero estos efectos son más evidentes con 3-DG y, sobre todo, con 3,4-DGE. El grosor de las líneas discontinuas representa la capacidad para inducir efectos biológicos. AGE, productos avanzados de glucosilación; 3-DA, 3-deoxialdos-2-ene; 3-DG, 3-deoxiglucosona; 3,4-DGE, 3,4-dideoxiglucosona-3-ene; HMF, hidroximetilfurfural. Otros PDG incluyen furaldehido, formaldehido, acetaldehído, metilglioxal y glioxal. Adaptado de referencia [23].](https://static.elsevier.es/nefro/monografias/1/168/890.jpg)
![Figura 4. Destino de los agentes osmóticos de las soluciones de DP. A. Glucosa. La absorción de glucosa varía ampliamente en función de la duración del intercambio (de 1 a 10 h), concentración de glucosa inicial de la bolsa y tipo de transporte peritoneal de pequeños solutos. Los valores presentados corresponden a un intercambio de 2 l y 2,3% de glucosa en un transportador promedio, y el rango, a los valores extremos correspondientes a transportadores altos y bajos. B. Icodextrina. Destino de la icodextrina de las soluciones de DP en un intercambio de 10-16 h. Los hexágonos representan esquemáticamente las moléculas de glucosa (cada hexágono es una molécula de glucosa), maltosa, polímeros intermedios e icodextrina. C. Aminoácidos. Destino de los aminoácidos de las soluciones de DP. La absorción de aminoácidos varía con el tipo de transporte peritoneal de pequeños solutos y con el tiempo de permanencia [80]. En situaciones de anabolismo, los aminoácidos se usan para sintetizar proteínas, pero cuando predomina el catabolismo o falta un aporte calórico pueden generar productos de degradación como la urea y acidosis. AGE, productos avanzados de glucosilación; PDG, productos de degradación de la glucosa. Figura 4. Destino de los agentes osmóticos de las soluciones de DP. A. Glucosa. La absorción de glucosa varía ampliamente en función de la duración del intercambio (de 1 a 10 h), concentración de glucosa inicial de la bolsa y tipo de transporte peritoneal de pequeños solutos. Los valores presentados corresponden a un intercambio de 2 l y 2,3% de glucosa en un transportador promedio, y el rango, a los valores extremos correspondientes a transportadores altos y bajos. B. Icodextrina. Destino de la icodextrina de las soluciones de DP en un intercambio de 10-16 h. Los hexágonos representan esquemáticamente las moléculas de glucosa (cada hexágono es una molécula de glucosa), maltosa, polímeros intermedios e icodextrina. C. Aminoácidos. Destino de los aminoácidos de las soluciones de DP. La absorción de aminoácidos varía con el tipo de transporte peritoneal de pequeños solutos y con el tiempo de permanencia [80]. En situaciones de anabolismo, los aminoácidos se usan para sintetizar proteínas, pero cuando predomina el catabolismo o falta un aporte calórico pueden generar productos de degradación como la urea y acidosis. AGE, productos avanzados de glucosilación; PDG, productos de degradación de la glucosa.](https://static.elsevier.es/nefro/monografias/1/168/892.jpg)
![Figura 3. La concentración de 3,4-DGE en las soluciones de DP es dinámica. Evolución de las concentraciones de 3-DG y 3,4-DGE en las soluciones de DP con el tiempo postesterilización almacenadas a 25 °C y efecto de subir la temperatura a 40 °C y de 24 h a 60 °C, temperaturas que se pueden alcanzar en verano en algunos países durante el transporte o almacenamiento. Valores correspondientes a soluciones convencionales de 1,5% de glucosa. Los cambios en la concentración de 3,4-DGE son mayores con soluciones convencionales de 2,3 y 4,25% de glucosa y mucho menos marcados en las soluciones bicamerales con un menor pH en la cámara de la glucosa. Adaptado de referencias [35,36]. Figura 3. La concentración de 3,4-DGE en las soluciones de DP es dinámica. Evolución de las concentraciones de 3-DG y 3,4-DGE en las soluciones de DP con el tiempo postesterilización almacenadas a 25 °C y efecto de subir la temperatura a 40 °C y de 24 h a 60 °C, temperaturas que se pueden alcanzar en verano en algunos países durante el transporte o almacenamiento. Valores correspondientes a soluciones convencionales de 1,5% de glucosa. Los cambios en la concentración de 3,4-DGE son mayores con soluciones convencionales de 2,3 y 4,25% de glucosa y mucho menos marcados en las soluciones bicamerales con un menor pH en la cámara de la glucosa. Adaptado de referencias [35,36].](https://static.elsevier.es/nefro/monografias/1/168/891.jpg)