Complicaciones no Infecciosas en Diálisis Peritoneal
ÍNDICE:
1. Complicaciones hidroelectrolíticas y metabólicas
1.1. Trastornos del agua
1.2. Trastornos del equilibrio ácido-base
1.3. Trastornos del Na y del K
1.4. Enfermedad óseo-metabólica
1.5. Hiperglicemia, aparición de diabetes mellitus de novo
1.6. Dislipemia
1.7. Malnutrición proteico-energética
1.8. Complicaciones cardiovasculares
2. Complicaciones relacionadas con el catéter de DP
2.1. Mala función
2.2. Obstrucción
2.3. Migración
2.4. Atrapamiento
3. Complicaciones intrabdominales
3.1. Hemoperitoneo
3.2. Quiloperitoneo
3.3. Líquido peritoneal turbio acelular asociado a BCC
3.4. Pneumoperitoneo
3.5. Estreñimiento
4. Complicaciones relacionadas con la presión intraperitoneal
4.1. Dolor abdominal
4.2. Hernias
4.3. Fugas abdominales
4.4. Fuga pleural o hidrotórax
4.5. Trastornos de la función peritoneal
4.6. Alteraciones hemodinámicas
4.7. Alteraciones de la función respiratoria
4.8. Otras: dolor lumbar, reflujo gastroesofágico, hemorroides, prolapsos, etc.
1. Complicaciones hidroelectrolíticas y metabólicas
La causa más frecuente de morbimortalidad del enfermo en Diálisis Peritoneal (DP), como de todos los enfermos renales, es la cardiovascular. Para minimizar los riesgos debe alcanzarse la adecuación en DP: dosis de diálisis correcta, normohidratación, tensión arterial (TA) controlada, tratar la anemia y la enfermedad óseo-metabólica; y tener un adecuado estado de nutrición. De todos estos temas hablaremos en este apartado.
1.1. Trastornos del agua
El objetivo de la DP junto con la depuración de solutos es conseguir la normohidratación. La hiperhidratación es más frecuente que la deshidratación. Aunque el tratamiento con DP ofrece una mayor estabilidad hemodinámica, los enfermos pueden presentar deshidratación que se suele manifestar con hipotensión. Es importante evitar la hipotensión para preservar la Función Renal Residual (FRR). Debemos estar atentos a los balances hídricos y a la prescripción de fármacos antihipertensivos. Por este motivo es tan importante el autocontrol del peso y TA diario.
Los signos de hiperhidratación son los edemas, la hipertensión arterial (HTA) y la insuficiencia cardiaca. Una hipervolemia sostenida da lugar a hipertrofia ventricular izquierda, cardiopatía hipertensiva, desarrollo de hipertensión pulmonar y produce un aumento de la morbimortalidad [1]. Además de la valoración clínica básica (edemas, aumento de peso e HTA), la utilización regular de la bioimpedancia puede ser de utilidad [2]. En manos expertas puede utilizarse también la ecografía torácica [3]. La valoración de los niveles de NTproBNP pueden ser de interés, pero su uso no se ha generalizado en DP [2] [4]. Es muy frecuente que los enfermos en DP tengan una moderada hiperhidratación comparados con los enfermos en HD. La valoración clínica clásica suele infravalorar el estado de hidratación [3]. Es mucho más fácil conseguir la normohidratación en HD.
La hiperhidratación es más frecuente cuando se pierde la FRR y es más difícil conseguir una correcta Ultrafiltración (UF) en DP. Es necesario combinar una adecuada prescripción de DP, con medidas para la preservación de la FRR, un buen cumplimiento dietético con restricción de agua y sal; y el uso de diuréticos de asa a dosis altas (hasta 240 mg al día de furosemida) que pueden combinarse con diuréticos tiazídicos o antialdosterónicos [5]. Conocer la función peritoneal y el transporte de agua, incluyendo el posible fallo de UF es fundamental para orientar la prescripción [1]. El uso racional de la DP contínua ambulatoria (DPCA) y la diálisis peritoneal automatizada (DPA), junto con la Icodextrina, facilita la obtención de una UF adecuada [6]. El control del volumen es tan importante en DP que ha recibido gran atención específica en las Guías de Adecuación de la ISPD publicadas en 2020 [7].
1.2. Trastornos del equilibrio ácido-base
Actualmente están disponibles los llamados líquidos peritoneales (LP) biocompatibles, con dos compartimentos, algunos tamponados con bicarbonato y con pH > 7. Los LP clásicos con pH bajos utilizan el lactato como tampón, pero no suelen dan problemas de acidosis metabólica porque el lactato se metaboliza a bicarbonato. Sin embargo, en una gran cohorte de 10.400 enfermos prevalentes en DP de EEUU, un 25 % tenían un bicarbonato sérico < 22 mEq/L. Estos enfermos tenían una mayor mortalidad cardiovascular y de cualquier causa [8].
Con el uso generalizado de LP con bicarbonato, de uso universal en nuestro ámbito, es más infrecuente que los enfermos en DP tengan acidosis metabólica y se observa una tendencia a la alcalosis metabólica con bicarbonato plasmático > 30 mEq/L, sin grandes repercusiones clínicas.
La acidosis metabólica se ha relacionado con la malnutrición, una pérdida más rápida de FRR, más resistencia a la insulina, más disfunción tiroidea y peor evolución de la enfermedad óseo-metabólica renal. En el caso de enfermos con bicarbonatos plasmáticos < 23 mEq/L se recomienda prescribir bicarbonato oral [9].
Con la utilización de LP con aminoácidos, solo un intercambio al día puede aparecer una acidosis metabólica que requiera tratamiento con bicarbonato oral. También puede haber una tendencia a la acidosis metabólica con el uso de algunos quelantes del fósforo como el Sevelamer, que se suele corregir al utilizar Carbonato de Sevelamer o al combinarlo con quelantes cálcicos [10]. El bicarbonato oral debe usarse con precaución en pacientes con HTA o anúricos por el aporte de Na.
1.3 Trastornos del Na y del K.
Trastornos del Na
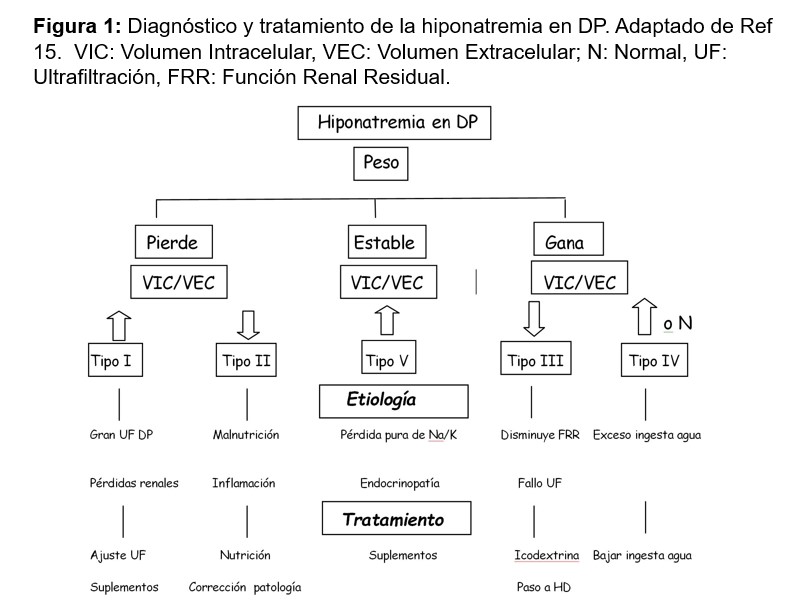
La hiponatremia puede aparecer asociada a los múltiples problemas de salud de estos enfermos y es mucho más frecuente que la hipernatremia. Los mecanismos fundamentales de la hiponatremia en DP son: una ganancia neta excesiva de agua debido a una ingesta excesiva junto con una baja UF de agua libre, un balance negativo de Na/K debido a una baja ingesta de Na/K con una elevada eliminación de Na/K, el paso de agua del compartimento intracelular al extracelular por el efecto osmótico de los metabolitos de la Icodextrina, el uso de diuréticos, y todo ello favorecido por situaciones de hipermetabolismo y malnutrición. Otras causas a tener en cuenta son: la inadecuada supresión de la ADH por fármacos (opióides y psicótropos) y enfermedades endocrinológicas como el hipotiroidismo y el hipoaldosteronismo [11].
La hiponatremia en DP se ha relacionado con un aumento de la morbimortalidad y una pérdida más rápida de la FRR. En 4.687 enfermos en DP de EEUU se detectó un Na < 136 mEq/L en un 9 % de los pacientes, y un Na > 144 mEq/L en el 4 %. La hiponatremia se relacionó con ser mujer, la diabetes, hacer DP manual, una menor FRR, tener una enfermedad tiroidea y una albúmina más baja [12].
Es frecuente la aparición de leve hiponatremia con el uso de la Icodextrina, con disminución de unos 2 mEq, sin repercusiones clínicas. La causa no está del todo aclarada, pero se piensa que es multifactorial: pseudohiponatremia debido a la presencia de maltosa como metabolito de la Icodextrina, hiponatremia verdadera por la extracción mayor de Na e hiponatremia dilucional en enfermos con exceso de volumen extracelular [13]. De manera anecdótica se han publicado casos de hiponatremias más severas, en relación con la Icodextrina, sobre todo en enfermos en DP por insuficiencia cardiaca refractaria [14].
Para el diagnóstico y tratamiento de la hiponatremia en DP es útil el estudio a través de Bioimpedancia del Volumen Intracelular (VIC) y el Volumen Extracelular (VEC) y su cociente (VIC/VEC) [15]. Según si se observa ganancia, pérdida o estabilidad del peso, junto con aumento, disminución o estabilidad del cociente VIC/VEC se puede orientar la causa a un exceso de UF y pérdidas renales, una situación de inflamación/malnutrición, un fallo de UF o pérdida de la FRR, o a un exceso de ingesta de agua, como las más frecuentes (Figura 1).
La hipernatremia en DP es más habitual en niños. Puede ocurrir sobre todo cuando se usan concentrados hipertónicos con escaso tiempo de permanencia (pauta habitual en pediatría), predominando la extracción de agua libre sin Na.
Trastornos del K
El LP no contiene potasio, lo que favorece su eliminación por gradiente osmótico. Esto y la mayor FRR hacen que la hiperpotasemia no sea tan frecuente en DP como en HD [16]. Además, la infusión de glucosa intraperitoneal favorece la entrada del potasio intracelular. Pero no podemos olvidar las situaciones de infradiálisis, la utilización de fármacos que favorecen la hiperpotasemia (IECAs y ARA2, ß-bloqueantes, AINEs, etc.) y la disminución o pérdida de la FRR. En un registro de 10.468 enfermos de EEUU publicado en 2012 [17] un 6 % de los enfermos en DP tenían un K > 5.5 mEq/L. El uso generalizado de IECAs/ARA2 nos hace sospechar que la hiperpotasemia es más frecuente ahora que hace dos décadas en DP.
La hipopotasemia actualmente no es muy frecuente, y su porcentaje es variable según las poblaciones estudiadas y la antigüedad de la publicación, pudiendo ser desde un 4 a un 36 % de los enfermos [16] [17] [18] [19] [20]. En revisiones más antiguas la hipopotasemia se encontraba hasta en un 36 % de los enfermos, mientras que en cohortes más contemporáneas se ha reducido a solo un 4-10 %. Es posible que tenga relación con el uso habitual de IECAs/ARA2. La hipopotasemia aparece con más frecuencia en enfermos mayores, mujeres, desnutridos y muy comórbidos.
El diagnóstico y control de la hipopotasemia tiene importancia porque se relaciona con un aumento de la morbimortalidad de los enfermos en DP [16]. La hipopotasemia crónica da lugar a HTA, arritmias cardiacas (sobre todo fibrilación auricular), intolerancia a la glucosa, alteraciones de la motilidad intestinal y estreñimiento. También se ha relacionado con un mayor porcentaje de peritonitis entéricas, por translocación bacteriana debida al estreñimiento propiciado por el K bajo, aunque los resultados de los estudios no son concluyentes [17] [21]. El Registro Brasileño publicó en 2015 con un ajuste de propensión que los enfermos con un K < 3.5 mEq/L tenían más mortalidad de causa infecciosa general, pero no relacionada con la propia técnica [19]. Recientemente el Registro PDOPPS ha publicado los resultados clínicos relacionados con la hipopotasemia persistente en 7.421 enfermos en DP, observando su relación con una mayor mortalidad y más infecciones peritoneales, aunque no causadas por gérmenes entéricos. Los enfermos con hipopotasemia tenían más desnutrición, menos FRR, recibían más dosis de diálisis, tomaban más diuréticos, tenían la TA más baja y usaban con menos frecuencia IECAs/ARA2 [22].
En caso de enfermos con hipopotasemia se recomienda liberalizar la ingesta de alimentos ricos en potasio y aportar suplementos orales de potasio.
1.4 Enfermedad óseo-metabólica
Solo citar algunas características diferenciales con la HD. La enfermedad ósea metabólica se relaciona con una mayor mortalidad y más rápida progresión de la enfermedad ateromatosa [23].
1. El hiperparatiroidismo secundario suele ser menos severo en DP.
2. En DP solo hay comercializadas dos formulaciones de calcio (Ca), 3.5 (1.75 mmol/L) y 2.5 (1.25 mmol/L). El control del fósforo (P) depende de la dieta, la FRR y la prescripción de DP. Dado que el P se elimina mejor en las permanencias largas, es más difícil controlar el P en DP automática con cicladora [24]. El LP habitual contiene 1.75 mmol/l de Ca, y produce un balance positivo. Sin embargo, el balance de Ca está influenciado por la UF. Así, con los intercambios de glucosa al 3.86-4.25 % se produce un balance negativo de Ca, mientras que con los del 1.36-1-5 % el balance es positivo. Por ello, cuando se usa más de un intercambio hipertónico, debe tenerse en cuenta la pérdida de Ca. Los líquidos hipertónicos con glucosa 3.86-4.25 % o los que consiguen más UF (Icodextrina) solo disponen de la formulación con Ca alto para evitar una pérdida excesiva [25].
3. La prescripción de Ca normal o bajo se individualiza según cada enfermo en función del tipo de quelante del P, el grado de hiperparatiroidismo, los niveles de Ca sérico, etc.
1.5. Hiperglicemia y aparición de diabetes mellitus de novo.
La absorción de glucosa desde el peritoneo supone un aumento importante del aporte calórico, pueden llegarse a absorber entre 100-200 gramos de glucosa al día (12-34 % del total). Esto puede traducirse en un aumento de peso del 5-10 % y en algunos casos obesidad. La absorción de glucosa peritoneal dependerá del transporte peritoneal, siendo mayor en los muy rápidos transportadores que además suelen requerir concentraciones más altas de glucosa. El porcentaje de enfermos con diabetes (DM) en DP puede ser de más del 50 %, según los países. Los enfermos en DP con DM tienen más comorbilidad y un peor pronóstico vital, sobre todo los diabéticos de más edad, aunque en los últimos años su pronóstico en diálisis ha mejorado [26]. Los enfermos con DM en DP tienen más infecciones, pero no está claro que tengan más peritonitis. También tienen una función peritoneal si no muy diferente, si con peor transporte de agua y posiblemente más sensible a las noxas [27] [28] [29].
La DP predispone a la aparición de DM de novo, como la IRC, la HD y el trasplante renal, debido a una mayor resistencia a la insulina. Parecería que los enfermos en DP debieran tener más riesgo que los de HD en desarrollar DM de novo, pero los resultados son contradictorios. En población de Taiwán en DP y HD, comparada a través de un test de propensión, se constató que desarrollaban DM de novo 3,7 y 2,4 de cada 100 pacientes-año en HD y DP, respectivamente [30]. En cambio, en un registro más reciente, también de Taiwán [31], encuentran que los pacientes en DP tienen más riesgo de desarrollar DM de novo que los de HD (9,4 vs 5,9 cada 1000 pacientes-año). También constatan que los enfermos en tratamiento con Icodextrina tienen menos riesgo de desarrollar DM (6,22 vs 12,1 cada 1000 pacientes-año). En 2020 se ha publicado una revisión sistemática y metaanálisis sobre la aparición de DM de novo en DP que incluye 9 estudios y 13.879 enfermos, observándose que hasta un 50 % de los enfermos en DP desarrollaran un trastorno del metabolismo de la glucosa, un 8% DM, un 15 % intolerancia a la glucosa y un 22 % glucosa basal alterada. No observan diferencias entre HD y DP ni entre diferentes grupos étnicos [32].
Los factores que se han relacionado con la aparición de DM de novo en DP han sido la edad avanzada, la obesidad y la inflamación. Curiosamente hay algún estudio que no encuentra relación entre la glucosa absorbida y la diabetes de novo [33].
Se ha demostrado que los enfermos en DP con DM de novo e incluso aquellos con solo la glicemia basal alterada, tienen peor evolución que los enfermos normoglicémicos [34]. Estos mismos autores han estudiado la evolución de la población en DP de Hong Kong en los últimos 25 años y han observado un preocupante aumento de la obesidad y de la aparición de DM de novo [35].
El control de la DM en DP se realizará como en la población general con la hemoglobina glicosilada, aunque es conocido que infravalora el control debido a las alteraciones hematológicas propias de la IRC. La albúmina glicosilada sería más adecuada y ha demostrado que es mejor predictor de supervivencia y de mortalidad cardiovascular, pero la evidencia es mucho más consistente en HD, hay pocos trabajos en DP, no se recomienda en las guías y su uso no se ha generalizado por razones prácticas [36].
El mal control glicémico en DP se ha relacionado con una mayor morbimortalidad [37]. También se ha relacionado con más infecciones. En un estudio el mal control glicémico solo se relacionó con las infecciones del orificio y no con las peritonitis [38].
1.6. Dislipemia
Es muy frecuente la existencia de hipercolesterolemia e hipertrigliceridemia en DP. Se ha definido el perfil lipídico de los enfermos en DP como más aterogénico que los enfermos en HD. Estos datos aislados no han demostrado por el momento una gran influencia en los resultados de morbimortalidad comparando las dos técnicas de diálisis. Al inicio de la DPCA es frecuente la existencia de hipertrigliceridemia favorecida por el aporte de glucosa, mientras que la hipercolesterolemia suele ser discreta y se acompaña con un aumento de Apoproteína B y en la Lp (a), sin variación de la Apoproteína AI (elevación del cociente apoproteína B/AI). Así mismo se produce un enriquecimiento en triglicéridos de las lipoproteínas. Este perfil lipídico es muy aterogénico [39]. El tratamiento consiste en una dieta pobre en grasas saturadas, ejercicio físico regular, evitar soluciones hipertónicas. No se recomienda el inicio de estatinas en situación de IRC-5D y por lo tanto en DP, ni tampoco su retirada en caso de que estuvieran prescritas prediálisis, según las últimas guías KDOQI [40]. Debemos destacar que la mayoría de los estudios están focalizados en HD y pocos en DP.
1.7. Malnutrición proteico-energética
También llamada síndrome de desgaste proteico-energético que ocasiona sarcopenia y fragilidad; y que en diversos grados puede estar presente en más del 80 % de los enfermos en DP. Está en clara relación con un aumento de la morbi-mortalidad y se relaciona con un estado de inflamación crónica.
La hipoalbuminemia es más frecuente en los enfermos en DP que en HD. Se pierden diariamente 2-3 gramos de aminoácidos y 6-12 gramos de proteínas plasmáticas, en su mayor parte albúmina. En el caso de sufrir una peritonitis la pérdida proteica se multiplica de 3 a 10 veces. Existe también una pérdida de vitaminas (B1, B6, C, Ácido fólico, D). Las Vitaminas B12 y B2 permanecen estables. La malnutrición proteica aislada es mucho más frecuente que la energética o proteico-energética. La mayoría de los enfermos tienen aseguradas las calorías necesarias bien sea a partir del aporte peritoneal o al tipo de alimentos que prefieren que suele favorecer a los hidratos de carbono. La ingesta de proteínas se reduce por múltiples motivos: la propia uremia, anorexia, disconfort abdominal y sensación de plenitud, patologías comórbidas, edad avanzada, problemas en la dentición, patología psicosocial, etc.
Se valora a través de datos antropométricos, bioimpedancia, test de Valoración Global Subjetiva y datos analíticos. La valoración de un experto en dietética es de gran utilidad. Para su prevención y tratamiento se recomienda una ingesta proteica de 1.2-1.3 gr/Kg/día en enfermos estables, consejo nutricional y estimuladores del apetito como el Acetato de Megestrol. En cuanto a la utilización de los líquidos con aminoácidos, el impacto en el estado nutricional es inconsistente y actualmente su indicación fundamental es el ahorro de glucosa.
Se puede valorar la utilización de suplementos dietéticos orales, están disponibles en el mercado adecuados para la IRC con bajo contenido en Na, K y P. Es necesario un abordaje multidisciplinar y muchas veces los resultados finales son muy pobres, lastrados por el envejecimiento de la población, la comorbilidad y la cada vez más importante problemática socio-económica [41].
1.8 Complicaciones cardiovasculares
Los enfermos en DP suelen tener un gran número de factores de riesgo agregados de patología cardiovascular: la edad avanzada, la propia etiología de la IRC (diabetes Mellitus, HTA), la ERC que es en sí misma aterogénica, la dislipemia, el hábito tabáquico, defectos vitamínicos y nutricionales, etc. Si añadimos a esta situación la falta de control de la HTA, la hiperhidratación continuada y una posible situación de subdiálisis, el enfermo se sitúa en una posición de muy alto riesgo cardiovascular.
Se deberán seguir las recomendaciones generales del tratamiento de las enfermedades cardiacas y vasculares [42] [43].
La DP presenta ciertas ventajas hemodinámicas sobre la HD. La extracción continua de volumen es mucho mejor tolerada en los pacientes con insuficiencia cardiaca por lo que se ha convertido en un tratamiento paliativo útil para la insuficiencia cardiaca refractaria. Asimismo, se ha descrito una menor incidencia de pericarditis en estos pacientes. Los pacientes en DP no presentan una mortalidad cardiovascular inferior a los de HD, seguramente debido a la suma de factores favorables y desfavorables (perfil lipídico más aterogénico, hiperinsulinismo, hipervolemia). En la cohorte observacional del estudio NEFRONA, enfermos con IRC-5D sin patología cardiovascular previa, se ha constatado que un menor grosor de íntima media carotidea se relaciona independientemente con estar en DP [44]. Este resultado podría explicar parcialmente la menor mortalidad en los primeros años de DP comparada con HD. Mientras se mantiene la FRR el control de la TA es más fácil. La aparición de hipotensión puede ser debida a una depleción de volumen o al uso de antihipertensivos, debe descartarse la existencia de valvulopatías como estenosis aórtica severa, pero puede persistir sin causa aparente y entonces es un factor de mal pronóstico vital.
2. Complicaciones relacionadas con el catéter de DP
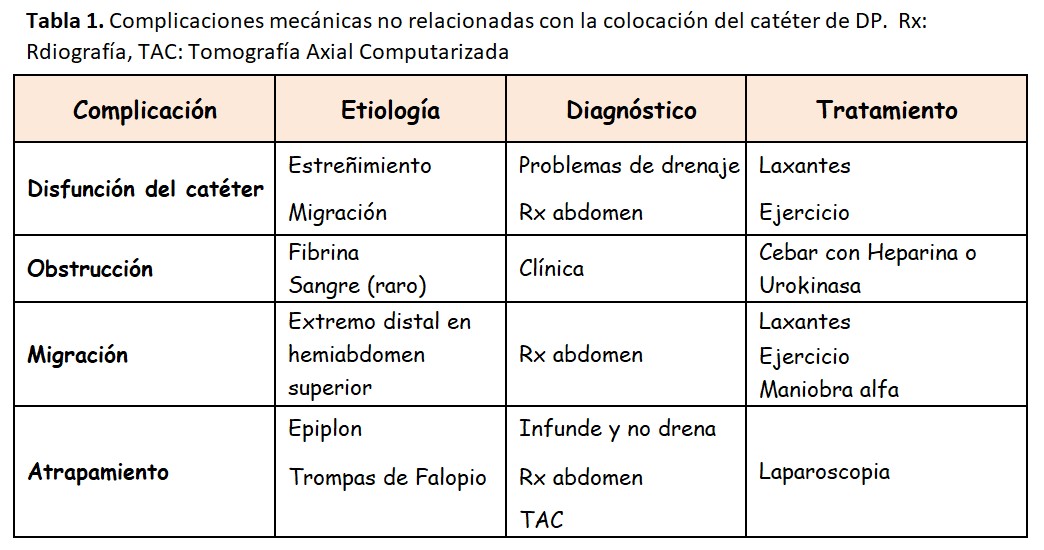
En general los problemas de disfunción del catéter de DP ocurren en los primeros meses del inicio de la DP y dependen en gran medida de una correcta técnica de colocación del catéter [45][46][47]. Supone una importante causa de fracaso de la técnica que puede alcanzar hasta el 20 % debido a una diálisis inadecuada, UF insuficiente, múltiples manipulaciones e intervenciones que pueden hacer que el propio enfermo solicite un cambio de técnica.
2.1. Malfunción del catéter
La malfunción del catéter de DP no siempre se debe a obstrucción, migración o atrapamiento. La causa más frecuente es la falta de motilidad intestinal. Consecuentemente, el tratamiento más eficaz es el uso de laxantes [46]. Para la valoración de la malfunción del catéter debe realizarse un intercambio de LP, valorando la velocidad de infusión y drenaje, el aspecto del LP (descartar la peritonitis y valorar la salida de fibrina), explorar el túnel subcutáneo (descartar acodaduras), valorar el funcionamiento del prolongador (en ocasiones la obstrucción se encuentra en ese tramo) y realizar una Rx de abdomen para valorar la posición del catéter y el contenido fecal intestinal.
2.2. Obstrucción
La obstrucción de los orificios del catéter puede ser por fibrina o coágulos. Puede ocurrir una obstrucción completa con ausencia total de drenaje e infusión y una obstrucción incompleta con drenaje/infusión parcial o lento. En el caso de obstrucción por fibrina o coágulos es frecuente que no sea posible infundir. Si se sospecha una obstrucción por fibrina se puede realizar una heparinización del catéter con heparina sódica. El volumen de cebado es diferente según cada catéter y prolongador. Se mantiene la heparina durante un periodo de 1 a 2 horas y se realiza un nuevo intercambio. Si la heparina es inefectiva pueden utilizarse agentes trombolíticos como la Urokinasa (5.000 a 10.000 unidades). También puede aspirarse el contenido del catéter con una jeringa, siempre con método estéril.
2.3. Migración
El extremo distal del catéter debería situarse en la pelvis menor para su correcto funcionamiento. Se denomina migración a la malposición del catéter hacia la parte superior del abdomen, donde difícilmente podrá recoger el líquido intraperitoneal. Para evitar las migraciones es fundamental una buena técnica de colocación del catéter [47] y evitar el estreñimiento. En muchas ocasiones el uso de laxantes soluciona el problema. También se puede recurrir a la llamada “maniobra alfa”. Esta maniobra la suelen realizar los radiólogos intervencionistas y consiste en introducir una o varias guías flexibles a través del catéter, manipularlas desde el exterior con método estéril y fluoroscopia hasta conseguir hacer descender el catéter. Los resultados positivos inmediatos oscilan entre un 60-80 % [46][48]. Los catéteres con extremos distales en espiral y los que llevan un lastre de tungsteno dificultan esta maniobra.
2.4. Atrapamiento
Aunque el catéter se encuentre correctamente situado en la pelvis menor el motivo de la malfunción puede deberse también al atrapamiento del catéter por una estructura intrabdominal, normalmente el epiplón. Se han descrito de manera excepcional atrapamientos por otras estructuras como la trompa de Falopio. Es más frecuente la dificultad del drenaje por mecanismo valvular (introducción de epiplón en los orificios del catéter), que la de la infusión. Un motivo de alta sospecha de atrapamiento por el epiplón es la persistencia de un catéter muy fijo en la misma posición en Rx simples de abdomen realizadas en diferentes tiempos.
Cuando existe la sospecha de atrapamiento por epiplón puede practicarse una cateterografía con contraste iodado a través del catéter o administrando un isótopo radioactivo. Radiólogos muy entrenados pueden observar también con ecografía como el epiplón se introduce a través de los orificios del catéter. En el caso de alta sospecha se recomienda realizar una laparoscopia exploradora que puede ser al mismo tiempo diagnóstica y terapéutica, y suele ser eficaz en > 80 % de los casos [49]. No siempre se consigue liberar el catéter del epiplón y entonces es necesario colocar un nuevo catéter durante el mismo procedimiento. Se puede considerar la posibilidad de realizar una liberación quirúrgica del catéter junto con una omentectomía parcial (extirpación de parte del epiplón) o una omentopexia (cuando el epiplón es muy redundante, fijación del epiplón en la parte superior del abdomen). La omemtectomía se suele realizar de manera rutinaria en los enfermos pediátricos, donde el epiplón es proporcionalmente mayor que en los adultos.
En la (Tabla 1) se resumen las causas y tratamientos de las complicaciones relacionadas con el catéter.
3. Complicaciones intrabdominales
Se revisan las principales complicaciones intrabdominales no relacionadas con la colocación del catéter de DP. La mayoría se las veces se basan en el aspecto del líquido peritoneal.
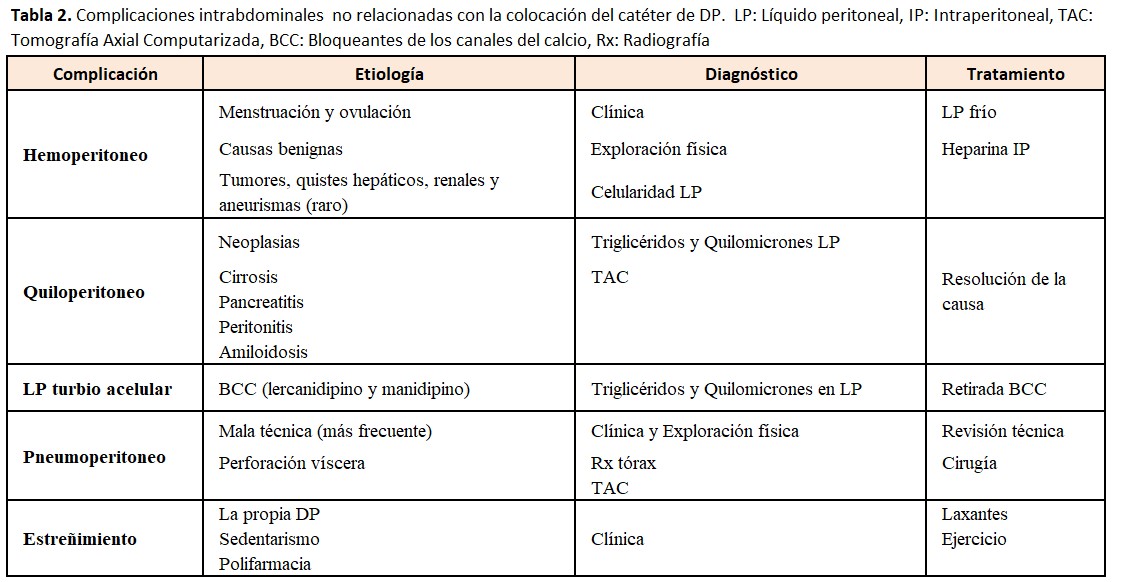
3.1 Hemoperitoneo
Mínimas cantidades de sangre tiñen el LP, generando una gran alarma en el enfermo. Es una patología frecuente que se ha descrito entre el 6 y 17 % de los enfermos en DP según diferentes revisiones [50]. La causa más común es la menstruación retrógrada o la ovulación en mujeres en edad fértil. Otras causas mucho menos habituales son: lesión o perforación de vísceras, ruptura de aneurisma de una arteria visceral, ruptura de un quiste hepático o renal, colecistitis, después de una colonoscopia, ruptura esplénica, erosión intrabdominal producida por el catéter, etc [51]. En un porcentaje no despreciable de hemoperitoneos no se encuentra la causa. En el caso de enfermos en DP por insuficiencia cardiaca refractaria, la aparición de hemoperitoneos es mucho más frecuente, posiblemente debido a su importante congestión venosa. En las descripciones clásicas se decía que hasta un 20 % eran hemoperitoneos graves, pero la experiencia clínica habitual y revisiones más contemporáneas nos dicen que solo un 5 % pueden ser catalogados de graves [51]. La presencia de hemoperitoneos de repetición se ha relacionado con afectación de la membrana peritoneal y de su función. En el caso de enfermos que llevan en DP mucho tiempo, la aparición de hemoperitoneo, junto con otros signos y síntomas compatibles, nos debe hacer sospechar la posibilidad de una Peritonitis Esclerosante.
Siempre que aparezca el primer episodio es recomendable realizar una anamnesis y exploración física cuidadosa, así como un contaje celular del líquido peritoneal. El LP hemático será también turbio y difícil de distinguir de una peritonitis, aunque las peritonitis rara vez son hemáticas. Según la intensidad del hemoperitoneo se decidirá realizar lavados peritoneales con LP frío, con una pequeña dosis de Heparina Na para evitar la obstrucción del catéter. En los casos muy severos y si se sospecha patología abdominal grave deben realizarse pruebas de imagen (TAC con contraste iv, arteriografía, etc).
3.2 Quiloperitoneo
Es una complicación rara. Se han descrito casos de rotura del conducto torácico linfático durante la colocación del catéter de DP. Se trata de la aparición de un líquido turbio de aspecto lechoso que no presenta celularidad. El aspecto turbio-lechoso lo confiere la abundante presencia de quilomicrones y de triglicéridos. Los casos no relacionados con la implantación del catéter suelen ser debidos a una obstrucción linfática por un proceso tumoral, en especial por linfomas, traumatismos, cirrosis hepática, pancreatitis, infecciones por micobacterias o amiloidosis [52] Es mucho más frecuente la presencia de un líquido turbio acelular, con menos contenido graso secundario al tratamiento con bloqueantes de los canales del calcio y que se trata en el siguiente punto. También es frecuente la aparición de líquido peritoneal de aspecto quiloso en los enfermos en DPP por insuficiencia cardiaca refractaria.
3.3. Líquido peritoneal turbio acelular asociado a bloqueantes de los canales del calcio (BCC)
Se ha descrito la presencia de LP turbio sin células asociado al tratamiento con BCC en enfermos asintomáticos [53][54]. La retirada del fármaco resuelve el problema. Debe siempre realizarse un diagnóstico diferencial con la infección peritoneal. Aunque está descrito con todos los BCC, es mucho más frecuente con BCC de última generación como el Lercanidipino y el Manidipino, moléculas mucho más lipofílicas. Todos los BCC reducen la motilidad intestinal porque actúan en las células musculares del intestino y de los vasos linfáticos, dificultando el retorno linfático de la cavidad abdominal. La distribución geográfica con varias series de casos publicados en Asia, y muy pocos en el resto del mundo, hace pensar en una predisposición genética.
3.4 Pneumoperitoneo
El pneumoperitoneo es un hallazgo relativamente frecuente en DP y se describe en el 4-36 % de los enfermos. Se detecta en las Rx de tórax realizadas por otros motivos. Una unidad de DP del Reino Unido encontró que hasta un 4 % de sus enfermos tenía un pneumoperitoneo que en el 70 % era un hallazgo casual [55]. A diferencia de lo que ocurre en la población general donde el pneumoperitoneo es indicativo de la perforación de una víscera, en DP la mayoría de los casos son secundarios a una mala técnica. También puede haber pneumoperitoneos en infecciones peritoneales con bacterias productoras de gas. El enfermo puede explicar dolor de irradiación frénica de predominio en ambos hombros. Es necesario realizar una buena anamnesis, exploración física completa, y valorar si son necesarias otras exploraciones complementarias. Ante la duda puede ser necesaria una laparotomía, pero debemos tener muy en cuenta que realizar una laparotomía en caso de patología benigna es una causa de pérdida del catéter y de fracaso de la técnica. Se han descrito casos de pneumoperitoneos más severos en enfermos con DPA debidos también a una mala técnica. En estos casos puede ser necesaria la aspiración del aire intraperitoneal en posición de Trendelenburg.
3.5. Estreñimiento
El estreñimiento es muy frecuente en los enfermos en DP. Puede ocasionar problemas mecánicos de funcionamiento del catéter peritoneal y se ha relacionado con un aumento de las infecciones peritoneales de origen entérico, debido a translocación bacteriana, por el propio estreñimiento o por el uso de laxantes potentes [56]. Sorprendentemente hay estudios que encuentran más estreñimiento en población en HD que en la DP [57]. La infusión del LP tibio se cita como un mecanismo que aumenta la motilidad intestinal y contrarresta el estreñimiento en DP. Los enfermos en DP tienen múltiples factores que empeoran el estreñimiento: edad avanzada, declive funcional e inmovilidad, poca ingesta de fibra y líquidos, alteraciones endocrino-metabólicas (DM, hipotiroidismo, hiperparatiroidismo, hipopotasemia, hipercalcemia, hipermagnesemia), fármacos favorecedores (opiáceos, psicótropos, anticolinérgicos, alfa-bloqueantes, BCC, hierro, quelantes del P, etc), enfermedades neurológicas (demencia, Parkinson) y disfunción del sistema nervioso autonómico. El tratamiento del estreñimiento en DP se basa en mejorar los hábitos y el estilo de vida y ensayar distintos laxantes: osmóticos, emolientes, estimuladores [58]. Puede también considerarse el uso de un quelante del P con una combinación de acetato cálcico y carbonato de magnesio que puede mejorar el estreñimiento en DP.
En la (Tabla 2) se resumen las causas y tratamientos de las complicaciones intrabdominales.
4. Complicaciones relacionadas con la presión intraperitoneal (PIP).
La PIP no se suele medir en las Unidades de DP de adultos, pero si en Pediatría para realizar una prescripción más ajustada y obtener el máximo rendimiento con los mínimos riesgos. La PIP puede medirse, estando en decúbito, a través del catéter de DP, utilizando un sistema de bolsas gemelas, conectando el catéter, elevando la bolsa de drenaje en un soporte y siendo el nivel 0 la línea medio axilar. Cuando se estabiliza la columna del líquido se mide en inspiración y espiración y se hace la media aritmética que se expresa en cm de H2O (método de Durand), teniendo en cuenta el volumen de LP drenado [59]. Se trata de un parámetro muy individual, es mayor en niños que en adultos, se relaciona con la postura (mayor en bipedestación que en decúbito), aumenta mucho con las maniobras de Valsalva y con la obesidad. La tos es la maniobra que más aumenta la PIP. Por cada litro de LP aumenta la PIP unos 2 cm de H2O [60]. Se considera que una PIP > 18-20 cm de H2O es patológica. Una PIP elevada se relaciona con alteraciones hemodinámicas, respiratorias, problemas de la pared abdominal (hernias, fugas), problemas abdominales (dolor, reflujo gastroesofágico, hemorroides) y alteraciones de la función peritoneal, sobre todo disminución de la UF. Recientemente se ha publicado el valor pronóstico que tiene una PIP > 16 cm de H2O en una peor supervivencia de la técnica (muerte y transferencia a HD) [61]. No hay unanimidad en cuanto a su utilizad en adultos, pero puede considerarse su medida en casos de enfermos obesos que requieren ajustar los volúmenes del LP para obtener una adecuada UF diaria, como un dato más a considerar. En las recientes guías de la ISPD sobre la valoración de la disfunción de la membrana peritoneal no se recomienda la medición de la PIP en rutina clínica, aunque se la considera de utilidad potencial en el ámbito de la investigación [62].
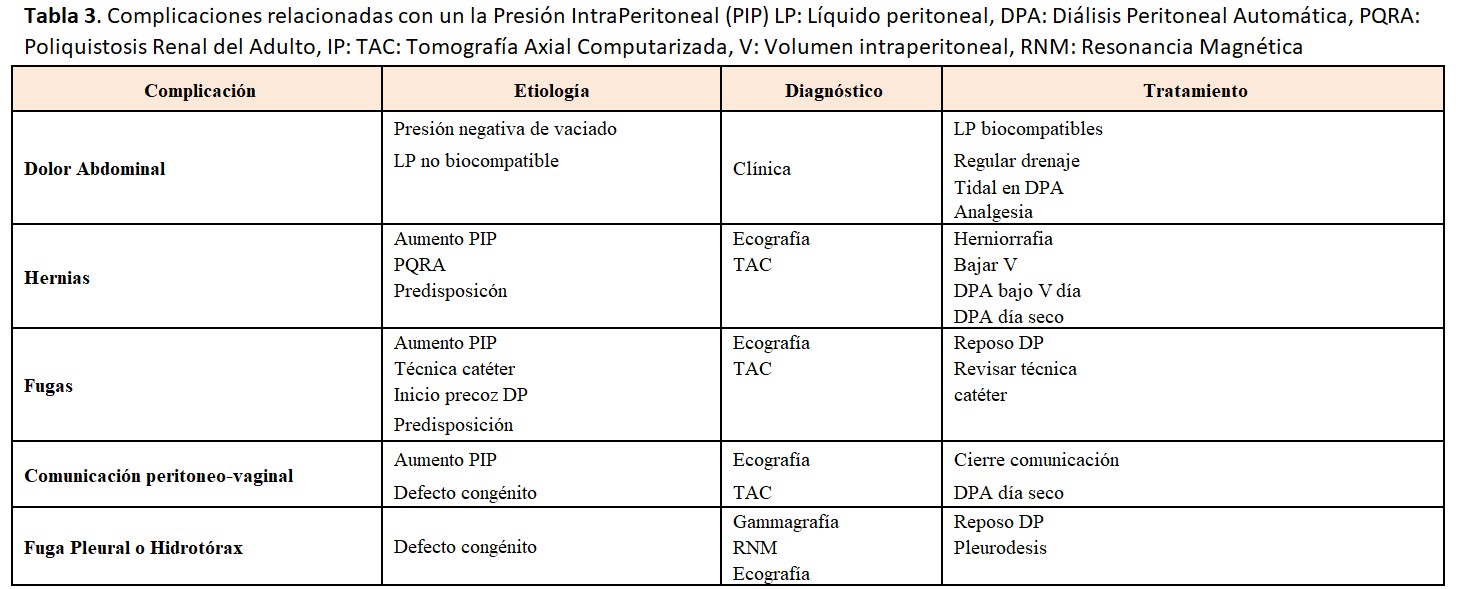
4.1 Dolor abdominal
Es un síntoma muy individual. Se ha relacionado con el volumen de infusión, y con distensibilidad y tolerancia de la pared abdominal. En general se prescribe el volumen de infusión según la superficie corporal y el volumen no suele sobrepasar los límites de seguridad. Se ha demostrado inconsistencia entre el volumen infundido y el disconfort abdominal referido por el paciente [63].
El dolor abdominal relacionado con la infusión es mucho más frecuente con los LP convencionales, tamponados con lactato y con elevadas concentraciones de Productos de Degradación de la Glucosa y pH bajos. No es excepcional tener dolor abdominal con el uso de la glucosa hipertónica al 3,86-4,25 %, incluso con líquidos biocompatibles.
El dolor abdominal relacionado con el drenaje aparece sobre todo con el final del drenaje por efecto vacío. Este síntoma es mucho más molesto en los enfermos que están en tratamiento con cicladora porque los puede despertar por la noche. Las causas exactas del dolor al drenar no se conocen con exactitud, pero también se relacionan con la longitud del tramo intraperitoneal del catéter que puede estar demasiado introducido en la pelvis [47]. Para evitar el dolor se puede abortar el drenaje e infundir en DPCA y utilizar la terapia Tidal en cicladora, dejando un volumen residual [64]. Se puede considerar también añadir pequeñas dosis de anestésico local en casos puntuales. El dolor abdominal suele mejorar con el paso del tiempo.
4.2. Hernias
Es muy importante diagnosticar y reparar las hernias abdominales antes de iniciar la DP. Es frecuente que hernias ya presentes pasen desapercibidas, incluso a una buena exploración física. Es interesante una experiencia amplia de Taiwán, donde encuentran hasta un 7% de hernias ocultas al revisar la cavidad abdominal durante la inserción del catéter por laparoscopia. La reparación concomitante de la hernia oculta da lugar a un porcentaje mínimo de necesidad de corrección de la hernia después de iniciar la DP [65].
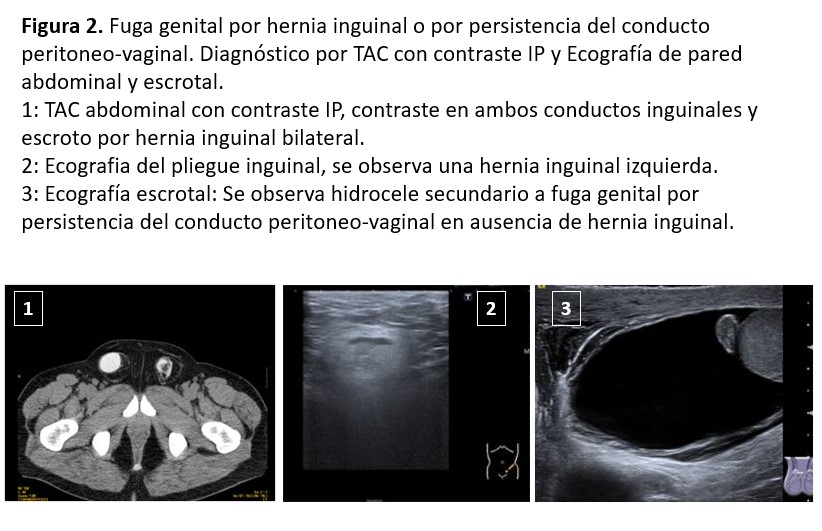
La aparición de hernias en DP es mayor que en HD, así que parece obvio que el aumento de la PIP tendrá algo que ver. Hasta 2023 sólo había un estudio pediátrico que demostraba la relación entre las hernias y una PIP elevada [66]. En 2023 se publicó la experiencia de la relación directa entre una PIP elevada y el desarrollo de hernias, pero no de fugas [67]. La incidencia de hernias es variable entre un 10 y un 27 %. Los factores predisponentes son la edad avanzada, los niños, ser varón, la obesidad, la poliquistosis renal y los antecedentes de hernias previas [68] [69]. La localización más habitual es la umbilical seguida de la inguinal. Otras localizaciones son: epigástrica, incisional (cicatrices quirúrgicas previas), de Spiegel, de Bochdalek, del orificio de Morgagni, del hiato esofágico o del orificio obturador. El edema genital, inguinal o escrotal puede ser la forma de presentación de comunicaciones peritoneo-vaginales o de hernias inguinales con el saco herniario roto.
En alguna ocasión se producen hernias incarceradas o no reducibles que obligan a la laparotomía urgente, e incluso a la resección intestinal por necrosis. Se han de considerar también la presencia de hernias internas, secundarias a la existencia de adherencias intraperitoneales.
El diagnóstico se fundamenta en una buena exploración física, la ecografía de pared abdominal, TAC con contraste intraperitoneal, RNM o gammagrafía peritoneal (Figura 2).
El tratamiento de elección es la reparación quirúrgica utilizando malla. Si hay suficiente FRR puede optarse por unas semanas de reposo, si no se puede realizar DPA con cicladora en decúbito con día seco. Aunque hay estudios que descartan que las hernias tengan un papel destacado en el fracaso de la técnica [70], otras revisiones consideran que juegan un papel fundamental en los cambios de técnica en los primeros meses de DP [45] [46].
4.3. Fugas
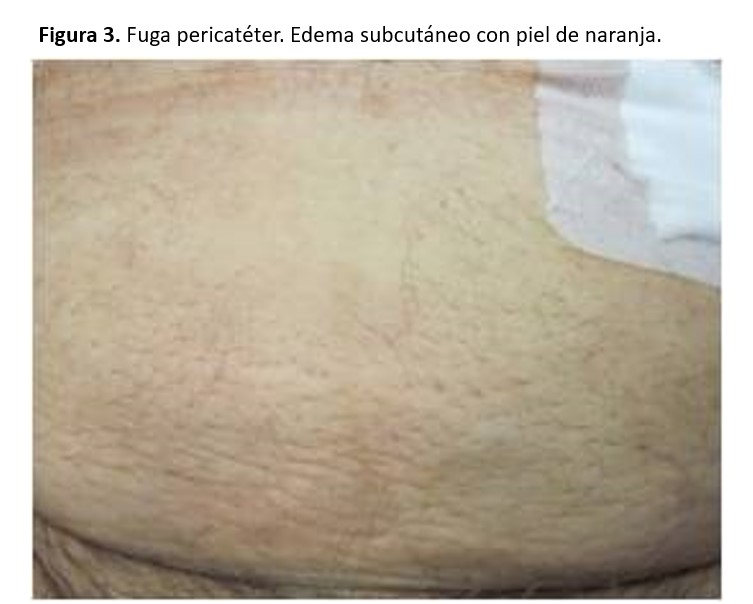
Ocurren en un 3-30 % de los casos, dependiendo de la técnica de colocación del catéter y del periodo de reposo después de la colocación. Se observan en las primeras semanas o meses después de colocado el catéter, aunque pueden existir fugas tardías [71]. Factores de riesgo para su desarrollo son: edad superior a 60 años, obesidad, DM, uso de corticoides, implantación previa de otro catéter, laparotomías, multiparidad e inicio precoz de la DP. Puede observarse la salida del líquido peritoneal a través del orificio de salida del catéter. Otras veces puede producirse un edema del tejido subcutáneo en la zona de inserción (aspecto de piel de naranja), edema genital, disminución del drenaje del líquido o aumento de peso (Figura 3).
El diagnóstico puede hacerse cuando existe una fuga externa pericatéter con una tira reactiva que será positiva para glucosa. Es muy útil la ecografía de pared abdominal en manos expertas. Podrá utilizarse también peritoneografía con TAC con contraste, RNM o gammagrafía.
El tratamiento consiste en volver al periodo de descanso o reposo peritoneal durante varias semanas, pudiendo realizar DPA con cicladora con volúmenes de intercambio bajos en decúbito y con el peritoneo vacío durante la bipedestación.
En algunas ocasiones una fuga refractaria puede precisar una revisión quirúrgica del catéter y su recolocación. Puede ocurrir que el tope interno de dacrón no haya quedado bien posicionado en el músculo recto y no se haya creado una fibrosis pericatéter que lo ancle y evite las fugas. También se han descrito experiencias positivas inyectando fibrina humana en la zona de la fuga.
En caso de fuga tardía, después de meses o años de la colocación, debería considerarse la posibilidad de una rotura del catéter, o del despegamiento espontáneo de los topes de dacrón con pérdida del anclaje del catéter y salida espontánea del mismo.
4.4. Fuga pleural o hidrotórax
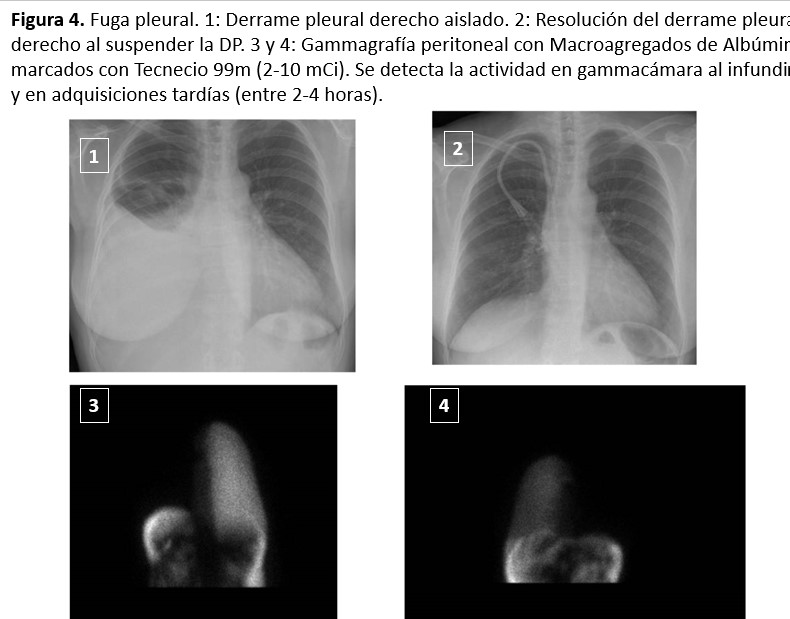
El derrame pleural es raro (< 2 %), suele ser derecho y aparecer de manera precoz al iniciar la DP (los hay también más tardíos, pero siempre en los primeros meses) y mucho más frecuente en mujeres. Puede ser secundario a defectos congénitos del diafragma. Son imprevisibles y no tienen una clara relación con la PIP elevada.
La clínica es muy característica, aguda con tos irritativa, disnea y disminución brusca de la UF. En la Rx de tórax se observa un derrame pleural, habitualmente derecho, que puede ser masivo. Se puede diagnosticar al observar una elevada concentración de glucosa (se debe realizar la toracocentesis a los 30 minutos de infundido el líquido peritoneal, antes de que la glucosa se equilibre). En ocasiones este método no es útil porque el derrame pleural tarda varias horas en aparecer y ya se ha producido el equilibrio. La suspensión de la DP y la posterior resolución espontánea del derrame pleural también sería diagnóstica.
Es importante hacer el diagnóstico diferencial con otras patologías que producen derrame pleural en estos enfermos, la más frecuente es la insuficiencia cardiaca.
El diagnóstico definitivo se obtiene con la fuga a la cavidad pleural de un trazador isotópico (macroagregados de albúmina marcados con tecnecio radiactivo) introducido en el peritoneo. Se requieren detecciones tardías en gammacámara (4-8 horas), dependiendo del débito de la fuga (Figura 4). Se han publicado experiencias positivas en el diagnóstico de fugas pleurales utilizando la ecografía con contraste (Perfuglutane-microesferas) [72] y con RNM de alta resolución. El tratamiento inicial sería el reposo peritoneal durante varias semanas, aunque no siempre es efectivo. La curación vendría dada por el cierre espontáneo de la comunicación peritoneo pleural por la inflamación/fibrosis ocasionada por la propia fuga. Siempre puede ensayarse, la tasa de resultados positivos se desconoce, pero posiblemente es baja. Si no se resuelve puede indicarse la realización de una pleurodesis utilizando la técnica de video toracoscopia, menos dolorosa y muy bien tolerada. No se garantiza el 100 % de eficacia, pero en general funciona. En un estudio con 29 casos, la videotoracoscópica fue eficaz en el 72 % de los casos [73].
En la (Tabla 3) se resumen las causas y tratamientos de las complicaciones relacionadas con la PIP.
4.5. Trastornos de la función peritoneal
Los aumentos de la PIP se relacionan sobre todo con una pérdida de UF. No se han objetivado cambios en el transporte de pequeñas moléculas [60] [74].
4.6. Alteraciones hemodinámicas
En general con los volúmenes que utilizamos no se detectan alteraciones hemodinámicas. Aumentos bruscos del volumen por sobrellenados pueden ocurrir sobre todo con errores en la prescripción de la DPA, con cicladrora con la modalidad Tidal, y pueden ocasionar accidentes graves con resultado incluso de muerte por colapso circulatorio [75] [76]. Estos problemas son más graves en niños por su menor margen terapéutico y actualmente los programas de las cicladoras se han modificado para evitar cualquier tipo de sobrellenado.
4.7. Alteraciones de la función respiratoria
La función pulmonar se altera en DP, disminuye la capacidad vital pulmonar y puede ocasionar hipoxia e hipercapnia [77]. No suele haber problemas con los volúmenes que utilizamos a no ser que el enfermo tenga patología severa pulmonar previa o adquirida. En pacientes con enfermedad pulmonar muy severa podría valorarse el uso de DPA con bajos volúmenes. La DP no está contraindicada en enfermos con Síndrome de Apnea del Sueño. También hay casos de correcta adecuación con DP en enfermos que requieren ventilación mecánica no invasiva domiciliaria por diferentes patologías (restrictivas, hipoventilación).
4.8 Otras: Dolor lumbar, reflujo gastroesofágico, hemorroides, prolapsos, etc.
La presencia del líquido peritoneal en el abdomen da lugar a modificaciones de la postura y estática de la columna. En algunos enfermos da lugar a intensas lumbalgias que pueden provocar el abandono de la técnica. Se recomienda la práctica de ejercicios para fortalecer la musculatura abdominal y lumbar. Otra opción en estos enfermos es utilizar DPA de inicio con volúmenes bajos de día.
Los trastornos gastrointestinales son más frecuentes en DP que en HD. Se relacionan con un aumento de la PIP. Son frecuentes la dispepsia, la sensación de plenitud, el reflujo gastroesofágico, las hemorroides, el estreñimiento [78]. Suelen mejorar con el paso del tiempo.
También pueden aparecer prolapsos vaginal-uterino-rectal y vesical con incontinencia urinaria, sobre todo en enfermos con patología del suelo pelviano previa y predisposición (mujeres multíparas).
PUNTOS CLAVE
1. Conseguir la normohidratación en DP es fundamental para reducir el riesgo cardiovascular. Se basa en preservar la FRR, una prescripción adecuada, la restricción de agua y sal; y una dosis alta de diuréticos de asa.
2. La hiponatremia, la hipopotasemia, la acidosis metabólica y la malnutrición son más frecuentes en los enfermos muy comórbidos y aumentan la morbimortalidad. Se recomienda corregir sus causas.
3. La aparición de DM de novo es frecuente en DP y empeora el pronóstico. Aplicar medidas higiénico-dietéticas y de ahorro de glucosa son fundamentales.
4. No se recomienda el inicio de estatinas en DP. Tampoco se recomienda retirarlas si estuvieran prescritas prediálisis.
5. Las complicaciones relacionadas con el catéter de DP (malfunción, obstrucción, migración y atrapamiento) pueden prevenirse con una colocación cuidada y con un buen tránsito intestinal.
6. El hemoperitoneo suele ser una patología benigna. En mujeres en edad fértil suele ser debido a menstruación u ovulación, aunque genera mucha alarma.
7. El quiloperitoneo es muy infrecuente, más habitual es el LP turbio acelular por uso de BCC, sobre todo Lercanidipino y Manidipino.
8. El pneumoperitoneo suele ser un hallazgo casual y se debe a una mala técnica. Precisa diagnóstico diferencial con la perforación de víscera hueca.
9. La DP aumenta la PIP que da problemas de pared abdominal, con más aparición de hernias. También una PIP más alta se relaciona con una menor UF y con peor supervivencia de la técnica de DP.
10. Lo más eficaz para prevenir el desarrollo de hernias y fugas es una correcta colocación del catéter, evitar el inicio precoz de DP y reparar las hernias conocidas.
11. El dolor abdominal, más frecuente en el drenaje, es muy individual. Mejora con el tiempo y con el uso de LP biocompatibles.
12. El sobrellenado es más frecuente en DPA con Tidal y puede tener consecuencias graves. El diseño de las cicladoras lo previene.