La membrana peritoneal
Palabras clave
Diálisis peritoneal, peritoneo, esclerosis peritoneal, membrana peritoneal, fisiología peritoneal
INTRODUCCIÓN
En la diálisis peritoneal (DP) utilizamos el peritoneo a modo de membrana semipermeable a través de la cual se ponen en contacto el líquido de diálisis y la sangre. Pero al tratarse de un tejido vivo, tenemos que tener en cuenta tres aspectos importantes:
1. Esta membrana es individual, es decir, las características de transporte son diferentes entre pacientes e impredecibles.
2. Es reactiva y por tanto puede cambiar con el tiempo.
3. Estamos exponiéndola a unas soluciones no del todo biocompatibles que la pueden dañar.
Esto nos obliga a evaluar las características del transporte peritoneal de agua y solutos, tanto al inicio del tratamiento con DP como a lo largo del tiempo. Conociendo la función peritoneal no sólo podremos optimizar la prescripción, sino que además detectaremos precozmente cambios en la membrana que nos alerten sobre posibles daños patológicos en el peritoneo inducidos por la propia diálisis.
FISIOLOGÍA PERITONEAL
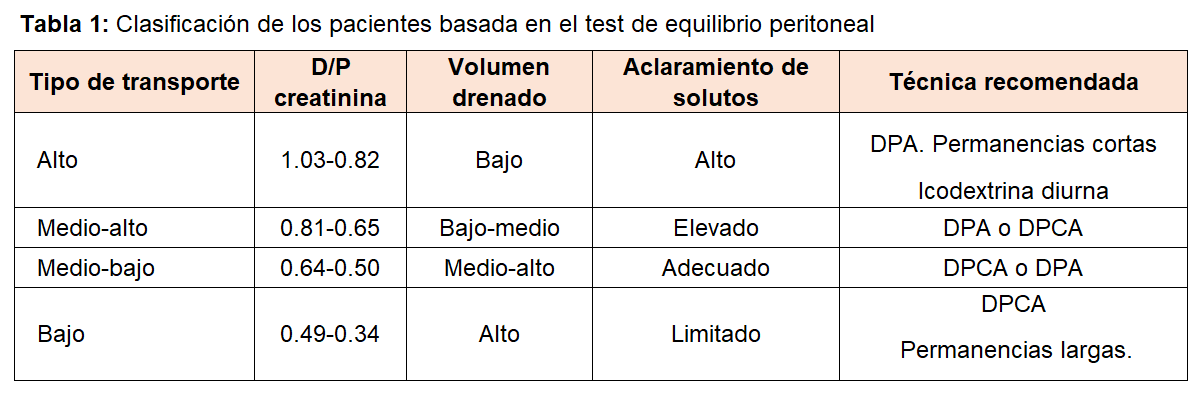
En DP es el propio peritoneo el que actúa como membrana de diálisis, aunque realmente el peritoneo no es una membrana con un poro único de tamaño conocido, sino una serie de barreras anatómicas al paso de solutos y agua. La principal barrera es el endotelio capilar y en él, asumimos que existen 3 tipos de poros (Figura 1):
1. Las acuaporinas, que son canales de agua intracelulares por los que sólo puede pasar agua.
2. Los poros pequeños, que corresponderían a espacios intercelulares por los que pueden pasar agua y pequeños solutos.
3. Los poros grandes o hendiduras intercelulares, que permiten el paso de pequeñas y medianas moléculas, pero dado que hay pocos de estos poros no son importantes para la diálisis.
Los principios físico–químicos básicos en los que se fundamenta la diálisis son la difusión (paso de solutos por diferencia de concentración) y la convección (paso de agua por diferencia de presiones). El transporte de solutos se hace por difusión fundamentalmente a través de los poros pequeños. Esta difusión dependerá, además del tamaño de la molécula y de la diferencia de concentración a ambos lados de la membrana, de la permeabilidad intrínseca de la misma, que a su vez está condicionada por el número y tamaño de los poros, la superficie de intercambio y el grosor del peritoneo.
El transporte de agua es por convección por diferencias de presiones hidrostáticas y osmóticas. En la DP, nosotros creamos un gradiente de presión osmótica a favor del paso de agua desde el paciente hacia la cavidad peritoneal mediante la introducción de un agente osmótico en el líquido de diálisis. El paso de agua dependerá del gradiente osmótico (el agente osmótico más frecuentemente utilizado es la glucosa en diferentes concentraciones) y de los poros disponibles utilizados para el paso de agua. Para explicar el transporte de agua el modelo uni-poro no es suficiente, ya que el agua puede pasar no sólo por los poros pequeños (espacios intercelulares, acompañando al sodio y otros solutos) sino también a través de las acuaporinas (o canales intracelulares de agua). La utilización de glucosa como agente osmótico genera un problema ya que su tamaño es muy parecido al de la creatinina, y en permanencias largas pasa del líquido de diálisis al paciente, lo que condiciona su pérdida de capacidad osmótica con el tiempo. Esto ocurre sobre todo en pacientes con peritoneo más permeable. Por tanto, la capacidad de transporte de agua dependerá de la permeabilidad de la membrana, de la presencia de acuaporinas y del agente osmótico que utilicemos. Conocer bien cada uno de estos elementos nos ayudará a optimizar los tiempos de permanencia y los agentes osmóticos a utilizar.
Tanto la capacidad de transporte difusivo (permeabilidad intrínseca de la membrana), como la capacidad de transporte convectivo (capacidad de ultrafiltración (UF) y funcionamiento de las acuaporinas) son parámetros medibles y caracterizan funcionalmente la membrana en cada momento. Su alteración puede comprometer la situación clínica del paciente, por lo que debemos no sólo medirlos sino además saber interpretarlos para optimizar la diálisis y evitar daños mayores en la membrana peritoneal.
EVALUACIÓN DE LA MEMBRANA PERITONEAL
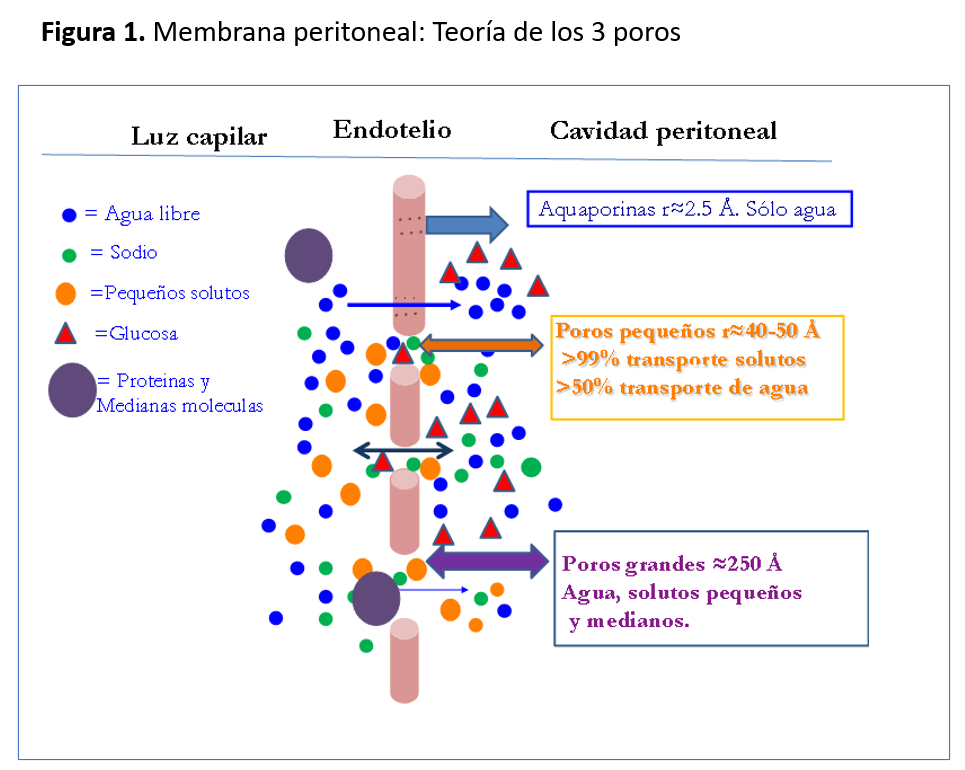
El análisis de la función peritoneal, también llamada cinética peritoneal, debe incluir una evaluación estandarizada del transporte de agua y pequeños solutos y realizarse tras iniciar la DP, así como periódicamente para registrar posibles cambios. Se han descrito diferentes pruebas para analizar las características de trasporte peritoneal. Lo ideal es que la cinética evalúe simultáneamente el trasporte de solutos a través de poro pequeño (TPPS) y la capacidad de UF de la membrana, distinguiendo entre las diferentes vías de trasporte de agua a nivel de la barrera endotelial (teoría de los tres poros), (Figura 1) y teniendo en cuenta el modelo distributivo, es decir, la distribución espacial de los capilares y la barrera al trasporte de agua que supone el intersticio. Los estudios cinéticos que miden todos estos parámetros son muy complejos y requieren software y programas específicos, quedando reservados para estudios de investigación. Para evaluar el transporte peritoneal difusivo (permeabilidad de la membrana), en las recientes guías ISPD se recomienda el test de equilibrio peritoneal (PET) ya que es el método más utilizado por su sencillez [1]. Este test fue descrito inicialmente por Twardoskwi en 1987 y se realiza mediante un intercambio de 4 horas con glucosa al 2.27/2.3% [2]. Se determina la relación dializado/plasma de creatinina (D/PCr) a los 240 minutos del intercambio y según el D/PCr los pacientes son clasificados en 4 categorías: altos (rápidos) trasportadores (AT), promedios- altos, promedios-bajos y bajos (lentos) trasportadores (Tabla 1). Como hemos comentado anteriormente los AT tienen menos capacidad de UF con tiempos de permanencia largos, debido a que la glucosa difunde desde la cavidad peritoneal al torrente sanguíneo y se pierde su capacidad osmótica. Los datos aportados por el D/PCr nos ayudan a realizar una prescripción inicial, sabiendo que el paciente AT se beneficiará más de DP automática (DPA) con tiempos de permanencias cortos y los bajos trasportadores de DP continua ambulatoria (DPCA) con tiempos de permanencia largos (Tabla 1). No siempre se cumple el paradigma de que a más rápido transporte de solutos menor transporte de agua [3], por lo que medir únicamente la permeabilidad no será suficiente para evaluar la capacidad de transporte de agua. La Sociedad Internacional de Diálisis Peritoneal (ISPD) recomienda medir la capacidad de UF de una manera estandarizada y en condiciones de máximo gradiente osmótico, es decir, realizando el PET con un intercambio de 4 horas con glucosa al 3.86/4.25% [4]. El PET-3.86/4.25% nos permite seguir midiendo la permeabilidad (datos superponibles a los del PET-2.27/2.3%) [5] y además medir la capacidad de UF de una manera estandarizada y diagnosticar los pacientes con fallo UF [6]. Además, en la cinética con glucosa hipertónica, el gradiente osmótico de la glucosa es muy alto en la primera hora, en estas condiciones aproximadamente el 50 % del agua pasa a través de poro pequeño acompañada de sodio y el otro 50 % a través de las acuaporinas en forma de agua libre, con el consiguiente descenso de sodio en el líquido peritoneal. Así la medida del descenso de sodio en la primera hora de una cinética con glucosa 3.86-4,25% nos permite analizar indirectamente el funcionamiento de las acuaporinas. Si el sodio en el líquido disminuye más de 5 mEq/L con respecto al basal o más de un 3% en la primera hora de la cinética, sabemos que se ha transportado agua libre de solutos a través de los canales intracelulares de agua.
Las guías ISPD, publicadas recientemente recomiendan la realización de un PET usando glucosa al 2.55/2.27% o 4.25%/3.86% al inicio de la diálisis peritoneal (6-12 semanas) y repetirlas siempre que existan dificultades para conseguir una adecuada ultrafiltración (UF) [1] . Por lo expuesto anteriormente, los autores de este capitulo recomendamos realizar una cinética a las 6-12 semanas del inicio de DP y como mínimo una vez al año o cuando surjan problemas clínicos (fallo de UF o diálisis inadecuada). Además, recomendamos que este PET sea con una concentración de glucosa del 3.86/4.25% de 4 horas, con medida de la UF estándar y del descenso de sodio a los 60 minutos, bien como simple diferencia (Na basal-Na 60 min) o bien como cribado de sodio.
Cribado de sodio (%) = (Na dializado basal-Na dializado 60min)*100 / Na dializado basal
FALLO DE ULTRAFILTRACIÓN (FUF)
En este apartado nos referimos sólo al FUF relacionado con alteraciones en la función peritoneal. Debemos recordar que un paciente puede tener un déficit de UF por causas no relacionadas con la membrana que deben ser descartadas antes de hablar de FUF (Figura 2).
Se define FUF como una UF neta menor a 400 cc tras cuatro horas de permanencia de una solución de 2000 ml de glucosa al 3.86/4.25% [6]. Clásicamente se han definido 4 tipos de FUF que se asocian a diferentes patrones de transporte de solutos:
1. D/PCr Bajo (FUF tipo II): es raro y aparece en esclerosis peritoneal ya establecida.
2. D/PCr Medio-bajo o medio-alto: según el cribado de sodio se distinguen dos tipos;
a) Con descenso de sodio >5 mEq/L (FUF tipo III): clásicamente se ha atribuido a un aumento de la reabsorción linfática, aunque es difícil de demostrar dado que la reabsorción linfática no es fácil de medir. También puede deberse a problemas mecánicos o del catéter, como un aumento del volumen residual en el abdomen o por aumento de presión intraperitoneal con volúmenes altos que aumente la retrofiltración; éstos serían déficit de UF no relacionados con la membrana propiamente dichos.
b) Con descenso de sodio <5 mEq/L (FUF tipo IV) o pérdida progresiva con el tiempo. En estos pacientes debemos sospechar un daño de membrana potencialmente peligroso ya que dos son las situaciones que se han asociado a ello: la pérdida de aquaporinas y la fibrosis submesotelial, y se ha relacionado con alto riesgo de desarrollar esclerosis peritoneal [7].
3. D/P Cr Alto: también denominado FUF tipo I, es la causa más frecuente de fallo de UF. Puede ser:
a) Inherente: Afecta al 10-20% de pacientes y representa el grupo con verdadera intolerancia a la DP si persiste al final del primer año. Se ha relacionado con edad avanzada y diabetes.
b) Adquirido: ocurre en un 20-30 % de los pacientes en DP a partir del 3-4º año y puede estar asociada a cambios estructurales patológicos inducidos por la propia DP, por lo que se analiza en el siguiente apartado.
Es importante diagnosticar de forma precoz el FUF. La (Figura 2) muestra una aproximación diagnóstica.
CAMBIOS FUNCIONALES Y ESTRUCTURALES EN EL PERITONEO RELACIONADOS CON LA DIÁLISIS PERITONEAL
Cambios funcionales inducidos por la DP
El peritoneo es un tejido vivo que no está preparado para la exposición repetida a soluciones no del todo biocompatibles y/o a situaciones de inflamación (peritonitis). Estudios realizados en la era de las soluciones más bioincompatibles han mostrado que el transporte de solutos y agua permanece estable en la mayoría de pacientes a largo plazo, pero en un 20-30% se observa un aumento progresivo de la permeabilidad con descenso de la UF a partir del 3º-4º año [8]. Estos cambios se han asociado sobre todo con el abuso de glucosa [9] y con peritonitis graves o repetidas con muchos días de inflamación acumulados [10]. Estudios con biopsias peritoneales nos han mostrado como estas alteraciones funcionales a menudo se asocian con cambios histopatológicos inducidos por la DP, como son la transición epiteliomesenquimal o la vasculopatía hialinizante [11]. Un objetivo de la cinética peritoneal es detectar precozmente cambios en la funcionalidad de la membrana, no sólo para optimizar el tratamiento sino también para prevenir daños irreversibles en el peritoneo, por lo que cada paciente tiene que ser control de sí mismo. La aparición de disminución progresiva de la capacidad de UF asociada a aumento de la permeabilidad a partir del 3-4ª año nos debe alertar sobre un posible daño inducido en el peritoneo por la propia técnica de DP y hacer que nos planteemos un descanso peritoneal. Actualmente sabemos que la pérdida del cribado de sodio es un dato que a menudo antecede al FUF [12] y es considerado el mejor predictor de riesgo de desarrollo de esclerosis peritoneal. Ante un paciente que desarrolla FUF con AT adquirido en el que detectamos pérdida del cribado de sodio nos debemos plantear el cese programado de la DP.
Alteraciones estructurales de la membrana peritoneal
La estructura de la membrana peritoneal durante la DP cambia con el tiempo. Las lesiones histológicas más frecuentes son: pérdida del mesotelio, fibrosis submesotelial, vasculopatía hialinizante y aumento del área vascular peritoneal [13]. La fibrosis peritoneal aparece con el tiempo en todos los pacientes en DP. Los hallazgos histológicos son similares a los encontrados en la diabetes, lo que sugiere un importante papel patogénico de la glucosa y sus derivados. Aunque algunos autores han sugerido que el sustrato morfológico del alto transporte es la neoformación vascular, esta asociación no es universal y hay estudios que muestran, en pacientes con menos de dos años en DP, que la transformación de la célula mesotelial en fibroblasto (TEM) se asocia con alto transporte peritoneal, independientemente del número de vasos [11]. La correlación entre las alteraciones anatómicas y funcionales de la membrana peritoneal no se conoce en profundidad. Un estudio de biopsias peritoneales ha mostrado mejor preservación del mesotelio y menor prevalencia de vasculopatía hialinizante en pacientes tratados con soluciones biocompatibles frente a los tratados con soluciones convencionales [14].
Esclerosis peritoneal encapsulante
La esclerosis peritoneal encapsulante (EPS) es la fase final de un proceso que se inicia con el engrosamiento fibrótico progresivo del peritoneo y conduce a la encapsulación de las asas intestinales y obstrucción intestinal, siendo la complicación más grave en pacientes en DP por su elevada mortalidad [15]. Su prevalencia es baja pero su incidencia aumenta con el tiempo en DP. Los principales factores relacionados con su desarrollo se incluyen en la (Tabla 2) y en su fisiopatología, el factor de crecimiento transformante β (TGF-β) parece jugar un papel esencial. Aunque se ha sugerido la utilidad de algunos biomarcadores, no hay actualmente ninguna herramienta de diagnóstico precoz, aunque la detección de estados pre-esclerosos parece primordial para frenar su aparición [16].
La presentación clínica es insidiosa, habiéndose descrito cuatro estadios evolutivos: pre-EPS, inflamatorio, encapsulante y obstructivo [17]. El diagnóstico se basa en los criterios propuestos por la ISPD, siendo clave la presencia de síntomas clínicos con grados variables de inflamación sistémica y hallazgos radiológicos compatibles (engrosamiento peritoneal, calcificación, obstrucción intestinal y encapsulamiento) [18]. Un abordaje múltiple que incluye el uso de soluciones biocompatibles y la retirada a tiempo de DP parece reducir su incidencia [19]. Aunque no existe un tratamiento eficaz, los inmunosupresores han evidenciado en casos aislados alguna mejoría y existen datos esperanzadores con el tamoxifeno [20], un antiestrógeno que disminuye la tasa de complicaciones y la mortalidad. Tras su diagnóstico, se recomienda transferencia a hemodiálisis, y en fases avanzadas muchos pacientes requieren tratamiento quirúrgico mediante enterolisis. La prevención es clave para el manejo de esta complicación. En este sentido, De Sousa y cols han sugerido que el uso de tamoxifeno en estadios iniciales puede ser útil para evitar la progresión de la enfermedad [21]. Un reciente documento de consenso de la ISPD refiere que no existe evidencia científica suficiente en la actualidad para recomendar su uso generalizado en el tratamiento de la EPS [22].