Peritonitis asociada a diálisis peritoneal
INTRODUCCIÓN
La peritonitis infecciosa es la inflamación de la membrana peritoneal causada por una infección, generalmente bacteriana, de la cavidad peritoneal. Los pacientes en Diálisis Peritoneal (DP) están expuestos a una posible infección de la cavidad peritoneal. Esto es debido a la comunicación no natural de la misma con el exterior a través del catéter peritoneal y a la introducción reiterativa de las soluciones de diálisis. La morbilidad de la peritonitis puede ser grave, exponiéndose estos pacientes a un mayor riesgo de muerte, sobre todo aquellos que tienen episodios frecuentes y peritonitis severas de evolución tórpida, especialmente en las así llamadas “catástrofes abdominales” [1]. Las peritonitis agresivas y persistentes pueden llevar a un daño de la membrana peritoneal con alteraciones estructurales y funcionales. En todos los casos, durante la fase aguda, aumenta la pérdida peritoneal de proteínas y también disminuye la capacidad de ultrafiltración temporalmente. Algunos episodios de peritonitis requieren la retirada del catéter para su curación, obligando de esta forma a que más de la cuarta parte estos pacientes necesiten una transferencia temporal a Hemodiálisis (HD) por este motivo.
La DP es una modalidad de tratamiento sustitutivo renal (TSR) perfectamente asentada, a pesar de lo cual, tanto la práctica clínica como los resultados de la DP siguen siendo muy variables, como demuestran los distintos registros a nivel internacional [2] [3] [4] [5] [6]. En nuestro país, la tasa de peritonitis ha disminuido progresivamente durante los últimos años, desde cerca de 1 episodio de peritonitis al año hasta menos de 1 episodio cada 2 años por paciente, siendo además tratadas en su mayoría de manera ambulatoria. La mayoría de las peritonitis evolucionan a la curación. Los factores que influyen en la necesidad de hospitalización y en la evolución de la peritonitis son el germen causal y la presencia de infección del orificio de salida asociado [7].
La reducción en la tasa de peritonitis se debe a tres factores fundamentales. El primero sería el avance de la conectología con el sistema de doble bolsa y las adaptaciones de los tapones [8]. En segundo lugar, los protocolos de cuidado diario para la prevención de la infección del orificio de salida del catéter. Por último, las mejoras en los programas de entrenamiento, incidiendo especialmente en el re-entrenamiento de los pacientes [9] [10] [11] [12] [13]. Las nuevas soluciones de diálisis peritoneal, más biocompatibles, pueden contribuir también al descenso de las peritonitis al interferir menos en las células responsables de la defensa peritoneal [14] [15].
El espectro de microrganismos causantes de peritonitis ha cambiado en los últimos años. Los episodios por bacterias coagulasa negativos se han reducido prácticamente a la cuarta parte del total de peritonitis, aumentando proporcionalmente los causados por Gram negativos. A pesar de ello, siguen siendo los Gram positivos más frecuentes, alcanzando alrededor de la mitad de los episodios. El abanico de antibioterapia es mayor, la vía intraperitoneal es factible y segura, por lo que la elección del tratamiento empírico debe tener en cuenta la sensibilidad antibiótica de los microorganismos locales más frecuentes [16].
Recientemente se ha realizado una extensa revisión bibliográfica y adecuación de las últimas guías vigentes a la realidad española resultando un documento muy recomendable para su lectura [9] [17].
PATOGENIA
El desarrollo de la infección peritoneal se produce por la llegada de las bacterias a la cavidad peritoneal siguiendo alguna de las rutas intraluminal, pericatéter, transmural o hematógena [18]. Los factores de riesgo de peritonitis se relacionan principalmente con los sistemas de conexión, la infección del orificio de salida y/o túnel del catéter y con los portadores nasales de S. aureus. A pesar de la mejoría en la conectología, la prevalencia de las bacterias Gram positivas sigue siendo alta, particularmente del S. epidermidis, por contaminación de la vía intraluminal. Otro germen Gram positivo, el S. aureus, se asocia con frecuencia a infección del túnel y orificio. Mención especial merece el Enterococcus por las posibles resistencias y por causar recidivas, siendo esta una característica propia de los agentes bacterianos formadores de biofilm en el catéter peritoneal, que pueden dar lugar a peritonitis recidivantes de difícil manejo [19].
Los Gram negativos pueden guardar relación con alteraciones intestinales y penetrar en la cavidad peritoneal por vía transmural. El E. coli es el agente más frecuente y generalmente responde bien al tratamiento. La especie Pseudomonas causa peritonitis difíciles de tratar, por lo que en muchas ocasiones se hace necesario retirar el catéter por su estrecha asociación con la infección del túnel y el orificio. La peritonitis causada por múltiples microorganismos, predominando los Gram negativos, nos hará pensar en patología intrabdominal; y la presencia de anaerobios en la “catástrofe abdominal” por perforación abdominal, siendo esta una urgencia quirúrgica por su elevada mortalidad [1] [20]. Las peritonitis fúngicas son raras, pero tienen una alta morbilidad y mortalidad. Su aparición está relacionada con tandas repetidas de antibioterapia, por lo que es recomendable la profilaxis como se explicará más adelante. La especie más frecuente es la Cándida albicans y se suelen comportar como peritonitis refractarias y recidivantes [21] [22]. La peritonitis por micobacterias es aún más rara y el diagnóstico es insidioso por la lentitud del crecimiento en cultivo, por lo que es imprescindible su sospecha.
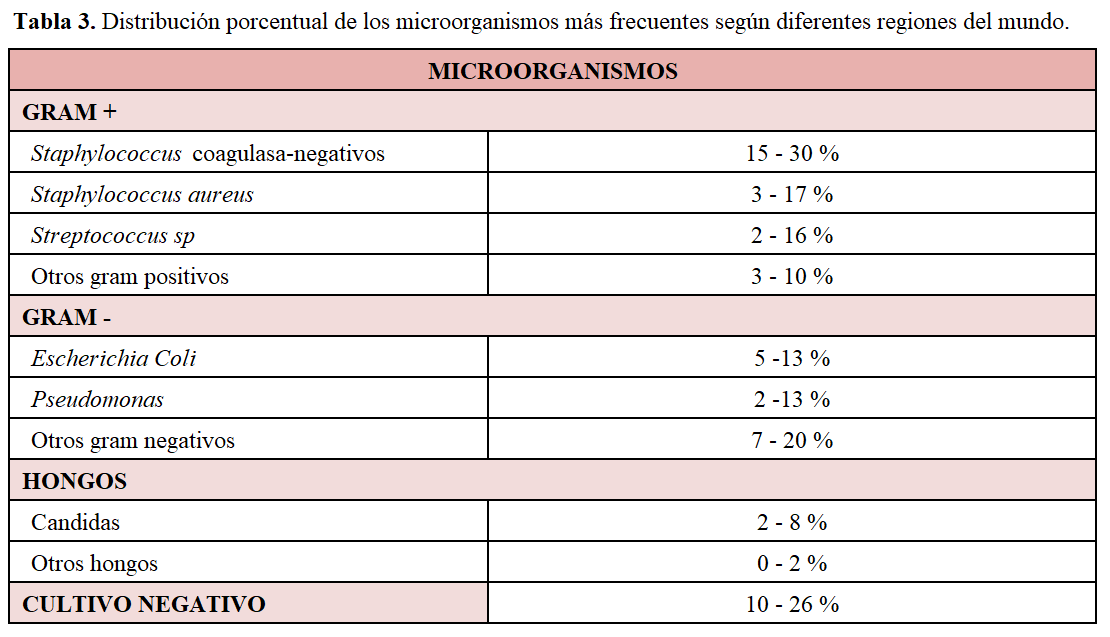
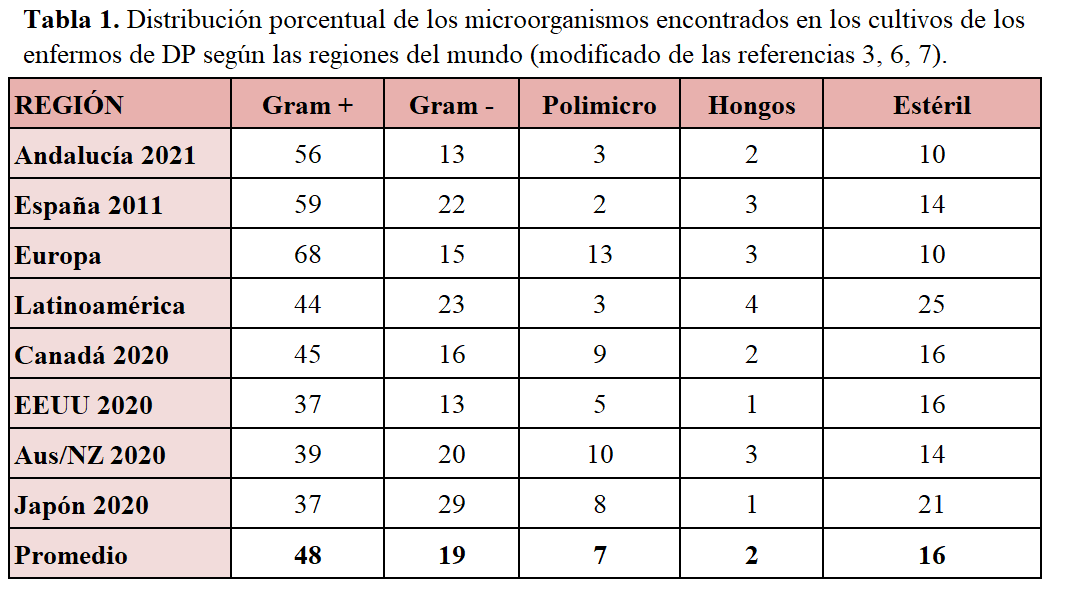
La inmensa mayoría de las peritonitis de los enfermos tratados con DP son infecciosas y casi siempre por bacterias habituales de la piel, como se muestra en la (Tabla 1). La etiología de las mismas varía en función de las regiones geográficas, época de recogida de datos e incluso entre hospitales, haciendo imprescindible conocer la ecología de cada hospital para adaptar los tratamientos empíricos. Las defensas peritoneales tienen una acción protectora de la cavidad peritoneal frente a la invasión de un microorganismo, relacionada con la actividad fagocítica de los leucocitos y con los factores inmunológicos. Por ello, la inmunidad local tiene un importante papel en la prevención y resolución de la peritonitis [23]. Las soluciones dialíticas alteran la concentración y la función de las defensas peritoneales, tanto de la población celular (macrófagos, leucocitos, linfocitos y células mesoteliales) como de los mediadores solubles locales. Las peritonitis han supuesto, para muchos investigadores, una oportunidad para estudiar la reacción inflamatoria local. Las soluciones de diálisis peritoneal más biocompatibles parecen tener menos efectos nocivos sobre las defensas peritoneales, aunque una revisión Cochrane es poco concluyente en este aspecto [14] [15] [24].
EVOLUCIÓN
La mayoría de las peritonitis evolucionan hacia la curación, aunque un 10-20% de los episodios de infección peritoneal tiene una evolución complicada, sobre todo las producidas por S. aureus, Pseudomonas y hongos. Se considera como evolución desfavorable, el fracaso de la técnica y el paso temporal o permanente a HD. La peritonitis sigue siendo una causa importante de fallo de la técnica dialítica. En la (Tabla 2), se describen los motivos más frecuentes relacionados con la mala evolución de la peritonitis. La severidad clínica, al comienzo del episodio, no es un marcador fiable de la evolución, a diferencia de lo que ocurre en los niños, pero los signos y síntomas intensos se siguen teniendo en cuenta [25] [26]. Un recuento celular elevado no condiciona siempre mal pronóstico, salvo si se considera el número de días con recuento positivo, siendo entonces un factor predictor de mala evolución. Los datos más recientes del estudio colaborativo de registros españoles de DP arrojan un 80.7% de curación, un 11.1 % de retirada del catéter, un 8.1% de recidivas y un 1.7% de exitus [27].
Aunque nuestras referencias nacionales recogen una baja mortalidad, su papel como causa directa o coadyuvante podría estar infraestimada, alcanzando hasta el 15% [28] [29].
MANEJO DE LAS PERITONITIS ASOCIADAS A DP
Cada centro de DP debe disponer de su propio protocolo para la prevención, el diagnóstico y el tratamiento de las infecciones peritoneales. Es importante disponer de datos propios, que incluyan tasas anuales de infección y la prevalencia local de gérmenes resistentes (p.e. meticilín-resistente), para poder adaptar las intervenciones que recomiendan las guías a cada unidad de manera individualizada. La mayoría de protocolos locales se basan en las actualizaciones que ha publicado periódicamente la sociedad internacional de DP (ISPD) a lo largo de los últimos 25 años [9] [17]. Las últimas Guías de la ISPD así como las Guías españolas disponibles del 2022 son excelentes documentos, que revisan la evidencia disponible en el tratamiento y la prevención de la peritonitis.
Sin duda alguna, las claves del éxito son la precocidad del diagnóstico y la intervención decidida sin demora ante situaciones de mala evolución clínica. Posponer una decisión de retirada de catéter en una peritonitis de evolución tórpida puede ser nefasto para el paciente y sus posibilidades de recuperar la técnica de DP.
La educación del paciente, las visitas domiciliarias y los reentrenamientos periódicos contribuyen a los buenos resultados. Los profesionales más implicados en DP tienen la misión de aportar el conocimiento de la realidad de las peritonitis al resto de personal implicado de las diferentes unidades responsables de este proceso (microbiología, urgencias, enfermería y nefrología) que no manejan a diario este tipo de pacientes.
Las guías ISPD recomiendan utilizar la tasa de peritonitis, definida como el número de episodios por paciente y año en riesgo, considerando así todas las peritonitis desde la implantación del catéter y no desde su uso. Se considera a las infecciones repetidas recurrentes como nuevos episodios, mientras que las recaídas no [9].
DIAGNÓSTICO
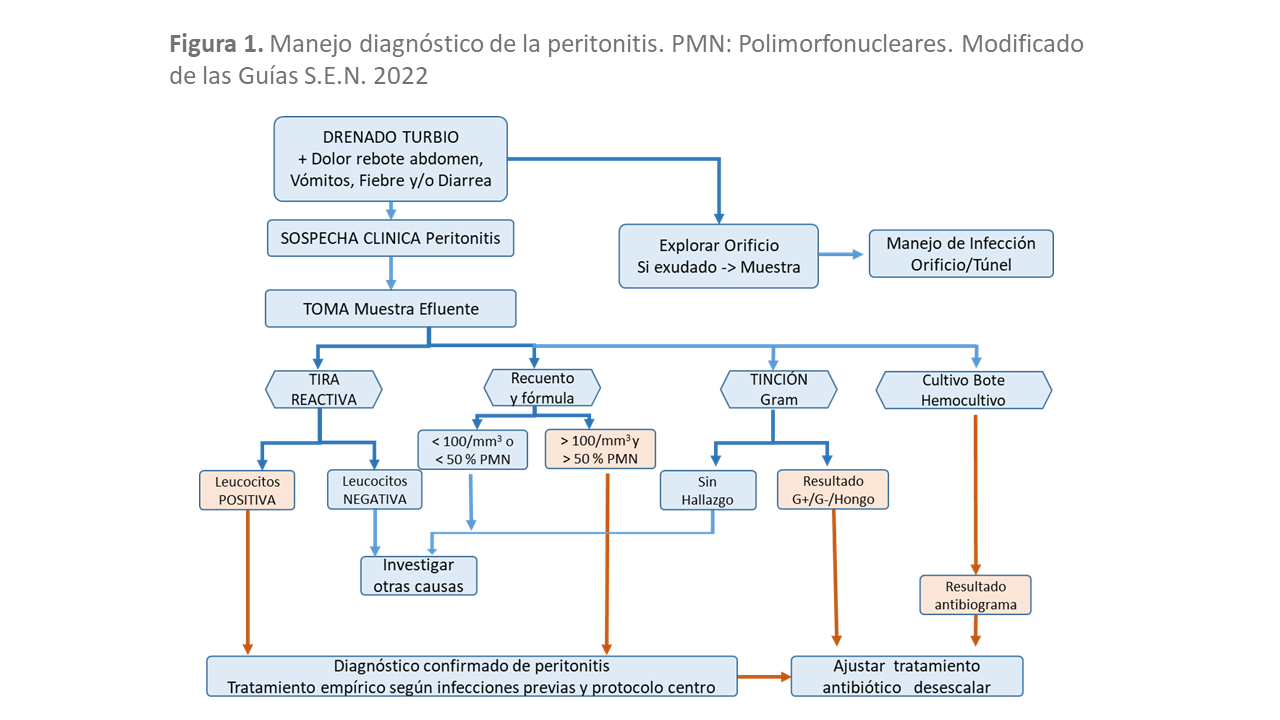
La peritonitis infecciosa se presenta generalmente con tres elementos claves: dolor abdominal, líquido efluente turbio y cultivo positivo. Las guías clínicas de la S.E.N. para la prevención y tratamiento de la infección peritoneal ratifican que el diagnóstico de la peritonitis infecciosa requiere la presencia de al menos dos de las tres condiciones siguientes (Figura 1):
- Presencia de síntomas y signos de inflamación peritoneal: dolor abdominal espontáneo, a la palpación y rebote abdominal (muy frecuente); acompañados o no de otros síntomas gastrointestinales: náuseas, vómitos y diarrea. Por otra parte, aunque menos frecuente, puede existir sensación distérmica, febrícula o incluso fiebre.
- Presencia de líquido peritoneal turbio: con más de 100 leucocitos por μL en el contaje celular (líquido con permanencia mínima de 2 horas) y un recuento, en la fórmula leucocitaria, superior al 50% de polimorfonucleares (PMN).
- Confirmación microbiológica: observación de microorganismos en la tinción de Gram del efluente peritoneal o en el cultivo del líquido peritoneal. Los microorganismos más frecuentes se pueden observar en la (Tabla 3). La prevalencia depende de aspectos locales, aunque predominan los Gram positivos. Las recurrencias de peritonitis son debidas también en su mayoría a Gram positivos. El diagnóstico de peritonitis puede ser más complejo en el caso de pacientes con síndrome cardiorrenal (SCR) tratados con DP en pautas de un intercambio cada 24 o 48 h. En estos casos, el bajo ritmo de lavado y la pérdida linfática por estasis venoso favorece la aparición de líquidos lechosos con recuentos celulares dudosos (100-200 cel./µL), en los que la evaluación clínica es fundamental para evitar tratamientos innecesarios.
Ante una sospecha de infección peritoneal debe extraerse recuento diferencial, tinción directa de Gram y cultivo del efluente sembrado directamente en botes de hemocultivo. Este procedimiento consigue un mejor rendimiento diagnóstico [30]. En casos de especial riesgo, puede obtenerse también una muestra para cultivo en medio específico de hongos.
Siempre debe explorarse el orificio y el túnel, para descartar que ese fuera el origen. Además, se debe realizar una anamnesis dirigida con el fin de identificar posibles errores de procedimiento en los intercambios previos.
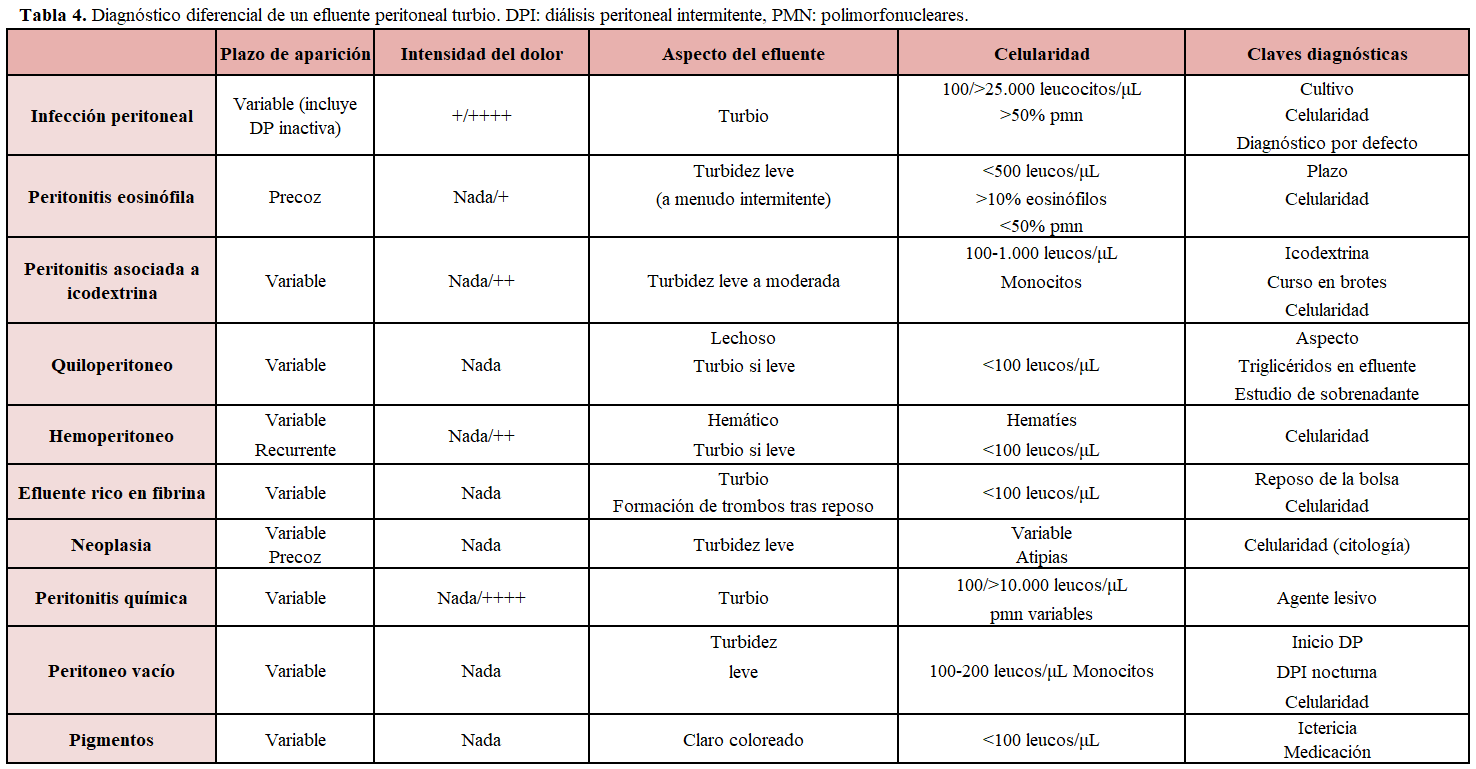
Una buena evaluación de las características del efluente y de la situación clínica nos pueden ayudar a excluir situaciones que no corresponden con una peritonitis infecciosa (Tabla 4). Esta aproximación es fundamental para la adecuada toma de decisiones especialmente en alguna situación específica, como el diagnóstico por exclusión de la peritonitis estéril o el manejo del paciente con síndrome cardiorrenal que veremos más adelante.
TRATAMIENTO
El tratamiento se debe instaurar de manera precoz, ya que la evolución de la peritonitis depende en gran parte de la rapidez y la elección acertada de la antibioterapia. Por ello, se inicia un primer tratamiento empírico inmediatamente después de extraer los cultivos, ajustando posteriormente en función de los resultados del mismo. Es de vital importancia no retrasar el inicio del tratamiento antibiótico en una peritonitis adecuadamente diagnosticada, por lo que aquellos centros que no dispongan de nefrólogo de guardia deben diseñar planes específicos para asegurar el mismo.
Tratamiento empírico inicial
Una vez confirmado el diagnóstico con el recuento celular y extraídas las muestras para cultivo, se iniciará el tratamiento empírico. En general, se combinan Cefalosporinas de 1ª generación o Vancomicina para bacterias Gram positivas con Ceftazidima o Amikacina, con amplio espectro anti-bacterias Gram negativas. La pauta clásica de Cefazolina se ha visto sustituida por Vancomicina en muchos centros con alta incidencia de estafilococos o enterococos meticilin-resistentes. Ninguna pauta específica ha demostrado ser claramente superior al resto para ser aplicada por todos y recomendamos una política individualizada en cada centro. Aunque no es universal, la Vancomicina ha demostrado tasas superiores de curación en algunas series y está especialmente indicada por mantener una concentración mínima inhibitoria (CMI) durante más tiempo en el líquido peritoneal. Por otra parte, su pauta de administración (una dosis cada 3-5 días) es muy adecuada en casos de DP asistida, baja destreza del paciente o necesidad de mantener tratamiento con cicladora.
Como novedad en las últimas guías ISPD 2022, se recomienda cefepime en monoterapia como una alternativa aceptable para el tratamiento empírico. Este fármaco en monoterapia ha demostrado, al menos no inferioridad comparado con cefazolina más ceftazidima [31].
Las Guías de la S.E.N 2022 recogen los factores que deben guiar el tratamiento empírico:
• El diagnóstico y el inicio del tratamiento deben ser lo más precoces posibles tras el inicio de los signos/síntomas de IP
• Debe evitarse iniciar el tratamiento sin una recogida adecuada previa de muestras bacteriológicas
• El tratamiento inicial (empírico) de una IP debe tener una amplia capacidad antibacteriana, tanto en relación al espectro bacteriano como al tipo de antibióticos y su dosificación
• La selección de la antibioterapia inicial (empírica) debe tener muy en cuenta la flora local habitual y sus perfiles de sensibilidad antibiótica, pero respetando el principio anterior
• La función renal residual es una consideración importante, tanto para seleccionar la terapia (evitar antibióticos nefrotóxicos) como para establecer las dosis antibióticas
• Planificar adecuadamente el seguimiento (ingreso, tiempo a revisión), teniendo en cuenta el estado clínico del paciente, factores limitantes de respuesta (inmunosupresión, infección simultánea del túnel…) y riesgo de tratamiento inadecuado en domicilio (mala adherencia, capacidad limitada…)
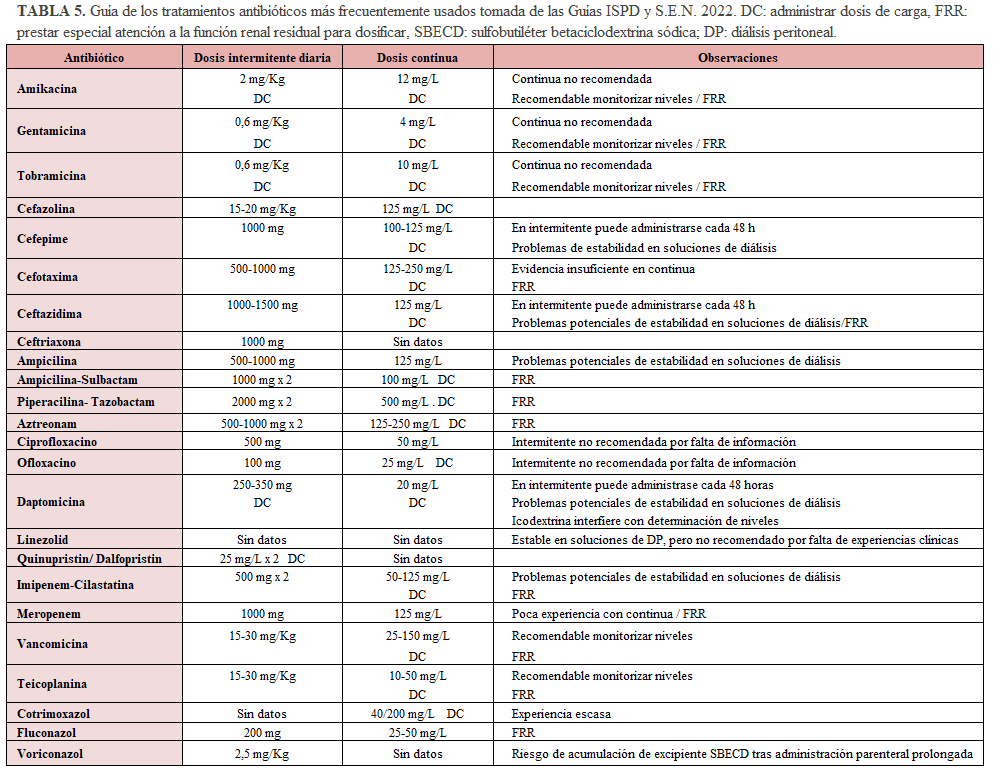
En la (Tabla 5) se describen los antibióticos más utilizados por la vía intraperitoneal y su dosificación. Podemos utilizar una dosificación continua, administrando antibiótico en cada intercambio o intermitente en un solo cambio cada día (el más largo). En general, los pacientes en Diálisis Peritoneal Automatizada (DPA), se suelen pasar a pauta manual con Diálisis Peritoneal Continua Ambulatoria (DPCA), para asegurar una dosificación continua. La Vancomicina IP se administra en general cada 4-5 días puesto que se absorbe adecuadamente y genera niveles circulantes que son efectivos siempre que se mantengan por encima de > 15 µg/ml [32]. Las pautas intermitentes también son más recomendables en el caso de los aminoglucósidos, por presentar menor toxicidad. Importante mencionar sobre el posible papel protector de la acetilcisteína para evitar otoxicidad y toxicidad vestibular secundaria a aminoglucósidos [33] [34]. Respecto a las cefalosporinas, hay poca evidencia para asegurar cual es el mejor régimen de administración. Se ha demostrado que la administración en ciclos cortos genera niveles plasmáticos adecuados [35]. Así mismo en pacientes en DPCA la dosis de 500 mg/L intraperitoneal mantiene niveles aceptables durante 24 horas [36], a diferencia de lo estudiado con la ceftazidima que en dosis intermitente se obtendrían niveles infra terapéuticos [37]. Recientemente, se ha postulado aumentar un 25%, tanto en la dosis de carga como en la de mantenimiento, en aquellos pacientes con una diuresis residual >100 ml/día para asegurar niveles terapéuticos adecuados [31]. La mayoría de las dosis recomendadas para otros antibióticos son empíricas y no proceden de estudios farmacocinéticos.
Las cefalosporinas, aminoglucósidos y vancomicina pueden mezclarse en la misma bolsa, pero se debe evitar poner en la misma jeringa Ceftazidima y Vancomicina [38] [39]. Existen otras alternativas a estos protocolos que incluyen el uso de quinolonas, cefalosporinas de cuarta generación (cefepime), carbepenémicos y los nuevos antibióticos contra cocos Gram positivos alternativos a la Vancomicina, tales como Daptomicina, Quinuspristina/Dalfopristina y Tigeciclina [9] [17].
Cada centro debe disponer de un protocolo específico para el tratamiento empírico inicial que adapte las guías clínicas vigentes a la situación de cada centro en cuanto a prevalencia de los distintos gérmenes, ecología de resistencias locales, aspectos específicos de recogida procesado de muestras etc.
En los primeros días, con inflamación peritoneal importante, puede asociarse pérdida de ultrafiltración, producción de fibrina y dolor. Si existe mucho dolor, los lavados rápidos pueden aliviarlo. Habitualmente con un par de recambios sin permanencia peritoneal los pacientes sienten alivio, gracias al aclaramiento de endotoxinas, aunque también se pierden defensas locales. Durante los primeros cambios, puede añadirse algún anestésico local (p.e. 1 ml de Scandicain® al 2%). Si existen restos de fibrina, pueden añadirse 1.000 UI de heparina sódica al 1%.
Las pautas antibióticas tienen éxito entre el 70-90% de los casos, pero en algunos programas, la resistencia a la Cefazolina puede llegar hasta el 50%. Estas diferencias entre los diferentes centros de sensibilidad de las bacterias a los antibióticos es lo que obliga a la elección del antibiótico más apropiado para ese lugar determinado, una vez conocida la sensibilidad antibiótica de esas bacterias en cultivos previos y la ecología bacteriana del área de salud.
Para prevenir las peritonitis fúngicas es importante añadir profilaxis antifúngica siempre que el paciente vaya a recibir un ciclo de tratamiento con antibióticos, independientemente de su duración. Como profilaxis antifúngica, los fármacos estudiados son la Nistatina oral 500.000 Unidades 4 veces al día o el fluconazol oral 200 mg cada 48 horas [40] [41] [42]. La mayoría de los casos pueden manejarse ambulatoriamente y la decisión de ingresar depende de la situación clínica. La tasa de ingresos ronda el 35% en series españolas, aunque este ingreso responde, en muchos casos, más a temas organizativos o sociales que de gravedad clínica. Se recomienda seguimiento con recuentos celulares y revisión clínica cada 48 horas, repitiendo los cultivos si no hay resultado o la evolución es desfavorable pasados 4 días (Figura 1). Ante una evolución tórpida, deben considerarse como causas potenciales: perforación o problema abdominal primario añadido (diverticulitis p.e.), colonización del catéter (especialmente en recidivas), infección del túnel, origen fúngico y siempre, la presencia de un germen resistente al protocolo empleado. La última actualización de las guías S.E.N. recomiendan en las infecciones de resolución lenta (recuento positivo con actividad decreciente al 5º día de tratamiento), valorar la optimización del tratamiento antimicrobiano antes de plantear retirada de catéter [9]. Como se ha comentado previamente, la mayoría de los pacientes en DPA se trasfieren temporalmente a una pauta de DPCA. Para aquellos casos en los que se decida mantener al paciente en DPA, debe considerarse la limitación existente por los pocos estudios farmacocinéticos y ningún ensayo con antibióticos concretos. La cinética y estándares de eficacia no tienen por qué ser iguales que en DPCA, por lo que corremos el riesgo de infratratar a los pacientes. La (Tabla 5) detalla los antibióticos más usados en DPA y sus dosis y pautas.
Tratamientos específicos
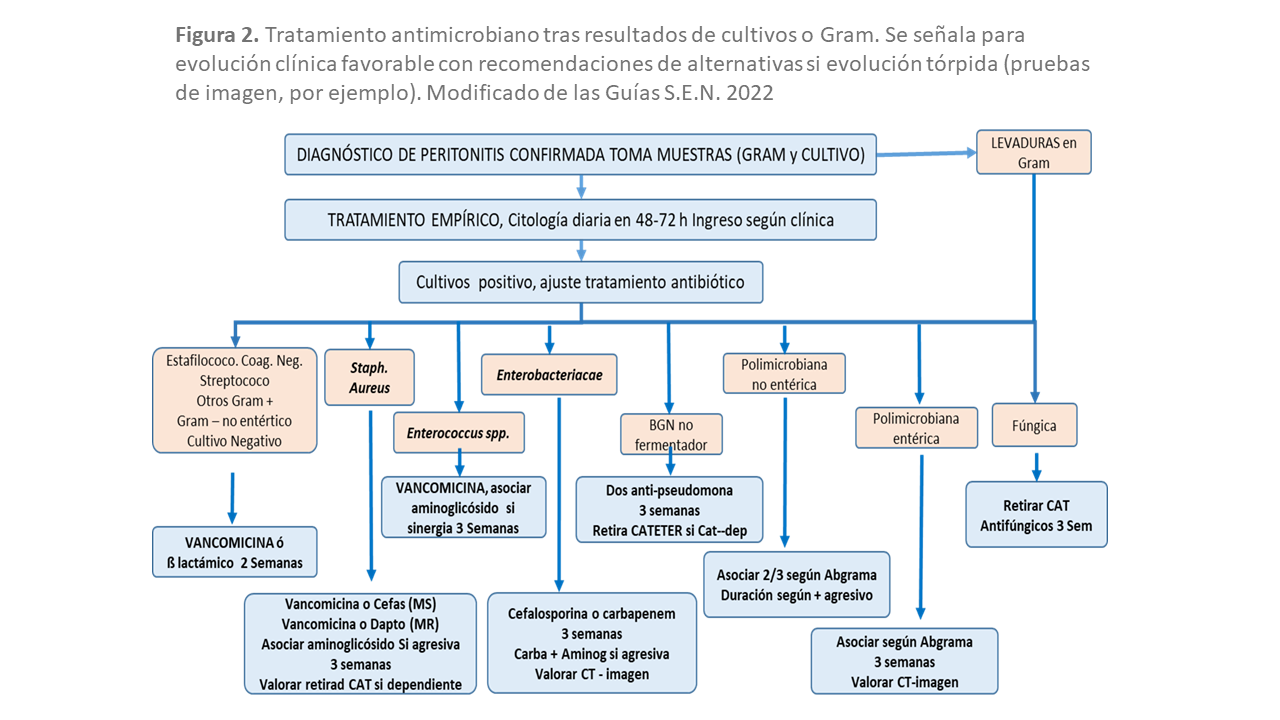
Con el resultado del cultivo y el antibiograma se buscará el antibiótico más específico y de mayor sensibilidad (Figura 2)
Los microrganismos Gram positivos siguen siendo los más frecuentes, aunque haya habido un descenso por las mejoras tecnológicas de los sistemas. Los estafilococos coagulasa-negativos pueden producir betalactamasas siendo resistentes a Penicilina y Ampicilina y las cepas meticilin-resistentes lo son a todos los antibióticos betalactámicos, incluyendo carbapenémicos. La duración del tratamiento de los estafilococos coagulasa-negativos será de 2 semanas, observándose mejoría antes de 48 horas en la mayoría de los episodios. Por otra parte, el uso de la vancomicina IP es mandatario contra microorganismos resistentes a las cefalosporinas, especialmente en ambientes donde no se disponga del antibiograma y se conozca que la sensibilidad de los estafilococos coagulasa-negativos a las cefalosporinas es baja. La dosis de vancomicina será de 15 – 30 mg /kg en un recambio de 2 litros, con permanencia peritoneal mínima de 6 horas, repitiendo la dosis cada 3- 5 días dependiendo de la función renal residual y ajustando la dosis en función de los niveles valle del fármaco [43] [44].
Si el causante de la peritonitis es el S. aureus, el tratamiento debe prolongarse hasta 3 semanas [45] [46]. Si es meticilin-sensible, se puede continuar con las cefalosporinas durante las 3 semanas. Algún estudio ha demostrado el beneficio de asociar Rifampicina 600 mg diarios durante 5-7 días para disminuir el riesgo de recaída o reincidencia [45], aunque las Guía españolas 2022 no lo recomiendan debido a sus potenciales efectos secundarios [9]. Si el S. aureus es meticilín-resistente debemos usar la misma pauta de Vancomicina hasta completar 3 semanas. Si la respuesta a vancomicina no es favorable se podría usar Daptomicina [47]. Los estreptococos son sensibles a penicilinas, ampicilinas y en general, responden bien al tratamiento. Los enterococos tienen resistencia intrínseca a cefalosporinas y aunque sean ampicilin-sensibles, esta se inactiva rápidamente en vía intraperitoneal. Las guías ISPD 2022 recomiendan usar amoxicilina oral (para cepas ampicilin-sensible) o Vancomicina intraperitoneal durante 3 semanas como primera línea de tratamiento, sin embargo, se desaconseja el uso de ampicilina intraperitoneal debido a una reducción en el efecto bacteriostático de la misma en el líquido peritoneal frente al enterococo faecalis [48]. En cepas resistentes a vancomicina y ampicilina, se recomienda el uso de linezolid intravenoso o daptomicina intraperitoneal. Para el tratamiento de la peritonitis por Gram negativos, se han utilizado los aminoglucósidos con éxito en cursos de 21 días, aunque actualmente las cefalosporinas de tercera generación, en concreto la Ceftazidima por vía intraperiotneal ha demostrado ser segura y eficaz, con unos índices de curación muy altos, incluso en monoterapia y evitando además los efectos otóxicos y nefrotóxicos de los aminoglucósidos. Otra familia de antibióticos contra Gram negativos son las cefalosporinas de cuarta generación, en concreto el Cefepime, de la que hasta la fecha no se conocen betalactamasas que inhiban su actividad bactericida. La administración intraperitoneal es segura y se conoce bien su farmacocinética [49]. Muchos microorganismos Gram negativos son sensibles a otros agentes antimicrobianos: Quinolonas, Aztreonam, Imipenem, etc. El uso de estos antibióticos alternativos contra Gram negativos se debe tener en cuenta para tratamientos prolongados. En el caso de peritonitis por Pseudomonas es mandatorio utilizar dos fármacos con actividad anti-pseudomona a través de dos mecanismos diferentes y mantener el tratamiento 21 días [50] (Figura 2).
Peritonitis polimicrobiana
La peritonitis polimicrobiana se atribuía en general a una perforación intestinal. Sin embargo, se ha observado que más de una cuarta parte de ellas pueden ser por contaminación y mala higiene. Las peritonitis polimicrobianas pueden ser secundarias a patología intestinal con perforación intestinal, (p.e. diverticulitis complicada) o por la existencia de un absceso abdominal. Las peritonitis secundarias a colecistitis, apendicitis o diverticulitis tienen mejor pronóstico. En las peritonitis polimicrobianas, se debe explorar el abdomen con una prueba de imagen, sobre todo si además de bacterias Gram negativas aparecen anaerobios u hongos, siendo imprescindible una valoración quirúrgica. La peritonitis polimicrobiama por Gram positivos se atribuye a contaminación y el pronóstico es mejor [51] [52].
Si hay presencia de flora entérica, se recomienda iniciar cobertura de anaerobios, aunque no se objetive aislamiento inicial, dado el crecimiento frecuentemente tardío de estos microorganismos [9]. Se debe usar antibióticos de amplio espectro, que cubra grampositivos, enterobacterias y anaerobios, durante al menos 3 semanas. La combinación de tres antibióticos: metronidazol + vancomicina + aminoglucósido o sustituyendo el aminoglucósido por una cefalosporina de tercera generación (ceftazidima o ceftriaxona) y valorar antifúngicos si existen hongos. También podemos usar en monoterapia a los carbapenémicos o penicilina-tazobactam para cubrir enterobacterias y anaerobios.
Peritonitis recidivante
La peritonitis recidivante es causada por el mismo biotipo de bacteria que en el episodio anterior antes de 4 semanas tras completar antibiótico, tras una aparente buena respuesta al tratamiento antibiótico y resolución de la clínica de peritonitis [53]. Las causas de peritonitis recidivante se enumeran en la (Tabla 6). La causa más frecuente se cree que es la colonización del catéter por la existencia de biofilm ya que al retirar el catéter e implantar uno nuevo no reaparece la infección. La Daptomicina puede ser un antibiótico con buen perfil para este tipo de peritonitis por la facilidad de penetrar en el biofilm del catéter [19] [54].
Peritonitis refractaria
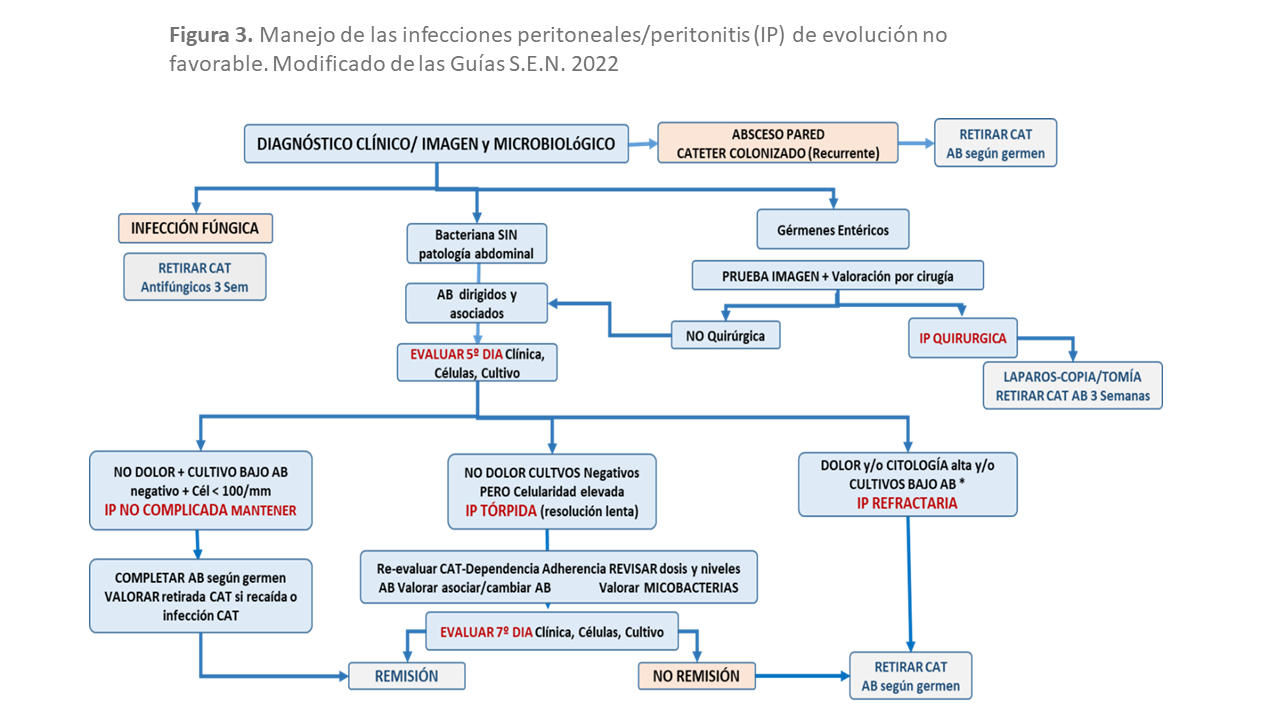
La peritonitis refractaria se describe como la infección peritoneal sin mejoría clínica evidente, con mantenimiento de los síntomas y signos de peritonitis más allá de 5 días, tras realizar un tratamiento antibiótico apropiado. En estos casos estaría recomendado retirada del catéter. Los factores que pueden mantener una peritonitis refractaria al tratamiento se describen en la (Tabla 6). Las guías hacen hincapié en diferenciar como IP de resolución lenta a los casos con tendencia a la mejoría (mejoría de la clínica, descenso del recuento, cultivos de control negativos). Aquí la decisión de retirar el catéter debe ser individualizada, después de considerar estrategias alternativas como optimización de los antimicrobianos y valorar el estado clínico del paciente, estimando el riesgo-beneficio de la medida.
La peritonitis tuberculosa es rara y ocurre generalmente tras activarse un foco tuberculoso latente. Las guías ISPD 2022 y españolas sugieren iniciar medicación antituberculosa y en las formas agresivas valorar retirada de catéter.
Peritonitis fúngica
La peritonitis fúngica aparece generalmente tras tandas repetidas de antibióticos de amplio espectro o en enfermos debilitados, y en las perforaciones intestinales. Es un cuadro grave y la retirada del catéter debe realizarse de forma urgente en cuanto se confirme el diagnóstico. Los tratamientos antifúngicos más empleado son los azoles y las equinocandinas, ambas con adecuada penetración peritoneal y se deben mantener al menos hasta 2 semanas posterior a la retirada del catéter peritoneal [55].
Peritonitis Estéril
Las peritonitis con cultivo estéril dejan al Nefrólogo sin posibilidad de ajustar el tratamiento. Es muy importante tratar de discernir entre aquellas que lo son (química, eosinofílica) de aquellas en las que existe un problema técnico con el cultivo. Una vez descartado el origen químico y ante una buena evolución clínica, se recomienda manejarla como una peritonitis por Gram positivos. Si la evolución es tórpida, debemos establecer como prioridad máxima la protección del paciente, luego la membrana y por último el mantenimiento de la técnica. No debemos demorar en exceso la decisión de retirada del catéter en casos de cultivo negativo.
Las guías españolas 2022 recomiendan:
- Si al tercer día la infección muestra signos de remisión, asumir por defecto IP por grampositivos, mantener vancomicina o cefalosporina y completar dos semanas.
- Si al tercer día la infección muestra indicios de resolución lenta, mantener tratamiento empírico inicial y valorar toma de muestras para cultivo y PCR de micobacterias, según contexto clínico.
- Si la infección muestra refractariedad al quinto día, repetir cultivo y valorar antibioterapia alternativa (daptomicina, carbapenem) y/o retirada de catéter, según criterio clínico.
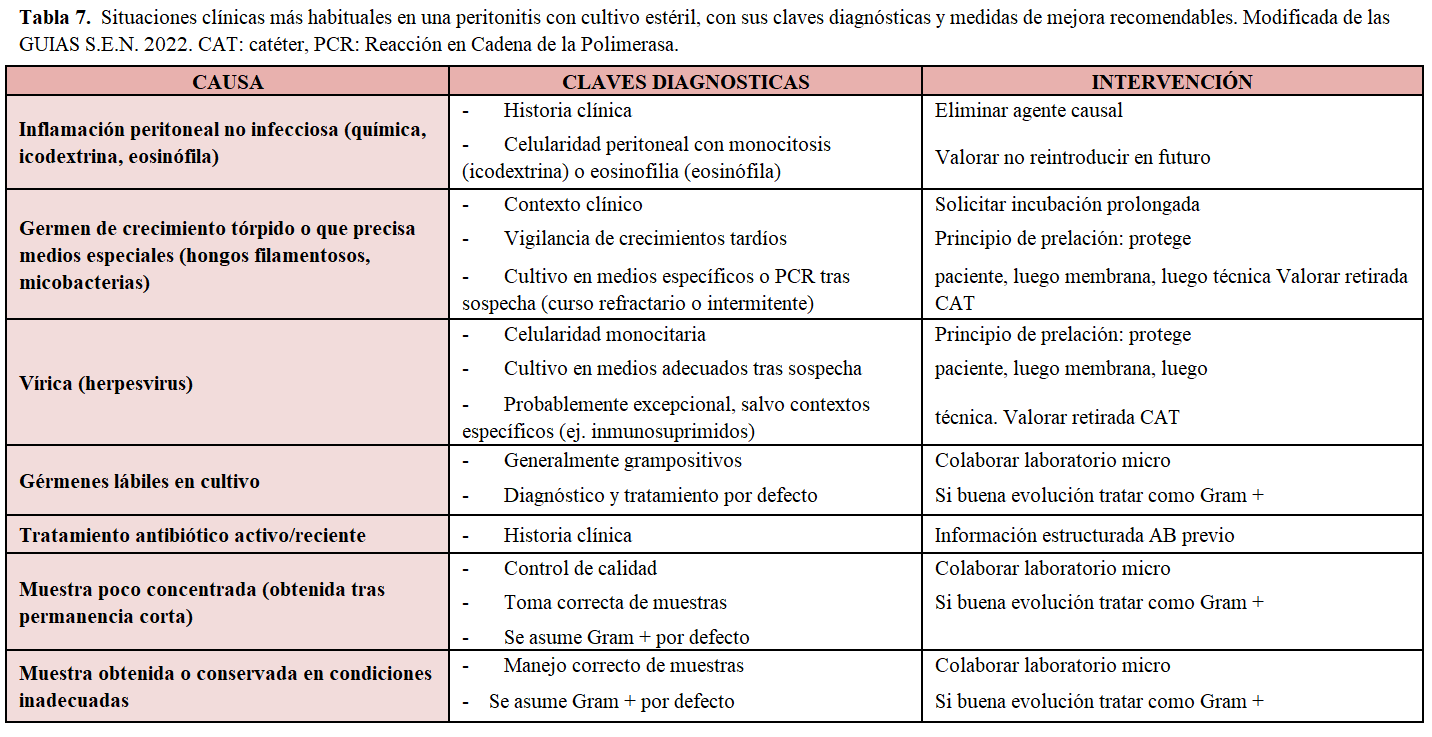
La Tabla 7 resume las distintas situaciones que pueden esconderse tras un cultivo negativo según la última actualización de las guías S.E.N. Nos hemos permitido añadir recomendaciones de mejora en cada una de las situaciones. Se aconseja revisar la técnica de cultivo cuando éstos sean negativos en más del 20% de las ocasiones en el mismo centro.
Peritonitis en pacientes tratados con DP por síndrome cardiorrenal
Cada vez es más frecuente tratar con DP a pacientes con síndrome cardiorrenal (SCR) y resistencia a diuréticos. En estos casos se trata de conseguir una eliminación peritoneal del exceso de líquidos que alivie la insuficiencia cardiaca y mejore el fallo funcional renal. En general se consigue con una pauta de un intercambio por día y el paciente queda en una situación de ERC estadio 3-4 con DP.
No disponemos de información fiable sobre la incidencia de infecciones en este escenario, dado que la mayoría de los registros de ESRD en diálisis excluyen estos casos de sus informes. Algunos estudios refieren una tasa de peritonitis más bajas en estos pacientes que atribuyen a un menor número de intercambios [56] [57].
No disponemos de guías específicas y hay poca evidencia robusta sobre cómo manejar las infecciones en SCR. Hay varios aspectos muy relevantes a recordar:
• La pauta con un solo intercambio puede dificultar el diagnóstico de celularidad alta. Es muy relevante considerar el porcentaje de PMN.
• Es frecuente que la sobrepresión circulatoria de precarga asocie un líquido lechoso (que no turbio) por drenaje linfático (con Triglicéridos elevados y celularidad moderada con PMN bajos). Esto nos puede llevar tanto a sobre tratar infecciones que no lo son, como a pasar por alto infecciones demorando su manejo adecuado.
• La pauta antibiótica debe adaptarse a la función renal residual, por lo que se recomienda ajustar la dosis total diaria con tablas específicas y no trasponer las habituales de las guías DP.
• Con determinados fármacos es recomendable ajustar la dosis con niveles plasmáticos.
• Ante la ausencia de guías específicas, cada centro actúa diferente para adecuar la prescripción de DP estándar de 3-4 cambios a un solo cambio diario. Alguna de las opciones sería:
O Uso de la administración intermitente diaria en aquellos antibióticos en los que hay evidencia con dosis adapta de función renal.
O Aumento transitorio del número de intercambios a 3 al día con pauta continua y dosis adaptada a función renal (basado en potencial reducción de balances hídricos por inflamación)
O Terapia antibiótica por vía oral o IV evitando la intraperitoneal por dificultad de ajuste.
No podemos hacer recomendaciones precisas de una estrategia univoca, por la falta de evidencia y/o guías de expertos. Con este apartado añadido en la actualización del tema en 2023, pretendemos llamar la atención sobre las particularidades de este perfil de pacientes, en los que una peritonitis mal manejada podría tener efectos desastrosos por su fragilidad y comorbilidad.
EVOLUCIÓN
A pesar de los avances en su tratamiento y prevención, la peritonitis persiste como una complicación importante de la diálisis peritoneal con consecuencias potencialmente fatales, aunque afortunadamente en pocas ocasiones, pero frecuentemente llevando al fallo de la técnica dialítica. Bien es verdad, que en la última década ha habido un descenso manifiesto de la incidencia de peritonitis con una mejoría de la evolución de las mismas. Actualmente, el objetivo es bajar la incidencia y mejorar la evolución de las peritonitis. Los factores asociados con un alto riesgo de mortalidad y fallo de la técnica dialítica encontrados en diversos estudios van desde la peritonitis fúngica a las peritonitis con mala respuesta al tratamiento; los factores descritos como de mal pronóstico evolutivo se describen en la (Tabla 6). Lo más importante para favorecer una evolución mejor es diagnosticarla y tratarla lo antes posible, intentando usar antibioterapia de amplio espectro, así como erradicar los posibles factores facilitadores y de mantenimiento de las peritonitis.
INFECCIÓN DEL ORIFICIO DE SALIDA Y TÚNEL SUBCUTÁNEO
La infección del orificio de salida del catéter peritoneal se asocia con frecuencia a la infección del túnel subcutáneo; los síntomas y signos clínicos inflamatorios más frecuentes son: inflamación y enrojecimiento con dolor en el trayecto del catéter y salida por el orificio de un exudado purulento. Las infecciones más severas, por su mala evolución, son debidas a S. aureus, Pseudomonas y hongos. Siempre se debe realizar un cultivo del líquido purulento.
Por otra parte, si la clínica es dudosa y crecen microorganismos coagulasa-negativos, saprofitos de la piel, es de gran ayuda comprobar la existencia de leucocitos en la extensión del exudado, porque en ausencia de polimorfonucleares se puede considerar colonización y no infección. La ecografía nos puede revelar la presencia de infección del túnel. Se seguirán haciendo las curas diarias del orificio con agua y jabón. Si hay dudas de infección, pero el cultivo es positivo para S. aureus, Pseudomonas u hongos, se hará un tratamiento antibiótico tópico con Mupirocina pomada, Gentamicina crema o Ciprofloxacino ótico, siempre que la infección sea poco importante. Las guías ISPD 2017 de infecciones asociadas al catéter recomiendan antibiótico oral empírico para las infecciones de orificio de salida. Este antibiótico debería proporcionar cobertura para S. aureus, con una penicilina resistente a penicilinasa o una cefalosporina de 1º generación. En caso de existir historia previa de infección por S. aureus resistente a meticilina o especies Pseudomona, se debe pautar un glucopéptido o clindamicina, así como un apropiado antipseudomónico respectivamente. Las infecciones por Pseudomona son difíciles de tratar y generalmente requieren 2 antibióticos. Si la infección se acompaña con un granuloma, éste se extirpará con nitrato de plata o violeta de genciana. La duración del tratamiento es de 2 semanas excepto para las especies Pseudomona que deberán ser tratadas durante 3 semanas [10]. Si pasadas 3 semanas con antibiótico o antifúngico adecuado no se observan datos de mejoría o si se produce una peritonitis, se valorará la retirada del catéter peritoneal [9] [10].
Como veremos después, la profilaxis sistemática con mupirocina o productos combinados con varios antimicrobianos ha demostrado ser efectiva para reducir las infecciones y así lo recomiendan las Guías ISPD 2017. Sin embargo, otro tipo de ungüentos no han demostrado mejorar los resultados. A pesar de esta recomendación con nivel de evidencia elevado, muchos centros con una baja incidencia de complicaciones en el orificio solo realizan cuidados con suero hipertónico y reservan las pomadas antibióticas para el tratamiento de infecciones.
PREVENCIÓN
La prevención tiene la finalidad de evitar el riesgo de la aparición de peritonitis, ya que su incidencia, las infecciones del orificio y del túnel pueden repercutir en el éxito o fracaso de un programa de DP. Debido a la variabilidad en la incidencia de peritonitis entre centros, es conveniente disponer de indicadores de calidad de cada programa de DP. En el caso de las infecciones peritoneales, la incidencia de peritonitis no debería ser superior a un episodio por paciente cada dos años. Pero para conseguir esta meta, con el fin de hacer una auténtica prevención, es imperativo conocer bien los riesgos de peritonitis [58]. En la (Tabla 8), describimos los cuidados y acciones preventivas.
La prevención comienza antes de implantar el catéter, continúa durante el entrenamiento y se mantiene con los cuidados apropiados durante el tratamiento dialítico. Existe una clara asociación entre los portadores nasales de S. Aureus y la infección del orificio por dicho microorganismo e incluso con la peritonitis. Por ello la esterilización de la colonización nasal del S. aureus con Mupirocina pomada debe hacerse antes de implantar el catéter peritoneal y durante una semana. Diversos estudios aleatorizados demuestran que la antibioterapia previa a la implantación de catéter disminuye las infecciones, al menos en el postoperatorio. Las guías españolas aconsejan que cada programa de DP elija su propia pauta de profilaxis antibiótica, teniendo en cuenta el espectro de incidencia y sensibilidad antibiótica local. Se han objetivado adecuados resultados con Vancomicina o una cefalosporina de 1º generación. En el postoperatorio, los cuidados del catéter debe hacerlos el personal de enfermería especializado [9] [10].
Los lavados del orificio de salida con agua y jabón, con secado posterior, deben hacerse a diario, así como vigilar y tratar cualquier posible alteración del orificio, como enrojecimiento y supuración. El empleo de pomadas en el orificio de salida con Mupirocina, cremas de gentamicina o ciprofloxacino ótico, incluso pomadas multiantibióticos, disminuye las infecciones del mismo [59] [60].
El entrenamiento adecuado del paciente es clave en disminuir el riesgo de las peritonitis. Un posible indicador de ello puede ser la incidencia de peritonitis por estafilococos coagulasa-negativos. Las posibilidades de contaminación se reducen al emplear sistemas de doble bolsa y conectología con menos desconexiones y, por lo tanto, menos posibilidades de contaminación por contacto. Toda contaminación por contacto en los sistemas o por rotura de bolsas se debe tratar con antibióticos según el protocolo de desconexión accidental, reduciendo de esta forma el riesgo de peritonitis [8]. Siempre debemos pensar que una peritonitis es un fracaso de nuestro programa, no del paciente, por eso el reentrenamiento servirá para no cometer los mismos errores.
La mayoría de los estudios observacionales encuentran una disminución en la incidencia de peritonitis con el uso de soluciones biocompatibles [61]. Por otra parte, un estudio aleatorizado, muy criticado por su diseño, no encontró diferencias [62]. Sin embargo, en el mayor estudio randomizado a largo plazo, se observó una disminución de peritonitis en los pacientes tratados con soluciones biocompatibles, por lo que se aconseja su uso [63].
Hay situaciones en las que el uso de antibióticos contra Gram negativos previo a la realización de exploraciones intestinales tipo colonoscopia, vía biliar y exploraciones ginecológicas previene del desarrollo de peritonitis por enterobacterias [64] [65] [66] [67]. La hipocalemia y los trastornos del ritmo intestinal también favorecen este tipo de peritonitis [68]. Las extracciones dentarias por infección se deben proteger con antibióticos profilácticos. [9]. El uso de antifúngicos en los pacientes que hagan cursos de tratamiento antibiótico disminuye la reinfección por hongos, habiéndose demostrado con nistatina y fluconazol [40] [41] [42].
La necesidad de conocer mejor las peritonitis para conseguir prevenirlas de manera más eficaz nos lleva a priorizar el aprendizaje de la técnica por nuestros pacientes, empleando tiempo suficiente y reentrenamientos frecuentes. Además, el crecimiento de las unidades y la intervención de expertos en la mejora de los cuidados del catéter han demostrado estar relacionadas con tasas inferiores de peritonitis como queda reflejado en los resultados de algunos grupos de trabajo. [69] [70].