Síndrome Nefrótico por Glomeruloesclerosis Focal y Segmentaria
INTRODUCCIÓN
La glomeruloesclerosis segmentaria y focal (GESF) está englobada dentro de las glomerulonefritis (GN) no proliferativas, aunque se trata más de un patrón anatomopatológico caracterizado por una esclerosis/hialinosis que afecta a parte del glomérulo (segmentaria) de algunos glomérulos (focal), que tiene diversas etiologías y mecanismos patogénicos (NAD: Glomeruloesclerosis focal y segmentaria).
Representa el 10% de las biopsias en menores de 65 años y en torno al 5% en mayores de esa edad, según datos del registro español de GN. La prevalencia es mayor en la etnia afroamericana. No existe una nomenclatura definitiva para su clasificación, en la que puede haber causas primarias y secundarias, aunque las KDIGO lo han actualizado [1]. Su mecanismo patogénico se basa en la lesión irreversible de los podocitos, aunque datos recientes implican también a las células del epitelio parietal. La clínica habitual es la proteinuria y el tratamiento se reserva a los casos con síndrome nefrótico (SN) en ausencia de etiologías secundarias o genéticas.
CASO CLÍNICO
En diciembre de 2020 se remitió a la consulta externa de nefrología un varón de 48 años por hipertensión (HTA), edemas y proteinuria. Se trataba de un paciente de raza negra, natural de Senegal, que trabajaba como electricista en España desde hacía 10 años, y era fumador activo. Tenía cefalea de características tensionales, edemas en miembros inferiores y astenia de 3-4 semanas de evolución. No tomaba ningún fármaco de forma habitual. No tenía antecedentes familiares de enfermedad renal.
Exploración física: 70 kg, PA 150/100 mmHg. Auscultación pulmonar normal. Edema con fóvea en piernas hasta raíz de muslos.
Se hizo bioimpedancia que calculó una sobrecarga hídrica de +4.5 L.
Los análisis mostraron: creatinina 1.06 mg/dl, FGe CKD-EPI 82 ml/min/1.73m2, albúmina 2.5 g/dl, colesterol total de 618 mg/dl (LDLc 504 mg/dl), microhematuria y cociente proteína/creatinina de 6.26 g/g. La ecografía renal fue normal.
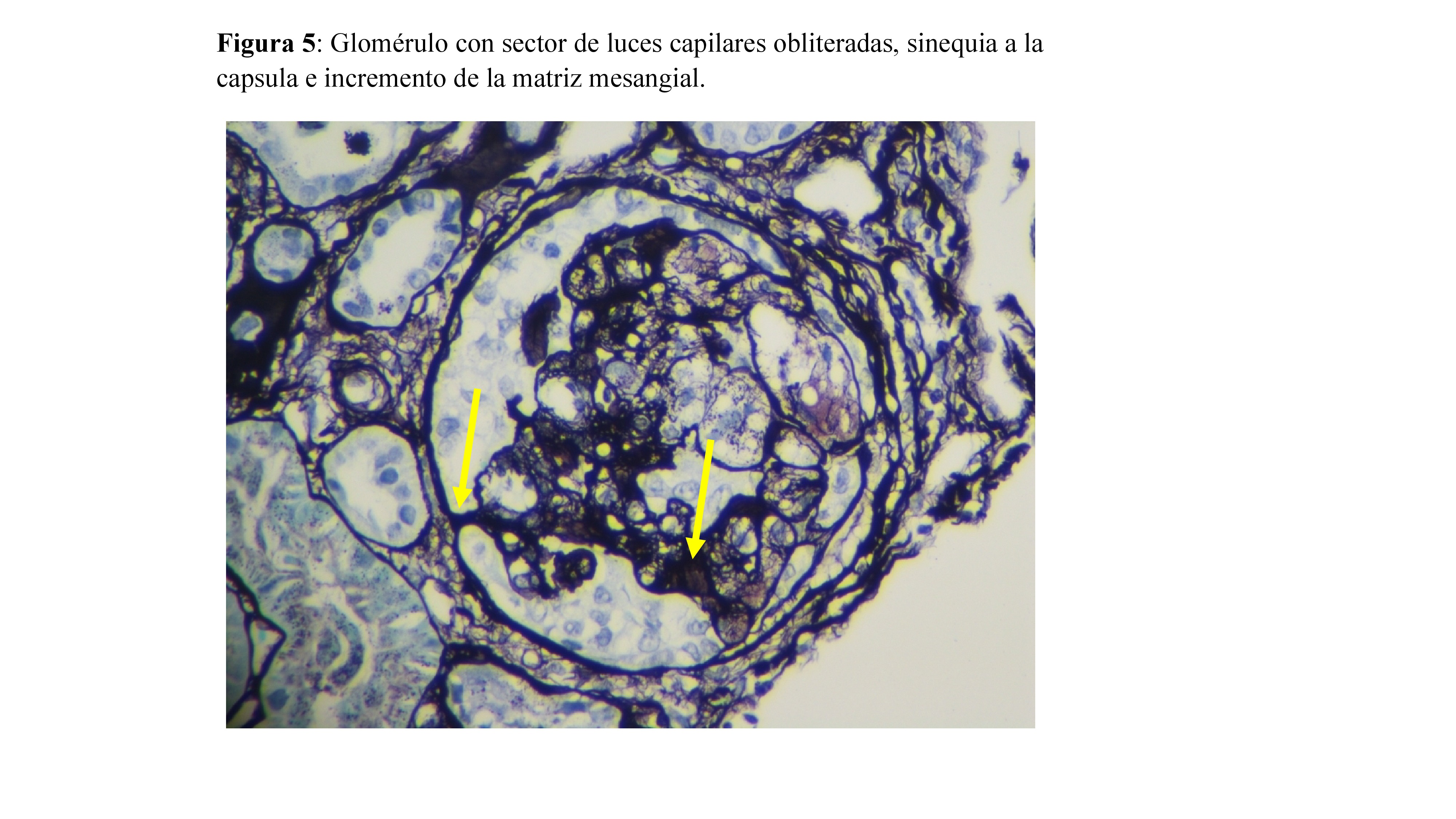
Ante el diagnóstico de SN, se inició tratamiento con IECA, diurético y estatina y se solicitaron pruebas complementarias para diagnóstico etiológico. Tanto el estudio inmunológico (complemento, ANA, ANCA, anti-PLA2R) como el estudio serológico (virus de hepatitis, VIH, CMV, sífilis y parvovirus) resultaron negativos. Se decidió realizar una biopsia renal, obteniéndose 2 cilindros con 20 glomérulos. En la microscopía óptica (MO) el 20% presentaba esclerosis mesangial focal con sinequias en la capsula de Bowman, sin atrofia tubular ni fibrosis intersticial, y sin depósitos en la inmunofluorescencia, etiquetándose como GESF. No se pudo realizar estudio con microscopía electrónica (ME) por falta de muestra.
Dada la presencia de SN y la negatividad del estudio de formas secundarias, se inició tratamiento con prednisona a dosis de 1 mg/Kg/día durante 8 semanas con posterior reducción progresiva de dosis y retirada en las 16 semanas siguientes, estabilizándose la proteinuria alrededor de 0.4-0.5 g/24h, con ausencia de edemas, y buen control tensional. En la actualidad (tras un año y medio del inicio del cuadro) mantiene tratamiento con IECA y un diurético, habiendo sido posible la retirada de estatinas.
COMENTARIOS
Nos encontramos frente a un SN en un adulto, sin síntomas sistémicos, que hacía pensar en una de las 3 entidades cuya clínica habitual suele incluir este síndrome: GN membranosa, enfermedad por cambios mínimos (MCD) o la GSF.
La sintomatología clínica hace difícil diferenciar estas patologías, aunque sí orientaba a una patología exclusivamente renal. La proteinuria es la clínica más habitual en la GSF, en adultos también es frecuente la hematuria (puede estar presente hasta en un 50% de los casos) y la HTA, pero ambas pueden aparecer en cualquiera de ellas. El hecho de que fuera de raza negra hacía más posible la GSF. Por otro lado, los datos bioquímicos, descartaban enfermedades sistémicas y la negatividad de anticuerpos frente al receptor de la fosfolipasa A2 (anti-PLA2R) apuntaba más hacia una GSF o MCD. Pero para el diagnóstico de certeza es necesario la biopsia renal, en cualquier caso. La ME aporta datos importantes en la GSF como el borramiento difuso o segmentario de los pedicelos, por lo que es muy útil disponer de ella; en nuestro caso no pudimos tenerla por falta de muestra.
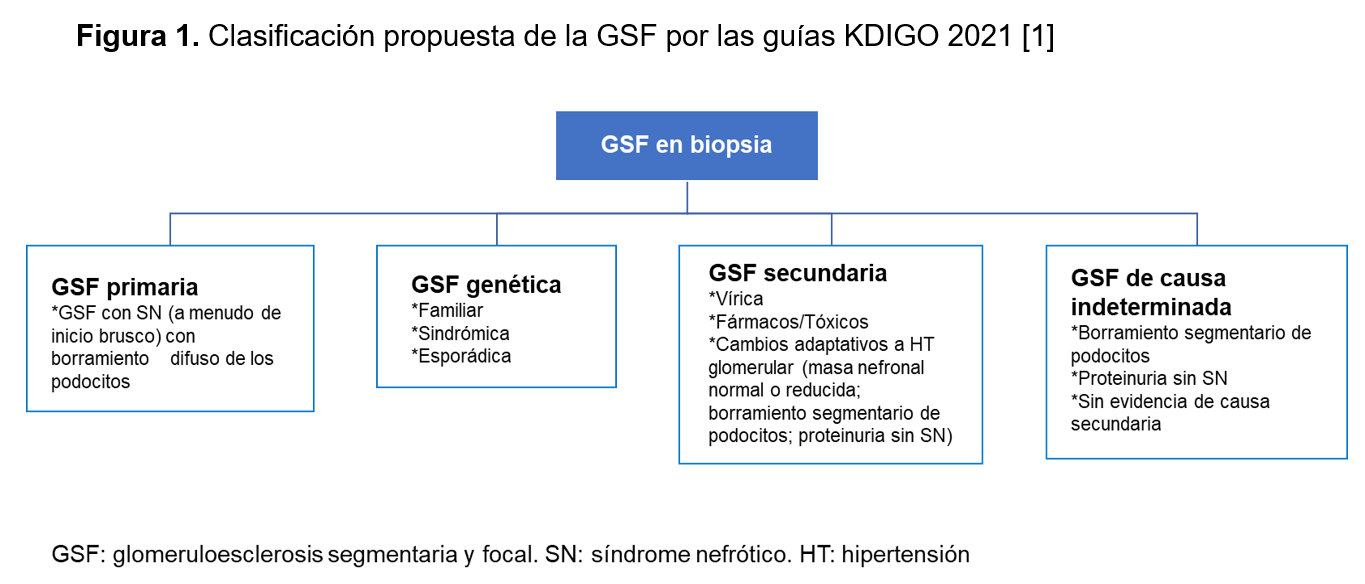
En las últimas guías KDIGO de manejo de las enfermedades glomerulares de 2021 [1], se propone una nueva clasificación de las GSF con el objetivo de mejorar y simplificar su utilidad clínica y clarificar su fisiopatología. En esta clasificación se elimina el término “idiopática”, clasificando la entidad en primaria, genética, secundaria y de causa indeterminada (Figura 1). Las formas primarias se definirían como aquéllas que clínicamente se presentan con un SN, en la ME presentan borramiento difuso de los pies podocitarios (no completamente específico de las formas primarias) y no existe ninguna otra causa identificable de GS. Aunque esta forma se ha atribuido a la exposición del podocito a un factor de permeabilidad circulante, éste todavía no ha sido identificado, y la única situación actual razonablemente atribuida a este tipo de factor es aquella GSF que recurre rápidamente tras un trasplante renal y que puede ser tratada con éxito con plasmaféresis para eliminar este factor.
Las causas secundarias de GSF pueden ser por infecciones (VIH, CMV, parvovirus B19, VEB, hepatitis C, síndrome hemofagocítico, SARS-COV-2 en genotipos de riesgo APOL1), fármacos/tóxicos (antivirales, inhibidores mTOR, anticalcineurínicos, antraciclinas, adulterantes de la heroína, litio, interferón, esteroides anabolizantes, AINES) y por cambios adaptativos con hipertensión glomerular (reducción en el número de nefronas, obesidad, HTA, glomerulopatías primarias, nefropatía diabética o hipertensiva, etc.). Estas formas secundarias no responden al tratamiento inmunosupresor, siendo el tratamiento principal el de la causa subyacente. No suelen recurrir en el trasplante renal.
Finalmente, la GSF también puede desarrollarse en sujetos con mutaciones en genes que codifican proteínas del podocito o de la membrana basal glomerular. El estudio genético no está indicado de forma rutinaria, sino en casos individualizados como agrupaciones familiares de GSF, corticorresistencia (típico de las formas genéticas), información pronóstica de cara a un futuro trasplante renal (las formas primarias recurren con frecuencia, no así las genéticas) y evaluación de los donantes vivos renales emparentados asintomáticos, especialmente si hay sospecha de la existencia de variantes genéticas de riesgo en APOL1. En pacientes de origen africano, la presencia de variantes de riesgo en el gen APOL1 se ha asociado a la forma colapsante de GSF. Cuando en una GSF no se identifican causas genéticas o secundarias, no se presenta con SN, ni hay borramiento difuso de los pedicelos en la ME, entonces estaremos ante una GSF de causa indeterminada.
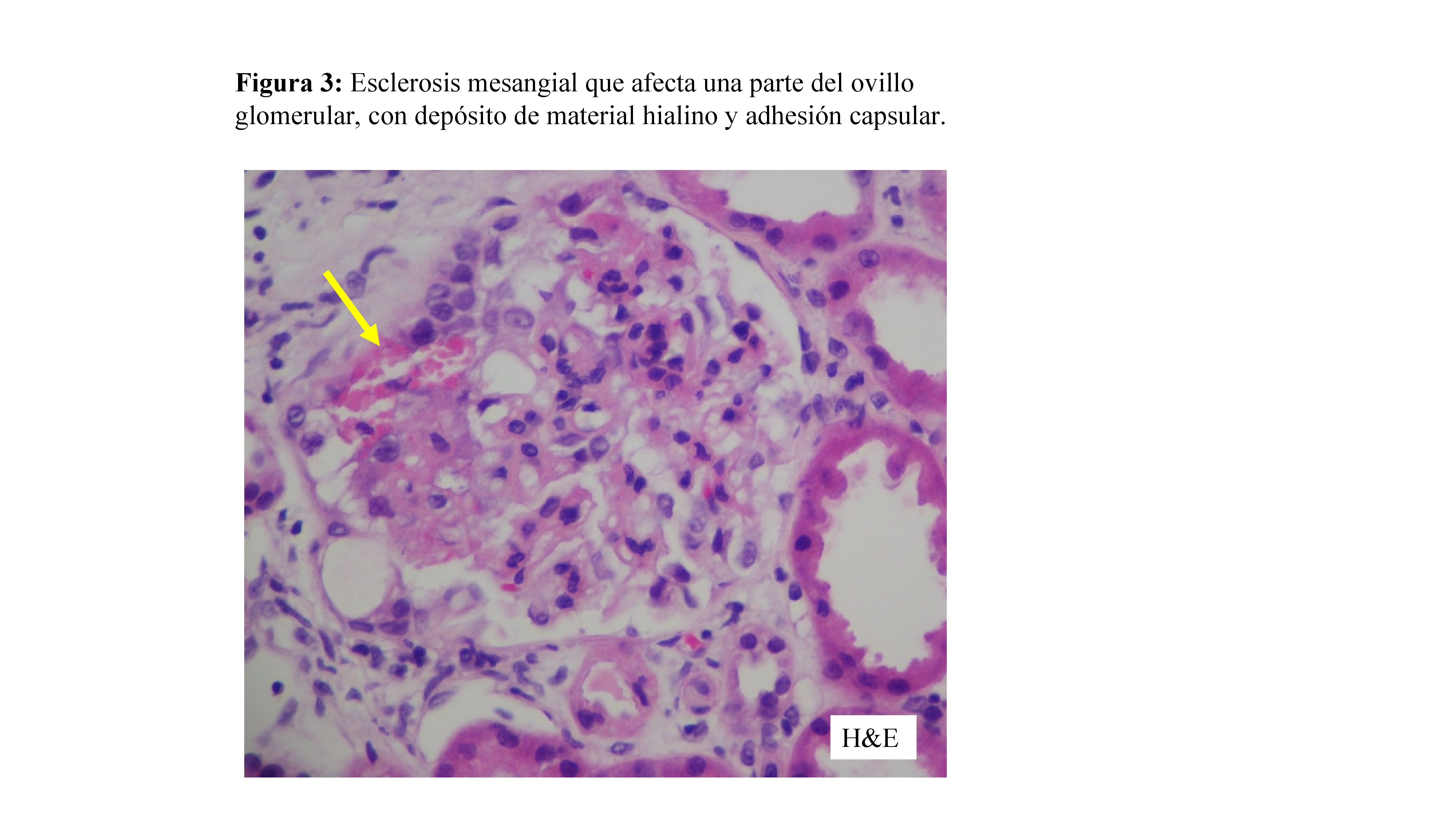
El algoritmo de las KDIGO de evaluación de los pacientes con una GSF en la biopsia, según su presentación clínica, se muestra en la (Figura 2). Se etiquetó de GESF probablemente primaria por: SN de inicio brusco, ausencia de antecedentes familiares y no se encontraron causas secundarias, iniciándose entonces el tratamiento de primera línea con esteroides en monoterapia a dosis de 1 mg/kg/dia durante 8 semanas. Como se observó respuesta al tratamiento, con reducción de la proteinuria, se fue reduciendo la dosis progresivamente a partir de ahí, con suspensión en las 16 semanas siguientes, obteniéndose una remisión parcial de la enfermedad con proteinuria alrededor de 0.4-0.5 g/24h, que se ha mantenido estable durante el seguimiento. En los casos de córtico-resistencia, córtico-dependencia o contraindicación a los esteroides, el tratamiento de segunda línea es un anticalcineurínico, a dosis similares a las usadas en la nefropatía de cambios mínimos y mantenidas un mínimo de 1-2 años; si no se toleran los anticalcineurínicos, una opción es el micofenolato + prednisona. El rituximab ha mostrado buenos resultados en casos de córtico-dependencia [1].
La evolución de esta enfermedad depende del grado de proteinuria, el daño observado en la biopsia (pérdida podocitaria y de fibrosis intersticial), la presencia de deterioro del FG y la respuesta al tratamiento. Los datos observados en los estudios muestran un porcentaje de remisión total o parcial en torno al 39-75% (NAD: Glomeruloesclerosis focal y segmentaria, tabla 6). De los casos resistentes, la mitad evolucionan a estadios finales de enfermedad renal crónica a los 10 años, algunos de forma rápida en 2-3 años. Existe un 30-40% de riesgo de recidiva en el trasplante renal en las GSF primarias. En nuestro caso cursaba con SN, pero el deterioro del FG era mínimo y no había fibrosis en la biopsia, teniendo una buena evolución. De todos modos, la respuesta al tratamiento es el parámetro con mayor poder pronóstico en pacientes con SN, incluso una respuesta parcial, por lo que la buena respuesta en nuestro caso hace presagiar un mejor pronóstico. Tras año y medio de seguimiento, la función renal se ha mantenido estable y con una proteinuria ≤ 0.5 g/24h. No obstante, las recaídas son frecuentes en esta entidad, por lo que es importante la monitorización. Como medidas complementarias para el control de proteinuria es importante el control estricto de la PA, con bloqueo del sistema renina-angiotensina y restricción de sal con o sin diurético.
En resumen, la GSF es una de las principales causas de SN, siendo necesaria la biopsia renal para su diagnóstico de certeza. Es importante diferenciar entre causas primarias del resto, dado que el tratamiento con esteroides sólo está indicado en el primer caso, con mejores resultados en ausencia de insuficiencia renal.
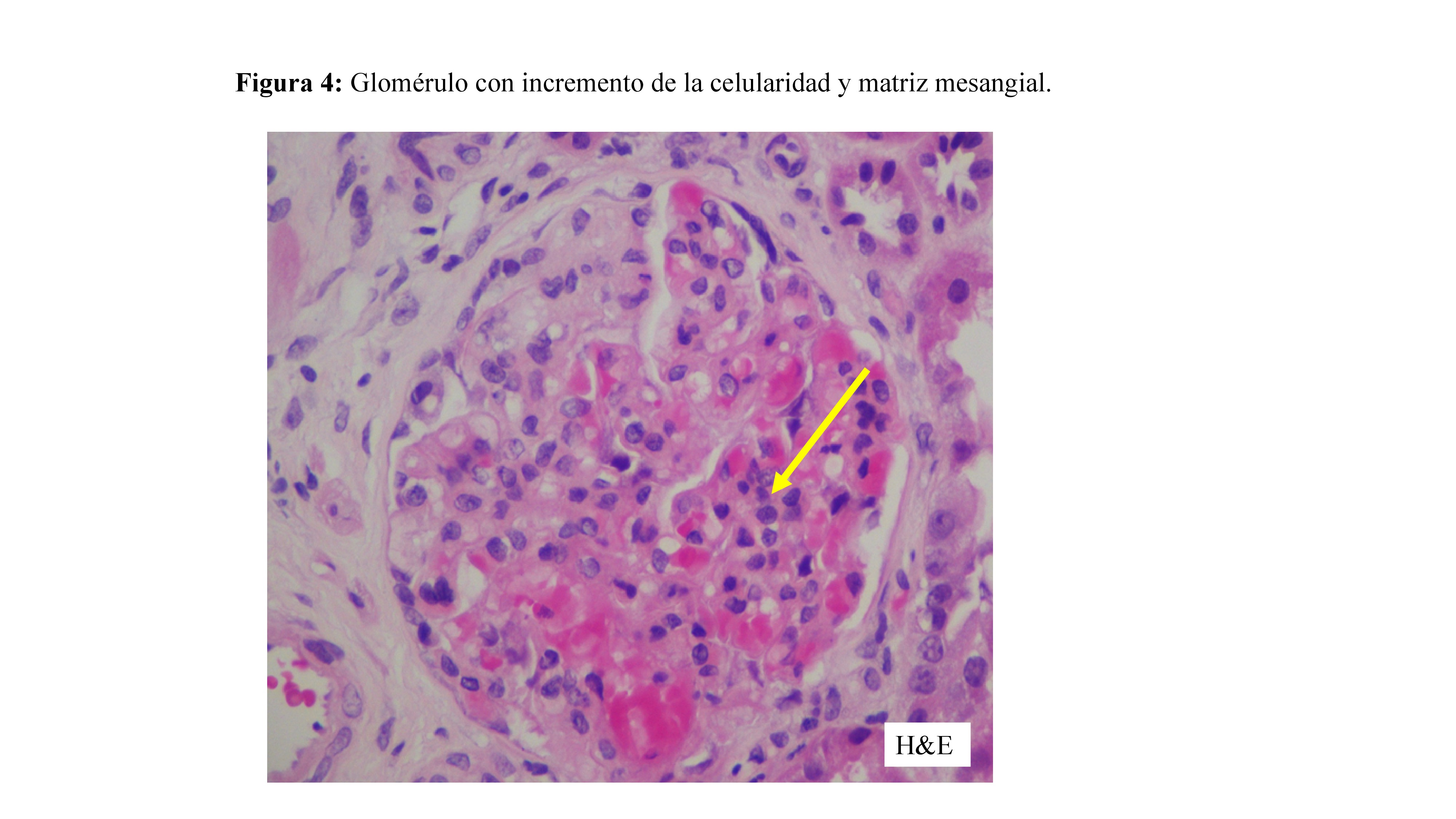
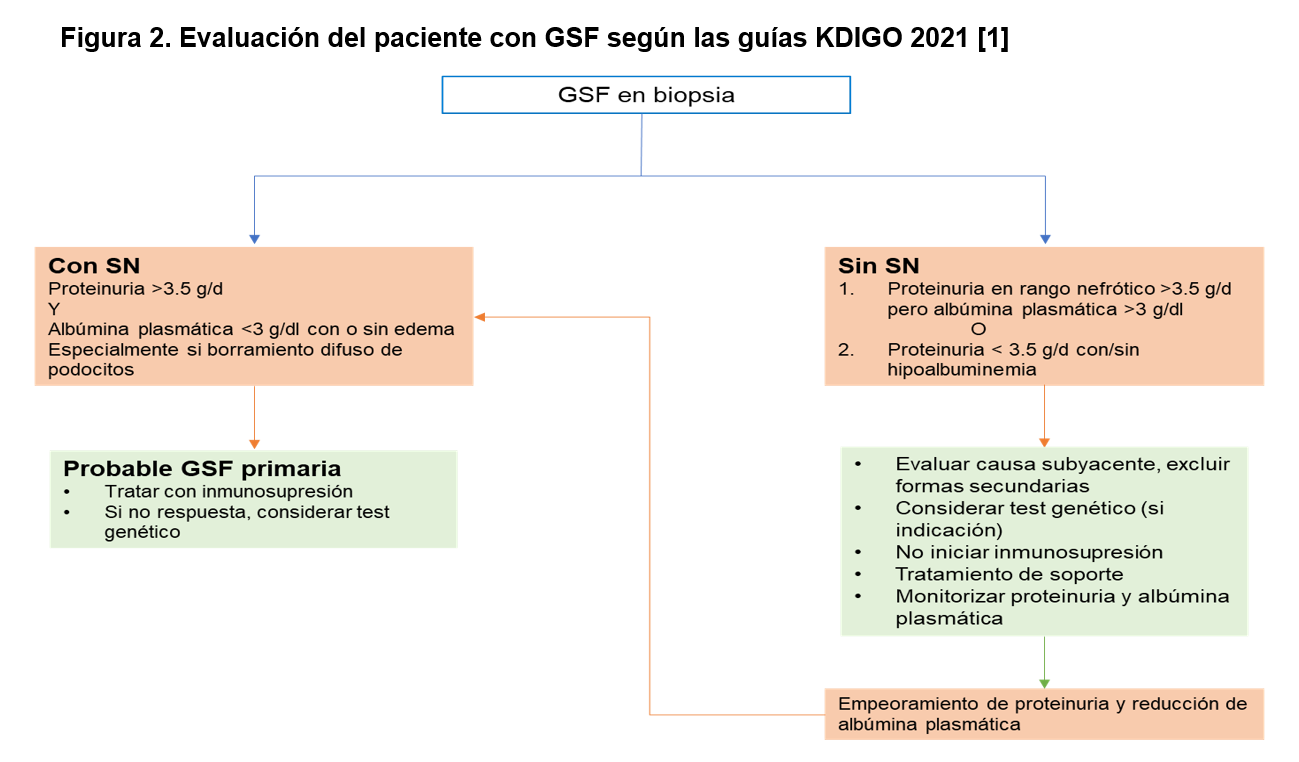
Los resultados de la biopsia renal se ilustran en la (Figura 3) (Figura 4) y (Figura 5)
REFERENCIAS BIBLIOGRÁFICAS
1. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021; 100: S1-S276.