Nefropatía membranosa primaria
INTRODUCCIÓN
La nefropatía membranosa es una glomerulopatía primaria que constituye la causa más frecuente de síndrome nefrótico en el adulto. Típicamente aparece en la 4º y 5º década de la vida. (NAD:Nefropatía membranosa). Aunque la biopsia renal sigue siendo la piedra angular para la evaluación de las enfermedades glomerulares, en adultos con función renal normal, inicio agudo de un síndrome nefrótico, y que son positivos para el receptor anti-fosfolipasa A2 (PLA2R), es probable que tengan una nefropatía membranosa y de forma individualizada se puede optar por no practicarla.
CASO CLÍNICO
Se trata de un varón de 48 años, fumador activo, sin otros antecedentes de interés ni tratamiento crónico, que vive en medio rural. Tras un viaje en periodo estival, comenzó con malestar general y encamamiento progresivo, acompañado de tos no productiva con algún esputo hemoptoico, dolor pleurítico izquierdo y aumento progresivo de perímetro de miembros inferiores. Se acompañaba de una ganancia ponderal de 4 Kg, sin ninguna otra sintomatología.
En la exploración física: TA 150/95, FC 105. Eupneico, rítmico y sin soplos. Hipoventilación en hemitórax derecho. Edema bilateral con fóvea hasta rodilla.
En analítica inicial, destacaba leucocitosis, función renal normal, hiperlipidemia, hipoalbuminemia, 3 cruces de proteinuria y microhematuria. La cuantificación de proteinuria de 24 horas fue de 7,5 gramos.
En radiografía de tórax se objetivó derrame pleural derecho. El análisis del líquido pleural fue compatible con un trasudado y la anatomía patológica fue sugestiva de hiperplasia mesotelial reactiva. Se realizó un TAC toraco-abdominal con hallazgo de enfermedad tromboembólica en arterias basales de lóbulo inferior derecho e infarto pulmonar a dicho nivel, así como trombosis de vena renal izquierda. No se objetivaron datos de enfermedad neoplásica. Se inició anticoagulación con heparina de bajo peso molecular.
Los análisis específicos mostraron proteinograma, cadenas ligeras, complemento e inmunoglobulinas normales, ANA y ANCAS negativos. Las serologías de hepatitis B, hepatitis C y VIH fueron negativas, así como los cultivos de sangre, orina y liquido pleural. Ante estos hallazgos se solicitaron anticuerpos anti-PLA2R que resultaron positivos, a título 1/160.
Dado el alto riesgo de biopsia renal, se asumió el diagnóstico de nefropatía membranosa primaria. Así, se inició tratamiento con bloqueadores del sistema renina-angiotensina, estatinas, diuréticos y restricción de sodio, con persistencia de congestión pulmonar y periférica, y de proteinuria de 8g/24h.
Durante ingreso presentó febrícula y aumento del derrame pleural derecho, que obligó finalmente a realizar una biopsia pleural mediante videotoracoscopia, que mostró pleura de aspecto inflamatorio y evacuando un total de 1700cc de líquido pleural compatible nuevamente con trasudado. Tras dicho procedimiento cesó la febrícula y se dio de alta. Los cultivos del líquido pleural fueron negativos.
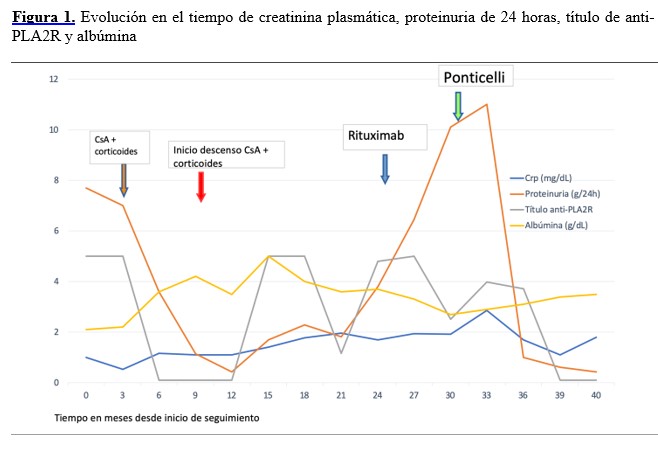
El paciente inició seguimiento en consultas (Figura 1). Inicialmente tuvo un leve descenso de la proteinuria a 4g/24h, por lo que se mantuvo manejo conservador. En siguiente control, 6 meses después, el síndrome nefrótico empeoró (albúmina 2.8 y proteinuria de 7g/24 horas) y se decidió iniciar ciclosporina a dosis de 100 mg/12 horas (3mg/kg/24h) y prednisona 10 mg/48 horas, a lo que se añadió cotrimoxazol como profilaxis. Se optó por este tratamiento inmunosupresor como primera línea ante la posibilidad de infección tuberculosa. Tras 6 meses de tratamiento, el síndrome nefrótico desapareció, pero al reducirse dosis de ciclosporina y prednisona, hubo un repunte de la proteinuria y un deterioro lentamente progresivo de función renal (creatinina plasmática 2 mg/dl y FGe 38 ml/min). Además, presentaba un síndrome constitucional llamativo por lo que se realizó despistaje de neoplasia de nuevo con TAC, sangre oculta en heces, PSA, endoscopia digestiva alta que resultaron normales.
Ante esta situación se optó por administrar 2 dosis de 1000 mg de rituximab intravenoso, separadas en un intervalo de 15 días. Tuvo una respuesta inmunológica parcial con disminución de los títulos de anti-PLA2R, pero ausencia de respuesta clínica y analítica. Tras 6 meses de seguimiento, persistía proteinuria de 11 g/día y albúmina 2.8 g/dl, con creatinina plasmática 2.86 mg/dl.
La ausencia de respuesta obligó a iniciar terapia inmunosupresora mediante esquema de Ponticelli modificado (meses 1, 3 y 5 corticosteroides; meses 2, 4 y 6 ciclofosfamida oral) y profilaxis antiinfecciosa con cotrimoxazol. En la actualidad, a los 3 meses de finalización de dicha pauta, los análisis son: proteinuria 0.44g/24h, creatinina plasmática 1.08 mg/dl, albúmina 3.5 g/dl y anti-PLA2R negativos. Se ha mantenido la anticoagulación de manera indefinida durante todo el tiempo de seguimiento, que plantearemos suspender si continua en remisión en sucesivas revisiones.
COMENTARIOS:
Describimos un caso de nefropatía membranosa primaria, en el que se prescindió de biopsia renal diagnóstica dada la necesidad de anticoagulación y la presencia de una trombosis en la vena renal izquierda. La positividad de los anticuerpos anti-PLA2R, con la compatibilidad del cuadro clínico permite asumir el diagnóstico y evitar la biopsia en casos de alto riesgo. En pacientes con función renal preservada, antiPLA2R positivo y sin evidencia de causas secundarias, la biopsia renal no aporta información adicional que conlleve cambios en el manejo [1]. En cuanto a la posibilidad de estar ante un cuadro de nefropatía membranosa secundaria, se descartaron razonablemente asociaciones con estudios de imagen y analíticos, sobre todo por la astenia inicial, que a lo largo de la evolución se convirtió en un síndrome constitucional; se realizaron estudios complementarios con el fin de descartar un proceso neoplásico subyacente, así como cribado de neoplasias más frecuentes en rango de edad del paciente. No encontramos signos o síntomas que orientasen a profundizar en la búsqueda de otras causas secundarias, a excepción de las complicaciones pulmonares y pleurales que fueron ampliamente estudiadas. Asimismo, la presentación como síndrome nefrótico puro con positividad para anti-PLA2R apoya la etiología primaria. Atribuimos la astenia a patología sistémica inmunológica activa en ausencia de otros hallazgos. La mejoría con la buena evolución de la proteinuria y resto de complicaciones, apoyan esta posibilidad.
La presentación al diagnóstico fue la típica de la nefropatía membranosa: un síndrome nefrótico completo con función renal normal. La presencia de fenómenos trombóticos condicionó un cuadro de deterioro desde el punto de vista respiratorio asociado a componente de sobrecarga de volumen en el contexto de hipoproteinemia. En ausencia de aislamiento bacteriológico en cultivos y dado que el líquido pleural era un trasudado, se atribuyó al tromboembolismo y el infarto pulmonar secundario. En general, pacientes con diuresis y función renal conservada al diagnóstico no suelen presentarse con un cuadro respiratorio tan florido como el nuestro. Por ello, hay que descartar el tromboembolismo pulmonar siempre que tengamos clínica compatible o cualquier signo de sospecha y valorar riesgo-beneficio de iniciar anticoagulación profiláctica en cada caso [2]. En general, se recomienda anticoagulación profiláctica en caso de hipoalbuminemia grave, especialmente si hay otros factores protrombóticos [3]. En nuestro caso, dada la forma de presentación con fenómenos tromboembólicos asociados, no hubo dudas en cuanto al beneficio de la anticoagulación. En la actualidad, dada la resolución de síndrome nefrótico plantearemos evolutivamente la suspensión de anticoagulación.
Además del diagnóstico, la monitorización de los anticuerpos anti-PLA2R tiene especial interés durante el seguimiento [3]. En pacientes que presenten concentraciones elevadas de anticuerpos anti-PLA2R es improbable que hagan una remisión espontánea. Si los anticuerpos desaparecen (remisión inmunológica), ya sea espontánea o inducida por inmunosupresión, la bajada puede preceder a la remisión clínica en meses (variable en cada caso) y cuando reaparecen tras su negativización tienen valor predictivo de recidiva clínica (también en meses, aunque variable). En el caso de que no se logre una remisión inmunológica, el riesgo de experimentar recidivas es más alto. El caso que presentamos mostró una negativización de anticuerpos tras la primera y segunda líneas de tratamiento, con posterior repunte y negativización de anticuerpos con la pauta de Ponticelli correspondiendo con la evolución clínica e indicando su utilidad.
La relevancia de nuestro caso radica fundamentalmente en la complejidad de manejo desde su presentación. El debut con complicaciones graves del síndrome nefrótico podría haber sido indicación de iniciar tratamiento con esquema de Ponticelli sin esperar a la remisión espontánea [4]. No obstante, la clínica respiratoria obligó a descartar una infección tuberculosa e hizo que se optase por la opción intermedia de esperar a negativización de cultivos y luego iniciar anticalcineurínico para minimizar riesgos infecciosos. Dado que los anti-PLA2R volvieron a repuntar y la clínica persistía, se decidió empleo de rituximab como agente de rescate sin adecuada respuesta, quedando como opción el esquema de Ponticelli, con la que alcanzamos remisión clínica e inmunológica. La principal duda que genera el caso es si se hubiese conseguido adecuada respuesta con el uso inicial de la pauta de Ponticelli tras haber descartado infección tuberculosa. No es infrecuente la necesidad de más de una línea terapéutica en los casos de nefropatía membranosa, guiándose la elección inicial tras la estratificación de riesgo.
Bibliografía
[1] Alsharhan L, Beck LH Jr. Membranous Nephropathy: Core Curriculum 2021. Am J Kidney Dis. 2021;77:440-453.
[2] GNTools.com. A tool to decide about prophylactic anticoagulation for membranous nephropathy https://www.med.unc.edu/gntools/
[3] Trujillo H, Alonso M, Praga M. New Ways of Understanding Membranous Nephropathy. Neph-ron. 2020;144:261-271
[4] Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021;100:S1-S276