Glomerulonefritis Rápidamente progresiva con presencia de anticuerpos anti-membrana basal glomerular
INTRODUCCIÓN
La glomerulonefritis rápidamente progresiva (GNRP) constituye un síndrome clínico caracterizado por deterioro de la función renal en días o semanas, con signos de daño glomerular. La presencia de proliferación extracapilar en el espacio de Bowman es el hallazgo histológico característico (NAD: Glomerulonefritis rápidamente progresiva). Se describe que el daño glomerular puede estar mediado por anticuerpos anti-membrana basal glomerular (anti-MBG), por inmunocomplejos o sin depósitos de inmunoglobulinas o pauci-inmune. El tratamiento debe ser precoz ante una alta sospecha clínica debido a que sin tratamiento presentan una elevada morbimortalidad.
CASO CLÍNICO
Mujer de 18 años que acudió a urgencias por un cuadro clínico de varios días de evolución caracterizado por astenia intensa, disnea de esfuerzo y disminución del ritmo de diuresis.
Entre sus antecedentes destacaban faringitis e infecciones urinarias de repetición estudiada por urología con ecografías y urografía intravenosa normales. Negaba hábitos tóxicos.
Exploración física: PA 160/95 mmHg, FC 87 lpm, SatO2 basal 94%. Hipoventilación en ambos campos pulmonares. Edemas pretibiales con fóvea.
Análisis en urgencias: creatinina 7.92 mg/dl (previa 0.8), urea 83 mg/dl, sodio 141 mEq/l, potasio 4.9 mEq/l, bicarbonato 24 mmol/l, glucemia 80 mg/dl, leucocitos 8.8 x 109/l, neutrófilos 71%, Hb 11 gr/dl, plaquetas 314 x 109/l, INR 1.05, VSG 86, TSH 1,47 mUI/l, calcio 8.8 mg/dl, fósforo 5.5 mg/dl, proteínas 5 g/dl, albúmina 3.7 g/dl. Orina elemental: 20-50 hematíes/c, 25-50 leucocitos/c, proteínas 1 g/l. Hematíes dismórficos en orina 80%. Tóxicos en orina negativos.
En urgencias, se inició tratamiento con furosemida intravenosa y se ingresó para ampliar estudio y seguir tratamiento. Al no obtener respuesta diurética, 24 horas más tarde precisó hemodiálisis. Al mismo tiempo, de forma empírica, a las 6 horas del ingreso se administró un bolus de metilprednisolona de 500 mg (total 3 bolus en 3 días consecutivos) y tras ellos se siguió con prednisona oral (a dosis de 1 mg/kg/día).
Se amplió el estudio con los siguientes resultados:
- Proteinuria: 2.3 gr/24 h.
- Autoinmunidad: inmunoglobulinas, ASLO y complemento (C3 y C4) normales. Anticuerpo anti receptor de fosfolipasa A2 (anti-PLA2R), anticuerpos anti-citoplasmáticos de neutrófilos (ANCAs), factor reumatoide, anticuerpos antinucleares (ANA), anti-dsDNA y crioglobulinas negativos. Anti-MBG positivos: título de 28 CU (intervalo de referencia: 0-20).
- Serologías VHB, VHC y VIH: negativas.
- PCR COVID 19, Ag Legionella y S.pneumoniae: negativos.
- Hemocultivo, urocultivo y coprocultivo: negativos.
- Sangre oculta en Heces: negativa.
- Radiografía de tórax: signos de edema intersticial pulmonar.
- Ecografía urológica, ecocardiograma y broncoscopia con lavado broncoalveolar: sin hallazgos patológicos.
Se realizó biopsia renal que se informó como glomerulonefritis necrotizante global y difusa, con un 94% de semilunas celulares (17/18, prácticamente en el mismo estadio evolutivo) y una semiluna fibrocelular (1/18, 8%). Infiltrado inflamatorio intersticial moderado. Sin evidencia de fibrosis intersticial ni atrofia tubular. En el estudio de inmunofluorescencia, se observaron 8 glomérulos con depósitos lineales de IgG (3+/3+) localizados en paredes capilares. Con este resultado de la biopsia renal (2º día de ingreso), se añadió ciclofosfamida oral 2 mg/kg/día y simultáneamente, se iniciaron sesiones de plasmaféresis (total 9 sesiones).
Durante el ingreso, presentó un episodio aislado de expectoración hemoptoica, que tras ser estudiada por neumología descartaron hemorragia pulmonar (LBA normal). Los anticuerpos anti-MBG negativizaron tras 8 días con corticoterapia y 6 días con plasmaféresis y ciclofosfamida. Sin embargo, no presentó mejoría analítica y mantuvo diuresis en torno a 500 – 600 cc/día continuando en hemodiálisis. Se redujo la dosis de ciclofosfamida por leucopenia, y finalmente se suspendió al no recuperar la función renal tras 13 semanas de tratamiento. Se mantuvo prednisona oral en pauta descendente durante 6 meses.
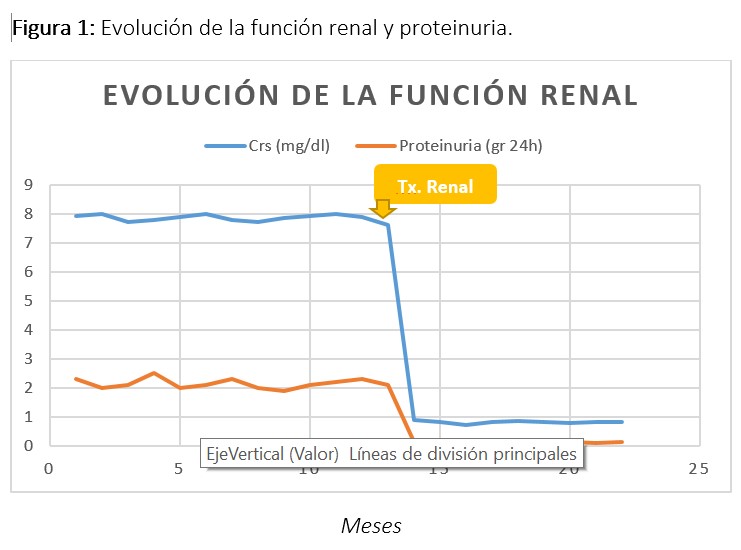
Tras recibir información sobre tratamiento renal sustitutivo (TRS) eligió diálisis peritoneal por lo que se transfirió a esta técnica con buena adaptación. En todos los controles mantuvo los Ac-MBG negativos. Un año después de este episodio, recibió un primer trasplante renal de cadáver. Actualmente, tras 9 meses de trasplante, presenta injerto renal funcionante, con creatinina de 0.8 mg/dl, sin alteraciones en sedimento urinario (Figura 1).
DISCUSIÓN
Nos enfrentamos a un fracaso renal agudo grave con: oliguria, edema agudo pulmonar, hematuria glomerular (hematíes dismórficos), leucocituria, proteinuria no nefrótica e hipertensión arterial, lo que constituye un síndrome nefrítico (NAD: Síndromes clínicos en Nefrología). La forma de presentación de síndrome nefrítico con grave deterioro de la función renal y síntomas generales nos orienta a la existencia de una GNRP (NAD: Glomerulonefritis rápidamente progresiva). Esta entidad provoca un importante daño renal progresivo, con ruptura de la membrana basal glomerular y proliferación extracapilar; en la mayor parte de los casos su presentación clínica es como la del caso, siendo la insuficiencia renal una constante en el momento de la presentación. La hemoptisis puede aparecer en todos los tipos de GNRP, secundaria a hemorragia pulmonar o a sobrecarga hídrica pulmonar. En nuestro caso, el episodio aislado de hemoptisis se asoció con la congestión pulmonar.
Ante la alta sospecha de GNRP se realizó estudio serológico urgente en el que la determinación de anti-PLA2R, ANA, anti-DNA, complemento, ANCAs, crioglobulinas y serología de virus B, C y VIH resultaron negativos, alejándonos de esta manera la posibilidad diagnóstica de patología vírica, lupus eritematoso sistémico (LES), crioglobulinemia y de vasculitis asociada a ANCAs. Sin embargo, se detectaron anticuerpos anti-MBG positivos, orientándonos hacia una enfermedad por anticuerpos anti-MBG. La otra parte diagnóstica esencial es la biopsia renal donde encontramos un 94% de semilunas celulares e Ig G lineal en el estudio de inmunofluorescencia. Estos hallazgos, la presencia de anticuerpos antiMBG y el cuadro clínico compatible nos confirma que se trata de una enfermedad por anti-MBG, ya que hay que recordar que los depósitos lineales de inmunoglobulinas pueden presentarse en otras patologías como diabetes, enfermedad por cadenas ligeras, LES o glomerulopatía fibrilar, ausentes en nuestra paciente.
La enfermedad por anticuerpos anti-MBG está causada por anticuerpos circulantes, habitualmente Ig G (1 y 3), dirigidos principalmente contra el dominio NC1 de la cadena α3 del colágeno tipo IV. Ocasionan una GNRP que frecuentemente conduce a insuficiencia renal aguda y puede presentarse con afectación exclusivamente renal o con lesión de la membrana basal alveolar causando hemorragia pulmonar. El estímulo que induce a la formación de los anticuerpos circulantes es desconocido. Algunos estudios recientes apuntan su patogenia a la presencia de linfocitos T autorreactivos. Se han sugerido como factores de riesgo de la enfermedad la existencia de una susceptibilidad genética, relacionándose con los complejos de histocompatibilidad HLA-DRB1*1501 y DR4 y factores ambientales como exposición a hidrocarburos y tabaco. El desarrollo de anticuerpos anti-MBG puede preceder por muchos meses a la aparición de signos y síntomas clínicos [1].
Ante la sospecha clínica de GNRP, es fundamental instaurar un tratamiento adecuado y precoz por la gravedad de la patología que se relaciona con un pronóstico infausto si se deja a su libre evolución. La terapia de inducción incluye esteroides y ciclofosfamida oral o intravenosa, sin evidencia de preferencia por una u otra vía de administración. Nosotros iniciamos tratamiento de inducción con esteroides y la ciclofosfamida oral poco después, habiendo realizado estudio de autoinmunidad y biopsia renal de forma urgente, pero sin esperar a la confirmación histológica, con la intención de frenar la formación de nuevos anticuerpos. Así mismo realizamos plasmaféresis precoz para intentar eliminar los anticuerpos de la circulación. La evidencia de que la plasmaféresis aumente la supervivencia total y renal es poca, pero su uso está muy extendido en la práctica clínica habitual en este tipo de pacientes (NAD: Glomerulonefritis rápidamente progresiva, tabla 3). Los autores apuntan a mantener el tratamiento inmunosupresor 3-6 meses con monitorización de los anticuerpos anti-MBG, incluso amplían hasta 9 meses en caso de no negativización. Las recidivas son poco frecuentes por lo que no recomiendan terapia de mantenimiento tras la remisión. Hay que recordar, el ajuste de la dosis de ciclofosfamida no sólo según recuento leucocitario sino también según función renal y la vigilancia estrecha de sus posibles complicaciones como leucopenia, infecciones, cistitis hemorrágica entre otros que podrían limitar su uso.
Como factores de supervivencia renal de mal pronóstico se han descrito la insuficiencia renal grave al diagnóstico, la necesidad precoz de TRS, la lesión extensa y tipo de semiluna (fibrosa) en la biopsia renal. En nuestro caso presentó muchos de los factores descritos, incluyendo un 94% de semilunas, aunque pocas eran fibrosas que son las que condicionan la irreversibilidad del cuadro. Así, a pesar de instaurar una combinación terapéutica adecuada y rápida no se logró recuperar la función renal. Actualmente, está trasplantada renal con buen funcionamiento del injerto renal y buena calidad de vida. La recidiva es rara si han desaparecido los anti-MBG circulantes al menos 6 meses antes del trasplante (NAD: Disfunción Crónica Tardía del Trasplante Renal).
En resumen, presentamos un caso de GNRP que necesita TRS de inicio sin hemorragia pulmonar y que a pesar del tratamiento precoz con inmunosupresores y plasmaféresis no recuperó la función renal. Aunque en nuestro caso no hubo respuesta satisfactoria al tratamiento es importante recalcar, que ante una fuerte sospecha diagnóstica es clave el inicio de una terapia adecuada precoz.
BIBLIOGRAFIA
1. Olson SW, Arbogast CB, Baker TP, et al. Asymptomatic autoantibodies associate with future anti-glomerular basement membrane disease. J Am Soc Nephrol 2011; 22:1946.