Resultados generales de la diálisis peritoneal
Palabras clave
Diálisis peritoneal, supervivencia, mortalidad, fallo de técnica, calidad de vida
Los procedimientos de tratamiento sustitutivo renal (TSR) con diálisis se han venido mostrando cada vez más eficaces a la hora de prolongar la vida de los pacientes con enfermedad renal crónica (ERC) y mantener, en la medida de lo posible, su salud general y estilo de vida. Para optimizar estos objetivos, es esencial una selección acertada de la técnica de diálisis más apropiada para cada paciente, y una planificación que incluya cambios de modalidad, si su conveniencia o sus necesidades cambian con el tiempo.
La decisión sobre modalidad de TSR es relativamente compleja, al estar influida por múltiples factores médicos y no médicos, y debe realizarse de manera reglada y en entorno multidisciplinar, con la participación del paciente y sus allegados. Aunque la comparación entre los resultados generales de la Hemodiálisis (HD) y la Diálisis Peritoneal (DP) no constituye un elemento determinante para un paciente concreto, su conocimiento puede resultar de ayuda en el proceso de toma de decisiones. En el presente capítulo se revisan los citados resultados, con especial atención a los tres marcadores pronósticos principales: mortalidad, fallo de la técnica y calidad de vida.
Supervivencia de los pacientes
Evitar la mortalidad es el principal objetivo de un tratamiento sustitutivo de la función de un órgano vital. Es evidente que el TSR es capaz de impedir el fallecimiento en uremia de los pacientes renales. Sin embargo, las tasas de mortalidad, sobre todo cardiovascular CV, de la población en diálisis exceden en mucho a las de la población general [1]. La expectativa de supervivencia de estos pacientes está muy condicionada por factores preexistentes. Mayor edad, presencia de diabetes e historial de eventos clínicos explican por sí solos la mayoría del riesgo de mortalidad en un paciente que inicia diálisis. Por otra parte, un gran número de factores, generales o asociados a la propia enfermedad renal crónica (ERC) y su tratamiento, muchos de ellos modificables, pueden influir en el patrón de riesgo de estos pacientes. No es objetivo de este capítulo revisarlos en profundidad, pero la intervención sistemática sobre algunos de ellos ha sido capaz de modificar el pronóstico vital en las últimas décadas, tanto en pacientes tratados con HD como con DP.
A lo largo del último cuarto de siglo, múltiples estudios han intentado comparar los resultados de la DP y HD en términos de supervivencia de los pacientes. Aunque es obvio que un ensayo aleatorizado constituiría la mejor forma de aproximación al problema, solo un estudio con este diseño, llevado adelante por el grupo NECOSAD [2], ha conseguido publicar sus resultados, aunque éstos no fueran significativos, por haber aceptado la aleatorización una ínfima fracción de los pacientes elegibles. La principal información disponible sobre la cuestión procede de estudios observacionales multicéntricos, siendo especialmente relevantes los de registros nacionales e internacionales, por su mayor potencia estadística.
Mortalidad comparada DP-HD en estudios más antiguos
El análisis de la supervivencia comparada en DP y HD puede fraccionarse en dos períodos. El primero incluye estudios sobre poblaciones de pacientes que iniciaron diálisis en los años 90, muchos de ellos publicados en los primeros años de este siglo. Disponemos de un excelente análisis-resumen de estos estudios, presentado por Vonesh et al [3]. La mayoría de los estudios analizados en esta revisión procedían de registros de países o áreas desarrolladas (Europa, Norteamérica y Australia-Nueva Zelanda). Un primer aspecto importante es que los resultados comparados mostraban variaciones significativas, lo que puede sugerir diferencias en las poblaciones de origen, metodologías dispares, diferencias de calidad en los registros y/o diferencias en la calidad de la HD y la DP proporcionada en diferentes partes del mundo desarrollado. El análisis conjunto de la información indicaba [3]:
- Relación dependiente de tiempo en la mortalidad comparada DP-HD, con ventaja para la DP en los primeros 12-24 meses de tratamiento, con posterior inversión progresiva de la razón de riesgos, en favor de la HD.
- Similar supervivencia global bajo ambas modalidades, cuando los itinerarios de seguimiento se analizaban en su conjunto.
- Necesidad de estratificar la población para poder establecer comparaciones más consistentes entre diferentes estudios. Así, el análisis sugería resultados más favorables a la DP en pacientes más jóvenes, no diabéticos y con menos comorbilidad CV de base. En cambio, los resultados eran más heterogéneos en pacientes mayores de 65 años y diabéticos, con una mayoría de estudios, muy prominentemente los procedentes de EE.UU. [4], sugiriendo resultados superiores en HD, y una minoría (sobre todo de Europa), resultados globalmente similares.
Algunos estudios de registro procedentes de EE.UU., han incidido en la noción de que la HD pude proporcionar mejor supervivencia que la DP en pacientes con alto riesgo CV, incluyendo aquéllos con antecedentes de insuficiencia cardíaca [5] [6] y enfermedad coronaria [7].
Mortalidad comparada DP-HD en estudios más recientes
Como ya se ha comentado, la mayor parte de los datos anteriormente mencionados proceden de poblaciones incidentes en diálisis, única o principalmente, en los años 90. Además, el uso de información procedente de registros permite una gran potencia estadística, pero también ajustes poblacionales relativamente pobres, por limitaciones en el número de covariables disponibles. Dadas las grandes diferencias entre las poblaciones tratadas con DP y HD, no es de extrañar que la validez de estos resultados haya sido cuestionada, hasta el punto de ponerse en duda la viabilidad global de comparar la mortalidad bajo ambas terapias [8] [9]. Sin embargo, en la última década ha surgido una nueva generación de análisis, justificados por dos premisas:
- El pronóstico de DP y HD podría haber cambiado desde los años 90, y no de manera paralela en ambas técnicas.
- Aunque no existe una posibilidad real de generar grandes ensayos aleatorizados, sí que existen métodos y estrategias de análisis que pueden hacer más comparables ambas poblaciones (seudoaleatorización).
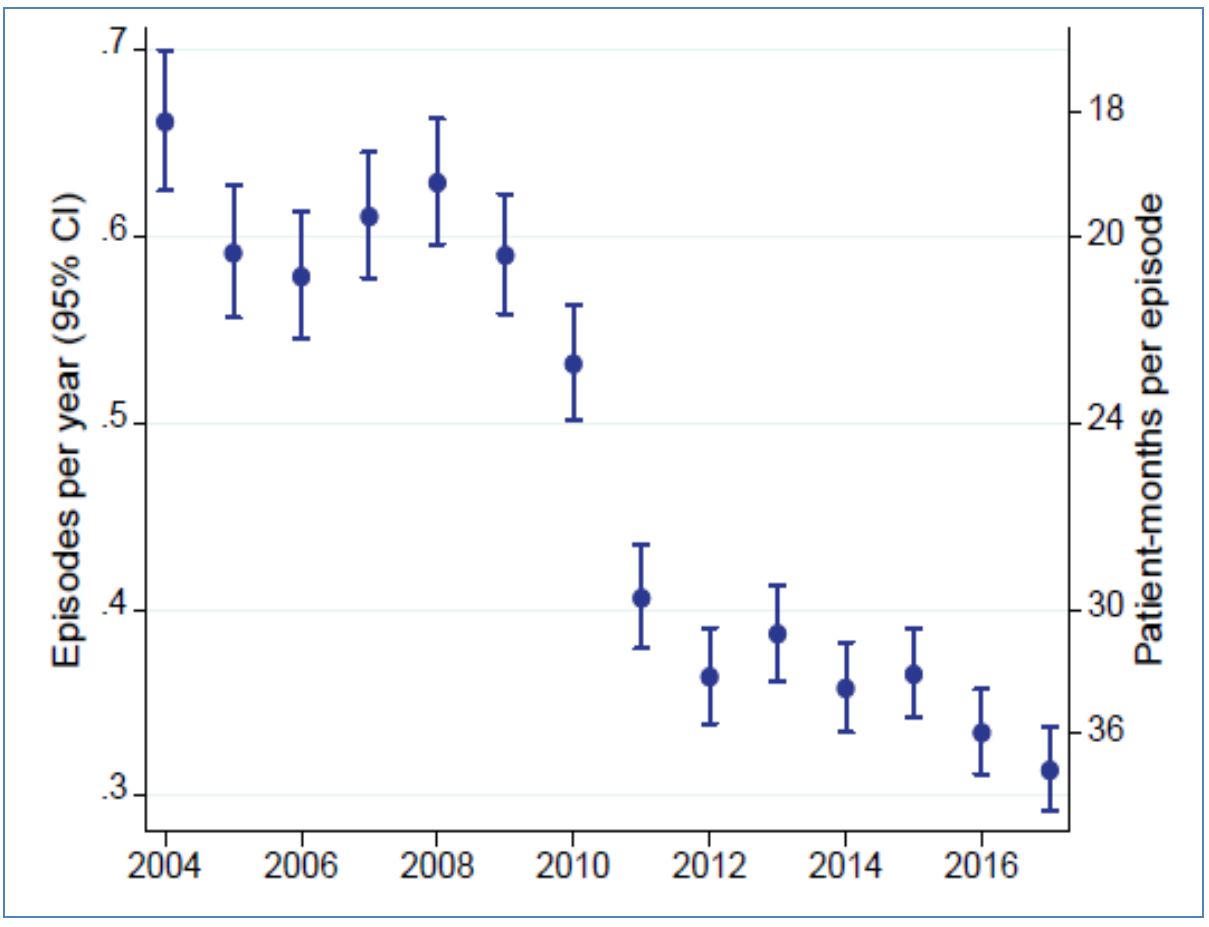
La supervivencia de los pacientes en diálisis parece haber ido aumentando a lo largo de las dos últimas décadas, a pesar de un incremento en la edad y comorbilidad medias de los pacientes, en el mismo período [10]. Por otra parte, existen importantes indicios de que los resultados de la DP han mostrado una tendencia particularmente positiva en este aspecto [11[ [12] (Figura 1), mejorando en mayor grado que los de la HD [13] [14] [15] [16], lo que ha alterado la relación de riesgos entre ambas técnicas. Por ejemplo, los datos del registro danés [14] muestran que, para pacientes incidentes en diálisis en los años 90, el período de ventaja en supervivencia de la DP sobre la HD se mantenía poco más de un año y medio en diabéticos y menos de tres años en no diabéticos, mientras que, para incidentes en la década siguiente, el citado período se alargaba a casi tres años para diabéticos, y casi cinco años para no diabéticos (Figura 2). En el Registro Europeo, el punto de inflexión en la supervivencia relativa DP/HD pasó de menos de tres años para pacientes incidentes a mediados de los 90 a cinco años para los incidentes una década después [16].
La última década ha contemplado la aparición de una serie de estudios observacionales destinados a comparar la supervivencia en DP y HD en contextos más equiparables. Para ello, se han utilizado dos tipos de estrategia:
1) Ajustes metodológicos más eficientes que tengan en cuenta, por ejemplo, la diferente probabilidad de que un paciente opte por DP o HD, con el riesgo asociado de que los que opten por una técnica sean de mayor riesgo que los que opten por la otra. Esta estrategia fue utilizada por Mehrotra et al [13], aplicando un modelo marginal estructural complejo a datos de registro de EE.UU. Su análisis confirmó la ya citada mejoría en la supervivencia relativa DP/HD, con resultados globales similares para ambas técnicas en el último período de inicio de TSR analizado (2002-2004). También se confirmaba que los resultados eran mejores para la DP en pacientes menores de 65 años, no diabéticos ni comórbidos, y mejores para la HD en ancianos, diabéticos y comórbidos, aunque con diferencias menos marcadas que en estudios más antiguos del mismo origen [4]. Hay que destacar que los datos del Registro EE.UU. se recogen a partir del día 90º en TSR, lo que excluye para análisis los casos de fallecimiento precoz (más frecuente en HD, al menos en el entorno de EE.UU.). Un análisis del Registro Europeo publicado el mismo año [17] desveló, como punto de partida, claros sesgos de selección, con menor asignación a DP de pacientes ancianos y comórbidos. Tras realizar ajustes para estos sesgos, la DP todavía ofrecía cierta ventaja en supervivencia global. Curiosamente, esta ventaja se mantenía en varones diabéticos, mientras que las mujeres diabéticas (sobre todo las más ancianas) mostraban mayores tasas de mortalidad en DP. En 2013, Lukowsky et al [18], analizando datos de un registro parcial de EE.UU., y usando también un modelo marginal estructural, observaron mayor nivel de salud en los pacientes que iniciaban DP. El consiguiente análisis ajustado mostró menor mortalidad en DP durante los dos primeros años de TSR, independientemente de los cambios de modalidad y de la presencia de diabetes. Al igual que en estudios previos, la ventaja aparente de la DP se difuminaba progresivamente a partir del tercer año de seguimiento.
2) Analizar subgrupos de población en TSR comparables, para evitar sesgos asociados a la asignación de modalidad de diálisis. Por ejemplo, los pacientes que inician TSR con HD lo hacen de manera no programada y sin acceso permanente para diálisis con mayor frecuencia que los que inician con DP, y esto tiene un impacto potencial sobre la mortalidad, que no puede ser atribuido a la técnica de diálisis, sino al tipo de paciente y sus circunstancias de inicio de TSR. Esta estrategia se puede materializar mediante los modelos de escalas de propensión, que generan muestras comparables en cuanto a la probabilidad de ser asignados a TSR con HD o DP. Utilizando esta estrategia sobre datos de Registro de EE.UU., Weinhandl et al [19] observaron tasas globales de mortalidad un 8% más bajas en pacientes que inician DP, aunque esta ventaja no persistía para pacientes en seguimiento a más largo plazo, y no se observaba en pacientes ancianos, diabéticos o comórbidos. Basándose en la misma estrategia, y usando datos de pacientes que iniciaron diálisis después de 2001 en el Registro Kaiser Permanente, Kumar et al [20] constataron una clara ventaja para la DP en los tres primeros años de tratamiento (Figura 6). Por otra parte, y utilizando otra forma de aproximación, Perl et al [21] mostraron que la relación de riesgo HD-DP se invierte según el acceso vascular de inicio sea temporal o permanente (Figura 4). Quinn et al [22], también sobre datos del Registro Canadiense, mostraron que, cuando se comparan solo pacientes con al menos 4 meses de cuidados prediálisis y que inician TSR de manera programada, la supervivencia en DP y HD es muy similar. Una vez más, los resultados de este estudio sugerían que la presencia de diabetes modifica la relación de riesgo en favor de la HD. Un estudio más reciente de la misma área [23], que comparaba pacientes tratados con DP y HD que fueran elegibles para ambas técnicas, proporcionó resultados similares. Por el contrario, un reciente reporte del registro REIN (Francia), que excluía del análisis los pacientes que iniciaron TSR en contexto de urgencia, mostró un riesgo de mortalidad entre un 18 y un 33% (dependiendo de la técnica de análisis estadístico) más bajo en pacientes tratados con HD que con DP [24].
Usando una estrategia diferente, dos estudios recientes han comparado los resultados, en términos de mortalidad, de la DP y la HD domiciliaria (HDD). Un análisis del registro de Australia y Nueva Zelanda comparó el pronóstico de una población de 10.710 pacientes en DP y 706 pacientes en HDD, valiéndose de varios modelos, incluyendo los de escalas de propensión [25]. Independientemente de la metodología de análisis, la HDD asociaba mejores tasas de supervivencia que la DP. El efecto se mantenía para diferentes grupos de edad, raza, diabetes y tiempo de seguimiento. Más recientemente, Weinhandl et al [26] compararon el pronóstico de dos muestras pareadas de 4201 pacientes tratados con DP o HDD diaria. Los resultados globales fueron similares a los descritos por Nadeau et al [25] pero, notablemente, cuando solo se consideraban pacientes incidentes en diálisis, los resultados de ambas técnicas eran muy similares, en términos de mortalidad (Figura 7).
Valoración global de la mortalidad comparada DP-HD
De lo anteriormente expuesto no se puede deducir que una modalidad de TSR sea superior a la otra en términos de supervivencia, pero sí hay algunos puntos que vienen mostrando notable consistencia:
1) Es clara la dependencia del tiempo de la relación de riesgo entre DP y HD. La DP proporciona mejor supervivencia en los primeros años de TSR que la HD. Con el tiempo, esta ventaja desaparece, e incluso se invierte. Las razones para el declive tardío de los resultados de la DP no están claras, pero, probablemente, deberían buscarse en dos circunstancias:
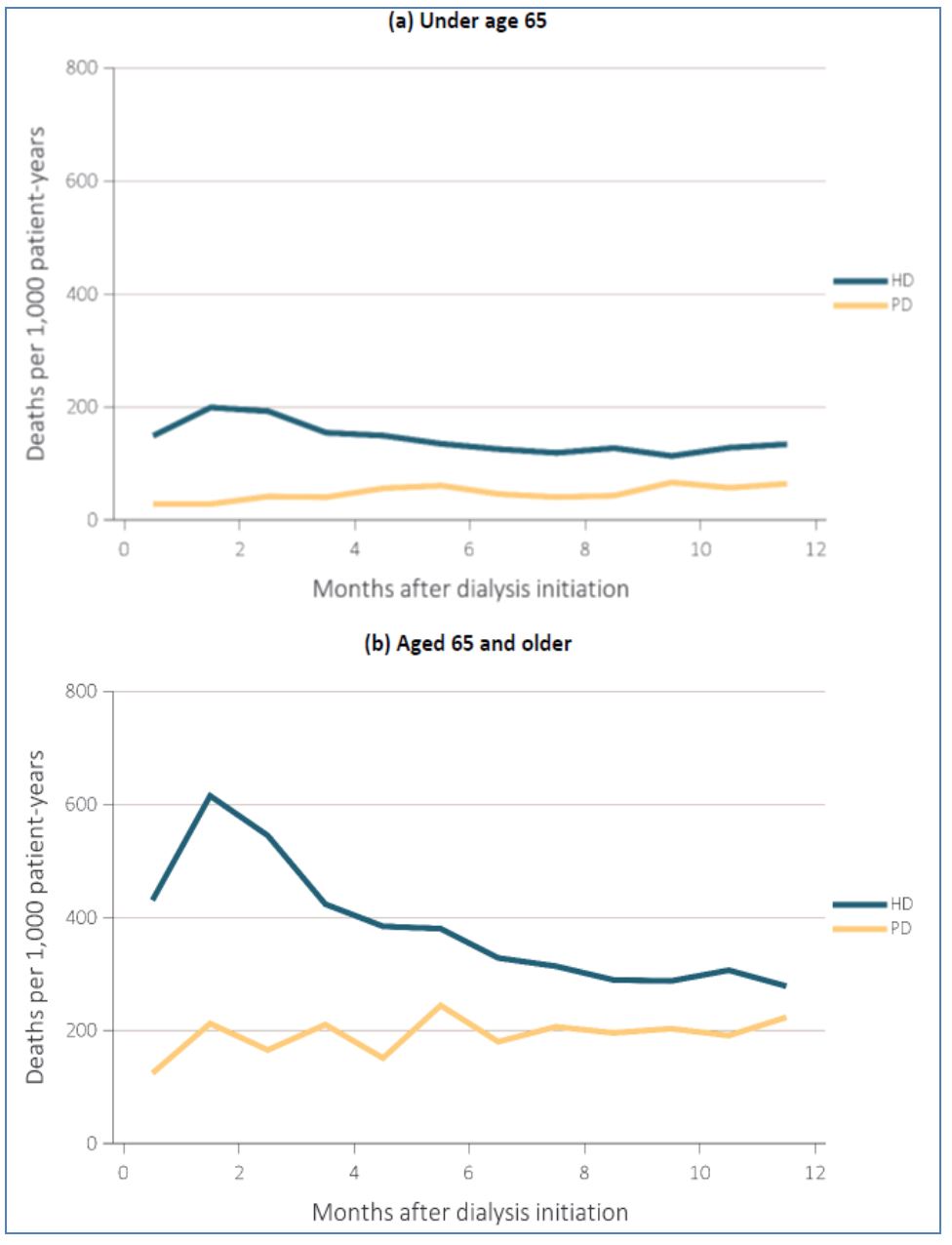
a. Los primeros meses de tratamiento con HD asocian una alta mortalidad, en gran medida relacionada con condiciones subóptimas de inicio. Este fenómeno no se produce (o lo hace en menor grado) en DP, una técnica que suele iniciarse de manera programada. (Figura 8).
b. La pérdida progresiva de la función renal residual y de la capacidad de ultrafiltración pone en marcha una secuencia fisiopatológica que multiplica el riesgo tardío de mortalidad CV en DP [27](Figura 9). Esta secuencia no se produce o, al menos, no es aparentemente tan nociva, en pacientes tratados con HD.
2) Otro hecho que parece claro es que, si bien todas las modalidades de TSR van mejorando sus resultados, la DP ha avanzado más que la HD, en las dos últimas décadas. La consecuencia es que el período de ventaja de la DP sobre la HD ha pasado en ese período de menos de dos años a más de cuatro. En pacientes incidentes, la DP proporciona actualmente resultados que resisten incluso la comparación con la HDD frecuente.
3) Las diferencias en resultados de supervivencia en DP y HD no son transversales. La DP parece ofrecer su mayor rendimiento en pacientes de menor edad, no diabéticos ni comórbidos. En cambio, en los pacientes mayores de 65 años, diabéticos y con comorbilidad CV los resultados son más similares, o incluso muestran cierta ventaja de supervivencia en HD, aunque esta diferencia es menos aparente en los estudios más recientes.
4) A la hora de valorar los resultados de un estudio concreto, es esencial tener en cuenta su ámbito de procedencia. Por ejemplo, los estudios procedentes de EE.UU. suelen ser más favorables a la HD, y los europeos a menudo lo son a la DP. También hay que considerar los criterios de reclutamiento y análisis aplicados, que pueden influir mucho en los resultados obtenidos.
La relación dependiente de tiempo entre la supervivencia en DP y HD constituye la base principal de las estrategia de tratamiento integrado de la ERC [28] y otras relacionadas (DP primero, DP preferente, DP como puente al trasplante). Parece lógico planificar el tratamiento empezando por DP y pasado el tiempo, si no se ha podido acceder a un trasplante, considerar una transferencia planificada a HD (incluyendo HDD) si las circunstancias (pérdida de función renal residual, fallo de ultrafiltración, inadecuación de DP) lo hacen conveniente, para evitar la fase de mayor mortalidad tardía de la DP. Por el contrario, la DP tardía, emprendida después de un período en HD, parece asociar resultados claramente inferiores [28] [29].
Factores de riesgo de mortalidad relacionados con la DP
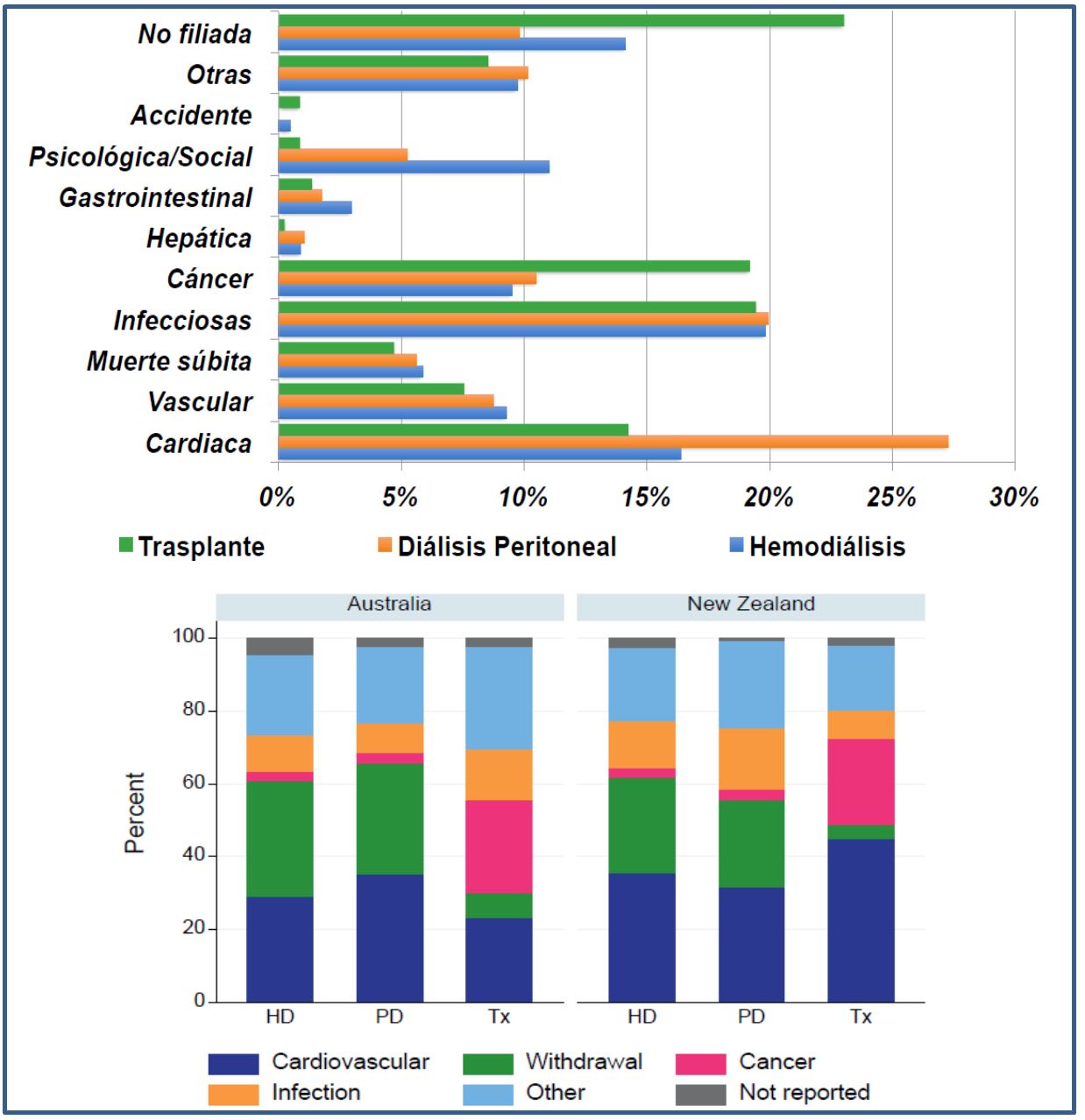
La enfermedad CV es la principal causa de mortalidad de los pacientes en DP en España, seguida por las infecciones ((Figura 10) superior) . En otros entornos, la enfermedad CV es también la causa principal, pero la distribución es más variable, dependiendo en parte de la calidad y codificación en la recogida de datos. En algunos países, la retirada de TSR constituye ya una causa muy prominente de mortalidad [30], mientras que las infecciones van perdiendo peso ((Figura 10) inferior). Es de destacar que el riesgo de mortalidad por abandono de TSR es hasta un 41% más bajo en pacientes en DP que en HD [30].
Aunque no es objetivo de esta revisión analizar la miríada de potenciales factores de riesgo de mortalidad descritos en pacientes en DP, conviene revisar brevemente el posible efecto de factores relacionados con la propia técnica sobre los resultados de la misma. Existe cierta controversia sobre la relación entre el transporte peritoneal de solutos y la supervivencia. El ya clásico metaanálisis de Brimble et al [31], que sugería un alto riesgo de mortalidad en los transportadores rápidos, fue muy criticado en su día por incluir pacientes prevalentes en el análisis, y sus datos podrían estar desfasados, tras los cambios en las dos últimas décadas. Un gran estudio de registro procedente de EE.UU. [32] ha sido incapaz de reproducir esta asociación en pacientes incidentes más recientes. El mismo estudio no detectó relación entre la capacidad de ultrafiltración (que se asocia, pero solo parcialmente, al tipo de transporte) y el pronóstico vital. En cambio, una baja ultrafiltración en el entorno clínico ha sido identificada como factor de riesgo de mortalidad por algunos [33] [34], pero no todos [35] los estudios. Por otra parte, existen pocas dudas sobre la escasa correlación entre depuración de moléculas pequeñas y pronóstico en DP. El estudio CANUSA [36] despertó importantes inquietudes en este aspecto, pero posteriores análisis [35] y dos ensayos aleatorizados [37] [38] mostraron que solo valores muy bajos (menos de 1,7) de Kt/V de urea pueden conllevar un peor pronóstico. En cambio, existe más consenso sobre la relevancia pronóstica de la función renal residual al inicio de DP [39] y su ritmo de declive durante el seguimiento [40].
No existe evidencia de un beneficio claro de las soluciones de DP bajas en productos de degradación de la glucosa y tamponadas con bicarbonato sobre la supervivencia de los pacientes. Este beneficio ha sido objetivado por algunos estudios observacionales con datos de registro [41], pero no corroborado por ensayos aleatorizados [42] [43]. Algo parecido puede decirse de la icodextrina, con una limitada evidencia observacional a favor de un efecto beneficioso sobre la supervivencia de los pacientes [44] [45].
Una reciente revisión en profundidad de la literatura [46] ha sido incapaz de detectar un efecto diferencial claro sobre la supervivencia de los pacientes entre las modalidades manual y automatizada de DP, mientras que un estudio multicéntrico por escalas de propensión procedente de Brasil, sí detectó un riesgo de mortalidad un 44% más alto en pacientes en DP manual [47]. Esta relación podría no ser transversal, ya que la DP automatizada podría proporcionar ventajas a los transportadores rápidos [48].
Supervivencia de la técnica
¿Qué es el fallo de la técnica de DP?
La supervivencia de la técnica debería entenderse como la capacidad de retener al paciente en una modalidad de TSR sin que un problema relacionado con la misma obligue a buscar una terapia alternativa. El término no abarca, pues, cambios de modalidad con mejora evidente (trasplante renal), ni los debidos a decisiones personales o variaciones en las circunstancias del paciente que hacen más conveniente una modalidad alternativa. También es dudoso que se deban considerar como fallo de la técnica las transferencias programadas de modalidad que se produzcan en previsión de, pero no como consecuencia de complicaciones de la técnica (por ejemplo, algunos profesionales abogan por el paso sistemático a HD tras unos años en DP, para reducir el riesgo a largo plazo de peritonitis esclerosante). Estas circunstancias deben ser claramente diferenciadas, ya que el fallo de la técnica es una complicación indeseable, mientras que las transferencias de conveniencia o programadas deben ser entendidas como oportunidades de mejora y, por tanto, deseables (tratamiento integrado de la ERC). Por otra parte, es tradicional la controversia sobre si la mortalidad debe computarse como una forma de fallo de la técnica. Aunque en sentido estricto lo sea, los autores son de la opinión de que la mortalidad es un evento de distinta naturaleza y perfil que la transferencia obligada a HD. Ante cualquier análisis de supervivencia de la técnica de DP, lo primero que ha de comprobar el lector es cómo tratan los autores esta cuestión, ya que los resultados esperados pueden diferir notablemente. En conjunto, el enfoque clásico, que agrupaba el abandono de DP por cualquier motivo, precisa revisión. De hecho, se han creado grupos de trabajo con el fin de sistematizar más racionalmente los resultados del tratamiento con DP [49].
Visión general
Aún teniendo en cuenta los matices del párrafo anterior, el fallo de la técnica constituye el gran talón de Aquiles de la DP, en la actualidad. Entre un 13 y un 21% de los pacientes que inician DP han de ser transferidos a HD en el primer año, entre un 23 y un 37% en los dos primeros años, y más del 40% en los cinco primeros años [50] [51] [52] [53]. En los registros españoles, las tasas acumuladas de fallo de la técnica se sitúan entre el 8 y el 14% al año, entre el 15 y el 24% a los 2 años, y entre el 42 y el 55% a los 5 años [54]. En el entorno de Australia y Nueva Zelanda, la tasa media de esta complicación es del 22% por año [55]. Estas tasas no admiten comparación seria con la HD, mucho más consistente en este aspecto [16] [26]. Dos cuestiones relevantes agravan esta limitación de la DP:
1) El fallo de la técnica tiende a concentrarse en las fases precoces del tratamiento, lo que multiplica su impacto negativo [56]. En el entorno del Registro Francés, un 6,3% del total de pacientes que iniciaron DP hubieron de ser transferidos a HD en los primeros 6 meses [57] mientras que, en Ontario (Canadá), un 25,5% de los pacientes que hubieron de ser transferidos a HD lo fueron en los 6 primeros meses, y 43,5% en el primer año [51]. El grupo NECOSAD ha reportado resultados similares [50] (Figura 11).
2) A diferencia de la supervivencia de los pacientes, la supervivencia de la técnica muestra grandes dificultades para progresar. Aunque algunos estudios recientes [55] han mostrado alguna mejoría (un 8% para pacientes incidentes entre entre 2004 y 2014), la impresión dominante es de cierto estancamiento [11] [15] [16] (Figura 1) y (Figura 12). Esta percepción refleja una mejora insuficiente en las medidas de prevención de esta complicación.
Factores que condicionan el fallo de la técnica de DP
Los factores que condicionan el fallo de la técnica en DP se pueden clasificar como generales y específicos. Entre los primeros cabe destacar el problema que representa una adecuada selección de pacientes para la técnica (desarrollado en otro capítulo). Una mala identificación y categorización de las barreras para la DP tiene un indudable impacto negativo a la hora de mantener a los pacientes en la técnica [58]. Una adecuada información y educación prediálisis, con toma compartida de decisiones, debería tener un efecto positivo en los resultados de la DP, pero la evidencia al respecto es poco concluyente [59] aunque, en sentido contrario, el inicio no programado de DP asocia tasas relativamente elevadas de fallo de la técnica [60]. Esta aparente contradicción resalta, probablemente, las dificultades que conlleva predecir la trayectoria de un paciente determinado en DP. Otro factor general con aparente impacto en los resultados de la DP es el llamado efecto centro. Existe una amplia variabilidad en los resultados de centros de diferentes países e, incluso, dentro de áreas geográficas relativamente homogéneas [55] (Figura 13). Esta variabilidad tiene que ver con factores genéricos, como la propia experiencia de los centros, reflejada en el número de pacientes tratados [61] (Tabla 1), pero también con la implantación de procedimientos reglados orientados a prevenir y manejar los factores que conducen al fallo de la técnica [56] [57] [62]. El hecho de que el entorno Anzdata sea el único en el mundo desarrollado que ha mostrado cierta mejoría en la supervivencia de la técnica [55] se ha relacionado con la aplicación sistemática de estrategias de control continuo de la calidad.
Otra forma de abordar el fallo de la técnica [s por causas específicas. Éstas se pueden clasificar en cinco tipos básicos:
1) Infecciones peritoneales. Tras una mejora radical en los primeros años 90, las tasas de infección peritoneal han seguido una tendencia descendente más lenta [52] [54]. Solamente en el ámbito Anzdata se ha registrado un fuerte descenso de incidencia en la última década (Figura 14), probablemente por las causas antes mencionadas. En consecuencia, las infecciones peritoneales siguen causando un 25-30% de los casos de fallo puro de la técnica [50] [54] [55] [63], y son responsables de más del 50% de los casos en algunos países [12]. Las medidas de prevención y manejo eficaz de las infecciones peritoneales se revisan en otro capítulo.
2) Inadecuación de DP. Aunque los registros multicéntricos citan a este factor como causa del 15-25% de los fallos de la técnica [55], la dosis de DP no parece influir directamente en esta complicación [64] [65]. Sin embargo, la evidente asociación entre función renal residual de inicio [64] y su ritmo de declive [40] [66] y la supervivencia de la técnica sugiere, en sentido contrario, la dependencia de la depuración renal para alcanzar una DP adecuada en una gran proporción de pacientes. La prevención del fallo de la técnica por inadecuación se basa en la preservación de la función renal residual y en alcanzar un equilibrio entre dosis suficientes de diálisis y pautas que permitan mantener el estilo de vida de los pacientes.
3) El fallo de membrana peritoneal se puede manifestar de diferentes maneras, pero la ultrafiltración insuficiente es el rasgo que con más frecuencia impacta en los resultados de la DP. Aunque existe una fracción de pacientes con ultrafiltración insuficiente desde el inicio de la terapia, este trastorno es reversible en la mayoría de los casos, y se produce en un entorno de función renal residual significativa, por lo que apenas afecta a los resultados clínicos [32] [67]. En cambio, el fallo adquirido de ultrafiltración tiende a ser progresivo, y genera tanto mortalidad como necesidad de transferencia a HD [31]. Sin embargo, su aparición es relativamente tardía y, por ello, tiene menos presencia en las tasas de fallo de la técnica (en torno al 5-6% de los casos), desde una perspectiva epidemiológica.
Como es de esperar, en pacientes anúricos la baja capacidad de ultrafiltración tiene un impacto más nítido en la supervivencia de la técnica [68]. Las medidas que mejoran la ultrafiltración en estos pacientes, como el uso de icodextrina, pueden prevenir el fallo de la técnica, como han mostrado estudios observacionales [44] y un pequeño ensayo aleatorizado [68]. En cambio, ni las soluciones biocompatibles [41] [42] ni la DP automatizada [48] [63] [70] han mostrado efectos positivos, en este aspecto.
4) Las complicaciones técnicas y abdominales (esencialmente fugas de dializado, malfunción de catéter, hernias y cirugía abdominal) causan en torno al 15-20% de los fallos de la técnica [55] pero, dada su aparición relativamente precoz, tienen un gran impacto en los resultados. Así, en el registro Anzdata representan un 35% de los fallos de la técnica en el primer año (http://www.anzdata.org.au/anzdata/AnzdataReport/41streport/c05_peritoneal_2 017_v2.0_20190526.pdf). La prevención y manejo de estas complicaciones se tratan en otro capítulo.
5) Existe un quinto grupo, mal categorizado y definido, de causas de fallo de la técnica, que se designan de diferentes maneras: causas sociales, psicosociales, miscelánea, etc… Este grupo representa en torno a un 25% de los casos [63], y más del 50% en el caso de los registros españoles [54]. Al igual que las complicaciones técnicas, estos casos se tienden a agrupar en el primer año de tratamiento [50] [51] [57], lo que multiplica su influencia en los resultados de la DP y refleja, al menos parcialmente, errores en la selección de pacientes (mala identificación o categorización de barreras).
Fallo precoz de la técnica de DP
Como ya se ha mencionado, el fallo precoz de la técnica de DP constituye un problema de gran relevancia específica [56]. Es de resaltar que el espectro de causas de transferencia indeseada a HD varía con el tiempo de permanencia en DP [50] [51] [52] [57] [63] [71]. En general, las causas de fallo precoz de la técnica incluyen problemas técnicos (fugas, malfunción de catéter), complicaciones abdominales y las antes mencionadas razones psicosociales/misceláneas. Las infecciones peritoneales constituyen una amenaza permanente para la técnica, extendiéndose desde fases precoces y durante toda la evolución. En cambio, la inadecuación y la ultrafiltración insuficiente son menos habituales en los dos primeros años. Todas las causas de fallo precoz de la técnica tienen en común su carácter modificable o prevenible, es decir que actuaciones sistemáticas y organizadas sobre ellas tienen gran potencial de beneficio. Estas actuaciones son objeto de atención específica en otros capítulos.
Calidad de vida
La calidad de vida de un paciente en diálisis depende, sobre todo, de sus condiciones generales de salud (edad y comorbilidad). El efecto que la modalidad de TSR pueda tener sobre este parámetro está necesariamente sesgado, ya que, en teoría, cada paciente elegirá la que más conveniente le resulte. Una reciente revisión sistemática de estudios comparando la calidad de vida en DP y HD fue incapaz de detectar diferencias consistentes [72]. Otra revisión sistemática aún más reciente [73] tampoco observó diferencias claras en el grado de sobrecarga y calidad de vida de cuidadores de pacientes en DP y HD. El mismo problema metodológico se produce cuando se compara la calidad de vida en DP manual y automatizada aunque, en este caso, un estudio aleatorizado (ya algo antiguo) otorgó un mejor perfil general a la segunda [74]. Por otra parte, la función renal residual [63], pero no la depuración por DP [64] [75], se asocia con una mejor calidad de vida de los pacientes en DP.
Resultados generales de la DP en contextos específicos
En este apartado se mencionan, de manera muy esquemática, los resultados generales de la DP en algunos contextos específicos. No se analizan relaciones evidentes o ya comentadas (por ejemplo asociación de diabetes o edad con mortalidad en DP, o comparaciones de supervivencia de la técnica en DP y HD).
Inicio no programado
Un reciente metaanálisis [76] mostró tasas de mortalidad comparables en pacientes con inicio programado o urgente de DP. La incidencia global de complicaciones técnicas también fue similar, salvo por el caso de las fugas, que son claramente más frecuentes en pacientes con inicio urgente con DP. La revisión no abordaba el riesgo de fallo de la técnica, lo que sí hizo un análisis del Registro Francés de Diálisis Peritoneal, que mostró un riesgo de fallo de la técnica un 35% más alto en caso de inicio no programado, con similares tasas de mortalidad [60]. Los pacientes que inician HD o DP de manera no programada parecen presentar tasas similares de mortalidad [77].
DP tras el fallo del trasplante renal
Al comparar los resultados de la DP en pacientes tras fallo del trasplante renal con los incidentes primarios, el Registro Francés [78] ha detectado similar supervivencia de los pacientes, pero un riesgo un 62% más alto de fallo de la técnica y un mayor riesgo de peritonitis en el grupo postrasplante. En cambio, los datos de los Registros de EE.UU. [79] y Australia-Nueva Zelanda [80] indican similar supervivencia de pacientes y técnica. Hay que destacar que los pacientes que inician DP tras fallo del trasplante son más jóvenes y menos comórbidos que sus controles incidentes primarios. Por el contrario, el declive acelerado de la función renal residual al retirar la inmunosupresión podría representar un factor de riesgo en la DP postrasplante [81].
Al comparar los resultados de DP y HD tras el fallo del trasplante renal, los datos del Registro Canadiense [82] indican similar supervivencia de los pacientes, mientras que los resultados del Registro de EE.UU. [83] reproducen los resultados generales comparados DP/HD: menor mortalidad precoz y mayor mortalidad tardía en DP, y similar mortalidad global.
DP asistida
La mayor experiencia con DP asistida en pacientes frágiles y ancianos procede de Francia y Dinamarca. Una reciente publicación conjunta [84] indica que estos pacientes presentan una supervivencia similar de la técnica, con mejores resultados si la asistencia es proporcionada por personal sanitario que por allegados, y similares resultados obtenidos con DP manual y automatizada. Como es de esperar, la supervivencia de estos pacientes es inferior a la de los que son capaces de autocuidado.
DP en diabéticos
Ya se ha comentado anteriormente que la presencia de diabetes puede modificar el riesgo relativo de mortalidad DP/HD, a favor de la HD, sobre todo en pacientes de mayor edad y más comórbidos. Por otra parte, la información disponible sobre el riesgo comparado de fallo de la técnica en diabéticos versus no diabéticos en DP no es consistente, ya que algunos estudios detectan una mayor incidencia de esta complicación [51] [63], que no es observada por otros [16] [53] [59].
DP en ancianos
También se ha mencionado la mayor probabilidad de mortalidad en pacientes ancianos en DP que en HD, sobre todo en estudios procedentes de EE.UU. En relación al fallo de la técnica, la mayoría de los estudios indican un riesgo incrementado en ancianos [51] [52] [63] [85], aunque algunos autores no detectan diferencia con no ancianos [53]. Esta cuestión ha sido objeto de una revisión extensa reciente [86], que ha mostrado resultados poco concluyentes.
DP en pacientes con poliquistosis renal
Aunque algún estudio de registro ha mostrado peor supervivencia de la técnica de DP en pacientes poliquísticos [52], un metaanálisis reciente indica mejor supervivencia de los pacientes, tasas similares de peritonitis, similar supervivencia de la técnica y mayor incidencia de hernias (con un riesgo relativo de 2,28) en estos pacientes [87].
DP en pacientes obesos
Como probable consecuencia de un fenómeno de epidemiología inversa, la mortalidad es menor en pacientes obesos que en no obesos bajo cualquier modalidad de TSR [88], aunque la mortalidad tardía podría ser similar a la de los no obesos [89]. También se ha indicado que los pacientes con grados más severos de obesidad (índice de masa corporal >35) podrían no tener el citado beneficio de supervivencia [90]. Asimismo, se ha sugerido que los resultados podrían ser algo mejores en obesos en HD que en DP y que, de hecho, la obesidad abroga los beneficios precoces de supervivencia que la DP ofrece sobre la HD [91](Figura 15).
Los resultados de la DP al comparar la supervivencia de la técnica en obesos y no obesos son contradictorios. Algunos estudios no muestran diferencias [53] [63], mientras que otros muestran peores resultados en obesos [85] [90] [92]. Se ha sugerido que la inadecuación es una causa particularmente frecuente de fallo de la técnica en obesos, lo que podría tener relación con un declive relativamente acelerado de la función renal residual, en estos pacientes [90].
Mensajes clave
• Existen grandes dificultades metodológicas para comparar la mortalidad en pacientes tratados con DP y HD, siendo notable la ausencia de estudios aleatorizados al respecto.
• La mortalidad comparada DP-HD muestra importante variabilidad dependiendo, entre otros factores, del entorno geográfico y de la metodología de análisis
• El riesgo de mortalidad de los pacientes que inician DP o HD parece globalmente similar.
• La expectativa de supervivencia de los pacientes que inician diálisis parece haber mejorado significativamente en las dos últimas décadas, pero lo ha hecho aparentemente en mayor medida en los pacientes tratados con DP que en los tratados con HD.
• En pacientes incidentes en diálisis, la DP proporciona una ventaja inicial en la expectativa de supervivencia respecto a la HD. A partir del 3º a 5º año de tratamiento (según estudios y subgrupos de población) esta diferencia se va difuminando, para acabar haciéndose favorable a largo plazo a la HD.
• La DP parece ofrecer sus mejores resultados, en términos de riesgo de mortalidad, en pacientes jóvenes no comórbidos, mientras que la HD ofrece resultados similares o algo superiores a la DP en ancianos, diabéticos y/o comórbidos.
• La supervivencia de la técnica constituye, actualmente, el principal punto débil en la práctica de la DP, siendo claramente inferior a la proporcionada por la HD.
• La incidencia de fallo de la técnica de DP muestra una tendencia en el tiempo menos favorable que la observada para la mortalidad de los pacientes tratados con este modalidad de TSR
• El fallo de la técnica tiene su mayor incidencia en el primer año de tratamiento, lo que multiplica su impacto en los resultados generales de la DP
• Las estrategias sistemáticas orientadas a mejorar la calidad global tienen un gran potencial de impacto positivo sobre la supervivencia de la técnica de DP
• La calidad de vida en DP y HD depende más de las condiciones generales de salud de los pacientes que de la técnica de diálisis. Cuando la selección de modalidad se hace de manera correcta, la modalidad elegida será, previsiblemente, la que aporte más calidad de vida.
Tablas
Figuras
![Figura 2. . Evolución temporal de la relación de riesgo de mortalidad DP/Hemodiálisis en pacientes diabéticos (DM) y no diabéticos Non DM) en el Registro danés [14] Figura 2. . Evolución temporal de la relación de riesgo de mortalidad DP/Hemodiálisis en pacientes diabéticos (DM) y no diabéticos Non DM) en el Registro danés [14]](https://static.elsevier.es/nefro/monografias/1/228/1238.jpg)
![Figura 4. Supervivencia comparada HD/DP según acceso vascular de inicio (catéter venoso central HD-CVC o acceso interno nativo o protésico HD-AVF/AVG). Registro Canadiense [21] Figura 4. Supervivencia comparada HD/DP según acceso vascular de inicio (catéter venoso central HD-CVC o acceso interno nativo o protésico HD-AVF/AVG). Registro Canadiense [21]](https://static.elsevier.es/nefro/monografias/1/228/1240.jpg)
![Figura 5. . Supervivencia comparada en hemodiálisis y DP. Análisis mediante escalas de propensión. Registro EE.EUU. [19] Figura 5. . Supervivencia comparada en hemodiálisis y DP. Análisis mediante escalas de propensión. Registro EE.EUU. [19]](https://static.elsevier.es/nefro/monografias/1/228/1241.jpg)
![Figura 12. Evolución temporal de mortalidad, fallo de la técnica y trasplante renal en pacientes tratados con DP en el Registro Europeo [16] Figura 12. Evolución temporal de mortalidad, fallo de la técnica y trasplante renal en pacientes tratados con DP en el Registro Europeo [16]](https://static.elsevier.es/nefro/monografias/1/228/1248.jpg)
![Figura 3. Supervivencia comparada ajustada de pacientes en DP y hemodiálisis en Europa en diferentes períodos temporales. [16] Figura 3. Supervivencia comparada ajustada de pacientes en DP y hemodiálisis en Europa en diferentes períodos temporales. [16]](https://static.elsevier.es/nefro/monografias/1/228/1239.jpg)

![Figura 13. Variabilidad en la supervivencia de la técnica en diferentes centros del Registro de Australia y Nueva Zelanda. Rombos verdes: Resultados no ajustados; Triángulos rojos: Resultados ajustados para pacientes; Círculos azules: Resultados ajustados para centro [55] Figura 13. Variabilidad en la supervivencia de la técnica en diferentes centros del Registro de Australia y Nueva Zelanda. Rombos verdes: Resultados no ajustados; Triángulos rojos: Resultados ajustados para pacientes; Círculos azules: Resultados ajustados para centro [55]](https://static.elsevier.es/nefro/monografias/1/228/1249.jpg)
![Figura 6. . Relación ajustada de riesgo de mortalidad (CHR) en DP y HD en el registro Kaiser Permanente. Análisis mediante escalas de propensión. ITT: Intención de tratar [20] Figura 6. . Relación ajustada de riesgo de mortalidad (CHR) en DP y HD en el registro Kaiser Permanente. Análisis mediante escalas de propensión. ITT: Intención de tratar [20]](https://static.elsevier.es/nefro/monografias/1/228/1242.jpg)



![Tabla 1. Efecto de la actividad del centro (nº acumulado o medio de pacientes tratados) sobre la supervivencia de la técnica. Adaptado de Pieper et al [61] Tabla 1. Efecto de la actividad del centro (nº acumulado o medio de pacientes tratados) sobre la supervivencia de la técnica. Adaptado de Pieper et al [61]](https://static.elsevier.es/nefro/monografias/1/228/1236.jpg)
![Figura 11. Cronología del fallo de la técnica de DP y sus causas [50] Figura 11. Cronología del fallo de la técnica de DP y sus causas [50]](https://static.elsevier.es/nefro/monografias/1/228/1247.jpg)
![Figura 15. . Relación de riesgo de mortalidad DP/HD según índice de masa corporal [90] Figura 15. . Relación de riesgo de mortalidad DP/HD según índice de masa corporal [90]](https://static.elsevier.es/nefro/monografias/1/228/1251.jpg)
![Figura 7. Mortalidad comparada de pacientes tratados con HDD diaria (DHHD) y DP (PD). A) y B) Análisis por intención de tratar; C) y D) Análisis según tratamiento. A) y C) Todos los pacientes. B) y D) Pacientes incidentes [26] Figura 7. Mortalidad comparada de pacientes tratados con HDD diaria (DHHD) y DP (PD). A) y B) Análisis por intención de tratar; C) y D) Análisis según tratamiento. A) y C) Todos los pacientes. B) y D) Pacientes incidentes [26]](https://static.elsevier.es/nefro/monografias/1/228/1243.jpg)
![Figura 1. Evolución temporal de las tasas de mortalidad, fallo de la técnica y trasplante renal en pacientes del Registro Canadiense [11] Figura 1. Evolución temporal de las tasas de mortalidad, fallo de la técnica y trasplante renal en pacientes del Registro Canadiense [11]](https://static.elsevier.es/nefro/monografias/1/228/1237.jpg)