Pautas de derivación a la Unidad de Enfermedad Renal Crónica Avanzada (ERCA)
INTRODUCCIÓN
La ERC avanzada (ERCA; grados 4 y 5) es un problema sanitario grave [1]. La detección precoz y la remisión adecuada a Nefrología de los pacientes con ERC mejora la morbilidad y supervivencia a largo plazo y disminuye los costes tanto para el paciente como para el sistema sanitario [2] [3] [4] [5] [6]. Por ello, en España se impulsó la creación de las unidades o consultas de ERCA, consultas multidisciplinares de cuidado integral de los pacientes, en las que informa al paciente y a su entorno sobre cómo transcurre la enfermedad y las diferentes opciones de tratamiento para mejorar el proceso de toma de decisiones [6].
Respecto al documento de 2019 [7], en 2023 se publicó un borrador de actualización de las guías de práctica clínica KDIGO (Kidney Disease Improving Global Outcomes) [8], así como un informe elaborado por diez sociedades científicas españolas [9]. Ambos textos revisan y ponen al día conceptos, criterios diagnósticos y nuevas opciones terapéuticas (tanto de fármacos como terapias que hacen hincapié en la dieta). Entre otras cuestiones, se enfatiza la importancia de evaluar la causa de la enfermedad puesto que tiene implicaciones en un pronóstico variable en el paciente y en la elección de tratamiento.
En conjunto, se recomienda que exista una atención cada vez más individualizada al paciente con ERCA. Su implicación y participación en el proceso de toma de decisiones y la definición de sus objetivos de salud es cada vez más reconocida. Tanto es así que el Consorcio Internacional para la Medición de Resultados de Salud (ICHOM, por sus siglas en inglés) reunió a un grupo de trabajo internacional de profesionales de la salud y representantes de pacientes para desarrollar un conjunto mínimo estandarizado de resultados centrados en el paciente [10].
Los pacientes que inician diálisis de manera urgente, sin acceso vascular o sin un seguimiento adecuado tienen un peor pronóstico, mayor morbilidad y menor supervivencia. Al igual que aquellos que vuelven a reiniciar tratamiento renal sustitutivo (TRS) desde un trasplante renal (TxR) no funcionante después de un tiempo. Por esta razón, además de la incorporación del paciente en la toma de decisiones que afecten a su salud, se ha de planificar y organizar su paso por cada etapa de la ERC.
En este capítulo se abordarán aspectos como:
1.- Criterios de derivación al programa de ERCA, objetivos y el equipo humano que debe constituir.
2.- Proceso de toma de decisiones compartida de la modalidad de tratamiento renal sustitutivo (TRS).
3.- Criterios para el inicio de diálisis.
4.- Criterios para realización del acceso vascular.
5.- Valoración psicológica.
6.- Valoración socioeconómica.
7.- Pacientes mentores.
1.- CRITERIOS DE DERIVACIÓN A LA UNIDAD DE ERCA, OBJETIVOS Y COMPOSICIÓN INTERDISCIPLINAR
1.1.- Criterios de derivación a la unidad de ERCA
La derivación de pacientes a la unidad de ERCA puede proceder de las consultas de nefrología clínica, trasplante renal o de la planta de hospitalización, tras constatar la no recuperación de la función renal. En algunos centros, también directamente a través del médico de atención primaria, que detecta el problema.
Deberán ser remitidos a la consulta ERCA pacientes con insuficiencia renal y filtrado glomerular (FG) por debajo de 25 ml/min en al menos 2 determinaciones. Esto es una aproximación en función de la edad, comorbilidad, estabilidad funcional y magnitud de la proteinuria entre otras variables. En general, el tiempo ideal de derivación a la consulta de ERCA debería ser antes de los 6 meses del inicio estimado en TRS [9].
Los pacientes que hayan iniciado el TRS de forma no programada deben ser derivados al proceso de información, deliberación y elección de técnica antes de cumplir el primer mes de inicio de tratamiento, con el fin de darle la opción de una elección meditada de la técnica de TRS que desea y que mejor se ajusta a sus condiciones. Por ejemplo, los pacientes trasplantados renales tienen una progresión del FG más lenta y, por ello, se deberían derivar con FG inferiores.
Una estrategia interesante es que la primera cita en la consulta de ERCA se inicie por el proceso de información, deliberación y opciones de técnica de TRS, utilizando el procedimiento de toma de decisiones compartida [11].
1.2.- Objetivos de la unidad de ERCA
El objetivo principal de la unidad de ERCA es proporcionar un cuidado integral del paciente. En dicho cuidado se debe contemplar:
- Asistencia, con actuaciones centradas en retrasar la progresión de la ERC, prevenir y tratar sus complicaciones (anemia, trastornos del metabolismo mineral óseo, malnutrición, trastornos hidroelectrolíticos, etc.), modificar o tratar las comorbilidades o factores de riesgo asociados (hipertensión arterial, dislipemia, tabaquismo, obesidad, etc.) y coordinarse con la Unidad de Cuidados Paliativos, dependiente de Atención Primaria, en el caso de que el paciente requiera sólo tratamiento conservador (TC).
- Información al paciente e inclusión de este en un programa de formación o educación progresiva en autocuidados. Información sobre la ERC, así como sus posibilidades de tratamiento para una elección independiente y preparación para inicio de TRS (vacunación, acceso vascular, etc.).
- Análisis de calidad asistencial, mediante el seguimiento de marcadores de calidad asistencial directos por los resultados de salud obtenidos (indicadores bioquímicos de morbimortalidad, inicio programado de diálisis, etc.), calidad de vida y satisfacción.
Con todo ello se pretende:
- Conservar la función renal el mayor tiempo posible, en un intento de retrasar la progresión de la enfermedad y disminuir su velocidad.
- Conseguir una mejor preparación del entorno y del paciente para el TxR, los tratamientos domiciliarios o para la elección del TC.
- Una reducción de los pacientes con entrada no programada en diálisis y de sus consecuencias.
- Desarrollo de acciones encaminadas a disminuir la comorbilidad asociada, sobre todo la cardiovascular.
- Disminuir la mortalidad de los primeros meses tras el inicio de TSR.
- Disminuir las estancias hospitalarias y los costes generales asociados a la ERC.
- Optimizar la calidad de vida del paciente en el periodo pre-TRS.
- Formación progresiva sobre las dietas más adecuadas en cada caso.
1.3.- El modelo de Acreditación de Calidad de las Unidades ERCA (ACERCA)
En 2020, el grupo de trabajo ERCA de la Sociedad Española de Nefrología (SEN) desarrolló un proyecto de estándares de calidad para mejorar la atención de los pacientes y el funcionamiento de las unidades ERCA [12]. Se trata de un documento pionero sobre los estándares para la Acreditación de Calidad de las Unidades ERCA (ACERCA) [11] en el que se evalúa su excelencia.
En total, el manual de ACERCA cuenta con 66 estándares, divididos en obligatorios y recomendables, agrupados en cinco bloques, según la temática:
- Requisitos generales de la unidad ERCA.
- Recursos materiales y humanos.
- Procesos.
- Derechos y seguridad de los pacientes.
- Resultados.
En función del cumplimiento de los parámetros se establecen cuatro niveles de acreditación, de básico a excelente. Entre otras cuestiones, los estándares promueven la atención basada en la multidisciplinariedad, el uso de escalas validadas para la medición de parámetros de la ERC (fragilidad, dependencia, comorbilidad, función cognitiva, estado nutricional, etc.), la disponibilidad de materiales para la formación de los pacientes y su entorno familiar. Todo ello, de cara a asegurar una transición óptima de los enfermos al TRS (tanto para los que lo inician de manera programada como para los que no), al TxR o al TC.
1.4.- Composición del equipo interdisciplinar
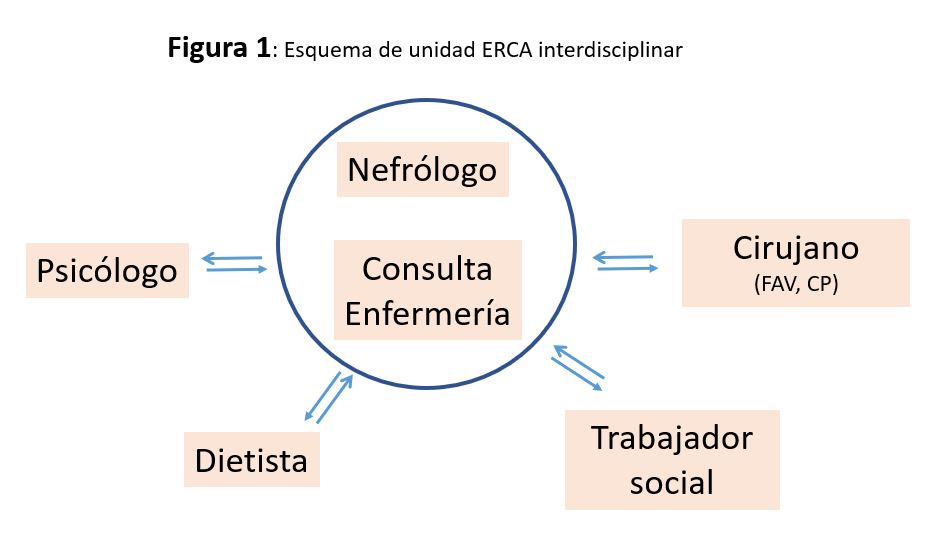
La unidad interdisciplinar de ERCA debería incluir en lo posible: nefrólogo/a, enfermero/a referente, nutricionista o dietista, psicólogo/a, trabajador/a social, fisioterapeuta, farmacéutico/a y cirujano/a vascular o general, entre otros (Figura 1). Todos ellos profesionales especializados en ERCA. Este equipo es el que inicia un proceso de información y formación del paciente y de su entorno familiar, con la finalidad de implicarlos tanto en su enfermedad como en la elección de las diferentes opciones de TRS. Además, de forma paralela, pueden participar pacientes mentores, cuidadores, gestores de casos y las asociaciones de enfermos renales, que ofrecen soporte a muchos niveles.
Un programa de atención interdisciplinar para estos pacientes puede mejorar su conocimiento sobre la enfermedad, aumentar su interés en las terapias de diálisis domiciliarias, diálisis peritoneal, el trasplante anticipado e incluir el tratamiento conservador como opción [13]. Asimismo, debe hacerse mediante planes de detección temprana en la población en riesgo lo que implica una estrecha coordinación con atención primaria [14] [15] [16] [17].
Los profesionales de atención primaria tienen un papel esencial en colaboración con nefrología para la detección precoz de la ERCA, pero también para el seguimiento (controles periódicos de peso, de presión arterial, de anemia o de diabetes, así como revisiones de la medicación y la dieta). Es importante que se les forme en el abordaje de la enfermedad renal, ya que se trata de una patología infradiagnosticada e infratratada, lo que resulta especialmente preocupante en los grupos de riesgo [18] [19].
2.- PROCESO DE TOMA DE DECISIONES COMPARTIDAS
Las modalidades de TRS incluyen: trasplante renal (TxR) en sus modalidades, Técnicas domiciliarias (HD domiciliaria (HDD), diálisis peritoneal (DP) en sus modalidades), HD en centros satélites (extrahospitalaria), hemodiálisis (HD) en hospital y tratamiento conservador (TC).
2.1.- Test de elegibilidad o factores que influyen en la elegibilidad de la técnica
Previamente al proceso de información, deliberación y elección de técnica se realizará una prueba de elegibilidad para valorar las contraindicaciones médicas, sociales (tales como vivienda, barrera idiomática, etc.), absolutas y relativas para cada una de las modalidades de TRS.
Trasplante renal
El TxR, tanto de vivo como de donante fallecido, ofrece mayor esperanza y calidad de vida [20], con lo que debería de considerarse en todos los pacientes con ERCA que puedan ser candidatos. En la actualidad, existen muy pocas contraindicaciones absolutas para que un paciente no pueda ser incluido en lista de espera, por lo que el TxR anticipado debe ser ofrecido a todos aquellos que cumplan criterios. También se debe evaluar a posibles candidatos a doble Tx (riñón-páncreas o riñón-hígado) y su derivación a los hospitales de referencia, si fuese el caso. Todo candidato a TxR anticipado [20] debería ser enviado para estudio de inclusión en lista de espera cuando su FG sea < 20 ml/min, una vez explorada la posibilidad de TX de donante vivo.
Hemodiálisis domiciliaria
A pesar de que permite una vida más autónoma de los pacientes, es una alternativa que no acaba de extenderse lo suficiente [21]. Los últimos datos indican que la realiza alrededor del 5,2 % de los pacientes [22]. Se trata de una modalidad que presenta múltiples ventajas en términos de supervivencia, alternativas terapéuticas (regímenes de HD intensiva, HD nocturna, HD diaria corta) y ahorro de costes. La principal barrera para su expansión, además de la falta de financiación por parte de las autoridades sanitarias [23] tiene que ver con el paciente (falta de motivación o de voluntad para cambiar de modalidad, prejuicios, miedo a la autopunción) [24] [25] [26]. A esto debemos añadir la elevada tasa de abandonos por razones sociales o recursos inadecuados (50 %) [27]. Las técnicas domiciliarias (tanto HD, como DP) requieren estrategias para superar las barreras actuales en su implantación y mantenimiento [28].
Diálisis Peritoneal
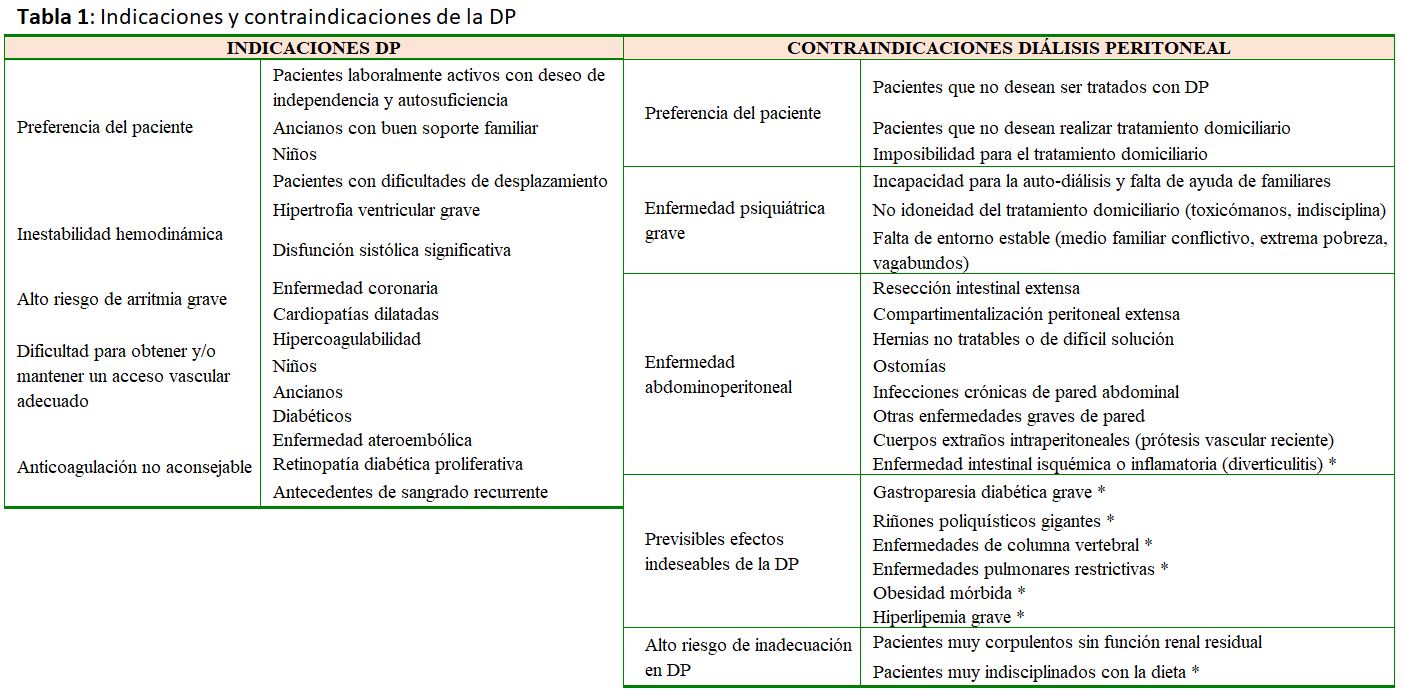
Desde el punto de vista médico están razonablemente definidas las situaciones en las que el tratamiento con DP puede implicar ventajas o desventajas para el enfermo (Tabla 1) [29]. Sin embargo, en la práctica, es habitual la ausencia de factores médicos que, de manera categórica, indiquen o contraindiquen la DP, siendo el estilo de vida, la actitud y las posibilidades del paciente, los determinantes esenciales para asignar uno u otro tipo de diálisis. Habitualmente, la derivación temprana al nefrólogo de los pacientes de ERC se asocia a una mayor proporción de enfermos que eligen la DP [30], probablemente debido a que los especialistas tienen el tiempo suficiente para educar al paciente en las diferentes opciones de tratamiento.
Hemodiálisis
Las posibles contraindicaciones para poder realizar HD crónica son [6]:
- Presencia de demencia grave e irreversible o situaciones de inconsciencia permanente.
- Tumores o enfermedades terminales con supervivencia <6 meses
- Incapacidades graves físicas o mentales con conducta incontrolable
- Decisiones anticipadas
- Inestabilidad cardiovascular que no permita un acceso vascular.
Tratamiento conservador o paliativo
Dentro de las alternativas, existe la posibilidad de elegir tratamiento conservador o paliativo, incluidos también entre los estándares de calidad de ACERCA [11]. El conservador consiste en un tratamiento continuo basado únicamente en el control de los síntomas mediante medicación y supervisión de la dieta y del estilo de vida del paciente sin iniciar tratamiento renal sustitutivo. [31].
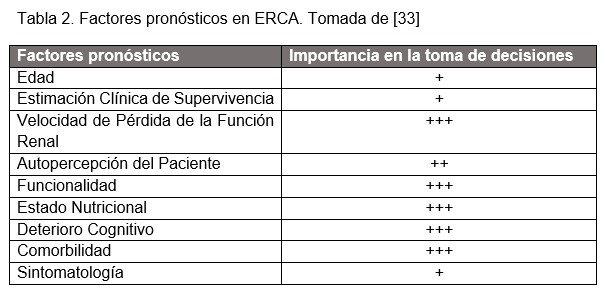
El tratamiento conservador es una alternativa efectiva a la diálisis en los pacientes en los que el equipo médico, el paciente y su entorno, consideran que ésta no aportará beneficios en términos de calidad de vida, hospitalización, carga de síntomas o supervivencia [32]. Para poder dar una información realista, ajustada y realizar una toma de decisión compartida habrá que tener en cuenta diferentes indicadores pronósticos en la ERCA con TRS [33] (Tabla 2), informar bien sobre las complicaciones de cada procedimiento y tener en cuenta los valores y deseos del paciente para que puedan realizar una toma de decisiones consciente [33].
La primera condición para que se sugiera un tratamiento conservador es que el paciente tenga una ERC estadio 5 (FG < 15 ml/min) y alguno de los factores previos [33] [34]. Los enfermos en tratamiento conservador tienen un riesgo de mortalidad mayor que aquellos que optan por la diálisis [35] [36], pese a ello, el tratamiento conservador tiene unos resultados de calidad de vida en este tipo de enfermos similares a la diálisis [37], ya que su supervivencia se ve más comprometida por el riesgo de eventos cardiovasculares y muerte que por la posibilidad de empeoramiento de la enfermedad o la entrada en diálisis [6].
Tras el proceso de decisión compartido del paciente y sus familiares, se debe firmar su negativa mediante el consentimiento informado.
2.2.- Toma de decisiones de inicio de TRS
La decisión de iniciar TRS debe realizarse respetando los principios de [38]:
- No maleficencia. No hacer daño.
- Autonomía. El paciente competente, debidamente informado, decidirá que opción es mejor para él.
- Proporcionalidad terapéutica. Obligación moral de implementar todas aquellas medidas terapéuticas que guarden relación de debida proporción entre los medios empleados y el resultado previsible.
La diálisis es un tratamiento proporcionado para el paciente con ERC avanzada, pero puede convertirse en desproporcionado por las propias condiciones físicas y psíquicas del enfermo [39].
Se ha demostrado que factores no médicos como la situación socioeconómica, la migración, la barrera idiomática o la dependencia influyen en el tipo de TRS elegido. Para abordar estos aspectos que pueden ser causa de inequidad se requiere de una intervención intersectorial y multinivel con equipos interdisciplinares [40] [41].
Algunos principios básicos en el proceso de toma de decisión de inicio de TRS son [42] [43]:
a) Objetivos de la información
- Ayudar al paciente en la toma de decisión en el TRS, informando y anticipando cómo los tratamientos se adaptarán a su estilo de vida teniendo en cuenta sus valores o preferencias.
- Proporcionar al paciente información sobre el proceso de su enfermedad, educación y entrenamiento para potenciar su autocuidado y su autonomía retrasando en lo posible la progresión de la enfermedad.
- Reducir la ansiedad y el conflicto decisional.
b) Toma de decisiones compartidas entre paciente (y/o familiares), médico y enfermera
Estas decisiones compartidas quedarán plasmadas con la firma del consentimiento informado o el rechazo al tratamiento. El equipo médico deber tener siempre la seguridad de que el paciente ha entendido bien las consecuencias de la decisión adoptada.
El proceso de información y educación del paciente y su entorno tiene un efecto importante en la evolución de la enfermedad y la elección del tratamiento. Así, la explicación de las modalidades debe incluir:
- Tipos de tratamiento disponibles.
- No iniciar TRS y seguir con tratamiento conservador hasta el fallecimiento [44].
- Inicio de TRS con posterior retirada de programa y asistencia médica hasta el fallecimiento.
c) Resolución de conflictos
Entre nefrólogo y paciente/familia, entre componentes del equipo nefrológico, o entre nefrólogo y otros médicos. Cuando los conflictos persisten y la necesidad de inicio de diálisis es urgente, es preciso iniciar y continuar hasta la resolución de dichos conflictos, haciendo constar tal decisión. En estos casos excepcionales, el Comité Asistencial de Ética Hospitalaria puede ayudar a solucionar las discrepancias.
Los pacientes y cuidadores deben ser informado de los riesgos, consideraciones o compensaciones de las diferentes modalidades de diálisis para que la selección de cada modalidad se adapte a su salud y circunstancias sociales.
2.3.- Descripción del proceso de información, deliberación y elección de TRS
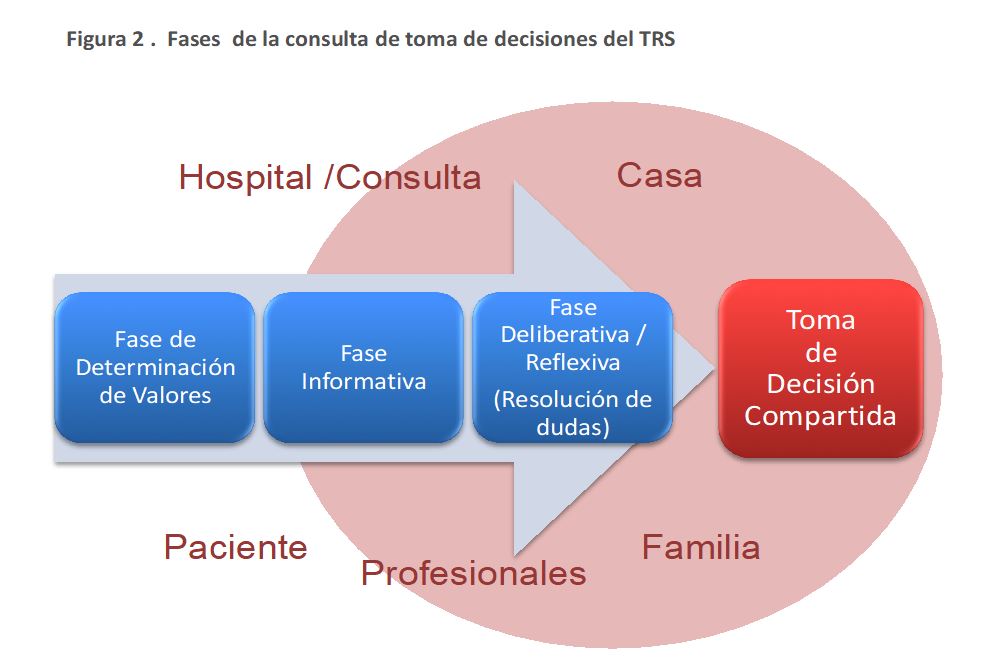
El proceso de toma de decisiones se inicia en la consulta de ERCA. Es importante o recomendable que, si fuera posible, el paciente acuda acompañado. Puede necesitar varias fases (Figura 2). Dentro de los procesos educativos publicados, el más utilizado es el que consta de 3 visitas, cada una de una hora, separadas una semana, para cubrir de forma óptima todas las fases en la consulta de enfermería de la unidad ERCA. En la primera visita y de forma individualizada, se dará información concreta y directa al paciente del motivo de la consulta y de cuál es la situación de su función renal, asegurándose que el paciente conoce su estado clínico. Se realizará una valoración integral del paciente para poder explorar posteriormente estilo de vida y valores. También se le dará información acerca de todas las opciones de TRS entre las que tendrá que elegir e incluso, en cumplimiento de la Ley Básica Reguladora de la Autonomía del Paciente y de Derechos y Obligaciones en Materia de Información y Documentación Clínica, de aquellas que no vaya a poder elegir (explicando el motivo que las desaconseja), y se detendrá especialmente en aquellas que no hayan sido contraindicadas por el Nefrólogo. Una vez el paciente haya completado el proceso, se procede a su derivación y visita médica correspondiente.
Fase de Determinación de Valores
En esta etapa del proceso se llevarán a cabo las siguientes intervenciones:
1. Se realizará una valoración integral del paciente, siguiendo los patrones funcionales de salud de Gordon, recogiendo datos biológicos, físicos y sociales. Se pasarán diferentes escalas sobre dependencia física, actividades instrumentales, calidad de vida, ansiedad, comorbilidad, etc.
2. Se le ofrecerá información sobre ERC mediante documentación accesoria (Flipchart/PPT).
3. Se determinarán sus preferencias y valores utilizando tarjetas de valores.
4. Se realizará con él la agenda de un día normal y del fin de semana para posteriormente ver cómo los diferentes tratamientos se adaptan a su estilo de vida.
5. Se realizará con el paciente el cuestionario sobre su estilo de vida para ver si su tendencia es de tratamiento domiciliario u hospitalario.
6. Se le proporcionará:
- Guía de acogida de la unidad de ERCA.
- Folleto resumen sobre modalidades de diálisis.
7. Se le aconsejará acudir acompañado en la próxima visita, si es posible.
El paciente debe identificar sus valores y los aspectos cruciales de su estilo de vida. Estos son aspectos del estilo de vida que se desea mantener a toda costa o que se rechazan de forma absoluta. Son específicos de cada persona y varían con el tiempo. Deben ser respetados independientemente de que concuerden o no con nuestros propios valores.
Las siguientes son potenciales herramientas de ayuda:
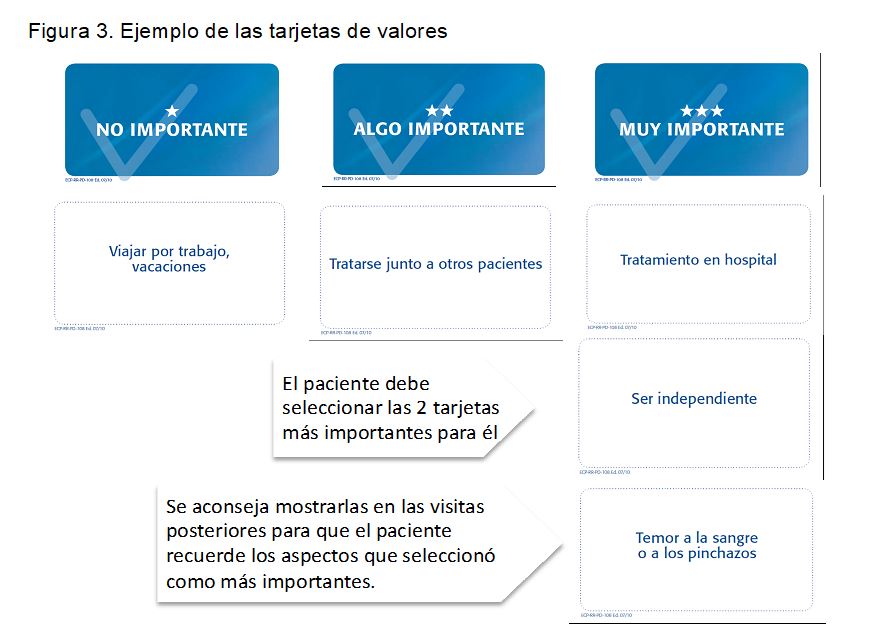
- Flipchart o tarjeta de valores: tiene por objeto ayudar al paciente a identificar sus valores fundamentales, los que deberían primar en su elección. Lo importante no es lo que dice cada tarjeta, sino lo que el paciente asocia a cada una de ellas según su forma de entender la vida y prioridades. Así, una misma tarjeta puede tener diferentes sentidos y diferente peso para personas distintas (Figura 3)
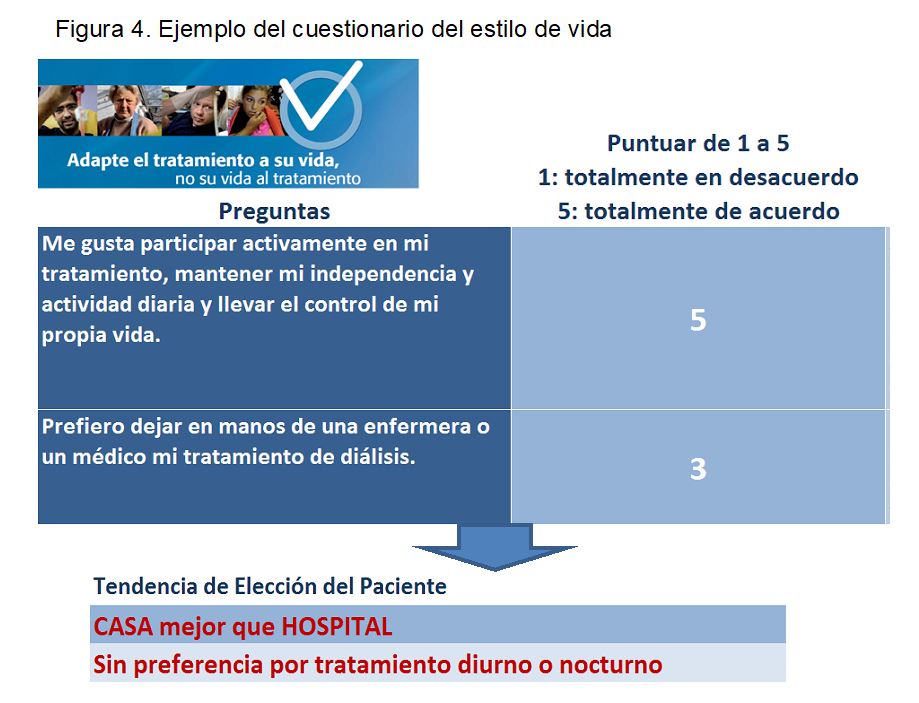
- Cuestionario del estilo de vida (Figura 4) cuyo objetivo es ayudar al paciente a identificar aspectos importantes le lleven a preferir tratamientos domiciliarios u hospitalarios. Contiene 18 afirmaciones relacionadas con los valores, estilo de vida e inquietudes que el paciente puntúa del 1 al 5 según cómo de acuerdo está con cada afirmación.
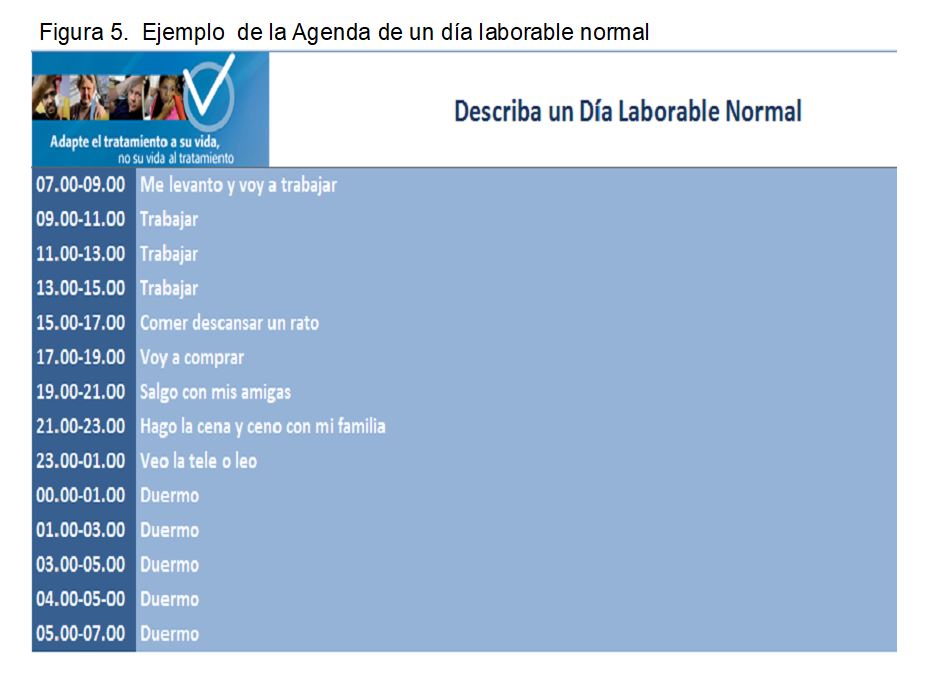
- Agenda de un día laborable normal y un fin de semana normal (Figura 5). El objetivo es ayudar al paciente a reconocer cómo es su forma de vida para valorar con mayor claridad, conforme avance en el proceso, cómo de fácil o difícil se adaptaría cada modalidad de TSR a su estilo de vida.
Fase informativa
1. Se informará al paciente en detalle sobre las diferentes modalidades TRS (mediante flipchart/PPT). Se realizará con el paciente y su entorno familiar (Figura 6).
2. Se le proporcionará material para casa:
- Libro/tríptico sobre opciones de tratamientos de la ERC.
- Tarjetas con direcciones web.
- Folleto de ayudas sociales para enfermos ERC.
- DVD (realizado con pacientes de DP, HD, TxR).
Fase de deliberación / reflexión
Se inicia con la resolución de dudas y se delibera sobre la opción a tomar.
1. Se realizará una hoja de ventajas/desventajas y puntos a considerar.
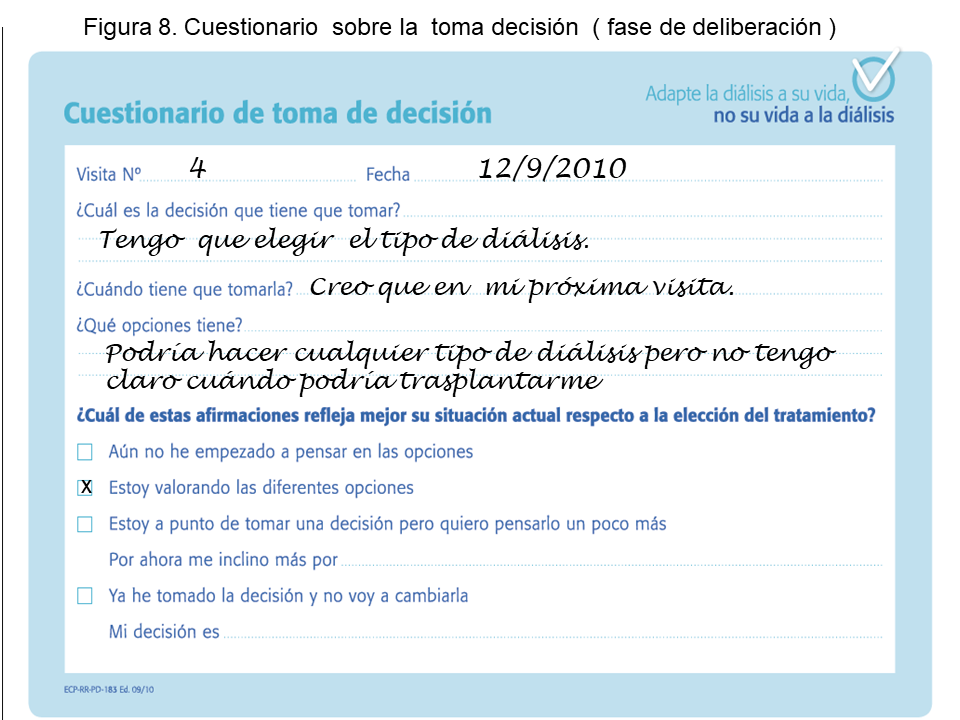
2. Cuestionario de fase de toma de decisión, en el que el paciente describirá su elección.
3. Si el paciente continúa indeciso, existen varias opciones:
- Pacientes mentores o sesiones grupales.
- Repetición del cuestionario de estilo de vida.
- Visitas Unidades DP y HD con nefrólogos especializados en cada área y enfermería.
- Se le citará en educación grupal para enfermos con ERCA donde participan y podrá conocer pacientes mentores.
- Se puede plantear la valoración psicológica para indagar porque no puede decidir, los miedos, etc.
En las siguientes figuras se ilustran herramientas a considerar: (Figura 7) (Figura 8).
Al finalizar el proceso de toma de decisiones, el paciente firmará los consentimientos informados sobre que ha recibido información sobre los TRS que formaran parte de su historia clínica, dejando anotado en su curso clínico que se procede a ello.
3.- CRITERIOS PARA EL INICIO DE DIÁLISIS
El momento óptimo para comenzar la diálisis no está claro y, en la práctica, las razones varían [45]. Las ecuaciones de riesgo pueden ser útiles para predecir un tiempo aproximado de inicio [7].
El TSR se plantea cuando el FG <15 ml/min/1,73 m2 y, en general, se inicia diálisis con un FG entre 8 y 10 ml/min/1,73 m2, [46] siendo el límite alrededor de los 6 ml/min/1,73 m2 [47] incluso en este caso sin sintomatología urémica.
Los síntomas que orienta a la necesidad de iniciar diálisis son [48]:
- Pericarditis o pleuritis (sin otra causa atribuible).
- Aumento del tiempo de sangría o diátesis hemorrágica (especialmente en forma de hemorragia intestinal).
- Insuficiencia cardíaca o sobrecarga de volumen refractario al tratamiento.
- HTA grave no controlable con tratamiento farmacológico.
- Hiperpotasemia severa no controlable con tratamiento farmacológico.
- Acidosis metabólica resistente al tratamiento con bicarbonato.
- Náuseas/vómitos o gastroduodenitis refractarias al tratamiento médico.
- Signos neurológicos y síntomas atribuibles a uremia (encefalopatía urémica, síndrome confusional, neuropatía urémica con síntomas motores).
- Prurito intratable.
- Anorexia no corregida tras tratamiento y descartando otras etiologías
Los pacientes con un FGe <6-7 mL/min/1.73m2 (mediante fórmula de MDRD4-IDMS, CKD-EPI o FGm promedio de aclaramiento de urea y creatinina) precisan inicio de diálisis, aunque no tengan síntomas [34] [49]
3.1.- Inicio de diálisis urgente / no urgente
Los inicios urgentes se definen como aquellos en los que debe realizarse diálisis inminente para corregir manifestaciones potencialmente mortales.
Los comienzos no urgentes son aquellos en los que la iniciación de diálisis puede demorarse más de 48 horas después de la presentación de síntomas o signos de alarma clínica.
3.2.- Inicio de diálisis planificada / no planificada
El inicio planificado es aquel en el que la modalidad ya ha sido elegida y hay un acceso listo para usar, si es el caso.
Un inicio no planificado es cuando se accede sin un acceso vascular o peritoneal maduro, que en general requiere hospitalización; o cuando la diálisis se inicia con una modalidad que no es la de elección del paciente. El inicio planificado es cada vez más frecuente cuando existe un programa bien estructurado de ERCA, disminuyendo la entrada prematura y la morbimortalidad asociada, aumentando la elección de técnicas domiciliarias durante el proceso de decisión [50] y la preparación a tiempo de un acceso vascular/peritoneal maduro. Según los estándares y criterios de ACERCA, se debería alcanzar un inicio programado >75 % en aquellos pacientes procedentes de ERCA (con más de 6 meses de seguimiento) [11].
3.3.- Diálisis peritoneal urgente
Históricamente la DP ha sido una técnica infrautilizada. La publicación de la Guía de DP en la lesión renal aguda (LRA) [51] considera la DP una modalidad adecuada para el tratamiento de la LRA en todos los entornos (1B), con una serie de recomendaciones al respecto:
1. Uso de catéteres peritoneales flexibles donde existan recursos y experiencia (1B) (óptimo).
2. Uso de catéteres tunelizados para reducir la peritonitis y la fuga pericatéter.
3. Implante por nefrólogos capacitados, en pacientes sin contraindicaciones.
4. Plantear que el objetivo de una urea Kt/V semanal de 3,5 proporciona resultados comparables a los de la HD diaria en pacientes críticamente enfermo.
5. Promover la DP automatizada tidal con 25 L, con un volumen tidal del 70 % cada 24 horas, que muestra una supervivencia equivalente a la hemodiafiltración veno-venosa continua con una dosis de efluente de 23 ml/kg/h y los ciclos cortos (1-2 horas) que probablemente corrijan más rápidamente la uremia, la hiperpotasemia, la sobrecarga de líquidos y/o la acidosis metabólica. Sin embargo, consideran que pueden aumentarse a 4-6 horas una vez que lo anterior se controla para reducir los costos y facilitar la eliminación de solutos de mayor tamaño.
6. La concentración de dextrosa debe aumentarse y el tiempo del ciclo debe reducirse a 2 horas cuando hay sobrecarga de líquido. Una vez que el paciente está euvolémico, la concentración de dextrosa y el tiempo del ciclo deben ajustarse para asegurar un equilibrio de líquidos neutro.
7. Medición diaria de los niveles de creatinina, urea, potasio y bicarbonato y medición del aclaramiento de creatinina y urea Kt/V de 24 h para evaluar la idoneidad cuando esté clínicamente indicado.
8. Plantear la interrupción de la diálisis una vez que obtenga una diuresis > 1 L de orina / 24 h y haya una reducción espontánea de los niveles de creatinina. Este conocimiento se puede utilizar en el caso de un inicio no planificado de la DP crónica y puede ser una herramienta para aumentar la tasa de penetración de la DP entre los pacientes incidentes que inician diálisis [52] y reducir el uso de catéteres temporales en HD [53].
Como limitaciones a la utilización de la DP de manera urgente, básicamente encontramos barreras logísticas y organizativas, como son la falta de profesionales que puedan colocar un catéter peritoneal dentro del tiempo de inicio urgente (es decir 48 horas) y la capacidad limitada para organizar el tratamiento de DP para pacientes de inicio urgente y formar a los pacientes a corto plazo.
Los 5 elementos clave para comenzar con éxito una DP urgente son: [54]
- Posibilidad de colocar un catéter peritoneal dentro de las 48 horas.
- Educación del personal sobre el uso del catéter inmediatamente después de la colocación.
- Apoyo administrativo en pacientes hospitalizados y ambulatorios.
- Identificación de candidatos apropiados.
- Utilización de protocolos en cada paso del proceso de inicio urgente (desde la selección del paciente para DP hasta un seguimiento apropiado después del alta).
3.4.- Hemodiálisis incremental
La HD incremental es un programa terapéutico bien definido, en el que la frecuencia y la dosis de la diálisis se adaptan al grado de función renal residual (FRR) del paciente y que requiere una atención clínica significativa. Consiste en dializar de forma rutinaria dos veces por semana durante un período variable después de la transición de ERCA a HD [55], adaptándose estrictamente a la tendencia de la FRR. El aclaramiento renal de urea ha de ser superior a 3 ml/min /1,73 m2. Se consideraría un "puente" terapéutico variable en el tiempo, que debe proporcionar un buen estado metabólico y una buena calidad de vida de los pacientes tratados [56] y podría ser utilizado también para quienes prefieren un enfoque más conservador en el manejo de la uremia.
Una creciente evidencia demuestra que la HD incremental se asocia a una mejor preservación de la FRR sin afectar negativamente la supervivencia en comparación con la HD de dosis completa (3 veces a la semana). En el metaanálisis de Garofalo et al [57], se analizan 22 estudios (con 75.292 pacientes), 7 en DP y 15 en HD, concluyendo que la HD incremental permite preservar la FRR durante un año más que la diálisis completa, tanto en HD y como en DP, sin que exista un aumento del riesgo de mortalidad. También se ha demostrado un equilibrio neutral de entrada/salida de fósforo debido a la contribución de la fosfaturia en comparación con los pacientes tres veces por semana que pierden temprano su FRR. No obstante, la hemodiálisis incremental sigue siendo un enfoque infrautilizado en esta población y aún se necesitan estudios más amplios y adecuados para confirmar estos hallazgos [58].
4.- CRITERIOS PARA LA REALIZACIÓN DEL ACCESO VASCULAR
La elección del acceso vascular (AV) óptimo para un paciente individual y la determinación del momento de la creación del acceso dependen de una multitud de factores que pueden variar ampliamente con cada paciente, incluidos los datos demográficos, las comorbilidades, la anatomía y las preferencias personales [59]. Los estándares de calidad de ACERCA [11] aconsejan que la unidad ERCA disponga de un protocolo urgente para acometer la fístula arteriovenosa (FAV) en pacientes seleccionados para HD.
Las guías españolas de AV [60] recomiendan la derivación para valoración (mapeo doppler) y creación del acceso vascular cuando el FG sea <15 ml/min/1.73m2. Y según los estándares de ACERCA, esta tasa debe ser > 90 % [11]. En pacientes con antecedentes de insuficiencia cardíaca congestiva o con nefropatía diabética, que tienen tendencia a tener sobrehidratación, parece más prudente remitirlos precozmente con FG más altos, para la construcción del AV.
Se recomienda que para facilitar la creación de FAV se extreme la conservación de la red venosa superficial de ambas extremidades superiores, que deben preservarse libres de punciones y canulaciones. Para ello es preciso instruir al personal sanitario e informar al paciente de forma precoz [60].
Se necesitan estrategias para potenciar la planificación, creación y mantenimiento del AV desde la consulta de ERCA, con el principal objetivo de que la mayoría de los pacientes puedan realizar HD con el mejor AV posible tras una valoración individualizada por el equipo multidisciplinar, para asegurar que los resultados no son fruto de una mala organización, gestión, variabilidad de criterios o experiencia de los profesionales responsables del AV [61].
Elección del tipo de acceso vascular
La elección del acceso vascular óptimo para el paciente ha de tener en cuenta diversos factores, tanto individuales del paciente, características relacionadas con el circuito de acceso anatómico, como características quirúrgicas y variables de proceso y tiempo como, por ejemplo, la urgencia de iniciar la diálisis. El acceso ideal es la FAV nativa, aunque existen alternativas como el uso de un injerto AV protésico (existen de canulación temprana que pueden ser utilizados solo 24 horas después de la creación). La utilización del catéter venoso central tanto temporal como tunelizado, debería ser la última opción a tener en cuenta, por su mayor tasa de complicaciones y morbimortalidad [60].
En definitiva, se requiere un enfoque de equipo interdisciplinar coordinado que eduque y considere las características del paciente. El tipo de acceso óptimo y el momento de creación del acceso también están influenciados por factores externos al paciente, como la experiencia del cirujano y los procesos de atención [61].
5.- VALORACIÓN PSICOLÓGICA EN ERCA
El impacto emocional que genera una enfermedad crónica avanzada está relacionado con las estrategias de afrontamiento de cada persona, las cuales, se pueden mejorar con la intervención psicológica a nivel cognitivo, emocional y social. La principal función del psicólogo en la consulta ERCA será apoyar al profesional en el proceso de comunicación y de toma de decisiones [62] [63] [64], y formar a los profesionales de la unidad de ERCA en este proceso [65]. También puede ser útil en la valoración previa a inclusión en lista de espera de trasplante o donación renales.
La valoración psicológica se puede estructurar de la siguiente manera:
1. Acogida y presentación del profesional - paciente - familia para favorecer el vínculo terapéutico.
2. Indicación del objetivo principal de la consulta y comprobación de la comprensión de la información recibida. Se le explicará que el motivo de la valoración psicológica es para acompañarle en el proceso de toma de decisión y, en caso necesario, se realizará un seguimiento durante la técnica escogida.
3. Se le pasarán unas pruebas objetivas de valoración para conocer el estado cognitivo y emocional del paciente.
4. Para comprobar que el paciente ha comprendido la información ofrecida de su estado clínico y proceso de toma de decisión se le pedirá que haga un breve resumen de su situación.
5. Exploración de necesidades y preocupaciones: se realizará exploración de las necesidades y preocupaciones del paciente, así como de la familia, para la detección y abordaje precoz de las posibles dificultades en la adaptación a la enfermedad.
6. Pruebas de valoración: las pruebas dependerán de las necesidades de los pacientes y quedan sujetas a la decisión de cada equipo de ERCA. Puede incluir test para evaluar la receptividad psicológica, el malestar emocional, la depresión, la ansiedad, etc.
6) VALORACIÓN SOCIOECONÓMICA EN ERCA
A pesar de que el proceso de toma de decisiones en la elección de TRS está reglado y estandarizado, existen factores no médicos que influyen en la toma de decisiones y que hay que tener en cuenta para evitar la inequidad [41].
Un reciente estudio ha demostrado que la elección de DP como técnica de TRS elegida (frente a HD) se asoció a personas con nivel socioeconómico alto, nacionalidad española, menor barrera idiomática y menor dependencia a actividades básicas de la vida diaria [40].
Los pacientes que optaron por TC eran significativamente de mayor edad, más dependientes, con una mayor proporción de mujeres y de españoles en relación con la elección de otras técnicas (DP y HD) [40].
Existen escalas estandarizadas y validadas de riesgo sociofamiliar, implementadas desde hace tiempo de forma rutinaria como, por ejemplo, la de Gijón [67].
Las unidades ERCA deben incorporar trabajadores/as sociales con el objetivo de incluir la narrativa social en la intervención integral del paciente ERCA atendiendo sus necesidades sociales. Su función será implementar programas de intervención proactivos, dando respuesta a las necesidades sociales y económicas de los pacientes de cara a permitirles abordar el TRS con seguridad. Además, para mejorar los sistemas de coordinación con los agentes sociales del territorio en referencia a los pacientes de la unidad ERCA.
7) PACIENTES MENTORES EN ERCA
Es importante la inclusión de pacientes mentores y asociaciones para favorecer la educación de los pacientes de ERCA [11]. Los pacientes mentores son pacientes más experimentados y en cualquiera de las opciones de TRS, que han sido previamente formados en habilidades comunicativas y gestión emocional. Su función será formar y acompañar a aquellos enfermos que estén a punto de comenzar su camino en la complicada enfermedad crónica, para ayudarles en la aceptación y adaptación a la ERC. Esta ayuda contribuirá a que tomen sus propias decisiones y reforzará la adherencia a las recomendaciones médicas y al tratamiento (Programa Mentoring de la SEN) [68]. Además, la intervención de pacientes mentores debe basarse en la diversidad cultural para sortear las barreras culturales, idiomáticas o religiosas que puedan existir [69].