Enfermedad Renal Crónica
A lo largo del texto hay numerosas referencias o enlaces, en cursiva, que corresponden a temas desarrollados en Nefrología al Día y que se accede desde el portal: https:// www.nefrologiaaldia.org/es
En Nefrología al Día ponemos al día el capítulo de enfermedad renal crónica (ERC) incorporando la actualización de las Guías KDIGO 2024 [1]. Estas Guías, basadas en una revisión sistemática de la evidencia, ofrecen las innovaciones más eficaces para ralentizar la progresión de la enfermedad, mejorar el manejo clínico y la calidad de vida de los pacientes.
EPIDEMIOLOGÍA DE LA ENFERMEDAD RENAL CRÓNICA
La enfermedad renal crónica (ERC) representa un desafío de salud pública global, con una prevalencia creciente y un impacto significativo en la morbilidad y mortalidad cardiovascular. Es una condición caracterizada por una disminución progresiva e irreversible de la función renal durante un período prolongado, generalmente superior a tres meses.
La ERC se ha convertido en una de las principales causas de mortalidad en todo el mundo, como así también de morbilidad, perdida de la calidad de vida, costos, desempleo, jubilaciones anticipadas, baja productividad, etc. [2] [3] [4] [5] [6].
Es una enfermedad progresiva e irreversible que afecta a más del 10% de la población general en todo el mundo, lo que representa más de 800 millones de personas. Es más frecuente en personas mayores, mujeres, minorías raciales y en personas con DM mellitus (DM) e hipertensión. La ERC epidemiológicamente es el doble que la DM y veinte veces más que el cáncer, y representa una carga especialmente grande en los países de ingresos bajos y medios, que son los menos equipados para hacer frente a sus consecuencias [5].
En España los estudios epidemiológicos ofrecen datos variables de prevalencia, entre un 5-15%, en parte atribuibles a diferencias metodológicas entre estudios, pero también podrían deberse a cambios evolutivos en el tiempo [7]. Se espera que estas cifras aumenten en España, llegando a una prevalencia superior al 18% en el año 2040, posicionándose como la tercera causa de muerte en España en 2050 [8] [9].
La ERC se considera el destino final común de una constelación de patologías que afectan al riñón de forma crónica, y que es, en general, asintomática hasta fases avanzadas. Lamentablemente tan solo un 10% de las personas con ERC conocen que la padecen por lo que es muy importante la detección precoz ya que mejora el pronóstico y reduce la progresión de la enfermedad. Una vez agotadas las medidas diagnósticas y terapéuticas de la enfermedad renal primaria, la ERC conlleva unos protocolos de actuación comunes y, en general, independientes de aquella. Brevemente, para su detección, que veremos más adelante, se aconseja realizar pruebas a las personas con riesgo de padecerla o que ya la padecen, utilizando tanto la medición de la albúmina en orina, como la evaluación de la tasa de filtración glomerular (TFG). Y en casos de detección incidental, incluida la hematuria, se aconseja repetir las pruebas para confirmar la presencia de ERC.
CAUSAS DE ENFERMEDAD RENAL CRÓNICA
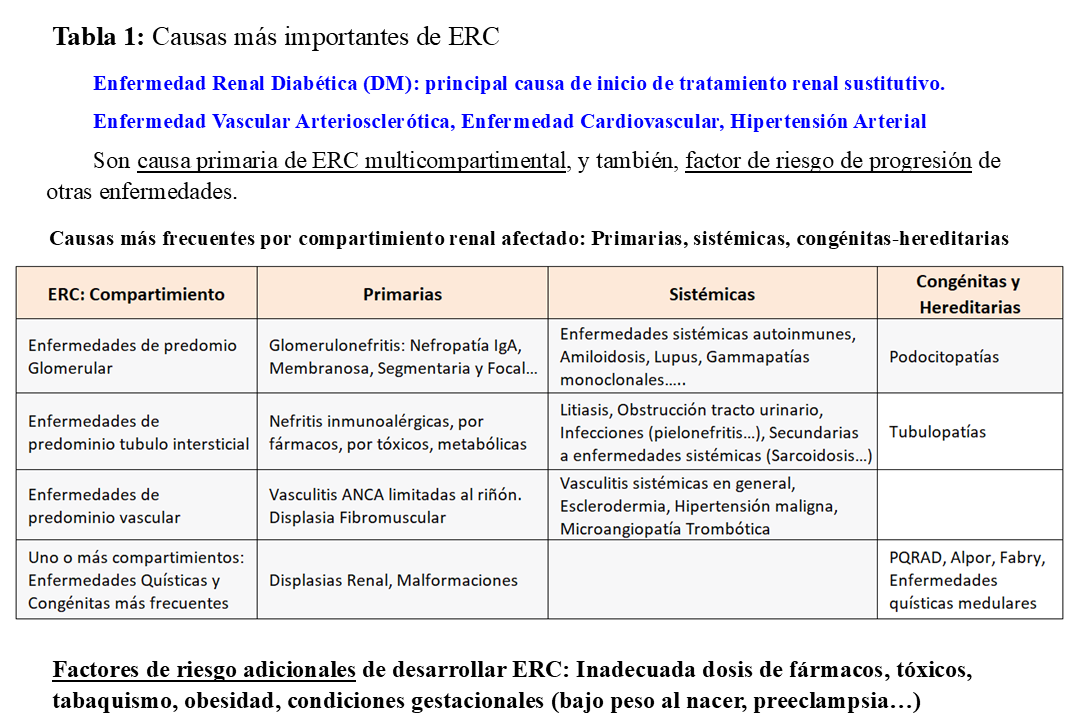
Las causas de ERC admiten distintas clasificaciones, pudiendo coexistir más de una causa que potencian el daño renal.
Causas Primarias: Son aquellas que afectan directamente a los riñones sin una enfermedad sistémica subyacente. Afectan predominantemente al compartimiento glomerular.
Causas Secundarias: Resultan de patologías de carácter sistémico, en general multiorgánico y multicompartimental renal.
Causas Genéticas: Hereditarias: se trasmite a través de material genético de padres a hijos, puede manifestarse al nacer o a lo largo de la vida. Congénitas: presentes desde el nacimiento, puede ser trasmitida o no por los progenitores.
En perspectiva anatómica, las enfermedades causantes de ERC pueden afectar a uno, o más de los compartimientos renales clásicos: glomerular, tubular intersticial, vascular
En la (Tabla 1) pueden verse las causas más importantes de ERC. Con frecuencia coexisten más de una causa (por ejemplo, vasculitis e hipertensión arterial) y potencian el daño renal.
[1] [7] [10] [11] [12] [13].
En este capítulo revisaremos los aspectos clínicos y el manejo conservador de la ERC con especial referencia al control de la progresión y las complicaciones cardiovasculares.
Como veremos, la detección temprana y el manejo adecuado de los factores de riesgo asociados a estas causas son esenciales para retrasar la progresión de la ERC. La detección precoz permite identificar causas tratables de insuficiencia renal. Los médicos de atención primaria desempeñan un papel clave en la detección y manejo de la ERC y se recomienda realizar pruebas de detección en personas de alto riesgo, como aquellas con hipertensión, DM, obesidad o antecedentes familiares de ERC.
DEFINICIÓN, CLASIFICACIÓN Y ESTADIOS DE LA ERC
La ERC en el adulto se define como la presencia de una alteración estructural o funcional renal que persiste más de 3 meses, con o sin deterioro de la función renal. Los marcadores de daño renal son cualquiera de los siguientes:
• TFG < 60 ml/min/1,73 m2 sin otros signos de enfermedad renal
• Albuminuria >30 mg/día
• Otros marcadores de ERC:
Alteraciones en el sedimento urinario
Alteraciones electrolíticas u otras derivadas de alteración tubular
Alteraciones estructurales histológicas
Alteraciones estructurales en pruebas de imagen
En las guías KDIGO 2024 [1] se insiste también en la Causa, incluyendo para su clasificación las siglas CGA, o sea: Causa, grados de Filtrado Glomerular y Albuminuria. Esto es debido a que la causa del daño renal tiene riesgo independiente de progresión de la ERC, de enfermedad cardiovascular y de mortalidad derivado de los escores de predicción de riesgo individual. Aunque la histología debe obtenerse siempre que sea posible, también se promueven otras herramientas de diagnóstico de precisión, como las pruebas genéticas. Más del 10% de las personas con ERC tienen una causa genética subyacente y la identificación de genes procesables mediante pruebas genéticas puede tener un impacto significativo en el manejo clínico de estos pacientes [7] [14]. Además, la obtención de este diagnóstico en una persona puede facilitar la detección precoz y el tratamiento adecuado en otros miembros de la familia.
También es muy importante establecer la cronicidad y diferenciar la insuficiencia renal aguda de la ERC, porque las causas, los tiempos de intervenciones y de evolución son diferentes.
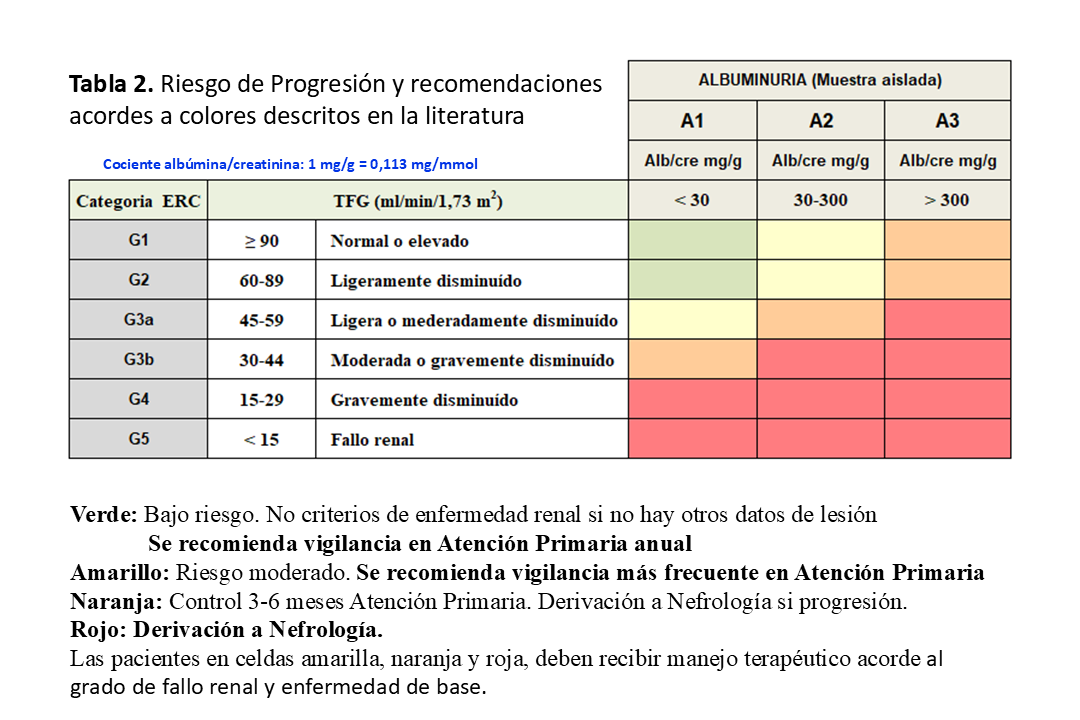
La gravedad de la ERC se ha clasificado en 6 categorías o grados en función de la TFG estimada (G1-G5) y la categoría de albuminuria (A1-A3) medida en miligramos de albumina por gramo de creatinina en muestra aislada primera de la mañana (uACR mg/g del inglés urinary-albumin creatinine ratio) (Tabla 2). Esto es debido a que la albuminuria (proteinuria) destaca como el factor pronóstico modificable más potente de progresión de ERC. El deterioro de la TFG es lo característico de los grados 3-5, no siendo necesaria la presencia de otros signos de daño renal. Sin embargo, en las categorías 1 y 2 se requiere la presencia de otros signos de daño renal. Los colores de las celdas indican el riesgo de progresión de ERC, la recomendación de derivación al nefrólogo y cuando deberían recibir manejo terapéutico acorde al grado de fallo renal y enfermedad de base.
Por todo ello, estamos ante una clasificación dinámica, que va sufriendo ligeros cambios con el tiempo, y que tiene la ventaja de unificar el lenguaje a la hora de referirnos a la definición y magnitud del problema. La metodología para la medición del FG y la determinación de la albuminuria, son herramientas claves para el diagnóstico y manejo de la ERC. A cualquier nivel de FG el incremento de albuminuria conlleva más rápida progresión de la enfermedad renal y mayor mortalidad cardiovascular [1] [10] [11] [12] [13] [14].
FACTORES DE RIESGO DE ERC
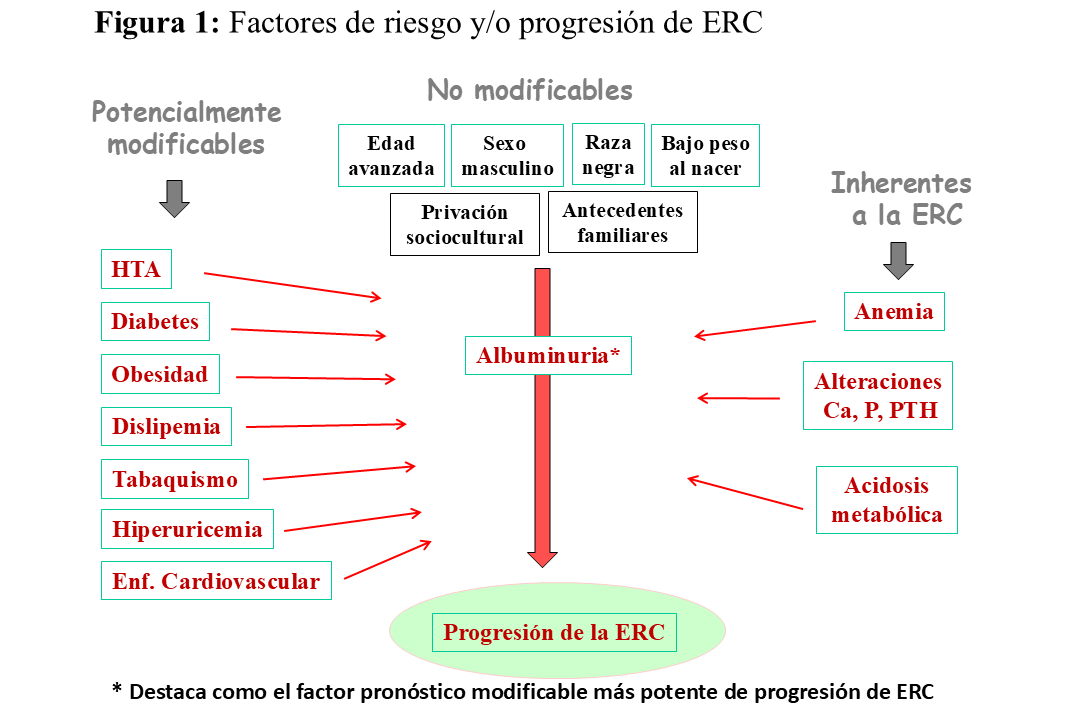
Se han descrito numerosos factores de riesgo de inicio y de progresión de la ERC [15] [16] [17] [18], que, a su vez pueden potenciar el efecto de la enfermedad renal primaria si es el caso. Lógicamente, la mayoría de los factores de inicio, son al mismo tiempo de progresión, lo que dificulta analizarlo separadamente. La coexistencia simultánea es frecuente y potencian el daño (Figura 1). Varios tienen mecanismos fisiopatológicos comunes, siendo la proteinuria y la hiperfiltración glomerular los más importantes.
Estos factores de riesgo podemos dividirlos en condiciones no modificables, alteraciones comórbidas potencialmente modificables [19] [20] [21] y alteraciones inherentes a la ERC que se han propuesto como factores de riesgo de progresión: anemia, alteraciones del metabolismo mineral, acidosis metabólica. Su manejo se discute en los apartados correspondientes.
Factores de riesgo no modificables
Edad
La edad avanzada es un factor de riesgo bien conocido de ERC. Sin embargo, no es un factor de progresión en sí mismo [22] [23] [24], más allá del deterioro funcional natural asociado a la edad ("riñón del viejo"). Hay un debate sobre el "riñón del anciano": el descenso de la TFG representa una enfermedad o es el resultado natural del envejecimiento. Se asume que, de acuerdo con los cambios de la hemodinámica renal con el envejecimiento, se pierde aproximadamente de 0.6-0.8 / ml año a partir de los 40 años [1]. Con el envejecimiento se constata esclerosis glomerular, atrofia tubular, y esclerosis vascular. Pero también hay individuos añosos en que no se observa el descenso esperado del filtrado [25] [26]. Por eso respecto al diagnóstico de ERC en adultos mayores de 65 años y ancianos ha habido grandes debates. La guía KDIGO 2024 [1] mantiene la cifra de < 60ml/min. Hay discusión por la caída de la TFG de 0.6-0.8 /ml/año, pero los cambios en la estructura y función renal son más que solo el FG y aumentan la susceptibilidad a eventos significativos. Por ello y basados en estudios epidemiológicos se mantiene la cifra de igual o menor a 60ml/min para el diagnóstico de ERC en adultos mayores incluso en ausencia de albuminuria por el riesgo relativo de efectos adversos. Además, pueden tener sarcopenia lo cual limita el uso de la TFG debido a una sobrestimación de esta.
Sexo masculino
Descrito en estudios poblacionales como factor pronóstico independiente de padecer ERC [27] [28] [29] no ha sido verificado por otros autores [30]. Sin embargo, en todos los registros de enfermos renales, el sexo masculino representa aproximadamente al 60% de los pacientes en tratamiento renal sustitutivo. No está claro como factor de progresión en sí mismo, habiendo varias circunstancias asociadas al sexo que son determinantes en la evolución del daño renal [31].
Raza negra o afroamericanos
En USA está demostrada una mayor incidencia en diálisis de la población afroamericana. Esta circunstancia debe atribuirse, principalmente, a la mayor prevalencia de HTA severa, peores circunstancias socioculturales y posibles factores genéticos [32].
Bajo peso al nacer
Está asociado a un reducido número de nefronas y al desarrollo posterior de ERC. De hecho, la perdida adquirida de masa renal, experimental o clínica, se asocia a hipertensión glomerular e hiperfiltración [33].
Privación sociocultural
Los estudios epidemiológicos demuestran claramente que el bajo nivel social, cultural y económico se asocian a peor salud. La enfermedad renal no escapa a estas circunstancias [32] [34] [35].
Antecedentes Familiares de enfermedad renal
La predisposición genética puede influir en la aparición de diversas enfermedades renales, como la nefropatía diabética, la glomeruloesclerosis focal y segmentaria, y especialmente enfermedades hereditarias como la enfermedad renal poliquística autosómica dominante. Además, la historia familiar puede reflejar factores ambientales compartidos y hábitos de vida que también contribuyen al riesgo de ERC. Las guías KDIGO 2024 [1] enfatizan la importancia de evaluar los antecedentes familiares en la identificación temprana y el manejo del riesgo de progresión de la enfermedad. Véase enfoque genético de las enfermedades renales hereditarias.
Factores de riesgo potencialmente modificables
Aunque los factores señalados a continuación son factores de riesgo y/o de progresión de ERC, todos de manera directa o indirecta están subordinados a la magnitud de la albuminuria, siendo esta el mayor factor de riesgo de progresión. De ahí que el manejo de la ERC se basa fundamentalmente en medidas antiproteinúricas.
HTA
Asociada mayoritariamente a la ERC, la padecen más del 75% de los pacientes. Es a la vez causa y consecuencia de la ERC [36] [37] [38] (Véase HTA esencial). Las guías KDIGO 2024 [1] sugieren que los adultos con PA elevada y ERC sean tratados con un objetivo de presión arterial sistólica (PAS) de <120 mm Hg, cuando se tolere. En pacientes con HTA y ERC, especialmente si son diabéticos, es recomendable la monitorización ambulatoria de la tensión arterial (MAPA), dada la frecuencia de hipertensión enmascarada o incremento nocturno de la tensión arterial [39] [40] (Véase Ambulatory Blood Pressure Measurement. What Is the International Consensus?)
DM Mellitus (DM)
Es un potente factor iniciador, siendo la causa más frecuente de ERC terminal [19] [41] [42]. En consultas de ERCA su prevalencia pueda alcanzar actualmente al 40-50% de los pacientes [16]. Como factor de progresión, la proteinuria condicionada por la nefropatía diabética es el principal predictor. De hecho, el grado de progresión depende directamente de la magnitud de la proteinuria: diabéticos y no diabéticos progresan igual a similares niveles de proteinuria [43]
Asimismo, en estudios poblaciones los niveles elevados de HbA1c [44] se han asociado a mayor riesgo de ERC. El control de la DM debe ser un objetivo prioritario, especialmente en pacientes proteinúricos. Veremos más adelante como el Control de glucemia según las guías KDIGO de la DM indican un objetivo de HbA1c individualizado que oscila entre <6,5 % y <8,0 % en pacientes con DM y ERC no tratados con diálisis (1C) [42] [45] [46].
El abordaje completo de la DM se desarrolla bajo el epígrafe: DM, Obesidad y Riñón
El sobrepeso y la obesidad son cada vez más frecuentes en los pacientes con ERC como reflejo de lo que ocurre en la población general, siendo además la antesala de la DM. Estudios poblacionales han demostrado una fuerte asociación entre obesidad y riesgo de ERC [47] [48] [49]. El exceso de peso se asocia a hiperfiltración glomerular. También la obesidad está asociada a hipertensión arterial, inflamación crónica, dislipidemia y alteraciones hormonales. Además del riesgo de deterioro renal, generan un problema adicional para incluir a un paciente en lista de espera de trasplante. Es por ello, que las medidas nutricionales combinadas con ejercicio físico acorde son preceptivas en estos enfermos.
Dislipemia
Véase Alteraciones lipídicas en la ERC
Es bien conocido que la dislipemia conlleva un efecto adverso sobre el árbol vascular en general. En la ERC existe elevada prevalencia de dislipemia y hay evidencias experimentales de que influye adversamente en la progresión del daño renal, aunque no se ha verificado en estudios clínicos controlados. En cualquier caso, la evaluación y la intervención terapéutica para el control de la dislipemia en el paciente renal es preceptiva [12] [44] [45] [46] [50] [51] [52] [53].
Tabaquismo
El tabaquismo es un reconocido factor de riesgo cardiovascular, y se propone como factor independiente de riesgo renal, aunque sus mecanismos no están establecidos. Debe considerarse uno de los más importantes factores de riesgo remediables, por ello la abstinencia al tabaco es una recomendación prioritaria en la ERC [54] [55] [56].
Hiperuricemia
La hiperuricemia (Véase Ácido úrico y enfermedad renal crónica) se considera cuando sus valores séricos son > 7 mg/dL. Puede ser asintomática u ocasionar enfermedades como nefrolitiasis úrica, nefropatía por ácido úrico, gota tofácea, artritis gotosa aguda e hiperuricemia asintomática.
En la ERC existen varios factores que pueden aumentar los niveles de ácido úrico: uso de diuréticos, aumento de la resistencia renal vascular, o coexistencia de resistencia a la insulina.
Los pacientes con ERC tienen con frecuencia hiperuricemia asociada a la caída de la TFG que en la mayor parte de los casos es asintomática. La hiperuricemia se ha visto asociada a mayor riesgo de morbimortalidad cardiovascular, HTA, desarrollo de nefropatía en pacientes diabéticos, y aunque no verificado completamente, a la progresión de la ERC. Estos son razones suficientes para tratar sistemáticamente los niveles elevados de ácido úrico aún en pacientes asintomáticos, aunque este extremo no es reconocido en todos los documentos de consenso.
En las guías KDIGO 2024 [1] respecto a la hiperuricemia la guía recomienda que a las personas con ERC e hiperuricemia sintomática se les prescriba una intervención para reducir el ácido úrico (1C), con preferencia inhibidores de la xantino oxidasa junto a consejos dietéticos como limitar la ingesta de alcohol, carnes y jarabe de maíz (edulcorante) con alto contenido de fructosa.
Enfermedad cardiovascular [20] [21]
Las enfermedades cardiovasculares (ECV) son la principal causa de muerte en pacientes con ERC. De hecho, las personas con ERC tienen un riesgo mucho mayor de sufrir un infarto de miocardio, un accidente cerebrovascular u otras enfermedades cardiovasculares que la población general. La relación entre la ERC y las ECV es compleja y multifactorial. Algunos de los factores que contribuyen a este mayor riesgo cardiovascular en pacientes con ERC incluyen:
• Factores de riesgo tradicionales: DM, hipertensión arterial, colesterol alto y tabaquismo, que son comunes en pacientes con ERC.
• Factores de riesgo específicos de la ERC: Disfunción endotelial, inflamación crónica, estrés oxidativo, sobrecarga de volumen y anemia, que son consecuencia de la disminución de la función renal.
• Otros factores: tenemos otros factores prevenibles o modificables como la yatrogenia (drogas y otros procedimientos) o exposición a tóxicos.
véase Alteraciones cardiovasculares en la ERC
Factores de riesgo inherentes a la ERC
La anemia [57] y las alteraciones del metabolismo mineral, y dentro de estas más concretamente la hiperfosforemia [58] [59] [60], se han asociado a más rápido deterioro renal. Sin embargo, estos factores, son consecuencia del daño renal, por lo que es difícil aislar su efecto como predictores. En cualquier caso, la corrección de la anemia y de las alteraciones del metabolismo mineral están indicados desde frases precoces de la ERC.
La acidosis metabólica es frecuente en la ERC debido a la deficiente eliminación de la carga ácida por parte del riñón. Asimismo, se ha descrito como un factor desfavorable en la progresión de la ERC y deben ser prevenidos y/o convenientemente tratados [61] [62] [63] La acidosis metabólica es más prevalente según aumenta la ERC y la guía KDIGO 2024 [1] sugiere no descender de 18 mEeq/l en adultos y considerar el tratamiento dietético y o farmacológico sin pasar el valor normal y que no afecte a sobrecarga de volumen, TA elevada o cifras de potasio sérico. No hay clara evidencia del beneficio en su uso, aunque es dudoso un posible beneficio en la progresión de la ERC.
INDICACIÓN DE PRUEBAS PARA DETECCIÓN DE ERC
El problema de la ERC es que es asintomática hasta fases avanzadas. Para su detección se aconseja realizar pruebas a las personas en riesgo de padecerla o que ya la padecen, utilizando tanto la medición de la albúmina en orina como la evaluación de la TFG [1] [7] [10]. Y en casos de detección incidental, incluida la hematuria, se aconseja repetir las pruebas para confirmar la presencia de ERC. Personas de riesgo de ERC a quienes debemos realizar pruebas de detección son fundamentalmente:
HTA
Enfermedad Renal Diabética
Enfermedad cardiovascular
Antecedentes de lesión renal aguda
Antecedentes familiares de enfermedad renal
Obesidad
Medicación nefrotóxica
Enfermedades sistémicas con riesgo renal
Bajo peso al nacer
Comorbilidades de riesgo
Bajo peso al nacer
Lupus Enfermedades sistémicas con riesgo renal
Medicación nefrotóxica
Otros
ECUACIONES DE RIESGO
Mientras que el mapa tradicional de estadificación de KDIGO ilustra los riesgos a nivel poblacional, el verdadero riesgo individual de un paciente dado está determinado no sólo por su TFGe (TFG estimada) o la albuminuria, sino también por la etiología subyacente de la ERC [1] [10] [13] [14]. En ella influyen las características demográficas, las condiciones comórbidas (especialmente las enfermedades cardiovasculares) y otros factores, incluyendo el estilo de vida, el estado socioeconómico, el estado nutricional y los eventos intercurrentes. La predicción del riesgo individual en nefrología mediante ecuaciones de riesgo precisas y validadas externamente tiene el potencial de ayudar a fundamentar decisiones clínicas clave y mejorar el diálogo entre el paciente y el profesional sanitario.
Las más recientes Guías KDIGO 2024 [1] avanzan en la implementación de estas “ecuaciones de riesgo validadas” para la toma de decisiones en un cuidado multidisciplinario. Hay que elegir la herramienta adecuada para cada elemento de interés, ya sea insuficiencia renal, eventos cardiacos o mortalidad. Las “ecuación de riesgo de fallo renal” (KFRE) es la recomendada actualmente por estas Guías, aunque existen otras muchas que van implementándose [14]. La ecuación KFRE (https://kidneyfailurerisk.com/) se desarrolló inicialmente en 2011, siendo validada posteriormente en 2016 utilizando datos de más de 30 países de 4 continentes. Brevemente, KDIGO incorpora las siguientes recomendaciones:
• Una TFG < 60 mL/min medido por marcadores exógenos o estimado es un criterio de ERC. La presencia de marcadores de lesión renal es imprescindible para catalogar a un paciente con ERC si su TFG es > 60 mL/min/1,73 m2 [1] [7].
• En personas con ERC G3-G5 (TFGe < 60 mL/min), se recomienda utilizar la ecuación KFRE (como ecuación de riesgo validada externamente) para estimar el riesgo absoluto de insuficiencia renal terminal (IRT). Esta ecuación puede no ser válida para TFGe superiores a 60 mL/min.
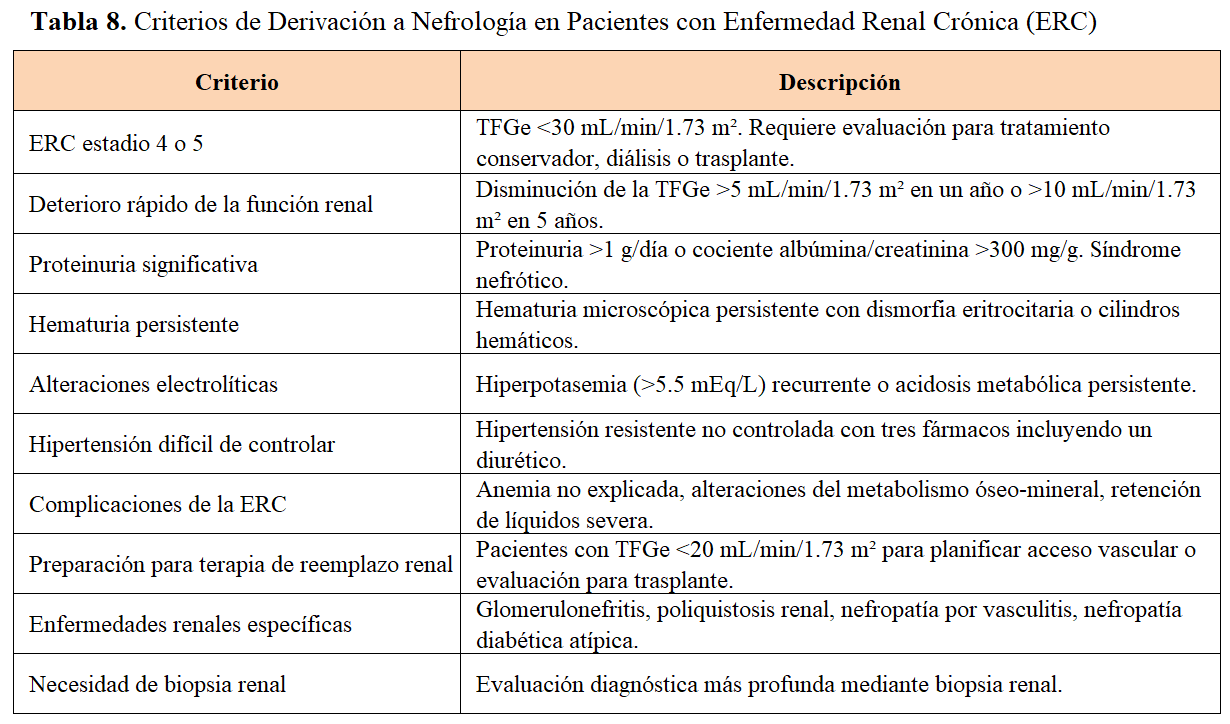
• Un riesgo de IRT a 5 años del 3-5% se puede utilizar para indicar la derivación a nefrología, además de los criterios basados en la TFGe o la relación albúmina-creatinina en orina, además de otras consideraciones clínicas.
• Un riesgo de IRT a 2 años, superior al 10 % se puede utilizar para indicar atención multidisciplinaria, además de los criterios basados en la TFGe y otras consideraciones clínicas.
• Un riesgo de IRT a 2 años superior al 40 % se puede utilizar para indicar la educación y preparación para la terapia de reemplazo renal (acceso vascular, modalidad de diálisis, trasplante renal).
Evaluación de la Función Renal: Tasa de Filtrado Glomerular (TFG)
Véase Pruebas de Función Renal: Glomerular y Tubular
El Filtrado Glomerular (FG) es un parámetro crítico para el estadiaje de la ERC, su manejo y seguimiento.
Los marcadores directos (inulina, DTPA, EDTA, iodotalamato, iohexol) son más precisos que el aclaramiento de creatinina, pero su complicada metodología los hace inviables en la práctica clínica rutinaria [64] [65] [66] Por ello, deben reservarse para situaciones donde el FG estimado es menos preciso y se demanden decisiones terapéuticas específicas.
El rango normal de creatinina sérica es 0,8-1,3 mg/dl en el hombre y 0,6-1,0 mg/dl en la mujer; cambios de ± 0,3 mg/dl en distintos laboratorios pueden considerarse cambios interensayo. La creatinina comienza a aumentar cuando el FG desciende un 50%. En fases avanzadas, pequeños cambios de la TFG provocan aumentos importantes de la creatinina sérica. Asimismo, la interpretación de los niveles de creatinina requiere considerar las dietas proteicas, así como numerosas sustancias pueden causar interferencias analíticas.
El aclaramiento de creatinina es la prueba más difundida, pero cuando el FG desciende, aumenta la secreción tubular de creatinina y sobrestima el FG real en un 10-30%. Además, conlleva el potencial error en la recogida de 24 horas.
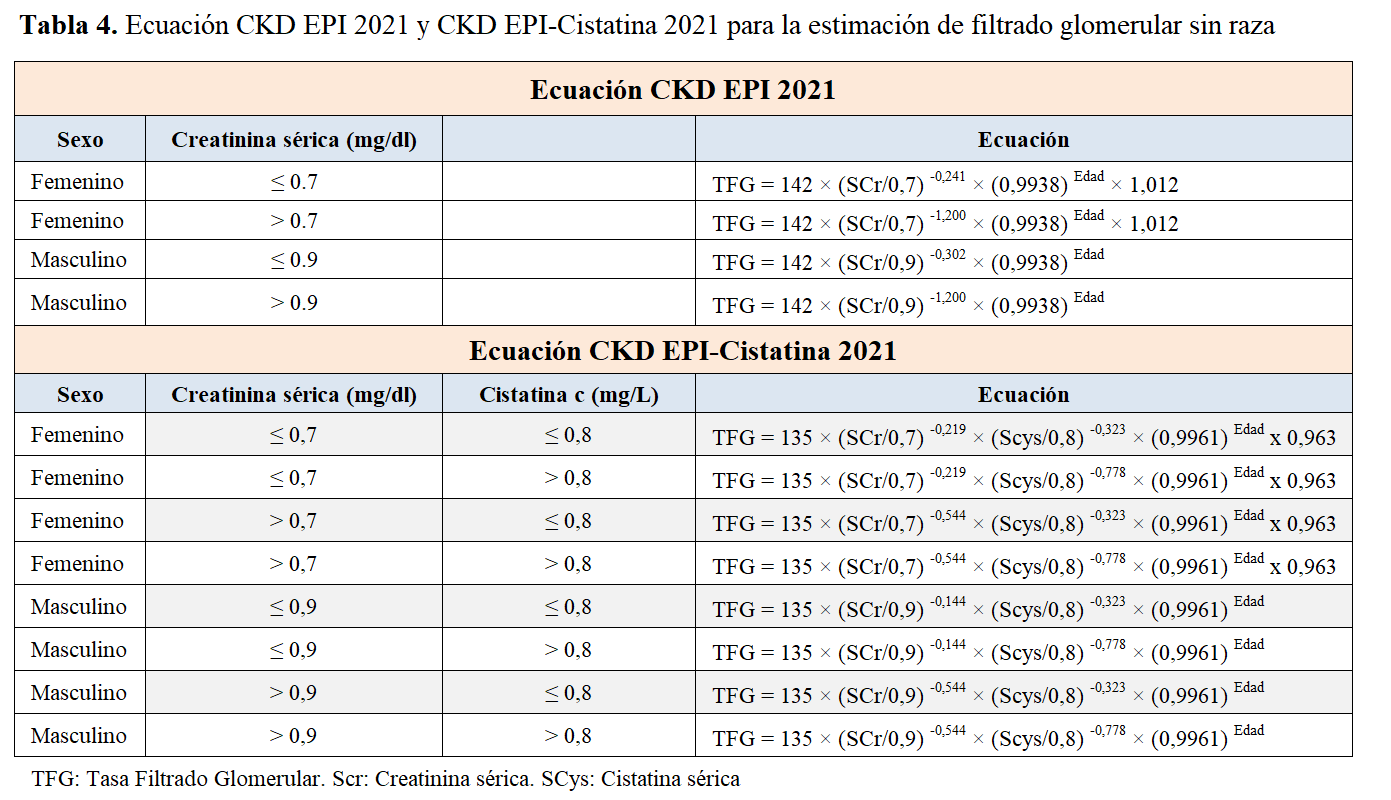
Se han desarrollado fórmulas para el cálculo de la TFG a partir de la creatinina sérica, junto a variables analíticas, demográficas y/o antropométricas, obviando la necesidad de recoger la orina de 24 horas. Clásicamente, las más empleadas en investigación y en la práctica clínica fueron la de Cockcroft-Gault, el MDRD en su formato simplificado (4 variables) o completo (6 variables) [64] (Tabla 3). Posteriormente la ecuación de CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) ha demostrado mejores resultados en cuanto a exactitud y precisión. Sin embargo, actualmente se considera que, dado que la raza es una construcción social y no biológica, esta variable no debe ser incluida en la ecuación [7] [8] [66] [67] (Tabla 4).
En base a estas consideraciones, se recomienda emplear la ecuación CKD EPI 2021 para la estimación de la TFG si bien hay criticas europeas al respecto como veremos. Si la cistatina es disponible, debería usarse la combinación de ambas cuando el FG estimado es menos preciso y afecta decisiones terapéuticas (trasplante de riñón simultáneo a otro trasplante de órgano sólido, candidatura de un donante de riñón, dosificación de fármacos, entre otros) [1] [7] [8] [65] [66] [67].
En general, las limitaciones más importantes para el uso de estas ecuaciones son las siguientes: Peso corporal extremo: IMC < 19 kg/m2 o > 35 kg/m2, dietas especiales (vegetarianos estrictos, suplementos de creatinina o creatina), malnutrición; alteraciones de la masa muscular (amputaciones, pérdida de masa muscular, enfermedades musculares o parálisis), o factores no relacionados con la función renal en las ecuaciones de TFG basadas en la creatinina (Tabla 5).
Alternativas adicionales tales como el empleo de cimetidina, la semisuma del KCr y Kurea o la cistatina, no se aplican en la práctica cotidiana y han visto su uso muy reducido.
En algunas enfermedades específicas, pueden emplearse ecuaciones de predicción de validación externa para determinar el riesgo de fallo renal a largo plazo; tales como la Nefropatía IgA [68] o la Enfermedad Poliquística Autosómica Dominante [69]
Finalmente, aunque lo deseable es mejorar la precisión metodológica, la monitorización periódica de la creatinina sérica es útil para conocer si el FG cambia o se mantiene estable.
Punto de vista europeo sobre la fórmula ideal del cálculo del filtrado
Aunque EE. UU. ha adoptado inmediatamente la ecuación CKD-EPI 2021 esta ecuación, sin embargo, es criticada en grupos europeos pues presenta un peor rendimiento en comparación con la versión anterior en poblaciones europeas, especialmente entre la población blanca. Implantar universalmente la CKD-EPI 2021 en Europa puede no ser óptimo, al introducir una menor precisión entre la población predominantemente no negra. Además, casi todos los países europeos no utilizaban el coeficiente de raza para la ecuación CKD-EPI 2009, y el argumento de cambiar a una ecuación menos precisa para eliminar un coeficiente no utilizado no parece convincente. Además, el cambio de ecuaciones también afecta a la carga de morbilidad y a la elaboración de políticas. Por ejemplo, en un sistema sanitario del norte de Europa, la prevalencia de los estadios 3-5 de la ERC disminuyó del 5,1% al 3,8% al utilizar esta nueva ecuación [14].
En resumen:
Aunque la TFG estimada basada en la creatinina (TFGe) se sigue sugiriendo como primera aproximación en adultos con riesgo de ERC, las nuevas directrices promueven el uso de la combinación de la TFGe basada en la creatinina sérica y la cistatina C (TFGecr-cys) cuando se requiere más precisión. El CKD-Prognosis Consortium (CKD-PC) ha demostrado que el eGFRcr-cys es superior para distinguir los estadios de riesgo de ERC [65], y más preciso que el FG medido en situaciones clínicas de discordancia entre ambos marcadores de filtración El eGFRcr-cys debería considerarse como mínimo en situaciones en las que la TFGe a partir de la creatinina sérica por sí sola puede estar sujeta a errores (por ejemplo, sarcopenia/pérdida muscular, dietas especiales, enfermedad grave) y/o cuando se necesita una mayor precisión para la toma de decisiones clínicas (por ejemplo, fármacos con un índice terapéutico estrecho o de alta toxicidad). Sin embargo, el acceso a las pruebas de cistatina C, los costes y el tiempo de respuesta en el mismo día son algunos de los retos que plantea su aplicación. Las situaciones en las que la cistatina C es menos fiable (por ejemplo, un alto recambio celular en hematología) aún no están plenamente documentadas.
Albuminuria
La albuminuria (también se emplea proteinuria indistintamente al aumentar la magnitud de perdida proteica en orina) es el principal factor modificable que influye decisivamente en el pronóstico y en la toma de decisiones clínicas. Tiene un efecto tóxico renal directo, induce inflamación y fibrosis tubulointersticial, y contribuye a la perdida de la masa nefronal. Asimismo, debe considerarse una manifestación de daño endotelial difuso, siendo una indicación de prácticas renoprotectoras y de modificación de factores de riesgo cardiovascular [10] [70] [71] [72] [73] [74] [75] [76] [77] [78] [79].
Los adultos sanos eliminan menos de 150 mg de proteínas y menos de 30 mg de albúmina en la orina cada día. Determinadas situaciones, como la presencia de fiebre, ingesta elevada de proteínas, insuficiencia cardiaca, hematuria, menstruación, ejercicio físico o las infecciones urinarias, pueden producir elevación de la albuminuria, que se resuelve después de la desaparición del factor causante.
La recolección de orina de 24 horas se considera el patrón oro en la medición de la albuminuria, pero es difícil garantizar su recogida completa. La determinación simultánea de creatinina en la muestra de orina permite establecer el cociente albumina o proteínas totales/creatinina (uACR), que presenta una buena correlación con la eliminación en 24 horas. Tanto en adultos como en niños se recomienda la determinación de este cociente en muestra aislada de orina [1] [7] [10]. El screening poblacional [80] con tiras reactivas solamente está indicado en pacientes con riesgo de ERC. Si la proteinuria es negativa o solo trazas está indicado determinar el cociente albúmina/creatinina en muestra aislada de orina y de verificarse positivo está indicada una medición cuantitativa en laboratorio. Si la proteinuria es negativa o solo trazas está indicado determinar el cociente albúmina/creatinina en muestra aislada de orina y de verificarse positiva está indicada una medición cuantitativa en laboratorio. El rango de excreción de albúmina que se extiende entre 30 y 300 mg/24 horas (20-200 ug/min) se conoce clásicamente como microalbuminuria, siendo sustituido más recientemente por "albuminuria moderadamente elevada". Estos límites comprenden el rango que va desde el nivel superior de la excreción urinaria normal hasta el nivel de detectabilidad inequívoca de las tiras detectoras de proteinuria. Este rango de albuminuria persistente durante >3 meses es un factor de riesgo de deterioro renal progresivo, así como de eventos cardiovasculares adversos.
Por todo ello, en el mapa de riesgo básico descrito en las Guías KDIGO 2013 [Tabla 2] [1] [7] [10] [13] se analizan los tres grados de albuminuria, con los 6 grados de FG, como el mejor predictor de riesgo de ERC. Asimismo, con ello podemos decidir seguimiento, tratamiento o remisión a Nefrología entre otras muchas cosas.
CLÍNICA DE LA ENFERMEDAD RENAL CRONICA
Cuando la función renal está mínimamente alterada (TFG 70-100% del normal), la adaptación es completa y los pacientes no tienen síntomas urémicos. A medida que la destrucción de las nefronas progresa, disminuye la capacidad de concentración del riñón y aumenta la diuresis para eliminar la carga obligatoria de solutos. La poliuria y la nicturia son los primeros síntomas.
Cuando la TFG cae por debajo de 30 ml/min aparecen progresivamente los síntomas que conforman el síndrome urémico: anorexia y náuseas, astenia, déficit de concentración, retención hidrosalina con edemas, parestesias, prurito e insomnio. Como vemos, los síntomas son inespecíficos pudiendo ser causados por otra enfermedad intercurrente. Cuando la enfermedad renal evoluciona muy lentamente, hay enfermos que se mantienen prácticamente asintomáticos hasta etapas terminales, con TFG incluso de 10 ml/min o menos.
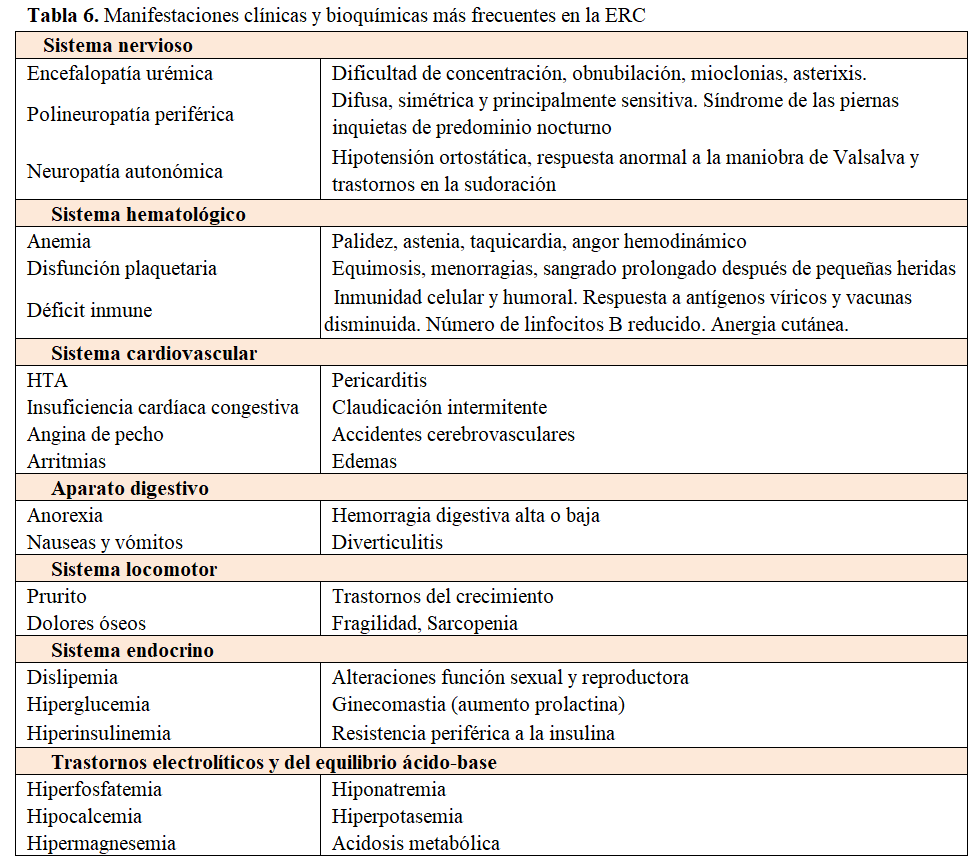
Las manifestaciones clínicas y bioquímicas más características, agrupadas por aparatos y sistemas, se representan en la (Tabla 6). Véase también Síndromes Clínicos
La ERC puede llevar a una serie de complicaciones graves que afectan la calidad de vida y aumentan el riesgo de mortalidad. Estas complicaciones incluyen:
• Anemia: La disminución de la producción de eritropoyetina puede causar anemia, lo que contribuye a la fatiga y debilidad. Véase Anemia en la ERC
• Enfermedad Ósea: Los riñones juegan un papel importante en el metabolismo del calcio y el fósforo y la vitamina D. La ERC puede alterar este equilibrio, lo que puede llevar a la enfermedad ósea, hiperfosfatemia, déficit de vitamina D, hiperparatiroidismo y riesgo de fracturas. Véase Alteraciones del Metabolismo Mineral en la ERC
• Hipertensión Arterial: La ERC y la hipertensión a menudo coexisten y se agravan mutuamente. La hipertensión no controlada puede acelerar la progresión de la ERC y aumentar el riesgo de enfermedad cardiovascular.
• Enfermedad Cardiovascular: Las personas con ERC tienen un mayor riesgo de desarrollar enfermedad cardiovascular, incluyendo enfermedad coronaria, insuficiencia cardíaca y accidente cerebrovascular.
• Trastornos Neurológicos: La acumulación de toxinas en la sangre debido a la disminución de la función renal puede afectar el sistema nervioso, causando problemas de memoria, dificultad para concentrarse, confusión e incluso convulsiones
• Fragilidad: Es un estado de transición de un individuo saludable, pero vulnerable, a un estado de discapacidad (dificultad de las personas para llevar a cabo sus actividades esenciales, dependencia, no autocuidado, pérdida funcional, institucionalización). Es un proceso biológico, naturalmente ligado al envejecimiento, aunque su vinculación con la edad cronológica de la persona es más bien relativa. Su seña de identidad es la sarcopenia, definida como la pérdida de masa y fuerza muscular, con descenso de las reservas y de la resistencia al estrés. La ERC se asocia directamente a un estado de fragilidad progresiva. Existen varias escalas para medir la fragilidad, siendo estos criterios predictores sensibles de efectos adversos tales como deterioro cognitivo, caídas con fracturas, sedentarismo, complicaciones cardiovasculares y finalmente hospitalización y muerte.
Véase Fragilidad y Sarcopenia en la Enfermedad Renal Crónica
DIAGNOSTICO DE LA ENFERMEDAD RENAL CRONICA
Deben aplicarse los preceptos generales de la práctica de la medicina interna. El diagnóstico de insuficiencia renal aguda y sus criterios diferenciales se abordan en el apartado correspondiente. (Véase Insuficiencia Renal Aguda).
Historia Clínica
Debe prestarse atención especial a la sintomatología urinaria como nicturia, poliuria, polidipsia, disuria o hematuria. También hay que obtener una historia completa de enfermedades sistémicas, exposición a tóxicos renales, infecciones y posibles antecedentes familiares de enfermedad renal.
Exploración física
Debe registrarse el peso, la talla, y posibles malformaciones y trastornos del desarrollo. Obviamente, es importante tomar la tensión arterial, el examen del fondo de ojo, la exploración del sistema cardiovascular y del tórax, y la palpación abdominal buscando masas o riñones palpables con contacto lumbar. En hombres es imprescindible el tacto rectal para examinar la próstata. En las extremidades pueden verse signos de edema y debe explorarse el estado de los pulsos periféricos.
Parámetros bioquímicos
Además de evaluar la función renal y la albuminuria como ecuaciones de riesgo principales; se deben valorar otros parámetros en función de las patologías asociadas, las causas de ERC y los factores de riesgo. Estos análisis deben incluir, si procede, test orientativos de enfermedades glomerulares y sistémicas que afectan el riñón.
Alteraciones del sedimento urinario
Los hematíes dismórficos y/o cilindros hemáticos (glomerulonefritis proliferativas, vasculitis), cilindros leucocitarios (pielonefritis o nefritis intersticiales), lipídicos (patologías proteinúricas), células tubulares renales o cilindros granulares y céreos son indicadores de la presencia de lesión renal.
Test genéticos
Estas herramientas diagnósticas van ganando protagonismo, especialmente en el reconocimiento de causas genéticas que pueden estar presentes sin la clásica historia familiar. En general, el rendimiento diagnóstico de las pruebas basadas en secuenciación masiva paralela en pacientes con enfermedad renal crónica (ERC) es del 30% en los casos pediátricos y del 6-30% en los casos de adultos [81] [82].
DIAGNOSTICO POR IMAGEN
Ecografía
Prueba obligada en todos los casos para comprobar en primer lugar que existen dos riñones, medir su tamaño, analizar su morfología y descartar la obstrucción urinaria (Véase Ecografía en la enfermedad renal)
Los riñones pequeños (por debajo de 9 cm, según superficie corporal) indican cronicidad e irreversibilidad. Unos riñones de tamaño normal favorecen el diagnóstico de un proceso agudo. Sin embargo, la poliquistosis renal, la amiloidosis o la DM pueden cursar con riñones de tamaño normal o aumentado.
Si los riñones presentan una diferencia de tamaño superior a 2 cm, ello puede ser debido a patología de la arteria renal, reflujo vesicoureteral o diversos grados de hipoplasia renal unilateral.
Eco Doppler
Es la primera exploración renal por imagen en cualquier tipo de enfermos. En manos experimentadas es el primer escalón diagnóstico de la estenosis uni o bilateral de arteria renal.
Doppler duplex
Tiene la ventaja de proporcionar datos anatómicos y funcionales de las arterias renales. La visualización directa de la arteria renal (modo B) se combina con la medida (doppler) del flujo sanguíneo y de sus características.
Urografía intravenosa
No indicada para el diagnóstico de la ERC, puesto que la información que proporciona es limitada al no eliminarse contraste, siendo éste además nefrotóxico, pudiendo precipitar la entrada en diálisis. Ha ido cayendo en desuso con las prestaciones de la ecografía.
Angiografía digital
El patrón oro para el diagnóstico de las enfermedades vasculares renales es la arteriografía, pero tiene el inconveniente de la toxicidad del contraste.
La primera exploración en estos momentos en cualquier tipo de pacientes es la realización de un doppler y posteriormente si la función renal es normal, se puede indicar un angioTAC o una angiorresonancia magnética, según la experiencia de cada centro.
Angio-TAC o Scanner helicoidal: Su mayor ventaja es la administración de contraste por vía intravenosa, que permite visualizar el calibre de la luz y las características de la pared arterial en tres dimensiones. Su limitación es la toxicidad del contraste en paciente con insuficiencia renal.
Angiorresonancia magnética
Es una técnica cada vez más utilizada en pacientes con función renal normal y no recomendada en pacientes con insuficiencia renal grado 3-4, dada la toxicidad del gadolinio (Véase Fibrosis sistémica nefrogénica).
Angiografía con CO2
Obvian la toxicidad por contraste, pero hay que tener presente, por ser un procedimiento arterial, el riesgo de enfermedad ateroembólica en pacientes con arteriopatía periférica.
Técnicas modernas de angiorresonancia con intensificación de imagen ofrecen excelente información del árbol vascular sin necesidad de emplear gadolinio.
BIOPSIA RENAL
Se realiza en casos seleccionados para determinar la causa subyacente de la ERC. Es un procedimiento invasivo y no exento de riesgo, indicado cuando existen dudas diagnosticas de la enfermedad renal primaria o del grado de cronicidad del daño tisular. Hay que valorar sus posibles riesgos, frente a los beneficios potenciales de la información que nos puede proporcionar. Si se efectúa en etapas precoces de la ERC su información puede ser útil. En fases avanzadas a menudo nos encontraremos con riñones esclerosados y terminales y no se debe hacer. Es pues una decisión que ha de ser compartida considerando el riesgo/beneficios. Es importante considerar que esperando los resultados puede retrasarse demasiado el inicio de tratamiento
Las potenciales indicaciones, contraindicaciones y riesgos de la biopsia renal se describen en el siguiente enlace: Biopsia Renal
PROGRESIÓN DE LA ERC
Definición de progresión
La monitorización de la progresión de la ERC, básicamente, debe realizarse con las tasas de progresión de la TFG, y uACR (Tabla 2). Asimismo, debe prestarse especial atención a las comorbilidades, destacando la DM, la HTA, la enfermedad cardiovascular y la dislipemia
Se considera una tasa de progresión renal normal a un descenso de 0,7-1 mL/min/1,73 m2/año a partir de los 40 años [8] y como ya hemos comentado existe debate acerca de si esta tasa de progresión relacionada con la edad es normal o patológica
Se puede considerar progresión del daño renal si presenta un descenso confirmado de la TFG > 5 mL/min/1,73 m2/año o > 10 mL/min/1,73 m2 en 5 años (una vez descartados deterioros funcionales y agudos de la función renal). Asimismo, un porcentaje de cambio de la TFG respecto a la situación basal > 25%, una vez descartados factores funcionales, es otro criterio de progresión.
Se considera progresión acelerada de la ERC a una disminución de más del 25% de la TFG o un descenso sostenido de la TFG≥ 15 mL/min/1,73m2 en un año.
Respecto al cociente uACR se considera relevante un incremento de más del 50% respecto a la situación basal [21] [83] [84].
A partir de un análisis amplio de pacientes, se ha construido una calculadora para estimar el riesgo de inicio de TSR, eventos cardiovasculares y muerte: http://ckdpcrisk.org/lowgfrevents/ [83].
En individuos con cociente uACR basal >300 mg/g, una disminución del 30% en el cociente uACR durante dos años confiere una reducción absoluta de más del 1% en el riesgo a 10 año de necesidad de tratamiento sustitutivo renal (TSR) [84].
La iniciación de terapias hemodinámicamente activas, como los inhibidores de la enzima convertidora de angiotensina (IECA), los bloqueadores de los receptores de angiotensina II (ARA II), los antagonistas no esteroideos del receptor de mineralocorticoides (nsMRA), los agonistas del receptor de GLP-1 (GLP-1ra) y los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2), resulta en disminuciones transitorias y a corto plazo de la TFG estimada (eGFR) en un rango del 10% al 30%. La Guía KDIGO 2024 [1] sobre ERC recomienda revisar las causas subyacentes y realizar un control cercano en pacientes que presenten reducciones de la eGFR superiores al 30% durante los primeros 3 meses de tratamiento con estos agentes. Sin embargo, los profesionales deben evitar la tentación de suspender estos fármacos protectores del riñón, especialmente porque estas disminuciones iniciales suelen ser reversibles y no indican toxicidad del medicamento, más aún, considerando que los beneficios clínicos potenciales son considerables [8] [12] [15] [19] [85] [86] [87]. Asimismo, existe una amplia evidencia de que los pacientes con ERC padecen mayor riesgo cardiovascular, lo que se explica en parte por los factores de riesgo tradicionales (HTA, síndrome metabólico, DM, dislipemia, etc.) más los propios efectos del estado urémico. Por lo tanto, además de las medidas para retrasar la progresión de la ERC, hay dos áreas de actuación fundamentales en el manejo de estos enfermos: 1) Prevención de las complicaciones propias del estado urémico, y 2) Manejo de los trastornos metabólicos asociados al daño renal y cardiovascular que ocurre con frecuencia en estos pacientes.
Mecanismos de progresión de la ERC
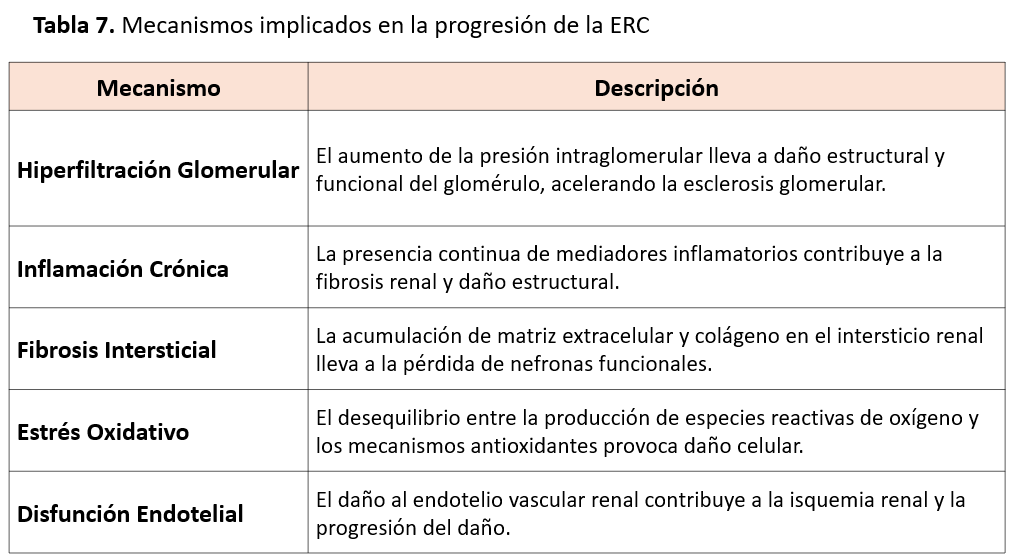
La progresión de la ERC es un proceso complejo que involucra varios mecanismos fisiopatológicos. Estos mecanismos pueden actuar de manera independiente o sinérgica, acelerando el deterioro de la función renal. A continuación, se describen los principales mecanismos implicados [88] (Tabla 7).
1.- Hiperfiltración glomerular
La capacidad de los riñones para aumentar la TFG en respuesta a ciertos estímulos bajo condiciones fisiológicas o patológicas se denomina reserva funcional renal (RFR). Gracias a los mecanismos adaptativos, la RFR puede utilizarse parcial o completamente para alcanzar una función renal normal o por encima de lo normal como en el embarazo, hipertensión, nefropatía diabética, riñones únicos o dietas hiperproteicas.
Una TFG por encima de lo normal se denomina hiperfiltración y forma parte de los mecanismos fisiopatológicos implicados en el desarrollo y progresión de la ERC, siendo objeto de intenso estudio desde que fuera descrito por Brenner B en 1996 [89]. El aumento patológico de FG explicaría la progresión de la insuficiencia renal y el daño estructural glomerular en pacientes con reducción del número de nefronas funcionantes [90] [91]. Datos experimentales han demostrado que estados con masa renal reducida conducen a una esclerosis glomerular de las nefronas funcionantes. Este fenómeno se puede acelerar mediante dietas hiperproteicas. La reducción en el número de nefronas condiciona una hiperfiltración en las nefronas intactas, con una disminución de la resistencia en arteriola aferente, aumento del flujo plasmático renal, de la presión glomerular y de la TFG. De todo ello resultan cambios funcionales y estructurales en el endotelio, el epitelio y las células mesangiales, que provocan microtrombosis, microaneurismas, expansión del mesangio glomerular y posterior esclerosis glomerular. La obesidad y la DM son situaciones de hiperfiltración con masa renal normal [90].
2.- Inflamación crónica
La inflamación persistente en el tejido renal estimula la liberación de citocinas y factores de crecimiento que promueven la fibrosis y cicatrización, afectando la arquitectura renal normal.
3. Fibrosis Intersticial
La fibrosis es el resultado final común de muchas enfermedades renales crónicas. Implica la acumulación de matriz extracelular que sustituye el tejido renal funcional, contribuyendo a la disfunción progresiva.
4. Estrés Oxidativo
El aumento en la producción de especies reactivas de oxígeno (ROS) y la disminución de la capacidad antioxidante celular provoca daño oxidativo a las células renales, acelerando la progresión de la enfermedad.
5. Disfunción Endotelial
El endotelio dañado pierde su capacidad de regular el tono vascular, lo que resulta en isquemia y daño adicional a los tejidos renales.
6. Activación del Sistema Renina-Angiotensina-Aldosterona (SRAA):
Este sistema regula la presión arterial y el equilibrio de sodio, pero su activación crónica contribuye a la hipertensión y fibrosis, empeorando la progresión de la ERC.
7. Proteinuria Persistente
La presencia de proteínas en la orina indica daño glomerular y también es nefrotóxica para los túbulos, provocando inflamación y fibrosis tubular
MANEJO GLOBAL
Básicamente, el manejo de estos enfermos se asienta en los siguientes pilares:
¿Cuándo enviar un paciente al nefrólogo?
Véase Pautas de derivación a la consulta ERCA (https://www.nefrologiaaldia.org/es-articulo-pautas-de-derivacion-a-la-unidad-de-enfermedad-renal-cronica-avanzada--374)
Véase Documento de información y consenso para la detección y manejo de la ERC. NEFROLOGIA 2021
Numerosos trabajos han destacado que la derivación precoz al nefrólogo mejora el manejo del paciente en la etapa prediálisis y aporta beneficios en términos de morbilidad y mortalidad una vez que ha iniciado tratamiento renal sustitutivo (TRS).
Un riesgo de fallo renal terminal a los 5 años puede ser usado para determinar la derivación al nefrólogo, junto a datos clínicos como el TFG estimado y la albuminuria, además de otras consideraciones clínicas [1] [7] [8] [12] [92] [93] [94] [95] [96]. El Documento de Consenso [97] elaborado conjuntamente por la Sociedad Española de Nefrología (SEN) y la Sociedad Española de Medicina Familiar y Comunitaria (semFYC) presenta una propuesta con criterios unificados y concisos de definición, derivación y manejo de la ERC, promoviendo una estrecha colaboración y coordinación entre Atención Primaria y Nefrología.
La (Tabla 2) ilustra el riesgo de progresión y los criterios de derivación al nefrólogo en función del daño renal basado en la TFG y la albuminuria. Las circunstancias y acciones para la derivación a nefrología están en la (Tabla 8).
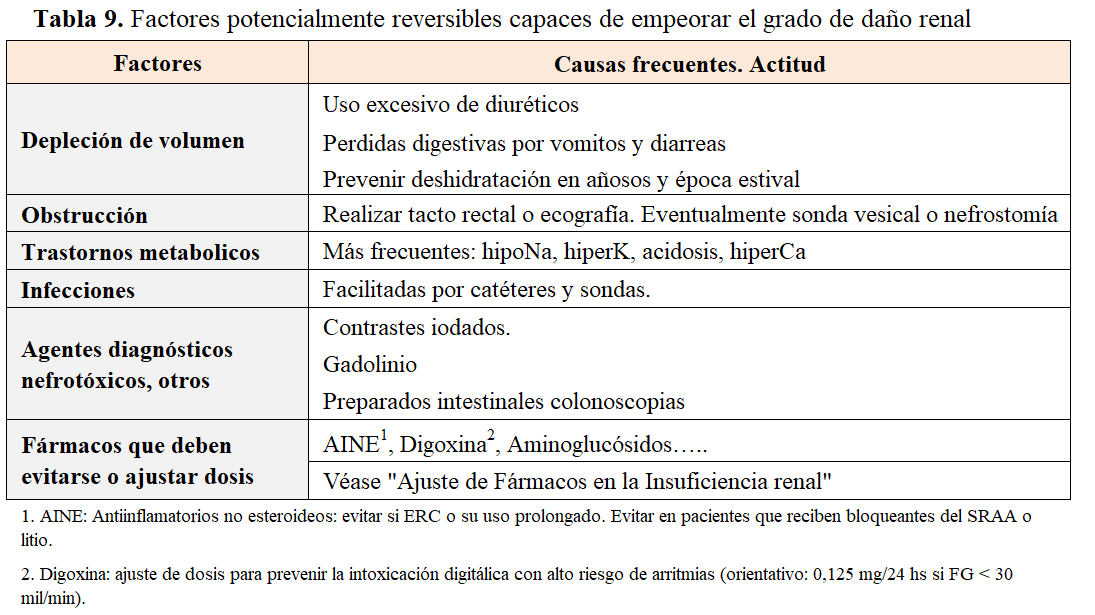
Actitud ante factores evitables o reversibles
Existen factores que aceleran el deterioro renal independientemente del ritmo de progresión propio de la ERC. Siendo muchos de estos factores reversibles, es imprescindible reconocerlos y corregirlos. Deben emplearse los fármacos estrictamente necesarios, en las dosis e intervalos adecuados, y durante el tiempo necesario. Si es imprescindible su empleo, hidratar adecuadamente al paciente y ajustar dosis al FG.
Debe tenerse en cuenta especialmente los factores que se ilustran en la (Tabla 9).
Nefropatía por contraste: es importante considerar que el paciente con ERC no debe ser excluido de estudios que resulten de ayuda para su mejoría evaluando eso sí los riesgos y beneficios de forma individualizada. Por tanto, considerar la indicación de los estudios de imagen de acuerdo con las indicaciones generales para la población. Mayor riesgo en pacientes diabéticos y/o FG< 60 mil/min.
En general se recomienda seguir las guías de las sociedades radiológicas. Ante el riesgo de nefropatía asociada a contraste, se sugiere (Véase Consensus Guidelines for the Prevention of Contrast Induced Nephropathy)
Sí FG > 60 ml/min, se considera bajo riesgo de nefropatía por contraste y no precisa profilaxis.
Sí FG < 60 ml/min, es preferible la realización de un Angio-TAC con medidas preventivas. Es importante hidratar bien al paciente (NaCl 0,9% NaHCO3) y utilizar contraste radiológico no iónico o iso-osmolar. Considerar asociar n-acetilcisteína, aunque sus beneficios adicionales no están contrastados en amplios metaanálisis. Suspender diuréticos 4-6 días antes. Asegurar adecuada hidratación
• Gadolinio: Para las personas con FG <30 ml/min por 1,73 m2 (ERC G4-G5) que requieren medios de contraste que contienen gadolinio, ante el riesgo de desarrollar fibrosis sistémica nefrogénica, ofrecerles preferentemente medios de contraste con gadolinio de los grupos II y III de la American Colleage of Radiology.(gadobenato dimeglumine (Multihance), gadoterate meglumine (Dotarem), gadobutrol (Gadovist) egadoteridol (ProHance), gadoxetato disódico (Eovist o Primovist).
• Los preparados intestinales ricos en fósforo antes de colonoscopias deben evitarse o usar con cautela [98].
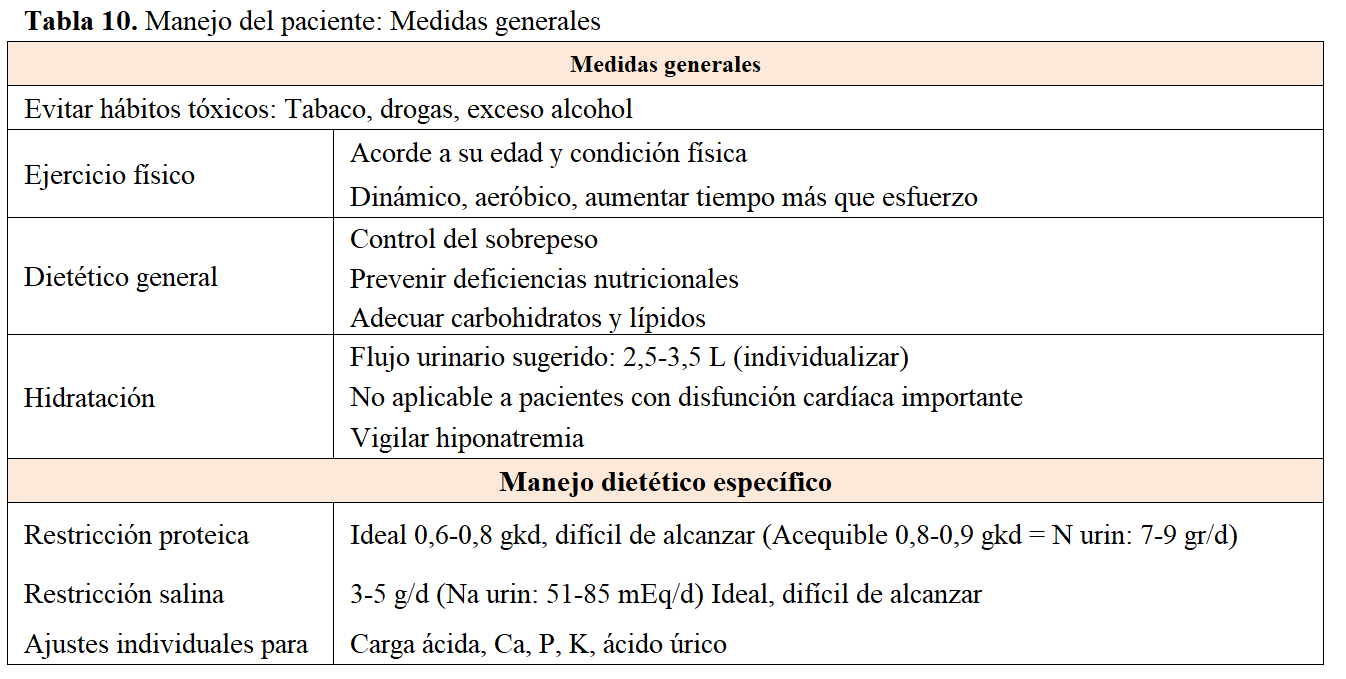
Medidas generales
Antes del manejo dietético y farmacológico específico de la HTA y la proteinuria, debe hacerse hincapié en unas premisas que, aunque obvias y repetidas, no deben dejar de prescribirse y vigilarse (Tabla 10). Estas recomendaciones han sido actualizadas en las guías KDIGO recientes, sin mayores cambios [1].
Evitar hábitos tóxicos: abstinencia de tabaco y drogas. Una ingesta moderada de alcohol se considera tolerable: 12-14 gr de etanol (300 cc cerveza o 150 cc de vino) [99].
Ejercicio físico: Como norma general, se recomienda realizar 30-60 minutos de ejercicio moderado de 4 a 7 días por semana con una duración acumulada de al menos 150 minutos por semana [99] o a un nivel compatible con tolerancia física y cardiovascular. Esta sugerencia es especialmente importante en individuos son exceso de peso. Ejercicio aérobico y dinámico, aumentando progresivamente el tiempo más que el esfuerzo.
(Véase Ejercicio Físico en la ERC)
Manejo nutricional
Debe prevenirse el déficit nutricional con dieta balanceada y rápida intervención ante estados catabólicos (véase manejo nutricional en la ERC). Se recomiendan dietas saludables y diversas con un mayor consumo de alimentos de origen vegetal en comparación con los de origen animal y un menor consumo de alimentos ultraprocesados; reducción moderada de la ingesta proteica y salina. No restringir la ingesta de proteínas en niños con ERC debido al riesgo de alteraciones del crecimiento. En adultos mayores con afecciones subyacentes como fragilidad y sarcopenia, considerar objetivos dietéticos proteicos y calóricos más elevados, con asesoramiento de especialistas en nutrición (https://www.nefrologiaaldia.org/es-articulo-nutricion-en-la-enfermedad-renal-cronica-220) [100].
Hay que destacar que estas dietas no solo son beneficiosas para la ERC sino para muchas de sus complicaciones como acidosis, hiperpotasemia, hiperfosfatemia. Asimismo, debe ajustarse la ingesta de hidratos de carbono y lípidos al estado metabólico individual.
Se considera relevante evitar el sobrepeso en esta población para prevenir la hiperfiltración glomerular y el desarrollo de proteinuria.
Hidratación y volumen de orina: Debe asegurarse una adecuada ingesta líquida especialmente en pacientes añosos y en épocas estivales. Alcanzar una diuresis de 2-3 litros al día, o incluso mayor, es una propuesta razonable y adecuada. Esta medida se aplica con más evidencia en pacientes con poliquistosis renal. Esta recomendación debe aplicarse con cautela e individualizarse: en caso de pacientes en riesgo de fallo cardíaco, las medidas de hidratación deben aplicarse con cautela, advirtiendo al paciente de los riesgos de retención hidrosalina [101] [102]
Véase Hidratación en la Enfermedad Renal Crónica.
No es aplicable a pacientes con síndrome cardiorrenal, con riesgo de retención hidrosalina e insuficiencia cardiaca congestiva.
Un análisis detallado de las alteraciones y del manejo nutricional en la ERC se desarrollan en los siguientes enlaces:
Manejo farmacológico
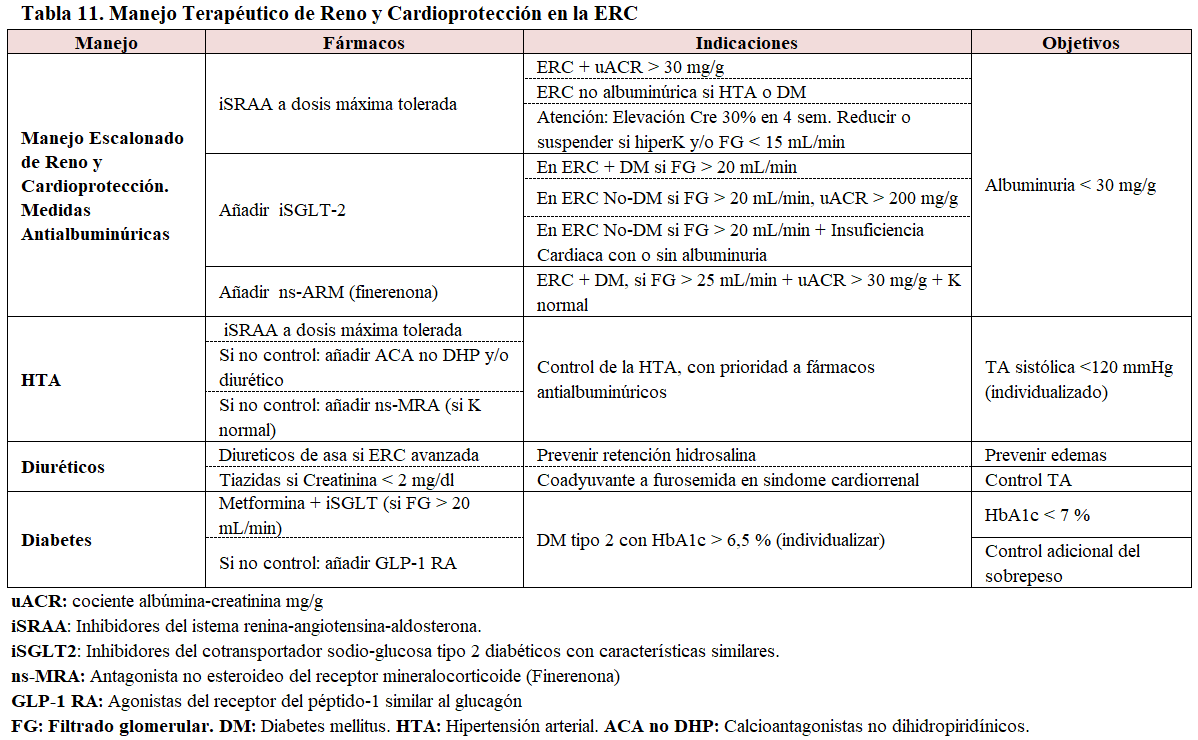
El manejo con fármacos de la ERC y patologías asociadas se resume en la (Tabla 11) y (Tabla 12). La progresión de la ERC está condicionada en gran medida por factores hemodinámicos y metabólicos, más allá de la enfermedad renal primaria. Las medidas farmacológicas se basan en fármacos antiproteinúricos y antihipertensivos, más el control de patologías directamente relacionadas como la DM, dislipemia, hiperuricemia, acidosis y de otros factores de riesgo cardiovasculares.
Medidas renoprotectoras
Inhibidores del Sistema Renina-angiotensina-aldosterona (iSRAA)
Los agentes bloqueantes o inhibidores SRAA incluyen los inhibidores de la enzima de conversión de la angiotensina (IECA) y los antagonistas de los receptores de la angiotensina 2 (ARA2). Tienen propiedades reno y cardioprotectoras, además de su acción antihipertensiva. Indicados aún en ausencia de HTA. Son especialmente eficaces en nefropatías proteinúricas, Reducen la presión intraglomerular y, como consecuencia, la proteinuria un 30-40 %; siendo la nefropatía diabética el caso más paradigmático [1] [15] [72] [87] [89] [97] [103] [104] [105] [106] [107] [108] [109] [110] [111] [112] [113]:
• Son el primer escalón terapéutico en pacientes con ERC proteinúrica (> 30 mg/24 hs) y no proteinúrica si HTA o DM [1].
• IECA y ARA2 son igualmente efectivos, pero los IECA pueden causar tos.
• Se recomienda la dosis máxima tolerada pudiendo intentarse dosis supraterapéuticas en casos de proteinuria resistente [97]
• Evitar la combinación IECA+ARA2.
• Más efectivos en pacientes con diuréticos y dieta hiposódica. La dieta rica en sal reduce su efecto antiproteinúrico [97].
• Contraindicados en pacientes con estenosis bilateral de la arteria renal o con lesiones vasculares distales graves.
• Es dudoso el efecto renoprotector en casos de ERC avanzada.
• Se tolera un aumento de creatinina hasta un 30% tras el inicio del tratamiento.
• Conllevan el riesgo de hiperpotasemia. Discreto incremento de los niveles séricos de K (hasta 6 mEq/L). Dada su eficacia, deben intentarse las medidas "antipotasio", antes de reducir o suspender el fármaco.
• Deben suspenderse en caso de sospecha o riesgo de embarazo.
Inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2)
Actúan inhibiendo la reabsorción de glucosa en el túbulo proximal. Retrasan la progresión de la ERC y reducen las complicaciones cardiovasculares, por lo que se añade su indicación en pacientes sin DM. No provocan hipoglucemia, inducen pérdida de peso y ligeros descensos de la presión arterial.
Sus indicaciones se puntualizan en las recientes Guías KDIGO [1], brevemente:
Pacientes con DM-2 + ERC (si TFG > 20 mL/min) + uACR > 200 mg/g
Pacientes con ERC (si TFG > 20 mL/min) + uACR >200 mg/g o insuficiencia cardiaca con o sin albuminuria
Pacientes con ERC (TFG 20-40 mL/min) + insuficiencia cardiaca con o sin albuminuria
En pacientes con DM-2 estan indicados como primera línea terapéutica en combinación con la Metformina, si TFG > 20 mL/min.
La dapagliflozina [114] y la empaglifozina [115] han demostrado efectos renoprotectores en la ERC no solo en pacientes con DM-2, sino también en pacientes con ERC no diabética [116].
No se recomienda su uso concomitante con diuréticos en situaciones de depleción de volumen (por ejemplo, gastroenteritis aguda), ni en personas mayores de 75 años.
Efectos adversos: Su uso se asocia a un incremento de infecciones urinarias y de micosis genital. Provocan diuresis osmótica pudiendo causar deshidratación, hipotensión y deterioro de la función renal, especialmente en ancianos o en pacientes con fármacos antihipertensivos.
Medicación antihipertensiva
No entra dentro de los objetivos de estas guías la revisión exhaustiva de la medicación antihipertensiva (Véase HTA esencial) [112] [113].
A continuación, resumimos los conceptos básicos del manejo antiHTA de estos pacientes:
• Objetivo de TA: < 120 mmHg. 120/80 si DM o Proteinuria. Tolerar hasta 150/90 mmHg si añoso y rigidez vascular
• Primer escalón terapéutico: iSRAA si no hay efectos adversos o contraindicaciones a dosis máxima tolerada.
• Segundo escalón: calcioantagonistas no-dihidropiridínicos por sus potenciales efectos adicionales antiproteinúricos.
• Tercer escalón: antagonistas no esteroideos de los receptores de mineralocorticoides (ns-MRA)
Otros fármacos antiHTA:
• ß bloqueantes: indicados en casos de insuficiencia cardiaca, enfermedad coronaria y miocardiopatía hipertrófica. Tendencia a la bradicardia. No recomendadaa la asociación con betabloqueantes ante el riesgo de bradicardia.
• α bloqueantes: Riesgo de hipotensión ortostática. Útiles en caso de hipertrofia prostática.
• Inhibidores de la renina (aliskiren): No recomendados por efectos adversos al asociarlos con bloqueantes del SRAA, sin beneficios adicionales, por lo que no están recomendados en esta población.
Diuréticos
• Diuréticos del asa (furosemida, torasemida) preferidos en la ERC. Véase Diuréticos y alteraciones electrolíticas
• Los diuréticos tiazídicos son inefectivos si creatinina >2 mg/dl. Pueden potenciar el efecto diurético de los diuréticos de asa en casos de síndrome cardiorrenal y retención hidrosalina.Véase síndrome cardiorrenal
Antagonistas esteroideos del receptor mineralocorticoide (MRA): Espironolactona, eplerrenona
Tercera linea en el tratamiento de la insuficiencia cardiaca, hiperaldosteronismo e HTA refractaria. Riesgo de hiperpotasemia y descenso reversible de la TFG. Efecto antiproteinúrico.
No recomendables en estadios 3-5 ERC por el riesgo de hiperpotasemia, especialmente si se asocian a iSRAA y/o betabloqueantes.
Antagonista no esteroideo del receptor mineralocorticoide (ns-MRA): Finerenona
Ha demostrado efecto renoprotector y cardiovascular. Recomendado en pacientes con DM-2, TFGe ? 25 ml/min/1.73m2, y uACR › 30 mg/g. Riesgo de hiperpotasemia. Pueden ser añadidos en casos de resistencia, a un inhibidor del SRAA y un iSGLT2, para el tratamiento de pacientes adultos diabéticos, con ERC [1] [117].
Activadores del receptor de vitamina D
Actualmente, la información disponible es insuficiente para aconsejar el empleo de la vitamina D nativa o sus derivados como fármacos antiproteinúricos [118].
Manejo de la DM
Véase fármacos antidiabéticos orales e insulina
El Documento de Consenso sobre el tratamiento de la DM2 en la ERC [46] y las Guías: KDIGO 2022 [42] proporcionan información completa del manejo de la DM en la ERC.
Resumen [1] [42] [46]:
Los valores séricos de HbA1c son el parámetro de referencia para el control a largo plazo de la glucemia. Idealmente deben mantenerse niveles de HbA1C < 7%. Se pueden tolerar valores hasta 8,5% en enfermos con riesgo de hipoglucemias. El riesgo de hipoglucemia es más elevado en pacientes con DM y ERC, dado que tanto la insulina, como los antidiabéticos orales (ADO) son mayoritariamente de eliminación renal, las dosis deben reducirse con la progresión de la ERC.
• Medidas generales: modificaciones del estilo de vida para optimizar la nutrición, el ejercicio físico, abandono del tabaco y control del peso corporal.
• Medidas antiproteinúricas: Se recomienda el tratamiento con iSRAA + iSGLT2 en pacientes con DM, HTA y albuminuria, escalando hasta la máxima dosis aprobada que sea tolerada y respetando el rango de TFG recomendado.
Ns-MRA (Finerenona: es recomendado en pacientes con DM-2, TFGe > 25 ml/min/1.73m2, normopotasemia y persistencia de albuminuria (uACR > 30 mg/g) a pesar del empleo de dosis máximas toleradas de inhibidores del SRA.
Control de la Glucemia
DM tipo 1: el control de la glucemia se basa en la insulina. Su empleo es seguro en todos los estados de fallo renal, aunque requier reducción de dosis conforme progresa la ERC. Pacientes con HbA1c >8,5% o hiperglucemia sintomática a pesar de empleo de ADO, tienen indicación de insulinización. Se recomienda el uso de insulina de acción larga (glargina, detemir o NPH) para los requerimientos basales, con la adición de insulina de acción rápida antes de las comidas si es necesaria. Los análogos basales (glargina, detemir) y rápidos (aspart, lispro, glulisina) inducen menos hipoglucemias que las insulinas humanas (NPH o regular). En algunos pacientes, con horarios de comidas muy regulares, pueden utilizarse las insulinas premezcladas. Hay que destacar que no existen pautas fijas de insulinoterapia y que todas las guías de práctica clínica recomiendan la individualización y contar con el apoyo de un experto para los casos de DM de difícil control.
DM tipo 2: se recomienda iniciar con metformina (biguanida) cuando el TFGe > 30 ml/min/1.73m2, con ajuste de dosis cuando el TFGe < 45 ml/min/1.73m2. Ante el riesgo de acidosis láctica debe usarse con precaución en pacientes con FG entre 30-45 ml/mn (reducir dosis 50%) y evitarse por debajo de esos valores [119]. Debe suspenderse temporalmente ante circunstancias que pongan en riesgo la función renal (vómitos, diarrea, radiocontrastes, cirugía mayor).
DM tipo 2 y ERC:
Primera línea: metformina cuando TFGe > 30 ml/min/1.73m2 e iSGLT2 si FG> 20 mL/min/1,73).
Segunda línea: cuando no se alcanzan los objetivos con metformina + iSGLT2, añadir agonistas del receptor GLP-1 RA
Agonistas del receptor del péptido-1 similar al glucagón (GLP-1 RA)
Son los únicos ADO que inducen pérdida de peso, por lo que están más indicados en pacientes con sobrepeso; no inducen hipoglucemia, pero tienen potenciales efectos gastrointestinales adversos [1] [120]. Indicados en segunda línea para pacientes que no han alcanzado los objetivos de glucemia a pesar del uso de metformina e iSGLT2, o intolerantes a estos tratamientos. Han demostrado reducción de eventos cardiovasculares, prevención de macroalbuminuria y caída más lenta de la TFG. Los GLP-1 RA comercializados en España que han demostrado beneficios renales (liraglutida, semaglutida y dulaglutida) se pueden administrar hasta una TFG de 15 mL/min/1,73 m2.
Alternativas ante falta de respuesta o ERC avanzada [42] [46]
Sulfonilureas: El riesgo de hipoglucemia se incrementa en pacientes con ERC. Las fichas técnicas para las sulfonilureas en general son imprecisas, por lo que su empleo debería limitarse a pacientes con FG > 45 ml/min. En caso de utilizarlas, se recomienda ajustar dosis en función del tipo empleado.
Glinidas: secretagogos, de metabolismo hepático, con menor riesgo de hipoglucemia que la sulfonilurea. La repaglidina (iniciar 0,5 mg) se emplea con razonable seguridad incluso en pacientes en diálisis. Puede utilizarse con cualquier grado de insuficiencia renal, incluso en pacientes en diálisis.
Glitazonas: Secretagogos, de metabolismo hepático. No requiere ajuste de dosis en la ERC, pero sus efectos adversos (edemas, insuficiencia cardíaca, fracturas, riesgo de carcinoma de vejiga) limitan su indicación. Se recomienda evitarla cuando el FG sea < 30 ml/min.
Inhibidores de alfaglucosidasa (acarbosa, miglitol): dada su potencial toxicidad y acumulación en la ERC, su uso no está recomendado en estos pacientes.
Gliptinas (inhibidores de la dipeptidil peptidasa- 4 (DPP4)): Estimulan la secreción de insulina de forma dependiente de la glucosa. Tienen un muy bajo riesgo de hipoglucemias y han demostrado ser eficaces y seguros en pacientes con ERC.
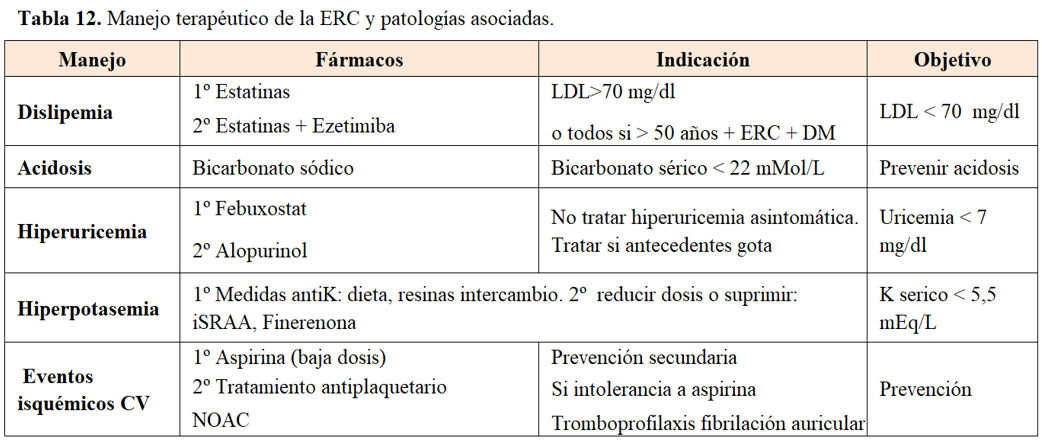
Manejo de la dislipemia
Véase Alteraciones lipídicas en la ERCA
Las siguientes recomendaciones son un resumen extraído de las Guías y documentos de consenso siguientes: [1] [12] [45] [46] [51] [52] [53] [99].
Los niveles de colesterol, HDL, LDL y triglicéridos deben ser evaluados periódicamente; y al menos 6 semanas después de un ajuste de tratamiento.
Objetivo: LDL < 70 mg/dl. Fundamento: la ERC es un factor de riesgo cardiovascular.
Optimizar los hábitos higiénico-dietéticos es el primer escalón terapéutico [53] [99].
Tratamiento de hipercolesterolemia
1) Estatinas: Se considera cardioprotector y probablemente también renoprotector. Además de mejorar el perfil lipídico se ha propuesto a nivel experimental que previenen el daño glomerular, pero su indicación como fármaco renoprotector directo aún no está establecida [121]. Atorvastatina y fluvastatina: no requieren ajuste de dosis, escasa eliminación renal. Simvastatina, pravastatina y pitavastatina: usar con precaución. Rosuvastatina: contraindicada si IR avanzada
Opcionalmente se sugiere el tratamiento con estatinas a todos los pacientes con ERC > 50 años o diabéticos.
2) Estatinas + ezetimiba (no requiere ajuste de dosis): si no se alcanzan los objetivos con estatinas.
Las Guías actuales para adultos >50 años y TFG<60 mL/min no en diálisis recomiendan estatinas solas o combinadas con ezetimiba. En pacientes más jóvenes se recomiendan estatinas en casos de riesgo cardiovascular evidente [1].
3) Sustituir por fibratos en caso de intolerancia a estatinas.
Tratamiento de la hipertrigliceridemia
Fibratos: gemfibrozilo (600 mg/d, no es recomendable administrarlos si FG < 45 mL/min, evitar si FG< 15). A nivel poblacional se sugiere como fármaco de segunda línea (tras las estatinas) en prevención cardiovascular en casos de hipertrigliceridemia o insuficiente control del LDL-colesterol [122] [123].
Es uso concomitante de estatinas y fibratos no está indicado en ERCA debido al riesgo de rabdomiolisis. Llegado el caso de requerirlo, mejor fenofibrato que gemfibrozilo y vigilar.
El ácido nicotínico, ni los ácidos omega-3 tienen actualmente indicación en el manejo de la dislipemia en la ERC.
Prevención de eventos trombóticos
Aspirina oral a dosis bajas para la prevención de eventos isquémicos recurrentes (es decir, prevención secundaria) en personas con ERC y enfermedad cardiovascular isquémica establecida.
Considerar otro tratamiento antiplaquetario (por ejemplo, inhibidores de P2Y12) cuando exista intolerancia a la aspirina.
Los anticoagulantes orales no antagonistas de la vitmina K son preferidos en lugar de los antagonistas de la vitamina K, como el acenocumarol (sintrom) o la warfarina (aldocumar) para la tromboprofilaxis de la fibrilación auricular en pacientes con ERC [124] [125].
Véase Fibrilación auricular no valvular en enfermedad renal crónica y anticoagulación
Anticoagulantes Orales en la ERC
Tratamiento Antiagregante Plaquetario en la Enfermedad Renal Crónica
Manejo de la hiperuricemia
Pacientes con ERC e hiperuricemia sintomática tienen indicación de xantina oxidasa (alopurinol, febuxostat) con preferencia a los agentes uricosúricos.
Para el tratamiento sintomático de la gota aguda en la ERC, la colchicina a dosis bajas o los glucocorticoides intraarticulares/orales son preferibles a los antiinflamatorios no esteroideos (AINEs). Con FG entre 30 y 50 ml/min debe reducirse la dosis, y evitarse por debajo de 30 ml/min.
En aquellos con hiperuricemia sintomática e insuficiencia renal leve o moderada, la administración de febuxostat ha demostrado una eficacia superior y una seguridad similar al alopurinol, sin necesidad de ajustar dosis.
Véase Ácido Úrico y Enfermedad Renal Crónica.
Acidosis metabólica
Las recientes Guías de Nutrición en la ERC recomiendan mantener los niveles séricos de bicarbonato entre 24-26 mMol/L [1] empleando manejo nutricional y suplementos de bicarbonato siempre que no afecten la carga de volumen o la tensión arterial. Considerar el uso de suplementos de bicarbonato [126] con o sin intervención dietética para prevenir el desarrollo de acidosis con posibles implicaciones clínicas (niveles de bicarbonato sérico <18 mmol/l en adultos) [1].
Véase Trastornos del matabolismo ácido-base
Hiperpotasemia
La hiperpotasemia puede tener lugar en etapas avanzadas de la ERC, especialmente en pacientes diabéticos, que reciben IECA/ARAII o diuréticos antialdosterónicos.
La prevención se basa en el manejo nutricional y la prevención del ayuno prolongado (Véase Manejo Nutricional de la ERC).
El tratamiento farmacológico de la hiperpotasemia crónica se basa en el empleo de resinas de intercambio catiónico, incluidas las más recientes: patiromer y ciclosilicato de sodio y circonio [127] [128]. El tratamiento de la hiperpotasemia grave sintomática es urgente y consiste en antagonizar los efectos cardíacos de la hiperpotasemia y al mismo tiempo promover el desplazamiento del potasio al interior de la célula y su eliminación del organismo en el menor tiempo posible.
Véase Trastornos del Potasio. Hipopotasemia. Hiperpotasemia
Preparación para el tratamiento renal sustitutivo
Iniciar la diálisis basándose en:
• Una evaluación compuesta de los síntomas, signos, calidad de vida, preferencias, nivel de TFG y anomalías de laboratorio.
• Signos y síntomas neurológicos atribuibles a la uremia, pericarditis, anorexia, anomalías ácido-base o electrolíticas, prurito intratable, serositis, incapacidad para controlar el estado de volumen o la presión arterial.
• Deterioro progresivo del estado nutricional refractario a la intervención dietética, o deterioro cognitivo.
Considerar la planificación de un trasplante renal preventivo y/o acceso a diálisis en adultos cuando el FG es <15-20 ml/min por 1,73 m2 o el riesgo de reemplazamiento de la función renal es >40% en 2 años.
La ERC es una enfermedad progresiva con importantes consecuencias sistémicas. Su detección temprana y el manejo adecuado son esenciales para retrasar la progresión de la enfermedad y mejorar la calidad de vida. Finalmente hemos de remarcar que el manejo de la ERC requiere un enfoque multidisciplinario.
Calendario de vacunaciones
Recomendaciones Guías KDIGO 2012, salvo contraindicación y teniendo siempre en cuenta el estado inmune individual:
Adultos con ERC: Vacunación anual influenza. Adultos ERC TFG<30 mL/min (especialmente con síndrome nefrótico y candidatos a trasplante renal): Vacuna neumococo polivalente, revacunación a los 5 años.
Adultos con ERC y serología negativa para el HBsAg y el antiHBs: Vacunación hepatitis B y control serológico posterior.
Vacunación hepatitis A: Adultos con ERC con enfermedad hepática crónica o que vayan a ser candidatos a trasplante.
Siempre es recomendable consultar el Calendario Oficial vacunaciones e inmunizaciones del Ministerio en grupos de riesgo.
Vacunaciones contra tétanos y difteria igual que la población general.
Véase: Barril, J. L. Teruel Calendario de Vacunas en la Enfermedad Renal Crónica Avanzada. Nefrología Vol. 28. Núm. S3, 1-39, 2008
En los siguientes enlaces temáticos de NAD se accede a todas las actuaciones que conducen a la preparación del paciente para el TRS:
Controversias KDIGO en español. Iniciación a la diálisis. Elección de modalidad, acceso y prescripción (2019).
https://www.nefrologiaaldia.org/es-articulo-iniciacion-a-la-dialisis-eleccion-de-modalidad-acceso-y-prescripcion-2-236
Adecuación del esfuerzo terapéutico en la enfermedad renal crónica avanzada. Manejo conservador. Tratamiento paliativo. Capítulo de NAD
https://www.nefrologiaaldia.org/es-articulo-adecuacion-del-esfuerzo-terapeutico-en-la-enfermedad-renal-cronica-ava-618
Protocolos de Calidad y seguridad en el tratamiento del paciente con enfermedad renal crónica. Nefrología al Día.
https://www.nefrologiaaldia.org/es-articulo-calidad-y-seguridad-en-el-tratamiento-del-paciente-con-enfermedad-rena-622