Toxinas Urémicas
1.- Definición de Toxinas Urémicas (TU)
A medida que desciende la función renal, especialmente cuando la tasa de filtración glomerular (TFG) cae por debajo de 60 ml/min/1,73 m2, comienzan a aparecer alteraciones clínicas, muchas de ellas de difícil explicación, que aumentan el riesgo de muerte por causa cardiovascular [1]. Una de las razones de estas alteraciones es causada por la acumulación de TU [2].
La definición de TU se basa en dos aspectos;
a) Son moléculas que se acumulan a medida que desciende la función renal, al ser el riñón su vía de eliminación.
b) Su acúmulo es responsable de las manifestaciones clínicas de la ERC, pues desaparecen si se elimina esa toxina.
Por lo tanto, las TU se han definido como solutos normalmente excretados por los riñones que se retienen en la ERC e interactúan negativamente con las funciones biológicas [3] [4].
La base de datos del Grupo de trabajo europeo sobre TU (EUTOX) presenta datos enciclopédicos sobre cientos de TU (https://database.uremic-toxins.org/soluteList.php) [5].
Curiosamente, los niveles séricos de algunas toxinas no guardan correlación con los niveles de creatinina. Esto puede explicarse tanto por la contribución diferencial en la cantidad de toxinas ingeridas o generadas, como por la reducción generalmente compartida en la depuración.
En este sentido, los solutos de retención urémica pueden representar moléculas derivadas de la ingesta de nutrientes (bisfenol A o la caramboxina) o productos del metabolismo como la creatinina [5] [6] [7].
La revisión actual se centra en las TU que se derivan principalmente de la ingesta o, porque la microbiota intestinal genera un metabolito intermedio tóxico. Es importante comprender estos procesos, ya que una menor ingesta de precursores puede tener un impacto favorable en la salud de los pacientes con ERC.
2.-Clasificación de las TU
En 2003 la EUTox clasificó las TU de acuerdo con el aclaramiento durante la hemodiálisis (HD). Estas clases incluyen pequeños compuestos solubles en agua con baja masa molecular (<500 Da), solutos unidos a proteínas y las llamadas moléculas intermedias (?500 Da) [8]. Es de destacar que el término molécula intermedia es un nombre inapropiado ya que se refiere a péptidos con un peso molecular bajo.
En 2012, EUTox enumeró 146 solutos de retención urémica. Las nuevas tecnologías permiten la expansión de la lista, creando una imagen más completa de la toxicidad urémica [9].
Así las TU podrían clasificarse en:
a) Moléculas hidrosolubles pequeñas (<500 Da): En este grupo tenemos la urea (60 Da) y la creatinina (113 Da) aunque no hay suficientes evidencias para considerarlas como TU.
b) Moléculas pequeño-mediano tamaño (0,5-15 kDa): como la hormona paratiroidea (9,5 kDa) y ß2-microglobulina (11,8 kDa).
c) Moléculas de medio-medio (>15-25 kDa) y medio-grande (>25-58 kDa): entre las que se encuentran las cadenas ligeras libres κ (22,5 kDa) y λ (45 kDa).
d) Toxinas unidas a proteínas: como el indoxil sulfato (IS) y el p-cresol sulfato. Cabe señalar que la función renal residual puede contribuir significativamente a la eliminación de solutos unidos a proteínas.
La clasificación más común de las TU en 3 grupos propuesta por EUTox es por peso molecular, capacidad de unión a proteínas y patrón de remoción por diálisis [10] [11].
a) TU de bajo PM (peso molecular <500 Da) o solubles en agua: son facilmente dializables. Determinadas moléculas de bajo peso molecular pueden presentarse en forma libre o unidas a proteínas, lo que altera la función tanto de la toxina como de la proteína transportadora. De los 90 moléculas evaluados por EUTox, 68 resultaron pertenecer a este grupo, siendo los compuestos más comunes ADMA (dimetilarginina asimétrica), creatinina, ácido hialurónico, guanidina, guanidinoacetato, guanidinosucinato, oxalato, SDMA (dimetilarginina simética), urea y ácido úrico
b) TU unidas a proteínas: el 27,8% de todos los compuestos urémicos evaluados por EUTox, corresponden a este grupo. Aunque el peso molecular (PM) de la mayoría de estas moléculas es inferior a 500 Da, son difíciles de eliminar por diálisis. Las más conocidas incluyen productos finales de glicación avanzada (AGE), ácido carboximetil propil furanpropiónico, citoquinas, interleucinas, factor de necrosis tumoral-α (TNF-α), dimetilguanidinas, ácido hipúrico, homocisteína, in- ácido dole-3-acético, indoxil glucurónido, indoxil sulfato (IS), ácido quinurénico, quinurenina, leptina, compuestos fenólicos libras, p-cresil sulfato (p -CS), p-cresilo glucuronido, sulfato de fenol, glucurónido de fenol, ácido fenilacético, ácido quinolínico y proteína fijadora de retinol.
c) TU de PM medio. Su PM es superior a 500 Da. Hasta ahora, existen definidas más de 50 y todas relacionadas con el desarrollo de patologías. En este grupo se incluyen: adiponectina, cistatina C, leptina, motilina, α1-glucoproteína ácida teína, ?1-microglobulina, endotelina, grelina, osteocalcina, péptido natriurético atrial, prolactina, prolactina que se une al retinol teína, ?2-microglobulina, colecistoquinina y vasoactivo péptido intestinal.
La clasificación EUTox no describe la toxicidad de los compuestos enumerados y hasta el momento no ha habido un método eficaz para caracterizarlos.
Clasificación de compuestos urémicos basada en similitudes en la estructura química
Otra forma de clasificar las TU es en base a las similitudes en la estructura química [12]:
- Los compuestos de guanidina son derivados de la urea e incluyen: ácido α-ceto δ-guanidinovalérico, α-N-acetilarginina, ADMA, ácido arginínico, ácido α-guanidinopropiónico, creatina, creatinina, ácido δ-guanidinobutírico, guanidina, ácido guanidinoacético, ácido guanidinosuccínico, ácido metil- guanidina, SDMA y taurociamina. Aunque las guanidinas son miembros de un grupo de pequeños compuestos solubles en agua con características fisicoquímicas similares a las de la urea y la creatinina, se ha demostrado que muchos compuestos de guanidina tienen un volumen de distribución mayor en comparación con la urea, lo que puede reducir su eliminación efectiva del cuerpo.
– Derivados de purina: citidina, hipoxantina, xantina y ácido úrico
– Derivados de la pirimidina: timina, ácido orótico, orotidina y uridina
– Derivados de metilamina: metilamina, dimetil- amina y trimetilamina
– Derivados fenílicos: 2-metoxiresorcinol, fenol, hi- droquinona y p-cresol
– Derivados de indol: quinurenina, indol-3-acetato, kyn- ácido urénico, melatonina, IS y ácido quinolínico
Clasificación según la capacidad de depuración por la hemodiálisis [9].
La subdivisión fisicoquímica actual puede considerarse artificial porque hay un continuo en el peso molecular de los solutos urémicos, y cualquier corte basado en el peso molecular es arbitrario [13]. Debido a que la HD sigue siendo la terapia de referencia para reducir la concentración de TU en la ERC avanzada, el enfoque de clasificación más práctico está basado en los patrones de eliminación por HD ya sea por técnica convencional, convección o adsorción [14].
El mecanismo de adsorción en HD parece ser la única forma eficaz de eliminar las toxinas unidas a proteínas, aunque su desarrollo está aún en proceso. Las técnicas existentes se saturan pronto y son poco eficaces [15] [16]. En cuanto a las membranas con capacidad de adsorción disponibles en la actualidad, estas tienen bajo coeficiente de cribado para solutos de bajo PM. Además, se produce un depósito de proteínas plasmáticas denominado protein cake que obstruyen algunos poros, provocando pérdida de eficacia de la técnica [17].
Es probable que las nuevas membranas de HD cambien la capacidad para eliminar solutos de mayor PM que pueden ser tóxicos. La capacidad de eliminar las TU más grandes depende en gran medida de la convección. El dializador de alto flujo, cuando se realiza HD convencional, tiene un punto de corte de PM de 25 kDa [18], que aumenta hasta 30 kDa con la hemodiafiltración [19]. Una nueva clase de membrana de corte medio (MCO) con un radio de poro de 5 nm y un diámetro interior de fibra de 180 mm [20] proporciona una capacidad de depurar moléculas de hasta 56 kDa [20]. Como comparación, la membrana de alto flujo tiene un radio de poro medio de 3,9 nm y un diámetro interior de aproximadamente 200 mm [21].
El aclaramiento es más eficiente para moléculas más grandes (25-58 kDa) con membranas de corte medio, que para las membranas de alto flujo. Los ensayos clínicos han demostrado una mayor eliminación de moléculas de mayor PM, como el complemento, factor D, cadenas ligeras k libres, TNF-a y b2-microglobulina [22].
Posiblemente que la clasificación de las moléculas intermedias debe incluir el efecto en la depuración de diferentes membranas, permitiendo en última instancia la personalización de terapias.
3.- Origen de las TU. Importancia de la microbiota. Bisfenol A
Generación intestinal de TU
El origen de las TU en la ERC es múltiple. Cada vez se reconoce más la importancia de las toxinas generadas por el metabolismo microbiano intestinal [23] [24]. Aproximadamente 10 g de proteínas alcanzan el colon diariamente, donde son degradadas por las bacterias intestinales a metabolitos como amonio, aminas, tioles, fenoles e indoles. Estos productos de la fermentación en el colon son eliminados por las heces, aunque una parte son absorbidos y deben ser eliminados por el riñón, por lo que se acumulan en la ERC [25].
Entre las TU derivadas de la microflora intestinal en la ERC están:
Fenoles e indoles: p-cresol e indoxil sulfato.
De los fenoles destacan el p-cresol, p-cresil sulfato (PCS), p-cresil glucurónido, el ácido fenilacético, fenil sulfato y fenol [26]. El p-cresol/p-cresil sulfato son productos del metabolismo de la fenilalanina y la tirosina por bacterias anaerobias intestinales. El p-cresol es conjugado en la pared intestinal a PCS y el p-cresil glucurónido en el hígado. El PCS es el principal metabolito circulante del p-cresol [27].
El P-cresol (4-metilfenol) tiene un bajo PM (108 Da) y es generada a partir del metabolismo de la tirosina y fenilalanina, dos aminoácidos aromáticos que se metabolizan por bacterias putrefactivas de la microbiota intestinal [28]. El p-cresol se procesa mediante sulfatación y glucuronidación por la acción de la enzima sulfotransferasa contenida en el citoplasma celular a medida que pasa a través de la mucosa en la parte distal del colon y el hígado; este proceso luego genera dos compuestos, pC Sulfato y pC glucoronato. Estas sustancias se encuentran en forma conjugada y no conjugada, y en pacientes con ERC, su impacto clínico es diferente [29]. El P-cresol está presente en pequeñas concentraciones en el ser humano, ya que se metaboliza rápidamente y no se detecta en pacientes urémicos, o en personas sanas en su forma no conjugada. Así, PCS (C7H8O4S) es la forma conjugada del P-cresol con evidente retención en pacientes urémicos, que es la forma que circula en el torrente sanguíneo en estos pacientes [30]. Alrededor del 95% del PCS se une reversiblemente en el plasma a la albúmina, y pronto se establece un equilibrio entre las fracciones ligadas y las fracciones libres de este compuesto en la sangre. Las fracciones libres se filtran directamente en el riñón sano, mientras que su fracción unida a proteínas es eliminada por las células epiteliales tubulares proximales en el riñón. Es decir, ambas fracciones (ligadas a la albúmina o libres) son excretados por la orina [29].
El fenol procede fundamentalmente de la ingesta, del catabolismo de la tirosina por las bacterias intestinales, así como del consumo de tabaco. El ácido fenilacético es el resultado de la degradación de la fenilalanina.
Entre los indoles destacan el indoxil sulfato [IS] y el ácido indolacético [26]. Ambos se originan de la degradación del triptófano por bacterias intestinales y posteriormente son sulfatados en el hígado a IS. Los indoles y fenoles son TU unidas a proteínas [3].
Aminas y poliaminas
Son generadas por el metabolismo microbiano intestinal. Una amina clínicamente relevante y de creciente interés es la trimetilamina N-óxido (TMAO). La TMAO se produce por el metabolismo intestinal de aminas cuaternarias, como colina/fosfatidilcolina, betaína o L-carnitina. La L-carnitina, presente en las carnes rojas, también induce la formación de TMAO y se asocia con un incremento de la enfermedad cardiovascular [31]. Las fuentes de TMAO en la dieta son las carnes rojas, carnes en general, yema de huevo, hígado, productos lácteos y pescados de agua salada. En la ERC se acumula TMAO y sus niveles se relacionan con el filtrado glomerular, pero su unión a proteínas es baja, y se elimina bien mediante la diálisis.
Las poliaminas son cationes orgánicos entre los que se incluyen la cadaverina, espermina, espermidina y putrescina. Proceden de la decarboxilación de la L-arginina, L-ornitina o lisina en el intestino. En la ERC, la putrescina, espermidina y espermina están aumentadas en suero [32]. Se ha demostrado que estas moléculas interaccionan con la insulina y las lipoproteínas, y contribuyen, con otros factores de comorbilidad de la ERC tales como la hipertrigliceridemia, a acelerar la aterosclerosis [33].
A partir de los nutrientes las vias para la producción de toxinas son:
1.- Vías metabólicas para la generación de la TMAO a partir de L-carnitina y colina de la dieta
2.- Vías metabólicas para la generación de las TU p-cresil-sulfato y p-cresil-glucurónido a partir de la tirosina de la dieta.
3. Vías metabólicas para la generación de las TU sulfato de indoxilo e indol-3-aldehído a partir del triptófano de la dieta. Las TU así generadas son excretadas por los riñones en sujetos sanos pero se acumulan como TU en individuos con ERC [34].
Productos avanzados de la Glicación (AGE)
Los AGE son un grupo heterogéneo de compuestos que se producen mediante reacciones de oxidación y glicación secuencial, no enzimáticas, de azúcares con grupos amino libres en proteínas, péptidos o aminoácidos. Esta secuencia de eventos se conoce como la reacción de Maillard, o de pardeamiento, identificada por primera vez en 1912 [35]. Ahora está claro, sin embargo, que los compuestos AGE pueden formarse a través de muchas otras vías, incluida la oxidación de azúcares, lípidos y aminoácidos para crear aldehídos reactivos que se unen covalentemente a las proteínas. El metabolismo normal de la glucosa genera intermediarios glucolíticos, que también contribuyen al conjunto de aldehídos reactivos. Además, los neutrófilos y los monocitos, tras la estimulación inflamatoria, producen mieloperoxidasa y se activa la NADPH oxidasa, que forma AGE mediante combinaciones oxidantes de aminoácidos que se encuentran en condiciones fisiológicas.
La N -carboximetillisina (CML), pentosidina y metilglioxal son los derivados que se encuentran entre algunos de los compuestos mejor caracterizados que comúnmente se usan como marcadores de AGE. Los compuestos AGE y sus precursores son numerosos y contienen N-carboximetillisina, pentosidina, hidroxiimidazolona, 3-desoxiglucosona, malondialdehído, pirralina, glioxal y metilglioxal. La acumulación de AGE se identificó por primera vez en la diabetes mellitus [36]. Debido a que la ERC como condición se caracteriza por inflamación, oxidación y retención, la acumulación de AGE es una característica típica de la ERC [37], independientemente del estado diabético [38].
Los AGE se puede medir mediante una variedad de técnicas. La detección de la capacidad de fluorescencia de AGE es simple pero no específica. Los AGE específicos pueden identificarse y cuantificarse mediante ELISA, HPLC o espectrometría de masas [39].
Datos convincentes de modelos experimentales y estudios en humanos indican que el exceso de proteínas en la dieta promueve el daño renal progresivo al aumentar la carga de AGE. Un enfoque prudente es recomendar que los pacientes con ERC alcancen la ingesta dietética recomendada de proteínas (0,8 g/kg por día, o alrededor del 10 % de las calorías) con énfasis en las proteínas que tienen un alto valor biológico y bajo en AGE. La carga dietética de AGE puede ser minimizado al consumir proteínas no cárnicas y métodos culinarios que reducen la formación de AGE durante la cocción (cocer al vapor, escalfar, hervir y guisar en lugar de freír, o asar) [40].
Los AGE se unen a una serie de receptores, entre los cuales el receptor específico del producto final de glicación avanzada (RAGE) desempeña un papel central para imponer varios efectos biológicos nocivos [41]. La expresión de RAGE aumenta en muchas afecciones inflamatorias y también en la ERC. Los AGE tienen un impacto negativo en las funciones corporales y los resultados generales a través de varios mecanismos, entre los cuales la inducción del estrés oxidativo [42], la inflamación [43] y la disfunción endotelial [44]. Los AGE también se han relacionado con la trombogenicidad, la fibrosis renal, y la neurotoxicidad. Con todas estas alteraciones funcionales, no sorprende que, a un nivel orgánico más global, los AGE estén relacionados con la rigidez vascular, el daño y la calcificación [45]. Los estudios sobre los vínculos entre los AGE y la mortalidad arrojaron resultados contradictorios, y algunos estudios incluso mostraron mejores resultados con niveles más altos de AGE [46]. Dichos resultados pueden reflejar factores de confusión, como un mejor estado nutricional que da como resultado AGE más altos y una mayor supervivencia, o el AGE índice puede haber sido un compuesto con un impacto biológico bajo o con una concentración de tejido vital más baja. Se han realizado muchos intentos de intervención para reducir los niveles de AGE ya sea mediante tratamiento extracorpóreo o farmacológico. La dieta restringida en AGE puede ayudar a reducir su concentración [47].
Bisfenol A
En los últimos años ha adquirido gran relevancia entre la comunidad científica el efecto nocivo de un tóxico ambiental, de tipo fenólico, el bisfenol A (BPA). El BPA se ha relacionado con alteraciones renales y endocrinas, pero como su eliminación es renal, el paciente con insuficiencia renal tiene incrementados sus niveles sanguíneos y tisulares. Puede considerarse una TU de origen exógeno.
Pero qué es el bisfenol A y porqué despierta tanto interés. La importancia del BPA deriva de su ubicuidad, pues se trata de un compuesto que está presente en la mayoría de los envases usados comúnmente; es un componente habitual en plásticos (policarbonatos) y resinas epoxi. Inicialmente fue sintetizado en la década de 1930 como estrógeno sintético, siendo sustituido por el dietilestilbestrol (DES). Por sus características hizo que fuera usado como monómero en la fabricación de diversos productos cotidianos como son botellas de plástico, biberones o lentillas. Las resinas epoxi que contienen BPA se usan como recubrimiento de latas usadas en alimentación, aunque existe una tendencia a su sustitución por poliésteres. Ante lo extendido de su uso, el riesgo potencial del BPA, como estrógeno sintético de consumo cotidiano, en la salud humana lleva muchos años siendo un tema de debate para las agencias regulatorias [6].
Sin embargo, más controvertida es su exposición constante durante años dada su función como agonista endocrino. El BPA está catalogado comúnmente como perturbador endocrino. A pesar de las evidencias publicadas [48], las autoridades europeas y americanas consideran que debido a su rápida eliminación, se puede considerar al BPA un compuesto relativamente seguro. Sin embargo, ante la falta de criterios científicos concluyentes recomiendan reducir la exposición lo más posible [49]. Aunque siguiendo un principio de precaución desde junio de 2011 se prohibió en toda la UE los biberones y tetinas que contuvieran BPA, al haberse observado un potencial daño mayor en niños recién nacidos.
El paciente en diálisis tiene más riesgo en la toxicidad al BPA, al tener abolida la eliminación renal, que es la vía de excreción habitual. Además, en los pacientes en HD se añade el que el BPA forma parte de la composición del material plástico de algunos dializadores y líneas de uso. El BPA está presente tanto en el policarbonato de las carcasas, como en múltiples membranas, como es el caso de la polisulfona (PS) o el “Polyester-Polymer alloy” (PEPA) [50].
Las recientes evidencias han llevado a que el “Scientific Committee on Emerging and Newly Identified Health Risks“, por encargo de la Unión Europea emita a principios de 2015 un informe titulado: “Final opinion on the safety of the use of bisphenol A in medical devices” en el que concluyen que existe un riesgo de efectos adversos derivados del BPA cuando está disponible por vía sistémica mediante rutas de exposición no oral, especialmente para neonatos en unidades de cuidados intensivos, niños sometidos a procedimientos médicos prolongados o pacientes en diálisis [51],por lo que recomiendan controlar su uso siempre que sea posible y que los efectos beneficiosos del material empleado no superen al potencial riesgo del BPA.
El uso de material de HD que contiene BPA, especialmente las membranas, incrementan los niveles de BPA sérico. Este aumento incrementa los marcadores de oxidación e inflamación [7].
Su daño biológico parece ser mucho más potente que otros productos similares [52], y también mucho mayor a otras toxinas conocidas como el p-Cresol [53].
4.- Repercusión clínica de las TU
Las clasificaciones fisicoquímicas actuales de TU no reflejan adecuadamente las consecuencias biológicas de las TU y no son capaces de identificar qué toxinas poseen mayor relevancia clínica. Wolley et al. [54] revisaron el efecto de un grupo de TU, de un tamaño medio, con masas moleculares mayor a 15 kDa. Los autores analizaron cómo estas moléculas están involucradas en enfermedades crónicas como inflamación, enfermedad cardiovascular, inmunodeficiencia secundaria, y síntomas sistémicos (Tabla 1).
Los efectos demostrados de las diferentes TU se relacionan con mortalidad y deterioro de la calidad de vida. Los efectos más conocidos son:
1. Cardiovascular: Disfunción endotelial. Proliferación del músculo liso vascular
2. Riñón: Progresión de la ERC
3. Endocrino: Resistencia a la insulina. Enfermedad mineral ósea
4. Sistema inmunitario: Deficiencia sistema inmune. Infección.
5. Hematología: Trombogenicidad, anemia
6. Gastrointestinal: Disbiosis intestinal
7. Neurológico: Deterioro cognitivo
8. Nutrición/ músculo: Aumento catabolismo proteico. Sarcopenia
Cardiovascular
Disfunción endotelial. Proliferación del músculo liso vascular [55].
- Sobre corazón: La creatinina y la urea causan alteración contráctil de los cardiomiocitos, así como un aumento del consumo de oxígeno. Causan resistencia a la insulina [56]. El ácido úrico también se asocia a lesión cardiaca, y se relaciona con hipertensión arterial, fibrilación auricular e insuficiencia cardiaca [57].
- Sobre el vaso: El ácido úrico causa efectos adversos cardiovasculares (CV) tales como incremento del estrés oxidativo, inflamación, disfunción endotelial y aumento de la actividad del eje renina-angiotensina-aldosterona (RAAS) [58].
El aumento de las concentraciones de indoxil sulfato (IS) en el endotelio puede provocar la liberación de micropartículas, la inhibición de la proliferación y reparación celular, además de aumentar la interacción/adhesión de leucocitos que causan lesión endotelial [59]. El IS sobre el tejido cardíaco causa aumento de la inflamación, fibrosis cardiaca, proliferación de cardiomiocitos, hipertrofia de los cardiomiocitos y estrés oxidativo [60].
El p-Cresol, además del daño vascular inducido por inflamación, es capaz de inducir la liberación de micropartículas de las células endoteliales [61].
- Arterioesclerosis: El N-óxido de trimetilamina (TMAO) es un compuesto soluble en agua derivado de la dieta con colina, fosfatidilcolina, L-carnitina y betaína [62]. Se ha demostrado que el aumento de las concentraciones de TMAO se correlaciona con arterioesclerosis coronaria [63]. El TMAO promueve la inflamación a través de la activación del NLRP3 inflamasoma y, en consecuencia, disfunción endotelial [64].
El PCS es capaz, in vivo, de inducir la contracción de la aorta torácica a través de la señalización de rho-quinasa, independiente del estrés oxidativo y del remodelado de la muscular interna [65]. Además, el aumento de PCS induce un aumento de la actividad oxidativa de la nicotinamida adenina dinucleótido fosfato (NADPH) y aumenta la producción de ROS en los miocitos cardíacos, contribuyendo a la apoptosis y a la disfunción diastólica en un modelo de nefrectomía en ratones [66].
Un acumulo de TU unidas a proteínas aumenta el riesgo de muerte, y sobre todo una mayor predisposición a la enfermedad cardiovascular [67]. IS y PCS están entre las toxinas unidas a proteínas más estudiadas. Los niveles altos de IS y PCS en suero se utilizan para predecir eventos CV y al estar implicados con el daño vascular, incluyendo arterioesclerosis, inflamación endotelial y estrés oxidativo. Además, los niveles elevados de IS están asociados con el remodelado vascular, mientras que tanto PCS e IS se correlacionan con la calcificación vascular en diferentes fases de ERC [66].
-Hipertrofia ventricular izquierda (HVI): El fósforo se ha relacionado con la HVI, enfermedad coronaria e insuficiencia cardiaca y por lo tanto aumenta la tasa de mortalidad. El fósforo es de las TU con el mayor efecto nocivo sobre el sistema cardiovascular [68].
El FGF23 y la PTH tienen implicación en el desarrollo de HVI además de desestructuración de la musculatura cardiaca [69] ambas son toxinas de mediano tamaño.
Los estudios in vitro han demostrado que el IS tiene un efecto hipertrófico en cultivos de cardiomiocitos al activar la señalización de la proteína quinasa activada por mitógenos (MAPK) y las vías NF-kB, lo que indica que la IS puede desempeñar un papel fundamental en el desarrollo de HVI en condiciones urémicas [70].
Indol Sulfato es una molécula altamente proinflamatoria y profibrótica, lo que sugiere que está directamente involucrada en el remodelado cardíaco mediante la activación de la via MAPKs/NF-kB [66]. La disfunción eléctrica también puede ocurrir como consecuencia de acumulación de las TU unidas a proteínas. Los cardiomiocitos presentan un perfil arritmogénico y aparece fibrilación auricular cuando se estimulan con IS tanto in vivo como in vitro [66]. Además, con PCs se observa una reducción de la contracción espontánea acompañada de un latido irregular en los cardiomiocitos junto con cambios estructurales y funcionales en las uniones comunicantes entre estas células [71].
-Calcificación vascular: Pi ha sido señalado en varios estudios como una TU que provoca calcificación cardiovascular [72].
Riñón
La acumulación de IS puede provocar la degradación de las nefronas funcionantes, principalmente las células tubulares proximales, estimulando la esclerosis glomerular, la fibrosis renal y la progresión de la ERC. Contribuye a aumentar la expresión del colágeno pro-a1, factor de crecimiento transformante b1 (TGF-b1) e inhibidor tisular de los genes de la metaloproteinasa 1 (TIMP-1), lo que resulta en una mayor pérdida de nefronas y progresión de la ERC [73].
Hay evidencia de que el aumento renal de PCS provoca incremento en la expresión de citocinas y genes proinflamatorios en las células tubulares renales, además de activación del RAAS y de la transición epitelio-mesenquimatosa, fibrosis y nefroesclerosis [74]. Además, el aumento de los niveles de PCS está relacionado con la disminución de Klotho a través de la metilación del gen Klotho, contribuyendo a la senescencia de las células renales [75].
Sistema inmune:
Nakano et al. [76] sugieren que hay es una disfunción inmune causada por IS; la activación de macrófagos proinflamatorios está mediada por su captación a través de transportadores, incluido OATP2B1, que es un importante mediador del proceso inflamatorio.
La retención de moléculas urémicas y citocinas activa la respuesta inmune innata que conduce a un círculo vicioso en el que se estimula la producción de citocinas y ROS, que se sabe que aumentan el riesgo cardiovascular y daño tisular [77]. La alteración del equilibrio inmunitario en pacientes con enfermedad renal da como resultado un reclutamiento continuo de células inmunitarias y un empeoramiento de la estructura y función renal [77]. Las TU tienen particularmente un efecto proapoptótico y/o efecto inhibitorio sobre las células inmunitarias, lo que contribuye al aumento riesgo de infecciones observado en pacientes con ERC. Entre las principales TU relacionadas con la activación del sistema inmunitario son: IS, PCS, p-cresil glucurónido, b2-microglobulina, FGF-23, IL-6 y TNF-a entre otros [78].
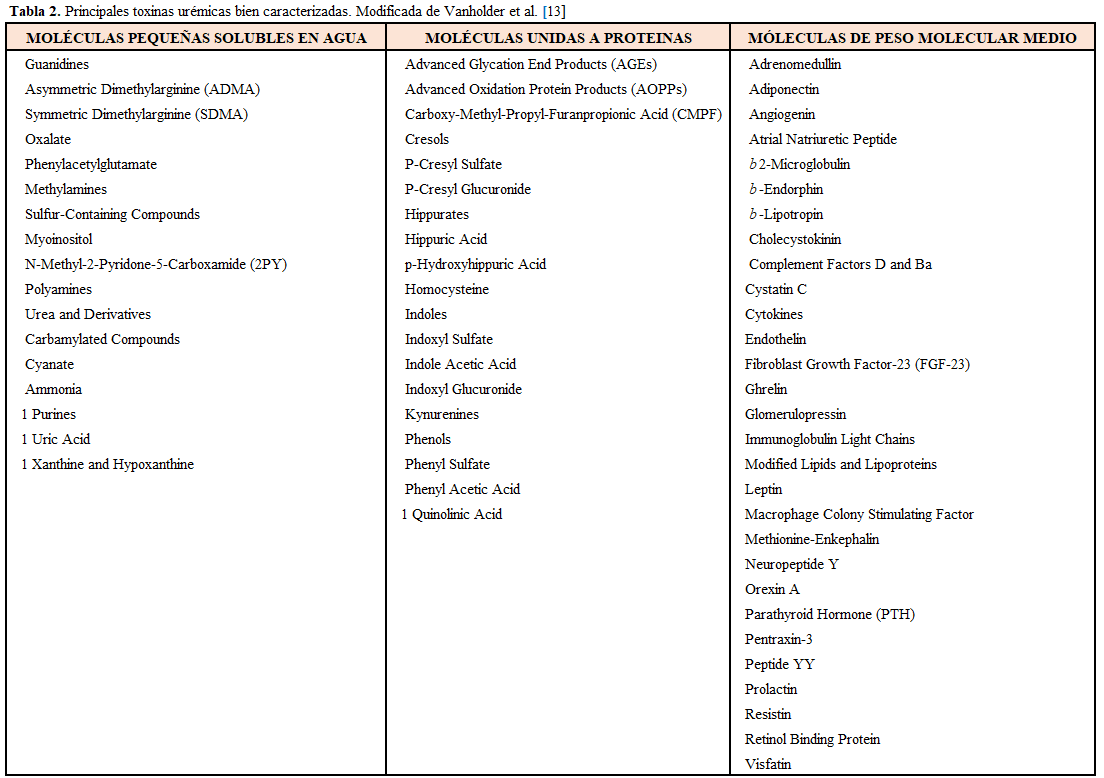
En la (Tabla 2) se describen pormenorizadamente las principales TU que han sido bien caracterizadas.
DISMINUCIÓN DE LAS TU
DIETA
Una dieta con un mayor contenido de vegetales modifica aún más la microbiota intestinal, lo que puede resultar en una mayor producción de ácidos grasos de cadena corta y una menor producción de TU nefrotóxicas. Las dietas basadas en plantas y el índice de proteína/fibra de la dieta se asocian significativamente con los niveles séricos de IS y PCS, más allá de su conocida asociación con la función renal. La fibra de la dieta puede reducir la producción de estas toxinas al limitar la fermentación bacteriana proteolítica. Las modificaciones dietéticas hacia un índice de proteína-fibra más bajo pueden contribuir a reducir IS y PCS [79].
En los últimos años existe un interés creciente por restablecer la simbiosis de la microflora intestinal en la ERC a fin de reducir la generación de TU, el estrés oxidativo y la inflamación [80].
a) Dieta rica en fibra
Una dieta rica en fibra aumenta la producción de ácidos grasos de cadena corta (AGCC), que proporcionan energía a la flora intestinal y permite que los aminoácidos que llegan al colon se incorporen a las proteínas bacterianas y sean excretados, en lugar de ser fermentados a solutos urémicos; además, los AGCC son utilizados como sustrato por la mucosa intestinal y mantienen su funcionalidad e integridad. La fibra aumenta el tránsito intestinal, reduciendo el tiempo de fermentación de los aminoácidos y mejora la composición de la microflora, reduciendo la producción de solutos indeseables.
En pacientes con ERC existe una relación directa entre el cociente proteína/fibra de la dieta y los niveles de PCS e IS, por lo que una dieta con un índice proteína/fibra menor podría ser beneficiosa [84]. En sujetos sanos, una dieta vegetariana versus dieta omnívora, esta reduce la generación de IS o PCS, lo que se relacionó con la mayor ingesta de fibra y menor de proteínas [85]. Una dieta muy baja en proteínas (0,3 g/kg peso/día) suplementada con cetoanálogos de aminoácidos también reduce los niveles de IS en pacientes con ERC [86].
b) Prebióticos, probióticos y simbióticos:
Otro enfoque para modular la producción de TU es la manipulación terapéutica de la composición de la microbiota intestinal. Varios ensayos clínicos en curso están explorando el impacto de cambiar la dieta o usar prebióticos (ingredientes alimentarios no digeribles), probióticos (microorganismos vivos) o simbióticos (una mezcla de ambos compuestos) en la composición de la microbiota [87].
El uso de antibióticos sobre la simbiosis de la microbiota resulta controvertida. En animales de experimentación, los antibióticos redujeron la producción de TU [88]. Los efectos adversos potenciales del uso de antibióticos para este fin, tanto en el paciente individual como en la salud pública, pueden superar los beneficios potenciales. Sin embargo, los antibióticos no absorbibles crónicos están clínicamente indicados para otras afecciones asociadas con las toxinas generadas por la microbiota, como la encefalopatía hepática y los ensayos clínicos en la ERC que brindan información sobre el balance riesgo/beneficio pueden ser valiosos.
La generación de TU podría reducirse incrementando selectivamente las bacterias sacarolíticas (que digieren la fibra de la dieta) y reduciendo las bacterias proteolíticas (fermentadoras de proteínas y aminoácidos) en el colon. El principal regulador del metabolismo de las bacterias del colon es la disponibilidad de nutrientes y, específicamente, la tasa de hidratos de carbono fermentables versus nitrógeno.
Los prebióticos son componentes alimentarios no digeribles que, fermentando selectivamente, permiten cambios específicos en la composición o actividad en la microflora gastrointestinal que confiere beneficios a la salud y bienestar del huésped. Los probióticos estimulan el crecimiento o la actividad de una o de un número limitado de bacterias en el colon, pueden aumentar la tasa de hidratos de carbono fermentables vs. nitrógeno, e incluyen la inulina, fructooligosacáridos, galactooligosacáridos, etc. La inulina enriquecida con oligofructosa reduce la generación de PCS y sus concentraciones séricas en pacientes en HD, pero no tiene efectos sobre IS [89]. El almidón resistente reduce los niveles de IS en pacientes en HD y reduce no significativamente el PCS [90]. En un modelo de ERC en ratas, una dieta rica en almidón resistente a la amilasa retrasaba la progresión de la ERC y atenuaba el estrés oxidativo y la inflamación [91]. Actualmente un ensayo clínico, aleatorizado, cruzado, doble ciego, en fase 2 analiza el efecto de la suplementación de arabinoxilanoligosacáridos en pacientes con ERC estadios 3b-4 sobre los niveles plasmáticos de PCS y derivados del indol, sobre su excreción urinaria y la resistencia a la insulina [92].
Los probióticos se definen como «microorganismos vivos» que cuando se administran en cantidades adecuadas proporcionan un beneficio para la salud del huésped. Una reciente revisión evalúa los posibles beneficios de los probióticos en general y especialmente en la ERC [93]. La eficacia de los probióticos para disminuir los niveles de TU y retrasar la progresión de la ERC ha sido investigada en modelos in vitro, modelos animales y en pacientes con ERC. Sin embargo, no existen hasta la fecha estudios de intervención de calidad a gran escala y sobre eventos clínicos que avalen su uso generalizado. Solo existen pequeños estudios que observan una disminución de los niveles de TU en su mayoría [94], aunque no en todos [95]. La administración de Bifidobacterium longum en cápsula entérica a pacientes con ERC tuvo mínimos efectos sobre la progresión de la enfermedad en pacientes con ERC [96]. Un ensayo aleatorizado, doble ciego en pacientes en diálisis peritoneal observó una reducción significativa de los niveles de endotoxinas y citocinas proinflamatorias en suero, un aumento en los niveles séricos de IL-10, y la preservación de la función renal residual tras 6 meses de tratamiento con un probiótico [97].
Los simbióticos son suplementos de probióticos combinados con prebióticos. En pacientes en hemodiálisis el tratamiento con un simbiótico disminuyó los niveles de PCS, pero no los de IS [98], lo que fue confirmado en otro estudio [99]. Otro estudio observó un retraso en la progresión de la ERC con el tratamiento con un simbiótico, mientras otro estudio no observó una mejoría significativa de los marcadores de inflamación [100]. Finalmente, un estudio aleatorizado, doble ciego, cruzado, en pacientes con ERC [101] demostró una reducción de los niveles de PCS, un descenso no significativo de IS y un aumento de bifidobacterias y reducción de rumicocáceas en heces, pero sin cambios en marcadores de inflamación, estrés oxidativo ni endotoxinas; aunque se observó un discreto aumento de la albuminuria.
Una de las principales limitaciones de la terapia con probióticos o simbióticos es que ningún estudio ha demostrado todavía la supervivencia sostenida de los probióticos en el colon disbiótico de los pacientes con ERC. Tampoco hay estudios que hayan evaluado el efecto de estos tratamientos sobre los niveles de TMAO en esta población. En la elección de probióticos debe considerarse la contribución de bacterias que poseen ureasa, ya que pueden incrementar la generación de amonio intestinal, que puede dañar las tight-junctions epiteliales, aumentando la permeabilidad intestinal al paso de endotoxinas desde la luz intestinal [102].
Los AGE también pueden promover la toxicidad [103]. Varios alimentos procesados son una fuente de PGA en la dieta [104]. En este sentido, un ensayo reciente de restricción dietética de AGE en pacientes en diálisis peritoneal demostró una disminución de los AGE séricos, así como un cambio en la microbiota bacteriana [105] .
c) Terapias adsortivas
El uso de sorbentes orales podrían disminuir las TU o endotoxinas circulantes de origen intestinal. El sorbente oral AST-120 disminuye los niveles de IS de forma dosis-dependiente [106]. Además, se ha descrito una reducción de los niveles de IS, PCS o fenil sulfato y de estrés oxidativo en pacientes en hemodiálisis [107]. Otros autores han descrito que la administración de AST-120 mejora la respuesta eritropoyética a factores eritropoyéticos [108]. El AST-120 mejora la disfunción de la barrera intestinal y disminuye los niveles plasmáticos de endotoxinas, marcadores de inflamación y estrés oxidativo en un modelo de ERC en ratas [109].
Aunque pequeños estudios controlados en animales de experimentación y estudios retrospectivos en pacientes han señalado un efecto nefroprotector de AST-120; un gran ensayo aleatorizado y controlado posterior en pacientes con ERC no lo pudo confirmar [110]. Este estudio tenía algunas limitaciones metodológicas, pero también planteaba la posibilidad de que el objetivo de tratar unas TU específicas pudiera no ser suficiente. Sin embargo, otro estudio retrospectivo sobre los efectos a largo plazo de AST-120 en pacientes con ERC estadios 3-5 objetivó una disminución del riesgo de progresión a diálisis, de mortalidad, de eventos cardíacos y de accidente vascular vs. aquellos pacientes que no lo recibieron [111].
Aunque se ha descrito un efecto beneficioso de sevelamer sobre IS y PCS en estudios in vitro, estudios in vivo en ratones o pacientes no han demostrado una reducción en los niveles de estas TU [112]. Sin embargo, sevelamer sí reduce los niveles de endotoxinas y la inflamación sistémica en pacientes en hemodiálisis [113].
c) Modulación de la síntesis de toxinas urémicas de origen intestinal [81].
Una restricción dietética de precursores de TU es un enfoque teórico para limitar la síntesis de TU. A pesar de que la superposición de restricciones adicionales en pacientes que potencialmente sufren de anorexia y con alto riesgo de desnutrición parece poco práctico, algunos precursores de TU son usados.
Se puede utilizar la manipulación genética de bacterias para reducir su capacidad de sintetizar precursores de TU. La seguridad general de esta estrategia debe explorarse cuidadosamente, incluidas las posibles consecuencias para la patogenicidad de las bacterias. En este sentido, la aplicación exitosa de tal terapia requeriría que las bacterias sean capaces de transferir la modificación genética horizontalmente o que cree una ventaja de supervivencia sobre otros competidores de la microbiota no modificada genéticamente. Asimismo, BT1492 se identificó como la triptofanasa más abundante en la microbiota intestinal humana y una mutación en este gen reduce la síntesis de indol y los niveles de IS en ratones. Además, los niveles de IS en ratones se redujeron con antibióticos que favorecen el crecimiento de bacterias negativas para BT1492 [82]. Los polifenoles fitoquímicos, como la quercetina y el resveratrol, reducen la síntesis de IS a través de la inhibición de la sulfotransferasa (SULT), una enzima implicada en la síntesis de IS en el hígado [83].
DIALISIS
a) Técnicas difusivas y/o convectivas
1) Membranas de alto flujo
Cuando nos centramos en las toxinas unidas a proteínas, está claro que tienen un papel importante en los pacientes que se someten a diálisis, ya que la membrana de diálisis no los filtra. Se han realizado varios estudios centrándose en este aspecto en diferentes enfoques [55]. Parece claro que ninguna membrana o técnica por muy alto coeficiente de cribado que tenga ha conseguido depurar correctamente estas toxinas. Si pueden demostrar una reducción de la fracción libre, pero con una modesta repercusión clínica, pues esta fracción supone una mínima cantidad de la cantidad total de toxina.
En los últimos años, los perfiles de aclaramiento de las membranas de HD de última generación han mejorado notablemente. Se deben considerar varias características para la evaluación de nuevas membranas. Estos incluyen nuevos índices de permeabilidad, la naturaleza hidrofílica o hidrofóbica de las membranas, la capacidad de adsorción y el potencial eléctrico [114]. Además, debe medirse el límite del peso molecular y el coeficiente del área de transferencia de masa [115].
2) Hemodiafiltración
Algunos estudios respaldan la elección de la hemodiafiltración postdilucional de alto volumen sobre las técnicas de diálisis actuales [116]. Más allá de la difusión y la convección, el patrón de eliminación de las TU mediante métodos de HD podría mejorarse mediante técnicas de adsorción [117], o mediante el uso de fármacos o moléculas para facilitar el cambio de la fracción unida a la fracción libre de proteínas [118]. La consideración de las características de la TU influye en la elección del tratamiento. Por lo tanto, los médicos deben considerar el radio molecular, las cargas eléctricas, las características del soluto de unión a proteínas, el peso molecular alto frente al bajo, hidrofílico frente a hidrofóbico, endógeno frente a exógeno, secreción por los túbulos renales y diferentes volúmenes de distribución [119].
La diálisis convencional de bajo flujo no elimina adecuadamente las TU relacionadas con triptófano, mientras que la hemodiafiltración de alta eficiencia aumentó las pérdidas de esta molécula [120].
3) Membranas de “medium cut Off” (MCO)
Una posible alternativa para filtrar estas toxinas se basa en nuevos tipos de dializadores que utilizan membranas con poros más uniformes y de mayor tamaño. Las membranas de alto flujo fueron diseñadas para eliminar moléculas medianas, sin embargo, el aclaramiento no es efectivo en moléculas con PM >15 kDa, como la mioglobulina (17 kDa), IL-6 (25 kDa) y FGF-23 (32 kDa) [121]. Un estudio de Sevinc et al. [122] compararon pacientes que recibían HD de alto flujo, seguido de HD con membrana de corte medio (MCO) o viceversa, y los resultados mostraron que los niveles de moléculas medias como la mioglobulina y la b2-microglobulina se redujeron en la primera y última sesión con dializadores MCO en comparación con los dializadores de alto flujo, lo que indica que es posible reducir los niveles de TU con esta modalidad. Otro resultado importante en este estudio es que el nivel sérico de albúmina disminuyó significativamente después de 3 meses con membrana MCO .
b) Técnicas adsortivas
Las membranas de adsorción, caracterizadas por la incorporación de partículas como carbón activado, zeolitas o estructuras metal-orgánicas, a la matriz polimérica de las membranas de HD, muestran mejores resultados en términos de eliminación de TU unidas a proteínas en comparación con las membranas de HD actuales. Sin embargo, existen preocupaciones con respecto a la hemocompatibilidad de los materiales de adsorción y se deben realizar más estudios para comprender su efecto sobre los componentes vitales de la sangre, como proteínas plasmáticas, HSA, plaquetas, etc. [123].
El uso de técnicas de hemoperfusión (HP) o perfusión de plasma se ha vuelto común, principalmente en combinación con otras técnicas de purificación sanguínea [124]. La adsorción se considera un mecanismo complementario para la eliminación de solutos, debido a la capacidad intrínseca de los sorbentes para unir moléculas en función de la afinidad química en lugar de la permeabilidad de la membrana, el coeficiente de tamizado y el límite de PM, mecanismos típicos que influyen en la difusión y la convección. En HP, la sangre circula a través de un cartucho que contiene el material absorbente sólido. En la práctica clínica, se han propuesto varios sorbentes nuevos para eliminar específicamente las moléculas diana, incluidas las TU unidas a proteínas [125]. La eficacia in vivo de los adsorbentes para eliminar las TU predichas por los estudios in vitro todavía se debate. En este campo, los materiales adsorbentes más prometedores se basan en divinilbenceno recubierto con polivinilpirrolidona (DVB-PVP) o celulosa con cadenas de hexadecilo por su alta hidrofobicidad y biocompatibilidad, haciéndolos apropiados para el uso directo en sangre total. Estos compuestos tienen una característica hidrofóbica similar a los metabolitos derivados de la microbiota, lo que justifica su uso para la absorción de IS y PCS.
Recientemente los cartuchos de resinas formados por divinylbenzene-polyvinyl pyrrolidone (DVB-PVP) han demostrado reducir los niveles de p-cresil sulfato e indolsulfato en un modelo in vitro. Como es lógico los estudios in vitro tienen la limitación de que las moléculas están libres cuando se realizan. Cualquier resultado que muestre que bajan los valores de estas toxinas deben analizarse con cuidado pues pueden referirse solo a forma libre y no unida a proteínas y por lo tanto tener un interés limitado [15] .
c) Desplazadores
Las TU unidas a proteínas están en el torrente sanguíneo en dos formas: una fracción ligada principal (y no difusible, unida a la albúmina) y una fracción libre menor. Como resultado, la mayoría de las terapias de reemplazo renal (como la HD) eliminan pobremente estos compuestos y su concentración difícilmente puede disminuirse en pacientes con enfermedad renal en etapa terminal [126]. Se podría lograr un aumento de la fracción libre de ellas usando desplazadores químicos que pudieran competir con estas para unirse a la albúmina sérica. Se llaman desplazadores químicos y son una opción muy interesante para mejorar la eliminación de las TU en pacientes con ERC [126] .
El uso de fármacos desplazadores de estas toxinas es una de las líneas actuales más prometedoras [127]. Entre los fármacos más usados son la furosemida, triptófano, DHA (Ácido docohexaenoico) y el ibuprofeno que por sus características farmacológicas presentan un alto porcentaje de unión a proteínas y compiten con las TU por los mismos sitios de unión a la albumina [128]. Esta unión permite un aumento de la fracción libre de toxinas susceptibles de poder ser dializadas. Sin embargo, los estudios publicados hasta el momento reflejan la necesidad de usar dosis masivas intravenosas de estos fármacos para conseguir el efecto desplazante impidiendo este hecho su uso en la práctica clínica por su potencial toxicidad [126].