Nefropatía por Cambios mínimos
La NCM(NCM) es, como la glomeruloesclerosis focal y segmentaria (GESF) y la glomerulonefritis mesangial IgM (GNIgM), una podocitopatia sin depósitos de inmunocomplejos en el glomérulo. Se define por la presencia de un síndrome nefrótico (SN), habitualmente puro, por la ausencia de lesiones morfológicas en microscopía óptica y de depósitos de inmunoglobulinas y complemento en inmunofluorescencia y por la desaparición (o fusión) de los pedicelos en microscopía electrónica [1].
La NCM tiene un curso clínico crónico marcado por recidivas, suele responder a los corticoides (Síndrome Nefrótico Corticosensible: SNCS) y a largo plazo, tiene un riesgo muy bajo de progresión hacia la enfermedad renal crónica (ERC) (5%) [2].
La GNIgM es para algunos autores una forma de transición entre la NCM y la GESF. Presenta una proliferación mesangial difusa leve, depósitos de IgM y de complemento y depósitos densos en el mesangio. La sensibilidad a los corticoides es menor que en la NCM, la incidencia de recidivas del SN es mayor y hay más progresión hacia la ERC [3].
La GESFESFS tiene mayor incidencia de HTA y microhematuria, es con más frecuencia resistente a los corticoides (Síndrome Nefrótico Corticoresistente: SNCR) y el riesgo de progresión de la ERC es mucho más elevado (70% a los 10 años de evolución) [4] [5]. No obstante, la NCM y la GESF no son sinónimos de SNCS y de SNCR respectivamente; en una serie pediátrica reciente de 2041 niños con SNCR, 56% tenían una GESF y 20% una NCM [6]. Este solapamiento entre signos clínicos y lesiones histológicas de las 2 enfermedades hacen pensar que no son entidades totalmente separadas. La NCM puede ser una forma precoz en la cual se inicia una lesión del podocito que se resuelve en la mayoría de los casos. Si la lesión inicial es severa o si los mecanismos de reparación no funcionan, se producen la pérdida de los podocitos así como las lesiones histológicas de la GESF. Esta última seria un estadio más avanzado de la misma enfermedad. Esto parece demostrarlo, en algunos pacientes, la aparición de lesiones de GESF en biopsias repetidas de NCM cortico-resistentes [6] [7], la presencia de lesiones histológicas de NCM en la biopsia renal realizada precozmente por proteinuria después de un trasplante renal realizado a un paciente con GESF [2] [8] y el hecho de que compartan mecanismos fisiopatológicos [9] [10].
La NCM puede ser primaria en ausencia de causa identificable (se incluyen las formas asociadas a mutaciones genéticas) o en el 15% de los pacientes es una forma secundaria a otra enfermedad glomerular (glomerulonefritis IgA, LES, diabetes tipo I, virus de la inmunodeficiencia humana), a un alérgeno, a la toma de algunos fármacos como los antiinflamatorios no esteroideos, a un linfoma de Hodgkin o a un timoma. Solo se puede confirmar que se trata de una forma primaria si se han descartado las causas mencionadas (Tabla 1) [2] [9] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21].
EPIDEMIOLOGÍA
La NCM es la causa del 80% de los casos de SN diagnosticados antes de los 10 años, del 50% de los casos diagnosticados entre los 10 y los 16 años y del 15-25% de los casos de SN idiopático del adulto [22] [23] [24] [25] [26] [27] [28] [29]. Es una enfermedad minoritaria con una incidencia que varía entre 0,4 y 2,4 casos/100000 habitantes/año [28]. Algunos datos epidemiológicos muestran variaciones geográficas y étnicas: la incidencia es mayor en Asia que en América del Norte o Europa y el porcentaje de GESF como causa de SN es mayor en la población de raza negra. Estas diferencias pueden ser la consecuencia de variaciones geográficas en las indicaciones de biopsia renal y de factores genéticos o ambientales [29] [30].
ETIOPATOGENIA
Los mecanismos fisiopatológicos de la NCM son poco conocidos, pero parte de ellos son compartidos con la GESF [31] [32] [33] [34].
Genes de susceptibilidad
(Véase los capítulos "Glomeruloesclerosis Focal y Segmentaria" y "Síndrome Nefrótico Corticorresistente, Genético y Familiar"). Se han identificado hasta ahora mutaciones en más de 50 genes en el SNCR , gracias a las técnicas de secuenciación masiva, principalmente en la GESF, pero también en la NCM [34].
Son genes que codifican proteínas de las distintas partes de la barrera de filtración glomerular: citoesqueleto del podocito, diafragma de hendidura, endotelio fenestrado y membrana basal glomerular. En la actualidad el estudio genético se reserva, en el caso de los adultos, a los que tienen un SNCR y una historia familiar de SN o si presentan signos extrarrenales. El hecho de que su coste haya disminuido considerablemente, de que haya cada vez más posibilidades de acceder a él y de que se hayan hecho avances considerables en este campo permitirán que forme parte muy pronto de la evaluación de estas podocitopatías [35] [36] [37].
Es probable que la NCM sea la consecuencia de interacciones complejas entre:
Un primer evento que inicia la enfermedad y corresponde a la inducción de la expresión de C80 (B7-1) en el podocito en respuesta a un factor circulante (citoquinas, alérgenos, derivados de microorganismos). Este factor disminuye la carga aniónica de la MBG, aumenta el coeficiente de cribado y permite el paso al espacio urinario de proteínas con carga negativa como la albúmina [38]. En condiciones normales, la expresión de C80 en los podocitos está controlada por las citoquinas de los linfocitos Treg (IL-10) y CTLA-4 (antígeno 4 del linfocito T citotóxico) [39].
Un segundo evento que provoca el SN es debido al mal funcionamiento de estos mecanismos de autorregulación. Se mantiene entonces la expresión de los C80 y la proteinuria ("two hit hypothesis") [35] [36] [40].
Desregulación de la inmunidad adaptativa
Tiene un papel importante en la patogenia de la NCM. Esta desregulación se produce a distintos niveles:
Genético
Se han descrito en el SNCS variantes genéticas de los loci HLA-DQ y HLA-DR, en estudios de asociación en distintas poblaciones y etnias [41] [42] [43]. En un estudio a nivel de exoma completo que analiza la asociación de variantes codificantes en una cohorte sud-asiática de 214 niños con SNCS, se han identificado 4 variantes en los loci HLA-DQA1 y HLA-DQB1 cuya asociación con en SNCS ha sido replicada en una cohorte independiente de 100 niños de población blanca de origen europeo [44]. Estos antígenos HLA están presentes en las células presentadoras de antígenos y algunos alelos específicos aumentan la susceptibilidad de padecer una enfermedad autoinmune sistémica (artritis reumatoide, enfermedad de Behcet, esclerosis múltiple, diabetes tipo I, psoriasis, miastenia, LES, enfermedad celiaca, uveítis...) o renal (nefropatía membranosa, GN IgA, vasculitis asociada a ANCA) [45] [46].
También se han descrito mutaciones autosómicas recesivas en genes relacionados con la síntesis de la coenzima Q10 (COQ2, COQ6 y ADCK4). En este caso, se corrige el SN con suplementos orales de esta coenzima [47].
Linfocitos T y liberación de un factor circulante capaz de aumentar la permeabilidad capilar.
Esta hipótesis fue avanzada por Shalhoub en 1974 [31] y se basa en las siguientes observaciones:
Los corticoides y la ciclofosfamida (esta última se administra en casos de corticodependencia o corticoresistencia) inducen una remisión del SN en la mayoría de los casos [2] [47] [48].
La NCM ocurre con mayor frecuencia en los pacientes con linfoma de Hodgkin que en la población general [49] [50].
-Las remisiones del SN pueden asociarse a una rubeola que se acompaña de una disminución de la inmunidad celular [51].
Linfocitos T
En un brote de SN se producen cambios en las subpoblaciones de linfocitos T y en las citoquinas que los activan, con un predominio de los linfocitos Th2 y de las citoquinas correspondientes (IL-4,-IL-5, IL-9, IL-13, IL-10) sobre los linfocitos Th1 (Interferon-gamma, TNF-beta, IL-2, IL-8) [52] [53] [54]. También se sabe que los linfocitos Th2 son los responsables de las reacciones inflamatorias y del aumento de IgE en los pacientes con atopia. Esta doble implicación de los Th2 en la NCM y en la atopia subraya la posible asociación, propuesta hace años, entre NCM y atopia [55] [56] [57] [58].
También esta presente una disminución del número de los linfocitos T reguladores en caso de brote de SN y un aumento de los linfocitos Th17. Además, estas citoquinas podrían modificar de forma directa la ultraestructura del podocito [52] [54] [59] [60] [61]. Estos datos sugieren un papel de las subpoblaciones de linfocitos T, cuya importancia y mecanismos quedan por precisar.
Factores circulantes, aún no identificados, capaces de aumentar la permeabilidad capilar.
La hipótesis de su existencia se apoya en muchas observaciones clínicas, algunas descritas en fases tempranas de una NCM, la mayoría en formas primarias de GESF:
Aparición de un SN transitorio en un recién nacido de una madre con SN [62]
Desaparición de un SN después del trasplante de un riñón con SN por NCM a un paciente sin SN [63]
Recidiva del SN después del trasplante renal en el 40%-50% de los pacientes con SNCR [64] [65], esta recidiva puede ocurrir en las horas siguientes al TR.
Obtención de una remisión transitoria con intercambios plasmáticos (riñones propios o injerto renal) [66] [67].
Inducción de una proteinuria en ratas después de la administración del sobrenadante de los linfocitos [48].
Hay muchos factores candidatos a ser responsables del aumento de la permeabilidad capilar:
La forma soluble del receptor del activador del plasminógeno tipo urokinasa (soluble urokinase-type plasminogen activator receptor) o suPAR es el más conocido. Está más elevado en la orina y el plasma de los pacientes con GESF recurrente después del trasplante que en pacientes con NCM o GESF no recurrente. Su expresión esta aumentada en el riñón de pacientes con GESF [69] [70]. Estos resultados no se confirman en otros estudios. Se han encontrado además niveles elevados de suPAR en otras enfermedades renales, con o sin proteinuria y en pacientes con ERC y riesgo de desarrollar una insuficiencia renal aguda [71] [72]. Parece más bien tratarse de un factor que contribuye a la formación de una lesión renal en general y sus niveles indican la progresión de la enfermedad renal con o sin proteinuria.
Anticuerpos anti CD40: un aumento de estos anticuerpos predice la recidiva de una GESF después del trasplante renal. Pertenecen a la superfamilia de los receptores del TNF y tienen un papel importante como moléculas coestimuladoras en la inmunidad y en la inflamación. Como su ligando (CD40L), se expresan en diversos tejidos (células presentadoras de antígeno endotelio, células epiteliales como los podocitos y estimulan la producción de quimioquinas, metaloproteasas, PARsu y PARu [73]. Los datos disponibles son experimentales y necesitan confirmación.
IL-13: esta interleuquina se produce espontáneamente en los pacientes con NCM, aumenta su ARN mensajero durante las recaídas del SN y los linfocitos B expresan su receptor. La transfección del gen de la IL-13 induce albuminuria en las ratas. En este modelo, la proteinuria se asocia a una sobre expresión del gen que codifica CD80 (o B7-1), proteína transmembrana presente en la superficie de los linfocitos B, de las células presentadoras de antígeno y en la superficie de los podocitos. Una vez activada esta proteína provoca la reorganización del citoesqueleto de actina, la fusión de los pedicelos y proteinuria. Los niveles urinarios de CD80 están mas elevados durante los brotes de SN que en los periodos de remisión en la NCM y que en la GESF [74] [75] [76] [77].
Hemopexina: es una glucoproteína presente en el plasma de los pacientes con NCM. Produce proteinuria al ser administrada a un riñón aislado de rata e induce una reordenación del citoesqueleto de actina de los podocitos en cultivo. Esta reordenación es reversible y depende de la nefrina. La hemopexina también induce una disminución de la glicocálix endotelial cargada negativamente [57] [78]. La implicación de la hemopexina en la NCM esta todavía por confirmar. El aumento de permeabilidad capilar inducida por estos factores se debe a una modificación de los pies de los podocitos que lleva a una fusión completa de los mismos y a una disminución de las cargas aniónicas de la membrana basal glomerular y del endotelio. Esto permite que proteínas plasmáticas de bajo peso molecular y con carga negativa a pH neutro, como la albúmina sérica, atraviesen con mayor facilidad la pared de los capilares glomerulares [78] [79].
Por otra parte, el hecho de que algunos pacientes muestren una respuesta favorable al rituximab, un anticuerpo monoclonal dirigido contra los linfocitos B CD20+, parece indicar que también los linfocitos B tienen un papel en la patogenia de esta enfermedad. La diferenciación de las células B parece verse afectadas en la NCM como lo demuestra la disminución frecuente de algunas subclases de IgG (IgG1, IgG2 o IgG3) que no se puede explicar solo por las pérdidas urinarias. Esto sugiere la presencia de anomalías de la cooperación de linfocitos T/B en la NCM [80].
Linfocitos B y autoinmunidad
El hecho de que algunos pacientes muestren una respuesta favorable al rituximab, un anticuerpo monoclonal dirigido contra los linfocitos B CD20+, indica que también estos linfocitos tienen un papel en la patogenia de esta enfermedad. La diferenciación de las células B parece verse afectadas en la NCM como lo demuestra la disminución frecuente de algunas subclases de IgG (IgG1, IgG2 o IgG3) que no se puede explicar solo por las pérdidas urinarias. Esto sugiere la presencia de anomalías de la cooperación de linfocitos T/B en la NCM [80]. Se han descubierto, recientemente, anticuerpos antinefrina en el suero del 30% de los pacientes de una cohorte de 62 adultos y niños con una NCM. Los niveles son altos cuando la extracción coincide con un brote de SN y disminuyen o desaparecen en periodos de remisión. La IF muestra una co-localización de depósitos granulares muy finos de IgG y nefrina en 9 pacientes con anticuerpos circulantes. Una mujer adulta, con un SNCD que debuto en la infancia, desarrolla una GEFS y una ERC-5D. Después de un TR, el SN recidiva, coincidiendo con niveles altos de anticuerpos antinefrina en el suero. La plasmaferesis permite la remisión del SN y la desaparición de los anticuerpos circulantes [81]. También muy recientemente, se ha descubierto en el 66% de 341 niños chinos con SNI, 7 autoanticuerpos dirigidos contra antígenos podocitarios [82][83]. Estos datos se han vistos confirmados en un modelo murino de SNI. Se trata de ratas inmunizadas con la proteína Crb2, una proteína transmembrana presente en los pedicelos. A las 9-18 semanas de la inmunización presentan un SN. Histológicamente tienen una NCM y en algunos casos uns Las cambios histológicos son los de una NCM y en algunos casos (después de las 18 semanas) de una GEFS. La inmunofluorescencia muestra una co-localización de IgG granular (muy discreta) y de Crb2 [84].
PATOLOGÍA DE LA NCM
Microscopía óptica
Glomérulos
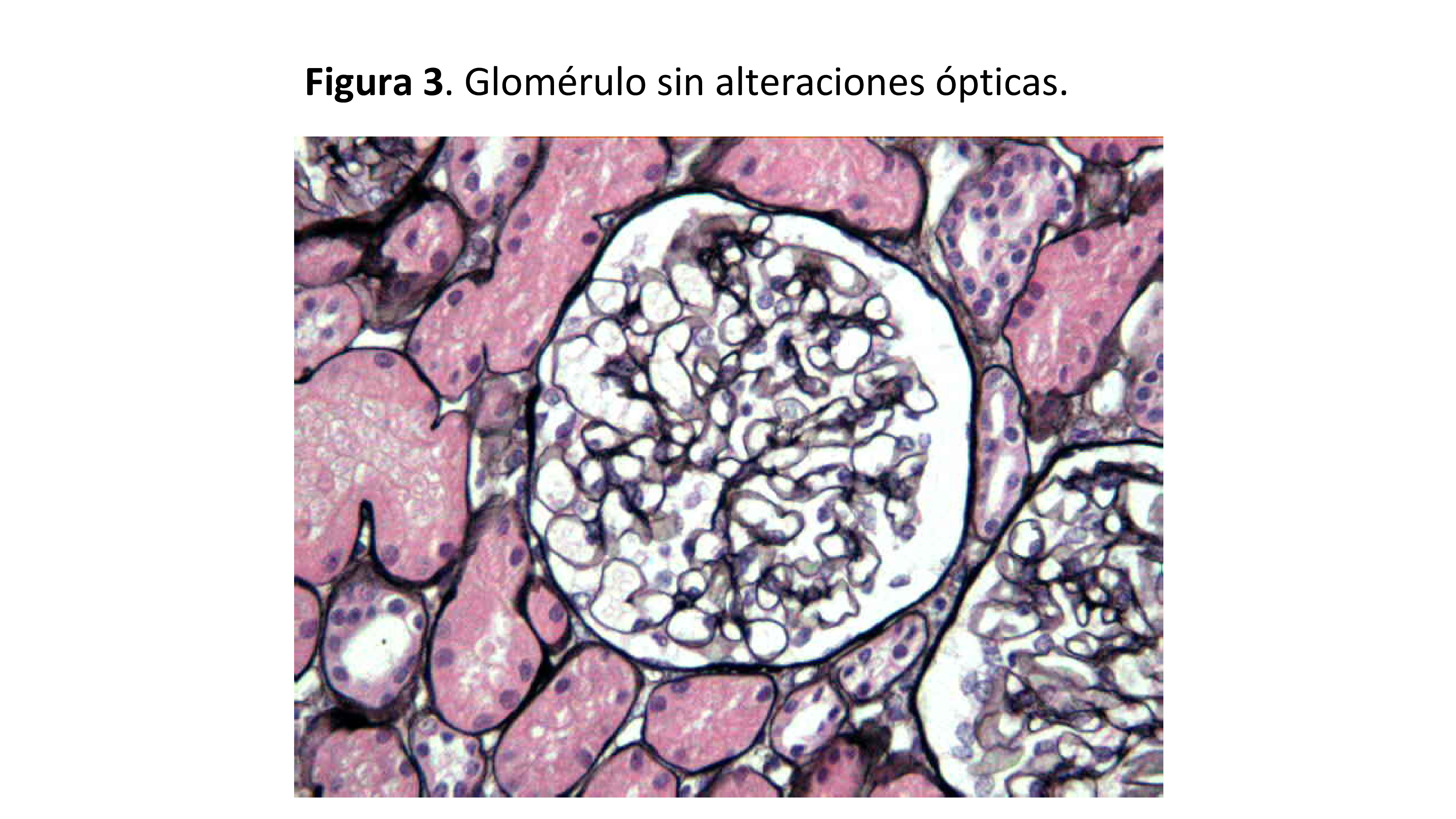
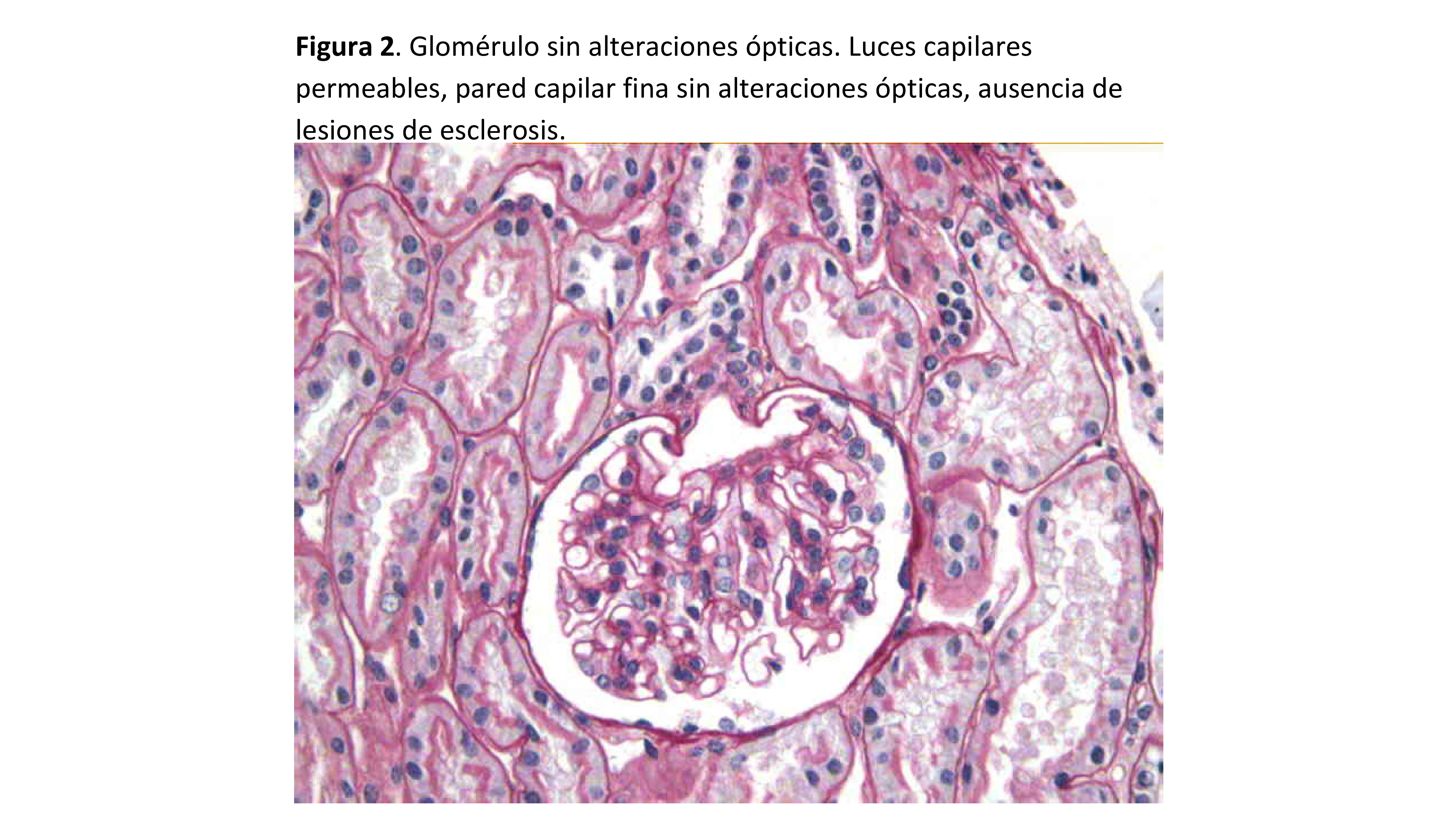
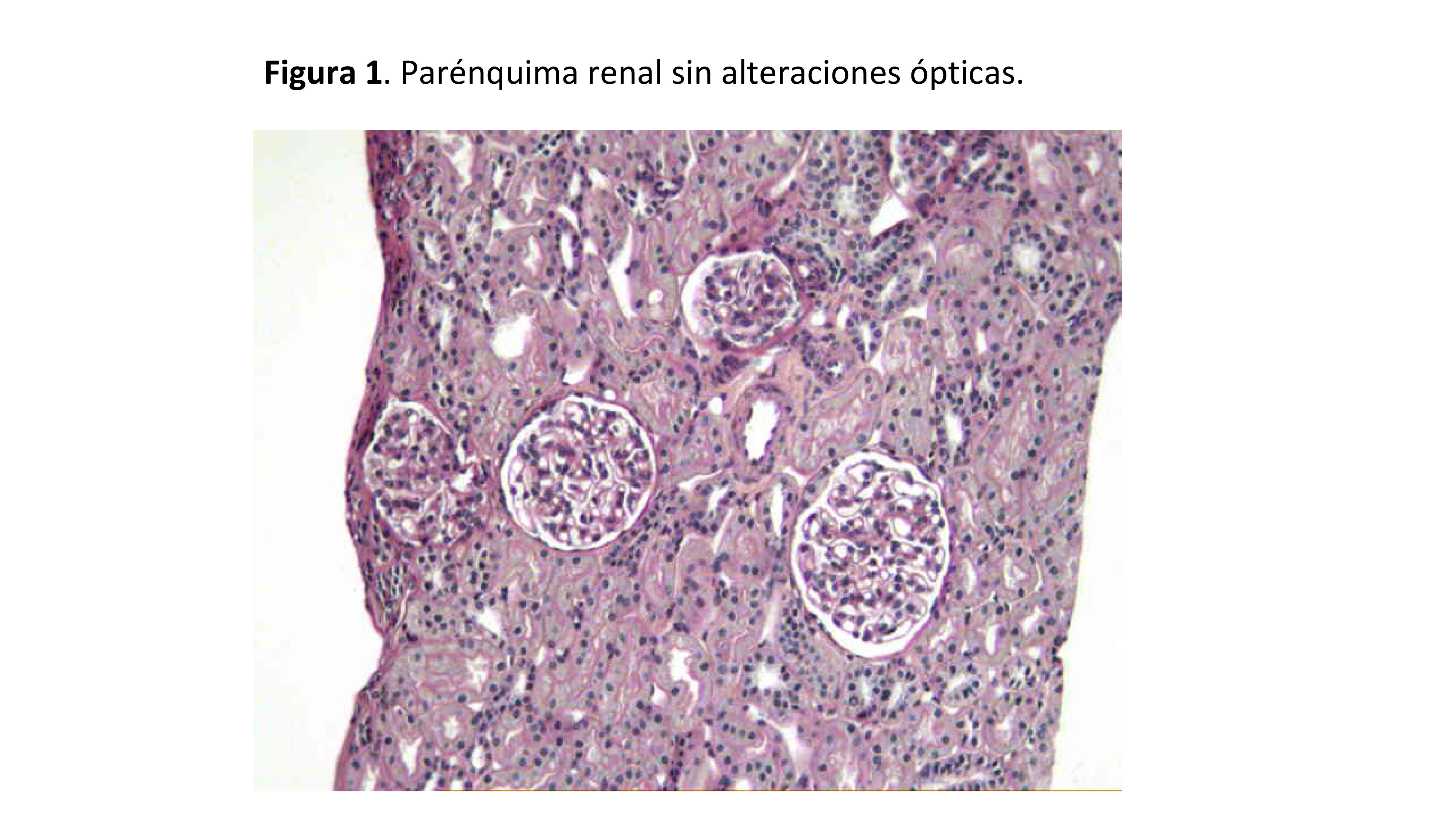
La principal característica morfológica de la NCM es la ausencia de alteraciones ópticas en el parénquima renal (Figura 1). La estructura glomerular debe estar preservada, sin alteraciones ópticas de la pared capilar glomerular, ni alteraciones en la celularidad glomerular (Figura 2) (Figura 3). La membrana basal glomerular es normal en grosor, textura y contorno. Puede observarse leve edema de los podocitos, pero no hiperplasia (observada con frecuencia en la GESF).
La presencia de algunas características morfológicas es incompatible con el diagnóstico de NCM. Se trata de :
- esclerosis glomerular segmentaria o colapso glomerular segmentario.
- adherencias capsulares.
- proliferación endocapilar.
- hialinosis glomerular.
En cambio, la presencia de otros hallazgos morfológicos se acepta. Se trata de:
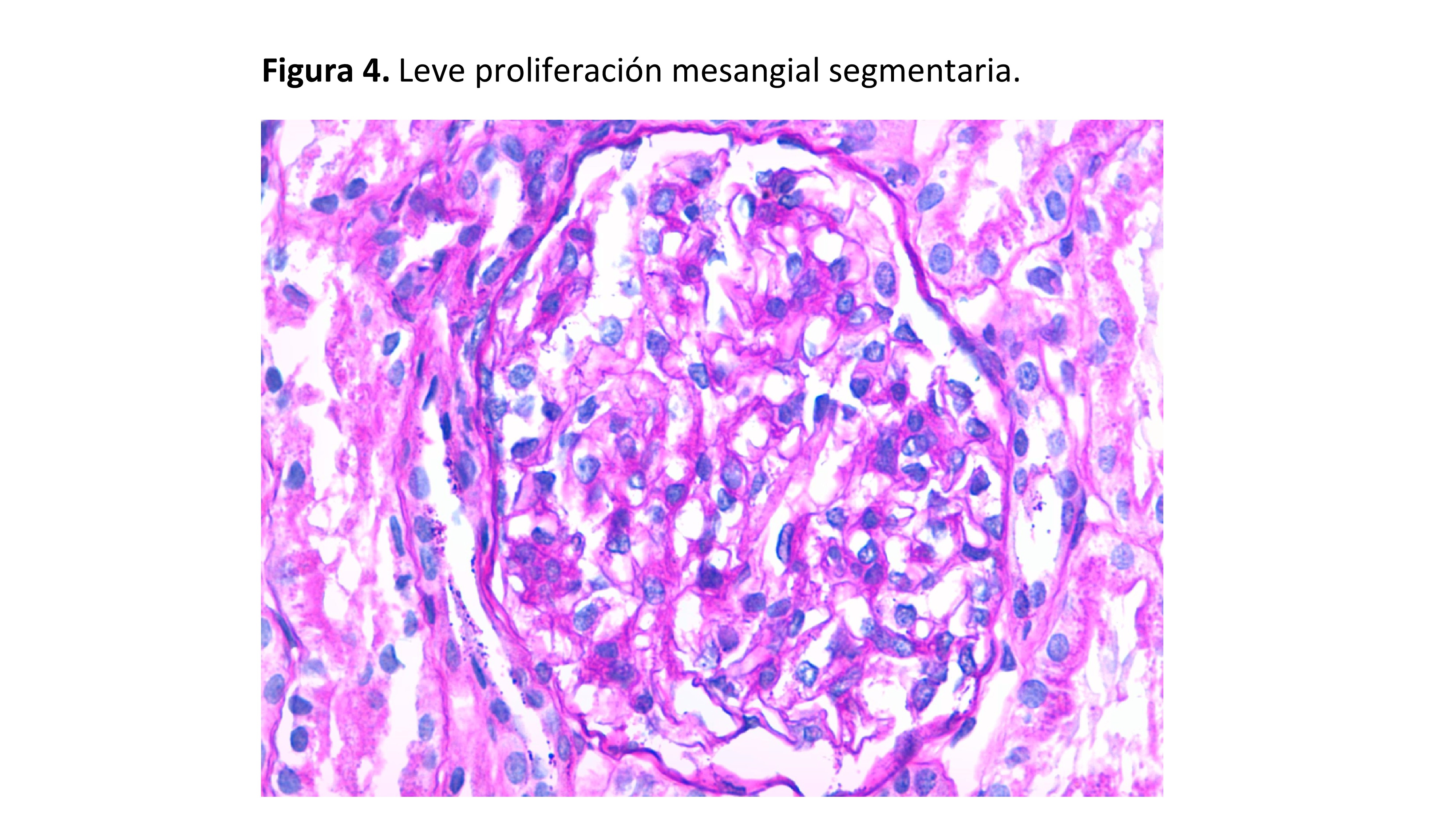
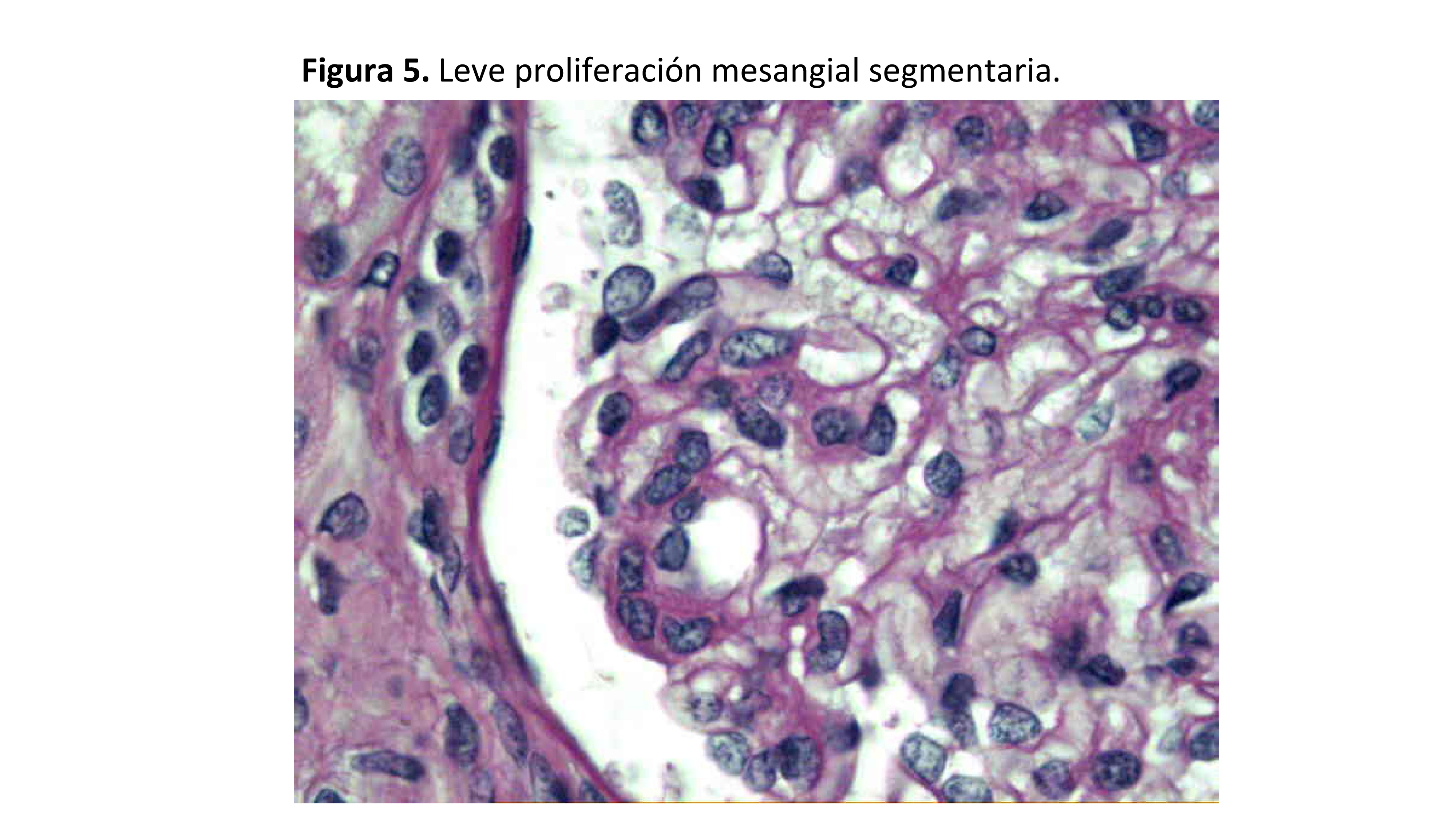
Leve incremento mesangial, focal y consistente en un incremento de la matriz mesangial o de la celularidad mesangial (Figura 4) (Figura 5).
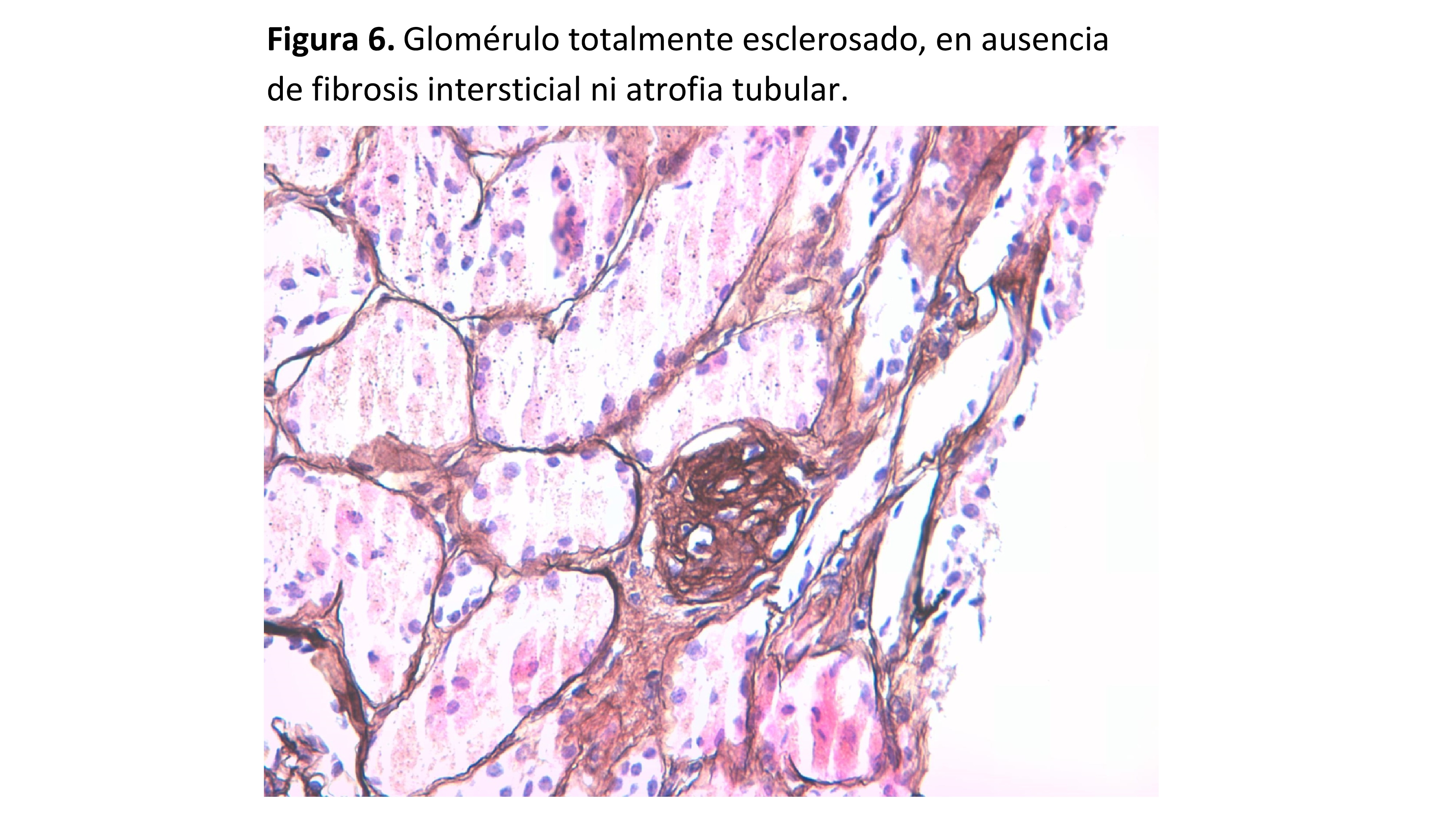
Glomérulos totalmente esclerosados (Figura 6): el número de glomérulos esclerosados debe ser inferior a la edad del paciente dividido por 2 menos 10. La presencia de glomérulos esclerosados (sin fibrosis intersticial ni atrofia tubular) no tiene implicaciones pronósticas ni se correlaciona con otros hallazgos como proliferación mesangial o depósito de IgM.
Túbulos
No hay hallazgos morfológicos tubulares característicos de la NCM (Figura 7) (Figura 8). Pueden observarse cambios inespecíficos en relación a la proteinuria:
- Vacuolas claras o glóbulos hialinos citoplasmáticos (que corresponden a reabsorción de proteínas): presentes en el epitelio tubular proximal, eosinófilos, PAS positivos y rojos con la tinción de tricrómico.
- Fina vacuolización citoplasmática (depósito de lípidos): presentes en el epitelio tubular proximal, claros con la H&E y no se tiñen ni con el PAS ni con el tricrómico.
La presencia de atrofia tubular no es propia de la NCM. Se acepta su presencia en focos parcheados, en pacientes mayores.
Intersticio
No hay hallazgos morfológicos intersticiales característicos de la NCM (Figura 7) (Figura 8).
Pueden observarse algunos hallazgos inespecíficos, como:
- Edema intersticial.
- Fibrosis focal (en relación con atrofia tubular) en pacientes mayores.
- Fibrosis intersticial como complicación de tratamiento previo con ciclosporina u otros inhibidores de la calcineurina.
- Infiltrado inflamatorio crónico secundario a daño tubular.
- Ocasionalmente pueden observarse células espumosas intersticiales, en general de forma aislada.
Vasos
No hay hallazgos morfológicos vasculares característicos de la NCM (Figura 7). Puede observarse fibrosis intimal en pacientes mayores.
Inmunofluorescencia
En la NCM no se observa la presencia de depósitos inmunes. De hecho, la presencia significativa de depósitos inmunes excluye el diagnóstico de NCM. Puede observarse leve depósito de IgM y C3 mesangial, sin que ellos se corresponda con depósitos electrón-densos. Estos leves depósitos se consideran secundarios a la proteinuria.
Microscopía electrónica
La característica morfológica principal de la NCM es ultraestructural, y afecta al podocito (Figura 9) (Figura 10). Es característica la extensa desaparición (o fusión o engrosamiento) de los pedicelos, de extensión variable, aunque suele ser un cambio extenso. Debe afectar como mínimo la mitad de la superficie de las asas capilares. También pueden observarse otros cambios en las células epiteliales como hipertrofia, transformación microvillositaria, formación de vacuolas y gotitas de reabsorción de proteínas o lípidos.
La membrana basal glomerular es normal en cuanto a grosor y textura.
En algunos casos, pueden observarse pequeños depósitos electrondensos paramesangiales que se correlacionan con depósitos de IgM y que se corresponden con proteínas plasmáticas atrapadas durante la proteinuria. Para el diagnóstico de NCM, no se acepta la presencia de depósitos inmunes en la periferia de los capilares glomerulares.
DIAGNÓSTICO DIFERENCIAL
Nefropatía IgM
Ópticamente no se observan alteraciones, o una leve proliferación mesangial. En la inmunofluorescencia, se observa depósito mesangial de IgM (++/+++) y se demuestran los depósitos mesangiales ultraestructuralmente.
Nefropatía C1q
Ópticamente puede no observarse alteraciones, una proliferación mesangial de intensidad variable o bien un patrón de glomeruloesclerosis focal y segmentaria. En la inmunofluorescencia se observa depósito mesangial de C1q.
Glomeruloesclerosis focal y segmentaria
Para descartar una GESF es necesario una muestra adecuada, idealmente más de 25 glomérulos incluyendo zona yuxtamedular. Si se identifican lesiones de esclerosis segmentaria, no hay problema de diagnóstico diferencial. El problema surge cuando dada la afectación focal de las lesiones, éstas no se identifican en la biopsia renal. En esos casos, la presencia de algunas características apoya el diagnóstico de glomeruloesclerosis: mayor tamaño glomerular o atrofia tubular. La presencia de afectación túbulo-intersticial crónica hace sospechar que se trata de launa GESF y debe motivar a la seriación del material buscando la lesión diagnóstica. La extensión de la desaparición de los pedicelos no diferencia la NCM de la GESF.
CUADRO CLÍNICO
Es el de un síndrome nefrótico clínicamente evidente, de aparición brusca, con edemas generalizados que pueden ir acompañados de ascitis y derrame pleural.
La proteinuria de rango nefrótico suele ser masiva y la hipoalbuminemia (< 30 g/L) severa. Como consecuencia del SN, está presente una hiperlipemia. El SN puro es mucho menos frecuente que en el niño [85] [86] [87] [88]:
- En el 10%-30% de los casos hay microhematuria.
- Hasta en el 40% de los casos se observa hipertensión arterial
- Puede estar disminuido el filtrado glomerular por la edad avanzada de muchos pacientes y por la disminución del volumen intravascular debido a la hipoalbuminemia.
Las complicaciones más frecuentes son las infecciones y los eventos tromboembólicos.
La función renal es normal en la mayoría de los pacientes, aunque algunos con SN grave pueden presentar una discreta disminución del filtrado glomerular "funcional" que vuelve a la normalidad cuando se corrige el SN [85] [86] [87] [88] [89] [90].
Hasta el 40% de los pacientes mayores pueden desarrollar un fracaso renal agudo grave cuya patogenia es desconocida. La edad, el sexo masculino, la HTA, la proteinuria masiva, las lesiones de arterioloesclerosis y la hipovolemia agravada por los diuréticos son factores de riesgo [7] [86] [87] [88] [89] [90] [91] [92][93] [94].
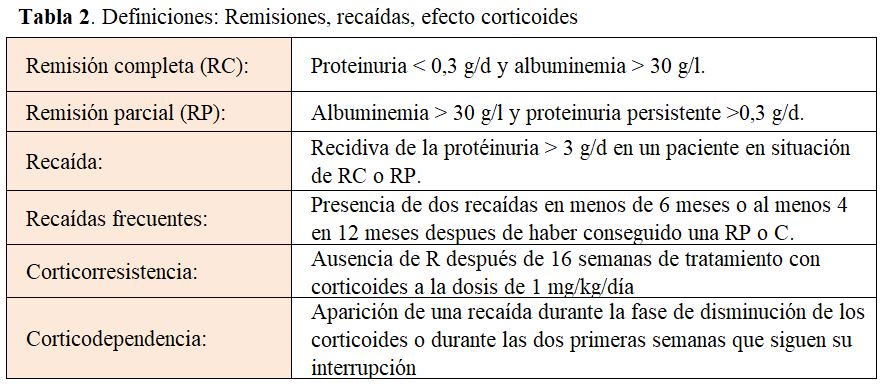
TRATAMIENTO Y PRONÓSTICO
Tratamiento inicial
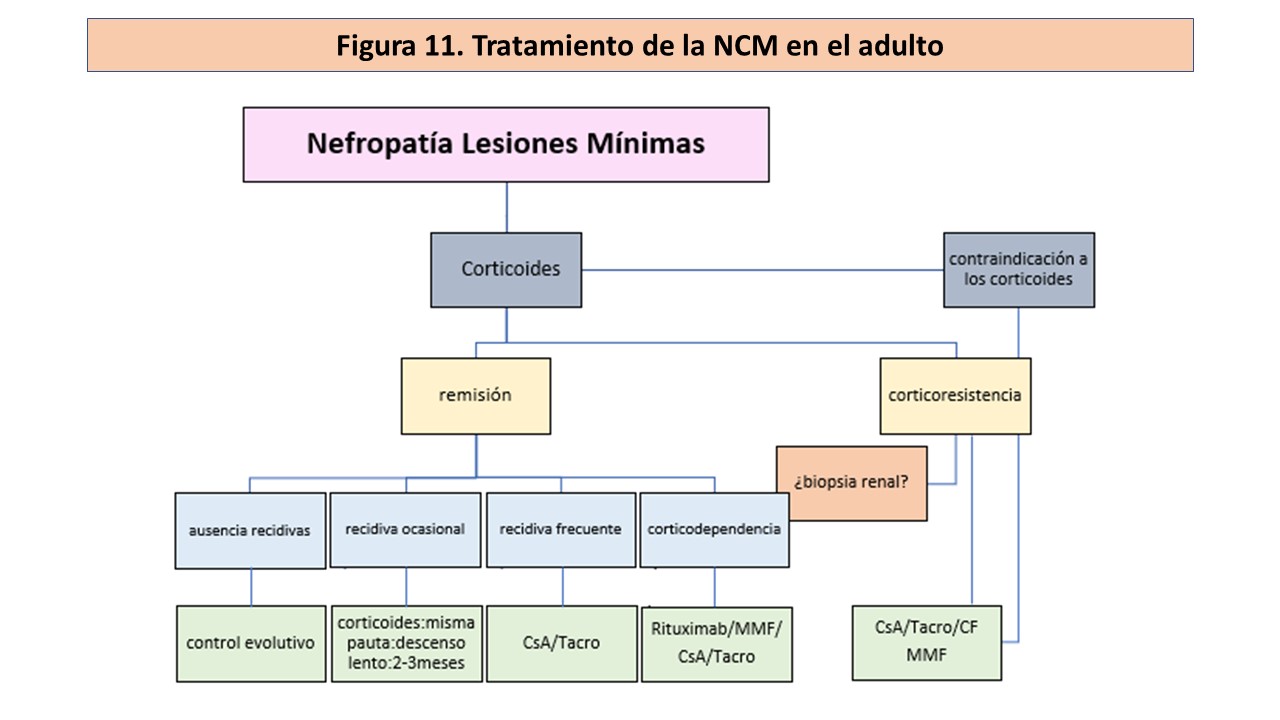
Mientras persiste el SN, el paciente corre el riesgo de presentar las complicaciones características del mismo, sobre todo trombosis venosas e infecciones. Como la tasa de remisiones espontáneas es excepcional y retrasar el inicio del tratamiento favorece la aparición de una insuficiencia renal aguda y de una cortico-resistencia, se justifica el inicio rápido del tratamiento una vez diagnosticada la NCM por biopsia renal [48] [95] (Figura 11).
El tratamiento con corticoides es el tratamiento de elección, aunque no existe ningún estudio controlado randomizado que lo apoye. Esta recomendación se basa en la opinión de los expertos, en datos fundamentalmente pediátricos y en algunos estudios retrospectivos realizados en el adulto.
En ausencia de contraindicaciones, la dosis inicial recomendada es de 1 mg/kg /d (máximo 80 mg/día), en una sola dosis matutina, para evitar la supresión de la glándula suprarrenal [95] [96] [97][98] [99].
Una vez conseguida la RC, se mantiene la dosis de prednisona 2 semanas más (un mínimo de 4 semanas y un máximo de 16 semanas), se reduce entonces a 0,5 mg/kg/d y se mantiene esta dosis durante 8 semanas. Posteriormente la disminución es lenta (5 a 10 mg/semana) hasta suspender los corticoides a los 6 meses de la remisión. Hay que estar atentos a la posible aparición de efectos secundarios y considerar tratamientos alternativos en el caso de que se manifiesten [98] [99] [100]. Otra posibilidad es iniciar el descenso de la dosis de corticoides antes de conseguir la RC, cuando hay una clara disminución de la proteinuria [7].
La tasa de remisiones (completas o parciales) esta relacionada con la duración del tratamiento (37 y 57% respectivamente a las 4 semanas de tratamiento, 68 y 75% respectivamente a las 8 semanas) [85] [86] [87] [88] [89] [100], 75 y 90% a las 16 semanas [101]. La CR se define, a partir de estos resultados, como la ausencia de respuesta a las 16 semanas de tratamiento [5] [20] [97] (Tabla 2). Estos resultados están muy alejados de la respuesta en los niños en los que se consigue un 90% de remisiones a las 8 semanas [102].
Algunos autores prefieren administrar los corticoides a días alternos (2mg/kg/día) con resultados similares tanto en eficacia como en seguridad [88].
Contraindicación o intolerancia a los corticoides a dosis altas
En casos de mal control de una diabetes, de enfermedad psiquiátrica, de obesidad mórbida, de osteoporosis o osteopenia o de rechazo a la toma de corticoides por parte del paciente, se utilizan tratamientos inmunosupresores alternativos (ciclofosfamida, anticalcineurínicos, ácido micofenólico o rituximab) asociados o no a dosis bajas de corticoides. Los resultados son similares a los conseguidos con dosis altas de corticoides [5] [102] [103].
En caso de SN persistente a pesar del tratamiento, se recomienda la administración de inhibidores del sistema renina angiotensina aldosterona o antagonistas de los receptores de la angiotensina II, de anticoagulación profiláctica (en caso de albuminemia inferior a 20-25 g/L) y de estatinas [5].
Recaídas
Aunque no existen estudios controlados, diversos estudios observacionales sugieren que el riesgo de recidivas del SN aumenta si la duración del tratamiento con corticoides es corta.
Tras el primer brote de la enfermedad son frecuentes las recaídas. Del 30 al 70% de los pacientes presentan una sola recaída en los primeros 6 meses después de conseguida la remisión, del 28 al 40% tienen recaídas frecuentes durante los dos primeros años que siguen a la remisión y del 14 al 30% son corticodependientes [85] [86] [88] [90] [99] [101].
En caso de recidivas frecuentes (mas de 3 recidivas al año) o de corticodependencia (2 recaídas seguidas durante la disminución de los corticoides o en las dos semanas que siguen la suspensión), es necesario introducir de nuevo los corticoides o utilizarlos de forma prolongada. El riesgo de complicaciones es alto. Para evitarlas se suele asociar otros inmunosupresores [62] [80] [85].
Recaídas aisladas
Cuando son aisladas, se deben tratar con la misma pauta inicial que el primer brote. El periodo de reducción (5 mg cada 3-5 días) hasta la suspensión suele ser más corto (de 1 a 2 meses) especialmente si la recaída esta diferida en el tiempo o desencadenada por una infección o un episodio alérgico.
Recaídas frecuentes y corticodependencia (Tabla 2)
Existen varias alternativas de tratamiento:
Dosis bajas de corticoides
En pacientes cortico-sensibles con recidivas frecuentes, una alternativa a los inmunosupresores es la administración de dosis bajas de corticoides a días alternos durante periodos largos (6-12 meses o más) en caso de buena tolerancia. Si la recaída se produce con dosis de prednisona superiores a 0,2 mg/kg/d, el riesgo de desarrollar efectos tóxicos es demasiado importante y se prefiere la introducción de inmunosupresores para mantener la remisión [85] [104] [105].
Anticalcineurínicos
Es el tratamiento de elección. Se utiliza la ciclosporina (CsA) (iniciar con una dosis total de 3-5 mg/kg/d, dividida en 2 dosis diarias, mantener unos niveles valle entre 150 y 200 ng/ml durante los 3 primeros meses, y de 100 a 150 ng/ml posteriormente) [106] [107] [108] o el tacrolimus (iniciar con una dosis de 0.05-0.1 mg/kg/d, mantener niveles valle entre 5-7 ng/ml durante los 3 primeros meses, y 4-6 ng/ml posteriormente) [109].
Contamos solo con estudios observacionales y un solo estudio randomizado: 60% al 90% de los pacientes con recidivas frecuentes y con SNCD respectivamente entran en RC o RP con una dosis de CsA de 4 a 6 mg/d [108] [110] [111].
En ausencia de respuesta a los 3 o 6 meses (según los grupos), se debe suspender el tratamiento.
En los pacientes respondedores existe un riesgo alto de dependencia a los anticalcineurínicos con recaídas (60 al 90% de los casos) en el periodo de disminución de la dosis o después de la suspensión del fármaco [108]. El riesgo es más alto si la duración del tratamiento es relativamente corta. Para evitar las recaídas, se propone un periodo de tratamiento de 18 a 24 meses con una disminución progresiva de la dosis.
En caso de tratamiento prolongado (más de 2 años) por dependencia, algunos grupos proponen realizar una biopsia renal para valorar el daño intersticial y arteriolar [106] [110] [112] [113].
Parte del efecto de la CsA es independiente de su acción sobre los linfocitos T y B. Bloquea la defosforilación de la sinaptopodina, una proteína organizadora de la actina del podocito. Este bloqueo inhibe la proteólisis de la sinaptopodina, estabilizando las hendiduras diafragmáticas y la concentración-relajación normal del podocito [114].
Ciclofosfamida:
Estudios no controlados en el adulto han demostrado que un ciclo de ciclofosfamida (CF) oral (2-2,5 mg/kg al día durante 8-12 semanas) iniciado después de haber conseguido la RC con corticoides, es efectivo para disminuir o incluso eliminar las recaídas en el 50% de los pacientes durante 5 años. [86] [88] [95] [98] [99]. Después del inicio de la CF, se inicia la disminución de la dosis de corticoides y se suspenden a las 4 semanas. La dosis de CF se ajusta para prevenir la leucopenia.
La incidencia de recaídas es menor con la CF que con los anticalcineurínicos. También mejoran los resultados cuando se prolonga el tratamiento de 8 a 12 semanas [85] [107] [115], pero las complicaciones de la CF (leucopenia, infertilidad, cistitis hemorrágica, infecciones, neoplasias) son frecuentes con dosis acumuladas superiores a 200-300 mg/kg y limitan su utilización de forma habitual.
Micofenolato
El micofenolato (MMF) ha mostrado una efectividad similar a la de los anticalcineurínicos (50 a 80% de remisiones), sin el riesgo de nefrotoxicidad, pero solo en estudios no controlados con pocos pacientes. La dosis diaria es de 750 a 1000 mg/d, la duración mínima del tratamiento de 12 meses. Como con la CsA el riesgo de recidiva después de su suspensión es alto por lo que se aconseja una disminución progresiva de la dosis antes de la suspensión [88] [116] [117] [118] [119].
Se necesitan estudios controlados para confirmar que el MMF como alternativa en la NCM en pacientes CD o con contraindicaciones a los corticoides o a otros inmunosupresores.
Rituximab
El Rituximab (Rtx) permite la depleción de los linfocitos B por 3 mecanismos [120]:
- Citotoxicidad celular mediada por anticuerpos
- Citotoxicidad dependiente del complemento
- Inducción de apoptosis.
Por otra parte, se une a la esfingomielina fosfodiesterasa tipo acida 3b (SMPDL3b) en los podocitos, estabilizando el citoesqueleto de actina y disminuyendo el fenómeno de fusión de los pedicelos y la apoptosis de los podocitos [121] [122].
En niños con SNI corticodependiente, el Rtx es eficaz y seguro lo que justifica su uso en la población adulta donde disponemos de algunos estudios prospectivos y retrospectivos unicéntricos y multicéntricos [123] [124] [125] [126] [127] [128], en los cuales también se muestra como un tratamiento seguro y eficaz para prevenir los brotes de SN en pacientes con SN difícil de tratar.
En un metaanálisis reciente que incluye 444 pacientes adultos tratados con Rtx por corticodependencia, más del 84% entran en RC y un 25% recaen a los 12 meses del tratamiento [129].
No hay ninguna pauta consensuada que establezca la dosis de Rtx ni el esquema de tratamiento que se debería usar. Las pautas descritas, con dosis más bajas que en la nefropatía membranosa o en las vasculitis asociadas a ANCA, son las siguientes:
Para inducir la remisión:
a) una dosis de 375 mg/m2 semanal, repetida 4 veces,
b) 1 dosis de 1 gramo quincenal repetida 2 veces
Para tratar una recidiva:
a) 375 mg/m2 (dosis única) y disminución progresiva de esteroides o inmunosupresores. Tratar con la misma pauta si se produce un brote.
b) 1 dosis única de 1 gramo y disminución progresiva de esteroides o inmunosupresores. Se trata con la misma pauta si se produce un brote.
En los casos de difícil control, se puede utilizar el Rtx con una periodicidad y dosificación muy variable según los autores y teniendo en cuanta los niveles de IgG y CD19: de 500 mg a 1g (1 sola infusión), repitiendo esta dosis cada 4-12 meses.
En estas indicaciónes y con estas dosis se han descrito muy pocos efectos secundarios: en el momento de la administración endovenosa la liberación de citoquinas puede producir fiebre, astenia, cefaleas, nauseas), a más largo plazo, hipogammaglobulinemia, infecciones (reactivación hepatitis B, neumocistis, leucoencefalopatía multifocal progresiva por virus JC) [120].
No está claro cual es el régimen óptimo ni la dosis adecuada, pero la mayoría de los autores piensan
que es un fármaco efectivo para mantener la remisión y reducir la cantidad y número de inmunosupresores necesarios.
Corticorresistencia
Un porcentaje escaso (5%-10%) de síndrome nefrótico por NCM muestra resistencia a los corticoides (Tabla 2). Puede ser debido a una duración del tratamiento con corticoides inferior a 16 semanas o a un diagnóstico patológico incorrecto, pudiendo tratarse de una GESF o de una nefropatía IgM no diagnosticadas si la muestra es inadecuada. Es aconsejable, en caso de duda razonable, realizar una nueva biopsia renal. También se sabe que hasta el 30% de estos casos, sobre todo en la infancia o entre los adultos jóvenes, son enfermedades hereditarias de causa monogénica: se han descrito mutaciones en más de 50 genes, de transmisión recesiva o dominante. Se tiene que realizar un estudio genético en todos los pacientes con un SNCR que debute antes de los 30 años [130] [131].
El tratamiento con CF aporta pocos beneficios en estos casos [98] [99] [132].
Los anticalcineurínicos son eficaces aunque no disponemos de resultados a largo plazo. El número de RP o RC es importante, pero las recaídas después de la suspensión son muy frecuentes. Es aconsejable no prolongar su administración más de 6 meses si no hay respuesta y evitar tratamientos de más de 18 meses (12 según algunos autores) [88] [95] [133].
En ausencia de respuesta, la actitud más razonable es el no insistir en el tratamiento inmunosupresor y limitarse al tratamiento del SN con diuréticos, inhibidores del sistema renina angiotensina aldosterona y estatinas.
PRONÓSTICO
Aunque algunos pacientes presentan numerosos brotes de SN o una dependencia prolongada a los corticoides, el pronóstico de la NCM es excelente. Las principales complicaciones son consecuencia de los tratamientos.
La insuficiencia renal avanzada es poco frecuente (< 5%) y solo ocurre en casos corticorresistentes. En estos casos, se observan lesiones de GESF si se repite la biopsia renal. Se desconoce si este dato corresponde a la ausencia de lesión de GESF en la biopsia diagnóstica, dado su carácter focal o a la evolución de un NCM hacia una GESF [59] [102] [134].
En conclusión, la mayoría de los pacientes con una NCM que debuta en la edad adulta son corticosensibles. Las recaídas aisladas responden bien a los corticoides y en caso de recaídas frecuentes o de corticodepencia, los anticalcineurínicos o el Rituximab son las alternativas de tratamiento. La corticorresistencia sugiere la presencia de lesiones de GESF. Hasta el 40% de los pacientes adultos presentan una insuficiencia renal aguda reversible. Las complicaciones derivadas del SN o del tratamiento son frecuentes. Las principales líneas de mejora son la identificación de biomarcadores que puedan orientar el tratamiento, la identificación de las dosis y duración más eficaces y seguras del tratamiento con corticoides y la realización de estudios controlados que permitan comparar los tratamientos de segunda línea.