Glomerulonefritis asociadas a alteraciones del complemento
Palabras clave
Enfermedad por anticuerpos anti membrana basal glomerular (Anti-MBG), Nefropatía membranosa, inmunocomolejos, complemento, activación del complemento
INTRODUCCIÓN
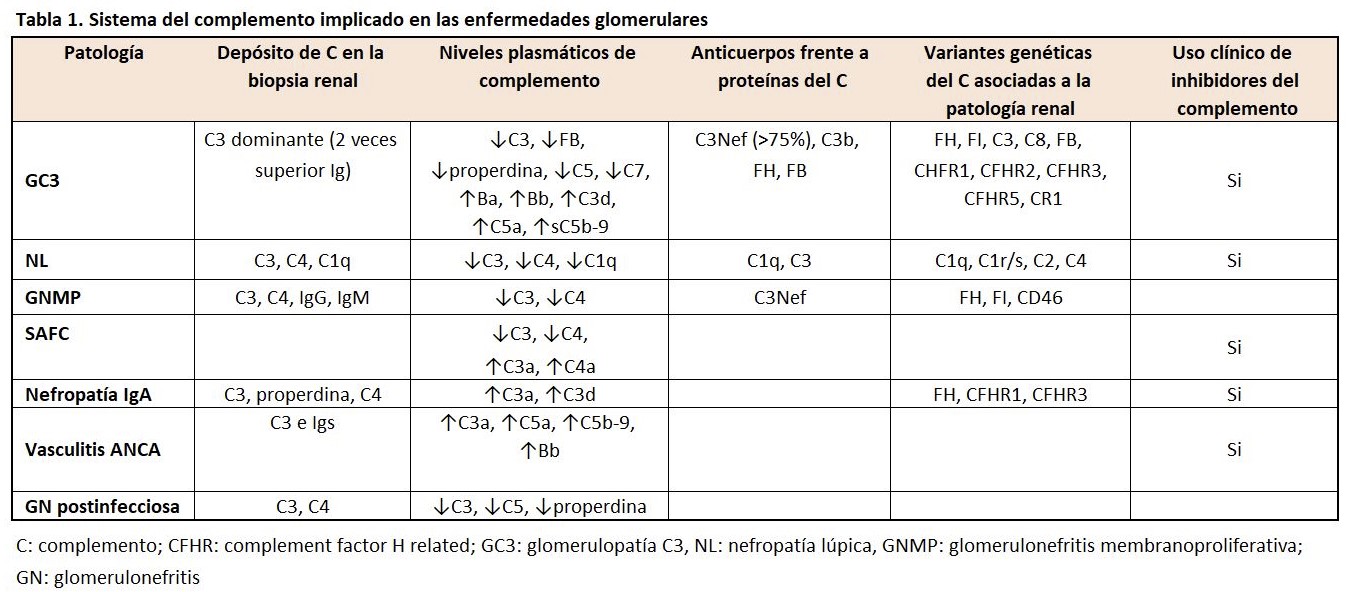
Existen diversas evidencias a lo largo de la historia sobre la implicación del complemento en la enfermedad glomerular. En los años 60 se comprendió el papel del complemento en el daño glomerular inducido por los inmunocomplejos (IC) [1], en la década de los 70 diversas proteínas del complemento eran detectadas por medio de la inmunofluorescencia y la inmunohistoquímica en las biopsias renales de los pacientes con patología glomerular [2]. Y, por último, estudios experimentales en modelos animales y en pacientes relacionan claramente el papel del complemento en la enfermedad glomerular [3] (Tabla 1).
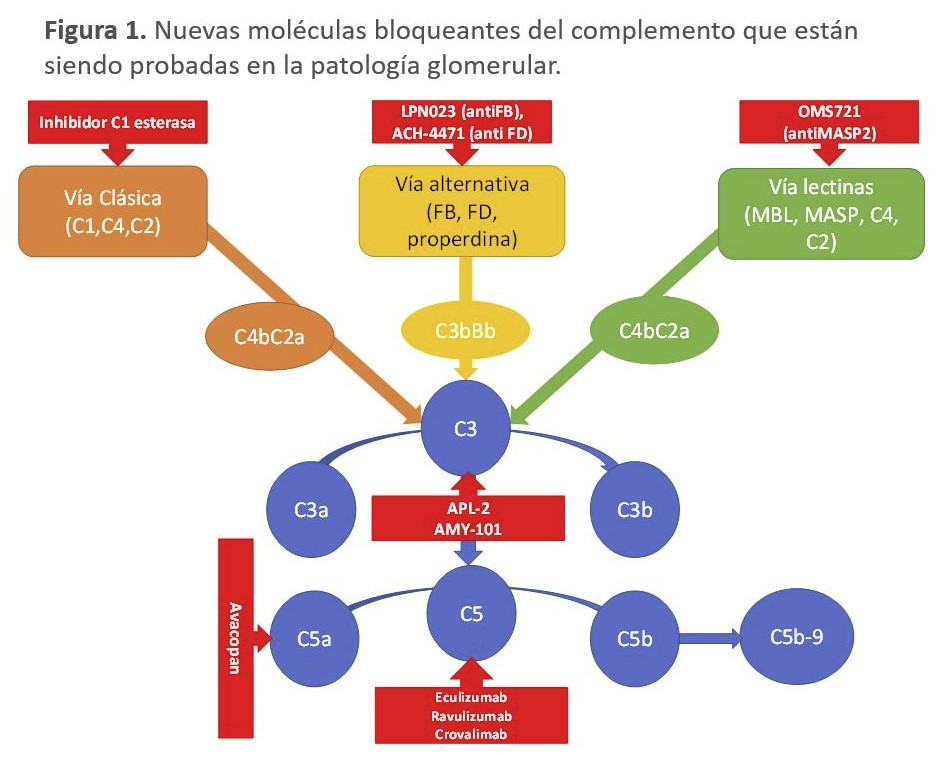
En los próximos años vamos a asistir al desarrollo de numerosas moléculas que bloquean diferentes factores del complemento (anti factor B, anti factor D, anti C3, anti MASP) en las patologías glomerulares, que permitirán el control de la inflamación y el daño renal provocado por los inmunocomplejos que no responden al tratamiento inmunosupresor habitual (Figura 1).
En esta revisión, vamos a dar una visión general de la evidencia científica a partir de datos clínicos y experimentales de la implicación del complemento en la enfermedad glomerular y su correspondiente trascendencia.
MECANISMOS DE ACTIVACIÓN DEL COMPLEMENTO EN LA ENFERMEDAD GLOMERULAR
La activación patológica del complemento en el tejido renal implica que existen eventos moleculares que promueven la activación del complemento (depósito de IC) y/o fenómenos locales que interactúan en la regulación del complemento [3]. Estos mecanismos no son excluyentes, los IC pueden causar la activación de la vía clásica (VC) del complemento, pero también generar un microambiente en el que los factores del complemento se encuentran excluidos [4]. Los diferentes compartimentos renales pueden estar implicados en la regulación del complemento y en la génesis de las diferentes patologías glomerulares.
a) Células endoteliales y vasos
Los depósitos subendoteliales de los IC son comunes en patologías como la nefropatía lúpica y la glomerulonefritis membranoproliferativa (GNMP). Las inmunoglobulinas IgG e IgM que componen estos IC son capaces de activar la vía clásica del complemento provocando la inflamación y las lesiones del tejido renal. Es posible que el daño endotelial active la VC, pero la activación de la vía alternativa (VA) perpetúa la lesión de la microvasculatura [3]. La VA es crítica para la patogenia de las vasculitis-ANCA, aunque el mecanismo exacto y el lugar de la activación no se conocen [5].
b) Membrana basal glomerular
La membrana basal glomerular (MBG) no expresa proteínas reguladoras del complemento y dependen del factor H (FH) circulante para el control de la VA [6]. En este sentido, defectos genéticos, anticuerpos u otras proteínas pueden interferir sobre la función del FH [7] [8] [9]. La deficiencia del FH está asociada con la activación del complemento en la fase fluida y con actuar sobre la MBG, mecanismos implicados en la génesis de la glomerulopatía C3 (GC3) [10]. Esta desregulación de la VA da lugar a los depósitos de C3 en ausencia de los de inmunoglobulinas, y esta es la base diagnóstica de la GC3. La enfermedad por depósitos densos es un subtipo de GC3 caracterizado por la detección de depósitos electrondensos en la MBG visualizados por la microscopía electrónica [11].
c) Podocitos
El papel del sistema de complemento en la lesión podocitaria ha sido estudiado en numerosas patologías renales (nefropatía membranosa, nefritis lúpica, glomeruloesclerosis segmentaria y focal, etc). Los podocitos han desarrollado mecanismos protectores para escapar del ataque del complemento, como la autofagia, la endocitosis y la expresión de factores reguladores del complemento. El balance de estos mecanismos determinará el destino del podocito (Bruno V, Mühlig AK, Oh J, Licht C. New insights into the immune functions of podocytes: the role of complement. Mol Cell Pediatr. 2023 Apr 15;10(1):3). Los IC se ven a menudo en el espacio subepitelial de pacientes con nefropatía membranosa. La IgG se une al receptor de la Fosfolipasa A2 y otros antígenos podocitarios [12]. Los podocitos expresan CR1, que puede regular la VC y VA del complemento, pero CR1 se escinde de la superficie de las células como ocurre en los pacientes con nefropatía lúpica. La pérdida de CR1 puede permitir la activación del complemento en este lugar, o puede ser una consecuencia de la formación de C5b-9 [13].
d) Mesangio
Los IC se depositan en el mesangio en diferentes enfermedades glomerulares incluyendo la nefropatía lúpica, causando la activación del complemento. Los pacientes con GC3 también pueden presentar depósitos de C3 en el mesangio [14], lo que indica que el FH es funcionalmente importante para controlar la activación de la VA, aunque las células mesangiales expresen en su superficie reguladores del complemento [15]. En la nefropatía mesangial IgA, los IC contienen depósitos de IgA1 en el mesangio, similar a lo que ocurre en otras enfermedades glomerulares mediadas por IC [16]. Recientes estudios genómicos han identificado a factores reguladores del FH que se asocian a un mayor riesgo de desarrollar nefropatía mesangial IgA [17] [18]. De esta forma, esta nefropatía puede ser causada por el depósito de los IC que contienen la IgA hipoglicosilada y/o la lesión glomerular ser causada por la desregulación del complemento.
e) Túbulo-intersticio
Existe una mínima expresión de las proteínas reguladoras del complemento en la superficie de las células epiteliales tubulares [15]. Habitualmente, este compartimento no está en contacto con las proteínas del complemento, pero la VA puede causar lesiones tubulointersticiales en pacientes con nefropatías proteinúricas debido al paso de proteínas del complemento en los túbulos [19]. Las células epiteliales del túbulo también sintetizan C3, y esa producción local puede ser causante de lesiones agudas o crónicas tubulointersticiales [20] [21]. Otras situaciones también pueden favorecer la activación de la VA (el amonio puede formar un enlace amida con C3 y activar la VA). Situaciones patológicas acompañadas de una reducción de masa renal pueden incrementar la producción en la cantidad de amonio por las nefronas restantes para mantener el equilibrio ácido-base y estos mecanismos adaptativos generar lesiones inflamatorias tubulointersticiales [22].
PATOLOGÍA GLOMERULAR MEDIADA POR LA ACTIVACIÓN DEL COMPLEMENTO POR AUTOANTICUERPOS.
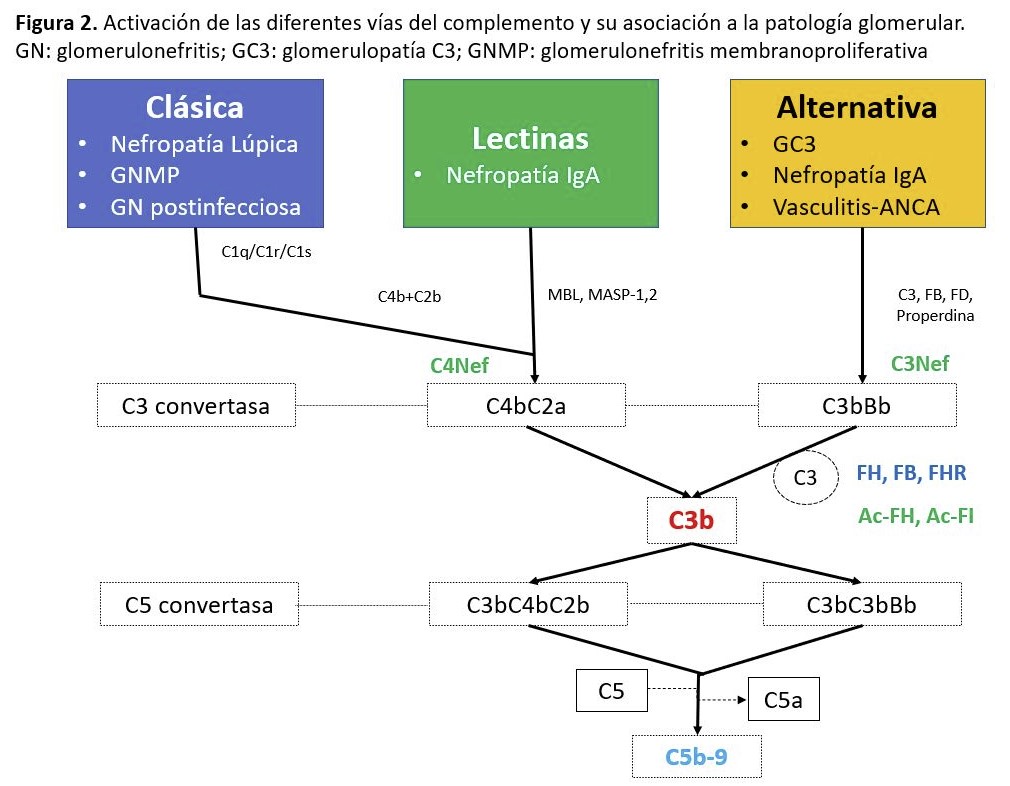
Los autoanticuerpos generados frente a diversos antígenos de la superficie renal e IC depositados en el riñón son causantes de diferentes patologías renales. Existe cada vez más evidencia de los mecanismos patogénicos que relacionan estos anticuerpos con la activación de diferentes vías del complemento (Figura 2) [6].
Nefropatía membranosa
La nefropatía membranosa (NM) es una causa común del síndrome nefrótico en adultos y se caracteriza por el depósito de IC en el espacio subepitelial de la pared capilar glomerular. Hasta el 40% de los casos de NM evolucionan hacia la insuficiencia renal terminal en un periodo de 5 a 10 años [23]. En aproximadamente el 25 % de los casos, la NM es originada por una enfermedad sistémica, como una neoplasia, una infección o por diversos fármacos, en cuyo caso se denomina "NM secundaria". En cambio, la NM primaria es una enfermedad autoinmune específica del riñón inducida por autoanticuerpos que reconocen proteínas expresadas en la superficie podocitaria (receptor de la fosfolipasa A2, trombospondina tipo 1)[23].
La contribución de la activación del complemento a la patogénesis de la de la NM fue sugerida por primera vez por el hallazgo de que la depleción de C3 prevenía la proteinuria en un modelo animal [24]. En este sentido, el depósito de C3 está presente en el 70-100 % de los pacientes con NM [25]. La deficiencia de C6 previno la lesión renal y retrasó la aparición de proteinuria en un modelo de rata, lo que indica un papel destacado del complejo de ataque a la membrana (CAM) [26]. La importancia del CAM en la NM está respaldada por el hallazgo constante de C5b-9 en los depósitos subepiteliales de los IC. Además, la excreción urinaria de sC5b-9 se correlaciona con la actividad de la enfermedad tanto en la NM experimental como en los pacientes con NM [27]. Un reciente estudio francés, demuestra que el depósito glomerular de C5b-9 estaba correlacionado con una mayor gravedad del síndrome nefrótico en el momento del diagnóstico, una menor remisión y una peor supervivencia renal [28].
Aunque la NM es una enfermedad mediada por IC, la mayoría de las IgG en los glomérulos y los anticuerpos anti-PLA2R en el suero de los pacientes con NM son IgG4, que no se une a C1q ni activa la VC [12][29]. A pesar de que la IgG4 no activa el complemento de forma eficaz, el depósito de C4d, es detectable en el 100% de los pacientes con NM [30].
El mecanismo por el que la IgG4 activa el sistema del complemento sigue siendo controvertido, pero puede deberse a la alteración de la glicosilación de la inmunoglobulina. La IgG hipogalactosilada puede unirse a la vía de las lectinas y activar el complemento. Existe escasa información sobre el efecto del bloqueo del complemento en este tipo de patología (G. Appel et al., datos no publicados) sugirieron que el uso de bloqueantes de C5 no tuvieron ningún efecto sobre la proteinuria en pacientes con NM. Un grupo alemán, ha estudiado el papel del complemento en animales de experimentación y humanos con NM, proponiendo que el uso de terapias que bloqueen el complemento, especialmente en la formas graves (síndrome nefrótico no controlado o en casos de deterioro de la función renal) podría ser de utilidad [31]. Sin embargo, son necesarios estudios adicionales para determinar si las terapias del complemento juegan un papel en esta patología.
Enfermedad por anticuerpos anti membrana basal glomerular (Anti-MBG)
Los autoanticuerpos dirigidos al dominio NC1 del colágeno tipo IV son mediadores patogénicos de la enfermedad por anticuerpos anti-MBG [32]. La glomerulonefritis proliferativa observada en esta enfermedad se caracteriza por el depósito lineal de IgG y diversos componentes del complemento a lo largo de la MBG [33]. La VC y VA del complemento están implicadas (C1q, FB, properdina, C3d/C4d y C5b-9 han sido detectados en la MBG). Existen evidencias clínicas que demuestran que la activación del complemento local da lugar a la liberación de anafilotoxinas como C3a y C5a, así como la formación del CAM dando lugar a la nefropatía y formación de la matriz extracelular [35]. En un estudio retrospectivo, demuestra que los pacientes con hipocomplementemia C3 y la presencia de depósitos lineales de C3 en la MBG, presentaban una mayor gravedad de la lesión histológica y una peor supervivencia renal [34]. En conjunto, estos hallazgos apoyan la necesidad de comprobar si la inhibición del complemento tiene un papel en la evolución de los pacientes con enfermedad por Anti-MBG.
PATOLOGÍA GLOMERULAR MEDIADA POR LA ACTIVACIÓN DEL COMPLEMENTO POR INMUNOCOMPLEJOS.
Los IC circulantes que se depositan en el espacio subendotelial y subepitelial del glomérulo pueden generar la lesión glomerular dependiente del complemento, como es el caso de las GN postestreptocócica, la crioglobulinemia o la nefropatía lúpica (NL). Por otro lado, existen casos de microangiopatía trombótica (MAT) asociados a una gran variedad de enfermedades sistémicas con solapamiento entre entidades y mutaciones del complemento hasta en un 33% de pacientes con síndrome hemolítico urémico (SHU) asociado a enfermedades autoinmunes [9] [36]. La presencia de diversos componentes del complemento en las biopsias renales plantea su papel patogénico y sugiere que la desregulación del complemento de base no genética puede desempeñar un papel importante y ser una posible diana terapéutica.
Glomerulonefritis membranoproliferativa
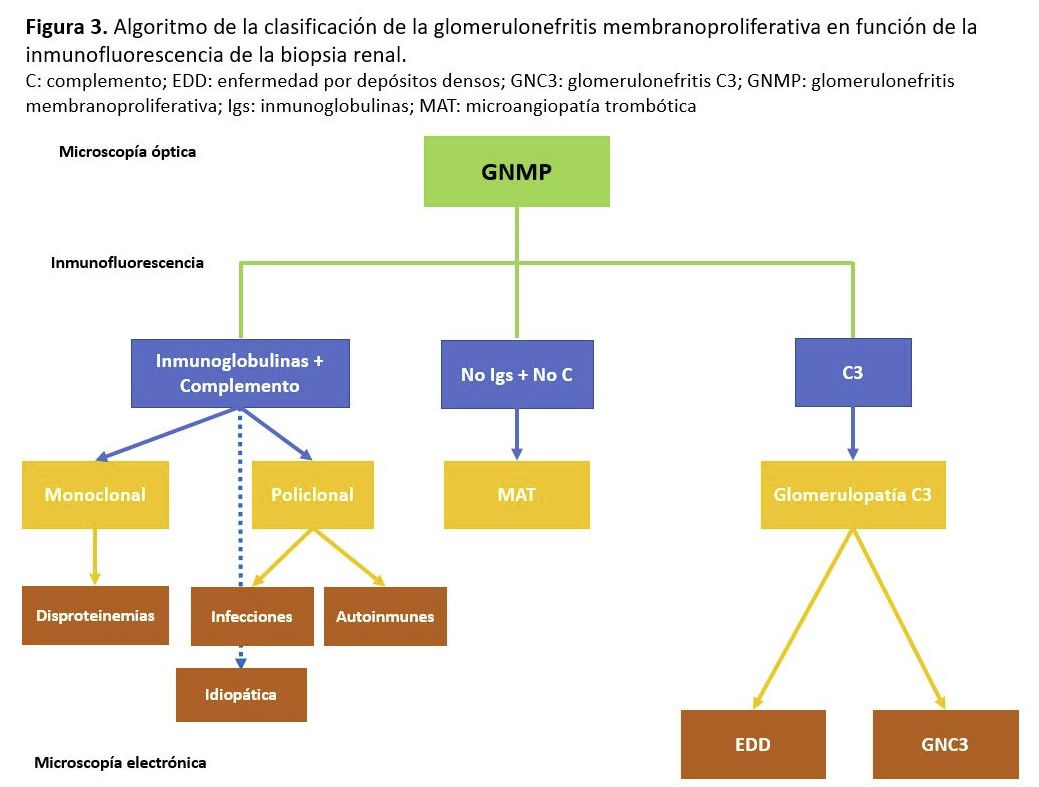
La clasificación tradicional de las glomerulonefritis membranoproliferativas (GNMP) se basaba en la localización y apariencia de los depósitos electrondensos: tipo I (depósitos subendoteliales), tipo II (también conocida como enfermedad por depósitos densos; depósitos dentro de la membrana basal glomerular) y tipo III (depósitos subendoteliales y subepiteliales). Pero hoy en día, se prefiere dividir esta patología en función de los hallazgos de la inmunofluorescencia: GNMP con depósito de C3 e inmunoglobulinas (Ig) y GNMP con depósitos exclusivos o claramente predominantes de C3 (Figura 3). Esta última categoría se denominaría glomerulopatía C3 y englobaría la enfermedad por depósitos densos y la GN C3 (estos dos subtipos se diferencian por la apariencia y localización de los depósitos). La GNMP con depósitos de C3 e Ig puede estar asociada a procesos infecciosos (las GN secundarias a la infección por el virus de la hepatitis C son las más frecuentes de este grupo), tumorales o enfermedades sistémicas (lupus, esclerodermia, sarcoidosis, etc), aunque en algunos casos no se encuentra mecanismo desencadenante alguno. La patogenia es debida a un depósito en las paredes capilares de los inmunocomplejos circulantes, formados por anticuerpos contra los antígenos tumorales o infecciosos. Las GNMP con depósito exclusivo o predominante de C3 son debidas a una desregulación de la VA del complemento, bien por mutaciones genéticas o por anticuerpos dirigidos contra las proteínas reguladoras del complemento, de los cuales el factor nefrítico C3 es el más frecuente. El pronóstico y el tratamiento están lógicamente relacionados con la enfermedad de base (tumores, lupus, infección por virus C). En los casos idiopáticos el pronóstico guarda relación con la gravedad de las manifestaciones clínicas en la presentación [37].
Lupus eritematoso sistémico
Numerosas observaciones clínicas sugieren la importancia del complemento en la nefropatía lúpica (NL) y la traducción histológica es la lesión característica conocida como "full house", con depósito de inmunoglobulinas y complemento [38] que juegan un doble papel en la patogenia de NL. Los componentes de la VC (C1q, C2, C4) tienen un papel protector facilitando la apoptosis de los IC del lupus eritematoso sistémico (LES), mientras que factores finales (C5 a C9) promueven inflamación y daño tisular a través de la generación de anafilotoxinas (C5a) y formación del CAM [39]. Un estudio experimental reveló el papel del déficit del FH como potenciador del desarrollo de la NL con una presentación clínica e histológica más agresiva [40]. La coexistencia histológica de NL y MAT confiere peor pronóstico renal [41]. Song et al [42], encontraron MAT en el 24.3 % de biopsias renales con NL en un estudio retrospectivo. Estos pacientes tuvieron datos clínicos e histológicos más severos respecto al grupo sin MAT, lo que supone un factor de riesgo para la evolución de la función renal. Estudios recientes han permitido corroborar los hallazgos encontrados en el estudio previo [43]. Estudios experimentales y clínicos, han mostrado que la activación del complemento es esencial en la patogenia de la MAT y del LES, por lo que el uso de bloqueantes del complemento podría ser una terapia prometedora [44]. El tratamiento con Eculizumab, ha mostrado seguridad y buena tolerancia en estudios en fase I en pacientes con LES; desafortunadamente, no han continuado con estudios en fase II o III [45] [46]. Sin embargo, aisladas experiencias en pacientes resistentes al tratamiento inmunosupresor habitual para NL respondieron positivamente al tratamiento con eculizumab [39] [47] [48]. En la actualidad, diversos bloqueantes del complemento se están empleando en la nefropatía lúpica como tratamiento coadyuvante de la misma (ravulizumab, un inhibidor de C5, pegcetacoplan, un inhibidor de C3 o iptacopan, un anti-factor B).
Síndrome antifosfolípido catastrófico
El síndrome antifosfolípido catastrófico (SAFC) es una variante del síndrome antifosfolípido ( < 1%) caracterizado por trombosis sistémica y desarrollo de un fracaso multiorgánico con elevada morbimortalidad y de difícil tratamiento. Diversos autores han sugerido que la activación incontrolada del complemento puede iniciar y amplificar los fenómenos característicos del SAFC, como la activación de endotelio, factor de expresión de los monocitos y agregación plaquetaria, unido a los hallazgos histológicos propios de la MAT [49]. El tratamiento abarca desde la anticoagulación hasta la terapia inmunosupresora (esteroides o ciclofosfamida), inmunoglobulinas y plasmaféresis. El uso de terapias que bloqueen el complemento puede ser una opción terapéutica especialmente en pacientes refractarios al tratamiento habitual [50]. En la literatura, se han descritos series de casos de pacientes con SAFC tratados exitosamente con eculizumab [51] [52] [53].
Vasculitis-ANCA (anticuerpos anticitoplasma de neutrófilos)
Las vasculitis asociadas a ANCA son un grupo heterogéneo de enfermedades que se caracterizan por la inflamación vascular de pequeños vasos con pocos o ningún depósito de IC (las llamadas "pauciinmunes") [54]. El concepto de vasculitis pauciinmunes está cambiando por el hallazgo de depósitos electrodensos en biopsia renal hasta en el 54% de los casos. Aunque el papel patogénico de los ANCA sigue siendo controvertido, una hipótesis actual implica a los neutrófilos que expresan niveles elevados de MPO o PR3 en su superficie [55]. Estos antígenos son entonces reconocidos por los ANCA, lo que provoca la activación de los neutrófilos, la desgranulación, así como la transmigración y la posterior lesión vascular. La señalización de C5a a través del receptor 1 de C5a (C5aR1) parece ser fundamental para este proceso [56].
Tradicionalmente, se pensaba que la vasculitis ANCA no estaba mediada por el complemento porque los niveles séricos de C3 y C4 rara vez eran bajos y porque el depósito de complemento en las biopsias renales era generalmente menos llamativo que en las enfermedades por IC. El interés por el sistema del complemento en las vasculitis ANCA fue debido a una elegante serie de experimentos con animales. En pacientes con vasculitis ANCA activa, los niveles urinarios y plasmáticos de C3a, Bb, C5a y sC5b-9 son significativamente más elevados en comparación con los que están en remisión [57]. Diversos estudios han encontrado que el depósito de ciertos componentes del complemento (C3, C4, C1q, factor B, properdina y CAM) en las biopsias renales de pacientes con vasculitis se ha asociado a un mayor grado de proteinuria y peor función renal [58] [59]. En este sentido, diversos trabajos demuestran que niveles bajos de C3 se asociaban a una mayor agresividad de la presentación histológica de las vasculitis y un peor pronóstico renal. Por otro lado, depósitos de C3d y properdina en la biopsia renal, sugiriendo la activación de la vía alternativa del complemento, se correlacionaban con un mayor porcentaje de semilunas y mayor cuantía de la proteinuria [60]. Un estudio colaborativo español, ha identificado variantes genéticas de la vía alternativa del complemento implicadas en las vasculitis ANCA. Algunas de estas tienen una acción protectora (CFB32Q/W) y otras están asociadas a una mayor gravedad (deleción CFH-H1, CFH-H2, and ΔCFHR3/1). Estos datos, apoyan que la inhibición de componentes de la vía alternativa del complemento, como el FB y el FHR-1, pueden convertirse en una diana terapéutica útil en las vasculitis. Esto es especialmente importante debido a la disponibilidad de fármacos dirigidos a determinados componentes de la vía alternativa como pegcetacoplan, iptacopan o danicopan [61]. La MAT en la biopsia renal asociada con vasculitis no es infrecuente (13,6%), especialmente en los casos graves y de peor curso evolutivo [62]. Recientemente, se ha demostrado que la activación de la VA del complemento tiene un papel primordial en la patogenia de las vasculitis [63]. Basándose en los prometedores resultados preclínicos, el avacopan se probó en pacientes con vasculitis ANCA. Como el C5a parece ser la molécula efectora en esta enfermedad mediada por el complemento, el bloqueo selectivo de C5a puede ser tan eficaz como otros fármacos inhibidores del complemento, pero con menos efectos secundarios. Un estudio de fase II del antagonista del C5aR oral en pacientes con vasculitis ANCA demostró unos resultados muy alentadores [64]. La inhibición del C5aR con avacopan podría reducir con éxito o incluso sustituir las dosis altas de glucocorticoides en el tratamiento de la vasculitis ANCA. En el estudio ADVOCATE, los resultados recientemente publicados en 331 pacientes con vasculitis ANCA que fueron randomizados 1:1 a recibir avacopan frente a una pauta de prednisona en descenso, han demostrado que avacopan no fue inferior pero tampoco superior a la pauta de prednisona para alcanzar la remisión en la semana 26. Sin embargo, cuando se analizó la remisión sostenida a la semana 52, el tratamiento con avacopan fue significativamente superior a la pauta descendente de prednisona con un 12.5 de puntos porcentuales (65.7% vs 54.9%) [65]. Estos resultados, han provocado que en las recientes guías EULAR, avacopan haya sido incorporado como terapia adyuvante en las vasculitis ANCA. Recientemente, han sido publicados los resultados de un estudio post-hoc del ADVOCATE en pacientes con un FGR<20 ml/min, avacopan consiguió una mayor proporción de pacientes y un mayor incremento del FGR que el grupo control [66]. Por lo tanto, este fármaco se perfila como una pieza clave en la estrategia terapéutica de las vasculitis ANCA.
OTRAS GLOMERULONEFRITIS Y SU IMPLICACIÓN CON EL COMPLEMENTO
Los intensos depósitos de diversos componentes del complemento observados en la mayoría de GN, evidencian que la activación del complemento juega un papel destacado en el daño glomerular de estos procesos. No existen estudios sistemáticos sobre la prevalencia de alteraciones genéticas o funcionales del complemento en las glomerulonefritis. Aparte de GC3 y la nefropatía IgA (NIgA), se han descrito casos de MAT/SHU en pacientes con glomeruloesclerosis segmentaria y focal (GSF), la NM, la GN aguda postinfecciosa y las GNMP [67].
Nefropatía por IgA
La nefropatía por IgA (NIgA) es la causa más común de glomerulonefritis en todo el mundo, y hasta el 20-30% de los casos evolucionan hacia la insuficiencia renal terminal dentro de los 20 años posteriores al diagnóstico [68]. Se cree que en la patogenia de la NIgA intervienen distintos mecanismos entre los que destacan: (1) niveles elevados de IgA1 deficiente en galactosa, (2) producción de autoanticuerpos específicos para la IgA1 alterada, (3) la subsiguiente formación de ICs circulantes, y (4) el depósito glomerular de estos ICs que originan la inflamación y la lesión renal (Teoría de multi-hits) [69]. Las primeras publicaciones que implicaban a la VA del complemento con la NIgA, encontraron depósitos de C3, properdina y C5b-9 en el mesangio glomerular, mientras que no se detectaron IgG ni C1q [70]. Estudios posteriores demostraron el depósito glomerular de MBL y MASP-1 en un subconjunto de pacientes con NIgA, sugiriendo la implicación de la vía de las lectinas [71]. Un hallazgo de relevancia clínica se produjo cuando Roos et al, demostraron que el depósito glomerular de MBL se asociaba a una mayor gravedad de la enfermedad y a un peor pronóstico [72]. Otros investigadores han encontrado una asociación entre el depósito mesangial de C4d y una progresión más agresiva de la glomerulopatía con una menor supervivencia renal de los pacientes [73][74]. Un estudio reciente ha demostrado que el depósito arteriolar de C4d en la NIgA también se asoció con una peor progresión de la enfermedad, lo que indica que la activación del complemento en la NIgA no se limita a los glomérulos [75]. Recientemente, un elegante estudio de Medjeral-Thomas et al, demostró unos niveles plasmáticos más bajos de MASP-3 en pacientes con NIgA [76]. Estos niveles bajos de MASP-3 se asociaron con una progresión más rápida de la nefropatía.
Grandes estudios de asociación del genoma identificaron que la deleción de los genes relacionados con el factor H del complemento 1 y 3 (CFHR1/3) eran un locus protector para la NIgA [77]. Estudios posteriores han examinado más a fondo el papel de las proteínas relacionadas con el factor H (FHR) en la fisiopatología de la NIgA. Los niveles plasmáticos de FHR-1 y la relación FHR-1/Factor H están aumentados en la NIgA y se ha demostrado que están asociados con una peor evolución [78]. Además, la elevación del FHR-5 en plasma se asociaba también con marcadores histológicos de mayor severidad [76]. Estos hallazgos están en línea con la hipótesis de que el factor H regula la activación del complemento y, por tanto, aminora la gravedad de la NIgA, mientras que FHR-1 y FHR-5 antagonizan el factor H y, por ende, contribuyen al desarrollo de una NIgA más agresiva [79].
Por último, la presencia de lesiones de MAT en las biopsias renales de pacientes con NIgA ha sido señalada en algunos estudios, relacionándose con un peor pronóstico renal [80][81]. Asimismo, se ha comunicado un efecto beneficioso de eculizumab en casos aislados de pacientes con NIgA agresiva sin MAT/SHU concomitante [82] [83]. En los últimos años, numerosos estudios han estudiado el papel de diferentes inhibidores del complemento en la NIgA, narsoplimab (inhibidor de MASP2), iptacopan (inhibidor del FB), vemircopan (inhibidor del FD), pegcetacoplan (inhibidor de C3), ravulizumab (inhibidor de C5), avacopan (inhibidor del receptor C5a) y cemdisiran (RNA interferencia dirigido contra C5) [84].
Es evidente que se necesitan más estudios para determinar con precisión la incidencia real de MAT en la NIgA y la posible indicación terapéutica del bloqueo del complemento en esta entidad. En este sentido, existen en la actualidad diversos ensayos clínicos con diferentes moléculas que bloquean el complemento (anti FB o anti MASP).
Glomeruloesclerosis segmentaria y focal
La patogénesis de la glomerulosclerosis segmentaria y focal (GSF) sigue siendo poco clara, pero los depósitos de IgM y de C3 se observan comúnmente en los glomérulos afectados. Se han descrito mutaciones en el FH y C3 en determinados casos de GSF [85]. Un grupo holandés describió la presencia de depósitos C4d en más del 70% de los pacientes con GSF en comparación con un grupo control [86]. Asimismo, la presencia de C4a y C4d en plasma y orina de pacientes con GSF frente al grupo control, demostraban la activación de la vía clásica del complemento y su implicación patogénica en esta entidad [87]. La inhibición del complemento no ha sido cuidadosamente estudiada como una terapia para GSF. Recientemente, ha sido publicado una serie francesa que describe la asociación entre una variante de la GSF (la forma colapsante), y la MAT, sugiriendo el papel que el daño endotelial puede jugar en la génesis de este tipo de glomerulopatías. Los pacientes con anormalidades de la VA del complemento (15%) tuvieron una presentación clínica más agresiva con mayor incidencia de MAT y una mayor necesidad de diálisis que el resto de pacientes [88].
Glomerulonefritis postinfecciosa
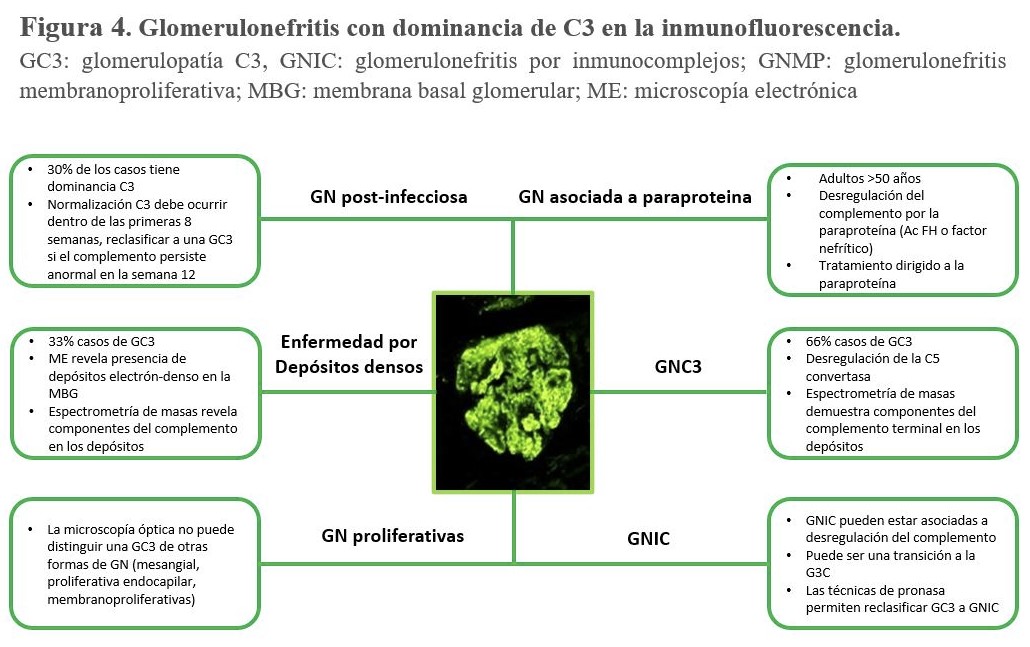
La glomerulonefritis postinfecciosa (GNPI) comparte características clínicas y patológicas con la GC3. La GNPI es una causa común de GN que se desarrolla semanas después de la exposición a un patógeno infeccioso y que se presenta típicamente como un síndrome nefrítico agudo. El sello patológico de la GNPI consiste en una GN proliferativa con depósitos subepiteliales (o "jorobas") en la microscopía electrónica, junto con tinción de C3 en la inmunofluorescencia con o sin depósito de IgG [89]. Por lo tanto, existe un considerable solapamiento con los hallazgos histopatológicos de la GNC3 (Figura 4). El diagnóstico de una GNC3 puede estar desencadenada por infecciones y una GNPI a veces se diagnostica en la biopsia sin ninguna evidencia de una infección previa. Por lo tanto, discriminar entre la GNC3 y la GNPI, puede ser un gran reto diagnóstico.
El curso clínico de la GNPI es generalmente autolimitado y se resuelve en semanas. Sin embargo, en una minoría de casos, la GNPI puede persistir e incluso conducir a la insuficiencia renal crónica terminal [90]. Aunque la GNPI se consideraba como una enfermedad mediada por IC, datos recientes demuestran que la desregulación de la VA del complemento podría jugar un papel en algunos casos [91]. Los depósitos glomerulares pueden contener inmunoglobulinas, C4d y C3. Sin embargo, la tinción de C4d solo se observa en aproximadamente la mitad de los casos de las GNPI, mientras que la tinción de C1q solo se observa en una minoría de los casos y suele ser de baja intensidad [91]. En conjunto, estos hallazgos apoyan la idea de que, al menos en algunos casos, la VA se activa en la GNPI. La participación de la VA se sustenta en la presencia de hipocomplementemia C3 con niveles plasmáticos normales de C4 en un número considerable de pacientes [93]. Además, la expresión transitoria de C3NeF y mutaciones del gen regulador del complemento se han detectado en pacientes con GNPI [91]. Un estudio asiático reciente, con un número reducido de pacientes con GNPI atípicas (depósito exclusivo de C3), encontraron variantes patogénicas del complemento (vía alternativa y de las lectinas). Aunque estos pacientes presentaban un curso evolutivo benigno, la persistencia de la estimulación del complemento originaba un mayor número de recurrencias y un peor curso evolutivo [92].
Las guías clínicas reconocen la similitud de la GNPI y la GNC3, pero no está claro si estas dos entidades son clínicamente distintas o representan un continuum. El término "GN postinfecciosa atípica" se ha propuesto para describir el subconjunto de pacientes en los que la VA está activada y en los que el curso de la enfermedad no es autolimitado, sino que persiste y puede incluso causar una insuficiencia renal terminal [91]. El documento de consenso sobre GC3 recomendó etiquetar estos casos como "GN con C3 dominante (relacionada con la infección)" y seguir su evolución para permitir una mayor diferenciación entre ambas entidades [94].
En un reciente estudio retrospectivo francés se investigó los mecanismos de activación del complemento en 34 niños con GNPI e hipocomplementemia C3. Este grupo de niños se comparó con 60 niños del Registro Nacional Francés que presentaban una GC3 e hipocomplementemia persistente. Todos los niños con GNPI presentaban una activación de la VA del complemento. Los autores demostraron la presencia de autoanticuerpos dirigidos al factor B (un componente de la VA C3 convertasa) en una proporción significativamente mayor de niños con una GNPI que los que tenían una GC3 (31 de 34 [91%] frente a 4 de 28 [14%], respectivamente). Este hallazgo podría ser fundamental en el diagnóstico diferencial de ambas entidades [95].
Gammapatías monoclonales
Las gammapatías monoclonales de significado renal (GMSR) son un grupo de trastornos renales recientemente reconocidos causados por inmunoglobulinas monoclonales o cadenas ligeras secretadas por un clon de células B o plasmáticas no maligno o premaligno [96]. Las enfermedades renales asociadas a las GMSR abarcan un amplio espectro de patología renal, incluyendo la GC3 y la MAT. El papel del complemento en la patogenia de este tipo de lesiones renales es incierto, pero la desregulación funcional de la VA del complemento parece jugar un papel clave. Las inmunoglobulinas monoclonales o las cadenas ligeras pueden actuar como autoanticuerpos contra el complemento o proteínas reguladoras del complemento, como el FH, y así inducir indirectamente una GN mediada por el complemento [97]. Meri et al, aislaron la paraproteína monoclonal IgG-lambda de un paciente con una GC3 y demostraron la activación in vitro de la VA mediante la unión selectiva y la inactivación del FH [98]. Schurder et al, presentaron el caso de una MAT asociada a gammapatía monoclonal con respuesta favorable al tratamiento con eculizumab, lo que sugiere el papel del complemento en esta entidad [97].
Un estudio retrospectivo demostró una prevalencia inesperadamente alta de la gammapatía monoclonal en pacientes con MAT (13.7%). Este hallazgo, sugiere el potencial mecanismo patogénico de las gammapatías en las microangiopatías y subraya la importancia de la evaluación de la gammapatía en pacientes con MAT, así como la posibilidad de enfocar nuestro objetivo terapéutico hacia el trastorno hematológico subyacente [99].
PATOLOGÍA GLOMERULAR MEDIADA POR EL COMPLEMENTO
Glomerulopatía C3 (GC3)
Introducción
Las GC3 constituyen una entidad cuyas características clínicas, patogénicas y evolutivas han sido perfiladas en los últimos años.
La GC3 es una entidad clínico-patológica rara, heterogénea y secundaria a la desregulación de la VA del complemento que acaba manifestándose en una patología glomerular. Esta hiperactivación de la VA del complemento da lugar al depósito de C3 y sus productos de escisión en los glomérulos, lo que conduce a la inflamación y a una lesión renal progresiva [100][101].
La incidencia estimada de la enfermedad es de 1-3 casos por millón al año, y se diagnostica con más frecuencia en la infancia y la adolescencia, aunque también puede observarse en personas adultas y de edad avanzada [102].
Esta entidad resulta de la regulación anormal de la VA del complemento y ahora se clasifican bajo el título de GC3. La presentación clínica es variable y el diagnóstico se basa en la presencia de depósitos intensos, aislados o claramente predominantes de C3 en la inmunofluorescencia [103].
Aunque inicialmente la GNMP fue considerado el patrón histológico característico (lo que llevo a una reclasificación de esta entidad) (Figura 3), la aparición de otros patrones histológicos (GN necrotizante, mesangiales, GSF) con depósitos predominante de C3 en la inmunofluorescencia y una alteración de la VA ha permitido que se modificará recientemente su definición [104].
Clasificación
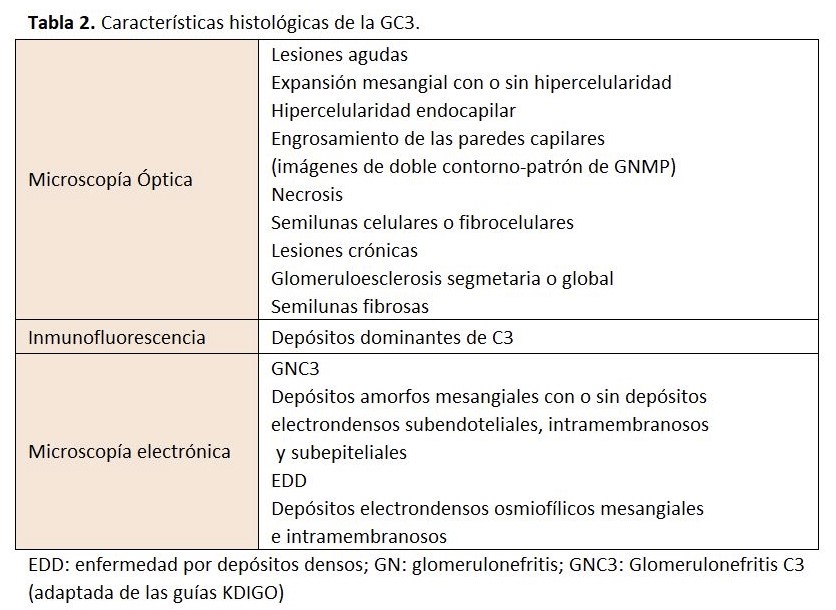
Se distinguen dos tipos: la GNC3 y la enfermedad por depósitos densos (EDD), esta última caracterizada por depósitos intensamente osmiofílicos, en forma de cinta, a lo largo de la membrana basal [94]. Ambas entidades son debidas a una alteración de la VA del complemento. El término de la GNC3, fue acuñado por primera vez en el año 2007 por un grupo francés que describió la presencia en 19 pacientes de una GN con depósitos de C3 en la inmunofluorescencia. La microscopía electrónica revela la presencia de depósitos electrondensos subendoteliales y mesangiales y en algunos casos, se pueden observar depósitos subepiteliales [14]. La presencia de hipocomplementemia C3 en la GNC3 es inferior a la EDD y su curso evolutivo es ligeramente mejor. La EDD es una patología extremadamente rara (2-3 casos por millón) que afecta fundamentalmente a niños y adultos jóvenes [105]. Clínicamente, se presenta con proteinuria de diferente cuantía y microhematuria y para confirmar su diagnóstico es necesario disponer de las tres técnicas histológicas que permiten confirmar la presencia de C3 por inmunofluorescencia y la presencia de depósitos electrondensos de aspecto lineal en la MBG en la microscopía electrónica [104].
La definición actual del consenso de la GC3 se basa en la presencia de una tinción de inmunofluorescencia positiva para C3, ya sea aislada o al menos dos órdenes de magnitud mayor que el resto de los reactantes inmunes [106]. Sin embargo, la experiencia acumulada ha demostrado que estos criterios podrían dar lugar a confusión en algunos escenarios clínicos por varias razones. En primer lugar, a veces los resultados de la inmunofluorescencia son dudosos y una biopsia renal posterior puede revelar hallazgos consistentes con una GNMP por inmunocomplejos o viceversa. En segundo lugar, las anomalías genéticas del complemento y/o autoanticuerpos contra los componentes del complemento también pueden encontrarse en casos de GNMP por IC [107]. En tercer lugar, la inmunofluorescencia utilizada habitualmente en la práctica clínica sirve para teñir el C3 (el fragmento C3c), mientras que, en la GC3, el producto de escisión predominante que se acumula es el C3dg [108].
Por lo tanto, se ha establecido una nueva clasificación patogénica de la GNMP por inmunocomplejos y de la GC3, basada en un análisis de un conjunto de datos clínicos, histológicos y genéticos de una gran cohorte de pacientes [107]. Según esta clasificación, se identifican cuatro grupos diferentes. Los pacientes de los grupos 1-3 tienen una activación del complemento en fase líquida, suelen presentar niveles bajos de C3 y tienen una elevada prevalencia de anomalías genéticas del complemento; los pacientes del grupo 4 presentan una activación del complemento en la superficie, tienen niveles normales de C3 en suero y se asocian con peores resultados renales. Esta nueva clasificación propuesta podría ser más útil para los clínicos porque, a diferencia de la clasificación patológica, aborda la patogénesis subyacente de la enfermedad. Sin embargo, esta clasificación aún no ha sido validado en otras cohortes y también puede estar sujeta a otras limitaciones.
Patogenia
La patogenia de las GC3 consiste en una activación anómala de la VA del complemento (fundamentalmente a nivel sérico o fase fluida) por mutaciones en los genes que codifican factores del complemento o proteínas reguladoras del mismo (factores H, I, CD46), o por autoanticuerpos (NeFs) contra estos factores reguladores que estabilizan la C3 y/o C5 convertasa [94] [106].
Diversos estudios han mostrado que el espectro de mutaciones genéticas y autoanticuerpos asociados a la GC3 es muy similar al de los pacientes con SHUa [94]. Se postula que en la GC3 la desregulación del complemento se produce en fase fluida, causando el acúmulo de los productos de la degradación del complemento en los capilares glomerulares, mientras que la activación del complemento en el SHUa afecta principalmente a superficies celulares (endotelio), provocando una MAT grave [101].
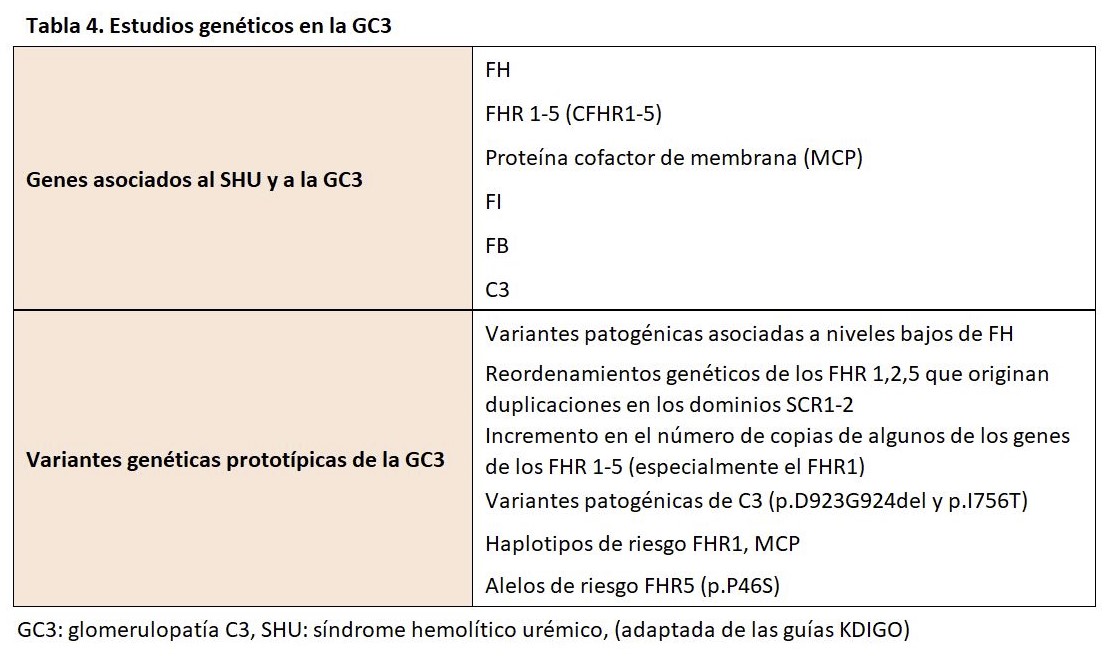
Las anomalías genéticas del complemento pueden encontrarse en alrededor del 25% de los pacientes, que afectan principalmente al gen C3, FB, FH, FI y FHR. La mayoría de las variantes patógenas en C3 afectan a los sitios de reconocimiento de la unión de FH y FI, lo que origina una división inapropiada de la molécula [109]. Las variantes patogénicas del FH pueden conferir propiedades de ganancia de función, mientras que ciertas anormalidades en el FI pueden reducir sus niveles y comprometer la actividad del cofactor [110]. Por otro lado, mutaciones en los genes que codifican las proteínas reguladoras del complemento también podrán desarrollar una GC3. En este sentido, mutaciones de la región N terminal (SCR 1-4) del FH favorecerían el desarrollo de una GC3. Por último, se han descrito otra serie de anormalidades genéticas, diferentes de las descritas, que conducirían al desarrollo de la GC3 (ganancia de función del FB o C3 o pérdida de función de las proteínas reguladoras FI o MCP) [111] [112]. Por esta razón, las recientes guías KDIGO recomiendan la realización de un estudio funcional y genético del complemento [113].
Se han descrito cinco proteínas relacionadas con el FH (FHR 1-5) que muestran una secuencia y estructura homóloga al FH. Estas proteínas contienen el dominio SCR 19-20 pero no el dominio N-terminal (SCr1-4). Su función es controvertida, existen estudios que demuestran su participación en la regulación del complemento, pero por otro lado podrían competir con el FH desencadenando un aumento no controlado de C3b que se depositaría en la MBG dando lugar a una GC3 [114]. Este mecanismo de duplicaciones o formaciones de genes híbridos descritos en los FHR han dado lugar a la descripción de entidades como la nefropatía chipriota (duplicación de los dominios SCR1-2 del FHR5) [115] [116], que más tarde se acabó denominando nefropatía FHR5 por haberse observado esta misma anomalía en pacientes de otras nacionalidades [117]. De esta forma, se han ido describiendo diferentes tipos de anomalías genéticas en los FHR que darían lugar a este tipo de nefropatía.
Los principales autoanticuerpos asociados a la GC3 son los llamados NeF, que comprenden un grupo heterogéneo de anticuerpos contra neoepítopos generados en las convertasas C3 o C5 con capacidad de estabilizar la molécula y prolongar su vida media [118]. Hay dos subtipos principales de factores nefríticos (C3NeFs) que han sido descritos: los C3NeFs dependientes de la properdina, responsables de la activación de la C5 convertasa, también llamados C5NeFs [119]; y C3NeFs independientes de la properdina que actúan como un anticuerpo, normalmente es una IgG, que se une a la C3 convertasa (C3bBb) e impide su disociación espontánea con lo que consigue estabilizar su función. C3Nef mantiene activa a la C3 convertasa y como consecuencia de ello, conduce a un consumo masivo de C3. C3Nef está presente en un 80% de los casos de EDD y hasta un 50% de las GNC3 [118], mientras que los C5NeF se han asociado a la GNC3 [120]. Asimismo, han sido descritos los NeFs dirigidos contra la convertasa C3 de la vía clásica/lectina (conocidos como C4NeFs). Existen otros casos asociados a la presencia de anticuerpos FB y C3b que impiden la disociación de la C3 convertasa [121]. Sin embargo, los anticuerpos frente al FH (presente también en los casos de SHU) están ampliamente descritos en la GC3 [104].
Además de los anticuerpos mencionados, las gammapatías monoclonales también se han implicado en la etiopatogenia de la GC3 como hemos mencionado con anterioridad.
Presentación clínica
La EDD es principalmente, aunque no exclusivamente, una enfermedad de la infancia. El rango de edad en el diagnóstico se extiende hasta la edad adulta. La EDD también se diagnostica ocasionalmente en adultos mayores, evidenciándose en algunos de los casos una estrecha relación con la presencia de una gammapatía monoclonal subyacente [122] [123]. Las manifestaciones clínicas iniciales de las GC3 pueden estar precedidas por infecciones respiratorias. Por lo tanto, es obligatorio un diagnóstico diferencial con la GNPI. Desafortunadamente, aparte de los anticuerpos antiestreptolisina O o la desoxirribonucleasa B, no se dispone de otros marcadores específicos de la GNPI. Una recuperación incompleta de la función renal o la persistencia de un nivel bajo de C3 en suero más allá de 8-12 semanas desde el diagnóstico inicial debe hacer sospechar la existencia de una GC3 [91]. De hecho, ciertas anomalías genéticas en los genes del FHR pueden predisponer a desarrollar una desregulación crónica de la vía del complemento, y, en consecuencia, desarrollar una GC3 tras una GN postinfecciosa.
Las manifestaciones de la GC3 incluyen:
a) Alteraciones urinarias: Entre las diferentes formas de presentación, el síndrome nefrótico ocupa el primer lugar (30-50% de los casos), síndrome nefrítico, proteinuria no nefrótica o microhematuria [124] [125].
b) De la misma manera, la función renal puede ser normal o presentarse como un fracaso renal agudo, aunque lo habitual es la presencia de un deterioro progresivo de la función renal [124]. La presencia de hipertensión en el momento del diagnóstico también es variable. En diferentes estudios, la hipertensión estaba presente entre el 20 al 60% de los pacientes con EDD y el 38% de los pacientes con GNC3 [126].
c) La hipocomplementemia C3 está presente en el 50% de los casos de la GNC3, pero no es imprescindible para su diagnóstico. En el caso de la EDD el porcentaje de pacientes con hipocomplementemia C3 es superior pudiendo estar presentes otras anomalías del complemento [127]. Los niveles séricos de los componentes de la VC, C1, C2 y C4 suelen ser normales, aunque una minoría de pacientes puede tener niveles séricos bajos de C4 durante el curso evolutivo de la enfermedad [126]. A su vez, pueden presentar también niveles séricos elevados de C5b-9 (CAM) [128]. C3NeF se encuentra en aproximadamente el 80% de los pacientes con EDD y en torno al 40% de los pacientes con GNC3 [129]. Otros hallazgos descritos con las deficiencias del factor H, que es más común en EDD que en GNC3, y las deficiencias de CD46 [130]. Recientemente, se ha descrito la presencia de C5Nef, un autoanticuerpo que prolonga y estabiliza la vida media de la C5 convertasa, y que podría explicar fisiopatológicamente el desarrollo de glomerulopatía C3 hasta en un 10% (72% GNC3). C3NeF y C5Nef se correlacionan con el consumo de C3, pero únicamente C5NeF con los niveles séricos de C5b9. Por lo tanto, la presencia de C3NeF y C5NeF tiene consecuencias funcionales y asociaciones patológicas diferentes [131].
d) Microangiopatía trombótica. En un reciente registro francés con 278 pacientes con GC3, 16 pacientes (6%) presentaban datos de MAT en la biopsia renal. El 85% tenían datos de anemia hemolítica microangiopática. Seis de los 14 pacientes en los que se realizó estudio genético del complemento, presentaban variantes patogénicas y un 25% datos de gammapatía monoclonal. El 56% de los pacientes desarrollaron enfermedad renal crónica avanzada en un corto plazo de tiempo a pesar de los tratamientos recibidos (eculizumab, inmunosupresión, quimioterapia) [132].
Manifestaciones extrarrenales
Entre las manifestaciones extrarrenales de la GC3 encontramos el SHU. En este aspecto, cabría formularnos la siguiente cuestión, ¿Por qué algunos defectos de la regulación de la VA del complemento causan una GC3 y otros pacientes desarrollan un SHUa?. Los motivos por los que unos pacientes con determinada mutación genética presentan SHUa y otros GC3, se conocen sólo parcialmente [133]. No obstante, en la literatura se han descrito casos coincidentes de SHU/MAT y C3G en un mismo paciente [131] [133][134], MAT en pacientes previamente diagnosticados de C3G [135] y otros cuya causa de insuficiencia renal terminal había sido C3G desarrollaron SHUa/MAT tras un trasplante renal [131] [133]. Una posible explicación podría estar relacionada con la generación de anticuerpos a los diferentes dominios del FH; si los anticuerpos van dirigidos frente al extremo C-terminal (SCR 19-20) favorecerán el desarrollo del SHU (responsable del reconocimiento de las superficies celulares, en especial las células endoteliales) mientras que los anticuerpos dirigidos frente al extremo N terminal (SCR 1-4) favorecerían el desarrollo de la GC3 (defecto de la regulación de C3 en la fase fluida) [136]. Otra de las manifestaciones extrarrenales es la degeneración macular asociada a la edad, que consiste en una pérdida progresiva de visión nocturna con una atrofia retiniana con drusas y depósitos con o sin hemorragias [114]. Y, por último, otra de las manifestaciones clínicas es la lipodistrofia parcial o también llamado síndrome de Barraquer-Simons (o Dunnigan-Kobberling). Esta entidad se caracteriza por la pérdida progresiva y simétrica de la grasa subcutánea a nivel facial, cuello, extremidades superiores, tórax y abdomen. Estos pacientes con lipodistrofia tienen hipocomplementemia C3 en el 80% de los casos y positividad para el C3Nef [137].
Diagnóstico
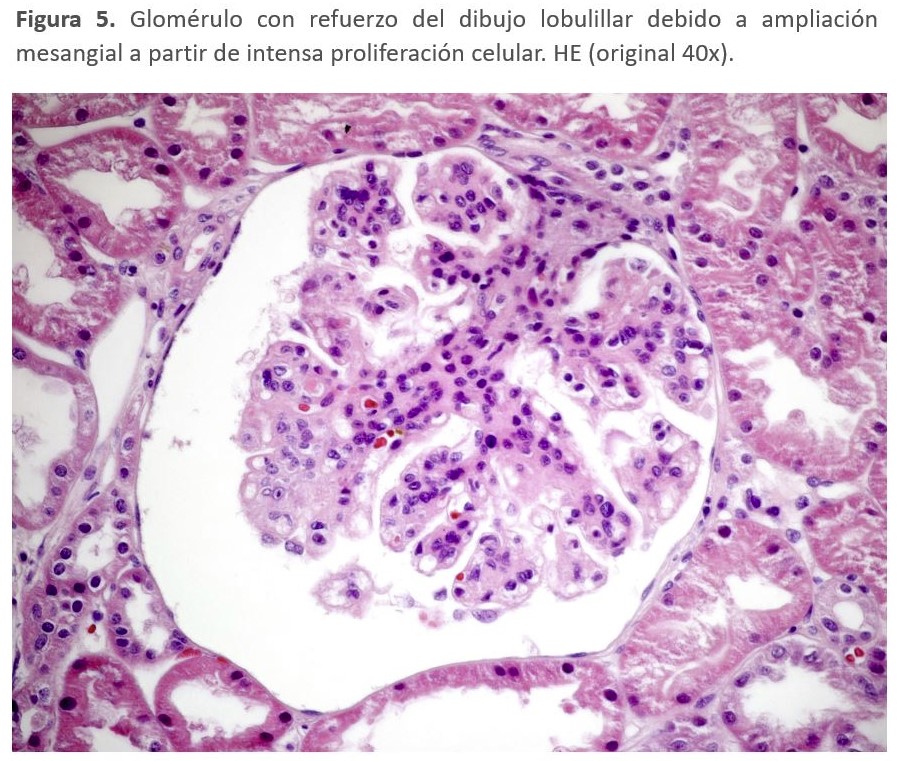
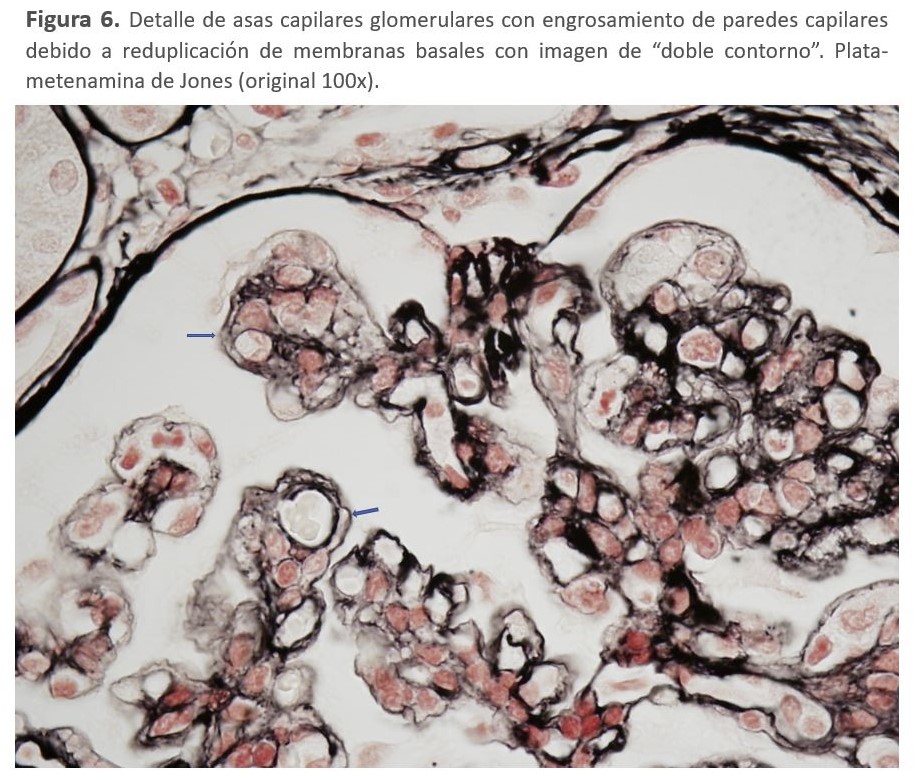
El diagnóstico de la GC3 se realiza mediante biopsia renal. La inmunofluorescencia y la microscopía electrónica van a ser los elementos cruciales para el diagnóstico de esta entidad y poder diferenciar entre los dos tipos de GC3 (Tabla 2). En el estudio por microscopía óptica el patrón histológico más característico es la GNMP (Figura 5) y (Figura 6), aunque este patrón "clásico" ocurre en sólo el 25 a 55% de las muestras de biopsia. Este patrón dio lugar a la reclasificación de las GNMP por medio de la inmunofluorescencia. Sin embargo, podemos encontrar otros patrones histológicos en esta entidad (GN necrotizantes, mesangiales, segmentarias y focales) [138].
Con el fin de determinar el significado pronóstico de las diferentes lesiones histológicas encontradas en la GC3 se ha propuesto recientemente un índice histopatológico para evaluar tanto la actividad de la enfermedad y la cronicidad [139]. Este índice pronóstico incluye siete parámetros de actividad (la hipercelularidad mesangial, la proliferación endocapilar, la morfología de la GNMP, la infiltración leucocitaria, la formación de semilunas, la necrosis fibrinoide, y la inflamación intersticial). Por otro lado, se puntúan 4 parámetros de cronicidad (la glomeruloesclerosis global o segmentaria, la atrofia tubular, la fibrosis intersticial y la presencia de arteriosclerosis). Todos los componentes son puntuados utilizando una escala semicuantitativa de 0 a 3, excepto la arteriosclerosis que se evalúa con una escala de 0-1. Los autores encontraron que tanto la actividad total como la cronicidad total eran predictores independientes de la supervivencia renal [140].
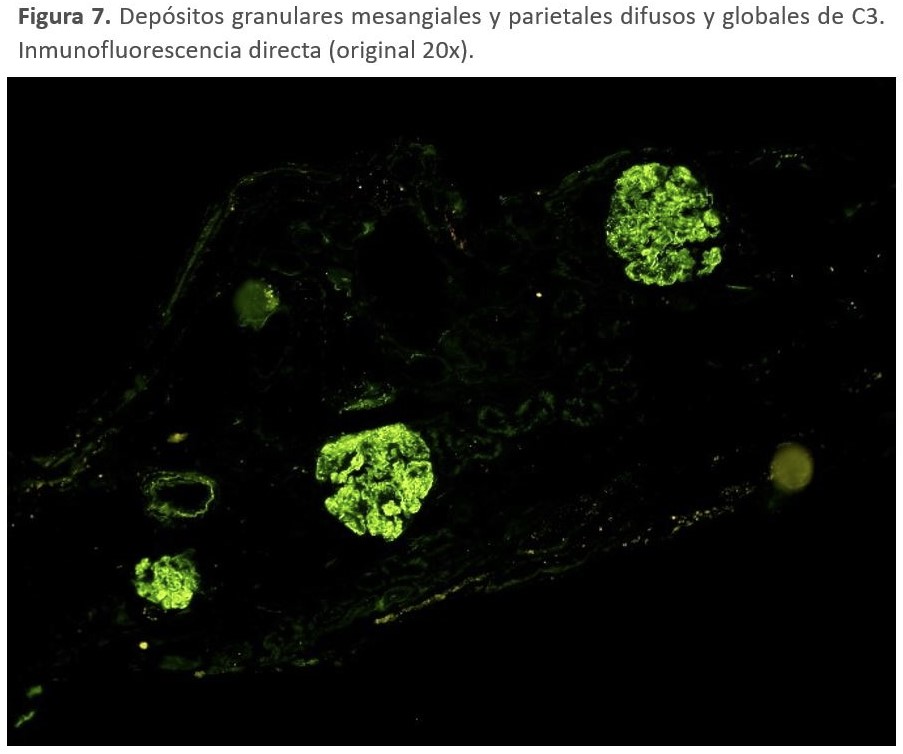
Inmunofluorescencia: Esta técnica es la que ha generado un cambio de visión de estas entidades. En la actualidad, se acepta la definición de C3 dominante (dos magnitudes superiores de intensidad al de las inmunoglobulinas). Los depósitos se localizan en el mesangio y en las paredes de los capilares glomerulares (Figura 7) [125]. En un intento de mejorar su precisión diagnóstica, también se ha estudiado el papel potencial de la tinción de C4d en GC3 para el diagnóstico diferencial de los procesos glomerulares mediados por inmunocomplejos [141]. Sin embargo, aunque los estudios iniciales encontraron que el C4d podía ayudar en el diagnóstico de la enfermedad, otros estudios arrojaron resultados discrepantes.
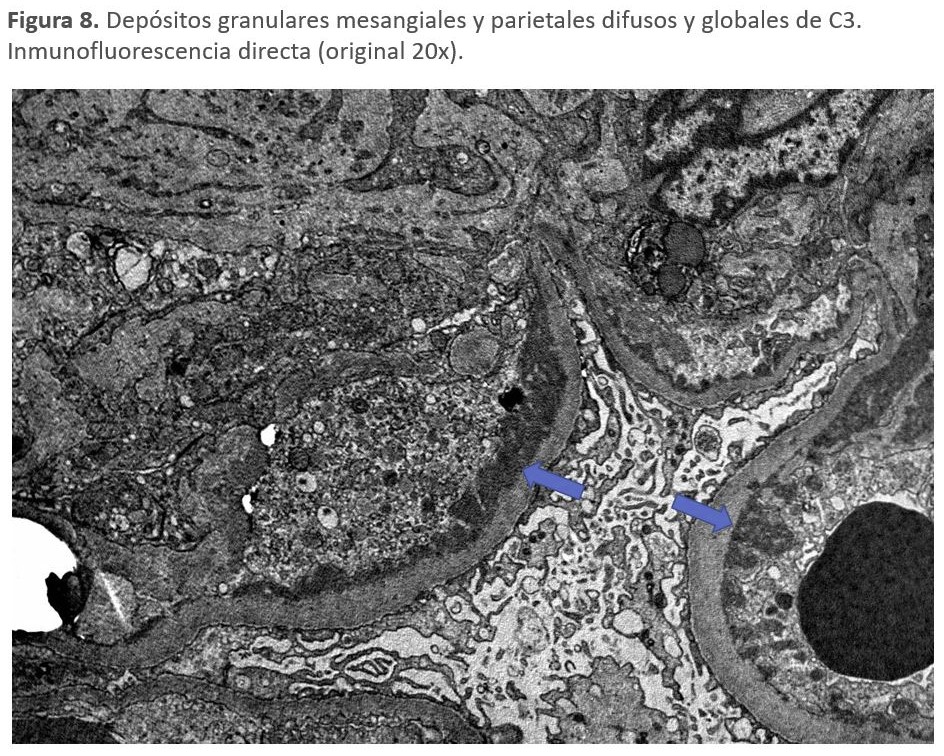
Microscopía electrónica: nos va a diferenciar los dos tipos de GC3. La GNC3, en la que los depósitos pueden ser mesangiales, subendoteliales y subepiteliales y la EDD en la que los depósitos de un material muy denso lineales y extensos ocupan la lámina densa de la MBG (Figura 8) [142].
Estudios diagnósticos especiales
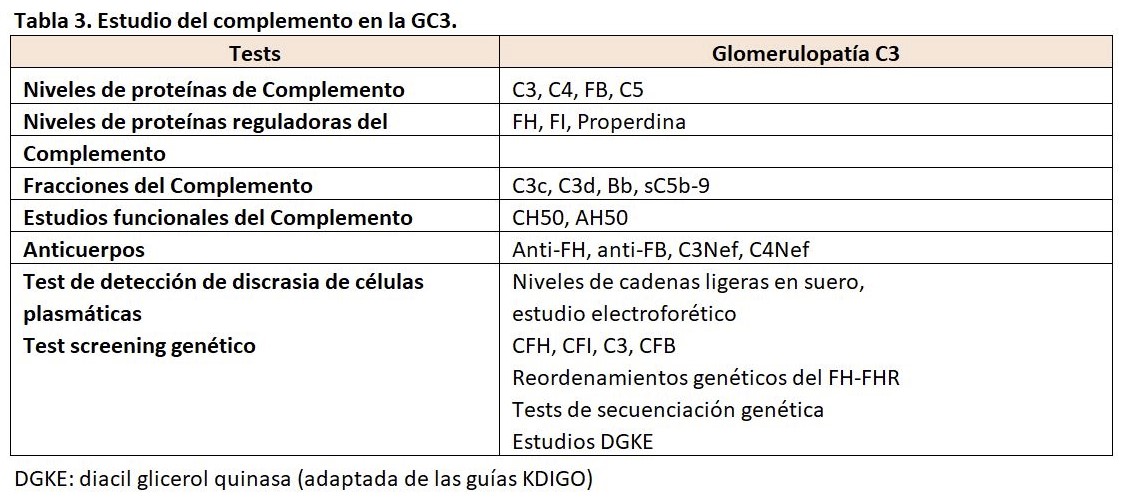
Además de los niveles séricos de C3 y C4, los siguientes tests diagnósticos deben ser realizados en pacientes con GC3 (Tabla 3) y (Tabla 4), ya que los resultados pueden ayudar a determinar el enfoque terapéutico [113]:
Factor nefrítico C3 (C3NeF): C3NeF es un autoanticuerpo que estabiliza la C3 convertasa (C3bBb). La determinación de C3NeF en el suero apoya el diagnóstico de GC3.
Factor sérico H: El factor H regula las convertasas C3 y C5. Si la actividad del factor H esta disminuida o si el factor H es deficiente, se debe realizar la evaluación de posibles mutaciones en el gen del factor H y los autoanticuerpos del factor H.
Las proteínas FHR: CFHR1, CFHR2 y CFHR5 son capaces de competir con el factor H en la regulación de la VA del complemento. Este equilibrio puede ser alterado por las mutaciones de CFHR. Como ejemplos, las mutaciones en el gen FHR5 que producen una duplicación interna son responsables de la GNC3 de origen chipriota y una mutación del gen del FHR3-1 apareció en una GNC3 de una familia irlandesa. Por lo tanto, se deben evaluar las mutaciones en CFHR5 y en otras proteínas relacionadas con el factor H complementario (es decir, CFHR1-4), así como en el factor 3 del complemento (C3) [143].
Inmunoelectroforesis, inmunofijación y determinación de las cadenas ligeras en el suero de los pacientes: Una paraproteína puede ser la responsable de la activación de la VA. Si se descubre una gammapatía monoclonal, se requieren pruebas especializadas para determinar si la proteína puede ser responsable o no de la GC3 [144].
Factor sérico B, factor sérico I y proteína cofactor de membrana (MCP o CD46): La deficiencia de los factores séricos B o I o MCP puede asociarse con la activación anómala de la VA. Si los niveles séricos son bajos deben investigarse mutaciones en estos genes o autoanticuerpos contra estas proteínas.
Niveles del factor soluble C5b-9 (complejo de ataque de membrana soluble): Los niveles elevados del CAM pueden indicar una mayor actividad de la VA.
Sin embargo, debemos considerar que las pruebas mencionadas anteriormente no pueden ser realizadas por la mayoría de los laboratorios clínicos de rutina. Por este motivo, deben enviarse a laboratorios especializados.
Estudios familiares
Los familiares de los pacientes afectados deben someterse a pruebas genéticas si se identifica una mutación potencialmente causal en el paciente. Si se encuentra que el miembro de la familia tiene la misma mutación, se debe evaluar la presencia de hipocomplementemia y un estudio analítico para valorar el grado de afectación renal. Los hermanos asintomáticos y otros miembros de la familia que tienen una mutación genética demostrada deben ser evaluados rutinariamente para descartar signos de enfermedad glomerular (parece razonable poder realizar una analítica de sangre y orina al menos una vez al año, o después de un proceso infeccioso que puede ser un "trigger" de la actividad del complemento) [113].
Pronóstico
La información que se dispone en la literatura es escasa y no suelen distinguir entre los dos tipos de GC3 (GNC3 y EDD), lo que ha generado series en las que la supervivencia renal a los 10 años era del 50% sin que se analizara la influencia del tratamiento inmunosupresor en la supervivencia renal [110] [127]. En una reciente serie española en la que se analizó retrospectivamente el efecto del tratamiento inmunosupresor sobre la evolución de la supervivencia renal, se encontró que un 100% de los pacientes mantenían la función renal a los 10 años de evolución [124].
Entre los factores de riesgo analizados que predicen una peor evolución renal destacan: la mayor edad en el momento del debut, la severidad de las lesiones histológicas (presencia de semilunas) y un mayor deterioro de la función renal en el momento del debut de la enfermedad [104].
En un estudio multicéntrico español, que incluía 98 pacientes con GNC3 y 18 con EDD, el 43% de los pacientes desarrollaban ERCA en un periodo medio de 65 meses. Los principales factores de riesgo clínicos eran la función renal y la proteinuria basal y la inmunosupresión utilizada. Dentro de los factores de riesgo histológicos destacaban, el índice de cronicidad y la afectación túbulo-intersticial [145]. En la búsqueda de un score pronóstico de la GC3, este mismo grupo español ha diseñado un modelo según los diferentes perfiles de pacientes que permite predecir el riesgo de progresión renal. Los pacientes con un índice de cronicidad >4 y una proteinuria >3.5 g/día o los rápidos progresadores (>5 ml/min/año) tuvieron un peor pronóstico renal [146]. (Caravaca-Fontán F, Cavero T, Díaz-Encarnación M, Cabello V, Ariceta G, Quintana LF, Marco H, Barros X, Ramos N, Rodríguez-Mendiola N, Cruz S, Fernández-Juárez G, Rodríguez A, Pérez de José A, Rabasco C, Rodado R, Fernández L, Pérez-Gómez V, Ávila A, Bravo L, Espinosa N, Allende N, Sanchez de la Nieta MD, Rodríguez E, Rivas B, Melgosa M, Huerta A, Miquel R, Mon C, Fraga G, de Lorenzo A, Draibe J, González F, Shabaka A, López-Rubio ME, Fenollosa MÁ, Martín-Penagos L, Da Silva I, Titos JA, Rodríguez de Córdoba S, Goicoechea de Jorge E, Praga M; Spanish Group for the Study of Glomerular Diseases (GLOSEN). Clinical Profiles and Patterns of Kidney Disease Progression in C3 Glomerulopathy. Kidney360. 2023 May 1;4(5):659-672).
Tratamiento
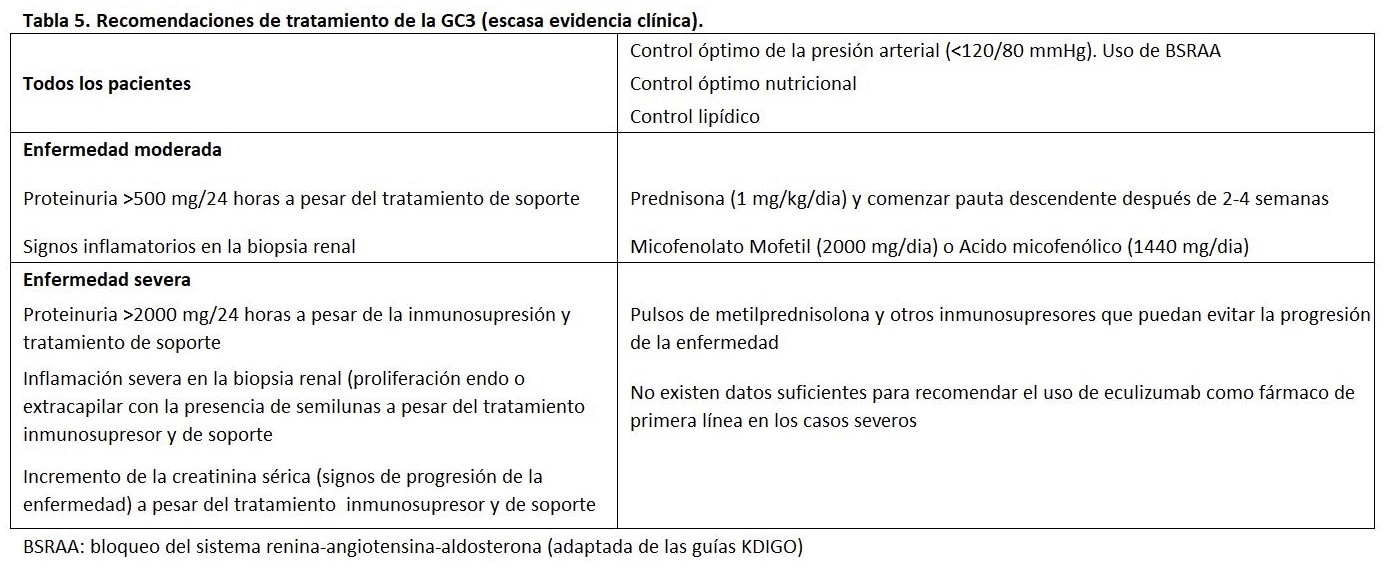
Las GC3 son enfermedades poco frecuentes, y no hay estudios prospectivos y randomizados que nos indiquen cual debe ser nuestra decisión terapéutica. El objetivo del tratamiento de las GC3 debería ir encaminado a la eliminación de los anticuerpos dirigidos a las proteínas reguladoras del complemento (C3Nef o anti-FH), restablecer proteínas reguladoras deficientes o disfuncionantes o eliminar proteínas mutantes o híbridas (Tabla 5) [147] [148].
- Medidas generales: Los pacientes con GC3 que tienen hipertensión y/o proteinuria mayor de 500 a 1000 mg/día, deberían recibir preferiblemente un bloqueante del sistema renina-angiotensina-aldosterona, aunque los beneficios de la inhibición del sistema renina-angiotensina no se ha demostrado en estudios específicos para la GC3. Por otro lado, en estos pacientes se debe evaluar y tratar la dislipidemia para reducir el riesgo de enfermedad cardiovascular [113].
- Paciente con enfermedad leve: Algunos pacientes con GC3 tienen una enfermedad leve caracterizada por hematuria, proteinuria leve (es decir, menos de 500 mg/día) y función renal normal. En estos pacientes, se sugieren utilizar las medidas generales antes comentadas [113].
- Pacientes con enfermedad moderadamente grave: En pacientes con proteinuria más severa, síndrome nefrótico y/o deterioro de la función renal, el tratamiento debe basarse en la etiología subyacente, si se conoce.
a. Pacientes en los que la causa puede ser determinada:
- Enfermedad debida a un autoanticuerpo: En pacientes cuya enfermedad es presumiblemente debida a un autoanticuerpo circulante, por ejemplo, C3NeF o un anticuerpo anti-factor H, no hay un consenso unánime entre los autores y revisores de este tema. Las opciones terapéuticas incluyen intercambio de plasma, inmunosupresión combinada (esteroides y micofenolato) [124] [128], rituximab y eculizumab (en pacientes con niveles elevados del CAM). En pacientes con C5NeF las terapias basadas en la prevención de la activación de C5 o dirigidas sobre la inhibición de la unión de properdina a C3bBb podrían tener un beneficio potencial [131].
- Enfermedad debida a una deficiencia genética: En pacientes cuya enfermedad se debe presumiblemente a una deficiencia hereditaria de un factor sérico del complemento, por ejemplo, deficiencia hereditaria del FH, se sugieren infusiones periódicas de plasma fresco congelado (PFC) para reemplazar la proteína ausente o mutante.
- Enfermedad debida a mutación del factor C3: En estos pacientes, se sugiere el intercambio de plasma, que teóricamente podría eliminar la proteína C3 anormal y reemplazarla por una proteína normal que puede ser inactivada por el factor H.
b. Pacientes en los que la etiología subyacente no puede determinarse
En estos pacientes, se sugiere infusión de plasma, porque esta terapia podría ser eficaz si el paciente tiene una mutación genética que conduce a la deficiencia de un factor sérico.
- Pacientes con deterioro rápido de la función renal: En pacientes con deterioro progresivo de la función renal y/o lesiones histológicas agresivas, se sugiere el uso de corticoides en combinación con ciclofosfamida o micofenolato mofetil. Algunos también tratarían a estos pacientes con intercambio plasmático además del tratamiento inmunosupresor. En pacientes con deficiencia genética de un factor sérico del complemento, se trataría con infusión periódica de PFC después de que se logre la remisión.
En resumen, podemos concluir que el tratamiento de la GC3 es controvertido. La inmunosupresión convencional había sido considerada inefectiva, sin embargo, basándose en algunos casos clínicos y series cortas de enfermos y especialmente en estudios recientes que han demostrado un efecto beneficioso de la terapia combinada con esteroides y micofenolato mofetilo (MMF), el tratamiento inmunosupresor podría ser una aproximación terapéutica válida en casos seleccionados. En 2015, un estudio coordinado por el Grupo Español para el Estudio de las Enfermedades Glomerulares (GLOSEN) describió por primera vez la eficacia de la combinación terapéutica de corticoides más MMF en una cohorte multicéntrica de 61 pacientes con GNC3 [124]. En particular, los pacientes que habían recibido inmunosupresión tuvieron resultados significativamente mejores que los pacientes tratados de forma conservadora. Sin embargo, este efecto favorable fue más notable en los tratados con corticosteroides más MMF. La principal limitación de este estudio fue que los análisis genéticos y moleculares del complemento sólo se realizaron en un grupo reducido de pacientes. Por lo tanto, si las anomalías genéticas del complemento o la presencia de C3NeF influían en la respuesta terapéutica a este régimen inmunosupresor no pudo ser determinado. Más recientemente, otro estudio realizado por el mismo grupo, describió una cohorte de 97 pacientes (84% GC3, 16% por EDD). Cuarenta y dos pacientes fueron tratados con corticosteroides más MMF, y este tratamiento se asoció a una mayor tasa de remisión y una menor probabilidad de insuficiencia renal (79% y 14%, respectivamente) en comparación con los pacientes tratados con otros inmunosupresores (24% y 59%, respectivamente), o eculizumab (33% y 67%, respectivamente), o tratamiento conservador (18% y 65%, respectivamente). La superioridad terapéutica de los corticosteroides más el MMF se observó tanto en pacientes con anomalías del complemento como con autoanticuerpos. Sin embargo, los pacientes con variantes patogénicas del complemento sólo alcanzaron una remisión parcial, mientras que las remisiones completas fueron comunes entre los pacientes con formas mediadas por autoanticuerpos. El principal determinante de la no remisión fue la proteinuria basal. Las recaídas se produjeron tras la interrupción del tratamiento en el 33% de los pacientes que habían logrado la remisión con corticosteroides más MMF y una mayor duración del tratamiento con MMF se asoció con un menor riesgo de recaída [149].
Un posible régimen terapéutico sería la administración de prednisona oral 0,5-1 mg/kg/día durante 1-2 semanas, seguido de una disminución lenta de la prednisona durante 3-4 meses, y MMF 1.000-2.000 mg/día (o micofenolato sódico 720-1.440 mg/día) según la tolerancia o los efectos secundarios durante un período de un año o como terapia de mantenimiento indefinida.
Las terapias que actúan directamente sobre el complemento han comenzado a incrementarse en los últimos años. Varios enfermos han sido tratados con eculizumab con resultados diversos [150] [151] aunque el análisis cuidadoso de los casos revela que el eculizumab podría ser efectivo en pacientes con enfermedad aguda y agresiva, ausencia de lesiones crónicas avanzadas en la biopsia renal y elevación de los niveles séricos de C5b-9 [150] [151]. A día de hoy, no nos consta que se hayan descrito casos de pacientes con C3G que desarrollaran una MAT tras ser tratados con eculizumab.
Varios de los agentes más nuevos que bloquean el complemento en diferentes lugares de la cascada, se están probando actualmente en la GC3 (inhibidores de moléculas pequeñas del factor B y factor D). En un estudio reciente, se ha descubierto de forma inesperada que la deficiencia de factor D no protegía a los ratones de la enfermedad glomerular en un modelo de GC3 [152], lo que indica que el factor D podría no ser un buen objetivo. La diana terapéutica más lógica para la intervención en GC3 podría ser la inhibición de la activación de C3, hipótesis que ha sido demostrado en animales con resultados prometedores. Dado que estos fármacos bloquean toda la activación de C3 a través de las tres vías, desde un punto de vista teórico, deberían ser eficaces en la GC3 y en la GN por IC. El tratamiento con CR1 soluble (sCR1, un inhibidor de C3) en un modelo de ratón similar a la EDD evitó el depósito renal de fragmentos de activación de C3 y normalizó los niveles sistémicos de C3 [153]. En consecuencia, el tratamiento a corto plazo con sCR1 en un paciente pediátrico con EDD y enfermedad renal avanzada demostró un incremento del C3 sérico y una disminución de los niveles de sC5b-9. Estudios recientes, con diferentes bloqueadores del complemento parecen abrir una puerta de esperanza para estos pacientes. Pegcetacoplan, un inhibidor de C3 y C3b en un estudio fase II con ocho pacientes, demostró una reducción de la proteinuria en un 50%, un incremento de los niveles de C3 y una estabilización de la función renal a las 48 semanas de tratamiento [154]. Iptacopan, un inhibidor del factor B, en un estudio fase II con 27 pacientes con GC3 (riñones nativos y pacientes con trasplante renal), demostraron una reducción de la proteinuria en un 45% y normalización de los niveles C3 a las 12 semanas de tratamiento [155].
c. Pacientes con una gammapatía monoclonal subyacente
Los pacientes que presentan una gammapatía monoclonal deben ser evaluados para descartar la presencia de un mieloma múltiple. El tratamiento general de estos pacientes dependerá de la extensión de la gammapatía monoclonal.
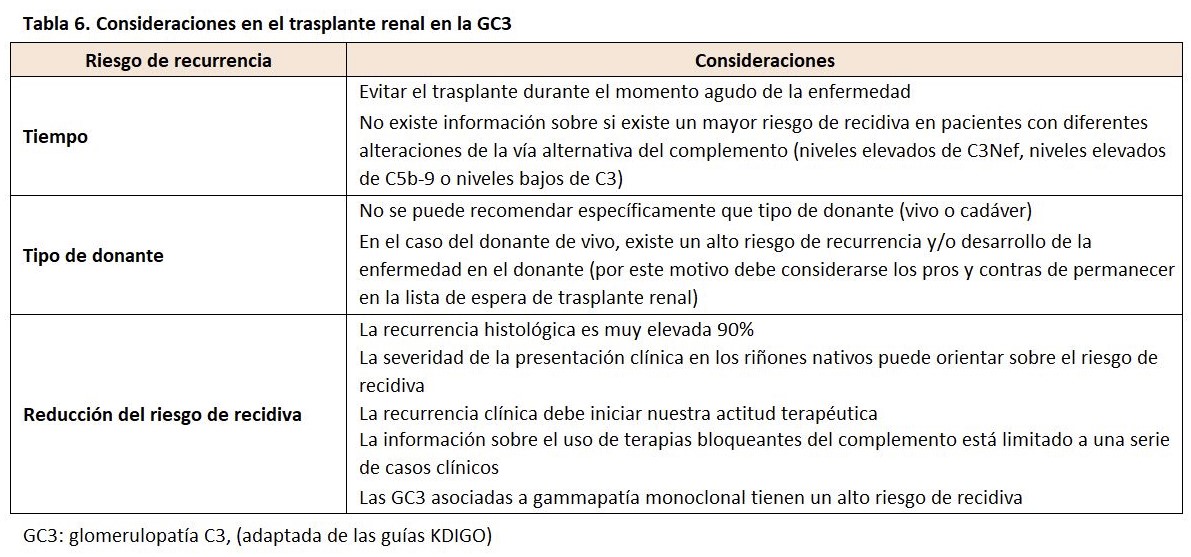
Recidiva en el trasplante renal
El riesgo de recidiva en el trasplante es muy elevado en la EDD, próximo al 70% y hasta un 50% pierde el injerto renal a los 2 años de la recidiva. En el caso de la GNC3, dos tercios de los pacientes presenta recidiva de la enfermedad en los dos primeros años del trasplante, con una pérdida del injerto similar al de la EDD [156] [157]. Entre los factores de riesgo evaluados para la recidiva de la enfermedad destacaba la presentación clínica agresiva de la enfermedad en los riñones nativos sin que existe información relevante sobre otros posibles factores (tipo de donante, inmunosupresión, tipo de alteración de la vía alternativa del complemento) (Tabla 6) [158]. La forma clínica de presentación es similar a la que ocurre en los riñones nativos con proteinuria generalmente nefrótica y microhematuria con diferentes grados de deterioro de la función renal [159] [160]. Se recomienda la realización de estudio genético del complemento que nos puede orientar hacia las diferentes opciones terapéuticas a utilizar en estos pacientes. En los casos de anticuerpos, la intensificación del tratamiento con micofenolato u otros agentes como rituximab, podría retrasar o prevenir la recidiva [161]. En los pacientes con alteraciones genéticas, se podría ensayar el uso de terapias como la infusión de plasma fresco o el tratamiento con algún bloqueante del complemento (iptacopan o pegcetacoplan) eculizumab. En el caso de la presencia de una paraproteina monoclonal, el tratamiento específico de esta entidad podría ser beneficioso.
Una cuestión importante que debemos tener en cuenta en esta patología es la viabilidad de la donación de vivo (donantes relacionados con el receptor) por el riesgo de desarrollar la enfermedad en el donante después de la cirugía. Lo que se recomienda es la realización de un estudio genético y funcional del complemento del receptor y del donante emparentado [161].
GLOMERULOPATÍA C4
Introducción
En el año 2014, se identificó un nuevo tipo de GN mediada por el complemento que se caracterizaba por el depósito de C4 en ausencia de C3, C1q e inmunoglobulinas. Este trastorno se denominó enfermedad de depósito denso C4 (si había depósitos densos de C4 a lo largo de la membrana basal glomerular documentada por microscopía electrónica) o GNC4 (si había depósitos de C4 principalmente en el mesangio) [162].
Patogenia
Aunque todavía no se ha definido la patogenia de la GC4, es probable que exista una hiperactividad de la vía de las lectinas. La vía de las lectinas, al igual que la VC del complemento (inmunoglobulina dependiente), activa C2 y C4 (pero no C1q), sin la participación de anticuerpos. Aunque no está probado, factores genéticos, autoanticuerpos adquiridos o una paraproteína que interfiere con la vía de las lectinas pueden desempeñar un papel en la patogenia de la GC4. También puede haber una mutación en la producción anormal de la proteína C4 que resista la degradación y acabe depositándose en el glomérulo [162] [163].
Manifestaciones clínicas
Los casos notificados de GC4 son escasos y afectan tanto a hombres como a mujeres. La mayor parte de los casos diagnosticados de GC4 son en la infancia o en los adolescentes. Las manifestaciones clínicas son superponibles a las de la GC3; proteinuria de rango variable, microhematuria, hipertensión arterial, niveles normales de C3 y ligeramente disminuidos de C4 y un progresivo deterioro de la función renal. A diferencia de la GC3, en los pacientes diagnosticados de GC4 no se han descrito niveles elevados de C5b-9 circulante [163] [164].
Diagnóstico
El diagnóstico de la GC4 se realiza mediante biopsia renal. En los pacientes con EDD por C4, la microscopía óptica muestra un patrón de GNMP con hipercelularidad mesangial, proliferación endocapilar y membranas basales glomerulares engrosadas y formación de doble contorno [164]. Se describen depósitos PAS positivos a lo largo de las membranas basales glomerulares. La microscopía óptica en pacientes con GNC4 también pueden presentar un patrón de GN proliferativa mesangial sin proliferación endocapilar ni formación de doble contorno. La inmunofluorescencia de la biopsia renal demuestra una tinción brillante para C4d, que es un producto de la fragmentación de C4. Por el contrario, la tinción es negativa para otros componentes del complemento (C3 y C1q) y para las inmunoglobulinas (IgG, IgM e IgA). La microscopía electrónica de la EDD por C4 muestra hallazgos distintivos de depósitos electrondensos osmiófilos en la MBG. En la GNC4, los depósitos electrondensos se observan principalmente en el mesangio; aunque también pueden observarse intramembranosos o subendoteliales [163] [164].
A diferencia de los pacientes con GC3, los pacientes con GC4 no deben presentar defectos congénitos o adquiridos de la VA de complemento. Sin embargo, los pacientes con GC4 pueden tener una hiperactividad de la vía de las lectinas del complemento. En los pacientes diagnosticados de GC4, debe realizarse una inmunoelectroforesis, una inmunofijación y medición de cadenas ligeras libres de suero porque la paraproteína puede ser responsable de la activación anormal del complemento. En el reducido número de pacientes con GC4, los niveles séricos del CAM están en rango normal [163].
Tratamiento
El tratamiento óptimo de los pacientes con GC4 no está claro. Se han utilizado los inhibidores de la enzima conversora de la angiotensina permitiendo un mejor control de la presión arterial, pero un pobre o nulo efecto sobre la proteinuria. No existen datos que apoyen el uso de la terapia inmunosupresora. Sin embargo, extrapolando el tratamiento empleado en las GC3, podríamos ensayar terapias inmunosupresoras (esteroides y micofenolato) en pacientes con GC4 que presentan proteinuria progresiva a pesar del tratamiento de soporte o que existan datos de proliferación extracapilar en la biopsia renal.