Glomerulomefritis Rápidamente Progresivas
INTRODUCCIÓN
El término glomerulonefritis rápidamente progresiva (GNRP) hace referencia a un evento clínico caracterizado por deterioro de la función renal que cursa en días o semanas y que, dejado a su natural evolución, produce insuficiencia renal terminal en la mayoría de los pacientes. Anatomopatológicamente, el concepto de GNRP se asocia a la presencia de proliferación extracapilar como consecuencia de la ruptura de la membrana basal glomerular que permite el paso de fibrina y monocitos al espacio de Bowman [1]. Tras un primer estadio en el que predomina la presencia de células y mediadores inflamatorios, entre los que destacan interleuquina-1 y factor de necrosis tumoral-alfa (TNF-alfa), se produce la formación de semilunas epiteliales [2]. Dejadas a su evolución, la consecuencia es la formación de semilunas fibrosas lo que se traduce en la irreversibilidad del cuadro. El porcentaje de semilunas fibrosas es un marcador pronóstico fundamental en esta entidad clínica [3].
TIPOS DE GLOMERULONEFRITIS RÁPIDAMENTE PROGRESIVAS Y PATOGENIA
En la GNRP existen cuatro mecanismos de daño glomerular:
Tipo 1. Mediado por anticuerpos anti-membrana basal glomerular (MBG)
Se caracteriza por la presencia de anticuerpos circulantes, normalmente IgG (1 y 3), aunque en ocasiones son IgA o IgM, que principalmente actúan frente a la cadena alfa3 de colágeno IV presente en la membrana basal glomerular (MBG) (antígeno de Goodpasture) [4] e incluso frente a la membrana basal tubular [5]. Estas cadenas se encuentran en otros órganos como en los alveolos, la cóclea, el ojo, el plexo coroideo y algunos órganos endocrinos. Además, algunos estudios experimentales recientes sugieren la presencia de linfocitos T autorreactivos como parte de la patogenia en esta entidad [6]. Clásicamente, se ha denominado síndrome de Goodpasture a la asociación entre hemorragia pulmonar y fracaso renal. No obstante, la entidad mediada por anticuerpos frente a MBG (enfermedad de Goodpasture) sólo es responsable de una proporción de pacientes con dicha clínica [7]. Entre los factores de riesgo de esta enfermedad, se encuentran la predisposición genética (HLA DRB1*1501 y DR4 como factores de riesgo y DR1 y DR7 como protectores) y determinados factores ambientales (exposición a hidrocarburos y tabaco) [8].
Tipo 2. Mediado por inmunocomplejos
Este tipo no es propio de ninguna patología específica, y puede desarrollarse como parte de numerosas enfermedades renales mediadas por complejos inmunes como las glomerulonefritis primarias (nefropatía IgA, glomerulonefritis post-infecciosa o membranoproliferativa) o enfermedades sistémicas (nefropatía lúpica, artritis reumatoide, crioglobulinemia, tumores sólidos, hipertensión maligna).
Tipo 3. Sin depósitos de inmunoglobulinas o pauci-inmune
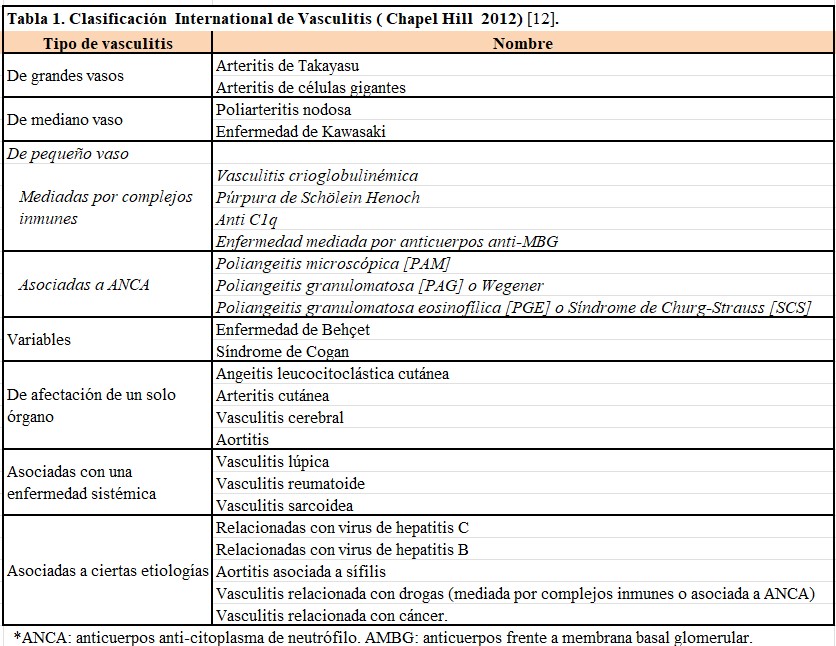
Consiste en una glomerulonefritis necrotizante sin evidencia de depósitos de inmunoglobulinas en el glomérulo y que presenta en el suero anticuerpos frente al citoplasma de neutrófilo (ANCA) en más de un 80% de los casos. Este tipo de glomerulonefritis forma parte de una vasculitis necrotizante, muchas veces autolimitada al riñón, que se caracteriza por infiltración leucocitaria en las paredes vasculares, necrosis fibrinoide y daño vascular. La vía patogénica más aceptada hasta la fecha consiste en la estimulación de los neutrófilos por unión de ANCA a la superficie celular. Posteriormente se produce el daño lítico y citotóxico sobre el vaso sanguíneo generando apoptosis y necrosis de los neutrófilos y de las células endoteliales [9]. Además, es necesaria la presencia de linfocitos B autorreactivos que desarrollen autoanticuerpos y linfocitos T autorreactivos para la presentación antigénica, coestimulación y producción de citoquinas proinflamatorias [10]. Esta disregulación inmunológica se ha puesto en relación con cierta susceptibilidad genética y con factores medioambientales como la falta de exposición a la radiación ultravioleta y el déficit de vitamina D (factores de riesgo para el desarrollo de vasculitis granulomatosas), el contacto con metales pesados, ciertas infecciones virales y bacterianas o vacunaciones [11]. Recientemente, se ha publicado una nueva y revisada clasificación International Chapel Hill Consensus Conference Nomenclature of Vasculitides actualizando la ya conocida de 1994 como se resume en la (Tabla 1) [12].
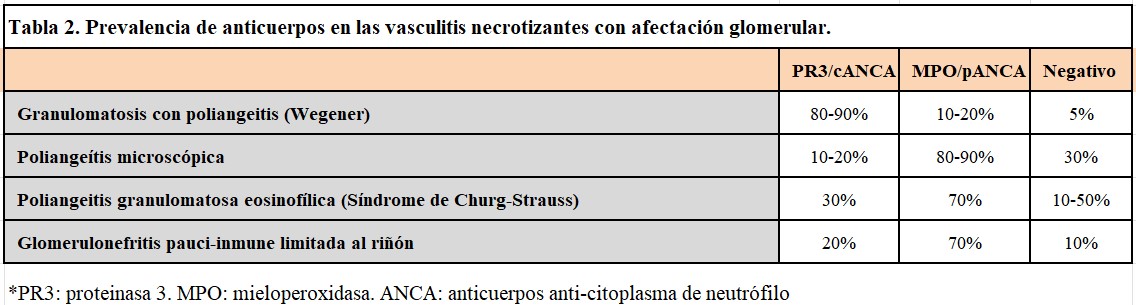
Únicamente las vasculitis con afectación de pequeño vaso producen afectación renal en forma de glomerulonefritis rápidamente progresiva. En ellas, los ANCA demostrados con mayor frecuencia son los dirigidos frente a proteinasa 3 (PR3) y mieloperoxidasa (MPO). La determinación de laboratorio de los anticuerpos puede realizarse utilizando inmunofluorescencia indirecta (IFA) que es más sensible o por inmunoensayo enzimático (ELISA) que es más específica. Existen dos patrones mayoritarios que incluyen la positividad citoplasmática (c-ANCA) o perinuclear (p-ANCA) demostrados con IFA; éstos suelen tener especificidad para PR3 y MPO respectivamente [13]. En modelos animales, se ha demostrado la capacidad de los ANCAs para inducir glomerulonefritis pauci-inmune, a pesar de que la asociación entre los títulos de anticuerpos y la severidad de la enfermedad presentan un nivel de correlación débil [7] [14]. En el curso de la enfermedad, los ANCA se pueden modificar con el tratamiento y negativizarse, lo que en general se ha relacionado con un mejor pronóstico [15]. Sin embargo, en algunos casos de vasculitis necrotizante, los ANCA pueden no detectarse, lo cual no excluye el diagnóstico (Tabla 2). Por otra parte, a pesar de la especificidad y sensibilidad de los ANCA, éstos pueden aparecer en patologías inflamatorias o inmunológicas diferentes a las vasculitis, además de las vasculitis asociadas a drogas y fármacos (propiltiouracilo, hidralazina, penicilamina, cocaína, levamisol). Recientemente, se han descrito dentro de los ANCA, los anticuerpos dirigidos contra lisosomas asociados a la proteína de membrana 2 (LAMP-2) que aparecen hasta en el 90% de las glomerulonefritis pauci-inmunes, sugiriendo un papel relevante en la patogenia de la enfermedad [16]. Aunque el diagnóstico y el tratamiento de la enfermedad no pueden basarse únicamente en la positividad de los anticuerpos, el valor predictivo positivo de los ANCA en presencia de un cuadro clínico de GNRP alcanza el 99% [17]. Además, en los pacientes en remisión con ANCA negativos, su positivización puede preceder a una recidiva por lo que el seguimiento clínico debe ser exhaustivo.
La presencia de vasculitis-ANCA puede presentarse de manera conjunta con otros tipos de afectación glomerular como la nefropatía membranosa, la nefropatía lúpica, la enfermedad de Goodpasture, la nefropatía IgA o la glomerulonefritis post-infecciosa.
Tipo 4. Combinación de los tipos 1 y 3
Presenta características de ambos tipos de GNRP. Normalmente estos pacientes con dobles anticuerpos tienen un curso clínico similar a las GNRP tipo 3 y, secundariamente al daño glomerular, desarrollan anticuerpos frente a la MBG (AMBG). Además, los títulos de AMBG suelen ser inferiores a los de ANCA.
EPIDEMIOLOGÍA
Las GNRP suponen el 6,6% de las biopsias renales registradas en el Registro de Glomerulonefritis de la Sociedad Española de Nefrología hasta el año 2023, siendo el tipo 3 el más frecuente, seguido del tipo 2 y finalmente del 1 [18]. Sin embargo, en pacientes mayores de 65 años, la GNRP tipo 3 y más concretamente la poliangeitis microscópica (PAM) son en España la primera causa de biopsia renal [19]. Las tipo 1 presentan una incidencia muy baja que se sitúa en 1 caso por millón de habitantes y año, con predominio de varones de raza blanca. Las tipo 3 normalmente debutan entre la quinta y la séptima década de la vida y presentan un predominio masculino. Además, en la raza caucásica alcanzan una incidencia mayor que en el resto [7].
CLÍNICA
La presentación de las GNRP se caracteriza por un daño progresivo, entre días y semanas, que afecta a diferentes órganos interindividualmente. La sintomatología típica cursa con un cuadro pseudogripal, que incluye artralgias y mialgias, febrícula, astenia, pérdida de peso y sobrecarga de volumen [1]. Al tratarse de enfermedades sistémicas pueden afectar prácticamente a cualquier órgano.
- En el momento de la presentación, la insuficiencia renal es constante. El sedimento urinario suele demostrar hematuria glomerular con hematíes dismórficos, cilindros granulosos y leucocituria y en la analítica de orina se evidencia proteinuria que con poca frecuencia supera los 3 gramos al día (éste hecho ocurre cuando el deterioro de la función renal es menor). En la mayor parte de los casos la presentación es en forma de síndrome nefrítico y cursan con oliguria, hematuria e hipertensión, así como otros datos de sobrecarga hídrica como insuficiencia cardiaca o edema agudo de pulmón [20]. Cabe destacar la existencia de vasculitis limitadas al riñón que, aunque se consideran dentro del espectro de la PAM, no suelen presentar manifestaciones extrarrenales [21].
- La afectación pulmonar suele presentarse en forma de hemoptisis en la tipo 1 (síndrome de Goodpasture) en más del 50% de los casos, pero también puede ocurrir asociada a las tipo 2 y tipo 3. Ocurre en la poliangeitis granulomatosa (PAG) y en la poliangeitis granulomatosa eosinofílica (PGE), aunque también en la PAM. La hemoptisis puede aparecen en todos los tipos de GNRP, ya sea secundaria a hemorragia pulmonar o por sobrecarga hídrica pulmonar. Dado que la hemorragia pulmonar es frecuente y puede condicionar el tratamiento, en ocasiones para su diagnóstico se precisa la realización de un test de difusión de CO, la demostración de macrófagos con hemosiderina e incluso una fibrobroncoscopia. Además de la hemoptisis, en la PAG y en la PGE se pueden producir granulomas necrotizantes, además de lesiones del tracto respiratorio superior como sinusitis, rinitis, otitis, destrucción del tabique nasal ("nariz en silla de montar"), conjuntivitis o úlceras corneales. Una de las manifestaciones cardinales de la PGE es el asma, que junto con la eosinofilia suele aparecen en las primeras etapas de la enfermedad. Más excepcionalmente se puede desarrollar fibrosis pulmonar, e hipertensión pulmonar [22].
- La afectación cutánea también es frecuente y suele manifestarse en forma de púrpura en miembros inferiores, alcanzando mayor incidencia en las PGE, PAG y PAM. La aparición de nódulos subcutáneos es más notoria en las PGE.
- La afectación cardíaca aparece más frecuentemente en la PGE y puede consistir en bloqueos de la conducción cardiaca, aquinesia ventricular, pericarditis, endocarditis o miocarditis [23].
- La afectación neurológica, también aparece de manera más frecuente en la PGE en forma de mononeuritis múltiple [24].
- La afectación gastrointestinal puede cursar con dolor, rectorragia, o incluso isquemia mesentérica y perforación intestinal, aunque esto es infrecuente [7].
- Otras manifestaciones menos frecuentes incluyen el aumento en la incidencia de trombosis venosa profunda o las adenopatías cervicales y axilares.
ANATOMÍA PATOLÓGICA
(Ver Atlas de Histopatología en NAD)
- Tipo 1. Para el diagnóstico de esta entidad, se precisa la positividad de anticuerpos frente a MBG (AMBG) en sangre o en la biopsia renal que se puede realizar mediante ELISA confirmado con Western Blot, evidenciándose pocos falsos negativos con ambas determinaciones. De todas formas, la realización de la biopsia renal está indicada en prácticamente todos los casos ya que ofrece información sobre el pronóstico de la patología lo cual puede influir en el manejo en función de la cronicidad y actividad de las lesiones. La anatomía patológica suele demostrar la presencia de semilunas (que suelen presentar el mismo tiempo de evolución), con cierto grado de atrofia tubular. El hallazgo patognomónico es la presencia en la inmunofluorescencia de IgG linear que predomina en los capilares glomerulares, aunque ocasionalmente puede aparecer en los túbulos. Excepcionalmente puede haber fijación de IgA e IgM. La fijación de C3 ocurre en el 75% de los casos [25]. Los depósitos lineales de inmunoglobulinas pueden ocurrir en otras patologías como en la diabetes, en el trasplante de cadáver, en la enfermedad por cadenas ligeras, en la glomerulopatía fibrilar o en el lupus eritematoso sistémico [7].
- Tipo 2. La anatomía patológica en este caso depende de la entidad con la que se relacione, además de la presencia de semilunas epiteliales o fibrosas.
- Tipo 3. La anatomía patológica suele demostrar necrosis segmentaria fibrinoide acompañada de infiltración leucocitaria y leucocitoclastia. Aunque en un principio las células predominantes son los polimorfonucleares, estos son sustituidos rápidamente por mononucleares. La necrosis fibrinoide genera lesiones esclerosantes que se pueden asociar a trombosis. La presencia de semilunas es muy frecuente y, dependiendo del estadio evolutivo, pueden ser epiteliales o fibrosas; además, su presencia se relaciona con la positividad de los ANCAs [26]. Aunque de predominio en la PGE, los eosinófilos se pueden encontrar en relación con las lesiones vasculíticas en cualquier tipo de vasculitis. En las pacientes con PGE y PAG es frecuente la presencia de granulomas necrotizantes. Ocasionalmente se puede producir necrosis papilar si existe afectación de los vasos medulares.
TRATAMIENTO
La GNRP dejadas a su evolución natural, sin tratamiento, condicionan una elevada morbi-mortalidad. Una fuerte sospecha clínica debe hacer que nos planteemos un tratamiento precoz ya que éste aumenta la supervivencia global de los pacientes.
En general podemos dividir el tratamiento inmunosupresor en dos etapas: la de inducción a la remisión y la de mantenimiento. Los regímenes clásicos y más utilizados en todos los tipos de GNRP incluyen esteroides y ciclofosfamida asociados o no a plasmaféresis. Sin embargo, en el momento actual se ha establecido la no inferioridad de fármacos biológicos como el Rituximab por su adecuado perfil de seguridad y efectividad. Por otro lado, es importante garantizar al paciente un buen tratamiento de soporte con profilaxis de infecciones y control sintomático e iniciando terapia renal sustitutiva si el paciente así lo precisa.
Tipo 1.
Dada la gravedad de la patología, el tratamiento debe iniciarse incluso sin esperar a la confirmación histológica de la enfermedad. Únicamente se debe valorar no iniciar tratamiento en aquellos pacientes que presenten una histología renal crónica (100% de semilunas fibrosas) sin evidencia de hemorragia pulmonar, dado que la frecuencia de aparición de esta posteriormente es extremadamente baja [27]. Como se ha expresado anteriormente, la inducción consiste en prednisona y ciclofosfamida (y rituximab como alternativa) con la intención de frenar la formación de nuevos anticuerpos, junto con plasmaféresis para retirarlos de la circulación.
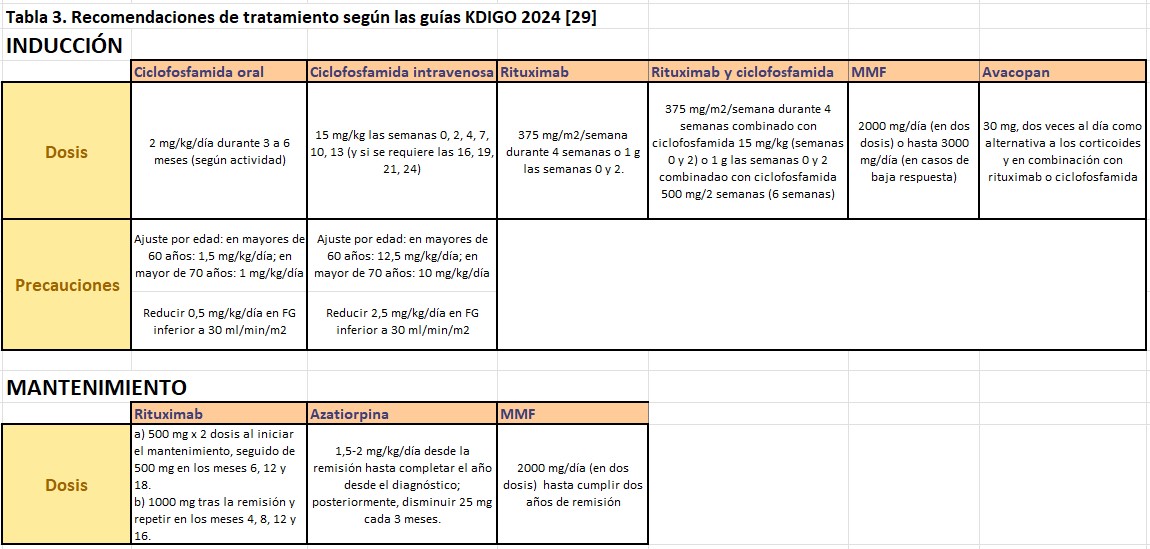
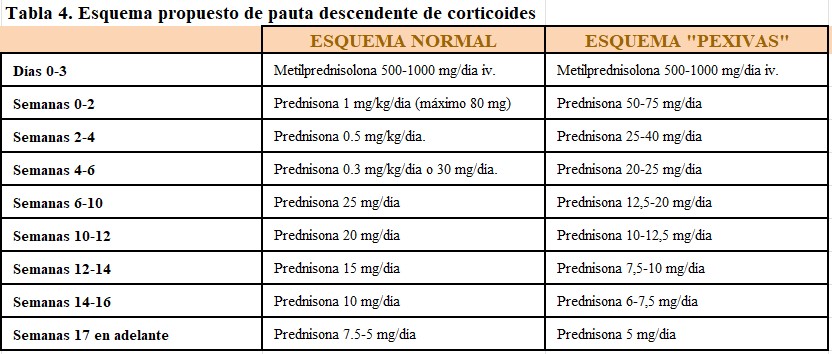
- Inmunosupresión: la terapia de inducción incluye ciclofosfamida (oral o intravenosa) o rituximab (Tabla 3). Las guías KDIGO de 2021 mantienen la preferencia por la primera para este tipo de afectación. Dado que el efecto adverso más temido de la ciclofosfamida son las infecciones, se debe titular la dosis en función del recuento leucocitario, suspendiendo o disminuyendo la dosis si el mismo es inferior a 3500/µL. En los pacientes tratados con ciclofosfamida intravenosa se recomienda realizar profilaxis con cotrimoxazol frente al Pneumocystis jirovenci y con MESNA (2-mercapto etansulfato de sodio) frente a la cistitis hemorrágica. Los corticoides se suelen administrar en tres bolos intravenosos de metilprednisolona de 250-1000 mg, seguidos de prednisona oral a dosis de 1 mg/kg/día con pauta descendente en los siguientes 3-4 meses (Tabla 4) [7].
- Plasmaféresis. En los casos en los que se realice debe ser precoz (primeras 72 horas). Existe poca evidencia de que su uso aumente la supervivencia total y renal de los pacientes, a pesar de que está muy extendido. La indicación principal es la hemorragia alveolar, aunque también se sugiere en debut con lesiones renal agudas graves. La reposición se suele realizar con albúmina, aunque en los casos en los que se evidencie depleción de factores de la coagulación o haya hemorragia pulmonar se puede sustituir una parte por plasma fresco congelado. Hasta la fecha, sólo existe un ensayo clínico randomizado con 17 pacientes que evalúe el papel de la plasmaféresis en esta entidad. Todos los pacientes recibieron prednisona y ciclofosfamida, y la mitad se aleatorizaron a recibir plasmaféresis, demostrándose en ellos una desaparición más rápida de los AMBG, mejor función renal y menor necesidad de diálisis frente a los controles. Sin embargo, en dicho estudio, los pacientes control tenían más semilunas en la biopsia inicial lo que supone un sesgo importante [28]. Ante el eventual riesgo de infecciones se pueden administrar inmunoglobulinas intravenosas, sobre todo si los niveles plasmáticos de éstas están por debajo de los límites normales [29].
En cuanto a la duración del tratamiento, la mayoría de los autores abogan por mantenerlo durante 3-6 meses, con monitorización de los AMBG. En caso de no negativización de estos, se puede ampliar hasta 9 meses o asociar azatioprina. Las recaídas y las recidivas son poco frecuentes por lo que en general no se recomienda la terapia de mantenimiento; si se producen se debe realizar nuevamente el tratamiento de inducción a la remisión [29]. Los factores pronósticos en cuanto a supervivencia renal incluyen la creatinina en el momento de la presentación, la necesidad de diálisis y el porcentaje y tipo de semilunas en la biopsia [29] [30]. Para la indicación del trasplante renal se debe mantener un título negativo de anticuerpos durante al menos 6 meses. Es fundamental que el paciente suspenda el hábito tabáquico y no permanezca en contacto con hidrocarburos, ya que ambos han demostrado ser factores de riesgo para el desarrollo de esta patología.
Tipo 2.
El tratamiento de este tipo de GNRP depende de la patología subyacente, aunque la proliferación extracapilar es indicación de uso de corticoides e inmunosupresores tal y como se describe en el tipo anterior. El uso de estos debe ser individualizado según la patología asociada.
Tipo 3.
El tratamiento incluye una fase de inducción a la remisión de 3-6 meses seguido de una fase larga de mantenimiento (18-24 meses). Además, se han definido alternativas terapéuticas para las recaídas o las resistencias al tratamiento.
- Inducción a la remisión
CORTICOIDES. Su recomendación es universal. Actualmente, tras la publicación de los estudios PEXIVAS y ADVOCATE la tendencia es a reducir la dosificación de corticoides, siempre individualizando en función del riesgo / beneficio (Tabla 4) [1] [29] [30] [31] [32]. El estudio PEXIVAS aleatorizó a 704 pacientes con vasculitis ANCA severa a recibir plasmaféresis y dosis estándar o reducidas de corticoides, en un diseño factorial [31]. En cuanto a los corticoides, los resultados demostraron que el uso de una pauta reducida de los mismos fue no-inferior a la pauta estándar en el desarrollo de enfermedad renal crónica terminal, muerte y recaídas con un mejor perfil de toxicidad [31].
El recientemente publicado estudio ADVOCATE es una de las grandes novedades en el tratamiento de las vasculitis ANCA-positivo. En él, 331 pacientes son aleatorizados a recibir en fase de inducción avacopan (un agente inhibidor del receptor C5a de la cascada del complemento) o prednisona (en pauta descendente). Avacopan demostró ser no inferior respecto al uso de prednisona a las 26 semanas, siendo además superior a las 52 semanas en términos de remisión. El perfil de seguridad de avacopan fue superior al de los corticoides, que demostraron mayor número de efectos adversos [32]. Las recientes guías KDIGO 2024 lo incluyen como alternativa a los corticoides en pacientes con toxicidad previa [29].
CICLOFOSFAMIDA. Su uso en la terapia de inducción junto con los corticoides presenta igualmente un amplio consenso [29] [30]. La vía de administración puede ser oral o intravenosa (Tabla 3) y precisa ajuste de dosis según el recuento leucocitario y la función renal [29]. La administración intravenosa ha demostrado una menor dosis acumulada que la oral y por tanto una menor tasas de efectos adversos (leucopenia). En el estudio CYCLOPS, los pacientes que recibían la formulación oral tuvieron menos episodios de leucopenia y mayor número de recaídas, aunque sin impacto en la mortalidad global frente a aquellos con formulación intravenosa [33]. La profilaxis en el caso de usar este agente ha sido ya descrita en el tratamiento de la GNRP tipo 1. Dado que la tasa de remisión alcanza aproximadamente el 75% en el tercer mes y el 90% en el sexto mes, la terapia de inducción se debe mantener entre 3 y 6 meses, en función de la actividad. Los criterios de recidiva se exponen en la (Tabla 5). Aunque el tratamiento se refiere a todas las patologías incluidas en las GNRP tipo 3, la PGE presenta algunas características que pueden suponer diferente indicación de tratamiento. Dado que muchos pacientes presentan una buena respuesta a corticoides, se puede obviar el uso de inmunosupresores en aquellos casos en los que no existan factores pronósticos de gravedad (afectación cardiaca, neurológica, gastrointestinal o renal).
RITUXIMAB. Dada la patogenia de las vasculitis, la introducción de agentes monoclonales frente a linfocitos B presenta en el momento actual un gran interés en la fase de inducción a la remisión. Dos estudios randomizados (RITUXVAS y RAVE) avalan su uso frente a ciclofosfamida en esta fase [34] [35]. En el primero de ellos (RITUXVAS) se aleatorizó 3:1 a 44 pacientes a recibir rituximab y 2 dosis de ciclofosfamida intravenosa frente a 6-10 ciclos de ciclofosfamida intravenosa, realizando terapia de mantenimiento únicamente en este segundo grupo y con azatioprina (del tercer al sexto mes). A los 12 meses, no hubo diferencias estadísticamente significativas en cuanto a remisión (76% vs 82%), número de muertes (6 vs 2), número de efectos adversos (14 vs 4), y mejoría del filtrado glomerular (19 ml/min/m2 vs 15 ml/min/m2). En el estudio RAVE, se aleatoriza a 197 pacientes a recibir ciclofosfamida oral o rituximab y se evalúan los resultados a los 6 meses de tratamiento. Todos los pacientes habían recibido esteroides en la inducción hasta el quinto mes, en el que eran suspendidos, y ninguno plasmaféresis. Asimismo, el grupo de ciclofosfamida continuó con azatioprina a los 3-6 meses como mantenimiento si permanecían en remisión. No hubo diferencias en cuanto a la remisión entre el grupo rituximab y el de ciclofosfamida (71% vs 62%). Sin embargo, cuando se evaluó a los pacientes que presentaban recaídas, se observó una superioridad estadísticamente significativa del tratamiento con rituximab (67% vs 41%), que se mantenía tras el ajuste para el tipo de vasculitis y el centro hospitalario. No hubo diferencias en la mejoría de la función renal (11 ml/min vs 10 ml/min), ni en el número total de efectos adversos (14 vs 17), aunque sí presentaron más episodios de leucopenia y menos hospitalizaciones los pacientes tratados con ciclofosfamida. En un análisis post-hoc realizado posteriormente, se demostró la no inferioridad del rituximab durante un seguimiento de 18 meses en la inducción a la remisión [36]. En un pequeño estudio retrospectivo, se evaluó la eficacia en la inducción de pacientes con enfermedad renal crónica avanzada (FGe <20 ml/min) y que habiendo recibido o no tratamiento con ciclofosfamida, recibieron corticoides y rituximab. Curiosamente, los resultados demostraron que no había diferencias entre los grupos en cuanto a las tasas de remisión, aunque este estudio presenta limitaciones más que evidentes [37]. Con todos estos datos, las KDIGO 2024 sitúan a Rituximab con el mismo grado de evidencia que la ciclofosfamida y con uso preferente en niños y adolescentes, mujeres fértiles, adultos frágiles, recaídas, vasculitis PR3 y en pacientes que requieran un descenso precoz de corticoides (Tabla 3) [29]. Del mismo modo, las guías europeas EULAR colocan rituximab y ciclofosfamida al mismo nivel de evidencia [38].
PLASMAFÉRESIS. Aunque el beneficio de la plasmaféresis no ha sido bien definido, las guías KDIGO recomiendan indicarla en las siguientes situaciones: hemorragia pulmonar, coexistencia de anticuerpos AMBG y lesión renal aguda con creatinina superior a 3,4 mg/dl. Además, en el estudio MEPEX se evaluó y demostró la no inferioridad de la plasmaféresis frente a metilprednisolona en la inducción a la remisión, aleatorizando a 137 pacientes que recibieron además ciclofosfamida [39]. El reciente estudio PEXIVAS probablemente modifique las guías de actuación clínica. En dicho estudio, cuyo diseño ya se ha comentado previamente, los pacientes que recibieron terapia con plasmaféresis no presentaron una mejoría ni en la mortalidad, ni en la progresión a enfermedad renal terminal ni en las recaídas. Estos resultados además se confirmaron en el análisis de los diferentes subgrupos estudiados (presencia de hemorragia alveolar, subtipo de vasculitis [PR3/MPO], tipo de inducción [ciclofosfamida vs rituximab] [31].
OTROS AGENTES. Se han realizado estudios clínicos con metotrexate y micofenolato de mofetil (MMF). El primero de ellos se evaluó en el estudio NORAM frente a ciclofosfamida en pacientes con afectación sistémica débil demostrando similares tasas de remisión, pero con un aumento en las recaídas en los pacientes tratados con metrotrexate [40]. Además, el metotrexate presenta una limitación fundamental en el espectro de pacientes que evalúa un nefrólogo, y es su contraindicación si existe afectación renal. Por su parte, el MMF como agente inductor a la remisión ha demostrado en los estudios realizados tasas de recaída superiores a las estándar, por lo que no se recomienda.
La novedad en el tratamiento de inducción es, como comentábamos previamente, el uso de avacopan. Tras los positivos datos del estudio preliminar CLEAR publicado en 2017 por Jayne et al., muy recientemente se han dado a conocer los resultados del estudio ADVOCATE [32][41]. En dicho estudio, el inhibidor de C5a avacopan, ha demostrado su efectividad en la reducción de las recaídas a las 52 semanas frente a la pauta estándar de corticoides, lo que supone una revolución en la minimización del uso de estos. De hecho, los efectos tóxicos de dicho estudio son superiores en el grupo de pacientes que recibieron prednisona lo que aumenta el interés por el desarrollo de este tipo de terapias ahorradores de corticoides [31].
- Mantenimiento.
El objetivo de esta etapa es lograr mantener la remisión y evitar las recaídas, minimizando los efectos de la dosis acumulada de ciclofosfamida (Tabla 3).
AZATIOPRINA. A pesar de que la ciclofosfamida es eficaz en el mantenimiento, sus importantes efectos adversos (tumores sólidos, síndromes mieloproliferativos, infecciones) han obligado a buscar alternativas. El estudio CYCAZAREM, promovido por Jayne y cols. aleatoriza a 144 pacientes en remisión tras ser tratados con ciclofosfamida y prednisona, a recibir azatioprina o ciclofosfamida oral [42]. Tras un seguimiento de 18 meses, no encuentran diferencias entre ambos tratamientos en cuanto al número de recaídas (11 vs 10), el aumento del filtrado glomerular (17 ml/min/m2 vs 23 ml/min/m2) y los efectos adversos (8 vs 7). Por lo tanto, la azatioprina es el fármaco de elección en el mantenimiento de la remisión. En los últimos años, los estudios han ido encaminados a demostrar la conveniencia de alargar el periodo de mantenimiento. En un estudio (REMAIN study) promovido por Karras at al. se aleatorizó a 117 pacientes a suspender la azatioprina a los 24 meses del inicio del tratamiento frente a mantenerla 48 meses. Al final del seguimiento, se redujo el número de recaídas en los pacientes con mantenimiento prolongado, pero a expensas de mayores efectos adversos y sin diferencias en la supervivencia global [43]. Sin embargo, estas conclusiones son al menos dudosas, y, tal y como se demuestra en un estudio publicado por Sanders et al. en el que se incluyó a 131 pacientes con vasculitis PR3, la tasa de remisión fue comparable en aquellos pacientes que recibieron azatioprina 1 año frente a 4 [44].
METOTREXATO. Como alternativa a la azatioprina se puede utilizar metotrexato en la fase de mantenimiento, tal y como demuestran los resultados del estudio WEGENT [45]. En él, 126 pacientes se aleatorizaron a recibir metotrexato o azatioprina tras haber alcanzado la remisión con ciclofosfamida; tras 12 meses no se encontraron diferencias en el número de recaídas (21 vs 23), ni en el de reacciones adversas (35 vs 25). La utilidad de este fármaco queda restringida por la función renal, no siendo aconsejable su uso con filtrados inferiores a 50 ml/min/m2.
RITUXIMAB. En los últimos años el rituximab ha conseguido resultados muy prometedores también en la fase de mantenimiento. Así, por ejemplo, el estudio MAINRITSAN aleatorizó a 115 pacientes a recibir en fase de mantenimiento, rituximab (500 mg a los 0 y 14 días, a las 6, 12 y 18 meses) o azatioprina y analizó los resultados a 28 y 60 meses [46] [47]. Los resultados en ambos momentos demostraron la superioridad de rituximab en cuanto a supervivencia y remisión de la vasculitis frente a azatioprina. Adicionalmente, el estudio MAINRITSAN 2 demostró que los resultados se mantenían con independencia del régimen de rituximab utilizado [48]. La extensión de dichos estudios se publicó bajo el acrónimo MAINRITSAN 3 demostrándose (con baja evidencia por baja potencia estadística) que rituximab en mantenimiento y a largo plazo se confirmaba como un agente incluso superior a azatioprina [49]. Por su parte, el estudio multicéntrico e internacional RITAZAREM mostró que en los pacientes que habían recibido inducción con rituximab, el uso de este mismo agente en el mantenimiento y a dosis fijas (1000 mg cada 4 meses) era más efectivo que azatioprina [50].
OTROS AGENTES. Se han ensayado diferentes fármacos como leflunomida (que ha demostrado eficacia al reducir las recaídas, pero con un elevado número de reacciones adversas) [51]; anti-TNFα (cuya combinación con ciclofosfamida como inductor se asoció a una elevada incidencia de tumores) [52]; o MMF (inferior frente a azatioprina en la prevención de recaídas según los datos del estudio IMPROVE) [53]. Probablemente, éste último pueda ser una alternativa para pacientes en los que esté contraindicado el uso de metrotrexato y azatioprina. De hecho, en las últimas guías europeas EULAR/ERA-EDTA se sitúan en el mismo escalón y con la misma evidencia en el tratamiento en fase de mantenimiento, la azatioprina, MMF, rituximab y metotrexate [38]. El trimetoprim-sulfametoxazol, además de cómo agente profiláctico de infecciones, se ha ensayado como terapia de mantenimiento sin datos concluyentes por el momento [7].
- Recidiva y resistencia.
Entre el 25 y el 50% de los pacientes sufren una recaída a lo largo de su vida. Los factores de riesgo de recaída son niveles de ANCA positivos en el momento de la remisión y elevación de los mismos durante el mantenimiento; los anticuerpos PR3 frente a los MPO; la afectación respiratoria, ótica, faríngea o nasal; y la discontinuación precoz en el uso de corticoides y las dosis bajas de ciclofosfamida [54]. La definición de recaída incluye criterios clínicos y analíticos como se muestra en la (Tabla 5). No se debe modificar el tratamiento exclusivamente en función de los títulos de anticuerpos (ANCA) [55]. El tratamiento de las recaídas y de los casos resistentes no está bien determinado, aunque las recomendaciones actuales abogan el uso de rituximab [29].
En cuanto a los pacientes en programa crónico de diálisis, dado que presentan un número inferior de recaídas, pero, sin embargo, una incidencia aumentada de infecciones que condicionan una elevada mortalidad se ha sugerido el finalizar o al menos disminuir la inmunosupresión en aquellos que no presenten datos de vasculitis activa [56]. Para la inclusión en el programa de trasplante renal se exige remisión de 6 meses independientemente del título de ANCA.
Tipo 4. En este tipo de GNRP no existe prácticamente evidencia sobre su historia natural ni ensayos clínicos que aboguen por un manejo específico. El tratamiento debe incluir corticoides, ciclofosfamida y plasmaféresis como terapia de inducción a las dosis habituales en las tipo 1 o 3, y se puede asociar azatioprina como mantenimiento, aunque algunos autores han señalado una evolución más benigna en cuanto al pronóstico renal que en la tipo 1 [1] [7].