Glomerulonefritis primarias
INTRODUCCIÓN
El término glomerulonefritis (GN) se emplea para designar las enfermedades que afectan a la estructura y función del glomérulo, aunque posteriormente se pueden ver implicadas las demás estructuras de la nefrona. Hablamos de GN primarias cuando la afectación renal no es la consecuencia de una enfermedad más general y las manifestaciones clínicas están restringidas al riñón, y de GN secundarias cuando la afectación está en el seno de una enfermedad sistémica: lupus, diabetes, etc. El presente capítulo se centra en el primer grupo.
ETIOLOGÍA
Las GN primarias son enfermedades de base inmunológica aunque en la mayoría se desconoce el antígeno o causa última de la enfermedad. La inmunidad desempeña un papel fundamental en el desencadenamiento de muchos tipos de lesiones glomerulares. En algunos casos la activación inespecífica de la inflamación puede causar o agravar el daño glomerular. También microorganismos infecciosos pueden desencadenar respuestas inmunes anómalas o frente a antígenos microbianos. Por último, los factores genéticos pueden ser causa de nefropatía glomerular pero también pueden influir sobre la predisposición al desarrollo de lesión glomerular, sobre la progresión de la misma o sobre la respuesta al tratamiento [1]
EPIDEMIOLOGÍA
Según datos del registro español de GN de la S.E.N. con datos de biopsia renales del periodo 1994-2020 y más de 26.000 biopsias, la nefropatía IgA (14.1%), la glomerulosclerosis segmentaria y focal (8.3%) y la GN membranosa (11%) constituyen casi la mitad de la patología renal biopsiada El síndrome nefrótico (SN) es la forma clínica más frecuentemente biopsiada (33.5%) pero con una tendencia a disminuir en todas la edades. Las patologías más frecuentes por edades son: nefropatía IgA entre los jóvenes (15-45 a); nefropatía IgA y nefropatía membranosa en adultos (45-65a ) y vasculitis y nefropatía membranosa en mayores de 65 años [2]. La biopsia renal hoy en día es la técnica “gold estándar” para el diagnóstico de las enfermedades glomerulares.
CLASIFICACIÓN
Las GN primarias son entidades muy heterogéneas tanto por su etiología como por su evolución. No es posible hacer una clasificación única que permita diferenciar las GN en grupos homogéneos. De acuerdo a datos evolutivos, histológicos y clínicos podemos clasificar al GN en diversos tipos [1].
Según su evolución:
- Aguda: comienza en un momento conocido y habitualmente con síntomas claros. Suele cursar con hematuria, a veces proteinuria, edemas, hipertensión (HTA) e insuficiencia renal (IR).
- Subaguda: suele tener un comienzo menos claro y con un deterioro de función renal progresivo en semanas o meses, sin tendencia a la mejoría.
- Crónica: independiente del comienzo tiende a la cronicidad en años. Suele cursar con hematuria, proteinuria, HTA e IR con evolución variable a lo largo de los años pero con tendencia a progresar una vez que se instaura el daño.
Según la histología:
Es la clasificación más utilizada y aporta información pronóstica de utilidad [3]. Las diferentes enfermedades glomerulares pueden compartir las manifestaciones clínicas lo que dificulta el gnóstico y por tanto la biopsia desempeña un papel decisivo. En este sentido, además, la biopsia renal es una técnica que permite al clínico no solo disponer de un diagnóstico para aplicar un tratamiento específico, sino disponer de información sobre el tipo de lesión aguda o crónica que por la historia clínica no se podrían sospechar. La presencia de lesiones más crónicas potencialmente no reversibles puede evitar tratar lesiones con pocas probabilidades de responder
a) GN proliferativas
Presentan aumento del número de algunas células glomerulares.
- GN mesangial: GN mesangial IgA, GN mesangial IgM.
- GN membrana-proliferativa.
- GN postestreptocócica o endocapilar difusa.
- GN extracapilar.
b) GN no proliferativas
Sin aumento del número de células de los glomérulos.
- Nefropatía por cambios mínimos.
- Glomerulosclerosis segmentaria y focal.
- GN membranosa o extramembranosa.
Según la clínica:
La expresión clínica de las GN es el resultado de la combinación de hematuria (macro o microscópica), proteinuria (con o sin SN) e IR en los casos en los que se produce bien aguda (síndrome nefrítico) o crónica. La HTA se asocia en 1/3 de los casos. De acuerdo a los datos clínicos podemos clasificar las GN según 6 patrones [1]:
Alteraciones urinarias asintomáticas: analíticamente se manifiesta como hematuria microscópica o proteinuria nunca >3g/día
Hematuria macroscópica: brotes de hematuria macroscópica sin coágulos que típicamente pueden coincidir con infecciones intercurrentes. Entre los brotes el sujeto suele estar asintomático salvo que puede persistir hematuria microscópica y/o proteinuria leve-moderada.
Síndrome nefrótico: la presencia de proteinuria >3.5 g/día en adultos y >40 mg/h/m2 en niños, con hipoalbuminemia <3.5 g/dL, edemas e hipercolesterolemia
Síndrome nefrítico: cuadro clínico agudo caracterizado por oliguria, hematuria, proteinuria generalmente <3g/día, edema e HTA.
GN rápidamente progresiva: se caracteriza por la aparición gradual de proteinuria, hematuria e IR que progresa en un periodo de días o semanas.
GN crónica: se caracteriza por anomalías urinarias persistentes (hematuria microscópica), deterioro lento y progresivo de la función renal y proteinuria moderada o intensa. El tiempo de progresión hacia la IR terminal es variable.
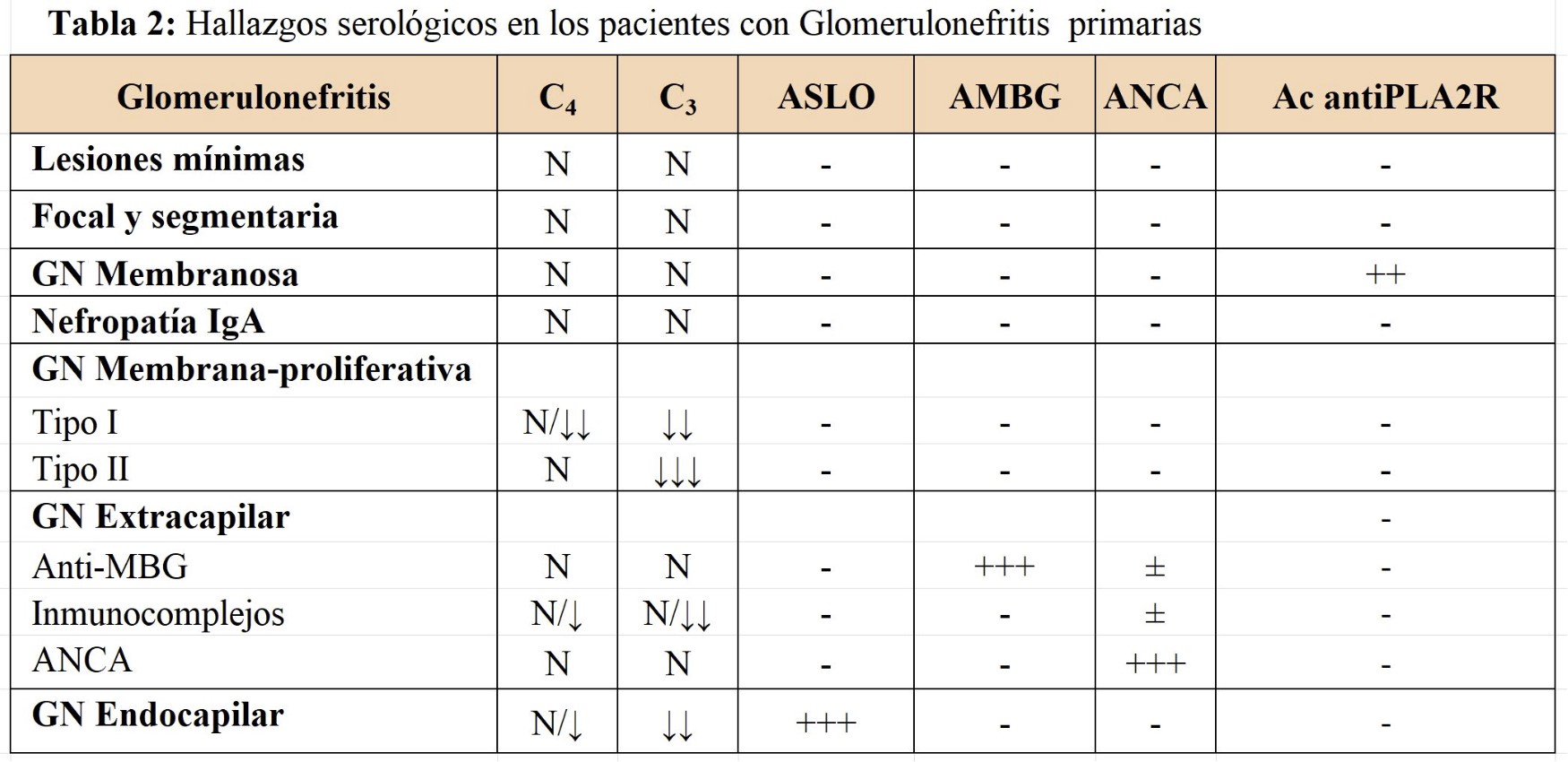
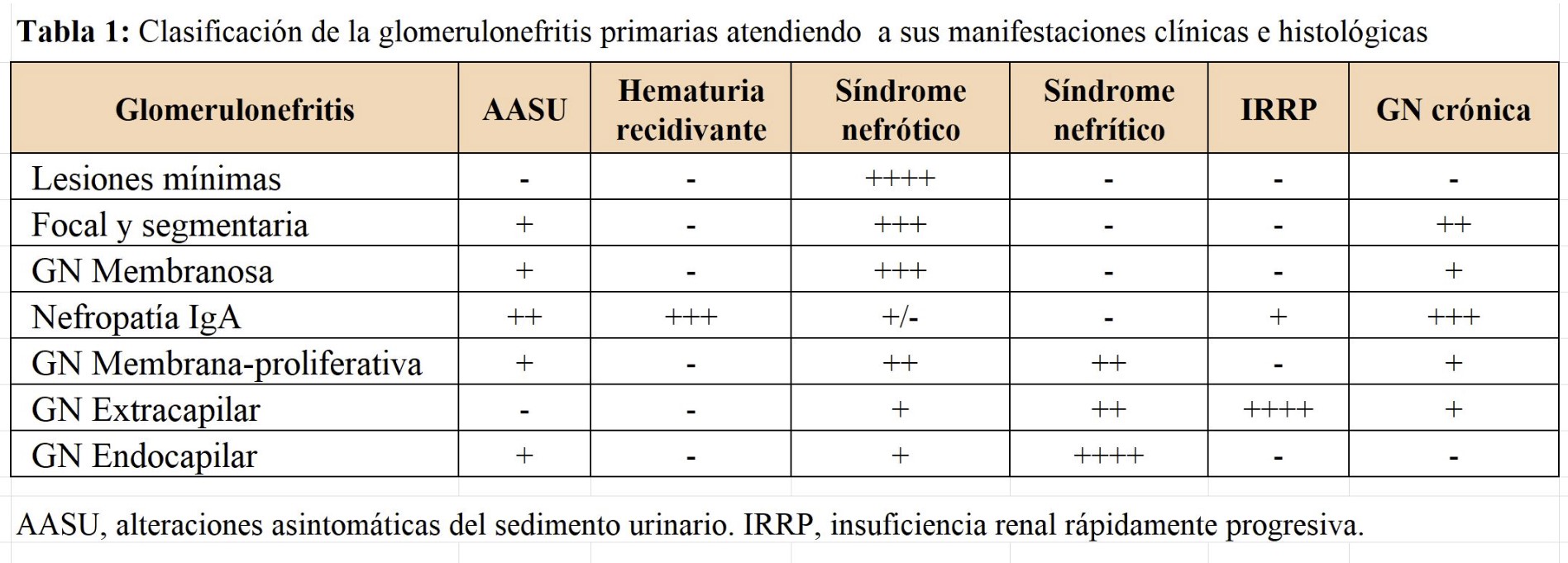
En la (Tabla 1) se muestra la clasificación de las GN primarias correlacionando las manifestaciones clínicas e histológicas. En la (Tabla 2) se muestran los hallazgos serológicos de las GN primarias.
TRATAMIENTO GENERAL DE LAS GLOMERULONEFRITIS PRIMARIAS
Conjuntamente con el tratamiento específico de cada GN, que se expondrá posteriormente, se debe instaurar una terapia sintomática dependiendo de las manifestaciones clínicas [4][5].
Medidas generales:
Dieta: restricción de la sal en caso de que exista HTA. En caso de SN, será precisa una restricción moderada de sal (2-4g/día) y de líquidos y sólo en casos de edema importante restricciones más severas En cuanto a la ingesta proteica, en el SN se recomienda una dieta de 1 g/Kg/día. Si existe IR reducir la ingesta a 60 g/día. Además es muy recomendable el control de la obesidad, abandono del tabaco y ejercicio físico regular. Sólo en situación de SN con anasarca es recomendable el reposo en cama, sin que sea prolongado por el riesgo trombótico.
Tratamiento de la HTA: Importante como factor de riesgo cardiovascular y de progresión de la enfermedad. Los fármacos de elección, especialmente si existe proteinuria son los inhibidores de la ECA (IECA) y los antagonistas de los receptores de la angiotensina II (ARA II). El objetivo de control debe ser 130/80 mmHg en los pacientes renales y incluso <125/75 en caso de de proteinuria >1g/24h (aunque son escasos los datos publicados que apoyan esta recomendación). Si es preciso, añadir otros fármacos antihipertensivos para alcanzar el objetivo.
Control de la proteinuria: Inhibición del sistema renina angiotensina (SRA): El objetivo del uso de IECA/ARA II es la reducción de la proteinuria además del control de la presión arterial. Iniciar tratamiento con dosis bajas e ir incrementado progresivamente hasta la dosis máxima tolerada o haber alcanzado el objetivo ideal <0.5g/día. Grandes estudios han demostrado el efecto renoprotector de ambos, que va estrechamente asociado al descenso de proteinuria. Su efecto antiproteinúrico es variable según el tipo de entidad. En la nefropatía IgA tienen un efecto demostrado, siendo menor en la glomerulosclerosis segmentaria y focal, GN membranosa o GN membrano-proliferativa aunque la indicación es clara especialmente en caso de proteinuria no nefrótica donde son el tratamiento de primera elección. En otras entidades no tienen ningún efecto favorable salvo para el control de la HTA como en la GN extracapilares y postestreptocócicas. En las lesiones mínimas no están indicadas salvo si existe HTA dada la respuesta tan rápida a esteroides. Por el contrario en fases iniciales del SN con anasarca pueden estar incluso contraindicados especialmente si existe hipovolemia o hipotensión. Por último, diversos estudios han demostrado el efecto sinérgico en la proteinuria del doble bloqueo del SRA, y en los últimos años también se ha visto el efecto antiproteinúrico de los antialdosterónicos. En estos casos y sobre todo si existe IR debe vigilarse cuidadosamente el potasio .
Tratamiento de la hiperlipemia. Es un trastorno frecuente en las GN que cursan con SN resultado de un incremento en la síntesis hepática de lípidos y apolipoproteinas. En caso de hiperlipemia transitoria (lesiones mínimas) el tratamiento dietético sería la única medida justificable o no ser que sea muy marcada. En el resto el tratamiento medico de elección son los inhibidores de la reductasa de HMGCoA (estatinas) ya que la hipercolesterolemia es la anomalía más frecuente.
Tratamiento del edema: en el SN con edema importante se pueden utilizar diuréticos de asa de inicio a dosis más altas (furosemida o torasemida). En caso de anasarca o albúmina <2g/dl puede ser útil la infusión combinada de albúmina y furosemida intravenosa. Si la respuesta de los diuréticos de asa es escasa se pueden asociar tiazidas o antialdosterónicos.
Complicaciones tromboembólicas: La trombosis de la vena renal y en general los fenómenos tromboembólicos constituyen una de las complicaciones más graves del SN. Oscilan entre un 5-60% de los pacientes. El riesgo aumenta con hipoalbuminemias severas (<2g/dl). A veces es preciso profilaxis antitrombótica (heparinas de bajo peso molecular) especialmente en pacientes que precisen reposo. Ante cualquier episodio trombótico se debe iniciar tratamiento anticoagulante.
Tratamiento del síndrome nefrítico: los puntos básicos son el control del edema vigilando la posible aparición de insuficiencia cardíaca y la HTA precisando antihipertensivos. La indicación del tratamiento antibiótico dependerá de cada caso. Una vez establecido la IR aguda el tratamiento consiste en una serie de medidas médicas y de soporte dialítico si se precisa hasta la resolución del cuadro.
Tratamiento de la insuficiencia renal crónica: En las GN que cursan con IR crónica el tratamiento derivado de la pérdida de función renal persigue la prevención de la aparición de síntomas derivados de la IR, minimizar complicaciones y preservar la función renal. Todos estos aspectos son tratados con más profundidad en otros capítulos.
Tratamiento de la hematuria macroscópica: Los brotes de hematuria macroscópica se autolimitan y no precisan tratamiento. No hay tampoco un tratamiento específico en caso de hematuria aislada.
Tratamiento con inhibidores de cotrasportador SGLT2: A raíz del estudio DAPA-CKD [6][7], se ha evidenciado una reducción del riesgo de progresión de la enfermedad renal y de proteinuria. Por tanto estos fármacos, con un buen perfil de seguridad, podrían incluirse en el manejo general de estos pacientes.
NEFROPATÍA POR CAMBIOS MINIMOS
https://www.nefrologiaaldia.org/es-articulo-nefropatia-por-cambios-minimos-429
Es una GN típicamente pediátrica cuya mayor frecuencia se encuentra entre los 2-6 años y con mayor incidencia en el sexo masculino. Clínicamente conlleva la presencia de SN puro. Es responsable del 80% del SN del niño y entre un 15-20% del adulto [8]
Etiología
Podría estar en relación a una posible disfunción de los linfocitos T pero algunos autores proponen que podría tratarse de una alteración transitoria en la expresión de proteínas constitutivas de la membrana. Se ha asociado con diversas enfermedades bien infecciosas, alérgicas, neoplásicas (síndrome de Hodgkin) o farmacológicas (AINEs)
Histología
Histológicamente y como su nombre indica no aparecen anomalías en la microscopia óptica siendo los glomérulos y los capilares normales, no objetivándose ningún depósito en la IF. El microscopio electrónico puede revelar cambios caracterizados por un ensanchamiento y borrado de los pies de los podocitos. La biopsia no esta indicada en los casos infantiles en donde la córtico-sensibilidad es casi constante, pero si en adultos donde las posibilidades diagnosticas se amplían.
Clínica
Se caracteriza casi exclusivamente por SN, junto con las manifestaciones clínicas que este provoca. Su pronóstico renal es bueno. No es infrecuente el deterioro de función renal reversible y en relación a factores funcionales (hipovolemia severa o tras tratamiento diurético intenso, administración IECA/ARA II, AINES, trombosis bilateral de la vena renal, etc).
Tratamiento [9][10]
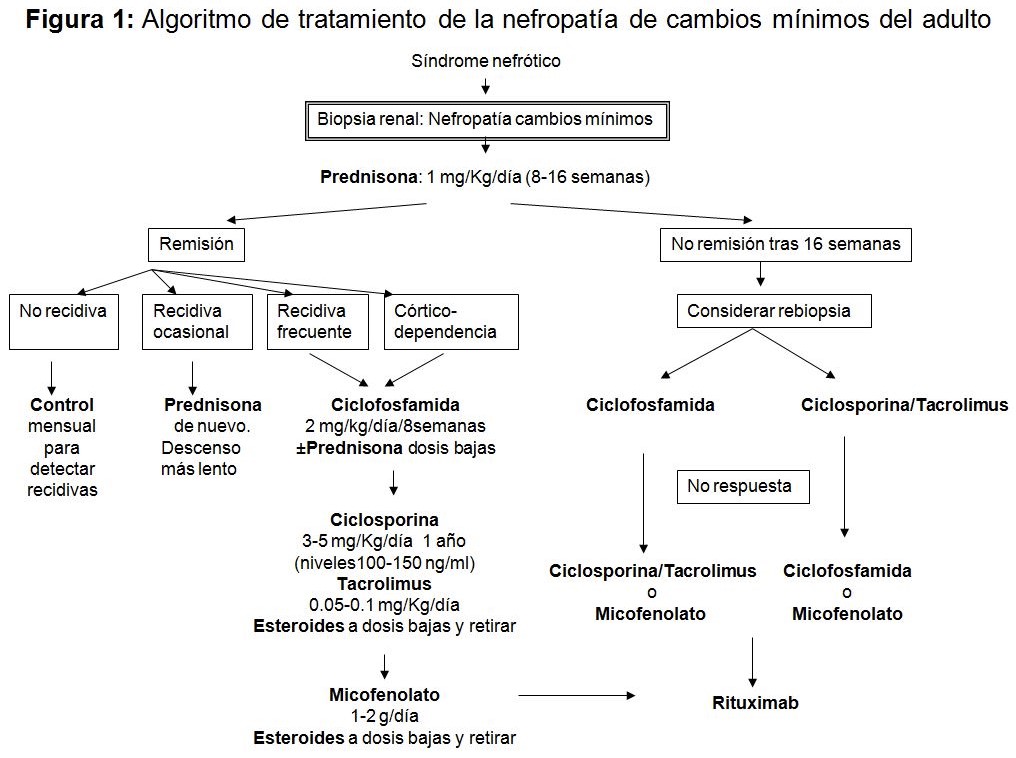
1.Tratamiento de primera elección: Los corticoides siguen siendo el tratamiento de elección. El plan terapéutico general consiste en de prednisona a 1 mg/Kg/día sin exceder de 60-80 mg/día en adulto. Se recomienda administrar los esteroides en dosis única matinal y con un protector gástrico. La respuesta al tratamiento se define como la desaparición de la proteinuria durante al menos 3 días. Los adultos se consideran córtico-resistentes cuando la proteinuria persiste tras 16 semanas de tratamiento o cuando la proteinuria no ha descendido nada tras 8-12 semanas de tratamiento. La remisión del SN se consigue en un 81-90% de los adultos tratados, similar a niños, siendo mayor el tiempo en conseguir la remisión. Un aspecto controvertido es la pauta descendente de prednisona tras la respuesta inicial. La interrupción brusca o una pauta descendente demasiado rápida una vez lograda la remisión completa puede dar lugar a una recidiva. En general, la duración de las dosis altas de prednisona debe ser de 8 a 16 semanas (o 1-2 semanas tras la remisión completa). El paciente debe entonces iniciar un régimen de descenso de prednisona de manera que la duración total del tratamiento sea de unos 4 meses como mínimo. Se definen varios patrones de respuesta a esteroides definidos en la (Tabla 3). En las recidivas se empleará el mismo esquema terapéutico que en el episodio inicial.
2.Tratamiento de segunda línea: En caso de recidivas frecuentes o córtico–resistencia se emplean otras opciones terapéuticas. Se iniciara un tratamiento esteroideo de inducción como en el primer episodio y se añadirá un segundo inmunosupresor durante un periodo variable de 1-2 años en algunos casos atendiendo a respuesta clínica, tolerancia y efectos adversos. Las opciones son:
a. Ciclofosfamida, 2 mg/Kg/día durante 8–12 semanas
b. Micofenolato mofetil 500-1000 mg cada 12 h por vía oral.
c. Tacrolimus 0.05-0.1 mg/kg/día por vía oral repartido en dos dosis. Los pacientes respondedores tiene riesgo de recidiva con recaída en el periodo de retirada. Niveles objetivos: 5-10 ng/dl
d. Ciclosporina 3-5 mg/Kg/día por vía oral repartidos en dos dosis. Existe riesgo también de recaída en la retirada. Niveles objetivos: 100-175 ng/dl
e. Rituximab, 375 mg/m2 1-4 dosis.
En la (Figura 1) se muestra un algoritmo de tratamiento.
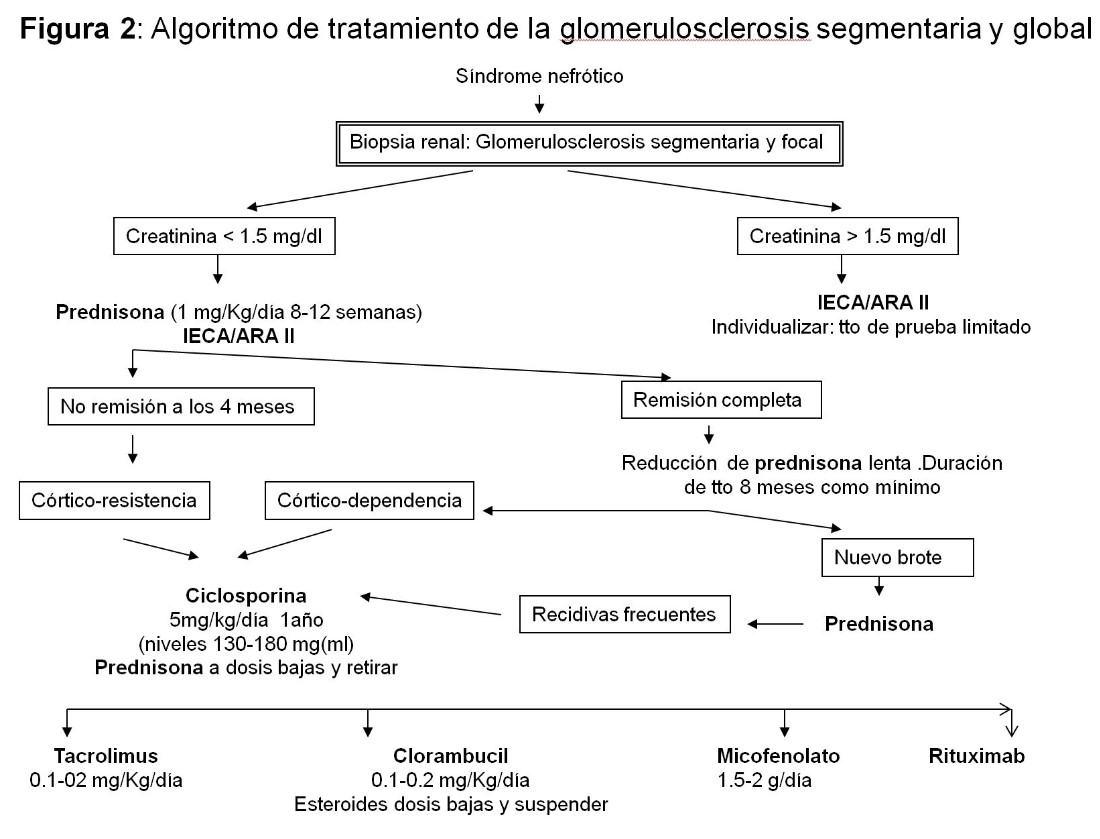
GLOMERULOSCLEROSIS SEGMENTARIA Y FOCAL PRIMARIA
https://www.nefrologiaaldia.org/es-articulo-glomerulosclerosis-focal-segmentaria-510
Es otra entidad responsable del SN en el niño (<10%) pero aumenta su frecuencia a medida que aumenta la edad llegando a un 20% en adolescentes y adultos jóvenes. No hay diferencias en el sexo. Ya que su diagnóstico es histológico su epidemiología depende de la población estudiada así como de los criterios de biopsia [11].
Etiología
Es fundamental el diferenciar las formas primarias (en las que no existe ningún agente o condición asociada), de las formas secundarias (por hiperfiltración, por tóxicos, por cicatrización por procesos glomerulares previos, etc) ya que el planteamiento terapéutico es diferente. En las formas primarias, a las que no referimos, se habla a favor de un posible factor circulante no caracterizado aun basándose en la elevada recurrencia tras el trasplante. Se propuso la forma soluble del receptor de activación del plasminogeno tipo urokinasa (suPAR) como uno de estos factores circulantes, sin embargo estudios recientes indican que los niveles de suPAR no son útiles en el gnóstico diferencial. Existen también raras formas genéticas probablemente relacionadas con mutaciones de proteínas podocitarias. Algunos autores las engloban dentro de las secundarias. .
Histología
La lesión característica en microscopia óptica es la esclerosis del ovillo glomerular que afecta focalmente a algunos glomérulos desde la zona yuxtaglomerular. Las luces capilares de la zona afecta están obliteradas por material acelular con zonas de hialinosis. En la IF muestra habitualmente depósitos de IgM y C3. Por criterios histológicos se distinguen cinco subtipos, existiendo una correlación clínica-histológica:
- Forma clásica: exige la exclusión de los otros subtipos
- Forma perihiliar: lesión esclerosante próxima al hilio
- Forma celular: destaca un aumento de células endoteliales, extracapilares y polimorfonucleares.
- Forma “tip lesion”: lesión próxima al túbulo
- Forma colapsante: colapso generalizado de los glomérulos.
Clínica
La manifestación clínica más frecuente es la proteinuria generalmente con SN, aunque en adultos se puede dar cualquier grado. En adultos, es frecuente la presencia de hematuria e HTA y muchas veces en el gnóstico existe ya IR sobre todo en las formas colapsantes. La evolución la marca el grado de proteinuria, el grado histológico, la presencia de IR y la respuesta al tratamiento. Los casos resistentes evolucionan a IR terminal en un 50% a los 10 años y en algunos de forma rápida en 2-3 años. El riesgo de recidiva tras el trasplante (habitualmente durante los primeros días) es alrededor de un 25%.
Tratamiento [12]
Se emplean los mismos tratamientos que en las lesiones mínimas pero los índices de respuesta son claramente inferiores.
1.Tratamiento de primera línea: Deben tratarse todos los pacientes con SN y función renal normal siendo de elección la prednisona durante un tiempo prolongado (6-8 meses) Iniciar a la dosis de 1 mg/Kg/día y mantener esta dosis durante 8-12 semanas si la tolerancia al tratamiento es adecuada. Si no se produce una remisión significativa de la proteinuria durante este tiempo, prolongar el tratamiento hasta 16 semanas. Si hay respuesta seguir con 0,5 mg/Kg durante 6-8 semanas, bajando hasta suspensión en otras 8 semanas. La poca evidencia existente no recomienda iniciar el tratamiento asociando prednisona a otro inmunosupresor. Los enfermos que presentan SN e IR pre-tratamiento deben ser analizados individualmente. Las pautas a días alternos son menos exitosas. Los IECA/ARA II deben ser utilizados especialmente en los pacientes con proteinuria no nefrótica en los que son la primera opción antes de los inmunosupresores.
2.Tratamiento de segunda línea: Los anticalcineurinicos son fármacos de elección en caso de córtico-resistencia o córtico-dependencia en el SN en el adulto y por tanto se recomienda su utilización en estas circunstancias. También son de elección de primera línea en caso de contraindicación para los esteroides Las dosis son similares a la empleadas en las lesiones mínimas y deben ser mantenidos mínimo 1-2 años con retirada lenta para evitar recidivas. En caso corticorresistencia y no tolerancia a anticalcineurínicos podría emplearse el micofenotalo con prednisona. Por último, el rituximab ha descrito buenos resultados en caso de cortico dependencia, con poca recomendación en cortico resistencia.
En la (Figura 2) se muestra un algoritmo de tratamiento.
GLOMERULONEFRITIS MEMBRANOSA
https://www.nefrologiaaldia.org/es-articulo-nefropatia-membranosa-167
Es la causa más frecuente de SN en el adulto (25-30%). Es una glomerulopatía poco frecuente en niños y su pico de incidencia se encuentra en la 4ª-5ª década de la vida con más frecuencia en varones [13][14]
Etiología
Habitualmente es idiopática. En los últimos años ha sido posible identificar algunos antígenos podocitarios relacionados con la patogenía de la nefropatía membranosa primaria. El antígeno principal lo constituye el receptor de la fosfolipasa A 2 del tipo M (PLA2R). Entre el 70-80% de los pacientes con nefropatía membranosa primaria poseen anticuerpos tipo IgG4 circulantes contra PLA2R. También se ha identificado otro antigeno podocitario denominado trombospondina tipo-1 que podría ser responsable del 10% de los casos anti-PLA2R negativo. Esta enfermedad puede tener relación también con otras enfermedades (neoplasias, enfermedades sistémicas, infecciones, drogas, etc.). Las enfermedades neoplásicas son responsables del 5-10% de los casos de GN membranosa secundaria, particularmente el carcinoma de pulmón, mama, colon.
Histología
Se observa engrosamiento de la pared de los capilares glomerulares global y difuso, a veces no evidente en las fases iniciales y que se inicia por la formación de agregados inmunes subepiteliales. Por plata-metenamina se visualizan paredes capilares con imagen especular En fases avanzadas puede observarse esclerosis glomerular de grado variable. La celularidad del glomérulo suele ser normal. Por IF se objetivan depósitos granulares difusos de IgG y C3.
Clínica
La forma típica es el SN de comienzo insidioso en el 80% de casos. A veces se presenta como sólo proteinuria. La hematuria microscópica es frecuente así como la HTA. Un 30% de casos se asocia con IR que puede evolucionar a IR terminal. Debe valorarse siempre la presencia de una causa identificable. La trombosis de la vena renal puede observarse con frecuencia. La evolución es variable. La frecuencia de remisión espontánea es variable, en torno a un 25%, siendo más alta en niños. La incidencia de IR terminal es de un 35% a los 10 años. Es difícil predecir la evolución pero los factores pronósticos son: proteinuria importante persistente (>8g/día), la presencia de IR y el grado de fibrosis túbulo-intersticial al diagnóstico. La edad avanzada, el sexo masculino y la presencia de HTA también pueden influir. la determinación seriada de los títulos de anti-PLA2R, en los pacientes positivos para estos anticuerpos, se ha configurado como el marcador más fiable para predecir la evolución y la respuesta al tratamiento. Se ha propuesto que en los pacientes positivos los cambios en el título de anti-PLA2R deberían de guiar el comienzo del tratamiento inmunosupresor o los cambios en el tipo de tratamiento cuando no se aprecia un descenso claro.
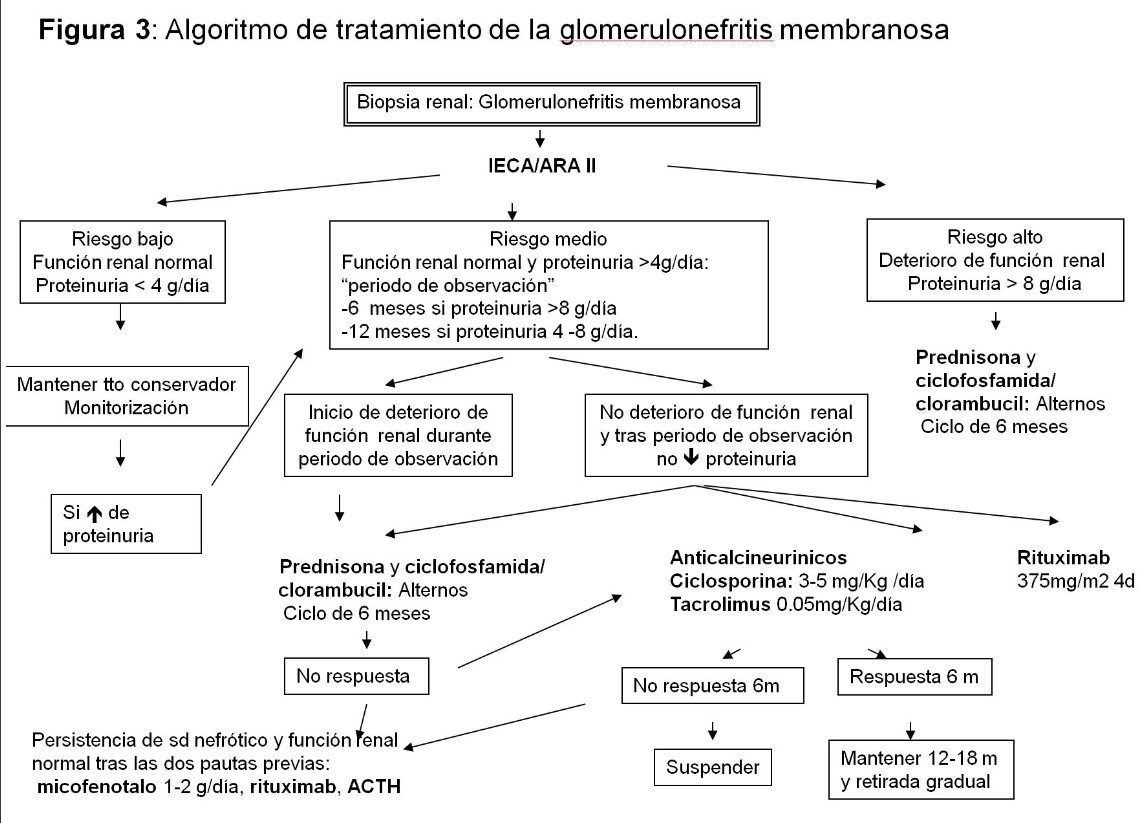
Tratamiento [15]
1.Tratamiento conservador: En pacientes sin SN o con grados de proteinuria moderados (< 4 g/día) el tratamiento con IECA/ARA-II junto a un manejo general conservador es la opción más recomendable, aplicable también a los casos con IR establecida y signos de cronicidad en la biopsia renal. En los casos con SN y función renal normal, se recomienda un período de observación, que incluirá tratamiento general conservador con IECA/ARA-II. En general se recomienda un período de observación de 6 meses si la proteinuria es > 8 g/día, sobre todo en varones de edad > 50 años. Si la proteinuria oscila entre 4-8 g/día, el período de observación puede extenderse a 12 meses, sobre todo en mujeres de edad < 50 años.
2.Tratamiento específico: Una vez transcurrido dicho período sin que aparezca remisión espontánea completa o parcial (proteinuria < 0,3 ó < 3,5 g/día, respectivamente), o una clara tendencia a la disminución de la proteinuria nefrótica, se recomienda tratamiento con una de las dos opciones que han demostrado eficacia en estudios randomizados:
a. Ciclofosfamida/clorambucil combinado con esteroides (Pauta de Ponticelli) administrados de forma cíclica durante 6 meses. Los meses impares ciclosfosfamida oral (2 mg/kg/día) y los meses impares esteroides en forma de bolus los 3 primeros días y a partir del 4 día oral (0.5 mg/Kg/día). El tratamiento aislado con esteroides no induce efectos favorables por lo que no se recomienda esta opción.
b. Anticalcineurínicos durante 12-18 meses (ciclosporina [3-5 mg/Kg/día] o tacrolimus [0.05 mg/Kg/día], y con ajuste de dosis según niveles en rangos terapéuticos bajos). El problema de estos fármacos es la nefrotoxicidad y el riesgo de recidiva tras retirada, que se debe hacer gradual.
c. Rituximab: en los últimos años, diversos estudios han demostrado la eficacia. Se puede emplear de primara línea o en la recidivas. Las dosis empleadas han oscilado entre 375 mg/m2/semana en 4 semanas consecutivas o 1 ó 2 dosis de 1 g. Se utilizan también pautas secuenciales tras anticalnineurinicos
d. Micofenolato mofetil: Puede jugar un papel beneficioso en casos resistentes a otras terapias o que presentan ya grados diversos, no avanzados, de IR pero se requieren más estudios con este tipo de pacientes.
e. ACTH: otra opción a valorar
En la (Figura 3) se muestra un algoritmo de tratamiento.
GLOMERULONEFRITIS MEMBRANOPROLIFERATIVA
https://www.nefrologiaaldia.org/es-articulo-glomerulonefritis-membranoproliferativa-209
La GNMP primaria, también llamada mesangiocapilar, incluye un grupo de nefropatías glomerulares poco frecuentes que comparten una lesión histológica característica, y que pueden originarse por muy diversos mecanismos patogénicos. Afecta principalmente a niños entre 8-16 años siendo una proporción similar según el sexo. Su frecuencia tiende a ser decreciente. Las formas secundarias son más frecuentes en adultos [16] y el diagnóstico es siempre histológico.
Etiología
La GNMP tipo I es una enfermedad mediada por inmunocomplejos aunque la identidad del antígeno se desconoce habitualmente. Cuando se identifica puede estar en relación a infecciones, neoplasias, enfermedades autoinmunes, disproteinemias, etc. La GNMP tipo II se caracteriza por depósitos densos que no contienen inmunoglobulinas pero se cree que activan el complemento. La hipocomplementemia es una característica común (80% en tipo I y 100 % tipo II), activándose por vía clásica en la tipo I y por vía alterna en la tipo II.
Histología
El patrón glomerular característico consiste en hipercelularidad mesangial, engrosamiento de la membrana basal glomerular e interposición mesangial en la pared capilar, adoptando con frecuencia el glomérulo un aspecto lobulado. Podemos diferenciar tres tipos:
- Tipo I: depósitos subendoteliales
- Tipo II: depósitos densos intramembranosos
- Tipo III: es similar a la tipo I pero con la existencia de depósito subepiteliales.
En los últimos años se ha propuesto una nueva clasificación de acuerdo a los hallazgos de la inmunofluorescencia Esta nueva clasificación añade importantes implicaciones etiológicas y terapéuticas. Se proponen dos tipos de GNMP
- GNMP mediada por inmunocomplejos: se caracteriza por el depósito de inmunocomplejos y elementos del complemento
- GNMP mediada por complemento o glomerulopatia C3: se caracteriza por el depósito de componentes del complemento en ausencia de inmunocomplejos.
Clínica
Cursan como SN en la mitad de los pacientes. Un 25% presentan proteinuria y hematuria asintomática y otro 25% puede cursar como síndrome nefrítico. La HTA puede aparecer. La IR puede estar presente en la mitad de los casos al gnóstico. La GNMP tipo I tiende a cursar más con nefritis mientras que la tipo II con SN. Se describe una supervivencia renal <65% a los 10 años y el pronóstico es peor en la tipo II.
Tratamiento
El tratamiento de las GNMP estará condicionado por la enfermedad subyacente. Es fundamental realizar una evaluación profunda para establecer el diagnóstico etiológico que guiará la actitud terapéutica.
-En niños con SN y con IR se recomienda la prednisona, aunque el régimen y duración del tratamiento no está bien definido. El único estudio con evidencia utilizó 40 mg/m2 a días alternos durante 130 meses de media. En niños con proteinuria <3 g/día, la prednisona puede ser útil sin evidencia con antiagregantes.
-En caso de síndrome nefrótico y deterioro progresivo de función renal se recomienda ciclofosfamida, micofenolato con esteroides o anticalcineurinicos. La terapia con rituximab ha sido eficaz en casos publicados con GNMP idiopática. Por último, los estudios publicados con eculizumab presentan resultados dispares
-Control agresivo de HTA y proteinuria con uso de IECA/ARA II.
GLOMERULONEFRITIS POSTESTREPTOCÓCICA
https://www.nefrologiaaldia.org/es-articulo-glomerulonefritis-e-infecciones-370
La GNPE afecta principalmente a población infantil con incidencia máxima entre 2-6 años. Puede ser epidémica o esporádica [17]
Etiología
Es el prototipo de GN asociada a infección aunque el mecanismo patogénico último no se conoce. Podría ser un efecto tóxico directo de una proteína estreptocócica o una lesión mediada por inmunocomplejos. En la actualidad, el espectro de agentes infecciosos incluye más bacterias aparte de los estreptococos.
Histología
Hipercelularidad global difusa de células mesangiales y endoteliales por proliferación endocapilar con neutrófilos. Por IF se detecta un patrón de tinción granular gruesa para C3 en la pared capilar.
Clínica
La presentación clásica es el síndrome nefrítico agudo que puede aparecer en gravedad variable desde casos asintomáticos hasta IR aguda oligoanuria. El periodo de latencia desde la infección oscila entre 7-21 días para las faringitis y 14-21 días para las cutáneas. En las fases iniciales suele existir hipocomplementemia transitoria y con frecuencia se detecta títulos de ASLO elevados. El pronóstico en general es bueno pero un pequeño porcentaje desarrolla HTA, proteinuria e IR terminal.
Tratamiento [18]
El tratamiento consiste en medidas de apoyo así como el tratamiento de la HTA y la sobrecarga de volumen con diuréticos y los antibióticos pertinentes. No existen pruebas que soporten el uso de agentes inmunosupresores a no ser que se objetive proliferación extracapilar.
NEFROPATÍA IgA
https://www.nefrologiaaldia.org/es-articulo-nefropatia-iga-162
Sigue siendo la forma más frecuente de GN. Puede presentarse a cualquier edad pero fundamentalmente en la 2º-3º década de la vida y su incidencia es más elevada en varones [19]
Etiología: es el resultado de la activación de complemento tras el depósito de inmunocomplejos circulantes, sobre todo IgA. La patogenia se debe probablemente a un defecto inmunitario de las mucosas produciendo una exposición a varios antígenos ambientales
Histología: Suele manifestarse como una GN proliferativa focal o difusa donde se observa expansión segmentaria e hipercelularidad de la matriz mesangial. En otros casos puede haber formas agresivas con semilunas. El diagnóstico definitivo sólo puede hacerse con IF donde se objetiva la tinción mesangial para IgA. Los niveles séricos de IgA se encuentran elevados en un 50% y los niveles de complemento suelen ser normales. En 2009 se desarrolló la clasificación Oxford, un consenso sobre la clasificación anatomopatológica de la nefropatía IgA. Se definieron 4 variables como predictoras de evolución renal:
- Hipercelularidad Mesangial (M)
- Hipercelularidad Endocapilar (E)
- Glomeruloesclerosis Segmentaria (S)
- Fibrosis interticial o atrofia Tubular (T).
Más recientemente se añadía la presencia de semilunas (MEST-C) como factor pronóstico [20]
Clínica: En el 40-50% de los casos se encuentra en el momento del diagnóstico hematuria macroscópica asintomática. Los episodios suelen sobrevenir con estrecha relación temporal con una infección de vías respiratorias superiores. Puede desarrollarse IR aguda durante los brotes de hematuria. Otro 30-40% de los pacientes presentan hematuria microscópica acompañada de HTA. El resto de casos se presentan en forma de SN o GN crónica con hematuria, proteinuria e IR crónica. En un 5% de los casos uno de los signos de presentación es la HTA maligna. Hoy no se considera a esta entidad tan benigna desarrollando IR terminal a los 20 años un 20-30%. Los factores de mal pronóstico son la HTA, la presencia de IR, la proteinuria persistente así como el sexo varón y la edad elevada al diagnóstico.
Tratamiento [21]
1.Tratamiento conservador: los pacientes deben recibir IECA/ARA II en especial si son hipertensos o si presentan proteinuria elevada.
2.Tratamiento con inmunosupresores:
a.Esteroides: se recomienda una pauta de mínimo 6 m de prednisona oral a 1 mg/kg de peso con pauta descendente posterior en caso de proteinuria mantenida > 1 g/día a pesar de bloqueo SRA o si hematuria persistente con deterioro de función renal.
b.Micofenolato mofetil: son escasos los datos y las guías KDIGO no lo recomiendan sin embargo algunos autores aconsejan su uso en monoterapia o con dosis bajas de esteroides
c.Budesonida oral: recientemente varios estudios han publicado mejoría de proteinuria y enlentecimiento en la pérdida de función renal.
d.Rituximab, azatioprina, anticalcineurinicos: poco beneficio
e.Prednisona y/o ciclofosfamida en pauta similar a las GN extracapilares cuando existe extensa formación de semilunas.
GLOMERULONEFRITIS EXTRACAPILAR
https://www.nefrologiaaldia.org/es-articulo-glomerulonefritis-rapidamente-progresivas-187
La GNEC representa el fenómeno estructural más agresivo de las lesiones causadas por inflamación glomerular. Las GNEC por inmunocomplejos es la causa más frecuente en niños, mientras que en adultos es la GNEC pauciinmunitaria [22]
Etiología: Se distinguen 3 tipos:
- Tipo I o mediada por anticuerpos antimembrana basal glomerular (AMBG) dirigidos contra el colágeno tipo IV (20%). Su incidencia tiene dos picos, en la 2ª- 3ª década y más frecuente en varones y a menudo con hemorragia pulmonar (síndrome de Goodpasture), y el la 6ª-7ª década en mujeres y limitada al riñón.
- Tipo II o medida por inmunocomplejos (40%): presenta pruebas clínicas y analíticas propias de las GN primarias
- Tipo III o pauciinmune o GN necrotizante idiopática (40%): constituye el tipo más frecuente en adultos, sobre todo de edad avanzada.
Histología [23]
Las semilunas es la expresión morfológica de la proliferación de células parietales. Las semilunas empiezan siendo epiteliales y acaban siendo fibrosas. En la tipo I suelen estar en el mismo estadio evolutivo a diferencia del la tipo III. En la tipo II el aspecto mediante microscopia óptica depende de la GN subyacente que se reconoce mejor en los glomérulos intactos. En la tipo III es frecuente que aparezcan lesiones de vasculitis El patrón de IF permite diferenciar los tres tipos:
-Tipo I: tinción lineal de la membrana basal IgG.
-Tipo II: con depósitos granulares pero el patrón y tipo de Ig depende de la GN por inmunocomplejos subyacente que haya inducido la formación de semilunas.
-Tipo III: ausencia o escasez de tinción glomerular para Ig.
Clínica: Forma de presentación subaguda aunque depende del subtipo. La GNEC tipo I se caracteriza por instauración rápida de una GN aguda con oliguria o anuria. Rara vez se presenta de forma más insidiosa. Si el tratamiento no se instaura de forma rápida el riesgo de progresión a IR terminal es elevado, ya que incluso con tratamiento agresivo el riesgo de progresión es de un 40%. El hallazgo de laboratorio más característico es la detección de AMBG en el 90%.
Aunque la tipo III suele presentarse como un deterioro rápidamente progresivo de la función renal con hematuria, proteinuria e HTA, en algunos pacientes el curso clínico es más indolente y con menos alteraciones urinarias. Es frecuente observar fiebre, artralgias, y fatiga. Cerca del 80-90% de pacientes presentan anticuerpos anticitoplasma de neutrófilo (ANCA) anti-MPO o anti-PR3. Cuando la enfermedad se asocia a vasculitis sistémica los pacientes pueden presentar trastornos pulmonares, cutáneos o multisistémicos simultáneos. Los tres síndromes clínicos principales asociados con ANCA son: poliangeitis microscópica, la granulomatosis de Wegener y el síndrome de Churg-Strauss.
El marcador pronóstico principal es el nivel de creatinina al inicio del tratamiento, así como las características histológicas en cuanto a fibrosis intersticial y tipo de semiluna. El retraso en el gnóstico y el inicio del tratamiento aumentan el riesgo de IR terminal
Tratamiento [20]: El tratamiento suele ser similar en las tres empleándose pautas de prednisona y ciclofosfamida. El tratamiento de inducción debe realizarse con pulsos de metil-prednisolona (0.5-1 g/día 3 días consecutivos) y posteriormente prednisona oral (1 mg/Kg/día un mes y pauta descendente en 3-4 meses). Simultáneamente debe emplearse ciclofosfamida oral (2 mg/Kg/día) o intravenosa (ciclos mensuales de 0.5-1 g/m2) en función de los recuentos leucocitarios. El tratamiento se mantiene 6-12 meses hasta la remisión. En la fase de mantenimiento cambiar a azatiporina (2 mg/Kg/día) o micofenolato (1-2 g/día) en sustitución de ciclofosfamida a los 3-6 meses. En los pacientes que no abandonan la diálisis el beneficio de mantener la inmunosupresión más de 12 semanas es escaso y aumenta la toxicidad.
Como tratamiento inicial también se puede empelar rituximab (375 mg/m2/4 dosis) más prednisona con pauta posterior de mantenimiento
En caso insuficiencia renal aguda que requiera diálisis se recomienda plasmaféresis.
En la GNEC tipo I debe instaurarse un tratamiento con plasmaféresis intensiva reponiendo con albúmina salvo hemorragia o tras biopsia hasta que los niveles de anticuerpos se vuelvan indetectables. En la tipo III esta técnica aporta beneficios en los pacientes que requieren diálisis.
Por último, el tratamiento de la GNEC tipo II depende el tipo de GN primaria.