Glomerulonefritis e Infecciones
Palabras clave
Glomerulonefritis aguda posestrptococica, Glomerulonefritis posinfecciosa IgA dominante, Endocarditis, Nefritis del shunt, Abscesos internos, Malaria, Paludismo, Esquisosomiasis, Leishmaniasis, VIH, Virus hepatitis B, virus Hepatitis C, Coronavirus
El conocimiento de las glomerulonefritis ha avanzado mucho en los últimos años. Estos avances han influido tanto en la nomenclatura como en la clasificación de estas entidades, más orientado a la patogenia y el patrón de lesión que a definir entidades [1]. Una gran parte de las glomerulonefritis tienen como base algún tipo de disrregulación inmunológica, ocurren por una patología autoinmune de base y/o desencadenadas por un estímulo infeccioso, como ya describió Hipócrates [2]. Algunos patógenos muestran predisposición a producir determinados tipos de lesiones, pero actualmente se comprenden las glomerulonefritis infecciosas como un continuo de afectación renal que puede aparecer con diversas presentaciones clínicas y patrones histológicos, y que se pueden dar en individuos con algún tipo de predisposición genética e inmunológica.
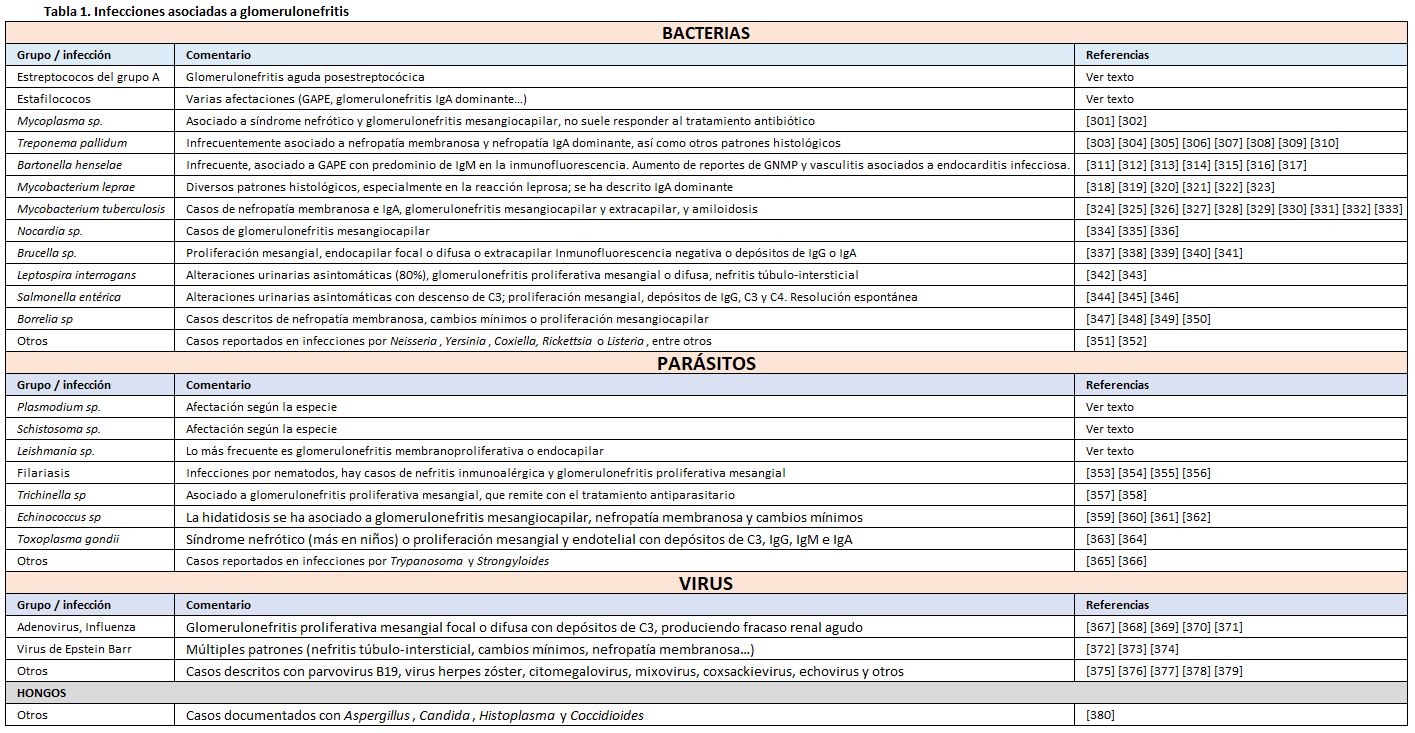
Sin embargo, se mantienen las definiciones de algunas entidades por razones docentes, históricas y de frecuencia. Es el caso de las glomerulonefritis posestreptocócicas, que se diferencian de otras glomerulopatías asociadas a infecciones principalmente por presentar un periodo de latencia [3] [4]. En el segundo grupo se incluyen las glomerulonefritis asociadas a infecciones bacterianas (incluyendo la glomerulonefritis posinfecciosa IgA-dominante, o la endocardítica o la derivada de la infección de un shunt), así como una larga lista de posibles afectaciones renales por otras infecciones por bacterias, hongos, parásitos y virus (Tabla 1) [5].
Mención aparte merecen por su importancia las nefropatías por el virus de inmunodeficiencia humana (VIH) y los virus de las hepatitis B y C [6]. Aunque también se relacionan con infecciones, se omiten explícitamente la nefropatía IgA y las glomerulopatías C3, con entidad propia y revisadas en capítulos específicos de este manual. Asimismo, aunque se comenta brevemente la nefropatía asociada a la COVID-19, se puede consultar el capítulo específico disponible.
1. GLOMERULONEFRITIS AGUDA POSESTREPTOCÓCICA
a. ETIOPATOGENIA
La glomerulonefritis aguda posestreptocócica (GAPE) se produce después de una infección habitualmente cutánea o faríngea por estreptococos ß-hemolíticos del grupo A (Streptococcus pyogenes). También se han reportado casos después de epidemias por S. zooepidemicus por ingesta de leche sin pasteurizar, así como por otros estreptococos [7] [8] [9].
La fisiopatología no está completamente aclarada, y es multifactorial [10]. Se asume el efecto patogénico directo de una proteína estreptocócica que induce daño por inmunocomplejos que se depositan a nivel glomerular. Como consecuencia, se modula la actividad del complemento y se producen factores quimiotácticos y citoquinas que atraen células inflamatorias, predominantemente neutrófilos [11].
En cuanto a las proteínas implicadas, la proteína M de superficie es la más estudiada. Existe evidencia de su papel patogénico, como secuencias compartidas con proteínas humanas o reacción cruzada con proteínas glomerulares como la vimentina [12]. Otras proteínas bacterianas halladas en los depósitos que actúan como antígenos nefritógenos son el receptor de plasmina asociado a nefritis (NAPlr) y la endotoxina pirogénica estreptocócica B o SEBP [13] [14].
Hay factores de agresividad propios del germen. Existen cepas estreptocócicas específicamente nefritógenas [15] [16], algunas de forma genérica y otras específicamente tras infecciones cutáneas o faringoamigdalares. Por otro lado, las diferentes tasas de afectación renal en las epidemias se explican por factores de susceptibilidad del huésped [17]. Se ha asociado a varios tipos de HLA, incluyendo DRW4, DPA*02-022, DPB1*05-01 y DRB1*03011. También es probable que contribuya cierta disregulación en la vía del complemento [18].
b. EPIDEMIOLOGÍA
Las primeras descripciones de GAPE aparecen en el siglo XIX. Durante mucho tiempo fue una de las nefritis agudas predominantes, pero desde finales del siglo pasado se observa una importante disminución del número de casos [10].
Una revisión de 11 estudios poblacionales mostró una incidencia de 24 casos por 100 000 pacientes-año en niños, de 2 casos por 100 000 pacientes-año en adultos en países en vías de desarrollo y de 0.3 casos por 100 000 pacientes-año en adultos en países desarrollados [19]. Estos datos infraestiman la incidencia real, ya que la enfermedad subclínica es 5 veces más frecuente que la clínica, y probablemente existen focos epidémicos no declarados [20] [21] [22].
Además del descenso en la incidencia, también ha variado el patrón de presentación. En países en vías de desarrollo, se mantiene el tipo clásico: más frecuente en varones con razón 2:1, y pico de edad entre los 2 y los 6 años [22]. En este contexto, es más frecuente la presentación en forma de focos o brotes epidémicos de infecciones estreptocócicas, con tasas observadas de afectación renal entre el 12 y el 38% [23] [24]. Por el contrario, en países desarrollados ha aparecido un nuevo patrón de casos esporádicos en pacientes de riesgo: añosos, inmunosuprimidos, oncológicos o alcohólicos [25]. Este grupo puede tener una presentación clínica más agresiva y peor pronóstico [26].
c. MANIFESTACIONES CLÍNICAS
El 80% de los casos son asintomáticos, y aparecen en forma de alteraciones urinarias asintomáticas que únicamente requieren de seguimiento. La presentación clásica sucede en forma síndrome nefrítico: fracaso renal agudo, hipertensión, hematuria y proteinuria [27]. El cuadro aparece con un periodo de latencia tras la infección originaria, que dura unos 10 días (7 a 21) en casos de faringitis y algo más (14 a 21 días, o más) cuando la infección es cutánea. El grado de severidad del fallo renal puede variar desde asintomático a oligoanuria [28]. La hipertensión suele ser leve o moderada, y ocurre en 3 de cada 4 pacientes. En los casos en adultos, puede haber síndrome nefrótico [29], y es más frecuente que la oliguria se complique con insuficiencia cardiaca, y que se requiera terapia renal sustitutiva.
d. DIAGNÓSTICO DIFERENCIAL
En función de la forma de presentación y el predominio de unos u otros síntomas, los principales diagnósticos diferenciales incluyen la insuficiencia renal rápidamente progresiva (especialmente en adultos mayores) y la nefropatía IgA con brotes de hematuria macroscópica. Más raramente, se puede confundir con una glomerulonefritis mesangiocapilar o con glomerulopatías C3, especialmente por la hipocomplementemia [30] [31]. Recientemente, se ha descrito en niños la presencia de anticuerpos antifactor B de la vía alterna de complemento, como forma de diagnóstico de la GAPE vs. la glomerulonefritis C3 [32].
e. HALLAZGOS DE LABORATORIO
En sangre, la insuficiencia renal aguda es menos frecuente en niños y jóvenes, pero se ve hasta en el 60% de los adultos [33]. En orina, el hallazgo de hematuria es casi constante, siendo macroscópica en un tercio de los casos [34]. Con frecuencia se acompaña de hematíes dismórficos y cilindros eritrocitarios. También puede haber leucocituria, y cilindros hialinos y granulosos [25]. La proteinuria también es casi constante, habitualmente subnefrótica e inferior a 0.5 gramos diarios [35]. La proteinuria en rango nefrótico se da hasta en el 20% de los adultos [36].
El estudio inmunológico muestra niveles descendidos de la fracción C3 del complemento en la fase aguda, retornando a la normalidad en unas 4-8 semanas [37] [38] [39]. Este descenso, junto a la normalidad en los niveles de C1q, C2 y C4 indican activación de la vía alterna [40] [41]. Es probable que la activación del complemento se dé también por la vía de la lectina, ya que se han demostrado depósitos de proteína de unión a la manosa [42]. Es posible que en la fase más inicial aparezcan crioglobulinas o factor reumatoide positivos [43]. Raramente hay alteraciones de la coagulación, tanto en forma de trombocitopenia como de factores de la cascada de coagulación, indicando un peor pronóstico [44] [45].
Los cultivos faríngeos o cutáneos muestran crecimiento de estreptococo del grupo A sólo en el 25% de los casos [46]. Por ello, la serología es más eficaz. Los anticuerpos más utilizados son los antiestreptolisina O (ASLO), positivos en > 90% de pacientes con faringitis. La curva de anticuerpos puede ser más eficaz que los títulos absolutos, especialmente en pacientes con infección cutánea. Otros anticuerpos indicativos de infección estreptocócica incluyen los antiestreptoquinasa, antihialuronidasa y antidesoxirribonucleasa B. Varios de ellos se incluyen en el test estreptozima, que puede ser útil en pacientes con infección cutánea y para cepas que no producen estreptolisina [47].
f. HISTOLOGÍA
Dado que el diagnóstico se puede realizar por la clínica, la biopsia renal se reserva para casos dudosos con un curso temporal atípico o si no se identifica una infección previa. Sin embargo, es más frecuente necesitarla en los casos en adultos. A continuación, se describe el patrón de lesión más frecuente, pero según el momento y la gravedad, pueden aparecer patrones (membranoproliferativa, focal y segmentaria, extracapilar) [48].
En el momento agudo, la microscopía óptica muestra una glomerulonefritis proliferativa exudativa: hipercelularidad mesangial y endotelial, e infiltración del glomérulo por neutrófilos [49] [50]. La afectación glomerular es global y difusa. Puede haber semilunas extracapilares, pero suelen ser escasas, excepto en adultos [51] [52] [53] [54]. Con tinciones específicas como el tricrómico de Masson, se pueden ver depósitos subepiteliales en forma de jorobas (-humps- en inglés). Suele haber edema e infiltración leucocitaria intersticial de predominio mononuclear, que puede ser intensa. También se han observado casos de vasculitis, pero los vasos extraglomerulares no suelen mostrar alteraciones [55].
A partir de la segunda semana, los infiltrados neutrofílicos y la hipercelularidad endotelial van desapareciendo, siendo la proliferación mesangial más duradera. La resolución suele ser completa [56], pero en casos más severos pueden quedar cicatrices en forma de esclerosis focal y segmentaria.
La principal diferencia histológica en los casos en adultos es que se suele acompañar de daño por patología concomitante previa, especialmente arteriosclerosis y diabetes.
La inmunofluorescencia demuestra depósitos granulares difusos de inmunocomplejos en capilares y mesangio, muy positivos para C3 y variables para IgG [57]. Si existe positividad para C1q o IgM suele ser poco intensa, y la IgA es excepcional [25]. Se han descrito varios patrones, pero no se ha demostrado que tengan valor pronóstico. El patrón en guirnalda muestra numerosos depósitos granulares a lo largo de la pared capilar, y suele asociarse a proteinuria en rango nefrótico. El patrón en cielo estrellado muestra depósitos granulares más dispersos, con afectación clínica más leve. El patrón mesangial, con predominio de C3, suele observarse en la fase de resolución [50] [58].
En casos dudosos, se pueden plantear la detección de NAPlr por inmunohistoquímica, o una zimografía para valorar la actividad de plasmina [59].
La microscopía electrónica muestra los característicos depósitos densos subepiteliales en forma de joroba (-humps-), recubiertos por procesos podocitarios epiteliales desdibujados que contienen filamentos citoesqueléticos condensados formando una corona alrededor. Las jorobas no son patognomónicas, ya que también se observan en otras glomerulonefritis [60]. También aparecen pequeños depósitos densos y dispersos a nivel subendotelial y mesangial [61]. En la fase de resolución, primero desaparecen las jorobas subepiteliales, y posteriormente los depósitos subendoteliales y mesangiales.
g. TRATAMIENTO
El tratamiento de la GAPE es de soporte. El manejo sintomático incluye el uso de fármacos antihipertensivos, y de diuréticos para tratar la retención hidrosalina. En los pacientes resistentes a tratamiento diurético o con alteraciones electrolíticas o gasométricas persistentes, es posible que se requiera terapia renal sustitutiva.
No existe evidencia actual para el uso de inmunosupresores [62], aunque se han probado en casos de proliferación extracapilar y mala evolución [63] [64]. Tampoco hay evidencia que favorezca el tratamiento antibiótico una vez establecido el cuadro de nefritis, pues el foco infeccioso suele estar resuelto, pero en caso de duda se suele prescribir. En las epidemias de infección estreptocócica, la administración de antibióticos parece prevenir la afectación renal [65] [66].
h. PRONÓSTICO
El fracaso renal y la hipertensión resuelven espontánea y progresivamente en 1 o 2 semanas [28] [67]. La hematuria y la proteinuria pueden durar varios meses. Ocasionalmente, la microhematuria puede persistir durante años.
En niños es de esperar la curación completa [68]. La mortalidad se estima en un 1%, ocurriendo el 97% en países en vías de desarrollo. La presencia de fracaso renal agudo no se asocia con peor pronóstico. A largo plazo, el pronóstico no es completamente benigno, especialmente si ha habido proliferación extracapilar difusa [69]. Los factores predictores de evolución a cronicidad incluyen persistencia de la infección, predisposición genética en la vía del complemento, alteraciones tubulointersticiales y daño renal previo [70]. Lo más frecuente es que a largo plazo sólo se dé hipertensión arterial leve [71] [72].
En los adultos, la mortalidad puede alcanzar el 30% [36]. No existen muchos estudios de seguimiento a largo plazo, pero hasta un tercio de los supervivientes pueden desarrollar enfermedad renal crónica [73].
2. GLOMERULONEFRITIS ASOCIADAS A OTRAS INFECCIONES
Las glomerulonefritis agudas relacionadas con otras infecciones se caracterizan por una mayor heterogeneidad etiológica, clínica e histológica, y porque habitualmente la infección aún está activa.
En cuanto a la etiología, actualmente los casos por infecciones estafilocócicas son igual de frecuentes que por estreptococos, incluso más en ancianos [74]. El más habitual es el Staphylococcus aureus, habitualmente resistente a meticilina [75] [76]. Hay casos descritos por otros estafilococos, así como por gérmenes Gram negativos, que pueden suponer hasta el 10% de los casos [52] [77] [78]. Otros casos incluyen también hongos y parásitos (Tabla 1). La infección puede provenir de focos más variados, incluyendo oral y gingival, respiratorio o urinario [79]. Los pacientes suelen presentar algún tipo de condición predisponente en más de la mitad de los casos: diabetes, alcoholismo, neoplasia u otros [25]. La patogenia está menos dilucidada que en la GAPE, pero la evidencia apunta a mecanismos inmunológicos similares.
La presentación clínica habitual es en forma de síndrome nefrítico, similar a la GAPE del adulto. La hipertensión es frecuente. Suele ir con hematuria y proteinuria. El fracaso renal suele ser severo, con necesidad de diálisis en más de la mitad de los pacientes [74]. Analíticamente, la hipocomplementemia es también frecuente, pero menos constante: un 70% muestran descenso de la fracción C3, y un 15-30% descenso de C4 [74] [78].
La microscopía óptica suele mostrar una glomerulonefritis exudativa con proliferación endocapilar focal o difusa y ocasionalmente semilunas, pero se han descrito diversos patrones histológicos. La afectación túbulointersticial y vascular depende de la presencia de comorbilidades. La inmunofluorescencia es variable según la situación, desde exclusivamente positiva para C3, diferentes depósitos, o incluso negativa o con patrón -full house- en la endocarditis.
Junto a las medidas de soporte, el pilar del tratamiento consiste en erradicar la infección, que suele estar activa en el momento del diagnóstico. No hay evidencia para el uso de inmunosupresores, que además pueden agravar el cuadro infeccioso de base. Hay reportes aislados sobre el posible uso de esteroides y ciclofosfamida en casos de proliferación extracapilar [80].
El pronóstico es muy variable. La coexistencia de diabetes y otras comorbilidades, así como la presencia difusa de semilunas en la biopsia, son indicadores de mal pronóstico [79] [81].
a. GLOMERULONEFRITIS POSINFECCIOSA IgA DOMINANTE
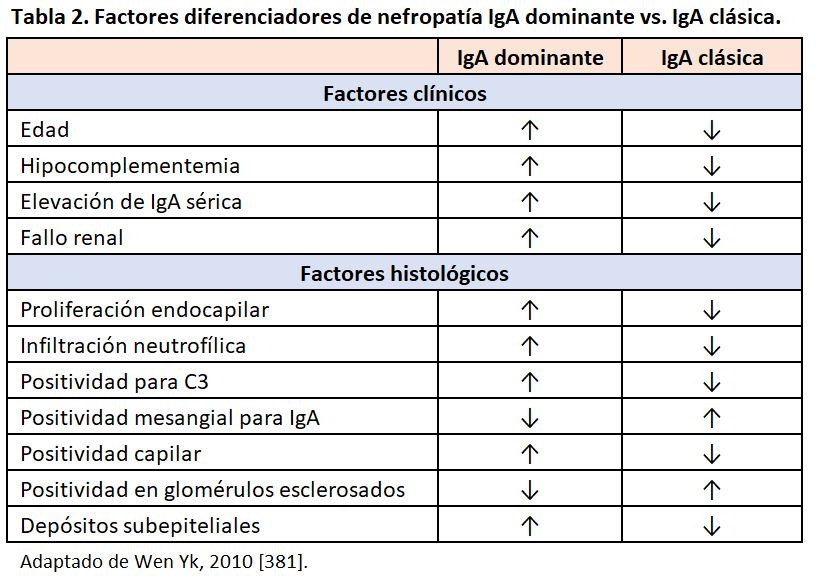
Este tipo de glomerulonefritis es una variante de reciente descripción en la literatura, cuya frecuencia parece estar aumentando en los últimos años [82]. en la que la glomerulonefritis endocapilar se asocia a una inmunofluorescencia con dominancia o codominancia de IgA [83] [84]. Suele coexistir positividad de menor intensidad para IgG, IgM o C3, y también se han descrito patrones histológicos de proliferación mesangial o extracapilar. Por su epidemiología y curso clínico, no parece una exacerbación de una nefropatía IgA de base, de la que es el principal diagnóstico diferencial (Tabla 2). Sin embargo, la patogenia también parece involucrar alteraciones en la galactosidación de la IgA, y se han descrito casos elevación de IgA sérica y de Schönlein-Henoch [85] [86] [87]. El hallazgo de positividad para IgA en glomérulos completamente esclerosados favorece el diagnóstico de la nefropatía IgA de base, mientras que la IgA dominante suele tener un patrón más inflamatorio [88] [89].
Se asocia habitualmente a infecciones activas por Staphylococcus aureus, frecuentemente resistentes a meticilina, pero también existen casos por otros estafilococos y alguno puntual por bacterias Gram negativas de origen urinario y parvovirus B19 [90] [91]. El foco más frecuente es cutáneo, pero hay descripciones de infecciones respiratorias, óseas, urinarias y cardiacas [74]. La mayoría de pacientes son varones (ratio 4:1), añosos, y tienen diabetes o algún otro factor debilitante, especialmente hepatopatía [92]. La presentación clínica es similar a la de la GAPE, con menor frecuencia de hipocomplementemia [93]. Se han descrito casos con crioglobulinemia asociada [94]. El tratamiento indicado es la erradicación de la infección, y si no hay respuesta, ocasionalmente se plantea tratamiento inmunosupresor [95] [96]. Con todo, el pronóstico no siempre es benigno: un 40% llegan a requerir diálisis crónica, aunque la mayoría tenían asociada una nefropatía diabética.
b. ENDOCARDITIS INFECCIOSA
La glomerulonefritis posinfecciosa por endocarditis presenta una incidencia en progresivo descenso (22-78% de las endocarditis). Clásicamente, se asociaba a endocarditis infecciosa subaguda, pero actualmente aparece también en casos agudos, habitualmente por S. aureus [97] y con un número creciente de casos reportados asociados a Bartonella (Tabla 1). Los datos inmunológicos en sangre y en biopsia, así como la detección de antígenos bacterianos en los depósitos orientan a un mecanismo patogénico mediado por inmunocomplejos [98] [99].
La manifestación clínica más habitual es en forma de fracaso renal agudo de severidad variable, acompañado de hematuria, leucocituria y proteinuria. La hipocomplementemia es muy frecuente (60-90%), habitualmente con activación por la vía clásica. Aunque no es específica de afectación renal, el grado de hipocomplementemia se correlaciona con la gravedad del fracaso renal y la respuesta al tratamiento [100]. Ocasionalmente, puede coexistir positividad para crioglobulinas, factor reumatoide, anticuerpos anticitoplasma de neutrófilo (ANCA) y antimembrana basal glomerular [101] [102] [103].
En la microscopía óptica, los patrones más frecuentes en las series recientes son la glomerulonefritis proliferativa focal y segmentaria y la proliferación extracapilar necrotizante con semilunas focales [104] [105]. También puede aparecer un patrón de proliferación endocapilar difusa similar al de la GAPE [106], y no es infrecuente la forma de vasculitis pauciinmune [107] [108] [109]. La inmunofluorescencia muestra depósitos granulares capilares y mesangiales de C3, con o sin IgG o IgM [97] Hay casos reportados con inmunofluorescencia negativa, pero también con patrón completo semejando al lupus [110]. La microscopía electrónica demuestra depósitos electrodensos mesangiales, subendoteliales y subepiteliales junto a la proliferación mesangial y endocapilar [25] [97].
El tratamiento antibiótico es eficaz y consigue la remisión de la afectación renal, aunque a veces persisten durante años la microhematuria y la proteinuria [97]. En casos específicos, se ha planteado el uso de plasmaféresis, esteroides e inmunosupresores, aproximación que se debe plantear con extrema cautela ante el riesgo de exacerbación de la patología infecciosa [111] [112] [113] [114].
c. NEFRITIS DEL SHUNT
Los shunts son dispositivos utilizados para disminuir la presión intracraneal en la hidrocefalia normotensiva. Las glomerulonefritis asociadas a shunts eran más frecuentes cuando se utilizaban dispositivos ventrículo-vasculares, habitualmente en infecciones por Staphylococcus albus [115]. Actualmente, la hidrocefalia se trata con shunts ventrículo-peritoneales, menos proclives a infecciones, pero con casos descritos de glomerulonefritis [116].
Clínicamente, el cuadro debuta semanas o meses tras la implantación del shunt, aunque hay casos descritos años después [117] [118]. Se presenta con fiebre y síntomas sistémicos (anemia, hepatomegalia, esplenomegalia, púrpura cutánea, artralgias y adenopatías). A nivel renal, puede haber hematuria, proteinuria (que llega a ser nefrótica en un tercio de los pacientes), hipertensión y fracaso renal agudo. A nivel analítico, además de la elevación en los reactantes de fase aguda, se puede encontrar hipocomplementemia y positividad para factor reumatoide, crioglobulinas o ANCA [119] [120] [121].
La microscopía óptica puede mostrar un patrón de proliferación mesangial o mesangiocapilar. La inmunofluorescencia muestra depósitos granulares de C3 e IgG, aunque a menudo predomina la IgM. En la microscopía electrónica se pueden ver depósitos electrodensos a nivel mesangial y subendotelial.
El tratamiento antibiótico y la retirada precoz del shunt suelen favorecer la remisión de la patología renal, pero hay casos de progresión a enfermedad renal terminal [122].
d. ABSCESOS INTERNOS
Se ha descrito asociación de glomerulonefritis con abscesos de localización pulmonar, abdominal y retroperitoneal [123]. La presentación clínica y analítica es comparable al de la glomerulonefritis en la endocarditis infecciosa, con hipocomplementemia y crioglobulinemia. Igualmente, la biopsia muestra proliferación difusa endocapilar y extracapilar. La remisión de la afectación renal depende de la adecuada respuesta al tratamiento antibiótico del absceso originario [124] [125].
e. MALARIA
De las cuatro especies de plasmodio que causan malaria en humanos, se ha documentado asociación con enfermedad renal con Plasmodium malariae, P. falciparum y P. vivax [126]. Series recientes apuntan a un descenso en la incidencia [127]. En el caso de P. falciparum lo habitual es la existencia de alteraciones urinarias asintomáticas sin afectación de la función renal [128] [129]. También hay reportes de esclerosis focal y segmentaria colapsante [130]. En el caso de P. malariae se puede ver glomerulonefritis proliferativa mesangial o mesangiocapilar, ocasionalmente con fracaso renal agudo, aunque también se ha descrito nefropatía membranosa [131] [132] [133]. La inmunofluorescencia muestra depósitos de C3, C4, IgG e IgM, mientras que la microscopía electrónica revela estos depósitos electrodensos en una membrana basal con engrosamiento irregular [134].
f. ESQUISTOSOMIASIS
Existen varias especies patogénicas de Schistosoma, con diferentes afectaciones a nivel renal [135]. S. mansoni se asocia con cirrosis hepática, y se ha relacionado con glomerulonefritis proliferativa mesangial, mesangiocapilar y extracapilar, así como con nefropatía membranosa y amiloidosis [136] [137] [138] [139] [140]. El tratamiento de la infección no siempre produce una mejoría de la clínica renal [141] [142]. Hasta un tercio de los pacientes acaban en diálisis [143]. S. hematobium es causa de cistitis hemorrágica y carcinoma escamoso de vejiga. A nivel renal presenta una asociación típica con síndrome nefrótico por nefropatía membranosa, que responde al tratamiento antiparasitario [144].
g. LEISHMANIASIS
Se puede dar afectación renal en la infección por Leishmania sp., aunque las formas clínicamente evidentes son raras [145] [146]. Puede ocasionar fracaso renal agudo por nefritis intersticial aguda [147]. Entre las diferentes glomerulopatías reportadas se incluyen glomerulonefritis mesangial, endocapilar focal, mesangiocapilar difusa o crioglobulinemia, con depósitos variables de C3, IgG e IgM, o más raramente, en forma de amiloidosis [148] [149] [150] [151] [152]. La respuesta al tratamiento suele ser buena, aunque la precocidad del tratamiento es clave [153] [154].
h. OTROS
Existen multitud de casos descritos asociando otras infecciones a diferentes tipos de glomerulopatías. Varios de ellos se encuentran en la (Tabla 1).
3. GLOMERULONEFRITIS POR DETERMINADAS INFECCIONES VIRALES
A) VIRUS DE INMUNODEFICIENCIA HUMANA (VIH)
Epidemiología
La epidemia que supone la infección por el VIH sufrió un cambio radical en la historia natural de la enfermedad con la aparición y posterior mejora del tratamiento antirretroviral de gran actividad (TARGA) [155]. De ser una enfermedad de elevada mortalidad e incontables manifestaciones sistémicas ha pasado a ser una patología crónica, con mayor posibilidad de control virológico, y normalmente asintomática [156]. El TARGA también supuso un cambio en la epidemiología de la enfermedad renal asociada al VIH. El diagnóstico histológico ha caído del 80% en 1997 al 20% en 2004, aunque probablemente se deba hacer una distinción entre países en función de sus recursos sanitarios [157]. Actualmente, la incidencia de enfermedad renal terminal por nefropatía por VIH ha dejado de crecer y se mantiene estancada. Por el contrario, la prevalencia va en aumento en paralelo a la mejoría en la supervivencia global [158]. Se estima una prevalencia del 3.5% en programas de cribado, alcanzando el 7% en series de autopsias [159] [160].
Patogenia
Se pueden encontrar múltiples formas de afección renal aguda y crónica en el paciente con VIH. De ellas, la más característica ha sido la nefropatía asociada al VIH, "NAVIH" o "HIVAN" en inglés [161] [162]. Mención aparte merece la iatrogenia farmacológica por los múltiples medicamentos que reciben [163], siendo el más estudiado el tenofovir, aparentemente con más efecto a corto que a largo plazo.
La NAVIH se describió como un patrón específico de glomeruloesclerosis focal y segmentaria colapsante, que causa síndrome nefrótico severo [164]. Aunque se puede dar en cualquier paciente, se da con mayor frecuencia en la raza negra con un ratio 12:1. Entre las potenciales causas para este disbalance se encuentra una mayor tasa de mutaciones virales atribuidas a factores raciales y una mayor predisposición del huésped con variantes genéticas en los genes MKY9 y APOL1 [165] [166] [167]. APOL-1, que se ha asociado a otras podocitopatías y nefropatías vasculares, multiplica el riesgo de NAVIH por 29 [168] [169]. Los mecanismos exactos son desconocidos, pero el aumento de interferón causado por el VIH aumenta la expresión de APOL1 [170].
Entre los factores de riesgo modificables destacan un recuento bajo de linfocitos T CD4, aunque suele darse en pacientes sin infecciones oportunistas acompañantes [171]. Se sabe que existe un papel de toxicidad directa por el VIH a nivel renal [172], habiéndose detectado ARN viral en varias estirpes celulares renales incluso en pacientes con carga viral negativa [173] [174]. Los productos de varios genes del virus (como nef y vpr) alteran el equilibrio de quinasas reguladoras del ciclo celular (p21, p27 y p57) en varias líneas celulares renales [175] [176] [177] [178]. También aumenta la síntesis de telomerasas como TERT, que estimulan la vía Wnt [179]. El resultado final es una proliferación de podocitos desdiferenciados [180].
Manifestaciones clínicas
Los pacientes con NAVIH suelen tener proteinuria, habitualmente por encima del rango nefrótico y generalmente muy elevada, aunque no siempre con un síndrome nefrótico clínico y bioquímico completo [164] [171] [181] [182] [183] [184]. Se suele acompañar de hipertensión arterial e insuficiencia renal. Pude haber microhematuria y leucocituria [185].
Diagnóstico
En microscopía óptica se observa un patrón de glomeruloesclerosis focal y segmentaria colapsante, con retracción de los capilares glomerulares y oclusión de sus luces, junto con marcada hipertrofia e hiperplasia de los podocitos viscerales que colapsan el glomérulo [186] [187]. La afectación suele ser más difusa y severa que en la glomeruloesclerosis focal y segmentaria primaria. Se acompaña típicamente de fibrosis e inflamación túbulo-intersticial marcada [161] [186]. Los pacientes con TARGA suelen presentar un patrón más parecido a la glomeruloesclerosis focal y segmentaria primaria que a la NAVIH [184]. La inmunofluorescencia es positiva para C3 e IgM. Con microscopía electrónica no se ven depósitos inmunes, sino depósitos fibrilares en forma de estructuras tubulares de 24 nm en el retículo endoplásmico de las células endoteliales y epiteliales [162] [186] [187].
Tratamiento
Es importante el cribado periódico de función renal en los pacientes con VIH [188]. El tratamiento de la NAVIH es el propio tratamiento antirretroviral, siendo una indicación de inicio de tratamiento incluso si el paciente no tuviera otras [189]. El uso de bloqueantes del sistema renina-angiotensina-aldosterona ha demostrado reducir la proteinuria y enlentecer la progresión de la insuficiencia renal [190] [191] [192]. Además de sus efectos hemodinámicos y su potencial antifibrótico sobre las células mesangiales, podrían actuar directamente sobre la proteasa viral. Los estudios con inmunosupresores son escasos, con buena respuesta a corto plazo, pero con potenciales problemas infecciosos asociados [193] [194] [195] [196] [197] [198].
Los pacientes con VIH que requieren terapia renal sustitutiva tienen una supervivencia similar a los pacientes no infectados, tanto en hemodiálisis como en diálisis peritoneal [199]. Cabe remarcar que las medidas universales de precaución son suficientes para el paciente VIH en hemodiálisis, y el aislamiento no está indicado. Varios estudios recientes han demostrado que en pacientes bien controlados con TARGA, el trasplante renal es una opción adecuada [200]. Aunque presenta tasas más altas de rechazo, los resultados a largo plazo son similares al a los del resto de población trasplantada [201] [202] [203]. La opción de donantes VIH positivos parece una alternativa aceptable para aumentar el número de órganos disponibles [204].
Otras formas de afectación renal por VIH
La NAVIH no es la única forma de afectación renal directa por el VIH [205]. La nefropatía por inmunocomplejos en el VIH (NIVIH, o HIVIK en inglés) es la segunda afectación relacionada, actualmente más frecuente que la NAVIH y especialmente en nuestro entorno [206] [207]. El aumento de su incidencia puede estar en relación con la modulación inmune asociada al TARGA. Entre las principales diferencias con la NAVIH, la NIVIH no es específica de raza negra, y su pronóstico es peor con menos probabilidades de recuperación [208].
Esta manifestación mediada por inmunocomplejos puede adoptar varios patrones histológicos. El más frecuente es mesangiocapilar, con presentación clínica similar a la glomerulonefritis membranoproliferativa tipo 1 clásica, con hipocomplementemia y crioglobulinemia, especialmente en pacientes coinfectados por el virus de la hepatitis C [209] [210]. Algunos casos pueden ser lupus-like, con positividad para ANA y anti-DNA [211] [212] [213]. También se han visto patrones de glomerulonefritis proliferativa mesangial, nefropatía membranosa o nefropatía IgA [157]. La nefropatía con inmunocomplejos por IgA anti-VIH puede presentar también varias formas, desde la afectación mesangial clásica a glomeruloesclerosis focal y segmentaria colapsante, con o sin síndrome de Schonlein-Hënoch [214] [215] [216] [217]. La indicación de tratamiento inmunosupresor es controvertida: se recomienda valorar el balance riesgo-beneficio al menos en pacientes con proliferación extracapilar [218].
Otras afectaciones reportadas en pacientes VIH incluyen enfermedad por cambios mínimos, nefropatía membranosa, amiloidosis, microangiopatía trombótica y nefropatías inmunotactoide y fibrilar [162] [219] [220] [221]. Sin embargo, al menos en entornos con alta disponibilidad de TARGA y el aumento concomitante en la supervivencia, cada vez es más frecuente que los pacientes con buen control viral presenten lesiones compatibles con nefropatía diabética y nefroangiosclerosis [222] [223].
B) VIRUS DE LA HEPATITIS B (VHB)
La infección por VHB se traduce en una hepatitis crónica en el 40% de los casos [224]. La vía de transmisión habitual en países endémicos suele ser vertical, por tanto, con una afectación renal infantil más frecuente [225] [226]. En los países desarrollados, donde la transmisión suele ser parenteral o sexual, es más frecuente en adultos [227] [228]. La incidencia de lesión renal es desconocida, pero se considera la enfermedad renal viral más frecuente [229]. La patogenia es claramente inmunomediada, habiéndose demostrado presencia de antígenos y anticuerpos de la hepatitis, así como material genético viral [230] [231]. Pese a ser más frecuente en pacientes en fase replicativa, se han dado casos en pacientes con hepatitis B oculta (con HBsAg negativo, pero DNA positivo en suero o tejidos) [232].
La presentación clínica más habitual es en forma de síndrome nefrótico, con función renal y sedimento normales, aunque a veces hay microhematuria. Normalmente coexiste con afectación hepática al menos leve, aunque no es raro que las transaminasas estén en niveles normales y que no se conozcan episodios de hepatitis aguda previa. La resolución espontánea es más frecuente en niños que en adultos [227] [233].
Histológicamente, la mayoría de los pacientes presentan una nefropatía membranosa, o más raramente, proliferación mesangial [227] [234] [235]. La inmunofluorescencia puede ser positiva para C3, IgG e IgM, o más raramente IgA. También se han descrito casos de proliferación mesangiocapilar con depósitos subendoteliales y subepiteliales, de poliarteritis nodosa y de amiloidosis [236]. Asimismo, algunos pacientes presentan asociación de semilunas con proliferación extracapilar [237] [238].
El tratamiento es controvertido [239]. En caso de pacientes con nefropatía membranosa se prefiere la conducta expectante. El tratamiento antiviral parece tener un efecto positivo a nivel renal [240] [241] [242]. Los resultados del tratamiento antiviral con interferón sobre la afectación renal son conflictivos [243] [244] [245]. La lamivudina es el único antiviral análogo de nucleósido que ha demostrado reducir la proteinuria y frenar la progresión de la nefropatía [224] [240]. No obstante, no es el fármaco de elección por el desarrollo de resistencias, prefiriéndose actualmente otros fármacos cono el tenofovir, el entecavir o la telbivudina, cuyos efectos sobre el pronóstico renal no son tan claros [246] [247] [248]. Algunas series muestran beneficio y seguridad con el uso de corticoides [249] [250]. Sin embargo, puede estimular la replicación viral, por lo que se desaconseja su uso generalizado [240] [251] [252]. La inmunosupresión se reserva con cautela para los casos de proliferación extracapilar o vasculitis secundaria [246] [253].
Además de las medidas universales para evitar la transmisión horizontal, las guías actuales de hemodiálisis recomiendan utilizar salas y monitores independientes y personal específicamente dedicado [254].
C) VIRUS DE LA HEPATITIS C (VHC)
La infección por el VHC deriva en una hepatopatía crónica en el 80% de los casos, lo que ha derivado en una prevalencia global en torno al 2-3% de la población [255]. Se estima que un tercio de los pacientes presentan afectación renal. La patogenia está mediada por inmunocomplejos (que pueden crioprecipitar o no), habiéndose demostrado la presencia de proteínas virales en el glomérulo [256], y una correlación entre la viremia o su desaparición con el tratamiento y el grado de proteinuria.
Las manifestaciones clínicas pueden ir desde alteraciones urinarias asintomáticas hasta insuficiencia renal progresiva típicamente proteinúrica [257] [258]. Aunque a menudo la proteinuria está en rango nefrótico, el síndrome nefrótico completo es infrecuente. La presencia de hipocomplementemia y otros marcadores inmunes es muy habitual. Si se asocia crioglobulinemia, se pueden dar los síntomas propios de esta, como síndrome constitucional, púrpura palpable, artritis o polineuropatía periférica. Suele haber algún grado de hepatopatía, pero a menudo las pruebas de función hepática son normales y no hay conocimiento de un episodio previo de hepatitis aguda.
Histológicamente, se manifiesta habitualmente en forma de glomerulonefritis mesangiocapilar tipo 1 (o a veces tipo 3), con o sin crioglobulinemia asociada [259] [260] [261] [262]. Se han descrito múltiples patrones: afectación extracapilar, proliferación difusa exudativa similar a la GAPE, glomerulonefritis inmunotactoide o fibrilar, microangiopatía trombótica, vasculitis, etc. [263] [264] [265]. Si hay crioglobulinemia, se pueden encontrar -pseudotrombos- hialinos luminales en la microscopía óptica, y depósitos electrodensos con estructura anular tubular en microscopía electrónica. Es raro encontrar el patrón de proliferación mesangiocapilar si no hay crioglobulinemia [259]. En la literatura hay reportes de nefropatía membranosa, sin hipocomplementemia ni crioglobulinas; estos casos parecen más probablemente primarios, lo que se demostraría con tinciones para el receptor de la fosfolipasa A2 [266].
El tratamiento antiviral suele producir una respuesta positiva a nivel renal [267] [268]. La terapia con interferón-¿ podía en algunos casos exacerbar la proteinuria y la hematuria por mecanismos no conocidos [269]. La terapia combinada con ribavirina tiene un mejor efecto combinado a nivel renal [270] [271]. La reciente aparición de nuevos regímenes con fármacos antivirales de acción directa ha supuesto una revolución en el tratamiento de la infección por VHC, consiguiendo tasas de curación muy superiores a pautas previas. Hasta ahora, la experiencia con estos fármacos se reduce a los casos de crioglobulinemia, con resultados satisfactorios a corto plazo [272] [273] [274] [275]. Empieza a haber también evidencia positiva a largo plazo [276] [277] [278]. Aun así, en un 5% de pacientes el tratamiento con antiviral de acción directa no resuelve la crioglobulinemia ni la afectación renal (frente al 20-25% con tratamientos más antiguos) [279] [280] [281]. Los fármacos inmunosupresores y la plasmaféresis se reservan para los casos de crioglobulinemia activa o afectación extracapilar. Se han reportado aproximaciones con buenos resultados con ciclofosfamida, fludarabina y rituximab [282] [283] [284] [285]. Sin embargo, hay que hacer un balance riesgo-beneficio, ya que puede producir una exacerbación de la replicación viral e incluso mutaciones virales con potenciales resistencias al tratamiento antiviral [286].
Los pacientes en hemodiálisis con VHC sin replicación viral no requieren aislamiento de monitor ni sala propia de diálisis, pero se recomienda como mínimo concentración en una parte de la sala o en turno propio, y dedicación exclusiva del personal de enfermería [254]. El trasplante renal es una opción adecuada, pero con la eficacia y tolerabilidad de los regímenes actuales se recomienda intentar la curación previa al trasplante [287] [288].
D) CORONAVIRUS TIPO 2 CAUSANTE DE SÍNDROME RESPIRATORIO AGUDO SEVERO (SARS-CoV-2)
Este virus, causante de la enfermedad por coronavirus de 2019 o COVID-19, ha generado la mayor pandemia vivida en los últimos 100 años. Se trata de una infección con clínica variable desde asintomática hasta letal, caracterizada en los pacientes más afectos por una bronconeumonía intersticial bilateral y una respuesta inflamatoria sistémica desmedida. A nivel renal, se ha asociado fundamentalmente a fracaso renal agudo de origen multifactorial [289].
No obstante, también se han descrito casos de glomerulonefritis secundaria. Se están observando diferentes patrones clínicos e histológicos:
- El más reportado es una glomeruloesclerosis focal y segmentaria colapsante muy similar a la que produce el VIH, y que algunos han denominado por comparación "COVAN" [290] [291] [292]. Aunque en series iniciales se mostró la presencia de partículas virales en biopsias renales, las últimas series publicadas no confirman estos hallazgos [293] [294]. Es más frecuente en pacientes afroamericanos con mutación en APOL1. Se manifiesta como síndrome nefrótico súbito con fracaso renal asociado, y su pronóstico es malo.
- Otro patrón histológico reportado con frecuencia es el de vasculitis. Se han descrito casos asociados a ANCA y antiMBG, así como vasculitis IgA con Schonlein-Henöch [295] [296] [297]. Finalmente, se han publicado algunas series de casos con microangiopatía trombótica en la biopsia renal, aunque el diagnóstico diferencial con la coagulación intravascular diseminada es complejo. La disfunción endotelial asociada a la COVID-19 podría ser el desencadenante de cuadros microangiopáticos en pacientes con factores predisponentes (fármacos o alteraciones de la vía del complemento) [298] [299] [300].
Aún no hay datos sobre pronóstico a largo plazo de estas patologías.