Modalidades de diálisis peritoneal. Prescripción y adecuación
1. INTRODUCCIÓN
La funcionalidad de la membrana peritoneal y su capacidad para conseguir una apropiada eliminación de agua y solutos es imprescindible para la realización de la diálisis peritoneal (DP). Su conocimiento es necesario para proporcionar una dosis de diálisis adecuada, definida como la que necesita una persona para corregir el síndrome urémico y evitar las complicaciones de este a medio-largo plazo. El asegurar una calidad de vida aceptable, con una atención integral de la persona en DP, es uno de los principales aspectos a considerar a la hora de prescribir la mejor diálisis [1].
2. MODALIDADES DE DIÁLISIS PERITONEAL
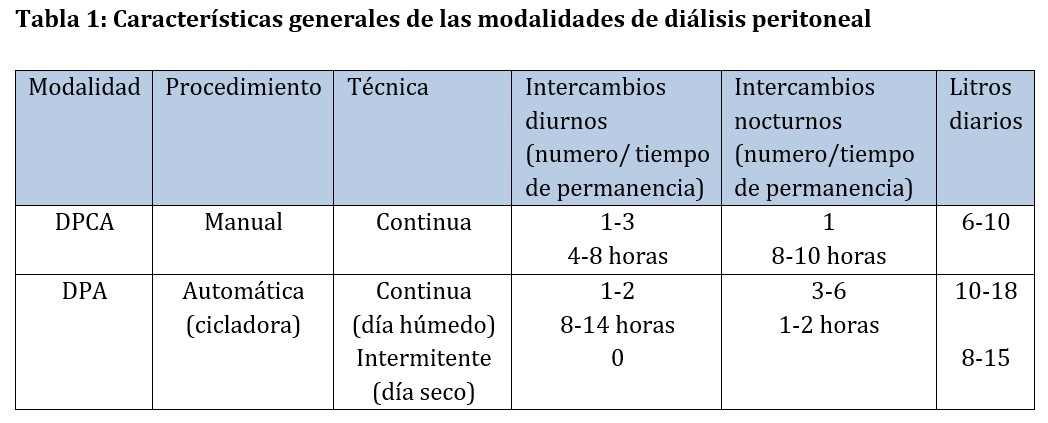
Existen dos modalidades de DP, la DP continua ambulatoria (DPCA), que se realiza de forma manual, y la DP automática (DPA) que requiere la utilización de una cicladora [2]. La DPA puede realizarse de forma continua o de forma intermitente. Las principales características de ambas modalidades se muestran en la (Tabla 1). El volumen de infusión utilizado en cada intercambio puede ser similar en ambas, y está condicionado fundamentalmente por el tamaño de la persona que se dializa. En individuos adultos, suele oscilar entre 2 y 2,5 litros, aunque hay personas que no toleran volúmenes superiores a 1,5 litros. Durante el periodo nocturno, se pueden tolerar un volumen superior ya que presión intraabdominal es menor en decúbito que en ortostatismo.
Las indicaciones para la elección de una u otra modalidad se deben basar en las preferencias de la persona que realiza la DP, su tamaño corporal, el tipo de transporte peritoneal, las características de la pared abdominal y la existencia o no de función renal residual (FRR). Diversos estudios han mostrado que no hay diferencias en la supervivencia de la persona en DP entre una y otra modalidad [3][4]. Por ello, a la hora de seleccionar la modalidad terapéutica más ventajosa es importante tener en cuenta otros aspectos como son las características de la población atendida (edad y comorbilidad asociada), la posibilidad o no de autocuidado y la disponibilidad de un cuidador si fuera necesario. La evaluación de todos estos parámetros va a permite realizar una prescripción individualizada en función de las características, necesidades y deseos de cada persona. En relación con la supervivencia de la técnica, no hay estudios determinantes que muestren una mayor supervivencia en una u otra modalidad. Mientras que algunos observan una mayor supervivencia en DPA [5], especialmente en personas con transporte peritoneal rápido [6], otros no han encontrado diferencias entre ambas [7].
2.1 Diálisis peritoneal continua ambulatoria
La persona tratada con DP lleva en su cavidad peritoneal liquido de diálisis durante las 24 horas del día y lo recambia de forma manual, generalmente 3-4 veces al día. Los parámetros que se modifican en la prescripción de DPCA son el volumen de infusión, el número de intercambios y la composición de los líquidos de diálisis utilizados. La DPCA es una técnica fácil de aprender y permite flexibilidad en su realización no interfiriendo con el descanso nocturno. En nuestro entorno, está generalizado el uso de sistemas de desconexión en Y con doble bolsa. Para su realización, el paciente debe tener insertado un catéter peritoneal que se conecta a un prolongador, y este a un sistema de doble bolsa. Este sistema contiene una bolsa con la solución de diálisis y una bolsa vacía en la que se recoge el efluente peritoneal drenado. La secuencia para realizar la técnica incluye la preparación del material, la conexión del sistema al prolongador, el drenaje del efluente peritoneal, el purgado del sistema, la infusión de una solución fresca de diálisis y la desconexión [8]. Su esquema permite flexibilidad en la realización, pudiéndose adaptar a las necesidades de cada persona y/o sus cuidadores. Sería la modalidad de elección en personas con bajo transporte peritoneal ya que estos se benefician de tiempos de permanencia más prolongados. Sus principales desventajas derivan de la limitación en el número de intercambios prescritos para conseguir una diálisis adecuada y el aumento de la presión intraabdominal durante el periodo diurno. Aunque la manipulación del circuito es más frecuente que en DPA, algunos estudios han observado una incidencia de peritonitis similar en ambas técnicas [9][10]. En relación con los aspectos económicos, su coste es inferior al de la DPA.
2.2 Diálisis peritoneal automatizada
La DPA utiliza una cicladora para realizar varios intercambios, habitualmente durante el periodo nocturno. Los tiempos de permanencia utilizados son más cortos que en la DPCA y el número de intercambios es mayor, por lo que está especialmente indicada en personas con transporte peritoneal rápido, permitiendo así lograr una mayor ultrafiltración (UF) peritoneal. Existen dos tipos de posibilidades a la hora de prescribir: las modalidades intermitentes, en las que el abdomen permanece vacío durante unas horas al día (día seco), y las modalidades continúas, en las que el abdomen está permanentemente en contacto con el líquido de diálisis (día húmedo) [11].
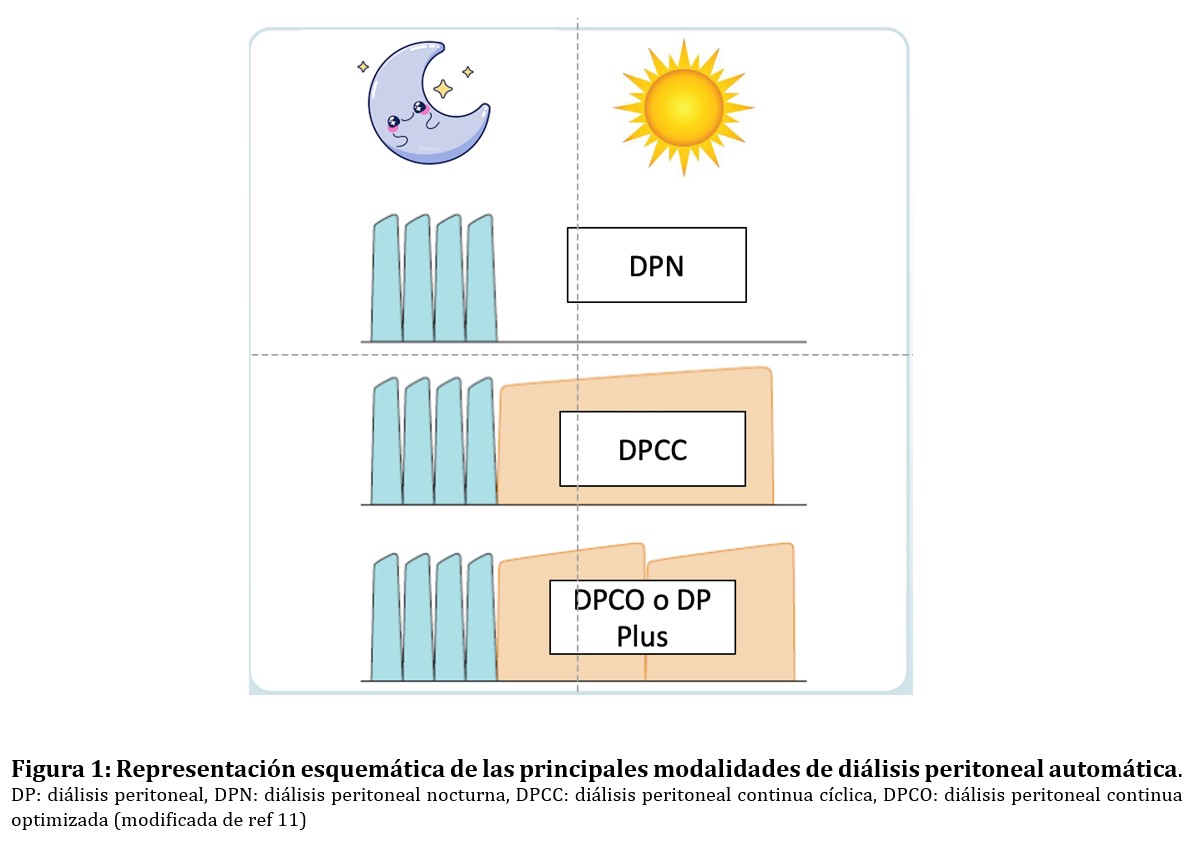
Las modalidades intermitentes incluyen la DP Nocturna (DPN) caracterizada por la realización de varios intercambios nocturnos con día seco y la DP Intermitente (DPI), en la que se realizan múltiples intercambios automatizados y el abdomen permanece vacío entre las sesiones. Esta última modalidad no suele utilizarse de forma habitual, al menos en nuestro medio, pero se puede emplear mientras la persona espera a ser entrenado en la técnica o cuando se requiere utilizar volúmenes pequeños de líquido peritoneal tras la colocación de un catéter peritoneal. La DPN utiliza la cicladora para realizar diversos intercambios durante la sesión nocturna, permaneciendo el abdomen en vacío durante el día (día seco). Está especialmente indicada en individuos con pequeña superficie corporal (SC), alto transporte peritoneal y presencia de FRR; o en aquellos con problemas de pared abdominal para evitar escapes y/o hernias.
Las modalidades continuas son las más utilizadas en la práctica clínica e incluyen la DP continua cíclica (DPCC) o DPA con día húmedo en la que la cicladora realiza varios intercambios nocturnos seguidos de la infusión de un intercambio diurno que permanece durante el día en la cavidad peritoneal hasta la siguiente conexión nocturna. Las soluciones de icodextrina estarían especialmente indicadas en personas tratados con DPCC para el intercambio largo durante el periodo diurno. La DP continua optimizada (DPCO), también denominada DPA ampliada o DPCC plus, añade a la anterior la realización de un intercambio diurno adicional, ya sea de forma manual o automatizada. Esta modalidad consigue un mayor aclaramiento de solutos y está especialmente indicada en sujetos anúricos o que requieran mayores dosis de diálisis [11]. La (Figura 1) muestra un esquema representativo de estas modalidades.
La prescripción de DPA requiere la realización de dos tipos de prescripciones, una durante la noche y otra durante el día. En el periodo nocturno se pueden utilizar mayores volúmenes de líquido peritoneal, el número de intercambios es mayor (habitualmente entre 4 y 6) y los tiempos de permanencia son cortos. Durante el periodo diurno se suelen emplear menores volúmenes de líquido de diálisis, el número de intercambios es de uno o dos, y los tiempos de permanecía son más prolongados. Existen otras dos modalidades de DPA que pueden prescribirse tanto con día húmedo como con día seco: la DP tidal y la DPA adaptada.
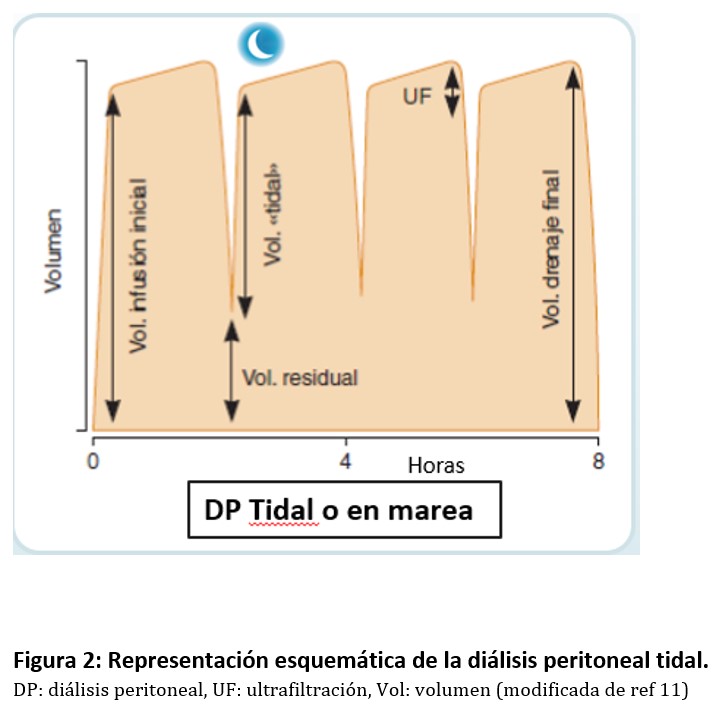
La DP tidal (DPT) o en marea se caracteriza porque tras un primer intercambio con infusión completa del líquido de diálisis, se produce un vaciamiento parcial del peritoneo en los siguientes ciclos, drenándose sólo un porcentaje del líquido infundido al que se añade la UF obtenida, manteniéndose un volumen de reserva intraperitoneal durante toda la sesión de diálisis. En el resto de intercambios se infunde un porcentaje del volumen inicial infundido, llamado volumen tidal (Figura 2). Se recomienda que este sea lo más alto posible, generalmente mayor del 70%. Su uso no conlleva un aumento del aclaramiento peritoneal [12] y, actualmente, sus principales indicaciones son la existencia de dolor relacionado con la infusión o drenaje del líquido peritoneal y la existencia de drenajes lentos en posición supina. Muchas veces también se utiliza para evitar alarmas y permitir un mejor descanso nocturno.
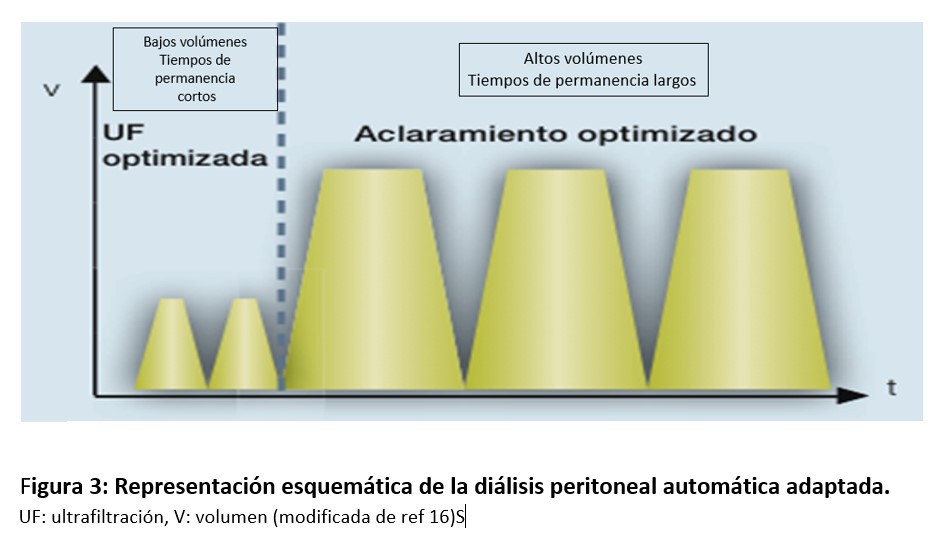
La DPA adaptada es un término utilizado para referirse a una prescripción individualizada de DPA que surge con la introducción de una nueva generación de cicladoras que permiten realizar una prescripción en la que no es necesario mantener constante, ni el volumen de infusión, ni la tonicidad de las soluciones de DP empleadas, ni el tiempo de permanencia. Incluye la prescripción de ciclos iniciales de bajo volumen y tiempos de permanencia corta que favorecen la UF inicial, seguidos de ciclos de mayor volumen y tiempo de permanencia más larga que contribuyen a obtener una mayor eliminación de solutos [13]. La (Figura 3) muestra un esquema de la misma. La UF inicial se ve favorecida por un gradiente osmótico elevado y una baja presión hidrostática en la cavidad abdominal debido a la menor presión intrabadominal ejercida. Posteriormente, los ciclos de mayor volumen y tiempo de permanencia contribuyen a obtener una mayor eliminación de solutos. El número de ciclos, el tiempo de permanencia y el volumen de llenado se determinan de forma individualizada en función de las características de la membrana peritoneal de cada persona y sus necesidades clínicas [14]. Esta modalidad, que combina en una misma programación objetivos de UF y aclaramiento de solutos, se ha utilizado fundamentalmente en niños con el objetivo de realizar una prescripción más personalizada y centrada en sus necesidades [15], obteniéndose también buenos resultados en adultos [16].
La DP de flujo continuo (DPFC) es una modalidad basada en la utilización de un flujo continuo y rápido de entrada y salida de la solución de diálisis manteniendo un volumen fijo intraperitoneal. Aunque podría ser una alternativa para optimizar el aclaramiento de solutos, la necesidad de disponer de un catéter de alto flujo y las grandes cantidades de líquido requeridas han dificultado su expansión. [17]. Actualmente están apareciendo sistemas novedosos que aplican los principios de la DPFC utilizando ciclos rápidos de dializado y un catéter estándar de una única luz. Estos sistemas incorporan procedimientos de regeneración del dializado peritoneal, ya sea a demanda o mediante el uso de adsorbentes. Ello puede reducir considerablemente el volumen de dializado requerido y consecuentemente el espacio de almacenamiento necesario [18].
El uso de la DPA cada vez es más frecuente por su mayor versatilidad a la hora de prescribir, siendo menor el número de conexiones requeridas [19]. Otras ventajas adicionales derivan de la mayor disponibilidad de tiempo libre para la persona, ya que la técnica se realiza fundamentalmente por la noche. Los estudiantes, personas dependientes como niños o ancianos, o aquellos con deseo de disponer de tiempo libre para su vida social o laboral, se beneficiarían especialmente de esta modalidad. Sus desventajas derivan de su mayor coste y la necesidad de utilizar una máquina durante el periodo nocturno, pudiendo interferir a veces con el descanso. Su aprendizaje es más complejo y el periodo de entrenamiento generalmente más prolongado. La DPA está también indicada en personas que necesitan disminuir la presión intraabdominal al permitir disminuir el volumen diurno o prescribir día seco. La DPA es la técnica preferente para sujetos sin FRR, especialmente si son altos o medio-altos transportadores, siendo la DPCC la modalidad de elección. La utilización de tiempos de permanencia cortos conlleva un menor aclaramiento de solutos y eliminación de sodio, por lo que la DPN no es recomendable si la persona no tiene FRR. La prescripción de la DPA debe realizarse de forma individualizada basándose en las características funcionales del peritoneo, la SC, la FRR y las preferencias de cada individuo.
2.3 Diálisis peritoneal incremental (DPIn)
La DPIn se ha definido de forma variable. Implica aprovechar la FRR, que suele estar presente al comienzo de la diálisis, para prescribir inicialmente dosis más bajas de DP pudiendo lograr objetivos de adecuación suficientes. Blake considera que la DPIn debe entenderse como una estrategia de tratamiento más que como una modalidad de DP en sí; y establece la necesidad de que se cumplan tres condiciones: prescripción inicial de una dosis de diálisis menor que la considerada como estándar en reconocimiento del valor de la FRR; eliminación peritoneal de agua y solutos inicialmente menor que el objetivo de depuración establecido, pero alcanzando los objetivos de adecuación señalados cuando se suma la eliminación peritoneal más la renal; y propósito de aumentar la dosis de DP a medida que disminuye la FRR y/o aparecen síntomas [20]. Desde un punto de vista teórico podría considerarse su uso tanto en personas en DPCA como en DPA. Su utilización cada vez es más frecuente como forma de inicio, ya que disminuye la carga de trabajo para las personas que realizan la técnica. Se ha relacionado también con ventajas clínicas, económicas y ambientales, como mejor calidad de vida, menos síntomas mecánicos, menores costos, leves efectos metabólicos adversos derivados de una menor exposición a la glucosa y menor consumo de agua y desechos plásticos [21]. Además, algunos autores han descrito que puede contribuir a preservar mejor la FRR [22]. Actualmente, la evidencia se basa en estudios de calidad moderada a baja que sugieren que los resultados de la DPIn son al menos similares a los de la DP de dosis completa. Es importante no olvidar que hay que monitorizar estrechamente a estas personas y aumentar la dosis de DP a medida que se pierde la FRR, intentado evitar situaciones de infradiálisis.
2.4 Diálisis peritoneal asistida
La diálisis peritoneal asistida (DPAs) se define como aquella DP que se realiza en el domicilio de la persona con la ayuda de un familiar, técnico o cuidador, así como la realizada en un centro sociosanitario con la asistencia de un profesional sanitario [23]. El número de personas que requieren tratamiento renal sustitutivo (TRS) está aumentando a nivel mundial, así como su edad, fragilidad y comorbilidad asociada. Esto supone un reto a la hora de apoyar la decisión de las personas mayores sobre su elección de TRS, ya que muchas de ellas no pueden ser tratadas con DP por no ser capaces de realizar la técnica de manera autónoma [24]. Los programas de DPAs se han convertido en una opción valiosa para estas personas mayores que no pueden gestionar de forma independiente la atención domiciliaria, Existen programas estructurados de DPAs en diversos países europeos [25], así como en Estados Unidos y Canadá [26][27], aunque el porcentaje de personas con disponibilidad de recibir esta terapia varía considerablemente y es generalmente pequeño. Es probable que muchas más personas elegirían hacer la diálisis en su domicilio si tuvieran apoyo suficiente, pero su fragilidad les impide realizarla [28].
3. ADECUACIÓN EN DIÁLISIS PERITONEAL
La uremia conlleva la pérdida de múltiples funciones del riñón, por lo que es difícil encontrar un único elemento de evaluación. Los métodos utilizados para valorar diálisis adecuada han sido múltiples e incluyen parámetros clínicos, datos analíticos, índices que miden la dosis de diálisis, como el Kt/V de urea y el aclaramiento de creatinina semanal (CCrS), la FRR, parámetros nutricionales y el transporte peritoneal de agua y solutos. Esto refleja que la adecuación, globalmente entendida, implica algo más que una simple medida de uno u otro índice y requiere una atención integral de la persona. Actualmente, se acepta de forma generalizada que el bienestar de los sujetos en diálisis está relacionado con factores diversos y no sólo con la eliminación de toxinas específicas. Por ello, se ha propuesto sustituir el concepto de “diálisis adecuada” por el de “diálisis orientada a objetivos”, definiendo esta como “el uso de la toma de decisiones compartidas entre la persona y el equipo que la trata con el objetivo de establecer metas de atención realistas que permitan al sujeto cumplir con sus propios objetivos vitales y al médico proporcionarle una atención dialítica individualizada y de alta calidad” [29]. Esto implica que se deben mantener conversaciones entre la persona que realiza la DP y el equipo sanitario que la atiende, para establecer los objetivos de atención que deben seguirse para la administración de la diálisis. Estos objetivos, siguiendo las recomendaciones de la Sociedad Internacional de DP (ISPD), estarían dirigidos a permitir que la persona que realiza la DP alcance sus propios objetivos vitales, y promover la provisión de una atención de diálisis de alta calidad por parte del equipo que la atiende. Esta DP de alta calidad tiene que estar guiada por evaluaciones que abarquen fundamentalmente el bienestar de la persona, la eliminación de pequeños solutos, el estado de volemia, el estado nutricional, el manejo de la anemia y el tratamiento del metabolismo óseo-mineral [30].
3.1 Calidad de vida relacionada con la salud: la terapia debe buscar maximizar la calidad de vida de la persona que realiza la DP, y para ello es necesario incorporar evaluaciones rutinarias de la misma. La incorporación de medidas de resultados informadas por el paciente (PROMs) en el cuidado rutinario de las personas en DP es necesaria, aunque no está definido que herramientas concretas utilizar ni como traducirlas en la mejora de la atención [31].
3.2 Eliminación de pequeños solutos: los índices más utilizados para medir la eliminación de pequeños solutos incluyen el Kt/V de urea semanal (siendo V el volumen de distribución) y el CCrS corregido por 1,73m2. Su cálculo está basado en la suma de los aclaramientos peritoneales y renales de urea y creatinina. Diversos trabajos han analizado la relación entre estos índices y los resultados clínicos en pacientes en DP. Los primeros estudios prospectivos de cohorte no fueron concluyentes, y aunque la mayoría de ellos encontraron relación entre índices de diálisis y mortalidad, otros no lo observaron. El estudio CANUSA incluyó 680 sujetos incidentes en DPCA. Los autores observaron que por cada 0.1 unidad que aumentaba el Kt/V, el riesgo relativo (RR) de muerte disminuía un 6%, y por cada 5 litros/semana que lo hacía el CCrS, el RR disminuía un 7% [32]. Las expectativas de supervivencia se basaban en aclaramientos totales, asumiendo que permanecían constantes a lo largo del tiempo y considerando que era igual una unidad de aclaramiento renal que de peritoneal. Sin embargo, un nuevo análisis de los datos demostró que el impacto en la supervivencia estaba relacionado con la FRR y no con los aclaramientos peritoneales [33]. El estudio NECOSAD confirmó estos datos, mostrando un efecto beneficioso del aclaramiento renal de solutos, y no del peritoneal, sobre la supervivencia [34]. Otros estudios han confirmado que los aclaramientos peritoneales y renales no implican lo mismo. Esta información debe tenerse en cuenta al calcular la dosis de diálisis y su prescripción, siendo necesario aumentar progresivamente la dosis de diálisis a medida que se pierde la FRR. Estudios posteriores observaron que los aclaramientos peritoneales dentro de los rangos habituales obtenidos, no se asocian con la supervivencia en DP. El estudio ADEMEX, multicéntrico y prospectivo, incluyó 965 sujetos con DPCA randomizados para un objetivo de CCrS superior o inferior a 60 l/semana/1,73 m2. Ambos grupos eran similares en comorbilidad y grado de FRR, y la supervivencia fue similar en ambos grupos [35]. Lo y col. analizaron 320 personas incidentes en DPCA con objetivos de Kt/V<1,7, entre 1,7-2 y por encima de 2. Los individuos con Kt/V<1,7 presentaron más complicaciones clínicas, sin diferencias entre los otros dos grupos [36]. Ambos estudios confirman que aumentar el Kt/V de 1,7 a 2 no mejora la supervivencia, aunque un Kt/V<1,7 se asocia con una mayor morbilidad.
Actualmente no existe evidencia sólida que demuestre la necesidad o el beneficio de alcanzar un valor objetivo específico de depuración de pequeños solutos que garantice una diálisis suficiente para una determinada persona. Aumentar la dosis de diálisis hasta un Kt/V>1,7, puede mejorar los síntomas relacionados con la uremia si los hubiera, pero solo hay datos de baja certeza que demuestren que el aumento de la depuración de urea tiene impacto real en la calidad de vida, la supervivencia a la técnica o la mortalidad [30]. Sin embargo, el objetivo de alcanzar un Kt/V de al menos 1,7, en personas anúricas, para prolongar la supervivencia, sigue estando vigente [37]. Las guías españolas de la Sociedad Española de Nefrología (SEN) recomiendan obtener un Kt/V mínimo de 1,7 independientemente de la modalidad de DP o de la existencia o no de FRR. Así mismo, refieren que valores de Kt/V >2 no han demostrado un impacto positivo en la supervivencia del paciente o de la técnica, ni en la calidad de vida, y apuntan que valores de Kt/V entre 1,7 y 2 serían los más adecuados para asegurar una depuración adecuada de pequeños solutos. No obstante, siguiendo las recomendaciones de la ISPD, se sugiere que no se debe modificar la prescripción de DP, para aumentar el Kt/V peritoneal, con el objetivo de lograr mejores resultados clínicos en personas asintomáticos con buen control del estado nutricional e hidratación y sin complicaciones asociadas con la uremia [38]. Las limitaciones existentes en la precisión de la estimación del V es otro de los aspectos que pueden cuestionan la validez de aplicar un único valor umbral de Kt/V como indicador de una diálisis adecuada. Por ello, algunos autores recomiendan que el objetivo de Kt/V se exprese mejor como un rango, y se determine la dosis de diálisis según las necesidades de cada individuo [39].
Aunque el Kt/V de urea es el índice preferido para medir la dosis de DP, el CCrS también se ha utilizado. Las guías españolas recomiendan alcanzar un CCrS mínimo de 45 litros/semana/1,73 m2, independientemente de la modalidad de DP utilizada o de que se trate de un paciente anúrico o con FRR, y sugieren que valores de CCrS entre 45-60 litros/semana/1,73 m2 parecen ser los más adecuados para considerar una aceptable depuración de solutos de bajo peso molecular [38].
3.3 Función renal residual: la FRR tiene gran importancia en DP, contribuyendo al balance hídrico y al aclaramiento de solutos de diverso peso molecular. Su determinación debe realizarse de forma periódica, utilizando para su cálculo el promedio de los aclaramientos de creatinina y urea en orina de 24 horas [40]. Diversos estudios han mostrado su relación con la mortalidad en DP y como su mantenimiento se asocia con mayor supervivencia [34][40].
3.3.1 Contribución a la dosis de diálisis: la FRR que tiene una importante contribución a la dosis total de diálisis, de tal manera que una tasa de filtrado glomerular de 1 ml/min equivale a un aclaramiento semanal de 10 litros. La eliminación de sodio y agua, elemento clave de la adecuación en DP, es otro aspecto fundamental que aporta. La presencia de FRR al inicio de la terapia permite comenzar con una prescripción menor de DP, siendo necesario incrementarla posteriormente de forma gradual a medida que la FRR disminuye o la situación clínica de la persona lo requiere. Esto proporciona a los individuos más tiempo libre para sus actividades, disminuye la carga del tratamiento y mejora la calidad de vida [30]. Con el tiempo, la FRR se pierde de forma progresiva, siendo inexistente en la mayoría de los sujetos a partir de 3-4 años. La presencia de FRR también se asocia con un mejor estado nutricional y el mantenimiento otras funciones del riñón no sustituidas por la diálisis. La (Tabla 2) muestra algunos de los principales efectos beneficiosos relacionados con el mantenimiento de la FRR [41][42].
3.3.2 Preservación y trascendencia: la preservación de la FRR es un criterio de valoración terapéutico importante en el manejo de las personas en DP. La modalidad de diálisis utilizada es uno de los factores que se ha relacionado con su preservación, existiendo estudios que muestran que la pérdida de la FRR es más rápida en personas que inician TRS con hemodiálisis (HD) con respecto a los que lo hacen con DP [43]. El impacto de la modalidad de DP sobre la evolución de la FRR es controvertido. Diversos estudios han mostrado que la DPA se relaciona con una pérdida más rápida, aunque otros no han observado estas diferencias. Un metaanálisis que analiza esta cuestión ha demostrado que no existen diferencias en este sentido y que las encontradas tienen relación más con la práctica clínica que con la modalidad en si [44]. Las nuevas soluciones de DP, bajas en productos de degradación de la glucosa (PDG), se ha relacionado con mejor preservación de la FRR, aunque otros autores no han encontrado diferencias. Cho y cols. en una revisión sistemática concluyen que el uso de estas soluciones se relaciona con un mayor volumen de orina y mejor FRR tras 12 meses de tratamiento [45]. El uso regular de la solución de icodextrina no compromete la preservación de la FRR, pero debe vigilarse la volemia por el riesgo de depleción de volumen. El uso de fármacos nefrotóxicos debe ser evitado y ajustarse al grado de FRR si es necesario. Siempre que sea posible, se debe utilizar un inhibidor de la enzima convertidora de angiotensina (IECA) o un bloqueador del receptor de angiotensina II (ARA-II) para preservar la FRR y disminuir la mortalidad. Los diuréticos sólo contribuyen a aumentar el volumen urinario, pero no preservan la FRR. Su uso se asocia con una mayor eliminación de sodio y agua, y favorece la utilización de soluciones con menor contenido de glucosa. La (Tabla 3) muestra los principales factores que contribuyen al mantenimiento de la FRR y las recomendaciones para su preservación [43][46].
3.3.3 Personas sin FRR: las recomendaciones de las dosis de diálisis se han basado en estudios realizados en sujetos con FRR, siendo escasos los realizados en anúricos. El estudio EAPOS, prospectivo, multicéntrico y observacional, que incluyó 177 individuos anúricos tratados con DPA, mostró que la supervivencia se relacionaba, además de con la edad y la comorbilidad, con la UF peritoneal. No se observó relación con la dosis de diálisis ni con el tipo de transporte peritoneal [47]. El estudio cooperativo NECOSAD mostró resultados similares en personas tratadas con DPA o DPCA [48]. En general, la supervivencia en los pacientes anúricos está más relacionada con la capacidad de UF peritoneal, existiendo tendencia a relacionarse con el aclaramiento de solutos, sin poder definir los límites inferiores requeridos [49]. La adecuación debe incluir eliminación de agua y solutos y, en general, se obtendrá más fácilmente con DPA, y en muchas ocasiones utilizando icodextrina.
3.4 Balance de agua y sodio: El apropiado control del volumen para lograr y mantener la euvolemia es una de las claves de la adecuación en DP. Ates y col. demostraron la existencia de una relación inversa entre la eliminación diaria de sodio y agua y la mortalidad en DP [50]; y esto es válido tanto para personas con FRR, como sin ella. La pérdida de la FRR se asocia con un aumento del volumen extracelular y con mayores complicaciones cardiovasculares [51]. La monitorización habitual del balance de fluidos es necesaria y se debe considerar su eliminación tanto por la UF peritoneal, como por la diuresis. El estado de volumen cambia con el tiempo por lo que su evaluación deber ser regular, e incluir al menos la medida de la presión arterial y la exploración clínica [52]. Aunque no existe evidencia clara de que el uso de métodos complementarios para evaluar el estado de hidratación, como la bioimpedancia, produzca beneficios clínicos, su incorporación en la práctica clínica puede ser de utilidad [38]. La extracción mínima total de líquido diaria no está definida, ya que esta va a depender parcialmente de la ingesta y debe ajustarse al objetivo final de mantener la euvolemia. No obstante, las guías españolas establecen, que, en el caso de sujetos anúricos, se debe garantizar una UF mínima diaria de 750 ml [38]. La (Tabla 4) muestra algunas de las medidas que se han propuesto para evitar la sobrecarga crónica de volumen en personas en DP.
3.5 Estado nutricional y eliminación de otros solutos: la depuración de otros solutos urémicos, los desequilibrios electrolíticos y acido-base, la hipoalbuminemia y el estado nutricional, pueden proporcionar una medida más holística de la adecuación de la diálisis para evaluar a personas en DP [53]. Una buena nutrición es uno de los aspectos necesarios para una salud óptima y por ello el estado nutricional debe evaluarse y monitorizarse periódicamente. Es necesario prestar atención al apetito y la ingesta de proteínas para mantener un estado nutricional normal, con restricción de fósforo, sodio y potasio, según los requerimientos de cada persona. La ISPD recomienda la medida periódica de potasio, bicarbonato, albúmina y fosfato como marcadores de nutrición [30].
4. PRESCRIPCIÓN DE DIÁLISIS
La prescripción de DP debe ser individualizada y tener en cuenta las circunstancias clínicas y preferencias de las personas que realizan la técnica. El proceso de toma de decisiones compartida, en el que participa el paciente, sus familiares/cuidadores y los profesionales que le atienden, es necesario para poder alcanzar objetivos de atención realistas que permitan brindar una atención de alta calidad a la persona que permita maximizar su calidad de vida [54]. La DP puede prescribirse de diversas maneras y es necesario conocer los recursos disponibles en cada caso, así como los deseos y necesidades del paciente y sus allegados, en el caso de que estos le presten asistencia [55].
Un primer paso es elegir la modalidad, DPCA o DPA y sus diferentes variantes, considerando las ventajas e inconvenientes de cada una de ellas y las necesidades de cada persona. La opción de empezar con DPIn, si el paciente tiene suficiente FRR, permite a los profesionales adaptar la prescripción a las preferencias del paciente, centrándose en las pruebas de laboratorio y la sintomatología clínica; y disminuyendo la carga del tratamiento. La prescripción del número de ciclos o intercambios peritoneales a realizar y el volumen de líquido utilizado deberá adecuarse a las peculiaridades de cada paciente. Además de la existencia o no de FRR, hay que conocer la SC de la persona, su pared abdominal y las características funcionales del peritoneo. La monitorización periódica de estos parámetros nos ayudará a realizar los cambios necesarios en la prescripción, y asegurar así una diálisis de alta calidad en todo momento, teniendo siempre presente los deseos del paciente.
Para evaluar el transporte peritoneal se recomienda el test de equilibrio peritoneal [56]. La categorización que establece en altos (rápidos) transportadores, promedio-altos, promedio-bajos y bajos (lentos) transportadores es útil para conocer la función de la membrana peritoneal y ayuda a la prescripción. Los altos transportadores tienen menos UF con tiempos de permanencia largos; la transferencia de solutos pequeños en tiempos de permanencia cortos es suficiente, y por ello la DPA podría ser la técnica de elección. En estos casos, la absorción de glucosa está aumentada, existiendo una pérdida rápida del gradiente osmótico y el consiguiente descenso de la UF neta. La utilización de tiempos de permanencia cortos puede conllevar menor aclaramiento de solutos, especialmente si se prescribe día seco, por lo que la DPN no es recomendable en el caso de pacientes anúricos. El uso de icodextrina durante el tiempo de permanencia largo permite obtener UF mayores que si se utilizan soluciones con glucosa, siendo una buena alternativa para este periodo [57]. Los transportadores promedio-alto y promedio-bajo son pacientes ideales para DP, pues consiguen un transporte de solutos y una UF adecuada en la mayoría de los casos. Constituyen el grupo mayoritario de pacientes, y pueden ser tratados tanto con DPA como con DPCA. Los bajos transportadores tienen una excelente capacidad de UF peritoneal, y si no tienen gran demanda de diálisis, se mantienen con DPCA sin dificultades. Por el contrario, si tienen una gran SC y carecen de FRR, pueden tener dificultades para conseguir los objetivos de aclaramiento necesarios. Aunque la categorización de los pacientes según la tasa de transferencia de solutos puede resultar útil, presenta limitaciones en la práctica clínica, ya que estos valores funcionan más como variables continuas que como grupos claramente diferenciados, y además se van modificando con el tiempo. Por ello es importante tener un enfoque práctico a la hora de prescribir la DP, priorizando siempre las preferencias del paciente y los resultados clínicos [58].
La existencia de FRR permite a la mayoría de los pacientes ser tratados con las diferentes modalidades de DP. La DPA será la técnica ideal para anúricos, especialmente si son altos o promedio-altos transportadores, siendo la DPCC la modalidad de elección en estos casos.
Los pacientes con mayor SC requieren más dosis de DP que el resto. En general, esta se consigue utilizando DPA, y en determinados casos hay que prescribir intercambios diurnos adicionales para conseguir aclaramientos suficientes. En relación con la pared abdominal, la DPA estará indicada en pacientes que precisan menor presión intraabdominal al permitir disminuir el volumen diurno o prescribir día seco.
La prescripción en pacientes mayores, frágiles, con elevada comorbilidad, mal pronóstico vital o en cuidados paliativos, debe ser especialmente individualizada. En estos casos, la DP es solo un componente más de la atención requerida por la persona, y debe estar claramente establecida mediante un proceso de toma de decisiones compartidas. Con el objetivo de maximizar la calidad de vida, la carga de la diálisis debe minimizarse, adaptando la prescripción de DP a las necesidades del paciente y sus cuidadores. Es esta fase es importante focalizar la atención en el control de síntomas y el mantenimiento de la FRR. La coordinación e integración de los cuidados con los servicios de geriatría, cuidados paliativos y trabajo social pueden facilitar la atención de las personas en la etapa final de su vida [59].
El enfoque en la prescripción de DP se ha ido modificando en los últimos años, siendo cada vez más evidente la necesidad de considerar múltiples factores para lograr mejores resultados clínicos y mayor calidad de vida de los pacientes. Por ello, se ha producido un cambio de paradigma en las directrices y recomendaciones sobre la idoneidad de la diálisis, dejando de lado una perspectiva centrada en la eliminación de toxinas específicas y adoptando un enfoque más holístico y centrado en la persona, que busca una atención integral con el desarrollo de estrategias que minimicen la carga de la diálisis. Esto requiere una estrecha colaboración entre la persona que realiza la DP, sus familiares/cuidadores y el equipo que le atiende, para facilitar así una comprensión de los objetivos, prioridades y preferencias del paciente, a la vez que busca alcanzar una atención de máxima calidad durante el tratamiento [60].