Microbiota Intestinal en la Enfermedad Renal Crónica
INTRODUCCION
Desde Hipócrates (400 años A.C.) que estableció que «la muerte asienta en los intestinos» es bien conocida su influencia en la salud del ser humano.
Se denomina microbiota a los gérmenes que habitan en nuestro organismo y a sus genomas colectivos, microbioma. Más de 100 trillones de gérmenes (1014) cohabitan con nosotros a lo largo de la vida, lo que representa 10 veces el número de células que conforman nuestro organismo y constituyen 1,5-2 kg de nuestro peso [1][2]. La concentración de gérmenes en el tracto digestivo se incrementa gradualmente desde el estómago hasta el colon, en donde alcanzan la mayor concentración (de hasta 1011 microorganismos/g de heces) y diversidad. Es por ello por lo que la microbiota intestinal juega un papel relevante en procesos metabólicos, nutricionales, fisiológicos e inmunológicos, y constituye un verdadero ecosistema [3]. La microbiota humana constituye un segundo genoma, con más de 3 millones de genes (100 veces más genes que el propio genoma humano) y es objeto de investigación por el Human Microbiome Project Consortium [4][5][6].
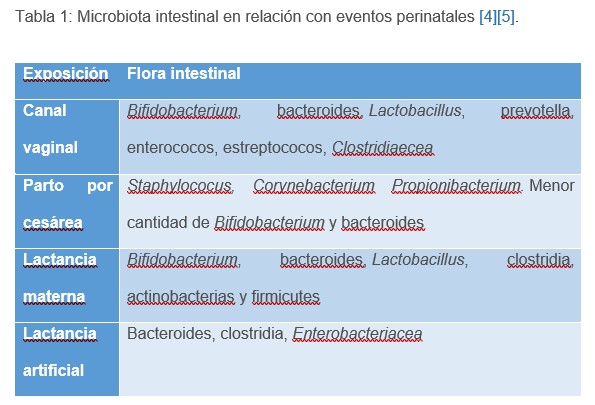
Originalmente, la microbiota intestinal se conforma a través de la placenta, en donde anidan bajos niveles de gérmenes no patógenos, especialmente firmicutes, bacteroidetes y Fusobacteria phyla. En los primeros años de vida, la alimentación, tipo de parto, higiene y uso de antibióticos condicionan la formación del microbioma intestinal [7][8]. Diferentes especies de gérmenes colonizan y se originan en los distintos eventos (Tabla 1).
La microbiota intestinal se establece en los primeros 2-3 años de vida como un ecosistema dinámico, dominado por las Bifidobacterias, y su composición va aumentando en riqueza y diversidad hasta alcanzar su máxima complejidad en la edad adulta, cuando las especies dominantes son Bacteroidetes, Firmicutes y Actinobacterias [9][10][11].
La comunidad bacteriana asentada en el intestino es una combinación de diferentes tipos y cantidades de bacterias y se han identificado 3 grupos diferentes de microbiota o enterotipos en el ser humano [12]. La composición filogenética de la microbiota intestinal tiende a ser similar entre individuos de la misma región, pertenecientes a la misma familia y entre los que tienen una dieta similar, la cual juega un papel relevante en su composición [13][14].
Los hábitos dietéticos afectan la composición de la microbiota intestinal. Dado que la microbiota está en contacto con un importante número de células neurales y de células inmunológicas, dirige la maduración del sistema inmune en la infancia y contribuye al mantenimiento de su homeostasis durante la vida [2]. Los polisacáridos complejos, que no son digeridos por las enzimas del intestino delgado, son metabolizados por la microflora del colon. Estos polisacáridos son degradados y fermentados en el intestino grueso y convertidos en ácidos grasos de cadena corta (AGCC) y gases (CO2 y H2). Un alto contenido intestinal de fructosa promueve la formación de butirato a través de las bacterias productoras. La suplementación de la dieta con polisacáridos específicos puede promover el crecimiento de gérmenes «saludables» (Bifidobacterium, Lactobacillus), la producción de AGCC y puede disminuir el pH intestinal con el objeto de inhibir el crecimiento de gérmenes patógenos [15][16].
La mayoría de la gente cree que las bacterias en el cuerpo son la causa de la enfermedad o el desarrollo de ciertas enfermedades. Las bacterias que componen el microbioma tienen un papel muy importante en el mantenimiento de un sistema inmunitario fuerte y eficiente que participa en el mantenimiento de la salud [17].
En el siglo XXI, con el desarrollo de la biología molecular y la metagenómica, se puso de manifiesto su enorme diversidad e importancia para la salud. Se trata de un conjunto de bacterias, árqueas, protozoos, hongos y virus que habitan en la piel y las mucosas. La flora normal recibió un nuevo nombre -microbiota- y el material genético de todos los microorganismos: el microbioma.
A lo largo de la vida de un individuo, el microbioma cambia debido a los hábitos alimentarios, de forma que la flora intestinal se ve alterada por los antibióticos, una dieta rica en azúcar y carbohidratos refinados las toxinas -gluten y aceites refinados-, el estrés y la edad. Uno de los mayores desequilibrios de la flora intestinal es la dieta moderna. Los alimentos ricos en azúcar y carbohidratos refinados (por ejemplo, pan, pasta, galletas y pasteles) favorecen el crecimiento de hongos, especialmente Candida, lo que favorece la colonización de parásitos [18].
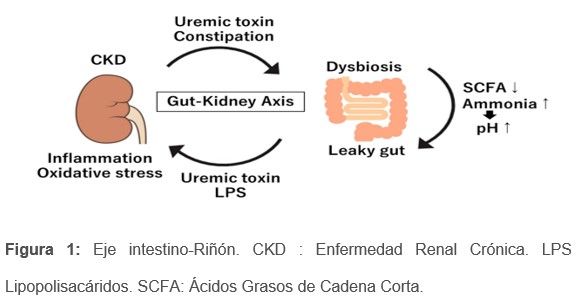
El eje intestino-riñón revela interacciones críticas entre el microbioma intestinal y la función renal que influyen en la salud humana y en la enfermedad. Esta vía de comunicación desempeña un papel importante en el riñón a través de la inflamación, la toxicidad urémica y los procesos metabólicos [19].
En los pacientes con ERC, los desequilibrios de la microbiota intestinal promueven la producción de toxinas urémicas, como el Indol Sulfato (IS) y el sulfato de P-Cresol (SPC), que deterioran la función renal y contribuyen a la inflamación sistémica. Mecanismos como la endotoxemia, la activación inmunitaria y el estrés oxidativo empeoran el daño renal al activar vías proinflamatorias y oxidativas [20]. El aumento de la permeabilidad intestinal, denominado "leaky gut”, también se asocia a la ERC, ya que permite que endotoxinas como los lipopolisacáridos (LPS) entren en el torrente sanguíneo.
Así pues, el estado inflamatorio crónico en la ERC se debe en parte a cambios en la barrera intestinal y en la microbiota, lo que pone de relieve el papel del eje intestino-riñón en la progresión de la enfermedad [21][22].
Una dieta basada en vegetales tiene menos colesterol y grasa que otros tipos de dieta. Su base consiste en verduras, proteínas vegetales, grasas buenas y cereales integrales. Según estudios anteriores, los veganos representan entre el 0,2% y el 1,3% de la población estadounidense y entre el 0,25% y el 7% de la población mundial [23]. La base de la nutrición vegetal es la fibra, y su retención en el intestino depende de su solubilidad en agua, por lo que ralentizan la digestión y dan sensación de saciedad. Esto se aplica a las fibras que se encuentran en frutas y legumbres, que crean sustancias viscosas en el agua. Las fibras que proceden de cereales integrales y verduras son menos solubles y, por tanto, aumentan la cantidad de masa fecal, lo que permite un aumento de la motilidad intestinal [24] (Figura 1).
MICROBIOTA EN LA ENFERMEDAD RENAL CRONICA (ERC)
Disbiosis en la Enfermedad Renal
En la ERC, la disbiosis se caracteriza por una disminución de bacterias beneficiosas, como Lactobacillus, Prevotella y Bifidobacteria, junto con un aumento de bacterias patógenas u oportunistas como Proteobacterias y Enterococos [25][26][27]. Los mecanismos subyacentes en la disbiosis de la ERC no se comprenden completamente; sin embargo, están implicados varios factores que incluyen la acumulación de toxinas urémicas, la acidosis metabólica, los efectos de algunos agentes quelantes utilizados en el tratamiento de la ERC como los suplementos orales de hierro, potasio y fósforo, así como el deterioro de la función intestinal, la reducción de la ingesta de fibra dietética y el frecuente estreñimiento observado en pacientes con ERC [28][29].
A medida que la función renal disminuye, las toxinas urémicas se acumulan en sangre, infiltrando potencialmente el intestino y alterando la barrera intestinal, lo que permite que los metabolitos tóxicos penetren en la circulación, desencadenando inflamación sistémica y aceleración del daño renal [21].
Los pacientes con ERC experimentan el fenómeno conocido como “leaky gut” consistente en un aumento de la permeabilidad intestinal, exacerbado por el estado urémico, edema y cambios isquémicos en el intestino [30]. Esto se asocia a una expresión reducida de la proteínas de las "tight junction" en el epitelio intestinal (ZO-1, claudina y ocludina), permitiendo que las endotoxinas, incluidos los LPS, pasen a la sangre [31][32]. Posteriormente, la endotoxemia provoca respuestas inmunes, estimulando citoquinas proinflamatorias (como IL-6 y TNF-α) que perpetúan un estado de inflamación crónica que hace progresar el deterioro de la función renal [32]. De hecho, los pacientes con ERC evidencian niveles más altos de endotoxinas circulantes que los individuos sanos, lo que sugiere una alteración de la función de barrera intestinal.
La permeabilidad intestinal en la ERC perpetúa un circuito de retroalimentación donde la inflamación altera aún más el microbioma intestinal, creando un círculo vicioso que aumenta la progresión de la enfermedad renal [33].
Metabolitos Intestinales y Toxinas
Los metabolitos derivados del intestino pueden tener efectos tanto beneficiosos como perjudiciales para el riñón. Los AGCC, por ejemplo, ayudan a mantener la funcionalidad de la barrera intestinal [34]. Por otro lado, toxinas como el amonio y fenoles, producidas durante la fermentación de proteínas mediante la producción de ureasa de las bacterias intestinales, promueven la inflamación sistémica y el daño renal. Este desequilibrio metabólico crea un ciclo vicioso, ya que el deterioro de la función renal reduce la eliminación de las toxinas intensificando el daño renal y sistémico. Sustancias nocivas, como el amoníaco, aminas, tioles, fenoles e indoles, son producidos por bacterias intestinales proteolíticas, como Bacteroides y Clostridium, que se encuentran aumentadas en la ERC [35].
La elevación sérica de la urea conduce a un aumento del flujo de urea al tracto gastrointestinal, lo que aumenta producción de amonio. Los niveles elevados de amonio elevan el pH local, alterando la barrera intestinal y en consecuencia dañan las células epiteliales [36].
Recientemente se ha descrito que el amonio afecta la integridad de las proteínas de las “tight junction” como ZO-1 y ocludina en la barrera epitelial intestinal [36]. Esta alteración en las "tight junction" compromete la barrera intestinal, lo que conlleva al aumento de su permeabilidad. La lesión epitelial inducida por la elevación de amonio puede desencadenar una cascada de respuestas inmunes, aumentando aún más la producción de citoquinas inflamatorias (p. ej., IL-6, TNF-α) agravando la inflamación crónica asociada a la ERC. Además, la alteración intestinal por el aumento de amonio puede promover el crecimiento bacteriano de cepas proteolíticas productoras de ureasa, que producen toxinas adicionales que alteran los riñones y otros tejidos [28].
Las toxinas urémicas, IS, SPC y N -óxido de trimetilamina (TMAO) que contribuyen significativamente a la progresión de la ERC y las complicaciones vasculares, derivan de los componentes dietéticos metabolizados por las bacterias intestinales [37]. Estas toxinas urémicas se encuentran en la sangre unidas principalmente a proteínas, como la albúmina, lo que limita su eliminación y contribuye a su acumulación y toxicidad en la ERC [38]. La fermentación de proteínas en el intestino genera varios metabolitos que impactan de forma importante en la homeostasis renal [39].
Una dieta rica en proteínas asociada a un status urémico puede conducir a un sobrecrecimiento de bacterias fermentadoras de proteínas, produciendo subproductos tóxicos como IS, PCS y amonio [40]. Estos metabolitos contribuyen a la toxicidad sistémica, promoviendo la progresión de la ERC y las complicaciones cardiovasculares.
Mecanismos de interacción entre el intestino y el riñón
1. Inflamación sistémica y activación inmune
La ERC se asocia con inflamación sistémica, donde la disbiosis intestinal juega un papel importante. Un desequilibrio entre bacterias saprofitas y patógenas aumenta la exposición a endotoxinas, activando el sistema inmunológico. Las bacterias patógenas producen metabolitos como los LPS, que pueden infiltrarse en el torrente sanguíneo debido a un "leaky gut" [21].
Los LPS actúan sobre las células inmunes libererando citoquinas proinflamatorias, que contribuyen a la progresión de la ERC y la inflamación vascular. Esta activación inmunitaria no sólo perjudica la función renal, sino que también aumenta el riesgo de enfermedad cardiovascular al dañar los vasos sanguíneos y promover la formación de placa, lo que en última instancia provoca lesión renal y empeora condiciones como la glomeruloesclerosis y la fibrosis [41].
2. Endotoxemia e inflamación renal y estrés oxidativo
Las endotoxinas, en particular los LPS, contribuyen significativamente a la inflamación en la ERC. La disbiosis intestinal aumenta la permeabilidad intestinal, lo que permite que los LPS pasen a la circulación y desencadenen respuestas inflamatorias en los riñones [42]. Esto activa los receptores tipo Toll (TLR), que provocan estrés oxidativo y aumento de citoquinas, lo que promueve la infiltración de células inmunitarias [43][44].
En consecuencia, el estrés oxidativo daña las células tubulares renales, promueve la fibrosis y empeora la función renal, creando un ciclo de inflamación crónica y deterioro en la ERC.
3. Fermentación de carbohidratos dietéticos
La fermentación intestinal de los carbohidratos produce AGCC beneficiosos como el acetato, el propionato y el butirato, que favorecen la salud renal. En ERC, la disbiosis intestinal y el bajo contenido de fibra dietética reducen su producción, lo que permite que las bacterias patógenas proliferen y comprometan la barrera intestinal [45][46]. Este aumento de la permeabilidad puede provocar endotoxemia, lo que desencadena inflamación y estrés oxidativo en los riñones. Estos cambios se correlacionan con niveles más altos de proteína C reactiva (PCR) y una mayor mortalidad en pacientes con ERC [47]. Se ha encontrado ADN bacteriano de especies como Klebsiella, Proteus, Escherichia, Enterobacter y Pseudomonas en la sangre de aproximadamente el 20% de los pacientes con ERC terminal [48].
4. Productos avanzados de la glicación
Los productos finales de glicación avanzada (AGES) son compuestos que se forman cuando los azúcares reaccionan con proteínas o lípidos, especialmente durante técnicas culinarias a alta temperatura, como freir y brasa [49]. En personas con ERC, los AGEs se acumulan por disminución de su aclaramiento y por dietas ricas en alimentos procesados, lo que provoca el daño renal por múltiples mecanismos que incluyen la activación de vías proinflamatorias, el estrés oxidativo y la fibrosis [49] [50].
Además, los AGEs aumentan la permeabilidad intestinal, lo que permite que los LPS ingresen al torrente sanguíneo, dañando las células endoteliales y contribuyendo a la rigidez vascular y la presión arterial elevada [50]. Las dietas altas en AGEs se correlacionan con un daño renal más significativo en pacientes con ERC [51].
Por lo tanto, reducir la ingesta dietética de AGEs y su producción endógena podría ayudar a controlar la progresión de la ERC.
5. Cuerpos cetónicos
Los cuerpos cetónicos (acetoacetato, β-hidroxibutirato y acetona) son metabolitos energéticos producidos durante el metabolismo de los ácidos grasos, especialmente en condiciones de inanición o niveles bajos de carbohidratos. Su metabolismo en los riñones es crucial para obtener energía, reducir el estrés oxidativo y proporcionar efectos antiinflamatorios [52].
En el eje intestino-riñón, la producción de cuerpos cetónicos puede mejorar la microbiota saprófita, mejorando la integridad de la barrera intestinal. Las dietas altas en grasas y bajas en carbohidratos que promueven la producción de cetonas pueden tener efectos protectores renales, pero la seguridad a largo plazo de las dietas cetogénicas en pacientes con ERC requiere más estudios, ya que podrían empeorar la acidosis metabólica [53] [54].
Implicaciones clínicas y terapéuticas
La investigación sobre el eje intestino-riñón está aumentando debido a su impacto sobre la salud renal. Las intervenciones que se centran en esta relación están ganando popularidad en el tratamiento de la ERC incluidos los cambios en la dieta, los probióticos, el trasplante de microbiota fecal (TMF), la modulación de metabolitos y la mejora de la motilidad intestinal.
1. Intervención Dietética
Las intervenciones dietéticas desempeñan un papel crucial en el manejo de la ERC, ya que la dieta afecta directamente la composición y la actividad metabólica de la microbiota intestinal. Una dieta rica en fibra y baja en proteínas animales fomenta el crecimiento de bacterias saprofitas que producen ácidos grasos de cadena corta (AGCC) [55][56]. Estos AGCC están relacionados con una disminución en la producción de toxinas urémicas. Además, estos AGCC tienen propiedades antiinflamatorias que ayudan a fortalecer la barrera intestinal, reduciendo así la inflamación de origen intestinal que puede afectar la función renal [57].
Las dietas basadas en vegetales y mediterráneas son especialmente beneficiosas, ya que aportan fibras prebióticas que promueven el crecimiento de bacterias saprofitas, reducen los niveles de toxinas urémicas y mejoran la salud general del intestino y los riñones [58].
Incorporar regularmente estas modificaciones dietéticas puede ayudar a reducir la inflamación sistémica y el estrés oxidativo, lo que puede retrasar la progresión de la ERC [59]. El aumento de la fibra dietética mejora la microbiota intestinal y eleva los niveles de Bacteroides acidifaciens. Una dieta rica en fibra no solo restaura la microbiota intestinal y el metaboloma, sino que también puede ayudar a retrasar la progresión de la ERC [60]. En un meta-análisis en el que se analizaron 10 estudios de cohorte con 19.843 pacientes con ERC en seguimiento entre 1.5 y 10 años, se vio que el consumo de fibra se asoció con una disminución de la mortalidad por todas las causas (HR 0,80; IC del 95%: 0,58–0,97; P < 0,001), mortalidad cardiovascular (HR 0,78; IC del 95%: 0,67–0,90) y enfermedad cardiovascular (HR 0,87; IC del 95%: 0,80–0,95) [61].
Las guías de práctica clínica de la Asociación Americana del Corazón (AHA), KDIGO y la reciente Guía Alimentaria para Estadounidenses de 2025-2030 incluyen su consumo dentro de sus recomendaciones [62] [63].
Estos efectos prometedores podrían estar mediados por la restauración de las uniones estrechas en el epitelio intestinal, la disminución del estrés oxidativo y la reducción de la inflamación y la fibrosis, en parte debido a un aumento de las bacterias productoras de AGCC [61][64].
2. Probióticos
Los probióticos son microorganismos vivos que mejoran la salud intestinal al equilibrar la microbiota [63]. Las cepas comunes como Lactobacillus y Bifidobacterium son particularmente beneficiosas para los pacientes con ERC [64], ya que pueden aliviar la disbiosis y reducir los niveles de toxinas urémicas, lo que podría ralentizar la progresión de la disfunción renal [65].
Las investigaciones indican que Lactobacillus acidophilus y Bifidobacterium pueden reducir los marcadores inflamatorios en pacientes con ERC y ayudar a modular las respuestas inmunitarias al disminuir las citoquinas proinflamatorias [66]. Además, los probióticos pueden ofrecer beneficios cardiovasculares, lo cual es importante en la ERC [67].
3. Prebióticos
Los prebióticos son componentes de los alimentos que no se pueden digerir pero que estimulan el crecimiento y la actividad de las bacterias beneficiosas en el intestino [68]. Los ejemplos comunes de prebióticos incluyen fibras como la inulina, los fructooligosacáridos, el almidón resistente, la dextrina no digerible (como la dextrina resistente), los galactooligosacáridos y los polisacáridos de glucosa como los betaglucanos (β-glucanos).
Los prebióticos pueden producir AGCC a través de los procesos de fermentación que llevan a cabo los microbios intestinales. Los AGCC actúan como moléculas de señalización que reducen la producción de citocinas proinflamatorias y promueven el crecimiento de células T reguladoras en el intestino grueso. Además, pueden reducir el pH luminal, prevenir la formación de toxinas urémicas e inhibir el crecimiento de patógenos [69].
Se ha demostrado que el aporte de prebióticos tiene una acción protectora en la ERC al reducir los niveles de toxinas urémicas [70]. Promueven el crecimiento de bacterias productoras de AGCC, con ello ayudan a reducir los niveles de IS y PCS. Los AGCC también ofrecen protección renal al inhibir las vías proinflamatorias y mejorar el metabolismo de la glucosa y los lípidos, ambos cruciales para controlar los trastornos metabólicos asociados con la ERC.
Diferentes estudios clínicos con prebióticos en pacientes con ERC han evidenciado resultados prometedores en la composición de la microbiota intestinal y en la reducción de los marcadores inflamatorios y las toxinas urémicas [71][72][73]. Por ejemplo, los prebióticos de tipo inulina se han relacionado con mayores niveles de bacterias beneficiosas como Bifidobacterium y Faecalibacterium prausnitzii, ambas conocidas por sus efectos antiinflamatorios [74]. Además, los galactooligosacáridos mejoran las bacterias intestinales saprofitas al tiempo que reducen las bacterias patógenas [75]. Los β-glucanos, que se encuentran principalmente en la cebada y la avena, además de sus propiedades hipolipemiantes y estabilizadoras de la glucemia, son inmunomoduladores y antioxidantes lo que les confiere la capacidad de atenuar el impacto adverso de la inflamación sistémica en diversos tejidos, incluyendo la vasculatura, en la enfermedad renal al reducir los niveles de TNFα, su precursor ADAM17, y la esfingomielinasa neutra 2 (nSMase2), una enzima agravante de la inflamación y senescencia en el daño vascular [76]. Se sabe también que los β-glucanos promueven una reducción de toxinas urémicas circulantes, principalmente PCS, indol y TMAO lo que implica relevancia clínica [77],[78]. Por los beneficios conocidos, la Autoridad Europea de Agencia Alimentaria (EFSA) y la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) recomiendan a la población el consumo de 3 gramos diarios de βglucanos [79].
La combinación de probióticos y prebióticos en simbióticos (una estrategia que utiliza ambos conjuntamente) puede tener un mayor potencial en la modulación de la microbiota y en el enlentecimiento de la progresión de la ERC [72][73]. Sin embargo, una reciente revisión con 45 ensayos controlados y aleatorizados, incluyendo 2266 pacientes con ERC en estadios 1 a 5, incluidos pacientes en diálisis y portadores de trasplante renal, analizaron los efectos de los prebióticos, probióticos y simbióticos, concluyendo que no existe suficiente evidencia sobre su efectividad para controlar la función renal, reducir de toxinas, mejorar el tránsito intestinal o la calidad de vida [80].
En resumen, se necesitan más estudios para definir las pautas de dosificación, optimizar la selección de cepas y comprender mejor los efectos a largo plazo sobre los pacientes y la progresión de la ERC
4. Ejercicio físico
El ejercicio físico es capaz de modificar la microbiota intestinal disminuyendo el ratio Firmicutes/Bacteroidetes [81] e incrementando especies como Akkermansia muciniphila, Bifidobacteria y Roseburia (productora de butirato) [82]. Allen et al. demostraron que realizar ejercicio aeróbico vigoroso, tres veces a la semana durante una hora, genera un aumento de AGCC, principalmente acetato, propionato y butirato [83]. Por cada 30 minutos de este tipo de ejercicio, disminuye en 0,584 μmol/L TMAO [84]. Se conoce que el ejercicio de gran intensidad se asocia a una disminución de marcadores de disfunción endotelial e inflamación de bajo grado [85]. Es decir, la intensidad del ejercicio tendría repercusión en la microbiota.
En tan solo una semana de seguir una dieta rica en alimentos integrales y de origen vegetal, ejercicio y manejo del estrés, individuos con riesgo moderado-alto de enfermedad aterosclerótica, modifican su microbiota, aumentan las familias de bacterias productoras de butirato Lachnospiraceae, Ruminococcaceae y Faecalibacterium prausnitzii lo que se asocia con un mejor control tensional, lipídico, glucémico e inflamatorio [86].
5. Modulación de los Metabolitos
La modulación de las toxinas urémicas es crucial para abordar la disfunción del eje intestino-riñón. El tratamiento de toxinas específicas como el IS y el PCS puede ayudar a reducir sus efectos sobre el riñón. Medidas como, promover dietas saludables aumentando el aporte de fibra, el uso de prebióticos y adsorbentes que capturan y disminuyen la absorción de estos metabolitos pueden ser útiles.
Las intervenciones farmacológicas han evidenciado ser prometedoras en el tratamiento ERC. Por ejemplo, el AST-120 que es un adsorbente oral que se une al indol y a otros precursores del IS en el intestino, puede reducir las toxinas urémicas [87]. Aunque el AST-120 no es universalmente aceptado en las pautas médicas, ensayos controlados aleatorizados realizados en Japón, específicamente el ensayo CAP-KD que incluyeron pacientes con ERC en estadios 4-5, demostraron una significativa mejoría de la función renal con la administración de AST-120 [88] [89]. Sin embargo, un estudio multinacional, aleatorizado, doble ciego y controlado con placebo, para evaluar la prevención de la progresión de la enfermedad renal crónica (EPPIC), incluyó 2035 pacientes con ERC moderada-severa y no encontró un significativo enlentecimiento en la progresión de la ERC al comparar AST-120 con un placebo [90]. Esta falta de eficacia puede atribuirse a la adherencia y efectos negativos en el entorno intestinal.
Se conoce que el carbón activado es capaz de reducir IS. Se ha descrito que los pacientes con prurito urémico tienen altos niveles de esta toxina. Actualmente se está llevando a cabo un ensayo clínico en pacientes con prurito asociado a ERC, en el que se busca evaluar la capacidad del carbón activado en controlar dicha sintomatología [91].
Los nuevos fármacos inhibidores del cotransportador de sodio-glucosa 2 (SGLT-2), en especial canaglifozina, han demostrado que alteran la composición de la microbiota y reducen las toxinas urémicas en ratones con insuficiencia renal. Este efecto se produce al aumentar el suministro de glucosa al intestino distal a través de la inhibición del SGLT-1 [92] [93]. Estos fármacos son de uso frecuente en la ERC, sin embargo, los mecanismos detrás de sus efectos renoprotectores aún no se comprenden por completo. Estos mecanismos pueden afectar al eje intestino-riñón, que podría estar relacionado con la mayor producción de cuerpos cetónicos a través de un cambio en el metabolismo energético [94].
La hemodiafiltración con reinfusión endógena del ultrafiltrado (HFR), una técnica dialítica que combina convección, difusión y adsorción, ha demostrado su capacidad para eliminar toxinas urémicas [95]. Recientemente, en un estudio piloto con 20 pacientes, se vio como después de una sola sesión con HFR, disminuyen de forma significativa IS, cadenas ligeras libres λ, β2 microglobulina, IL-6, P-cresol, proteína similar a la quitinasa-3 1, leptina, ácido hipúrico, TMAO, dimetilarginina asimétrica, TNF-α y FGF23, al comparar con la hemodiafiltración [96]. Sin duda, el alto coste puede ser un obstáculo, sin embargo, los beneficios obtenidos pueden ser mayores.
6. Motilidad Intestinal
La regularidad de la actividad intestinal es esencial para mantener la salud intestinal y renal [97], ya que influye en la retención de toxinas urémicas. En la ERC y en espacial en los pacientes en diálisis, suelen sufrir una alta prevalencia de estreñimiento en torno al 30%. El estreñimiento incrementa del riesgo de desarrollar hiperpotasemia [98], empeora la función renal, incrementa el riesgo de padecer ERC, su progresión a estadios finales [98][99][100] y aumento en la mortalidad [101][102] en posible relación con una mayor retención de toxinas urémicas [98].
Varios factores contribuyen al estreñimiento, entre ellos destacan la baja ingesta de fibra, la comorbilidad asociada, la reducción del flujo sanguíneo intestinal, problemas neurológicos que afectan el movimiento intestinal, una producción disminuida de moco (lo que disminuye la lubricación intestinal), efectos secundarios de ciertos medicamentos (como resinas de intercambio iónico, captores de fósforo o suplementos orales de hierro), restricciones dietéticas (como limitaciones de potasio que disminuyen la ingesta de fibra), alteraciones en la microbiota intestinal, la retención de toxinas urémicas, la hiperhomocisteinemia o bajos niveles de butirato [103][104][105].
En estudios con pacientes en hemodiálisis, se observó que aquellos con estreñimiento presentaban niveles más elevados de homocisteína en plasma, lo que parece coincidir con estudios previos en modelos animales, en los que la hiperhomocisteinemia se asoció con una disminución del peristaltismo intestinal [103]. Asimismo, el perfil proteolítico dominante de la microbiota del paciente renal puede también disminuir el tránsito colónico debido a un incremento en la síntesis de toxinas urémicas [103][104]. El butirato, metabolito que contribuye al mantenimiento de la función barrera, estimula la secreción de mucina favoreciendo el tránsito colónico y presenta actividad antiinflamatoria; no obstante, se encuentra disminuido en pacientes renales [103].
Algunas intervenciones para manejar y disminuir el estreñimiento:
# Lactulosa: En estudios recientes en modelos animales [106] y pacientes con ERC [107], el uso de lactulosa redujo los niveles de toxinas urémicas y modificó positivamente la microbiota, incrementando especies como Bifidobacterium y Lactobacillus, ejerciendo un efecto prebiótico.
# Actividad física: Además de modificar la microbiota como se mencionó anteriormente, el ejercicio acelera el tránsito intestinal [108] convirtiéndose en una posible intervención efectiva para reducir el estreñimiento [103].
# Fibra dietética: Las fibras solubles (inulina, pectina, oligosacáridos, β-glucanos, gomas) [108] parecen ser más efectivas para reducir el estreñimiento en pacientes renales que las fibras insolubles, puesto que aceleran el tránsito colónico [103] y son las que mayor capacidad de fermentación presentan [109] [110].
# Probióticos: La administración de probióticos ha demostrado mejorar la consistencia de las heces y la frecuencia defecatoria [103]. No obstante, existe una evidencia limitada respecto al uso de estos compuestos para disminuir el estreñimiento en pacientes con ERC.
Se necesitan más investigaciones para identificar intervenciones específicas, pero el eje intestino-riñón sigue siendo un objetivo terapéutico prometedor en el tratamiento de la ERC. Estas estrategias resaltan el potencial de mejorar la salud intestinal para mejorar los resultados renales, un potencial que sigue creciendo con los avances en la investigación del microbioma y la nefrología.
MICROBIOTA EN LAS ENFERMEDADES GLOMERULARES
En la nefropatía IgA, se ha descrito una predominancia de Actinobacteria llegándose incluso a postular como un posible marcador de la enfermedad. También se ha visto que el ácido beta-hidroxibutírico es inversamente proporcional al riesgo de nefropatía IgA [111]. Este ácido es un cuerpo cetónico que actúa como agente antioxidante, antiinflamatorio, antiapoptótico y se sabe que regula las células madre, protege la barrera intestinal favoreciendo la unión de las células epiteliales y promueve la secreción de IgA [112][113][114][115].
MICROBIOTA EN LA LITIASIS RENAL
La litiasis renal es un conocido factor de riesgo independiente de desarrollo de ERC, de riesgo cardiovascular y de fracturas, y su prevalencia está en aumento. Se ha descrito su asociación con alteraciones en la microbiota, principalmente Oxalobacter formigenes y Lactobacillus spp. En el año 2021, se inició un proyecto para investigar la relación existente entre litiasis y microbiota, denominado MICROCOSM — MICRObiome contributes on the Complexity Of the Stone Matrix. En él, los expertos llegan a un consenso donde estandarizan protocolos para reducir los sesgos experimentales y las dificultades que pueden surgir en el estudio de la microbiota [116].
MICROBIOTA EN EL FRACASO RENAL AGUDO
El fracaso renal agudo (FRA) tiene una incidencia del 10-20% en pacientes hospitalizados y del 20-50% en cuidados intensivos. Su prevalencia aumenta con la edad. Afecta aproximadamente a 13 millones de personas por año y es por sí solo, un factor de riesgo independiente de mortalidad. Una de cada 4 personas que tuvieron un FRA, fallecen dentro del primer año.
Dentro de los factores predictores de mortalidad del FRA, se encuentra la sobrecarga de volumen de más del 10% [117]. Ella, junto a la hipoperfusión y la uremia van a aumentar la permeabilidad de la barrera intestinal reduciendo las proteínas de unión de las células epiteliales y favoreciendo la fuga de endotoxinas al torrente sanguíneo. Esto genera una activación del sistema inmunológico innato desencadenando una respuesta proinflamatoria y estrés oxidativo. Los patógenos que liberan LPS estimulan al factor nuclear kappa B (NF-kB) que dará a su vez TNF, IL-1, IL-6, IL-8, COX-2, C5F1, entre otros.
Además del daño de la barrera intestinal, en el FRA se modifica la microbiota aumentando las bacterias patógenas que producirán toxinas urémicas y disminuirán las bacterias comensales, con lo que se reducirá la producción de AGCC. Además, sabemos que en la necrosis tubular aguda se deterioran las células epiteliales, con lo que disminuirá la expresión del transportador de aniones orgánicos 1 y 3, que es importante en la eliminación de dichas toxinas, con lo que habrá un mayor acúmulo de las mismas [118].
Estas toxinas, tanto las unidas a proteínas (IS y p-cresol) como aquellas de bajo peso molecular solubles en agua (TMAO), van a contribuir para que ese deterioro agudo de la función renal progrese a una ERC. El IS favorecerá al acúmulo de sustancias reactivas de oxígeno, daño del ADN, detención del ciclo celular en las células tubulares del riñón y fibrosis renal [119][120]. El acúmulo de p-cresol sulfato inducirá TWEAK-Fn14 que contribuye a la fibrosis de las células endoteliales renales [121]. También se ha asociado TMAO con dicha progresión [122].
Así es como la alteración en la microbiota está implicada en la progresión de la enfermedad renal aguda hacia la cronicidad, lo que sucede hasta en un 70% de los casos.
De forma más específica, se ha descrito en pacientes con sepsis, una alteración en la microbiota manifestada como la disminución de F. prausnitzii, productor de butirato, y Bifidobacterium sp con propiedades inmunorreguladoras. Además, los pacientes sépticos tienen bajos niveles de acetato y propionato. El primero participa en la eliminación de los microorganismos patógenos, y el segundo en la inmunoregulación, hemodinámica y fibrosis cardíaca. Así es como se han ensayado probióticos como Bifidobacterium sp con lo que se ha conseguido una reducción de LPS y marcadores de inflamación, y, AGCC como el acetato como regulador de la NADPH-oxidasa de los linfocitos T, contrarrestando el estrés oxidativo de la sepsis [123],[124]. Sin embargo, no se ha visto que los probióticos reduzcan la mortalidad a seis meses, en pacientes con FRA asociado a sepsis [125]. Se ha descrito que una microbiota sana, juega un papel protector sobre el riñón [126].
Conclusiones
El eje intestino-riñón implica interacciones complejas influenciadas por la inflamación sistémica, la endotoxemia, el estrés oxidativo y los metabolitos derivados de la fermentación de proteínas y carbohidratos, y AGEs de la dieta. Cada una de estas vías contribuye a un circulo de inflamación, activación inmunitaria y estrés oxidativo, creando un estado de retroalimentación que acelera la progresión de la ERC. Abordar estos mecanismos, posiblemente a través de intervenciones dietéticas, prebióticos y terapias dirigidas a las toxinas urémicas, puede proporcionar nuevas estrategias para frenar la progresión de la enfermedad renal y mejorar el estado de salud del paciente.
Un entendimiento integral del eje intestino-riñón enfatiza la importancia de controlar la microbiota en la ERC y destaca la necesidad de investigaciones en un futuro centradas en tratamientos específicos.
El eje intestino-riñón es parte de una red más amplia a veces denominada eje intestino-riñón-cardiovascular (cardíaco) debido a los efectos interrelacionados de la disbiosis y las toxinas urémicas en la salud renal y cardiovascular. Este eje tiene un impacto significativo en la enfermedad cardiovascular asociada con la ERC. La disbiosis y las toxinas urémicas en el intestino pueden provocar un aumento de la incidencia de aterosclerosis, hipertensión y enfermedad cardíaca en pacientes con ERC. La acumulación de sulfato de IS, PCS y TMA crea un estado proinflamatorio y prooxidativo que exacerba las enfermedades renales y cardiovasculares. Esta relación subraya la importancia de controlar la salud renal y los factores de riesgo cardiovascular mediante un enfoque centrado en el intestino.
Nuestra comprensión de las funciones específicas de la microbiota y los mecanismos en el eje intestino-riñón tiene importantes lagunas. Se necesita más investigación sobre las vías de señalización microbiana que vinculan la disbiosis, la inflamación sistémica y la fibrosis renal, así como sobre las especies microbianas individualizadas y los cambios del microbioma a lo largo del tiempo. Esta investigación es crucial para mejorar las estrategias terapéuticas.
Los probióticos de próxima generación dirigidos a cepas bacterianas específicas y las técnicas de modulación precisa del microbioma ofrecen opciones de tratamiento prometedoras. Las terapias individualizadas basadas en el microbioma único de un paciente podrían mejorar la salud intestinal y renal al reducir las toxinas y fortalecer la barrera intestinal.
En la enfermedad renal crónica (ERC) con un ciclo de urea activado, apuntar a la producción o absorción de amonio intestinal puede reducir los niveles de toxinas urémicas, posiblemente utilizando inhibidores de la ureasa o adsorbentes de amonio especializados.
En resumen, el eje intestino-riñón es un objetivo prometedor para el manejo de la ERC y sus complicaciones. Al abordar la disbiosis intestinal, reducir las toxinas urémicas y mejorar la integridad de la barrera intestinal, las intervenciones terapéuticas centradas en el microbioma tienen el potencial de enlentecer la progresión de la ERC. Es esencial realizar más investigaciones para desarrollar tratamientos basados en el microbioma que podrían revolucionar el manejo de la enfermedad renal.