Desgaste proteico energético en la enfermedad renal crónica
RESUMEN
La presencia de malnutrición es bien conocida en la enfermedad renal crónica (ERC). El descubrimiento en los últimos 15 años de los mecanismos fisiopatólogicos que desencadenan este proceso, tales como la anorexia, el aumento del catabolismo proteico y la inflamación ha generado la necesidad de una nueva denominación por la Sociedad Renal Internacional de Nutrición y Metabolismo (ISRNM): “protein energy wasting syndrome” (PEW). Los objetivos de este documente son en un primer paso proponer la utilización del término Desgaste Proteico Energético (DPE) como una traducción más fiel al término anglosajón, y realizar una actualización de los mecanismo implicados, que son inherentes al término DPE. Simultáneamente, revisamos las últimas evidencias epidemiológicas que ponen de manifiesto la relevancia de la malnutrición y su impacto tanto en mortalidad como morbilidad en la ERC. Por último ponemos de manifiesto la necesidad de redefinir los criterios diagnósticos de DPE que sean aplicables a la población española con ERC. Los criterios establecidos por la ISRNM creemos que no son extrapolables a las diferentes poblaciones, como ocurre por ejemplo con las diferencias antropométricas interraciales. La información ha sido obtenida, fundamentalmente, a partir de las últimas publicaciones consenso de la ISRNM.
Concepto clave
- El término desgaste proteico–energético se define como un estado patológico donde hay un descenso o desgaste continuado tanto de los depósitos proteicos como de las reservas energéticas.
- Los mecanismos fisiopatológicos implicados en el DPE son anorexia y aumento del catabolismo proteico, que dan lugar a un desequilibrio energético con el resultado final de un aumento del gasto energético.
- Para un correcto diagnóstico de DPE se requiere la valoración de marcadores bioquímicos, composición corporal, cálculo de pérdida de musculo e ingesta dietética.
- La presencia de DPE se asocia a un aumento en el riesgo cardiovascular, inflamación, y tendencia a procesos infecciosos; con un aumento de la hospitalización y empeoramiento de la calidad de vida.
- La presencia de DPE explica el conocido fenómeno de Epidemiología inversa, donde los factores de riesgo tradicionales aparecen como factores de protección. El DPE sin embargo se sitúa entre los factores de riesgo de mortalidad en la población con ERC.
INTRODUCCIÓN
La insuficiencia renal crónica (IRC) se caracteriza por alteraciones nutricionales e inflamación sistémica que se acompaña de un aumento del catabolismo, lo que incrementa la morbimortalidad. Las alteraciones del estado nutricional se han descrito en la literatura con numerosos y confusos términos como malnutrición, sarcopenia, caquexia o síndrome de malnutrición-inflamación-aterosclerosis. Tales denominaciones describen una parte del problema, pero no engloban los múltiples mecanismos que influyen en la salud y el pronóstico del paciente. En 2008, la Sociedad Internacional de Nutrición Renal y Metabolismo (ISRNM) propuso la adopción del término protein-energy wasting (PEW) como nomenclatura unificadora y punto de partida hacia un mejor conocimiento y tratamiento de estos problemas en el paciente urémico. El término PEW no presenta una traducción fácil al castellano y desde el Grupo de Trabajo en Nutrición de la Sociedad Española de Nefrología (S.E.N.) proponemos la utilización del término «desgaste proteico energético» (DPE) como traducción más fiel del término anglosajón.
El síndrome de DPE es muy frecuente en el paciente renal, ocasiona un deterioro de su calidad de vida y acorta la supervivencia a corto plazo. Sin embargo, lamentablemente, muchos centros aún no incorporan medidas de valoración y monitorización del estado nutricional. Asimismo, la nutrición adecuada es una estrategia a veces olvidada en el manejo de los pacientes renales.
Podemos definir el síndrome de DPE como una entidad patológica única en donde confluyen alteraciones puramente nutricionales con condiciones catabólicas. Ambas están fisiopatológicamente relacionadas, potenciadas entre sí, y crean un círculo vicioso que dificulta en la práctica clínica diferenciar ambos componentes. El enfoque diagnóstico y terapéutico de los pacientes con DPE debe ser multifactorial, intentando tratar todos y cada uno de los factores que podamos identificar, ya que la repleción nutricional es insuficiente como único tratamiento, ya que no frena la proteólisis subyacente. Con la intención de ofrecer una visión actualizada del conjunto de alteraciones catabólicas englobadas en el síndrome de DPE, describimos los principales conceptos, mecanismos e implicaciones de este estado.
CONCEPTO Y TERMINOLOGÍA
El DPE [1] se define como un estado patológico donde hay un descenso o desgaste continuado tanto de los depósitos proteicos como de las reservas energéticas, incluyendo pérdida de grasa y músculo. Antes de introducir en nuestra terminología este nuevo concepto, debemos detenernos brevemente en el concepto de malnutrición-desnutrición y su diferencia con otros términos como el síndrome de wasting o desgaste, para así poder entender el carácter unificador del término DPE.
El término «malnutrición» engloba los estados patológicos provocados tanto por exceso como por defecto de nutrientes. Sin embargo, generalmente se utiliza en la uremia para referirse a la desnutrición, es decir, a los trastornos derivados del déficit de macro y micronutrientes [2].
Por «desnutrición» entendemos un trastorno de la composición corporal caracterizado por un exceso de agua extracelular, asociado con frecuencia a disminución del tejido muscular y grasa, hipoproteinemia y déficit de potasio, que interfiere con la respuesta normal del huésped a su enfermedad y tratamiento. La «desnutrición calórica-proteica» se produce cuando las necesidades diarias no son cubiertas por la dieta. Revierte en muchos casos con la recuperación de la ingesta y la resolución del problema de base. La desnutrición calórica-proteica puede dividirse en tres grandes síndromes clínicos:
Marasmo o desnutrición calórica: se desarrolla de forma gradual tras meses o años de ingreso energético insuficiente. El paciente aparece caquéctico, con pérdida generalizada de masa muscular y ausencia de grasa subcutánea. El resultado es un síndrome de consunción generalizado (síndrome de emanciamiento), con importante pérdida peso, reservas generalmente normales de proteínas viscerales y empeoramiento de las medidas antropométricas.
Kwashiorkor, desnutrición proteica o hipoalbuminémica: su inicio y su desarrollo son mucho más rápidos y es modulada por hormonas y citocinas que actúan disminuyendo los depósitos orgánicos de proteína visceral. Intervienen citocinas como interleucina (IL)-1 y factor de necrosis tumoral (TNF) que median en la respuesta inmune del huésped al estrés y producen cambios en los reactantes de fase aguda, como el fibrinógeno a expensas de albúmina. El descenso en la producción, junto con un exacerbado catabolismo, conduce a una marcada hipoalbuminemia. Recientemente se ha implicado a la microbiota intestinal en el Kwashiorkor.
Mixta: muy frecuente en el paciente hospitalizado. Suele darse en aquellos sujetos previamente desnutridos que sufren un proceso agudo intercurrente provocando una desnutrición calórico-proteica.
La característica fundamental de la desnutrición es un descenso de peso. La supervivencia durante el ayuno se relaciona con el volumen de almacenamiento graso existente. Los cambios en la composición corporal se reflejan como un aumento relativo del agua extravascular, descenso de los depósitos grasos y descenso de la masa magra corporal. Es importante resaltar que el peso puede aumentar durante una enfermedad aguda grave, por paso de líquidos al tercer espacio. Las alteraciones presentes en la uremia reflejan en cierta manera una desnutrición mixta, aunque cursa con una intensidad moderada y no es el resultado de un proceso agudo intercurrente, sino de una inflamación crónica de baja intensidad.
El término de «caquexia» representa un complejo síndrome metabólico asociado a una enfermedad crónica y está caracterizado por pérdida gradual del tejido muscular, acompañado o no por pérdidas concomitantes de reservas grasas. La caquexia representa, sin embargo, un grado extremo de consunción que raramente se observa en la ERC avanzada.
El término «wasting» o «desgaste» fue propuesto por la Organización Mundial de la Salud en 1988 [3] y se define como una pérdida involuntaria de peso superior al 10 % del basal en ausencia de infección oportunista, enfermedad tumoral o diarrea crónica. Es un síndrome multifactorial y en ocasiones es difícil conocer la causa principal. Se caracteriza por pérdida desproporcionada de masa magra debido a alteraciones específicas en el metabolismo, como parte de un mecanismo de defensa del organismo en respuesta a una situación de estrés. Esta situación mantenida conduce a una depleción de proteínas, sobre todo del músculo esquelético, y no se recupera con la ingesta, ya que todo el proceso es debido a cambios metabólicos celulares.
Es de gran importancia adoptar una terminología común en castellano, y el concepto de DPE consensuado por el Grupo de Nutrición de la S.E.N. pensamos que representa fielmente el espíritu de la nomenclatura PEW de la ISRNM. Este término describe los mecanismos implicados y de esa manera permite identificar dianas terapéuticas, utilizar los métodos apropiados de monitorización y elegir el abordaje terapéutico más eficaz. Reconocemos que el término «desgaste» conlleva menor gravedad clínica que el proceso de «emanciamiento» que puede ocurrir en los pacientes con enfermedad renal. Sin embargo, en la elección de términos y acrónimos debemos sopesar la ventaja de llegar, con un lenguaje más sencillo, a impactar en los profesionales sanitarios acerca de la necesidad de identificar y tratar estos desórdenes catabólicos. La terminología de DPE evita la inclusión de términos como malnutrición o catabolismo, con el fin de no dar más importancia a uno de los componentes. Y es que en estas alteraciones tanto la desnutrición como el catabolismo muscular confluyen y están fisiopatológicamente relacionados, por lo que es imposible diferenciar uno del otro en la práctica clínica. Así, DPE implica tanto la pérdida acelerada de proteína (músculo) como de energía (grasa).
MECANISMOS IMPLICADOS EN EL DESGASTE PROTEICO ENERGÉTICO
Las alteraciones implicadas en la malnutrición de la insuficiencia renal han sido recientemente revisadas por la ISRNM [4]. La anorexia [5] y el aumento del catabolismo proteico [6] dan lugar a un desequilibrio energético, con un resultado final de un aumento del gasto energético [7] y del consumo de las fuentes de almacenamiento energético.
Otros mecanismos fisiopatológicos implicados en el DPE de la ERC son la acidosis metabólica [8], las alteraciones endocrinas [9] [10], la inflamación [11] [12] y la activación del sistema ubiquitina-proteasoma (UPS) [13] [14]. Simultáneamente, otros aspectos como la dieta restrictiva, la pérdida de aminoácidos y micro-macronutrientes [15] por las técnicas de diálisis, la pérdida de sangre, la sobrecarga de volumen [16] y otros factores psicosociales alteran el balance energético.
Pérdida de masa muscular (wasting)
El término sarcopenia define una situación de pérdida de masa y fuerza muscular importante y de etiología multifactorial, donde puede intervenir un déficit de ingesta, alteraciones hormonales, daño neuropático, alteraciones metabólicas y presencia de toxinas urémicas [17]. Representa un tipo de atrofia muscular crónica y en la ERC se asocia con DPE, limitando la autonomía del paciente y la calidad de vida. Produce compromiso de órganos vitales con deterioro respiratorio, músculo esquelético y del músculo cardíaco [18]. La disminución en la ingesta, la acidosis metabólica, la inactividad física, la diabetes y la sepsis son factores asociados en la ERC que aumentan la proteólisis muscular, mediante un aumento del catabolismo, activación de distintas señales intracelulares de apoptosis de la célula muscular y disminución en la síntesis. Varios estudios demuestran una atrofia significativa de las fibras musculares en la ERC [19] [20] [21] (Tabla 1).
Uno de los principales mecanismos por los que el DPE se asocia a la atrofia muscular en la uremia es el aumento del catabolismo proteico mediado por el UPS y la activación de la miostatina a nivel del músculo esquelético. El sistema UPS degrada proteínas musculares y la miostatina es un miembro de la familia factor de crecimiento transformante β (TGF-β) que inhibe la proliferación celular y la síntesis de músculo [22]. La activación intracelular de la vía de las caspasas y la miostatina estimulan la degradación proteica proveyendo el sustrato para el sistema UPS y la apoptosis celular. El extenso tejido dañado lleva a una aumento de actina circulante que puede consumir gelsolina (proteína encargada del ensamblaje y desensamblaje de la actina) y otras proteínas como la vitamin D binding protein que tienen una función protectora [23].
Niveles circulantes elevados de actina y bajos de gelsolina en pacientes en hemodiálisis se asocian con riesgo elevado de mortalidad. El aumento del catabolismo proteico y la acumulación de toxinas urémicas producirían una alteración en la síntesis de gelsolina, con pérdida de la capacidad de ensamblar actina, activación plaquetaria, disfunción endotelial e incremento de susceptibilidad a complicaciones infecciosas [24].
Otro mecanismo recientemente descrito es la resistencia a la insulina. El factor de crecimiento insulínico tipo 1 (IGF-1) activaría la vía de la fosfatidilquinasasl-3 alterando el metabolismo proteico, favoreciendo una sobrerregulación de la miostatina con disminución de la proliferación de las células musculares satélites [25].
CRITERIOS DIAGNÓSTICOS DE DPE PROPUESTOS POR LA ISRNM
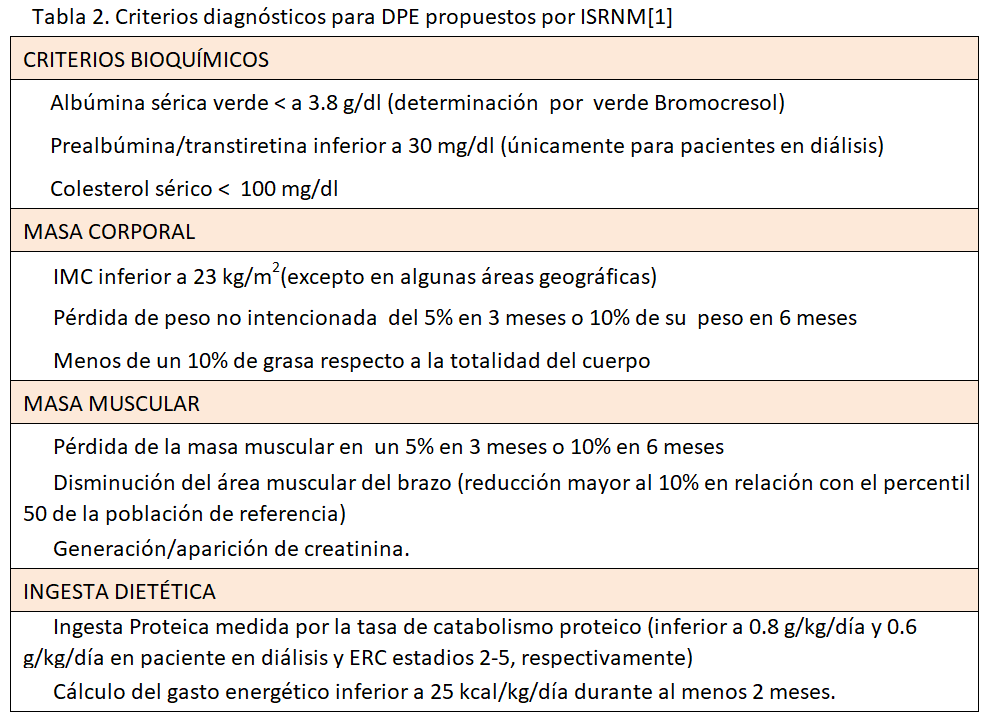
Un avance importante es la consideración del síndrome de DPE como una entidad patológica única en donde confluyen la desnutrición y el hipercatabolismo. El abordaje terapéutico eficaz del DPE no podrá llevarse solo a cabo con mera repleción nutricional, ya que persistirá la proteólisis. Un síndrome de origen multifactorial requerirá un criterio diagnóstico y una terapia integral. La ISRNM ha recomendado criterios diagnósticos (Tabla 2). Se requiere cumplir al menos un criterio en tres de las cuatro categorías propuestas (criterios bioquímicos, masa corporal, masa muscular e ingesta) [1] (Tabla 2).
Estos criterios son inicialmente atractivos por su ámbito multifactorial (analítico, antropométrico y nutricional), pero cuando tratamos de aplicarlos a la práctica clínica diaria resultan confusos. Leinig et al. [26] no encontraron ningún paciente que presentase alteraciones en tres de las cuatro categorías señaladas por la ISRNM y al redefinir el síndrome de DPE como alteración en dos de los cuatro compartimentos encontraron una prevalencia del 17%, anormalmente baja si la comparamos con la prevalencia del 65% al diagnosticarlo por encuesta de valoración global subjetiva (SGA). Otro ejemplo de la validez cuestionable de estos criterios lo hallamos en el trabajo de Drechsler et al. [27], donde analizaron la relación entre DPE y mortalidad cardiovascular y de otras causas en una cohorte de 1255 pacientes diabéticos en hemodiálisis periódica. Observaron que ningún paciente cumplía los criterios de DPE propuestos por la ISRNM. En este caso los autores redefinieron los criterios de la ISRNM, considerando DPE si el índice de masa corporal (IMC), la albúmina y la creatinina sérica eran inferiores a la mediana de los pacientes estudiados. Este artículo tiene limitaciones derivadas de que toda la población estudiada era diabética, con la consecuente asociación a obesidad, por lo que tras los ajustes encuentran una prevalencia de DPE del 16%.
Tras la publicación en el 2008 de los criterios de DPE, se realizó el estudio observacional prospectivo ARNOS [28] en el cual simplifican los criterios y describen un nuevo score PEW-2014 (Tabla 3), dicho nuevo score se ha asociado a mortalidad precoz. La importancia de Creatinina plasmática como biomarcador de pérdida de masa muscular (sarcopenia), se describe una buena correlación entre Creatinina plasmática y masa muscular, siendo la creatinina plasmática < 3,8 mg/dL/m2 una variable independiente asociada a mortalidad [29].
Desde un punto de vista crítico, opinamos que los criterios de la ISRNM presentan limitaciones que debemos tener presentes. Estos criterios todavía deben demostrar en estudios prospectivos la superioridad a otras posibles combinaciones diagnósticas antes de generalizarse su implantación. Observaciones recientes ilustran este hecho al sugerir en una población de 570 pacientes en hemodiálisis que solo la presencia de hipoalbuminemia tenía un valor predictor de mortalidad similar o mayor que la suma de varios de los marcadores de malnutrición propuestos por la ISRNM [30]. Sin embargo, a menudo olvidamos que predicción de mortalidad no necesariamente se equipara a diagnóstico de malnutrición, y los puntos de corte sugeridos se basan en muchas ocasiones en análisis de supervivencia. En segundo lugar, los puntos de corte de los parámetros propuestos derivan de poblaciones americanas, planteando la duda de si son extrapolables a otras distribuciones geográficas y de estilo de vida, como Europa, Asia o, en el caso que nos ocupa, los países de la franja mediterránea. En tercer lugar, la población de diálisis cada vez es más anciana, y resulta difícil separar los cambios nutricionales y de composición corporal que ocurren con la edad de la malnutrición derivada de la uremia. Por todo ello, es lógico pensar que los criterios diagnósticos de DPE en la ERC deben adaptarse y variar en diferentes contextos demográficos (edad, raza), situaciones clínicas (obesidad, diabetes, ERC moderada, avanzada, diálisis y trasplante) y contextuales (hábitos de vida, situación geográfica y cultural) [31].
En conjunto, estos datos nos lleva a concluir, que si bien los criterios propuestos por la ISRNM refuerzan el carácter complejo del síndrome de DPE, se basan en unas determinaciones/mediciones que pueden ser cuestionables de forma individualizada [32] y, por otro lado, todavía no han demostrado validez diagnóstica o pronóstica. Sin embargo, consideramos un paso importante el resaltar por vez primera en esta definición el carácter multifactorial del DPE y la necesidad del uso de diversos marcadores complementarios del estado nutricional.
Criterios diagnósticos de DPE propuestos por las guías KDOQI 2020
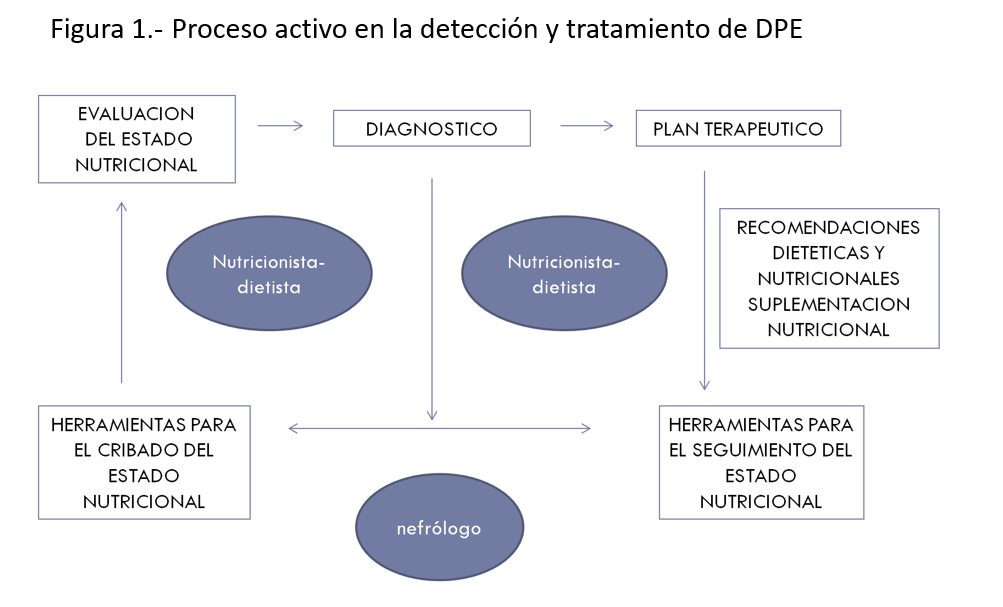
Recientemente en 2020, se han publicado las guías KDOQI sobre malnutrición y ERC. El primer punto de interés en estas guías es la evidencia y recomendación del cribado y seguimiento de la malnutrición, reflejando el carácter dinámico del proceso de malnutrición que presentan los pacientes con ERC (Figura 1), estableciendo la recomendación de realizar valoración nutricional anual si ERC E3 y cada 6 meses si ERC E4-5.
También introducen la necesidad de un nutricionista, dietista o incluso enfermería especializada para la realización de los métodos de cribado de malnutrición en los pacientes con ERC.
Según las recomendaciones de las guías, en el caso de tener una persona especializada en realizar valoración nutricional (enfermería y dietista), recomiendan la utilización de la escala SGA (1B) y escala MIS (2C). En la práctica clínica la utilización de dichas escalas tienen como puntos positivos que es barato, no invasivo, puede aplicarla distintos profesionales, da una puntuación global del estado nutricional proteico-energética y la escala SGA se centra en la ingesta de nutrientes y la composición corporal. En su contra tenemos que la escala SGA es lento y el personal capacitado para llevar a cabo no siempre están disponibles; entrenamiento es necesaria para asegurar resultados consistentes entre diferentes examinadores; proteinas viscerales no están incluidas y no incluyen marcadores de inflamación.
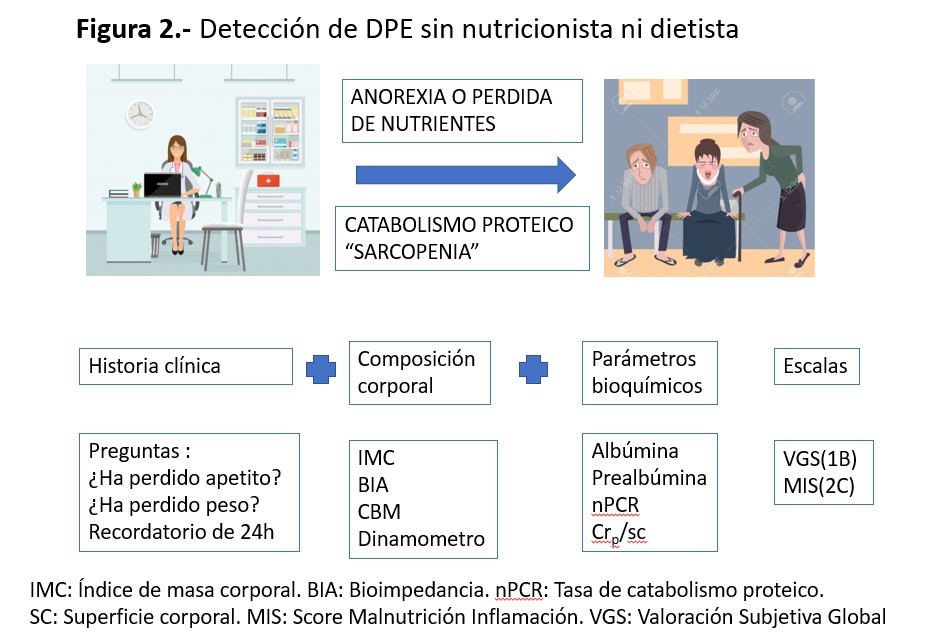
Aunque cada vez más en las unidades de ERCA y diálisis están incluyendo personal especializado en valoración y detección de malnutrición, la realidad en la práctica clínica es que el nefrólogo se encuentre solo y tiene que ser quien detecte y realice dicha valoración y seguimiento, para lo cual recomiendan la utilización de herramientas como marcadores bioquímicos, antropométricos e ingesta dietética muy similares a los criterios de DPE de la ISRNM (Figura 2).
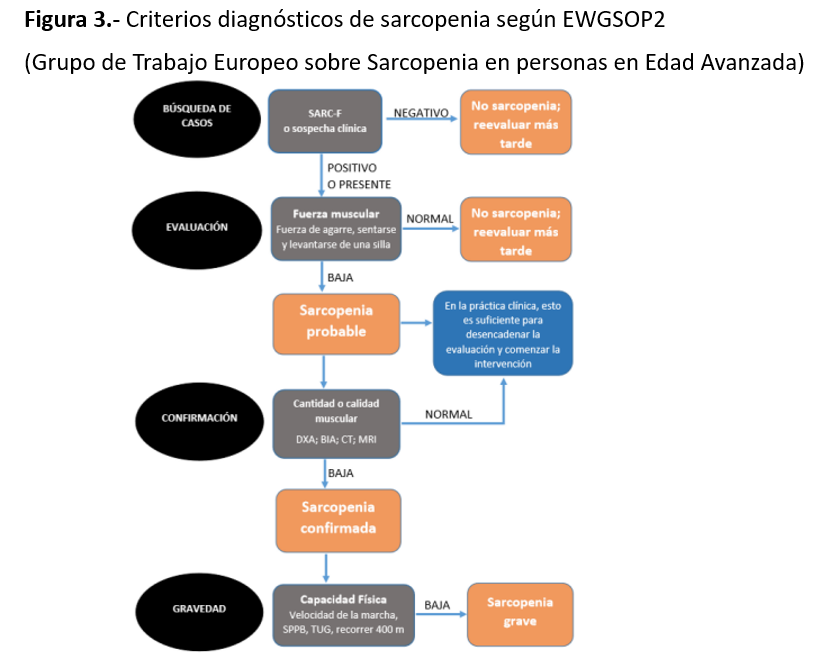
La valoración de la composición corporal en el paciente en diálisis es difícil por la retención de líquido, presencia de inflamación, aumento del gasto energético, ingesta disminuida y aumento del catabolismo proteico que va a producir en los distintos compartimentos tanto pérdida de masa magra como proteica y alteración en la distribución del agua corporal total. En las últimas guías KDOQI dan relevancia al uso de la BIA en diálisis para la valoración de dichos cambios en la composición corporal. En estudios con BIA multifrecuencia se observa que los pacientes en diálisis con el tiempo presentan un aumento en el parámetro de sobrehidratación a expensas sobre todo a una disminución en el compartimento de agua intracelular, mientras que el agua extracelular no presenta cambios significativos en el tiempo. La disminución de agua intracelular después de la diálisis se correlacionó con atrofia muscular, inflamación y fue un factor de riesgo independiente de mortalidad [33]. Asimismo, empleando los criterios del Grupo de Trabajo Europeo sobre Sarcopenia en personas en Edad Avanzada (EWGSOP2) [34] (Figura 3), se observó que aplicando los criterios de funcionalidad muscular, la prevalencia de sarcopenia alcanzaba el 78%, poniendo de relevancia la importancia del ejercicio físico en pacientes para impedir el proceso de sarcopenia [35].
PREVALENCIA DEL DPE
Tradicionalmente se ha definido la prevalencia del DPE en la población de diálisis oscilan dentro de un amplio rango del 18-75 % [26]. Ciertamente, la imprecisión de estas cifras nos impide sacar conclusiones válidas. Uno de los problemas es la variedad de las herramientas de valoración y monitorización y de los puntos de corte que se han empleado para obtener estas cifras. En el caso de la hipoalbuminemia, se ha definido en la literatura con cifras de < 4, < 3,8 o < 3,5 g/dl, con la dificultad añadida de variar su estimación en función de la metodología empleada (bromocresol púrpura o bromocresol verde). Así, no es de extrañar que la prevalencia varíe en gran medida con la metodología empleada para su estimación. Una muestra de ello nos la dan dos estudios de Brasil [26] y Europa [30]. La prevalencia de DPE varió entre un 23 % y un 74 %, dependiendo de si se definió por herramientas bioquímicas (albúmina, creatinina), antropométricas (perímetro del brazo, IMC) o nutricionales (SGA, ingesta energética/proteica). Lo mismo ocurre con otros estudios multicéntricos, como los realizados en Estados Unidos, donde describen una prevalencia del 38 % [36]. Por último, y no por ello menos importante, la prevalencia del DPE en distintos países será un reflejo de la situación económica, el grado de desarrollo y la prevalencia de la malnutrición en la población general, haciendo que sea imposible hablar de una prevalencia general a la población de diálisis. Esto también se aplica a la prevalencia en distintas regiones con más o menos recursos de una misma ciudad, provincia o país.
En España, los primeros estudios sobre prevalencia de malnutrición datan de 1994 Lorenzo et al [37] analizaron en 29 pacientes en hemodiálisis crónica el estado nutricional por medio de medidas antropométricas como pliegue tricipital (PT) , circunferencia muscular del brazo (CBM), índice de masa corporal (IMC) , proteínas viscerales (albúmina) la tasa de catabolismo proteico normalizado (nPCR) y la ingesta proteica. En dicho estudio observaron que en una proporción considerable de pacientes (65%) la reducción de las reservas de grasas y proteínas es más importante que lo que indicaba la única recogida del peso corporal relativo (deficiente sólo en el 38% de ellos).
En ese mismo año, el Estudio Cooperativo de Nutrición en hemodiálisis [38] [39] publicaron las primeras y únicas tablas de parámetros antropométricos de una población española en hemodiálisis (761 pacientes) y simultáneamente analizaron la malnutrición según parámetros antropométricos y marcadores bioquímicos (albúmina, TRF, recuento de linfocitos). En ese análisis la prevalencia de malnutrición fue del 51,6% en hombre y del 46,3% en mujeres. Los predictores de malnutrición fueron la edad avanzada, el índice de comorbilidad, el sexo masculino, el tiempo en hemodiálisis y el nPCR. En el estudio multicéntrico Dialysis Outcomes and Practice Pattern Study (DOOPS) [40], los resultados recogidos observaron una importante variación en la monitorización de los parámetros nutricionales, siendo España uno de los países más deficitarios en la recogida de dichas medidas. Así la tasa de catabolismo proteico se realizaba sólo en el 20% de las unidades de diálisis en España en comparación con el 90% en Alemania, y además la presencia de dietista existía solo en un 20% de las unidades en España comparado con un 85% en UK. A pesar de dichas variaciones, no hubo diferencias significativas en los resultados de las cifras de albúmina sérica 3,98 g/dl, Creatinina 9,1 mg/dl, índice de masa corporal (IMC) 23,9 kg/m2 con el resto de países europeos. Si que hubo diferencias significativas en la prevalencia de malnutrición moderada según la escala SGA, con un 11,2% en España (la menor tasa) comparado con Francia que presentó un 18%.
Debemos mencionar que los estudios hasta ahora citados incluyen pacientes estables, por lo que existe un sesgo al eliminar al paciente crítico o agudamente enfermo y que probablemente presente DPE. Este hecho nos conduce a pensar que la prevalencia de DPE puede ser incluso mayor de lo que aquí se reseña. Así, en un reciente análisis de nuestra unidad hemos observado una prevalencia de DPE según los criterios de la ISRNM del 37%, que se incrementó al 41,1% cuando los pacientes se siguieron durante dos años [41]. Aunque el tamaño muestral es relativamente pequeño, el estudio incluyó a todos los pacientes de la unidad de diálisis (sin exclusiones) y se usaron los criterios de DPE de la ISRNM.
Las últimas guías de la S.E.N. de nutrición en ERC avanzada publicadas en el año 2008 [42] recomiendan valorar el estado nutricional mediante la determinación de marcadores nutricionales, bioquímicos, antropométricos y de ingesta energética y proteica.
IMPLICACIONES CLÍNICAS
Es conocido que los pacientes con ERC tienen una alta tasa de mortalidad [43] [44] [45] especialmente cardiovascular [46]. Sorprendentemente a pesar de corregir los factores cardiovasculares tradicionales ya conocidos como hipertensión, dislipemia, hipertrofia ventricular izquierda y mejorar las técnicas de diálisis [47] sigue persistiendo una alta tasa de mortalidad y riesgo cardiovascular no explicado. En este punto surgen los factores de riesgo noveles como el DPE. Un ejemplo de la relevancia de dichos factores de riesgo no tradicionales, es el fenómeno de epidemiología inversa, donde marcadores que en la población general se asocian con menor probabilidad de eventos cardiovasculares como el descenso de IMC o bajos niveles de colesterol se asocian con mayor presencia de enfermedad cardiovascular y menor supervivencia en pacientes en diálisis [48].
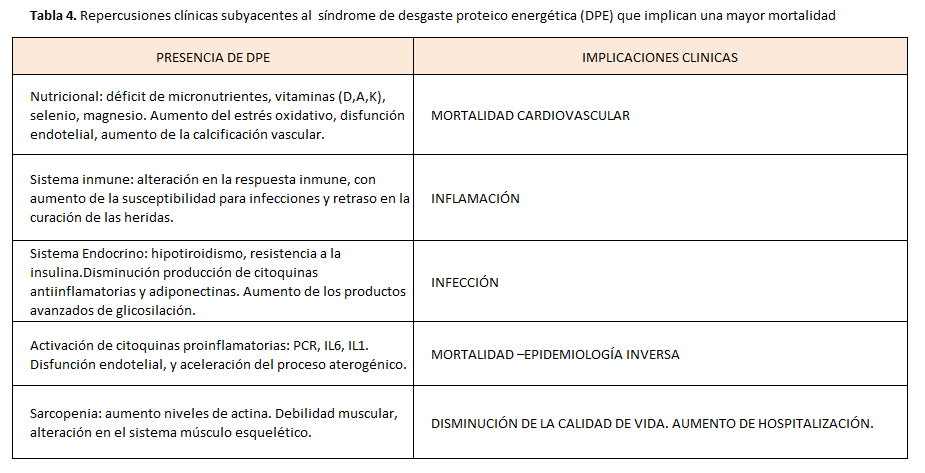
La presencia de DPE conlleva en el paciente renal la activación de distintos mecanismos compensatorios y desregulación de otros, que afecta a los distintos órganos y sistemas incluyendo sistema inmune, endocrino, músculo-esquelético, tejido adiposo , hematopoyéico, gastro-intestinal y mala adaptación a la activación de la cascada inflamatoria [49] [50] con lo que aumenta la mortalidad global (Tabla 4).
DEP y mortalidad cardiovascular
En pacientes con ERC avanzada, la malnutrición y la presencia de DPE se relacionan de forma importante con la mortalidad cardiovascular [51] [52].
Todos los nutrientes (grasas, carbohidratos, proteínas, minerales, vitaminas y agua) desempeñan una función esencial en el organismo y son necesarios para su correcto funcionamiento. Las necesarias restricciones dietéticas en el paciente urémico para limitar la ingesta de potasio, fósforo o sodio, entre otros, puede conducir a deficiencias en otros nutrientes esenciales si no existe consejo y dirección por parte del personal sanitario en lo referente a alternativas dietéticas para el paciente. Los nutrientes esenciales son necesarios para la síntesis de tejido y producción de energía, al tiempo que son coenzimas en la mayoría de reacciones enzimáticas del organismo. Por tanto, no resulta extraño que carencias nutricionales especificas como la deficiencia en selenio, magnesio o vitamina D, tan comunes en el paciente renal, tengan consecuencias negativas en la capacidad antioxidante, anti-inflamatoria y el metabolismo óseo mineral. Por ello, el DPE se asocia a un mayor riesgo de infecciones del acceso, peritonitis y muerte por causas infecciosas [31] [53].
Micronutrientes interesantes en este sentido son las vitamina A, K y D [54] [55], cuyo deficit en el paciente en hemodialisis conlleva un aumento de mortalidad cardiovascular. Recientes estudios describen un déficit de vitamina K de casi el 80% en pacientes en HD. La ingesta de vitamina K en pacientes en HD suele ser insuficiente (140 mcg/día vs 200 mcg/día en pacientes sanos) con lo que aumentan las proteínas inactivas no-carboxiladas y existe una deficiencia subclínica de vitamina K hepática, que puede contribuir a aumentar el riesgo de fracturas óseas y de calcificación vascular. Los suplementos de vitamina K (menaquinona-7) inducen una disminución de las proteínas no carboxiladas en pacientes en HD y el tratamiento prolongado es capaz de aumentar la elasticidad vascular [56] [57] [58].
El DPE propicia un aumento del catabolismo muscular en el paciente urémico, tanto por la falta de nutrientes circulantes como por el efecto combinado de la inflamación sistémica, la acidosis metabólica, las toxinas urémicas y otros factores. La consecuencia es una pérdida de masa muscular que también afecta al tejido muscular de las arterias y el corazón, encontrándose asociaciones directas entre malnutrición, rigidez arterial y alteraciones en la estructura miocárdica. La distensión vascular continuada como consecuencia de la sobrecarga hidrosalina agrava este proceso y propicia la hipertrofia ventricular. Un ejemplo de cómo la desnutrición pura conlleva alteraciones en el sistema cardiovascular data del experimento Minnesota, realizado en 1944 durante la II Guerra Mundial. El objetivo era conocer mejor la fisiopatología de la desnutrición a que se veían sometidos los judíos en los campos de concentración. Se sometió a 36 voluntarios a una disminución controlada de la ingesta que resultó en la pérdida total del 25% del peso. La desnutrición produjo una disminución del volumen cardíaco del 17%, con disminución del gasto cardíaco, bradicardia, hipotensión, y disminución de la oxigenación periférica y de la contractilidad miocárdica [59].
La hipoalbuminemia es el biomarcador más común y frecuentemente usado para medir el DPE en diálisis y es un potente marcador pronóstico de morbimortalidad [60] [61]. Además, la hipoalbuminemia se ha asociado con el desarrollo de novo y recurrencia de insuficiencia cardíaca congestiva en pacientes en hemodiálisis y en diálisis peritoneal [62]. En el estudio 4D realizado en una cohorte de 1255 pacientes diabéticos en hemodiálisis se investigó el efecto del DPE sobre la mortalidad a los cuatro años. La presencia de DPE (definido como IMC 26,7 kg/m2, albúmina sérica < 3,8 g/dl y creatinina < 6,8 mg/dl) duplicó el riesgo de mortalidad global, de muertes debidas a infecciones y de muerte súbita de origen cardíaco, pero no se relacionó con mayor incidencia de infartos de miocardio. La presencia de enfermedad cardiovascular no arteriosclerótica en este estudio tuvo más relevancia en los pacientes con DPE como causa de los eventos cardiovasculares [27].
Las alteraciones hormonales asociadas a la uremia como el hipotiroidismo subclínico [63] o el síndrome de T3 baja [64] se asocian a inflamación y malnutrición [65] y pueden contribuir a la enfermedad cardiovascular. Así, se ha observado una asociación independiente entre hipotiroidismo y mortalidad cardiovascular en pacientes en hemodiálisis [66] [67].
En estudios randomizados la administración de T3-sintético en pacientes con ICC vs placebo en pacientes con hipotiroidismo subclínico, se observó una mejoría en el perfil neuroendocrino con descenso significativo en los niveles de noradrenalina y proBNP. Además se observó un aumento del volumen telediastólico del ventrículo izquierdo con aumento del gasto cardíaco, sin observarse un aumento de la precarga [68]. La disminución en la síntesis de otras hormonas anabólicas como la testosterona [69], también se asocia a una mayor perdida muscular [70], disfuncion endotelial [71], anemia y resistencia a la eritropoietina [72] y mortalidad [73].
DEP E INFECCIÓN Y HOSPITALIZACIÓN
El síndrome urémico se considera un estado de inmunodeficiencia adquirida [74] por lo que los pacientes con ERC tienen un alto riesgo de infección [75]. En el estudio HEMO la infección fue la primera causa de muerte (23%) y el riesgo de mortalidad asociado a una infección durante el ingreso hospitalario fue del 15%. Los factores que predisponen a la infección en el paciente con ERC según el estudio HEMO fueron la edad avanzada, hipoalbuminemia, terapia inmunosupresora y los catéteres como acceso vascular [76]. Paralelamente en el estudio DOPPS [31] la infección es la causa del 55,3% de las muertes en pacientes en HD, que se relacionó con la hipoalbuminemia, bajo nPCR y caquexia.
En su definición de status de malnutrición, DPE conlleva una deficiencia en el sistema inmune y una alteración en la respuesta del huésped, por lo que tienen una mayor susceptibilidad para las infecciones y una lenta recuperación de las heridas [77]. El déficit de ciertos micro-macronutrientes favorece el estado de inmunodeficiencia. Algunos aminoácidos como la arginina y glutamina intervienen y favorecen la respuesta inmune [78]. Un mayor déficit de zinc, vitamina B6 (piridoxina), vitamina C y acido fólico [79] [80] [81] inducen alteraciones en la inmunidad, y ocasionan una disminución en la secreción de anticuerpos, disfunción en la respuesta de los leucocitos polimorfonucleares o linfocitos y retraso en la cicatrización y curación de las heridas. El paciente en hemodiálisis en presencia DPE no sólo estará expuesto a un mayor riesgo de infecciones sino que agravará sus complicaciones, aumentando la mortalidad [82]. Por ejemplo en la infección del virus C se ha observado que la presencia de hipoalbuminemia y un resultado elevado de la escala MIS (inflamation malnutrition score) se asocia independientemente con infección activa y mayor replicación viral [83].
En pacientes hospitalizados un estado nutricional deficiente retrasa la recuperación, prolonga la estancia hospitalaria, incrementa la tasa de infecciones y de reingresos, y aumenta la dependencia al alta y la necesidad de institucionalización. En pacientes en diálisis con estancias hospitalarias prolongadas y complicadas, se produce un rápido descenso de la albúmina y pérdida de peso, sobre todo en aquellos que presentan una desnutrición previa, edad avanzada, comorbilidad y anorexia [84]. Las recomendaciones de las guías de prevención y manejo de la desnutrición hospitalaria pueden ser muy útiles en los pacientes con ERC hospitalizados, puesto que incluyen el uso de suplementos y nutriciones parenterales para mejorar la situación nutricional [85].
DEP E INFLAMACIÓN
Varios estudios han observado una asociación independiente entre procesos inflamatorios, comúnmente medidos por el aumento de Proteína C reactiva (PCR), IL-6, IL-1 y TNF-α, con el riesgo de mortalidad cardiovascular en los pacientes en hemodiálisis [86] y en la población general [87].
Dado que la inflamación se asocia tanto con anorexia como con un aumento del catabolismo proteico [88] [89] esta parece ser el nexo de unión que explica la relación entre DPE y mortalidad en la ERC.
La relación entre malnutrición e inflamación en pacientes con ERC puede ser una de las causas de mortalidad asociada a la malnutrición. Por otro lado, el DPE también puede ser consecuencia de estados inflamatorios crónicos en los pacientes con insuficiencia renal [90] [91].
DEP Y CALIDAD DE VIDA
Un aspecto a veces poco apreciado por el nefrólogo, pero que cada vez tiene más relevancia en la práctica clínica, es la repercusión de la enfermedad en el grado de funcionalidad del paciente. El impacto de la ERC sobre el funcionamiento global del paciente se puede recoger en encuestas de calidad de vida como PROs (patient–reported outcomes) y QoL (health related quality of life), que evalúan el estado mental y funcional del paciente. La ERC se asocia a un pobre QoL y este conlleva un mayor riesgo de mortalidad [92]. Igualmente se ha relacionado QoL con marcadores de malnutrición, donde peores valores de QoL se asocian con niveles bajos de albúmina, creatinina plasmática, pérdida de LBM (tejido magro, principalmente muscular) y alto porcentaje de grasa [93]. La mejoría de QoL se ha convertido en uno de los objetivos en los pacientes en diálisis.
Cada vez hay más estudios que evidencian una alta prevalencia de estados mentales de depresión y ansiedad [94]. Los pacientes en diálisis se enfrentan a diferentes situaciones como hospitalizaciones, ansiedad a los cambios en diálisis, restricciones en la dieta y agua, la adaptación que supone la diálisis en sus vidas cotidianas. El miedo a la incapacidad, minusvalía y una menor esperanza de vida son el origen de estas alteraciones del estado de ánimo. Nuevos métodos y herramientas se están desarrollando para medir dichos síndromes, de los cuales la ansiedad parece que está más infradiagnosticada de lo sospechado [95].
EPIDEMIOLOGÍA INVERSA EN LA INSUFICIENCIA RENAL: IMPLICACIONES DEL ESTADO NUTRICIONAL
Al evaluar los factores de riesgo relacionados con la morbimortalidad de los pacientes con ERC a menudo se observan tendencias paradójicamente opuestas a lo que se ha descrito para la población general. Un claro ejemplo es la obesidad, que en estudios observacionales aparece como un factor protector de mortalidad en los estadios finales de ERC. Es lo que se conoce como fenómeno de epidemiología inversa o paradoja de la obesidad urémica. La causa de estos fenómenos de epidemiología inversa se debe al efecto devastador que tiene el DPE sobre la supervivencia del paciente. Así, la fisiopatología del DPE tiene un mayor impacto en la mortalidad a corto plazo, no dejando tiempo suficiente a otros factores de riesgo tradicionales a actuar en la mortalidad a largo plazo [96]. Entre los ejemplos más llamativos encontramos el caso de la hipercolesterolemia, que oponiéndose a la población en general, se asocia de manera inversa a la mortalidad del paciente urémico. Cuando se segregan a los pacientes en función de si presentan o no DPE se puede observar que en presencia de DPE la hipercolesterolemia es un factor protector, mientras que en ausencia de DPE, la hipercolesterolemia es un factor de riesgo. Ante el proceso de consunción energética que afronta el paciente, el colesterol en este caso se convierte temporalmente en un marcador de las reservas de grasa del organismo, y a mayor grasa, el paciente puede resistir esta consunción energética más tiempo.
El mismo razonamiento se aplica a la paradoja de la obesidad. Los pacientes en diálisis, independientemente de la modalidad elegida, presentan una relación inversamente proporcional entre IMC y mortalidad [97], difiriendo de la población general, en donde esta relación tiene forma de U (ambos extremos, malnutrición y obesidad, presentan un incremento de la mortalidad) [98]. En este caso, la obesidad supone un estado de exceso energético que ayuda a que el paciente resista el DPE. Sin embargo, la obesidad a largo plazo supone un factor de riesgo relacionado con inflamación, aterosclerosis y calcificación, por mencionar algunos [99]. Ello es debido al carácter endocrino del adipocito y a la capacidad de modular estos procesos mediante la secreción de citocinas y adipocitocinas [100]. La grasa endocrinológicamente activa, primordialmente la acumulada en el abdomen, propicia estos procesos. Por ello, la cantidad de grasa total (reflejo del bienestar de reservas energéticas) y la grasa abdominal (participante del riesgo asociado a la obesidad) pueden tener efectos opuestos sobre el riesgo del paciente [101].
Otra explicación al problema es la incapacidad del IMC de diferenciar masa muscular, distribución corporal de grasa (abdominal frente a periférica) e hipervolemia. Así, pudimos observar recientemente que un IMC > 30 kg/m2 no era capaz de discriminar un exceso de grasa corporal en un 65 % de los pacientes en diálisis [48]. Estudios recientes señalan que el tipo y distribución de la grasa, más que el total de esta, es un determinante factor de riesgo [102], particularmente el acúmulo de grasa abdominal es un factor de riesgo y se asocia a una mayor secreción de adiponectinas proinflamatorias [103]. Tanto la leptina como la visfatina se han descrito como activadores de la enfermedad cardiovascular y factores de riesgo de disfunción endotelial [104] [105]. Ramkumar y colaboradores [106] en estudios observacionales mediante la comparación de IMC alto y creatinina en orina como indicador de masa muscular, sugirieron que el efecto protector de IMC en los pacientes en hemodiálisis es secundario a mayor masa muscular. Posiblemente la preservación de ambos tejidos, grasa y musculo, es necesaria para el paciente en diálisis, como sugirieron Huang y colaboradores [107] al observar que un percentil bajo de circunferencia del brazo muscular (CBM), como indicador de masa muscular, y un percentil bajo de pliegue tricipital bajo, como indicador de tejido graso, se correlacionan en igual medida con mayor mortalidad en pacientes en hemodiálisis. Por último en un estudio realizado por Kalantar y colaboradores examinaron cambios de peso en el tiempo con mortalidad, resultando que el riesgo de mortalidad aumentaba cuando el IMC, creatinina y peso disminuían, pero en los pacientes que disminuía el peso y la creatinina aumentaba el riesgo de mortalidad se reducía [108] .
CONCLUSIÓN
El término de desgaste proteico-energético (DPE) intenta aunar en una sola entidad patológica las múltiples alteraciones nutricionales y catabólicas que acontecen en la enfermedad renal crónica y que conlleva la pérdida gradual y progresiva tanto de masa muscular como grasa. Es un síndrome común en los pacientes, especialmente a partir del estadio 4-5. Así, durante la etapa de diálisis, parece estar presente en el 30-60% de los pacientes. Sus implicaciones clínicas son importantes y reclaman un tratamiento rápido y efectivo, pues DPE se asocia a un incremento de la mortalidad tanto global como cardiovascular, número de infecciones e ingresos, y otras muchas comorbilidades. Su efecto devastador origina paradojas epidemiológicas que se explican por la competitividad entre los factores de riesgo a corto y a largo plazo.