Intervención nutricional en el paciente con Enfermedad Renal. Hemodiálisis en centro y domiciliaria
Indice
1. Introducción.
2. Resumen conceptual: necesidad de una dieta individualizada y no demasiado restrictiva.
3. Requerimientos nutricionales en las personas en hemodiálisis
3.1. Hidratación
3.2. Ingesta de sal
3.3. Balance energético
3.4. Ingesta proteica: cantidad y calidad
3.5. Ingesta de Fósforo
3.6. Ingesta de Calcio
3.7. Ingesta de Potasio
3.8. Carga ácida y acidosis
3.9. Ingesta de fibra y probióticos
3.10. Patrones dietéticos en diálisis
4. Soporte nutricional para la prevención y tratamiento del DPE de las personas en hemodiálisis.
4.1. Soporte dietético.
4.2. Uso de suplementos orales.
4.3. Nutrición parenteral intradiálisis.
5. Soporte dialítico para la prevención y tratamiento del DPE de las personas en hemodiálisis.
5.1. Adecuación en hemodiálisis y estado nutricional.
5.2. Peculiaridades del manejo nutricional del paciente en hemodiálisis en centro.
5.3. Peculiaridades del manejo nutricional del paciente en hemodiálisis domiciliaria.
1. Introducción
El estado nutricional es uno de los determinantes pronósticos más consistentes y clínicamente relevantes en los pacientes con enfermedad renal crónica (ERC) avanzada en tratamiento con hemodiálisis (HD). Diferentes indicadores de las reservas proteicas y energéticas —como la masa muscular, la masa grasa, el índice de masa corporal o la albúmina sérica— se asocian de forma estrecha e independiente con la morbimortalidad en esta población [1][2][3].
La malnutrición en HD no debe interpretarse como una consecuencia exclusiva de una ingesta insuficiente. Por el contrario, representa el resultado final de un proceso fisiopatológico complejo y multifactorial, en el que confluyen la anorexia urémica, el estado inflamatorio crónico, el hipercatabolismo, las alteraciones hormonales y metabólicas, la comorbilidad asociada y los efectos propios de la técnica dialítica, incluyendo las pérdidas obligadas de aminoácidos y proteínas durante la sesión de HD [4][5][6][7]. Este conjunto de alteraciones se engloba bajo el término desgaste proteico-energético (DPE), propuesto por la International Society of Renal Nutrition and Metabolism (ISRNM) como marco conceptual específico para la ERC y la diálisis [8]. Desde un punto de vista fisiopatológico, el DPE se caracteriza por un desequilibrio persistente entre anabolismo y catabolismo, en el que la inflamación sistémica de bajo grado desempeña un papel central. La activación de vías catabólicas musculares, como el sistema ubiquitina–proteasoma, junto con la resistencia a señales anabólicas (insulina, IGF-1) y la acidosis metabólica, contribuyen de forma decisiva a la pérdida progresiva de masa muscular [6][7][8][9]. A ello se suma el impacto directo de la HD sobre el metabolismo proteico, con un aumento del recambio y pérdidas obligadas hacia el dializado [6][7].
Históricamente, el manejo nutricional del paciente en HD ha estado dominado por un enfoque restrictivo, centrado en el control de sodio, potasio, fósforo y líquidos. Aunque este paradigma respondió durante años a la necesidad de prevenir complicaciones metabólicas agudas, ha demostrado importantes limitaciones a medio y largo plazo. La restricción dietética excesiva y no individualizada se asocia con una reducción progresiva de la ingesta energética y proteica, empobreciendo la dieta y favoreciendo el desarrollo y la progresión del DPE [10][11].
En paralelo, la optimización de las técnicas de HD y el avance en el conocimiento de la fisiopatología del DPE han puesto de relieve que la adecuación de la diálisis desempeña un papel central en la regulación del apetito, el estado inflamatorio y el equilibrio proteico-energético, influyendo de manera directa en el balance anabólico-catabólico del paciente. Una diálisis insuficiente se asocia con anorexia, disgeusia y menor ingesta espontánea, mientras que una diálisis adecuada puede mejorar el apetito y favorecer un entorno metabólico más favorable [5][6][11]. En este sentido, la diálisis debe entenderse no solo como un procedimiento depurativo, sino también como una intervención metabólica con impacto directo sobre el estado nutricional. De hecho, el uso de esquemas de diálisis como la hemodiafiltración en línea (HDF-OL) o la HD diaria se asocian a una mejoría de los parámetros nutricionales, pudiendo ser de utilidad para prevenir o revertir el DPE cuando se asocia a otras medidas nutricionales [11].
Sobre esta base fisiopatológica se sustenta el cambio conceptual en el abordaje nutricional del paciente en HD que se desarrolla en los apartados siguientes. El objetivo ya no es la restricción sistemática de nutrientes, sino la prevención del DPE y la preservación de la masa muscular, la funcionalidad y la calidad de vida, integrando la nutrición dentro de una estrategia terapéutica global [10][12].
2. Resumen conceptual: necesidad de una dieta individualizada y no demasiado restrictiva.
Una vez establecido el impacto pronóstico del estado nutricional en los pacientes en HD, resulta necesario redefinir el papel de la dieta dentro del abordaje terapéutico global. La nutrición no debe entenderse como un conjunto de restricciones orientadas exclusivamente al control bioquímico, sino como una intervención clínica dirigida a preservar la masa muscular, la funcionalidad y la calidad de vida a lo largo del tiempo [11][12]. El modelo dietético clásico en HD, basado en la aplicación uniforme de restricciones amplias, ha mostrado importantes limitaciones. Diversos estudios han evidenciado que una proporción significativa de pacientes no alcanza los requerimientos energéticos y proteicos recomendados, situación que se ve agravada por dietas excesivamente restrictivas, pobres en variedad y con baja palatabilidad [13][14]. En este contexto, la dieta puede convertirse en un factor activo de deterioro nutricional más que en una herramienta terapéutica.
Un principio central del enfoque actual es reconocer que las alteraciones analíticas no dependen exclusivamente de la ingesta dietética. Parámetros como el fósforo o el potasio reflejan un equilibrio complejo entre ingesta, depuración dialítica, función renal residual, redistribución corporal y estado metabólico. Interpretarlos de forma aislada conduce con frecuencia a restricciones desproporcionadas que penalizan innecesariamente la calidad global de la dieta [10].
La individualización dietética implica adaptar las recomendaciones nutricionales al perfil clínico y metabólico de cada paciente, considerando edad, composición corporal, comorbilidades, nivel de actividad física y esquema de diálisis. Esta adaptación debe ser dinámica y reevaluada periódicamente, evitando tanto la inercia terapéutica como la aplicación rígida de esquemas predefinidos [10][11].
En este marco, el foco se desplaza desde nutrientes aislados hacia la calidad global de la dieta y los patrones dietéticos. El concepto de matriz alimentaria subraya que el impacto metabólico de un alimento depende de la interacción entre nutrientes, grado de procesamiento y biodisponibilidad, más que del contenido aislado de un nutriente concreto [14][15]. Este enfoque resulta especialmente relevante en HD, donde la relación entre ingesta proteica, fósforo, potasio y carga ácida no puede abordarse de forma fragmentada. La evidencia disponible sugiere que patrones dietéticos con mayor proporción de alimentos frescos y de origen vegetal, integrados de forma racional y sin excluir fuentes animales, pueden asociarse a un perfil metabólico más favorable, con menor carga ácida, menor biodisponibilidad de fósforo y mayor aporte de fibra, tal y como abordaremos en apartados posteriores [16][17].
En conjunto, el manejo nutricional en HD debe basarse en un enfoque individualizado y no excesivamente restrictivo, centrado en la calidad global de la dieta y en los patrones alimentarios, más que en la restricción sistemática de nutrientes aislados. Este modelo conceptual permite integrar la dieta dentro de una estrategia terapéutica coherente con los avances en la técnica dialítica y orientada a preservar la masa muscular, prevenir el deterioro funcional y mejorar los resultados clínicos a largo plazo [18]. La (Tabla 1) resume los principales cambios paradigmáticos en la forma de entender y abordar la nutrición del paciente en HD.
3. Requerimientos nutricionales en las personas en hemodiálisis
3.1. Ingesta hídrica.
El manejo del balance hídrico constituye uno de los pilares clásicos del tratamiento del paciente en HD. La sobrecarga de volumen se asocia de forma consistente con hipertensión arterial, hipertrofia ventricular izquierda, insuficiencia cardiaca y aumento de la mortalidad, mientras que tasas elevadas de ultrafiltración durante la sesión se relacionan con hipotensión intradiálisis, peor tolerancia al tratamiento y mayor riesgo cardiovascular [19][20][21]. Por ello, el objetivo del manejo hídrico no debe limitarse a minimizar la ganancia de peso interdiálisis, sino a mantener un equilibrio entre control del volumen, estabilidad hemodinámica y preservación del estado nutricional.
Desde un punto de vista práctico, la ganancia de peso interdiálisis refleja no solo la ingesta de líquidos, sino también la ingesta alimentaria, el contenido hídrico de los alimentos sólidos y la producción metabólica de agua. Una restricción hídrica excesiva puede tener efectos adversos indirectos, al dificultar la ingesta de alimentos sólidos, reducir la palatabilidad de la dieta y favorecer el estreñimiento, con impacto negativo sobre la calidad de vida y el estado nutricional del paciente [18].
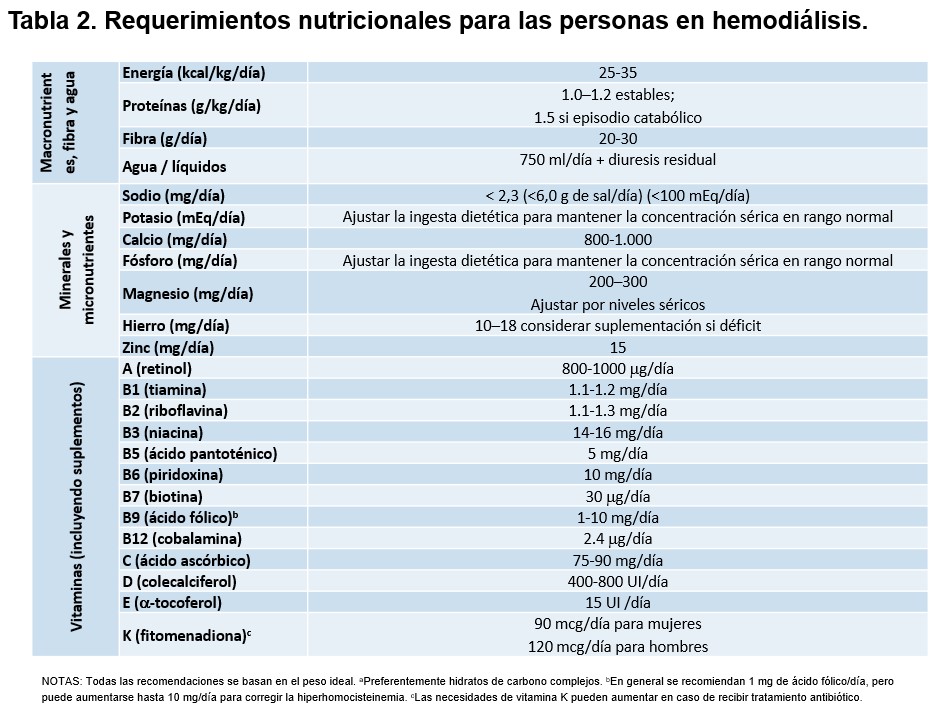
En los pacientes con función renal residual, incluso mínima, la ingesta hídrica adquiere un significado adicional. La preservación de la diuresis residual se asocia a un mejor control del volumen, mayor depuración de toxinas urémicas, menor inflamación y mejor pronóstico [22][23]. Aunque no existe evidencia sólida que establezca una cantidad óptima de ingesta hídrica, debe evitarse una restricción excesiva que pueda comprometer la hidratación y la función renal residual. De forma orientativa y basada en el consenso clínico, suele recomendarse una ingesta aproximada de 0,5–0,75 litros de líquidos al día, además del volumen correspondiente a la diuresis residual del paciente [18]. Esta cifra debe entenderse como una referencia flexible y ajustarse individualmente en función del estado cardiovascular, la ganancia de peso interdiálisis, la tolerancia hemodinámica a la HD y la evolución de la función renal residual. En este contexto, el objetivo del abordaje hídrico en HD no es la minimización absoluta de la ingesta de líquidos, sino la evitación de tasas elevadas de ultrafiltración, la preservación de la función renal residual cuando exista y el mantenimiento de una adecuada ingesta alimentaria. Este enfoque integrador permite compatibilizar el control del volumen con la calidad de vida y el estado nutricional del paciente [18][24]. En la (Tabla 2) se resume la ingesta hídrica y los requerimientos nutricionales actualmente recomendados para las personas en tratamiento con HD.
3.2. Ingesta de sal.
La ingesta de sodio constituye uno de los determinantes más relevantes del balance hídrico, del control tensional y de la tolerancia hemodinámica en los pacientes en HD. A diferencia de otros nutrientes, el sodio dietético requiere una restricción clara y sostenida, dado su impacto directo sobre la sed, la ganancia de peso interdiálisis y la sobrecarga de volumen [18]. En ausencia de función renal residual, la excreción de sodio depende casi exclusivamente de la HD, lo que convierte a la ingesta dietética en un factor crítico del control del volumen en estos pacientes [25]. De este modo, un consumo elevado de sodio incrementa la osmolaridad plasmática, estimula la sed y favorece una mayor ingesta hídrica, traduciéndose en mayor ganancia de peso interdiálisis y necesidad de tasas elevadas de ultrafiltración, lo que se asocia con hipotensión intradiálisis, isquemia miocárdica y cerebral, activación inflamatoria y peor pronóstico cardiovascular [24]. Por el contrario, una restricción adecuada de sodio se asocia a menor ganancia de peso interdiálisis, mejor control de la presión arterial y menor necesidad de ultrafiltración, contribuyendo a una mejor tolerancia del tratamiento dialítico [26][27].
En la práctica clínica, la principal fuente de sodio no suele ser la sal añadida de forma consciente, sino el consumo habitual de alimentos procesados y ultraprocesados con alto contenido en sodio oculto, como embutidos, precocinados, conservas, snacks salados y salsas comerciales. Estos productos no solo aportan grandes cantidades de sodio, sino que además presentan una baja densidad nutricional y desplazan alimentos frescos, contribuyendo a un patrón dietético de peor calidad [28]. Por ello, la educación nutricional debe centrarse prioritariamente en evitar estos alimentos, más que en pequeños ajustes de la sal de mesa. La reducción del sodio dietético plantea, no obstante, un desafío en términos de palatabilidad, especialmente en pacientes de edad avanzada. En este contexto, resulta fundamental promover el uso de especias, hierbas aromáticas, ajo, cebolla o cítricos como estrategias para mejorar el sabor sin incrementar la carga de sodio, favoreciendo la adherencia a largo plazo [18][28].
Es especialmente importante desaconsejar el uso de “sal sin sodio” o sales sustitutivas, ya que la mayoría contienen cloruro potásico en cantidades significativas y pueden incrementar de forma inadvertida la ingesta de potasio, aumentando el riesgo de hiperpotasemia [28]. De forma orientativa, la ingesta de sodio en HD debería situarse en torno a ≤2 g de sodio al día (equivalente a aproximadamente 5 g de sal), ajustando esta recomendación según la diuresis residual, el estado cardiovascular y el esquema de diálisis [18]. En cualquier caso, la restricción de sodio debe ser más estricta que la de otros nutrientes y debe integrarse con la prescripción del sodio en el baño de diálisis y la estrategia global de ultrafiltración [28]. Finalmente, el manejo del sodio dietético debe integrarse con la prescripción del sodio en el baño de diálisis y con la estrategia global de ultrafiltración [28].
3.3. Balance energético: sin suficientes calorías, la proteína no sirve
El balance energético constituye un determinante central del estado nutricional en los pacientes en HD y, con frecuencia, uno de los componentes menos visibles del deterioro nutricional. Una ingesta energética insuficiente compromete la eficacia metabólica de la proteína dietética, favoreciendo su oxidación como sustrato energético en lugar de su utilización para la síntesis y el mantenimiento del tejido muscular [29]. En este contexto, incluso una ingesta proteica aparentemente adecuada puede resultar insuficiente si no se acompaña de un aporte energético mínimo que permita un balance nitrogenado favorable [30].
La ingesta energética espontánea en HD es con frecuencia inferior a la recomendada. La anorexia urémica, la disgeusia, la fatiga asociada a la sesión, las restricciones dietéticas excesivas y los síntomas gastrointestinales contribuyen a una reducción progresiva de la ingesta que puede pasar desapercibida si no se evalúa de forma sistemática [13][30]. Además, el estado inflamatorio crónico de bajo grado, frecuente en esta población, se asocia a peor apetito y a un entorno metabólico menos eficiente, aumentando el riesgo de balance energético negativo [31]. Este déficit energético suele preceder a la pérdida manifiesta de masa muscular y actúa como un factor temprano en la cascada del deterioro nutricional.
Las recomendaciones habituales sitúan las necesidades energéticas en torno a 30–35 kcal/kg/día en pacientes jóvenes o físicamente activos, y 25–30 kcal/kg/día en pacientes de mayor edad, con menor nivel de actividad física o con obesidad, utilizando como referencia el peso seco ajustado [18][30]. Estas cifras deben interpretarse como objetivos orientativos y requieren una adaptación individual basada en la composición corporal, la evolución clínica y la respuesta funcional del paciente.
La distribución temporal de la ingesta adquiere una importancia particular en HD. Los días de diálisis asocian con frecuencia a una menor ingesta global debido al tiempo dedicado al tratamiento y a la fatiga postdiálisis. En este contexto, estrategias dirigidas a asegurar aportes energéticos suficientes en torno a la sesión pueden contribuir de forma significativa a mejorar el balance energético semanal, especialmente en pacientes con ingestas irregulares o insuficientes [32]. De hecho, la propia sesión de HD representa una oportunidad terapéutica para la intervención nutricional. Permitir y promover la ingesta durante la diálisis se ha propuesto como una estrategia práctica para aumentar el aporte energético total y mejorar la adherencia a la HD, sin interferir de forma relevante con la eficacia del tratamiento dialítico [33]. Evidencia reciente basada en ensayos clínicos aleatorizados indica que esta práctica no incrementa en general de forma significativa el riesgo de hipotensión intradiálisis y puede asociarse a mejoras en la ingesta total y otros parámetros nutricionales [34][35][36].
En pacientes con sobrepeso u obesidad, el balance energético plantea un desafío específico, especialmente en aquellos que asocian sarcopenia. En estos casos, el objetivo no debe ser la restricción calórica agresiva, sino la preservación de la masa muscular, evitando déficits energéticos que aceleren la pérdida de tejido magro, y fomentando un aporte proteico y ejercicio físico adecuados (ver: https://www.nefrologiaaldia.org/es-articulo-obesidad-sarcopenica-en-la-enfermedad-renalcronica-705).
En conjunto, el balance energético debe considerarse un componente estructural del manejo nutricional en HD. Garantizar una ingesta energética suficiente es un requisito imprescindible para que la ingesta proteica sea metabólicamente eficaz y prevenga la progresión del DPE.
3.4. Ingesta proteica: cantidad y calidad.
La ingesta proteica constituye el eje central del abordaje nutricional en el paciente en HD. A diferencia de etapas previas de la ERC, en las que la restricción proteica puede tener un papel en la ralentización de la progresión, la HD se asocia a un estado netamente catabólico que exige un aporte proteico suficiente para preservar la masa muscular, la funcionalidad y el pronóstico. En este contexto, la insuficiencia proteica, ya sea cuantitativa o cualitativa, se asocia de forma directa con el desarrollo y la progresión del DPE [37][38].
Cantidad de proteína: compensar pérdidas para sostener el anabolismo
Las guías clínicas recomiendan en pacientes en HD una ingesta proteica mínima de ≥1,2 g/kg de peso seco/día, ajustada a la composición corporal y al estado clínico, con el objetivo de compensar las pérdidas asociadas al tratamiento y sostener un balance nitrogenado adecuado [18]. En pacientes jóvenes, físicamente activos o con pérdida reciente de masa muscular resulta especialmente importante asegurar que este umbral mínimo se alcanza de forma sostenida. En la práctica clínica, una proporción relevante de pacientes no alcanza estas recomendaciones, especialmente aquellos con anorexia, síntomas gastrointestinales, depresión o sometidos a múltiples restricciones dietéticas [13][39]. Conviene por último remarcar que la eficacia metabólica de la proteína depende de forma crítica de la disponibilidad energética, de modo que una ingesta proteica aparentemente adecuada puede resultar ineficaz en presencia de un déficit calórico persistente, como se ha descrito previamente [29][30][31].
Calidad de la proteína: más allá de los gramos
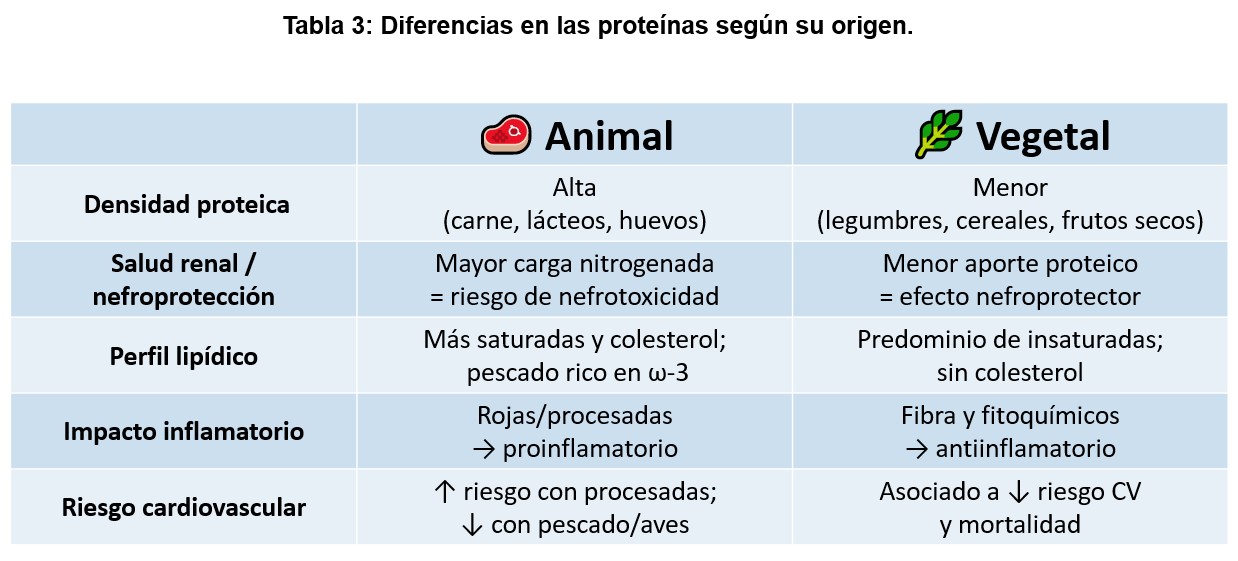
Más allá de la cantidad, la calidad de la proteína desempeña un papel relevante en el estado nutricional del paciente en HD. Las proteínas con un adecuado contenido en aminoácidos esenciales, y en particular en leucina, son fundamentales para estimular la síntesis proteica muscular en un contexto de resistencia anabólica. No obstante, el enfoque actual supera la dicotomía simplista entre proteínas de origen animal y vegetal. La evidencia disponible indica que patrones dietéticos con mayor proporción de proteínas de origen vegetal pueden ser compatibles con una ingesta proteica adecuada en HD, siempre que se planifiquen correctamente [14]. Este enfoque presenta ventajas metabólicas relevantes, incluyendo una menor carga ácida neta, una menor biodisponibilidad de fósforo y un mayor aporte de fibra y compuestos bioactivos [40]. Por el contrario, los productos cárnicos procesados y ultraprocesados suelen contener aditivos fosfatados inorgánicos altamente biodisponibles, que incrementan de forma desproporcionada la carga de fósforo sin aportar beneficios nutricionales equivalentes [41][42]. La (Tabla 3) muestra las principales diferencias entre las proteínas según su origen y su relevancia clínica en HD.
Distribución y momento de la ingesta proteica
Además de la cantidad y la calidad, la distribución de la ingesta proteica a lo largo del día influye en su aprovechamiento metabólico. La distribución de las proteínas en varias comidas, incluyendo aportes en torno a la sesión de diálisis, puede contribuir a mejorar el balance proteico neto, especialmente en pacientes con ingesta limitada. En este contexto, la suplementación proteica oral intradiálisis, cuando está indicada, debe entenderse como un complemento a la dieta habitual y no como un sustituto.
En conjunto, la ingesta proteica en HD debe abordarse como un concepto integrador, en el que cantidad, calidad, patrón dietético y contexto metabólico forman un todo. Garantizar un aporte proteico adecuado y de calidad, en el marco de un balance energético suficiente y una diálisis adecuada, constituye uno de los pilares fundamentales para prevenir el DPE y preservar la funcionalidad y la calidad de vida de las personas en HD [18][39].
3.5. Ingesta de Fósforo.
La hiperfosfatemia constituye una de las alteraciones metabólicas más relevantes en los pacientes en HD, al asociarse de forma consistente con calcificación vascular, enfermedad cardiovascular y aumento de la mortalidad. No obstante, el manejo dietético del fósforo no puede abordarse de forma aislada ni exclusivamente restrictiva, ya que el fósforo dietético está estrechamente ligado a la ingesta proteica, pilar fundamental para la prevención DPE en esta población [41][42][43]. Desde un punto de vista fisiopatológico, el fósforo sérico refleja el equilibrio entre ingesta dietética, absorción intestinal, depuración dialítica y regulación hormonal (vitamina D, PTH, FGF23). En el paciente en HD, la pérdida de la excreción renal convierte a la dieta y a la diálisis en los principales determinantes del balance de fósforo. En este contexto, interpretar la hiperfosfatemia exclusivamente como un marcador de exceso dietético conduce con frecuencia a la culpabilización del paciente y a la restricción proteica inapropiada, con impacto negativo sobre la masa muscular, la funcionalidad y el pronóstico [41][42][43]. La (Figura 1) sintetiza las intervenciones nutricionales clave para la prevención y el tratamiento de la hiperfosfatemia en HD.
Biodisponibilidad del fósforo y fuentes dietéticas
Un avance conceptual clave ha sido reconocer que no todo el fósforo dietético se absorbe en la misma proporción. El fósforo de origen vegetal presenta una biodisponibilidad limitada (≈30–50%) al encontrarse mayoritariamente en forma de fitato, mientras que el fósforo de origen animal muestra una absorción superior. En contraste, el fósforo inorgánico añadido como aditivo alimentario alcanza tasas de absorción cercanas al 90–100% [42][43][44]. Este hecho explica por qué alimentos con un contenido absoluto de fósforo similar pueden tener efectos muy distintos sobre la fosfatemia según su origen y grado de procesamiento.
La ratio fósforo/proteína como herramienta clínica
Dado que el fósforo dietético está intrínsecamente ligado a la proteína, la restricción cuantitativa del fósforo entra en conflicto directo con el objetivo de asegurar una ingesta proteica adecuada. Para superar esta limitación, se ha propuesto el uso de la ratio fósforo/proteína (mg de fósforo por gramo de proteína) como herramienta práctica para la selección de alimentos. De forma orientativa, se considera deseable una ratio inferior a 16 mg/g, umbral asociado a un mejor control del fósforo sérico sin comprometer la ingesta proteica [45]. Los alimentos frescos y mínimamente procesados suelen presentar ratios más favorables que los productos ultraprocesados, que concentran una elevada carga fosfórica con escaso beneficio nutricional.
Desde un punto de vista práctico, la reducción de aditivos fosfatados debe considerarse la primera línea del control dietético del fósforo. Estos aditivos, ampliamente utilizados en productos cárnicos procesados, quesos fundidos, precocinados y refrescos de cola, aportan fósforo altamente biodisponible y de difícil identificación por el paciente [44]. La educación nutricional debe centrarse prioritariamente en identificar y evitar estos productos, más que en restringir alimentos proteicos naturales.
Integración con la diálisis y el tratamiento farmacológico
La capacidad de depuración del fósforo mediante HD convencional es limitada, especialmente para el fósforo intracelular, y los quelantes del fósforo solo permiten captar una fracción de la ingesta diaria total. Por ello, el control del fósforo debe entenderse como el resultado de una estrategia integrada que combine dieta de calidad, adecuación dialítica (con especial atención a la duración de las sesiones de HD) y tratamiento farmacológico individualizado [46][47][48]. Las guías reflejan este cambio conceptual y, en lugar de establecer una ingesta “adecuada” de fósforo, recomiendan reducir los niveles séricos hacia el rango normal, minimizar la carga de fósforo dietético considerando su fuente (animal, vegetal, aditivos) y restringir el uso de quelantes cálcicos, evitando la sobrecarga de calcio [18][48].
3.6. Ingesta de Calcio
El manejo del calcio en el paciente en HD se enmarca dentro del trastorno mineral y óseo asociado a la enfermedad renal crónica (ERC-MBD) y no puede abordarse exclusivamente desde la perspectiva dietética. El balance cálcico depende de la interacción entre la ingesta alimentaria, el uso de quelantes cálcicos, la concentración de calcio en el baño de diálisis y la regulación hormonal mediada por la PTH, la vitamina D y el FGF23. En este contexto, el objetivo clínico no es maximizar ni minimizar la ingesta de calcio, sino mantener un balance global adecuado, evitando tanto el déficit como la sobrecarga [49].
La evidencia acumulada indica que una exposición crónica excesiva al calcio se asocia a progresión de la calcificación vascular, aumento de la rigidez arterial y peor pronóstico cardiovascular, sin un beneficio claro sobre los resultados óseos [50]. Por este motivo, el calcio ha dejado de considerarse un nutriente “protector” per se y debe manejarse de forma individualizada, especialmente en pacientes con bajo recambio óseo o elevado riesgo cardiovascular.
En los últimos años se ha producido un cambio conceptual relevante, desplazando el foco desde el calcio dietético aislado hacia la ingesta total de calcio, entendida como la suma del calcio procedente de la dieta, de los quelantes cálcicos y del baño de diálisis. En pacientes con ERC avanzada y en HD, la ingesta total de calcio no debería exceder aproximadamente 800–1.000 mg/día, con el objetivo de minimizar el riesgo de calcificación vascular [18][47]. En la práctica clínica, el calcio dietético procedente de alimentos naturales, integrado en una dieta de calidad, no debe demonizarse siempre que la ingesta total se mantenga dentro de rangos seguros y no exista hipercalcemia [48].
El uso de quelantes del fósforo a base de calcio debe realizarse con cautela y en situaciones bien seleccionadas. Las guías KDIGO recomiendan restringir su empleo en presencia de hipercalcemia, calcificación vascular, enfermedad ósea adinámica o niveles bajos de PTH, priorizando quelantes no cálcicos cuando sea posible [47]. Estudios observacionales, ensayos clínicos y metaanálisis han mostrado un mayor riesgo de mortalidad y de eventos cardiovasculares asociado al uso de quelantes cálcicos frente a quelantes no cálcicos, especialmente a dosis elevadas [50][51].
La concentración de calcio en el baño de diálisis constituye otro determinante clave del balance cálcico. En la práctica actual se recomienda, para la mayoría de los pacientes, un baño con calcio de 1,25 mmol/L, ajustándolo de forma individual según el perfil bioquímico, el tipo de quelantes utilizados y la situación ósea [47][48][49]. En conjunto, el manejo del calcio en HD debe basarse en una visión integrada del balance cálcico total, evitando restricciones dietéticas indiscriminadas y, al mismo tiempo, minimizando exposiciones excesivas procedentes de quelantes y del baño de diálisis.
3.7. Ingesta de Potasio.
La hiperpotasemia constituye una complicación potencialmente grave en los pacientes en HD y se asocia a un aumento del riesgo de arritmias y mortalidad. Tradicionalmente, su manejo se ha basado en la restricción dietética estricta del potasio. Sin embargo, la evidencia acumulada en los últimos años ha puesto de manifiesto que el potasio sérico refleja un equilibrio complejo entre ingesta dietética, redistribución intracelular, depuración dialítica, función renal residual y eliminación colónica, por lo que no puede interpretarse exclusivamente como un marcador de exceso dietético [52][53][54].
Diversos factores no dietéticos influyen de forma decisiva en los niveles de potasio del paciente en HD. La acidosis metabólica, el estado inflamatorio, el catabolismo muscular y determinados fármacos pueden favorecer la liberación de potasio desde el compartimento intracelular, mientras que la eliminación colónica adquiere un papel compensador relevante en la ERC avanzada [52][55]. Estudios recientes han demostrado consistentemente la ausencia de una correlación entre la ingesta dietética de potasio y sus concentraciones séricas en pacientes con ERC avanzada, de manera que la contribución relativa de la ingesta dietética al potasio sérico es variable y, en muchos casos, menor de lo que tradicionalmente se ha asumido. En este contexto, la restricción indiscriminada de alimentos ricos en potasio, especialmente frutas, verduras y legumbres, conlleva un empobrecimiento significativo de la dieta, reduciendo el aporte de fibra, vitaminas y compuestos bioactivos. Este enfoque puede tener consecuencias negativas sobre la salud digestiva, la calidad de vida y el estado nutricional global, sin garantizar necesariamente un mejor control del potasio sérico [53][56]. Más relevante que la ingesta total es el patrón de consumo del potasio. La evidencia disponible indica que el principal riesgo dietético de hiperpotasemia se asocia con la ingesta concentrada o en forma de bolo, como ocurre con el consumo puntual de grandes cantidades de fruta, zumos, batidos, sopas o preparados líquidos, especialmente cuando se ingieren de forma aislada [53]. Por el contrario, la ingesta de potasio distribuida a lo largo del día, integrada en comidas mixtas y acompañada de hidratos de carbono y fibra, parece asociarse a una mejor tolerancia metabólica, al favorecer la captación intracelular mediada por insulina y la activación de la bomba Na/K-ATPasa. El origen y el grado de procesamiento de los alimentos constituyen otro elemento clave. El potasio procedente de aditivos alimentarios (sales potásicas empleadas como conservantes o sustitutos del sodio) presenta una biodisponibilidad muy elevada y puede contribuir de forma desproporcionada a la carga potásica, a menudo sin que el paciente sea consciente de ello. En contraste, el potasio presente en alimentos frescos de origen vegetal forma parte de una matriz alimentaria compleja, con una absorción más gradual y modulada por la fibra, los hidratos de carbono y otros componentes del alimento. Por este motivo, las estrategias dietéticas actuales priorizan la reducción de alimentos ultraprocesados y de fuentes ocultas de potasio, más que la restricción indiscriminada de frutas y verduras [53].
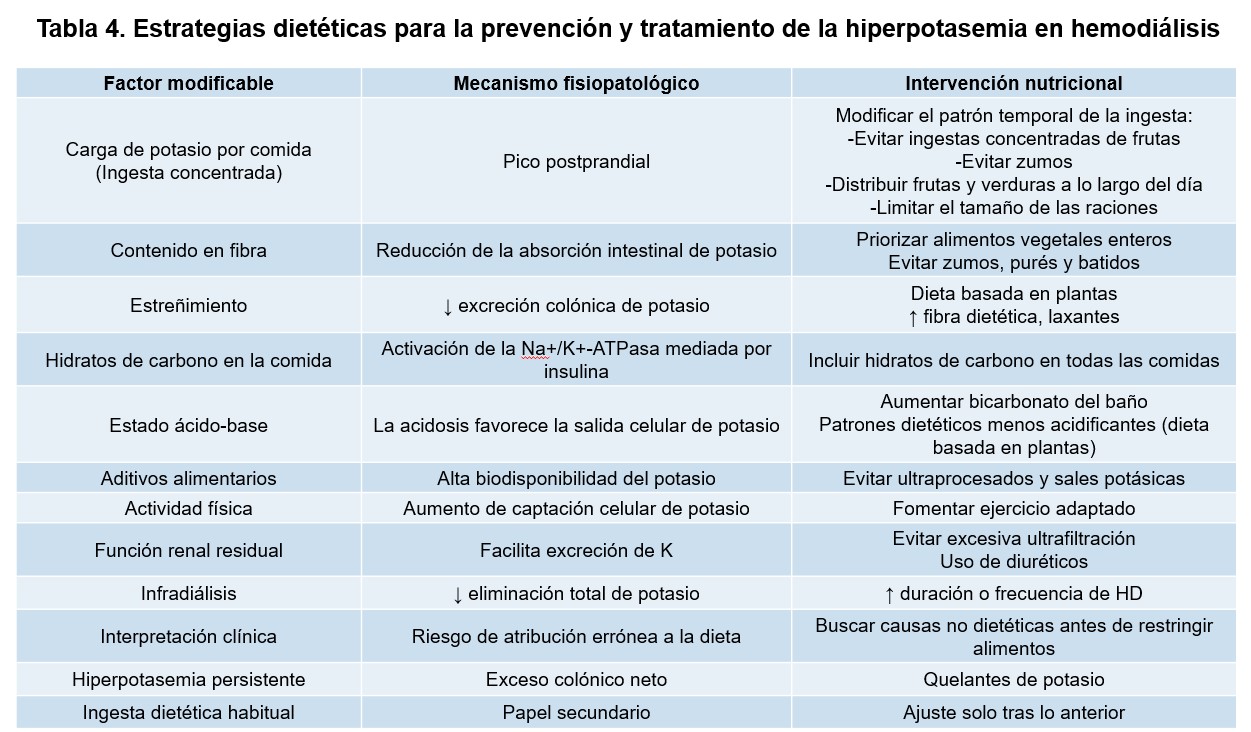
Las principales estrategias dietéticas para prevenir y manejar la hiperpotasemia en HD se recogen en la (Tabla 4). Desde un punto de vista práctico, el manejo dietético del potasio debe ser individualizado y escalonado. En pacientes con potasio sérico persistentemente elevado, el primer paso debe ser la revisión de factores no dietéticos y de la adecuación del tratamiento dialítico. Estas intervenciones incluyen el aumento de la excreción urinaria mediante diuréticos en pacientes con diuresis residual, la intensificación de la diálisis (aumentando la duración o la frecuencia de las sesiones), la corrección del estreñimiento mediante el incremento de la ingesta de fibra y el uso de laxantes cuando sea necesario, y el control de la acidosis metabólica mediante bicarbonato oral [54][55][56][57][58][59]. El colon desempeña un papel relevante en la excreción de potasio, especialmente en estadios avanzados de la ERC. El estreñimiento crónico reduce esta capacidad compensatoria y puede contribuir de forma significativa a la hiperpotasemia. En este contexto, mantener una ingesta adecuada de fibra no solo es compatible con el control del potasio, sino que puede facilitarlo, siempre que se seleccionen alimentos con una relación fibra/potasio favorable [60]. Solo tras haber abordado de forma adecuada estos factores debe considerarse la restricción dietética del potasio, priorizando la selección de alimentos con menor densidad de potasio, técnicas culinarias que reduzcan su contenido y una distribución equilibrada a lo largo del día, evitando restricciones generalizadas [54][56].
En los últimos años, el uso de captores de potasio ha ampliado las opciones terapéuticas para el manejo de la hiperpotasemia crónica en HD, facilitando mayor flexibilidad dietética y la continuidad de fármacos nefro- y cardioprotectores [57][58][59][60][61][62][63][64]. En este nuevo escenario terapéutico, el manejo del potasio en HD debe alejarse aún más de la restricción indiscriminada y orientarse hacia una liberalización responsable, permitiendo incluso el uso de patrones alimentarios basados en plantas mediante la distribución de la ingesta de vegetales a lo largo del día y la corrección de factores no dietéticos. Este mismo enfoque dietético tiene además un efecto positivo sobre el equilibrio ácido-base, aspecto que se desarrolla en el apartado siguiente [65].
3.8. Carga ácida y acidosis.
La acidosis metabólica es una alteración frecuente en los pacientes con ERC avanzada. Aunque la diálisis corrige parcialmente la acidosis, en muchos pacientes persiste un estado de acidosis crónica leve o intermitente que puede tener relevancia clínica a largo plazo [66][67][68]. Desde un punto de vista fisiopatológico, la acidosis metabólica favorece un entorno catabólico, con activación de la degradación proteica muscular y resistencia a las señales anabólicas. Estos efectos contribuyen a la pérdida progresiva de masa muscular y a la disminución de la fuerza y la funcionalidad, especialmente cuando la acidosis coexiste con una ingesta energética o proteica insuficiente [67][69].
La dieta influye en el equilibrio ácido-base fundamentalmente a través de su carga ácida neta. Los alimentos ricos en proteínas animales y productos ultraprocesados tienden a generar una mayor carga ácida, mientras que frutas, verduras y otros alimentos de origen vegetal aportan precursores alcalinos. Sin embargo, la carga ácida de la dieta no puede equipararse de forma simplista con la cantidad total de proteína ingerida, ya que alimentos con un contenido proteico similar pueden tener efectos muy distintos sobre el equilibrio ácido-base según su composición y matriz alimentaria [66][70].
En la práctica clínica, el manejo de la acidosis en HD debe abordarse de forma integrada, combinando una adecuada prescripción dialítica, la corrección farmacológica cuando esté indicada y una planificación dietética que evite una carga ácida excesiva sin comprometer la ingesta proteica ni la calidad global de la dieta. En este sentido, patrones dietéticos con mayor presencia de alimentos frescos y de origen vegetal, integrados de forma racional, pueden contribuir a reducir la carga ácida neta y mejorar el entorno metabólico [68][70][71]. La introducción progresiva y distribuida de frutas y verduras, integrada en comidas mixtas y evitando ingestas concentradas, permite aprovechar su efecto alcalinizante sin incrementar de forma significativa el riesgo de hiperpotasemia.
3.9. Ingesta de fibra y probióticos.
La recomendación de fibra en pacientes con ERC avanzada no difiere sustancialmente de la población general, situándose de forma orientativa en torno a 20–30 g/día, adaptando las fuentes alimentarias al perfil clínico y bioquímico del paciente [18][73]. Sin embargo, la ingesta de fibra dietética en los pacientes en HD es habitualmente inferior a la recomendada, como consecuencia del uso tradicional de dietas restrictivas en frutas, verduras, legumbres y cereales integrales. Esta baja ingesta de fibra se asocia a estreñimiento, peor calidad de vida y alteraciones del ecosistema intestinal, con potencial impacto sobre el estado inflamatorio y metabólico del paciente con ERC avanzada [71][72][73].
En los últimos años, el eje intestino–riñón ha adquirido un papel creciente en la comprensión de la uremia. La disbiosis intestinal característica de la ERC favorece la producción de toxinas urémicas de origen intestinal y la alteración de la barrera epitelial, contribuyendo a un entorno proinflamatorio. En este contexto, la fibra dietética actúa como sustrato fermentable para la microbiota, favoreciendo la producción de ácidos grasos de cadena corta y modulando de forma indirecta la inflamación y el metabolismo [74–76]. Revisiones sistemáticas y metaanálisis recientes indican que la modulación dirigida de la microbiota intestinal mediante probióticos, prebióticos o simbióticos pueden asociarse a reducciones modestas pero significativas de marcadores inflamatorios, especialmente proteína C reactiva, así como a descensos en determinadas toxinas urémicas de origen intestinal, como el indoxil sulfato y el p-cresol sulfato [76][77][78] (ver: https://www.nefrologiaaldia.org/es-articulo-microbiota-intestinal-en-la-enfermedad-renal-cronica-716). Un beneficio clínico adicional de la fibra dietética es su papel en la regulación del tránsito intestinal, reduciendo el estreñimiento —frecuente en esta población— y contribuyendo potencialmente a un mejor control del potasio a través del aumento de su eliminación colónica [79]. Estos hallazgos se alinean con los beneficios metabólicos descritos para dietas con mayor proporción de alimentos de origen vegetal, ya discutidos en apartados previos.
3.10. Patrones dietéticos en diálisis.
Los patrones dietéticos permiten capturar la interacción entre nutrientes, alimentos y matriz alimentaria, superando la visión fragmentada centrada en componentes aislados. Desde esta perspectiva, el impacto de la dieta sobre el estado nutricional, la inflamación, el metabolismo mineral, el equilibrio ácido-base y el riesgo cardiovascular depende más de la estructura global de la alimentación que del cumplimiento estricto de objetivos cuantitativos individuales. La evidencia observacional disponible sugiere que patrones dietéticos de mayor calidad, caracterizados por una mayor presencia de alimentos frescos, mínimamente procesados y de origen vegetal, se asocian a mejores perfiles inflamatorios, menor carga ácida, mejor control metabólico y menor mortalidad en pacientes con ERC avanzada y en diálisis. Estos patrones de tipo mediterráneo suelen aportar mayor cantidad de fibra, antioxidantes y compuestos bioactivos, y menor proporción de sodio, fósforo inorgánico y grasas saturadas, lo que resulta coherente con los objetivos terapéuticos descritos en los apartados previos [16][80][81].
Desde una perspectiva práctica, el abordaje nutricional basado en patrones dietéticos facilita la individualización y la adherencia a largo plazo. En lugar de imponer restricciones uniformes, permite adaptar la dieta a las preferencias culturales, sociales y personales del paciente, manteniendo los objetivos clínicos. Este aspecto resulta clave para evitar la fatiga dietética, mejorar la relación terapéutica y reducir la percepción de la dieta como una dieta adicional al tratamiento de las personas en diálisis [82].
4. Soporte nutricional para la prevención y tratamiento del DPE de las personas en hemodiálisis.
Desde una perspectiva clínica, el DPE debe entenderse como un continuo, que va desde formas subclínicas —difíciles de detectar si no se evalúan de forma sistemática— hasta estados avanzados de caquexia. Este carácter progresivo subraya la importancia de una estrategia proactiva, centrada no solo en el tratamiento del DPE establecido, sino, de forma prioritaria, en su prevención [8].
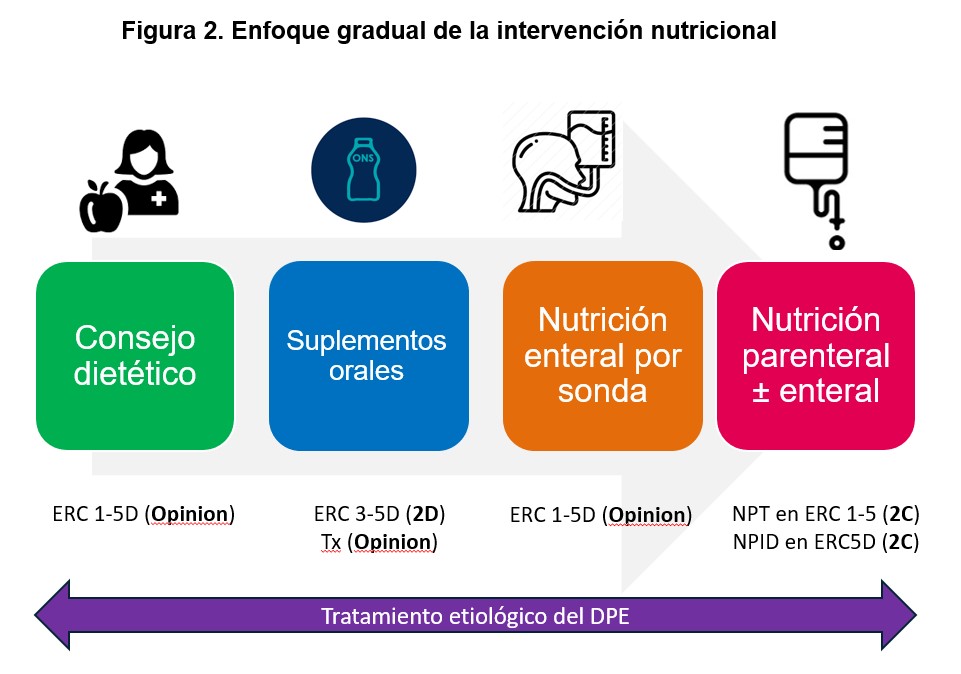
La intervención nutricional en HD debe organizarse de forma escalonada, comenzando por medidas dietéticas optimizadas, progresando hacia la suplementación oral y reservando estrategias más invasivas, como la nutrición parenteral intradiálisis, para situaciones seleccionadas [83]. De forma paralela, la adecuación de la técnica dialítica constituye un elemento clave y frecuentemente infravalorado del abordaje del estado nutricional.
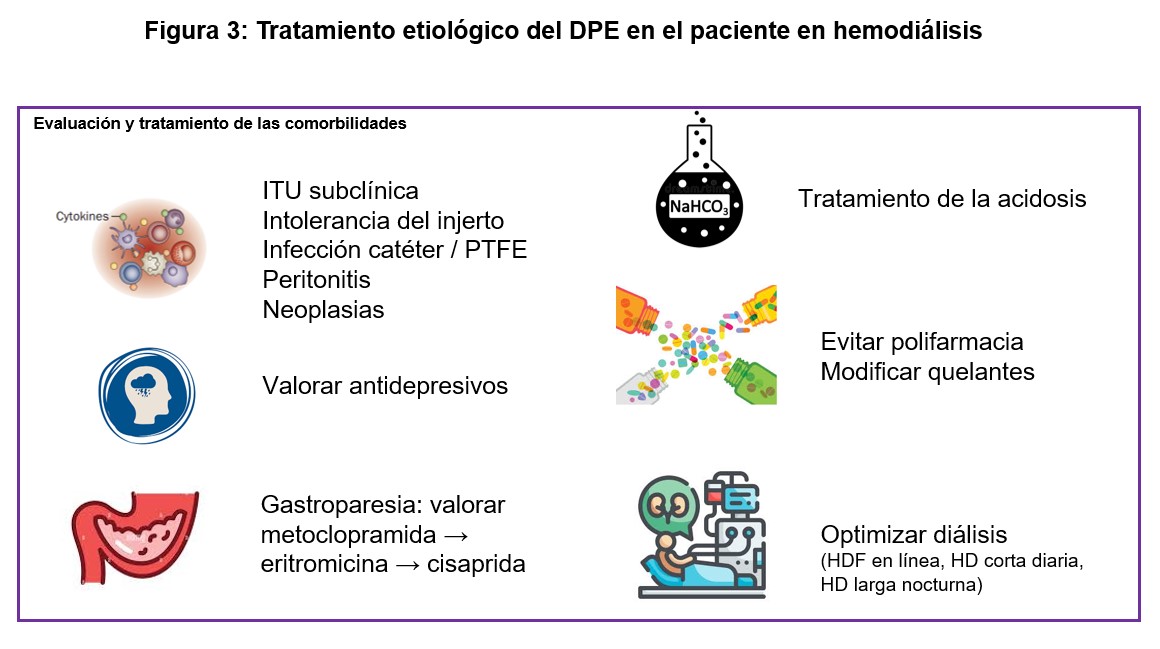
La (Figura 2) propone un enfoque gradual y estructurado de la intervención nutricional en el paciente en HD. Durante dicha intervención nutricional, es imprescindible mantener un abordaje etiopatológico del DPE, tal y como se presenta en la (Figura 3). Este enfoque se centra en identificar y corregir causas potencialmente reversibles del DPE, favoreciendo así un entorno metabólico más anabólico, que va más allá de la mera suplementación nutricional.
4.1. Soporte dietético.
El soporte dietético constituye la primera y fundamental línea de intervención nutricional en los pacientes en HD. Su objetivo principal es garantizar que la ingesta habitual cubra los requerimientos energéticos y proteicos del paciente, previniendo o corrigiendo de forma precoz el DPE, tal y como se ha descrito previamente [18]. La identificación de pacientes candidatos a soporte dietético debe basarse en un cribado nutricional sistemático y periódico, complementado por una valoración nutricional completa cuando esté indicado. La detección precoz de ingestas insuficientes, pérdida de peso involuntaria, reducción de la masa muscular o deterioro funcional permite intervenir antes de que el déficit nutricional se consolide y sea más difícil de revertir.
La intervención dietética debe priorizar el uso de alimentos naturales y estrategias culinarias que permitan aumentar la densidad energética y proteica de la dieta sin incrementar de forma desproporcionada la carga de sodio, fósforo o potasio. Estas medidas incluyen el ajuste del tamaño y la distribución de las raciones, la selección de alimentos con una mejor relación proteína/energía y la optimización del aporte en el día de diálisis, aspectos desarrollados previamente [18][29]. El papel del dietista-nutricionista es central en el diseño, individualización y seguimiento del soporte dietético. La educación nutricional continuada, el refuerzo positivo y la reevaluación periódica permiten adaptar la intervención a la evolución clínica del paciente y detectar de forma temprana la necesidad de estrategias complementarias, como la suplementación nutricional oral o la nutrición intradiálisis [82].
4.2. Uso de suplementos orales.
La suplementación nutricional oral (SNO) ocupa una posición intermedia y estratégica dentro del abordaje escalonado del DPE en HD, estando indicada cuando el soporte dietético resulta insuficiente para cubrir los requerimientos energéticos y proteicos. Su objetivo es complementar la ingesta habitual y prevenir la progresión del DPE, sin sustituir a la dieta convencional [18,84]. En este contexto, la suplementación oral permite incrementar de forma significativa la ingesta energética y proteica sin aumentar de forma relevante la carga de volumen ni la complejidad del plan dietético, y sin exigir cambios drásticos en los hábitos alimentarios del paciente [85].
La evidencia disponible indica que la SNO permite aumentar la ingesta energética y proteica total y mejorar diversos parámetros nutricionales, incluyendo el peso corporal, la albúmina sérica o la fuerza muscular, especialmente cuando se mantiene de forma continuada y se integra dentro de un programa de seguimiento nutricional [86-88]. Aunque la heterogeneidad metodológica limita la extrapolación a resultados duros, estudios observacionales de gran tamaño sugieren una reducción de la hospitalización y una mejora de la supervivencia en pacientes con alto riesgo nutricional [85,89].
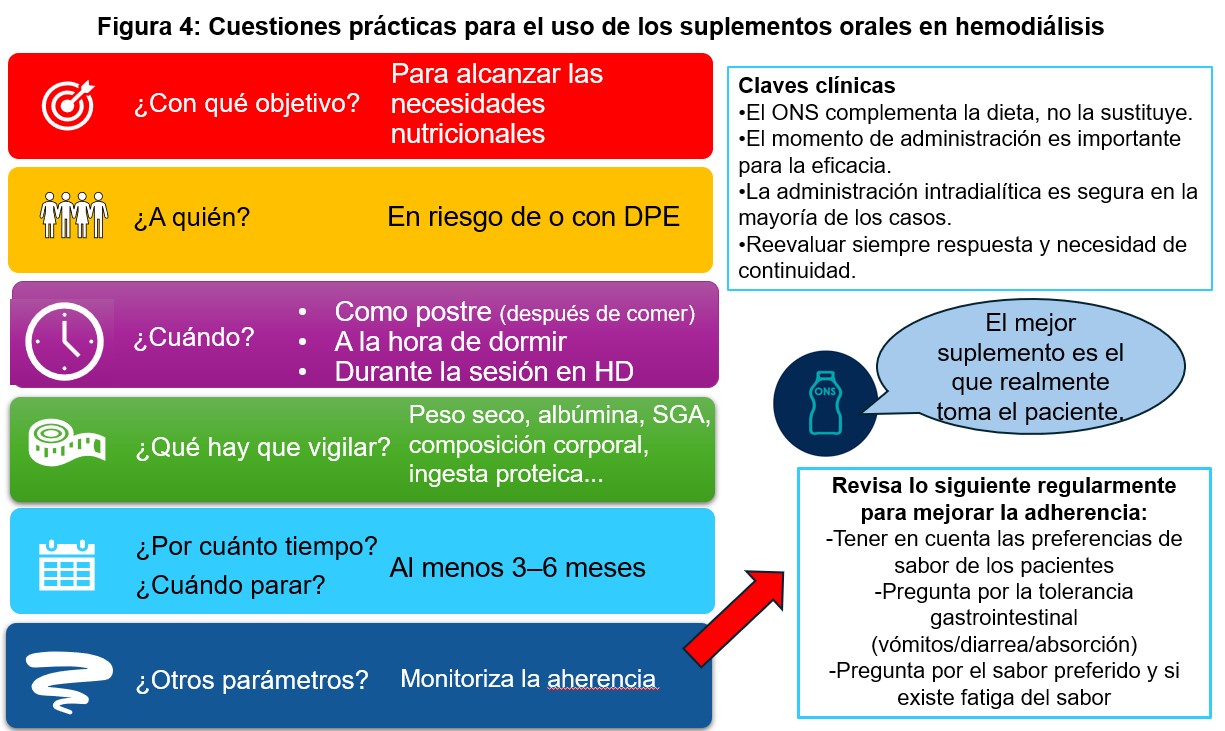
Las consideraciones prácticas para el empleo de suplementos nutricionales orales se detallan en la (Figura 4). Los suplementos específicos para enfermedad renal presentan ventajas claras frente a las formulaciones estándar en los pacientes en diálisis. Su mayor densidad energética, el contenido proteico adaptado a la situación dialítica y la menor carga de potasio, fósforo y sodio permiten un aporte nutricional eficaz en volúmenes reducidos, favoreciendo la tolerancia y la adherencia [18][32][85].
Un aspecto de especial interés es el momento de administración del suplemento. Tal y como hemos comentado previamente, la sesión de HD representa una oportunidad terapéutica infrautilizada para la intervención nutricional. La administración de suplementos durante la diálisis ha demostrado ser, en general, segura y eficaz, y permite mejorar la adherencia al asegurar la ingesta bajo supervisión directa [32][85], sin aumentar el riesgo de hipotensión ni otras reacciones adversas en la mayoría de los pacientes [33][34][35][36][90]. La prescripción debe individualizarse en función del perfil metabólico y funcional del paciente, y reevaluarse periódicamente para ajustar el tipo de suplemento, la dosis y el momento de administración según la respuesta clínica.
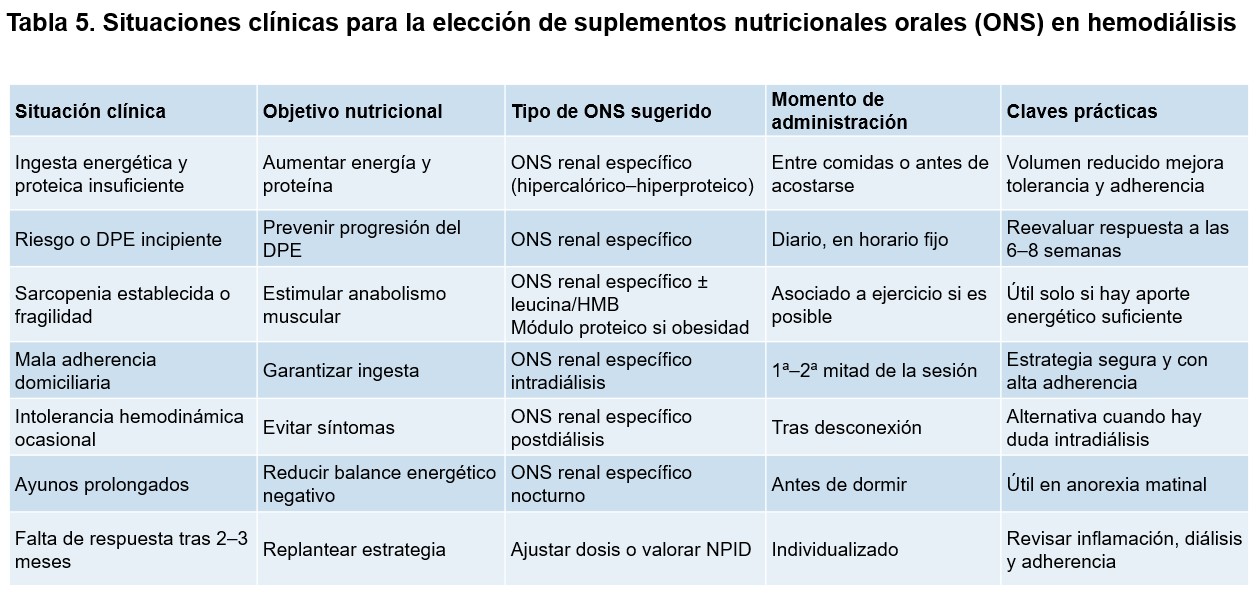
La (Tabla 5) enumera las principales situaciones clínicas en las que está indicada la utilización de suplementos nutricionales orales en HD. Su utilización temprana, personalizada y sostenida en el tiempo permite prevenir la progresión del deterioro nutricional, mejorar la tolerancia metabólica al tratamiento dialítico y, en muchos casos, evitar la necesidad de intervenciones nutricionales más complejas [18][90][91].
4.3. Nutrición parenteral intradiálisis.
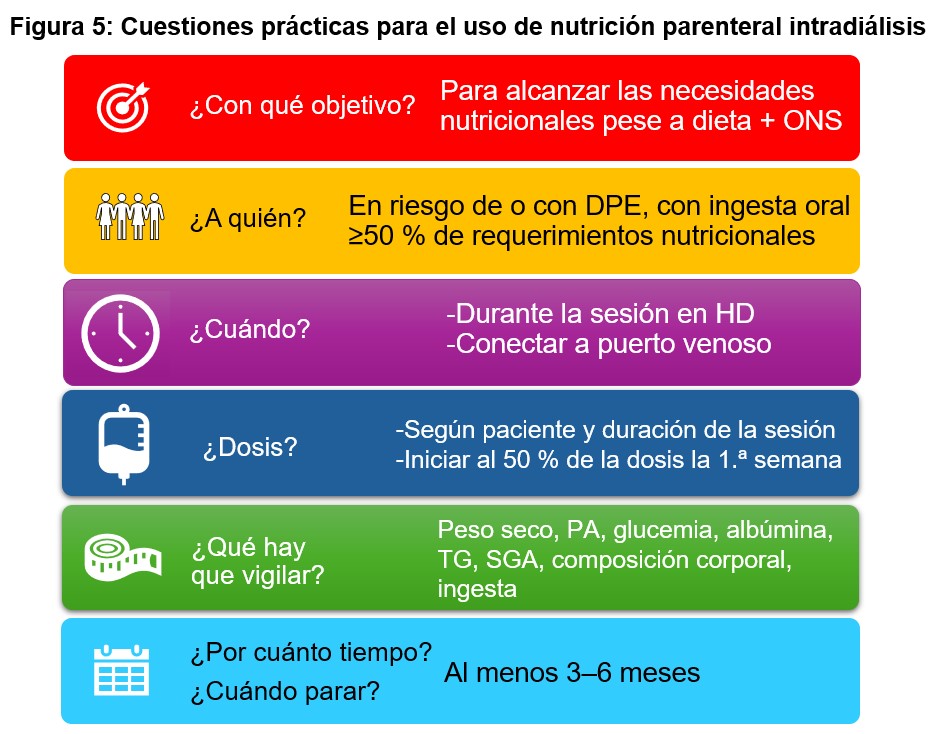
La nutrición intradiálisis parenteral (IDPN) consiste en la administración de nutrientes por vía intravenosa durante la sesión de HD, aprovechando el acceso vascular ya disponible [92][93]. Se trata de una estrategia de soporte nutricional de tercera línea, indicada en pacientes con deterioro nutricional establecido o en riesgo elevado de DPE, en los que el soporte dietético y la SNO han resultado insuficientes o no son factibles [18][94]. La (Figura 5) resume las cuestiones prácticas más relevantes relacionadas con el uso de nutrición parenteral intradiálisis.
La experiencia clínica disponible indica que la IDPN permite aumentar de manera significativa el aporte energético y proteico efectivo en pacientes seleccionados [95][96]. Ensayos clínicos aleatorizados han mostrado mejoras en parámetros bioquímicos relacionados con el estado nutricional, como la albúmina o la prealbúmina, así como estabilización o mejoría de la composición corporal frente a la atención estándar [97][98][99][100]. Aunque estos estudios presentan heterogeneidad metodológica y tamaños muestrales limitados, sus resultados son consistentes en señalar un beneficio nutricional cuando la IDPN se utiliza de forma adecuada. En conjunto, la IDPN representa una herramienta eficaz para mejorar el soporte nutricional en pacientes en HD seleccionados, cuando se utiliza de forma individualizada y como parte de una estrategia escalonada que prioriza la dieta y la vía oral siempre que sea posible [18][97].
5. Soporte dialítico para la prevención y tratamiento del DPE en pacientes en hemodiálisis.
5.1. Adecuación en hemodiálisis y estado nutricional.
El estado nutricional del paciente en HD está profundamente condicionado por la propia técnica dialítica. Más allá de su papel en la depuración de toxinas urémicas y el control del volumen, la HD actúa como un modulador central del entorno metabólico, inflamatorio y hormonal en el que se desarrollan el balance proteico, la masa muscular y el apetito. En este sentido, la adecuación de la diálisis debe considerarse una intervención terapéutica indirecta, pero esencial, en la prevención y el tratamiento del DPE [5][11]. Desde un punto de vista fisiopatológico, una diálisis inadecuada puede contribuir al deterioro nutricional a través de varios mecanismos: persistencia de toxinas urémicas con efecto anorexígeno (como leptina u otros solutos de peso molecular medio), inflamación crónica de bajo grado inducida por la bioincompatibilidad o por infecciones intercurrentes, acidosis metabólica insuficientemente corregida y pérdidas repetidas de aminoácidos, péptidos y micronutrientes durante la sesión [5][8]. Si estos factores no se corrigen generarán un entorno catabólico que limita la eficacia de cualquier intervención nutricional aislada.
Aunque la HD convencional tres veces por semana permite alcanzar objetivos mínimos de depuración, diversos estudios han mostrado que modalidades que incrementan la depuración convectiva o la frecuencia de tratamiento pueden asociarse a mejoras en parámetros nutricionales. La HDF-OL se ha relacionado con una reducción de marcadores inflamatorios, mejor control del estado de hidratación y mejoras modestas pero consistentes en proteínas viscerales y el apetito [101][102]. Estos efectos pueden ser especialmente relevantes en pacientes con DPE establecido o con inflamación crónica persistente. De forma similar, esquemas de HD más frecuente o diaria, utilizados de manera transitoria en situaciones seleccionadas (ingresos prolongados, procesos inflamatorios agudos, pérdida acelerada de masa muscular), han demostrado mejorar el balance nitrogenado, el control de la acidosis y la tolerancia metabólica, facilitando la recuperación nutricional cuando se combinan con un soporte nutricional adecuado [103][104].
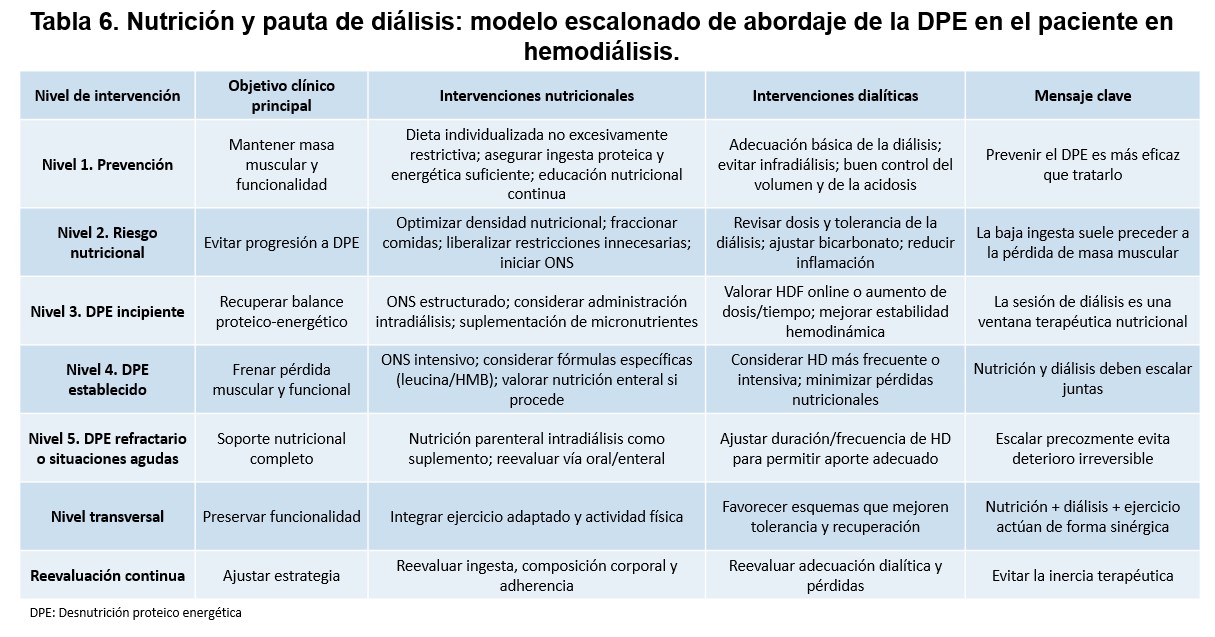
La corrección del estado ácido-base es otro elemento clave de la adecuación dialítica con impacto nutricional. Como se ha desarrollado previamente, la acidosis metabólica persistente actúa como un potente estímulo catabólico. La concentración de bicarbonato en el baño de diálisis, junto con la duración efectiva de la sesión, debe ajustarse de manera individual para evitar estados de acidosis crónica predialítica, especialmente en pacientes con sarcopenia o DPE [18]. Asimismo, la adecuación dialítica debe contemplar la minimización de pérdidas nutricionales inducidas por la técnica. Durante cada sesión de HD se producen pérdidas inevitables de aminoácidos, péptidos, vitaminas hidrosolubles y oligoelementos. Aunque estas pérdidas son relativamente pequeñas de forma aislada, su repetición crónica puede contribuir al deterioro nutricional, especialmente en pacientes con ingestas marginales o inflamación persistente [5]. Este hecho refuerza la necesidad de integrar la adecuación dialítica con estrategias nutricionales activas, como la ingesta intradiálisis, la suplementación oral o, en casos seleccionados, la IDPN. La (Tabla 6) integra nutrición y prescripción dialítica, proponiendo un modelo escalonado para el manejo del DPE en HD.
5.2. Peculiaridades del manejo nutricional del paciente en hemodiálisis en centro.
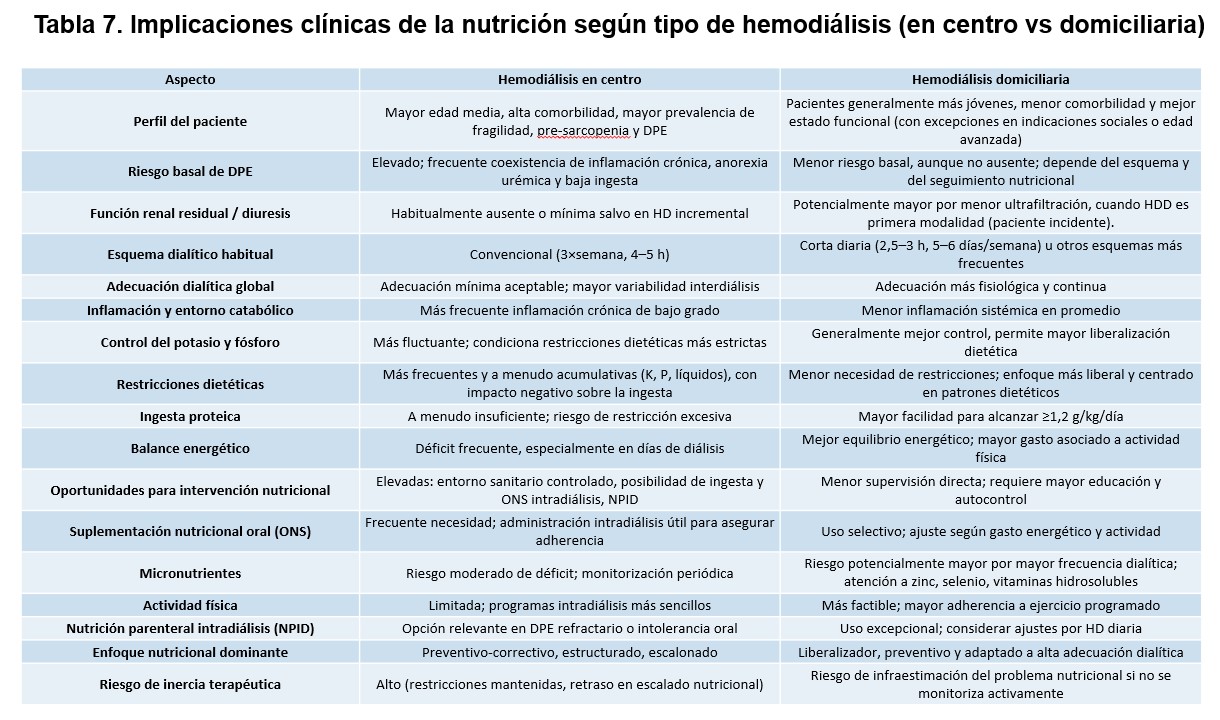
Las implicaciones nutricionales y clínicas diferenciadas entre HD en centro y HD domiciliaria se presentan en la (Tabla 7). Los pacientes tratados mediante HD en centro constituyen un grupo especialmente vulnerable desde el punto de vista nutricional. Se trata, en general, de una población de edad avanzada, con elevada carga de comorbilidad cardiovascular y metabólica, y sometida mayoritariamente a esquemas convencionales de HD trisemanales, con sesiones de 4 a 5 horas de duración. Este perfil clínico se asocia de forma frecuente a fragilidad, sarcopenia y DPE [105].
Oportunidades y limitaciones del entorno en centro
El tratamiento en centro presenta limitaciones evidentes, como la dependencia del transporte, los horarios rígidos y la fatiga asociada a la sesión de diálisis, que pueden dificultar la ingesta, especialmente en los días de tratamiento [106]. Sin embargo, este mismo entorno ofrece oportunidades únicas para la intervención nutricional. La presencia regular del paciente en un entorno sanitario permite una supervisión estrecha, la detección precoz de cambios clínicos y la implementación de estrategias estructuradas de soporte nutricional. En este sentido, el centro de diálisis debe concebirse no solo como un espacio de depuración renal, sino como un entorno activo de promoción de una nutrición adecuada, incluyendo la facilitación de alimentos y suplementos nutricionales orales durante la sesión de HD, tal como se ha discutido en apartados previos [33][34][35][36][90][91]. El centro de diálisis puede convertirse así en un espacio clave para reforzar la educación nutricional, monitorizar la adherencia, introducir suplementos nutricionales orales de forma pautada —incluida su administración intradiálisis— y, en casos seleccionados, implementar IDPN. La coordinación entre nefrólogos, el personal de enfermería y los nutricionistas es fundamental para que estas intervenciones sean eficaces y sostenibles [18].
Abordaje nutricional individualizado y escalonado
El plan nutricional debe adaptarse a las características del paciente, con un objetivo general de ingesta proteica en torno a 1,2 g/kg/día y un aporte energético suficiente para evitar el balance negativo, ajustado según edad, nivel de actividad y composición corporal [18]. En pacientes frágiles o con saciedad precoz, resulta prioritario optimizar la densidad nutricional de la dieta y evitar restricciones innecesarias que comprometan la ingesta global.
Cuando la dieta habitual no permite alcanzar los objetivos, debe considerarse de forma precoz la SNO, seleccionando la fórmula más adecuada según el perfil clínico (diabetes, sarcopenia, inflamación) y prestando especial atención al momento de administración. La intervención nutricional debe complementarse, siempre que sea posible, con la prescripción de actividad física o ejercicio adaptado, incluso de baja intensidad. En pacientes en HD en centro, programas sencillos de ejercicio intradiálisis o domiciliario supervisado pueden contribuir de forma significativa a preservar la masa muscular y la funcionalidad, especialmente cuando se combinan con un soporte nutricional adecuado [107][108][109].
Enfoque integrado y prevención de la inercia terapéutica
Un aspecto clave en el manejo del paciente en centro es evitar la inercia terapéutica, tanto en la restricción como en la intensificación del soporte nutricional. La persistencia de ingesta insuficiente, pérdida de masa muscular o deterioro funcional debe conducir a una reevaluación activa del plan nutricional y dialítico, escalando las intervenciones cuando sea necesario y evitando retrasos que condicionen situaciones clínicamente irreversibles. Este enfoque resulta especialmente relevante en una población envejecida y frágil, en la que pequeñas mejoras en el estado nutricional pueden traducirse en beneficios clínicos significativos en términos de funcionalidad, tolerancia al tratamiento y calidad de vida.
5.3. Peculiaridades del manejo nutricional del paciente en hemodiálisis domiciliaria.
Los pacientes tratados mediante HD domiciliaria (HDD) presentan, en términos generales, un perfil nutricional más favorable que aquellos en HD en centro. Este hecho no debe interpretarse como un efecto exclusivo de la técnica, sino como el resultado de una combinación de factores clínicos, organizativos y fisiopatológicos que condicionan tanto el riesgo de DPE como las oportunidades de intervención nutricional. En primer lugar, existe un claro sesgo de selección: los programas de HDD incluyen con mayor frecuencia pacientes más jóvenes, con menor carga de comorbilidad cardiovascular y metabólica, mejor situación funcional y mayor nivel de autonomía. Este perfil se asocia a una mayor actividad física, mejor composición corporal y menor prevalencia de fragilidad y sarcopenia, factores todos ellos estrechamente ligados al estado nutricional [110].
Un segundo elemento clave es la posibilidad de realizar una HD más frecuente y fisiológica, lo que contribuye una mayor corrección del medio urémico y un entorno metabólico menos catabólico, con impacto favorable sobre la inflamación, el apetito y el estado nutricional y funcional global. Desde el punto de vista técnico, el esquema de HDD más habitual en nuestro medio es la HD corta diaria, con sesiones de 2,5–3 horas, cinco o seis días por semana [111]. Este esquema terapéutico representa una forma más fisiológica de sustitución de la función renal, con una mayor estabilidad metabólica y hemodinámica. La mayor frecuencia dialítica se asocia a un mejor control del volumen, del sodio, del potasio y del fósforo, lo que permite liberalizar la dieta de forma segura y reducir la necesidad de restricciones clásicas que penalizan la ingesta [104], lo que se traduce en una reversión del hipercatabolismo asociado al síndrome urémico, con potenciales beneficios sobre la calidad de vida y la supervivencia [111][112]. Adicionalmente, este mejor control metabólico facilita aceptar pesos secos ligeramente superiores, minimiza la ganancia interdialítica y por tanto la ultrafiltración excesiva, lo que impacta positivamente en la tolerancia al tratamiento, la calidad de vida y, probablemente, al mantenimiento de la función renal residual [110][113]. Del mismo modo, la HDD larga nocturna también se asocia a una mejoría en el estado nutricional de los pacientes en diálisis [114][115].
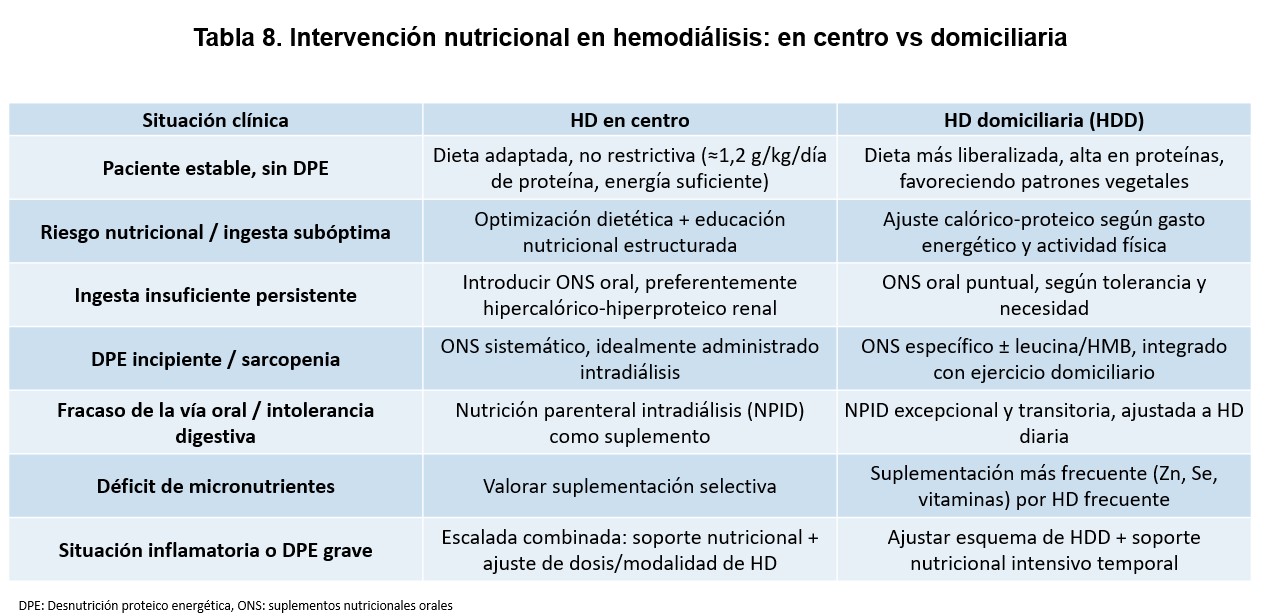
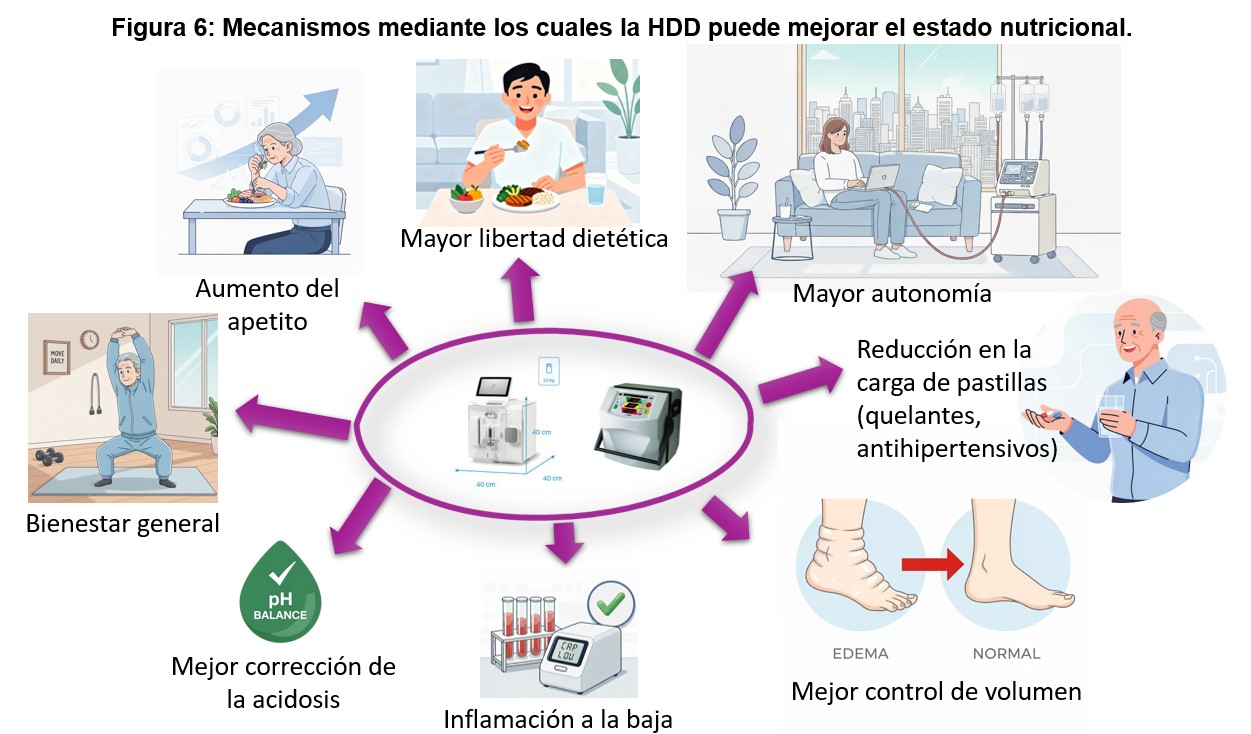
La (Figura 6) ilustra los mecanismos mediante los cuales la HDD puede contribuir a mejorar el estado nutricional. En conjunto, la HDD ofrece un marco particularmente favorable para el manejo nutricional, gracias a una mayor adecuación dialítica, mejor control metabólico y mayor flexibilidad dietética, consolidando su papel como una modalidad especialmente adecuada para la prevención y el tratamiento del DPE. No obstante, estas ventajas no eximen de la necesidad de una evaluación nutricional sistemática y de un seguimiento activo. Las diferencias prácticas en la intervención nutricional entre HD en centro y HD domiciliaria se resumen en la (Tabla 8).
Conclusiones
El manejo nutricional del paciente en HD debe entenderse hoy como una parte inseparable del tratamiento dialítico integral. La experiencia clínica y la evidencia disponible muestran que una aproximación basada exclusivamente en la restricción dietética y en el control analítico aislado resulta insuficiente y, en muchos casos, contraproducente. El objetivo real no es “normalizar parámetros analíticos”, sino preservar la masa muscular, la funcionalidad y la calidad de vida, anticipándose al desarrollo del DPE.
Desde una perspectiva práctica, la dieta por sí sola rara vez es suficiente si el entorno dialítico no es el adecuado. En este contexto, la optimización de la técnica de HD debe considerarse una intervención nutricional indirecta al mejorar la depuración de toxinas, reducir la inflamación, corregir la acidosis y paliar la pérdida de nutrientes mediante la ingesta de alimentos y la suplementación oral o parenteral cuando sea necesario. Integrar de forma coherente la dieta, la prescripción dialítica y el soporte nutricional, adaptándolos a la situación clínica y funcional de cada paciente, nos permitirá sin duda mejorar resultados clínicos relevantes para las personas con ERC en HD.