Hipertensión arterial resistente
Palabras clave
Hipertension arterial resistente, Hipertensión Bata Blanca, Pseudohipertensión
Introducción
La hipertensión arterial (HTA) resistente constituye un reto diagnóstico y terapéutico para el profesional sanitario que trata pacientes hipertensos. Los factores que confluyen en la HTA resistente son múltiples e incluyen circunstancias habituales como la edad avanzada, la obesidad, el síndrome de apnea-hiponea del sueño (SAHS), la presencia de diabetes o de enfermedad renal crónica (ERC) u otras comorbilidades. Asimismo, la HTA resistente se ve favorecida por la falta de cumplimiento por parte del paciente o la inercia terapéutica de los clínicos.
En este capítulo se revisa la definición de la HTA resistente y aquellas situaciones que deben considerarse antes de confirmar el diagnóstico, como el fenómeno de bata blanca, por lo que se resaltará la importancia de medir la presión arterial (PA) fuera del ámbito clínico o el despistaje de HTA secundaria. El manejo adecuado de todas estas situaciones así como una optimización e intensificación del tratamiento farmacológico, o la indicación de algunas terapias invasivas, pueden contribuir a mejorar el control de la HTA resistente.
Definición de hipertensión arterial resistente
La definición clásica de HTA resistente es aquella situación en la que no se alcanza el objetivo de control, PA < 140/90 mmHg, a pesar de realizar tratamiento no farmacológico (modificaciones del estilo de vida) y farmacológico con tres agentes antihipertensivos a la máxima dosis tolerada incluido un diurético [1][2]. La combinación más habitual es la formada por un antagonista del calcio, un inhibidor de la enzima de conversión de angiotensina (IECA) o un antagonista de los receptores de angiotensina (ARA II), y un diurético tiazídico.
La American Heart Association ha ampliado esta definición incluyendo también aquellos pacientes hipertensos que alcanzan el objetivo de control mediante el uso de cuatro o más fármacos antihipertensivos [3]. Además, durante mucho tiempo se han utilizado los términos resistente y refractaria como sinónimos, pero desde hace unos años se reserva el concepto “HTA refractaria” para aquellos casos que no alcanzan el objetivo de control a pesar de utilizar cinco o más antihipertensivos, precisándose en algunas definiciones que esta quíntuple combinación ha de incluir un diurético tiazídico y un fármaco antagonista mineralcorticoide [4]. Además, para el correcto diagnóstico de HTA refractaria debe excluirse la HTA pseudorresistente por fenómeno de bata blanca y la HTA secundaria.
La redefinición de la HTA al umbral 130/80 mmHg de las guías norteamericanas propuesta por el American College of Cardiology, la American Heart Association (ACC/AHA 2017) conlleva que la definición de HTA resistente utiliza estas cifras para establecer el diagnóstico [5]. Sin embargo, en Europa las guías ESC/ESH 2018 se ha mantenido la definición de HTA resistente con el umbral de PA > 140/90 mmHg pese al uso de 3 fármacos incluido un diurético [1].
Prevalencia de la HTA resistente
Los estudios sobre prevalencia de HTA resistente están limitados por las características de las poblaciones o cohortes de pacientes analizadas. Según los datos del estudio National Health and Nutrition Examination Survey (NHANES), la prevalencia ha ido aumentando de 8,5% en el periodo 1999-2004 hasta 11,8% en 2005-2008 [6]. En los datos de la cohorte de Kaiser Permanente de California, la prevalencia de HTA resistente fue 16,9% al aplicar la definición convencional y 21,8% según los criterios de las guías ACC/AHA 2017 [7]. Según los datos del Registro Español de Monitorización Ambulatoria de Presión Arterial (MAPA), el 12,2% de los hipertensos tratados presentaron HTA resistente [8]. Cuando se analizan los datos de ensayos clínicos en los que se utilizan esquemas de tratamiento escalonado con el objetivo de conseguir un control adecuado de la HTA, se observa que un 20-30% de los pacientes precisa más de 3 fármacos antihipertensivos [9]. Finalmente, en pacientes con ERC se han descrito prevalencias de HTA resistente incluso más elevadas con cifras entre el 25% y el 40%, observándose un aumento del riesgo de resistencia al tratamiento antihipertensivo a medida que disminuye el filtrado glomerular [10][11][12][13].
Características clínicas de paciente con hipertensión arterial resistente
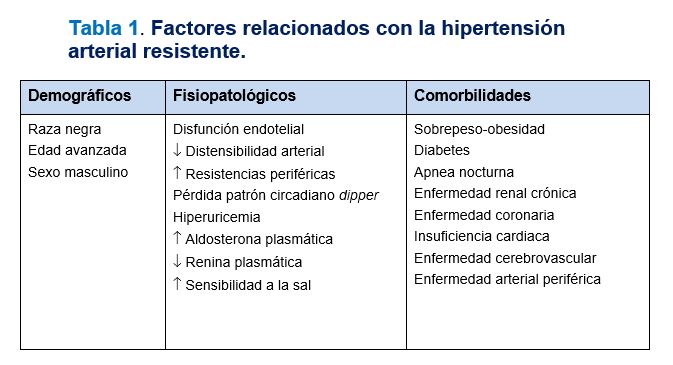
El fenotipo del paciente con HTA resistente incluye una serie de factores demográficos, fisiopatológicos, de comorbilidades asociadas y daño subclínico de órgano diana que contribuyen tanto en su resistencia al tratamiento farmacológico como en su pronóstico cardiovacular (Tabla 1). Tanto la raza negra, la edad avanzada o el sexo masculino se relacionan con una mayor prevalencia de HTA resistente. Asimismo, la presencia de otras morbilidades como la obesidad, el SAHS, la diabetes o la ERC contribuyen de forma clara en dicha resistencia. Estas situaciones conllevan o se asocian con cambios fisiopatológicos que determinan la aparición de daño orgánico y de enfermedad cardiovascular establecida [3].
Pronóstico de la hipertensión arterial resistente
Los pacientes con HTA resistente presentan un riesgo cardiovascular más elevado que los pacientes con HTA controlada. En un estudio retrospectivo con más de 200.000 pacientes, aquellos que presentaban HTA resistente presentaban un aumento del 47% de riesgo de presentar un infarto de miocardio, insuficiencia cardiaca, ictus, enfermedad renal crónica en un periodo de seguimiento de unos 4 años [14]. Asimismo, estudios prospectivos con MAPA muestran que el riesgo cardiovascular de los pacientes con HTA resistente duplica al de pacientes que responden al tratamiento [15][16].
Evaluación del paciente con hipertensión arterial resistente
Como se comentaba anteriormente, en el diagnóstico de la HTA resistente hay que descartar aquellas situaciones que favorecen la pseudorresistencia, entre las que cabe destacar el incumplimiento terapéutico, el fenómeno de bata blanca, una técnica inadecuada de medida de la PA, la pseudohipertensión y la inercia clínica y terapéutica.
Cumplimiento terapéutico
La evaluación del cumplimiento terapéutico es un paso esencial en el abordaje del paciente hipertenso. Debe considerarse tanto la capacidad del paciente para seguir las recomendaciones de forma diaria (adherencia) como el mantenimiento de dichas recomendaciones a lo largo de tiempo (persistencia). Ambos aspectos están muy influidos por el número de comprimidos prescritos al día. Se considera que el cumplimiento terapéutico necesario para que el paciente se beneficie del tratamiento farmacológico debe ser superior al 80% de lo prescrito [3]. Los datos sobre tasas de incumplimiento son muy variables, ya que oscilan entre el 7% al revisar registros de recogida de fármacos en farmacias, hasta > 60% cuando se mide concentración de fármaco en sangre [17]. La falta de cumplimiento terapéutico es una de las principales causas de sobreestimación de la prevalencia de HTA resistente [3].
Fenómeno de bata blanca
Este fenómeno consiste en la observación de cifras tensionales elevadas en consulta en un paciente hipertenso que presenta cifras normales fuera de la consulta. La prevalencia de HTA de bata blanca se sitúa en torno al 30% [18]. Diversos estudios estiman que entre un 30-35% de pacientes con HTA aparentemente resistente presentan en realidad este fenómeno. El fenómeno de bata blanca se puede identificar fácilmente mediante la MAPA o la automedida domiciliaria de la presión arterial (AMPA) [19]. El Registro Español de MAPA mostró que el 62,5% de los pacientes con HTA resistente presentaban una HTA resistente verdadera y un 37,5% mostraba una HTA pseudorresistente por fenómeno de bata blanca [8].
Técnica inadecuada de medida de presión arterial
La introducción de métodos automáticos de medición han resuelto varias fuentes de error en la medida de la PA, como el sesgo del personal que realiza la medida, la velocidad de inflado y desinflado del manguito o la preferencia de finalizar la medida en cero o cinco. Sin embargo, otros factores influyen en la medición correcta de la PA, como el tamaño del manguito adecuado al brazo del paciente, la posición del brazo y del paciente, el ambiente y condiciones en que se realiza la medida. La técnica correcta de medida de la PA debe realizarse en una habitación en silencio, a temperatura adecuada, con la espalda apoyada en el respaldo y los pies en el suelo, sin cruzar las piernas y con la vejiga urinaria vacía. Debe utilizarse un manguito con porción hinchable de longitud adecuada, que cubra al menos el 80% de la circunferencia del brazo, y una anchura de al menos el 40% de la longitud del brazo. El manguito se colocará directamente sobre la piel del brazo a la altura del corazón. Se recomienda realizar al menos tres medidas separadas por 1 minuto [1][2] [20].
Pseudohipertensión
En pacientes con un incremento de la rigidez arterial pueden detectarse mediciones auscultatorias de PA elevadas con valores intraarteriales normales, con el consiguiente sobrediagnóstico de HTA resistente. Este fenómeno debe sospecharse en pacientes con HTA grave y ausencia de daño orgánico, en pacientes con síntomas de hipotensión, con evidencia radiológica de calcificación vascular, con cifras de PA más elevadas en brazos que en piernas y en pacientes con HTA sistólica aislada severa. Clásicamente, la maniobra de Osler, que consiste en la palpación del pulso radial a pesar de oclusión de la arteria mediante el inflado del manguito a cifras suprasistólicas, permite sospechar esta situación [21].
Inercia clínica y terapéutica
La prescripción de fármacos antihipertensivos a dosis subóptimas, el uso infrecuente de combinaciones o de combinaciones no sinérgicas, o la perpetuación de una pauta farmacológica en pacientes no controlados, contribuyen en la falta de control tensional y en el sobrediagnóstico de HTA resistente.
Otras situaciones clínicas asociadas con la hipertensión arterial resistente
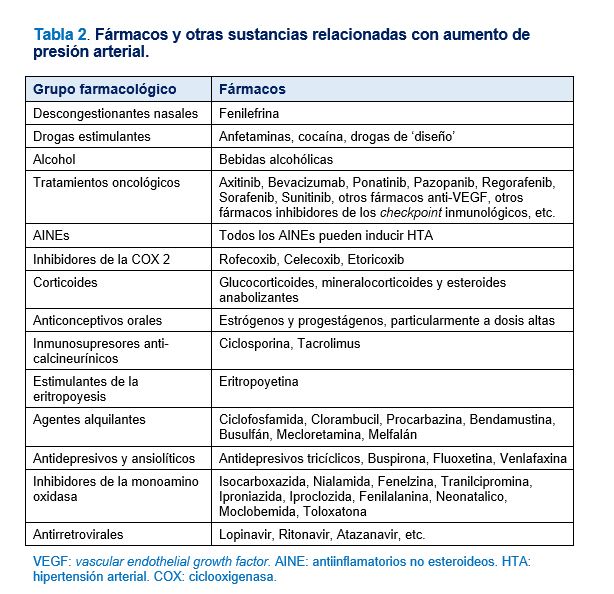
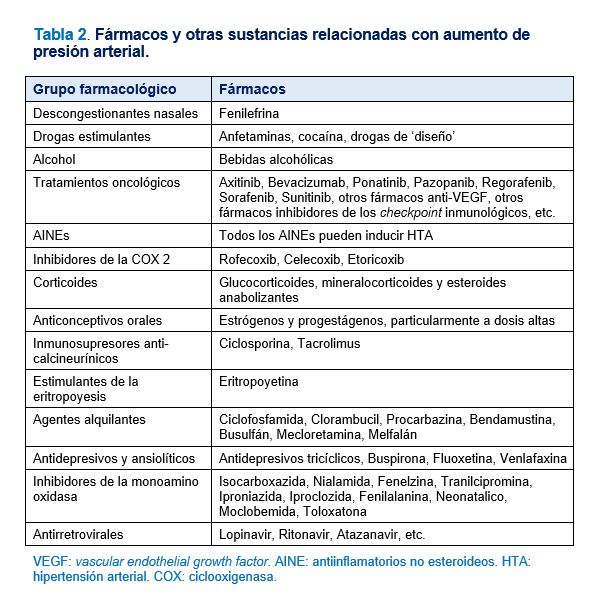
Además de todo lo comentado anteriormente, otras situaciones clínicas pueden contribuir a la resistencia al control tensional, por ejemplo el uso de fármacos u otras sustancias presoras, el síndrome de apnea obstructiva del sueño o la presencia de una ERC o una HTA secundaria. El uso de fármacos para el tratamiento de patologías concomitantes o el consumo de otras sustancias es una causa frecuente de HTA resistente [3], que precisa un abordaje individualizado sobre la necesidad de ajustes de dosis de dichos fármacos o la recomendación de evitar algunos consumos inadecuados (Tabla 2). El SAHS es muy frecuente en pacientes con HTA resistente, con prevalencias que pueden alcanzar el 70-90% [22]. El diagnóstico y tratamiento adecuado de dicho síndrome puede mejorar el control del paciente hipertenso resistente.
Aunque el diagnóstico de la HTA secundaria excede los objetivos de este capítulo, sin duda debe ser tenido en cuenta en la evaluación del paciente con HTA resistente, tanto por las particularidades de su diagnóstico como de su tratamiento específico [23]. La HTA secundaria es objeto de un capítulo específico en Nefrología al Día [enlace]. A destacar por su especial frecuencia el hiperaldosteronismo primario y la ERC. La presencia de ERC, independientemente de su etiología o de que se trate de una nefropatía primaria o una complicación de una HTA no controlada de larga evolución, contribuye en la resistencia al tratamiento. Dicho deterioro de la función renal se relaciona frecuentemente con un empeoramiento de la excreción de sodio, sobrecarga de volumen, activación del sistema renina-angiotensina-aldosterona y aumento de la actividad simpática, mecanismos fisiopatológicos todos ellos implicados en la génesis y mantenimiento de la HTA resistente [24].
Diagnóstico de hipertensión arterial resistente
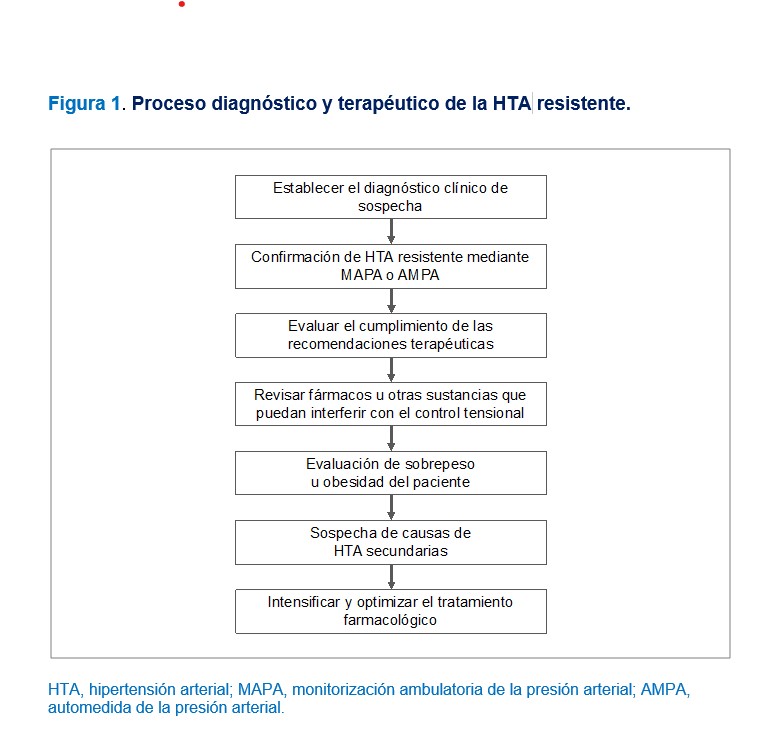
La evaluación diagnóstica del paciente con HTA resistente debe ir dirigida a confirmar la presencia de una resistencia verdadera, la identificación de aquellas causas contribuye en esa resistencia y la detección de complicaciones asociadas a la progresión de la hipertensión. De tal forma, la evaluación de cumplimiento terapéutico y el uso de MAPA o AMPA para confirmar la elevación de la PA son necesarios (Figura 1) [1][2][3][5][25].
Historia clínica
Debe documentarse la duración, gravedad y evolución de la hipertensión, los fármacos antihipertensivos previos y sus efectos secundarios y el uso de otros fármacos o sustancias que puedan elevar la PA o interferir los efectos de los antihipertensivos.
Exploración física
El examen físico del paciente con HTA resistente debe ir dirigido a identificar daño orgánico y posibles causas secundarias. La presencia de daño vascular incluirá la palpación de pulsos carotídeos y periféricos, la auscultación abdominal para la identificación de soplos, que podrían asociarse a una estenosis de arteria renal, y la exploración del fondo de ojo. En la primera visita, la PA se medirá en ambos brazos y piernas si se sospecha una coartación aórtica. El hipercortisolismo puede estar presente en pacientes con obesidad y estrías abdominales, facies de luna llena y depósito de grasa interescapular.
Presión arterial fuera de la consulta
La disparidad entre las cifras de PA medidas en consulta y fuera de ella es muy frecuente. Se recomienda la utilización de técnicas automáticas de medida en consulta, si es posible sin supervisión de personal sanitario, así como la AMPA y la MAPA. De todos estos métodos, la MAPA es de elección para el diagnóstico por su mayor capacidad pronóstica en comparación con las medidas realizadas en consulta.
Técnicas de laboratorio
La evaluación de pacientes con HTA resistente debe incluir una bioquímica básica (sodio, potasio, cloro, bicarbonato, glucosa, creatinina y urea plasmáticos) y perfil lipídico. En orina se realiza determinación de excreción urinaria de albúmina, natriuresis y estudio de sedimento. Se determinarán renina y aldosterona plasmáticas para calcular el cociente aldosterona/renina como test de cribado de hiperaldosteronismo, así como determinación de cortisol si se sospecha un hipercortisolismo, o catecolaminas en orina en casos con clínica sospechosa de feocromocitoma.
Técnicas radiológicas
En aquellos casos con sospecha de estenosis de arteria renal se recomienda la realización de Doppler renal en un primer paso. La angiotomografía computorizada o la angiorresonancia se utilizarán como tests de confirmación, si bien deben ser utilizados con cautela en presencia de enfermedad renal. La arteriografía renal en ausencia de hallazgos en los tests no invasivos no se recomienda.
En pacientes con sospecha bioquímica de neoplasias adrenales (aldosterona, catecolaminas o cortisol elevados), se realizará tomografía computorizada o resonancia magnética.
Consulta especializada
En aquellos casos con HTA resistente verdadera, sospecha de HTA secundaria o ERC establecida, se recomienda una consulta especializada (Figura 1).
Tratamiento de la hipertensión arterial resistente
El tratamiento más adecuado para la HTA resistente se basa en la identificación y normalización de todos los factores contribuyentes a dicha resistencia, ya comentados previamente. Además, desde el punto de vista farmacológico hay una serie de recomendaciones para optimizar la pauta de tratamiento (Tabla 3).
Cambios de estilo de vida
Las recomendaciones sobre cambios de estilo de vida tienen que estar presentes en el tratamiento de todo paciente con HTA resistente. La pérdida de un 5-10% del peso corporal se acompaña de una reducción significativa de las cifras de PA y de los requerimientos de fármacos. Igualmente, la dieta pobre en sodio disminuye la PA de forma significativa en pacientes con HTA resistente. Se recomienda una ingesta de sal inferior a 5 gramos al día. Asimismo, se recomienda una dieta rica en frutas y verduras y restricción del consumo de alcohol. Por otra parte, la realización de ejercicio físico regular contribuye a mejorar el control de la HTA resistente.
Tratamiento farmacológico
De acuerdo con la definición de HTA resistente, el esquema terapéutico de partida consiste en una combinación de un antagonista del calcio, un IECA o ARA, y un diurético tiazídico, todos ellos a la dosis máxima recomendada. En presencia de un filtrado glomerular inferior a 45 ml/min/1,73 m2 la hidroclorotiazida no es efectiva, mientras que la clortalidona mantiene su eficacia hasta filtrados de 30 ml/min/1,73 m2. Por debajo de estas cifras se precisará un diurético de asa. Esta triple terapia puede simplificarse mediante la utilización de combinaciones de fármacos en un único comprimido, lo que puede contribuir a favorecer el cumplimiento terapéutico [1][3].
Como siguiente paso en el tratamiento farmacológico, la adición de una dosis baja de espironolactona (12,5 a 50 mg) puede acompañarse de una reducción de PA sistólica/diastólica de unos 20/10 mmHg. El estudio PATHWAY-2 mostró que espironolactona es la opción más efectiva en comparación con placebo, bisoprolol o doxazosina [26]. Igualmente, el uso de antialdosterónicos más específicos, como eplerenona, también se acompaña de descensos significativos de la PA en pacientes con HTA resistente, y con un mejor perfil de tolerabilidad [27]. Estos efectos sugieren un estado de aldosteronismo aumentado presente en muchos pacientes con HTA resistente. Las recomendaciones sobre la adición de más fármacos se basan en el consenso de expertos, ya que no hay datos procedentes de ensayos clínicos. Puede añadirse un betabloqueante en pacientes con tendencia a la taquicardia, o si este está contraindicado, plantear un agonista central como clonidina. Mucho menos frecuentemente se recomienda hidralazina en pacientes con insuficiencia cardiaca, o minoxidil en pacientes que no alcancen el objetivo de control [3].
Terapias invasivas
La activación simpática es frecuente en pacientes con HTA resistente y el bloqueo farmacológico de dicha actividad no siempre es posible debido a los efectos secundarios de los fármacos. La técnica de denervación simpática renal mediante cateterismo bilateral de ambas arterias renales y aplicación de radiofrecuencia, ultrasonido o inyección de sustancias neurotóxicas se ha descrito como una opción de tratamiento en pacientes con HTA resistente. Las evidencias clínicas sobre la eficacia de la técnica son motivo de controversia. Varios estudios observacionales y registros nacionales e internacionales muestran una reducción significativa de la PA en estos pacientes [28][29][30]. El primer estudio aleatorizado controlado con placebo confirmaba la seguridad de la técnica, pero no mostraba reducciones significativas de la PA [31]. Otros estudios aleatorizados posteriores de pequeño tamaño han mostrado la eficacia antihipertensiva de esta técnica, con descenso de la PA sistólica ambulatoria de 24 horas entre 5-10 mmHg [32]. Esta técnica sigue siendo motivo de estudio para clarificar aspectos fundamentales como la identificación de predictores de respuesta a la denervación o las diferencias entre los diferentes métodos disponibles. Con el mismo sustrato fisiopatológico de modular la actividad simpática se ha desarrollado otra técnica de estimulación eléctrica de barorreceptores carotídeos, que precisa la implantación de un dispositivo en el paciente. Las primeras evidencias publicadas mostraron descensos significativos de la PA en pacientes con HTA refractaria muy seleccionados [33]. Otras terapias invasivas como la estimulación mecánica de los barorreceptores carotídeos [34] o la creación percutánea de fístulas arteriovenosas están en fases iniciales de estudio [35].
Conclusiones finales
La mejora del control de la HTA resistente precisa un abordaje multifactorial dirigido a mejorar los estilos de vida, diagnosticar y tratar aquellas comorbilidades asociadas y a optimizar el tratamiento antihipertensivo. La MAPA aporta información de gran relevancia tanto en el diagnóstico como en el tratamiento de la HTA resistente. Es fundamental evaluar el cumplimiento del tratamiento e intentar simplificarlo mediante el uso de combinaciones de fármacos antihipertensivos en un mismo comprimido. El uso de fármacos antialdosterónicos contribuye a mejorar el control de pacientes con HTA resistente. En algunos pacientes seleccionados la denervación simpática renal u otras técnicas invasivas pueden ser contribuir a mejorar el control.