Hipertensión arterial renovascular
Palabras clave
Enfermedad renal vascular, Nefropatía isquémica, Angioplastia transluminal percutánea, Revascularización quirúrgica
Introducción
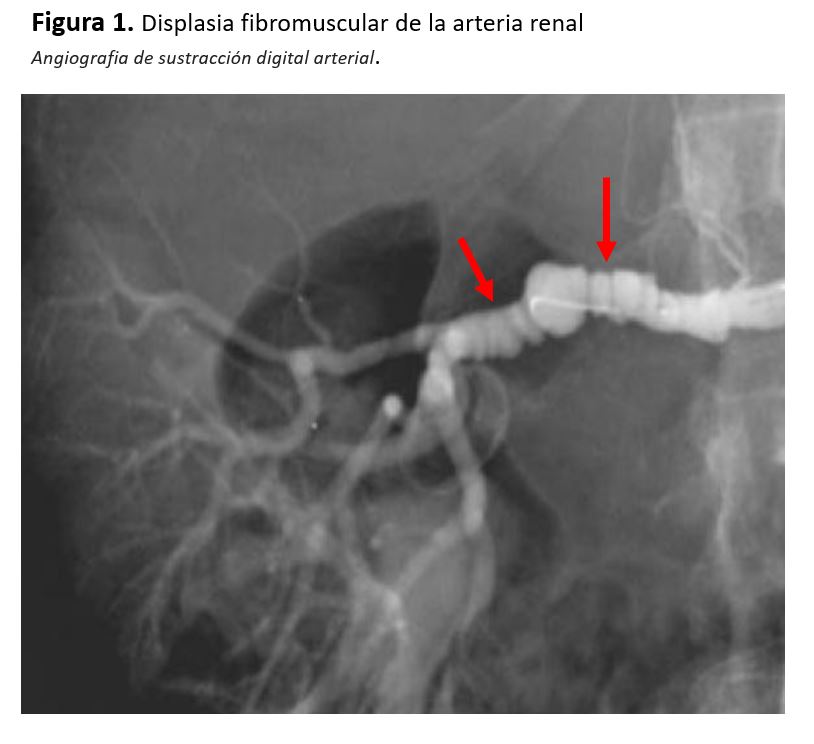
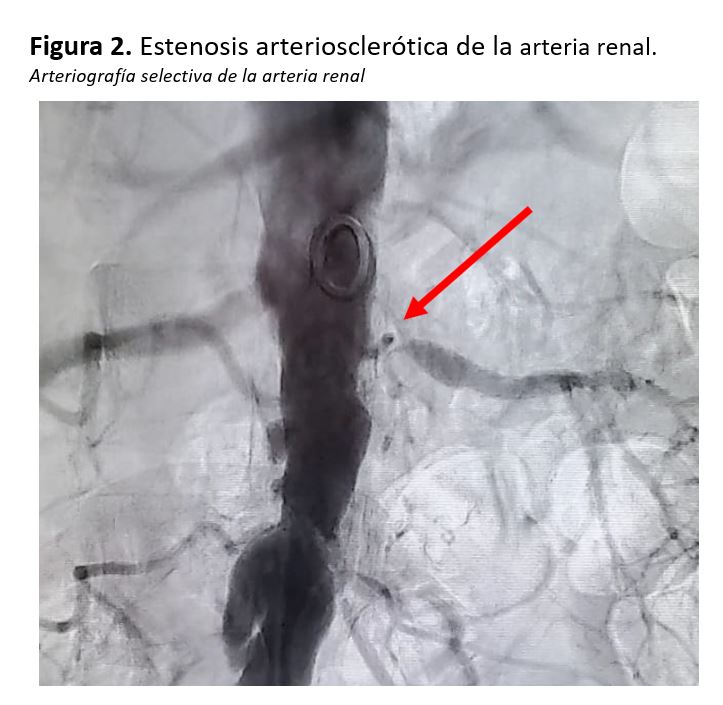
La enfermedad renal vascular (ERV) es una causa importante de hipertensión arterial (HTA) secundaria y puede presentarse con una gama de manifestaciones clínicas que van desde la HTA asintomática hasta la insuficiencia renal o el edema pulmonar. Existen distintos tipos, grados y manifestaciones clínicas de ERV. La mayoría de los casos se deben a una lesión aterosclerótica en el contexto de enfermedad aterosclerótica generalizada, siendo la displasia fibromuscular la segunda causa. La ecografía-Doppler, la angiografía con tomografía computarizada (TC) o resonancia magnética (RM), son exploraciones iniciales ante la sospecha de ERV, aunque el diagnóstico se confirma mediante arteriografía (Figura 1) y (Figura 2). La realización de esta última suele plantarse con intención terapéutica si se confirma la sospecha diagnóstica. Sin embargo, la angioplastia con stent en la arteria renal no ha mostrado beneficios adicionales frente al tratamiento médico óptimo en los ensayos prospectivos con pacientes con ERV moderada. Esto puede deberse tanto al diseño inadecuado de los estudios como al hecho de olvidar una parte importante de la fisiopatología, esto es, el daño renal progresivo causado por la inflamación renal, la remodelación microvascular y el daño mitocondrial resultantes de la isquemia por hipoperfusión crónica, que podrían ser susceptibles de tratamientos médicos específicos. De momento, la terapia médica integral, incluido el uso de agentes que bloquean el sistema renina-angiotensina-aldosterona (SRAA) y el control de lípidos, constituye la base del manejo de la ERV aterosclerótica, pero los médicos deben reconocer la HTA renovascular que progresa a presentaciones clínicas de alto riesgo que deberían someterse a revascularización renal para lograr mejores resultados renales y cardiovasculares.
El sistema arterial renal, que abarca desde las arterias renales principales hasta la microvasculatura renal, es un determinante clave tanto de la función renal como de la regulación de la presión arterial (PA) sistémica. En el presente capítulo se abordará la ERV de vaso grande como causa de HTA secundaria o HTA renovascular.
Enfermedad renal vascular, hipertensión renovascular
La ERV, mayoritariamente debida a lesiones ateroscleróticas en la arteria renal, constituye una de las causas más frecuentes de HTA secundaria [1]. Esta forma de HTA se conoce como HTA renovascular. La HTA renovascular es potencialmente reversible pero también puede ocasionar insuficiencia renal sobre todo en población de edad avanzada. La ERV puede presentarse con una amplia gama de manifestaciones clínicas desde HTA asintomática a HTA resistente, desde disminución progresiva de la función renal hasta insuficiencia renal, o bien con síndromes de desestabilización cardíaca como edema o congestión pulmonar, insuficiencia cardiaca recurrente o síndromes coronarios agudos [2]. Los pacientes con ERV tienden a progresar a enfermedad renal crónica (ERC) y tienen un mayor riesgo de desarrollar HTA renovascular y complicaciones cardiovasculares con el consiguiente aumento de morbilidad y mortalidad. Así, las enfermedades vasculares crónicas representan una de las principales causas de ERC que precisa tratamiento renal sustitutivo mediante diálisis y trasplante renal. Los experimentos iniciales, hace más de 80 años, demostraron que la reducción en la presión de perfusión renal daba lugar a un incremento en la PA sistémica mediante activación del SRAA. Los estudios que a principios del siglo XX vincularon la oclusión renovascular y la regulación de la PA, establecieron el papel hemodinámico principal del riñón y el potencial para identificar una causa reversible de elevación sistémica de la PA. La HTA renovascular ha sido el principal ejemplo de HTA secundaria desde la década de 1930. Identificar la constricción de la arteria renal como un medio para aumentar la PA sistémica sigue siendo un descubrimiento básico que definió el papel del riñón en la regulación de la circulación sanguínea. Los modelos experimentales que utilizan el estrechamiento de la arteria renal han sido fundamentales para dilucidar el papel del SRAA en la regulación de la PA, la homeostasis del sodio y las complejas funciones de la angiotensina en la biología vascular.
Sin embargo, en las últimas dos décadas, nuestra comprensión y entusiasmo por la revascularización renal como un medio para controlar la HTA renovascular ha sufrido grandes oscilaciones. Desde una perspectiva clínica, la identificación de la HTA renovascular brindó la oportunidad de aplicar directamente los principios fisiológicos a la terapia. En la década de 1960, el enfoque quirúrgico para la revascularización renal, con la extracción de un riñón presor, permitió por primera vez la preservación de la función renal y mejoró el control de la PA. En un momento de terapia farmacológica antihipertensiva poco efectiva y mal tolerada, la selección de pacientes que podrían lograr la curación quirúrgica de la HTA renovascular se convirtió en un objetivo clínico importante. Sin embargo, la cirugía vascular conlleva riesgos sustanciales y no todos los pacientes experimentan beneficios. Incluso en modelos experimentales, se observó que la reversibilidad de la HTA renovascular con eliminación del clip era limitada en el tiempo. Como resultado, la selección de pacientes con probabilidades de lograr una reducción significativa de la PA con la revascularización se convirtió en una prioridad en el tratamiento de la HTA renovascular. Estos esfuerzos llevaron a estudios renales funcionales complejos, incluyendo muestreo de renina de la vena renal, medición de flujos sanguíneos, reabsorción de solutos, tasa de filtración glomerular y otros. La reducción dramática de la PA y el beneficio clínico que experimentaron algunos pacientes subrayaron la importancia potencial de este esfuerzo, a veces consiguiendo retirar todo el tratamiento farmacológico antihipertensivo.
Epidemiología
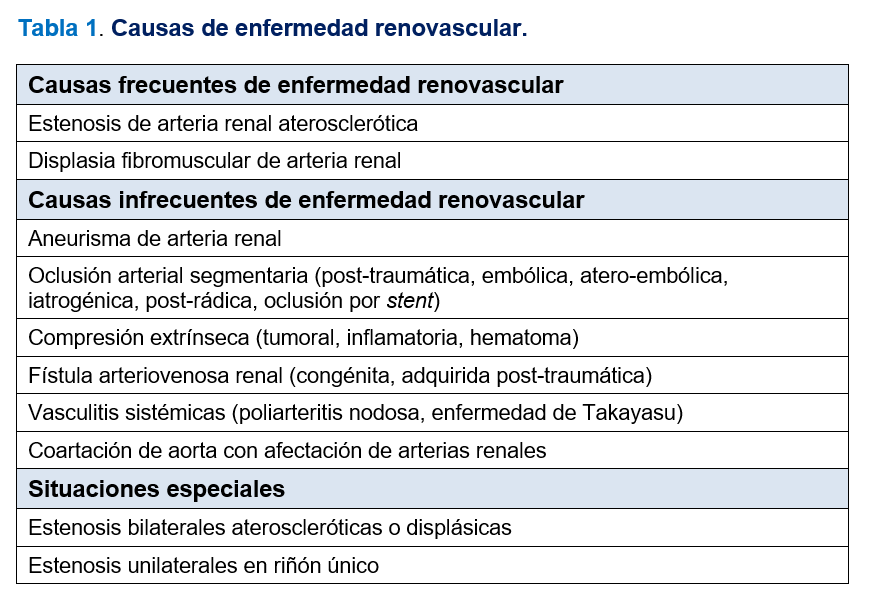
Las causas más frecuentes de ERV son la enfermedad aterosclerótica en pacientes mayores y la displasia fibromuscular de la arteria renal en pacientes jóvenes. Una serie de causas infrecuentes de ERV completan el espectro de las causas de HTA renovascular (Tabla 1).
La ERV es una causa frecuente de HTA secundaria y puede representar hasta el 5% de todos los casos de HTA en la población general [3]. La ERV es más frecuente en la población de edad avanzada, mayor de 65 años, en la cual la prevalencia de estenosis de arteria renal (EAR) significativa ( > 60% de oclusión por ecografía Doppler) puede alcanzar el 7%. Sin embargo, la incidencia y la prevalencia varían debido a la variabilidad de la definición de EAR y el tipo de poblaciones estudiadas. La prevalencia puede alcanzar el 40% en poblaciones de referencia altamente seleccionadas [3].
La acumulación de placas ateroscleróticas en las arterias renales es un reflejo tardío de un proceso sistémico que también afecta a otros territorios vasculares. De hecho, la presencia de EAR aterosclerótica suele reflejar una enfermedad vascular generalizada, que incluye enfermedad aterosclerótica de las arterias coronarias, vasos cerebrales y vasos sanguíneos periféricos, que juntos son responsables de la alta prevalencia de morbilidad cardiovascular y de muertes de causa vascular de pacientes con EAR [4]. Muchas de estas placas son extensiones de placas aórticas dentro de la arteria renal. Por ello, la localización de la enfermedad aterosclerótica suele estar cerca del origen de la arteria, aunque puede observarse en cualquier lugar de la arteria renal y puede afectar a una o a ambas arterias. Así, pues, la prevalencia de EAR aterosclerótica es elevada en pacientes con enfermedad vascular aterosclerótica sistémica, como la enfermedad coronaria (hasta un 18%) y la enfermedad arterial periférica (hasta un 25%) [5]. Otros autores apuntan cifras más elevadas: se ha descrito que la EAR aterosclerótica se encuentra hasta en el 45% de los pacientes a los que se realizan estudios vasculares por enfermedad vascular periférica y hasta en un 40% de aquellos sometidos a angiografía coronaria [3]. Globalmente, la EAR aterosclerótica es más prevalente en pacientes mayores con otros factores de riesgo para aterosclerosis, como diabetes, HTA, tabaquismo y dislipidemia.
Por otro lado, la prevalencia de la displasia fibromuscular como causa de EAR se sitúa en torno al 5% y se observa típicamente en mujeres jóvenes. La displasia fibromuscular es un grupo heterogéneo de enfermedades congénitas no-ateroscleróticas y no-inflamatorias que afectan las capas íntima o fibrosa de la pared vascular [3]. La displasia fibromuscular suele afectar a las arterias renales y cerebrales (65-70%) pero puede afectar otros lechos vasculares [2]. Puede dar lugar a estenosis arterial o a la formación de aneurismas, con disección e incluso oclusión de las arterias de mediano tamaño. Existen 2 subtipos: la displasia fibromuscular multifocal es la forma más frecuente con la apariencia de un “collar de perlas” y la displasia fibromuscular focal, que se presenta como una estenosis circunferencial o tubular. Las lesiones de displasia fibromuscular se localizan típicamente lejos del origen de la arteria renal, con frecuencia involucrando la porción media a distal de la arteria renal.
Otras causas más infrecuentes de HTA renovascular son los traumatismos renales, la oclusión arterial por disección o trombosis, la oclusión embólica de la arteria renal y algunas enfermedades vasculares inflamatorias (Tabla 1).
Fisiopatología
La HTA renovascular está causada por una reducción de la perfusión sanguínea en el riñón. Se puede encontrar ERV incidental en pacientes sometidos a estudio de imagen vascular por otras causas, pero la estenosis hemodinámica puede no tener importancia clínica significativa [3]. Los efectos hemodinámicos parecen desarrollarse en oclusiones luminales de entre el 75% y el 85%. Los estudios clínicos muestran que la oclusión con un globo expandido provoca la liberación de renina solo después de que la presión distal al globo disminuye entre un 10% y un 20% respecto a la presión proximal a la lesión. Estas medidas se corresponden con un gradiente pico sistólico translesional de al menos 20 a 25 mm Hg y una estenosis luminal de al menos el 70% [3]. Conforme progresa la EAR, la presión y el flujo disminuyen de forma gradual. El desarrollo de HTA en la ERV está directamente relacionado con la liberación de renina de las células yuxtaglomerulares, que actúan sobre el angiotensinógeno para producir angiotensina I. La angiotensina I es transformada por la enzima convertidora de angiotensina (ECA) en angiotensina II en el lecho capilar pulmonar. La angiotensina II es un vasoconstrictor potente y promueve la liberación de aldosterona de la corteza suprarrenal y la retención de sodio y agua. De esta forma, se incrementan las presiones sistémica y renal distal para mantener la perfusión renal. Así pues, la EAR da lugar a hipoperfusión renal, que a su vez activa no sólo el SRAA, sino también el sistema nervioso simpático, la síntesis intrarenal de prostaglandinas, aldosterona y óxido nítrico y reduce la excreción renal de sodio, causando vasoconstricción [5]. El requerimiento de la angiotensina en la HTA renovascular se confirmó en un modelo de ratón de HTA 2K1C (2 riñones 1 clip) de Goldblatt. El modelo modificado genéticamente que era knockout para el receptor de angiotensina II subtipo 1A (AT1A L/L) no desarrolló HTA, indicando el papel crítico del receptor subtipo 1A de angiotensina II en el control de la PA [3]. En la EAR unilateral, el riñón isquémico secreta renina, que provoca producción de angiotensina y elevación de la PA. A la vez, la excreción de sodio por parte del riñón contralateral no estenótico se incrementa, evitando la retención de sodio y sobrecarga de volumen. Es la llamada HTA renina-dependiente, caracterizada por una mayor resistencia periférica. Aunque la ERV sigue siendo un prototipo de HTA dependiente de angiotensina, estas respuestas hormonales suelen ser transitorias. A medida que avanza la oclusión, o si hay ausencia de un riñón perfundido contralateral, los mecanismos de HTA sostenida difieren. A medida que aumenta el volumen intravascular debido al empeoramiento en la excreción de agua y sodio por un riñón contralateral ineficaz, hay una disminución progresiva de la secreción de renina con el tiempo. Esta fase se conoce como HTA volumen-dependiente [3]. La actividad de la renina puede ser normal o baja en esta fase. La presión de filtración glomerular se mantiene distal a la estenosis por la vasoconstricción mediada por angiotensina II que actúa preferentemente sobre las arteriolas eferentes. Esta acción puede alcanzar una etapa crítica en la cual la tasa de filtración glomerular requiere angiotensina II como resultado de una perfusión reducida. La eliminación del efecto de angiotensina II con el bloqueo del SRAA puede disminuir drásticamente la tasa de filtración glomerular. Ejemplos clínicos de esto incluyen el bloqueo del SRAA con EAR bilateral o estenosis significativa en un riñón solitario. En estos casos no hay excreción de sodio compensatoria y se produce retención hídrica e insuficiencia renal y cardíaca. La administración de medicamentos antihipertensivos, como los inhibidores del ECA (IECA) o bloqueadores del SRA en pacientes con estenosis bilateral o riñón único funcionante se debe hacer con precaución debido al potencial empeoramiento de la función renal causada por este mecanismo [3].
Sin embargo, la fisiopatología de la enfermedad vascular renal y sus consecuencias dista mucho de ser sencilla. El riñón es un órgano complejo en el que la vasculatura desempeña múltiples funciones como la nutrición renal tisular, la filtración de sangre y la eliminación de desechos sistémicos. Aunque el riñón mantiene la función como resultado de autorregulación, la hipoperfusión renal prolongada da lugar a alteración de la función microvascular, rarefacción vascular y fibrosis intersticial [3]. Estudios preclínicos y clínicos mostraron que la rarefacción microvascular renal, tanto funcional como estructural, es una característica patológica universal de la ERC que puede comenzar temprano ante la presencia de factores de riesgo cardiovascular y renal (HTA, diabetes, obesidad),y a menudo puede predecir la disminución de la función renal. Los estudios preclínicos también muestran que la EAR induce una importante y a menudo progresiva remodelación y pérdida de la microvasculatura distal a la estenosis, junto a mecanismos renales de reparación microvascular y angiogénesis. La lesión microvascular progresiva es el resultado de la combinación de diversas agresiones como isquemia renal, inflamación sistémica y renal y la consecuente actividad pro-fibrótica y pro-apoptótica que se desarrolla en el riñón, a menudo independientemente de la gravedad de la EAR pero exacerbada cuando coexisten varios factores de riesgo [6]. La angiotensina II tiene per se, además, interacciones celulares complejas que conducen a la activación de mecanismos inflamatorios y fibrogénicos. Todos estos factores contribuyen a la HTA renovascular en esta población. El grado exacto de oclusión vascular que amenaza la función renal sigue siendo una cuestión de debate. El riñón es un órgano altamente perfundido y capaz de mantener la autorregulación, incluso con diámetros arteriales reducidos. Sin embargo, en algún momento la reducción de la perfusión renal más allá de la estenosis crítica (75%-80%) conduce a hipoxia tisular según lo medido por imágenes dependientes del nivel de oxígeno en sangre [3]. No puede excluirse la posibilidad de que la ERV aterosclerótica represente un proceso gradual de lesión isquémica aguda repetida en el contexto de un medio inflamatorio, que conduce a hipoxia y eventual pérdida de la función renal viable, entidad conocida como nefropatía isquémica. La identificación de esta población con perfusión renal disminuida antes de que este proceso se vuelva irreversible, es una prioridad clínica importante. En línea con lo expuesto, los estudios experimentales muestran que la angioplastia no restituye totalmente la función renal (a pesar de resolver técnicamente la estenosis) probablemente por la persistencia de la rarefacción microvascular y la fibrosis renal.
Manifestaciones clínicas
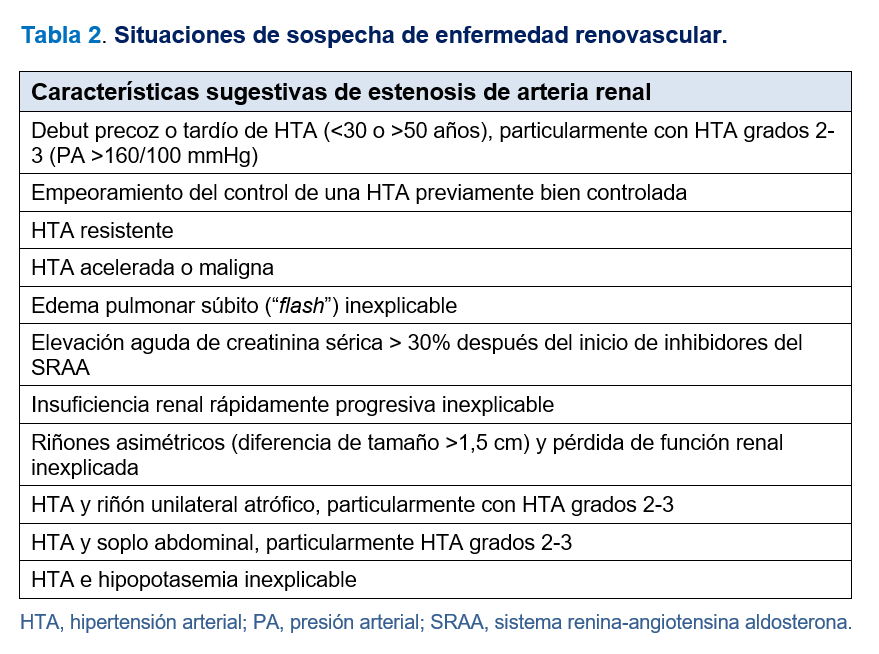
Existe una fuerte asociación entre la EAR y el riesgo cardiovascular. La incidencia incrementada de enfermedad cardiovascular en estos pacientes se atribuye a la presencia de aterosclerosis en otros lechos vasculares, estimulación pronunciada del SRAA y del sistema nervioso simpático y la coexistencia frecuente de ERC. Debido a este riesgo y al hecho de que la HTA renovascular es una causa potencialmente corregible de HTA secundaria, la detección y tratamiento de pacientes con HTA renovascular constituye un objetivo primordial. En la (Tabla 2) se detallan algunas de las principales características clínicas sugestivas de EAR.
La clínica de la EAR puede variar desde una enfermedad asintomática, descubierta de forma casual en estudios de imagen y otros procedimientos intervencionistas, a síndromes clínicos que se presentan con síntomas cardiovasculares activos, incluyendo la HTA resistente, el edema agudo de pulmón súbito (flash) recurrente y el deterioro progresivo de la función renal [3]. Así pues, la ERV puede dar lugar básicamente a 3 manifestaciones clínicas: cambios en la PA, en forma de HTA, síndromes de desestabilización cardíaca y renales especialmente en forma de nefropatía isquémica.
Hipertensión arterial
La HTA renovascular puede desarrollarse por cualquier causa que reduzca la perfusión sanguínea en el riñón afectado. En pacientes con EAR hemodinámicamente significativa, el SRAA está supuestamente activado, dando lugar a HTA, aunque hay pocos datos en humanos. En algunos pacientes, puede haber un componente de HTA renovascular sobreañadido a HTA esencial preexistente [2].
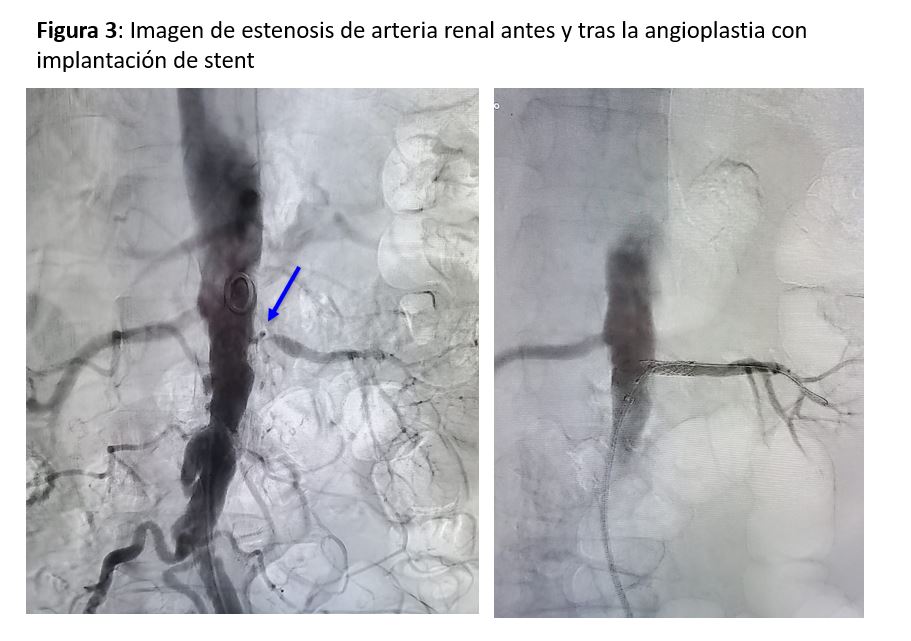
Aunque la EAR moderada puede ser asintomática, eventualmente se desarrolla HTA a medida que progresa la EAR. Las manifestaciones clínicas incluyen un incremento progresivo, con frecuencia rápido, de la PA, que suele ocurrir en personas con HTA preexistente tratadas ya con fármacos antihipertensivos. En estos casos debería mantenerse un elevado grado de sospecha de causas secundarias de HTA sobreimpuestas, sobre todo en pacientes con historia de tabaquismo, que tiene una fuerte asociación con resultados cardio-renales deletéreos. El hallazgo de un soplo abdominal a la auscultación del flanco abdominal en la exploración física de un paciente evaluado por HTA puede ser el punto de partida para ulteriores estudios. El diagnóstico de EAR a menudo ocurre durante los estudios de imagen o procedimientos para otras indicaciones, como el cateterismo coronario, RM o la angiografía por tomografía computarizada (angioTC). El diagnóstico de HTA renovascular en asociación con EAR se define por un síndrome clínico con aumento progresivo de la PA, que a menudo conduce a HTA resistente o refractaria con o sin hallazgos de ERC. Un criterio de uso común para identificar estenosis hemodinámicamente significativa es una disminución de al menos el 60% del diámetro luminal de la arteria renal, que se asocia con una velocidad sistólica máxima > 200-300 cm/s por ecografía Doppler. Sin embargo, los estudios han demostrado que el riñón estenótico es capaz de adaptarse a una reducción moderada del flujo, lo que permite el tratamiento con medicamentos antihipertensivos de forma segura a largo plazo para controlar la PA. Con el tiempo, algunas oclusiones renovasculares progresan y la terapia médica sola no controla la HTA. En estos casos, la HTA renovascular puede progresar con el desarrollo de síndromes de alto riesgo, incluyendo emergencias hipertensivas asociadas con edema pulmonar flash y disminución progresiva de la función renal. En ese punto, puede ser necesaria la combinación de terapia médica y de revascularización de la EAR. Existe gran controversia respecto a si los pacientes con HTA resistente con EAR aterosclerótica tienen más probabilidad de responder al stent de la arteria renal con mejora de la PA (Figura 3).
Síndromes de desestabilización cardíaca
La HTA no controlada y la sobrecarga de volumen asociadas con la EAR juegan un papel importante en la desestabilización de pacientes con síndromes coronarios agudos, edema pulmonar flash, síndromes aórticos o insuficiencia cardíaca congestiva recurrente [2].
Nefropatía isquémica
La EAR hemodinámicamente significativa puede causar nefropatía isquémica y ERC [2]. La nefropatía implica pérdida de masa renal, pérdida de superficie glomerular y de filtración y fibrosis extensa del parénquima; este es un marcador de resultado adverso para prácticamente todos los resultados de HTA, renal y cardiovascular. Es importante determinar si el paciente tiene enfermedad renal intrínseca, nefropatía isquémica o ambas. La evaluación de la nefropatía puede incluir análisis de orina para proteinuria, creatinina sérica e imágenes renales para evaluar las dimensiones, los índices de resistencia y los patrones arteriolares renales. La nefropatía avanzada, que probablemente no se beneficie de la revascularización, viene determinada por una proteinuria > 1 g/día, tamaño renal < 7 cm, o tratamiento con hemodiálisis durante > 3 meses. Algunos estudios sugieren que hasta el 12% de los pacientes con enfermedad renal crónica estadio 5 tienen ERC atribuible a nefropatía isquémica progresiva por EAR. La atrofia del riñón se produce como consecuencia de la progresión de EAR. En pacientes con ERC y EAR grave la colocación de stent en la arteria renal es más beneficiosa en aquellos con una pérdida de función renal rápida.
La displasia fibromuscular, como ya se ha comentado anteriormente, afecta sobre todo a mujeres y se suele diagnosticar en la edad media de la vida. Los estudios de intervención sugieren que entre los pacientes referidos para revascularización renal por HTA, la displasia fibromuscular tiene lugar en ≤ 16%. El síntoma de presentación más frecuente es la HTA, pero también puede haber otros, como el tinnitus pulsátil, ictus o dolor torácico (por afectación de otros territorios vasculares) [3]. En el registro prospectivo ARCADIA (Assessment of Renal and Cervical Artery Dysplasia), en que pacientes con displasia fibromuscular sintomáticos fueron sometidos a angioTC o angioRM, se observó que en los pacientes con presentación cerebrovascular, la prevalencia de lesiones de arteria renal fue más elevada en aquellos con HTA respecto a los normotensos. Además, entre los pacientes con presentación renal, la prevalencia de lesiones cerebrovasculares fue más elevada en pacientes con EAR bilateral que en aquellos con EAR unilateral [3].
Diagnóstico
Respecto al diagnóstico antes de emprender estudios de imagen potencialmente costosos o peligrosos, se deben establecer los objetivos para estudiar la imagen: ¿este estudio cambiará el abordaje médico actual?, ¿presenta el paciente características clínicas que merezcan una intervención vascular?, ¿los resultados de estos estudios conducirán a revascularización renal o incluso nefrectomía? [3].
Evaluación no invasiva de las arterias renales
De acuerdo con las guías de las Sociedades Europeas de Hipertensión y de Cardiología de 2018 y las guías American College of Cardiology / American Heart Association de 2017, la investigación de cribado ante la sospecha de EAR debe realizarse mediante ecografía-Doppler de las arterias renales, angioTC o angioRM [7] [8].
Ecografía Doppler renal
La ecografía Doppler renal constituye un excelente método de cribaje inicial al proporcionar una evaluación funcional de las arterias renales y también cierta información anatómica. Una velocidad sistólica pico > 200-300 cm/segundo sugiere estenosis > 60% [3][5]. Además, una relación entre velocidad sistólica pico de la arteria renal con respecto a la velocidad sistólica pico de la aorta > 3,5 tiene una sensibilidad del 92% para estenosis > 60% de diámetro [2]. Es una exploración no invasiva y relativamente económica que permite la evaluación seriada para objetivar la progresión de la enfermedad y detectar la recurrencia de estenosis después de revascularización sin exponer a los pacientes a toxicidad potencial de los agentes de contraste necesarios en la angioTC o angioRM. Como inconvenientes debe destacarse que es dependiente del operador y que tiene precisión potencialmente reducida en pacientes obesos y en presencia de gases intestinales. Se considera que un test positivo aporta más información que un test negativo. Por otro lado, el índice de resistencia (IR) = [(1 – velocidad end-diastólica / velocidad sistólica máxima) – 100] junto con los hallazgos del eco-Doppler puede contribuir a la predicción del éxito o no de la revascularización. En general, un IR elevado ( > 80) indica enfermedad aterosclerótica extensa de los vasos más pequeños y se asocia a una mejoría escasa en la PA después de la revascularización. El ultrasonido en modo B (US) y el Doppler color (DC) tienen una alta sensibilidad y especificidad en el diagnóstico de enfermedades vasculares crónicas [9]. Los US y el DC deben usarse para identificar a los sujetos de la población de alto riesgo que se ven afectados por EAR principal y para identificar y caracterizar a los pacientes sin EAR que tienen nefropatía isquémica crónica causada por nefroangioesclerosis o enfermedad ateroembólica. Los parámetros de DC más importantes sospechosos de EAR susceptible de tratamiento se muestran en la (Tabla 3).
En ausencia de signos directos o indirectos de EAR, los IR intraparenquimatosos elevados asociados con la enfermedad aterosclerótica sistémica son indicativos de daño por microcirculación relacionado con nefroangiosclerosis o enfermedad ateroembólica. El diagnóstico de EAR se basa sólo en un aumento significativo de la velocidad sistólica-diastólica y una ampliación del espectro de velocidad en el segmento estenótico. Los factores que determinan el daño renal aún no se conocen bien, ya que la estenosis aterosclerótica se superpone comúnmente con un daño importante de la microcirculación (causada por nefroangioesclerosis o, rara vez, por ateroembolismo). El patrón de daño renal suele ser básicamente de fibrosis intersticial y reducción progresiva de la microcirculación cortical y sólo en estadios finales se ven afectados los glomérulos. El comportamiento de los IR, calculado en las arterias interlobares mesorenales, reproduce las etapas hemodinámicas de la enfermedad. Si la EAR es el daño prevalente, la hipoperfusión causa una caída del flujo renal y del IR, debido a la activación de los mecanismos de autorregulación. Los valores de IR en el riñón isquémico son mucho más bajos en comparación con el riñón contralateral (Diferencia > 0,12), donde las resistencias vasculares aumentan debido a la barrera pre-glomerular causada por la HTA sistémica. En otras palabras, los IR son bajos y lateralizados en el riñón isquémico en comparación con el riñón contralateral. En caso de estenosis grave ( > 80-85%), las arterias hiliares pueden mostrar una curva lenta y aplanada (signo de parvus-tardus) que indica la falta de afluencia y la caída de las resistencias intrarrenales [9].
En cualquier caso, los valores de IR en el riñón isquémico varían según la edad, el deterioro de la microcirculación, el daño parenquimatoso y el tratamiento. En la isquemia renal avanzada, cuando el tamaño renal es < 9 cm y prevalece la remodelación de la microcirculación, los IR aumentan significativamente ( > 0,75-0,80). En tales condiciones, la revascularización está contraindicada ya que hay pocas posibilidades de recuperación funcional.
AngioTC o angioRM
La estenosis > 75% en una o ambas arterias renales, o una estenosis del 50% con dilatación post-estenótica, indica que la lesión puede causar reducciones hemodinámicamente significativas del flujo sanguíneo renal y la presión de perfusión y, consecuentemente, HTA renovascular [5]. Aunque la angioTC proporciona un elevado grado de sensibilidad (90 al 100%) y de especificidad (hasta el 97%), expone a los pacientes no sólo a la radiación sino también al contraste yodado, que es potencialmente nefrotóxico. Esto se evita con la RM, un método también altamente sensible (92 al 97%) y específico (73 al 93%) [2], pero el gadolinio no está libre de complicaciones debido a su asociación con la fibrosis sistémica nefrogénica en pacientes con función renal deteriorada (contraindicado en caso de filtrado glomerular < 30 ml/min/1,73m2). Además, es un método caro. La angioRM se prefiere en arterias muy calcificadas, lo que puede ser un desafío mayor para la angioTC. Tanto la angioRM como la angioTC son muy útiles para la evaluación de patrones de ramificación renal, vasos accesorios y orientación de los vasos [2].
Otros métodos diagnósticos no invasivos
Otros métodos diagnósticos de la EAR no invasivos como la determinación de actividad de renina plasmática (ARP), ARP estimulada y el renograma con captopril han quedado en desuso para el diagnóstico inicial de enfermedad renovascular potencial debido a su sensibilidad y especificidad limitadas [5]. La determinación de la ARP sola tiene un valor limitado porque tiene mucha variabilidad en función del estado de retención de sodio y agua. El cociente aldosterona/renina puede mostrar un exceso secundario de aldosterona, comportando hipopotasemia en algunos casos. La determinación de concentraciones de renina en las venas renales también podría ser útil para mostrar lateralización y supresión contralateral, pero no se utiliza debido a la limitación relacionada con la interferencia de la medicación y el estado de volumen [3].
La elección de una u otra prueba se hará de acuerdo con la experiencia institucional y los factores del paciente. En caso de un test no invasivo no concluyente combinado con una elevada sospecha clínica, se recomienda la arteriografía renal convencional. Esta prueba se reserva para pacientes considerados candidatos a revascularización en la misma sesión.
Otra modalidad que aún no se utiliza ampliamente en la práctica clínica para la evaluación funcional de EAR es la RM dependiente del nivel de oxígeno en sangre (BOLD-RM) [1]. Esta es una técnica no invasiva para evaluar la oxigenación del tejido renal que no requiere exposición al contraste. La BOLD-RM se basa en las propiedades paramagnéticas de desoxihemoglobina, mientras que la oxihemoglobina es diamagnética. La presencia de desoxihemoglobina afecta el tiempo de relajación T2* de las moléculas de agua vecinas y, a su vez, influye en la señal de imagen de RM de las imágenes potenciadas en T2* (eco de gradiente). La tasa de centrifugación de rotación R2* (R2: 1/T2) por lo tanto está estrechamente relacionada con el contenido de tejido de desoxihemoglobina. Como la pO2 en sangre capilar está normalmente en equilibrio con el tejido circundante, los cambios en los niveles de R2* representan cambios en la pO2 en el tejido. Las imágenes de BOLD-RM pueden proporcionar información crítica sobre los cambios en la función renal antes del inicio de la lesión renal irreversible y puede identificar pacientes con mayor probabilidad de beneficiarse de medidas para revertir o reparar trastornos de oxigenación de tejidos.
Evaluación invasiva de las arterias renales
La angiografía por sustracción digital (DIVAS) es una modalidad de imagen bidimensional que discrimina de forma relativamente pobre la gravedad de la lesión de la arteria renal porque estas estenosis a menudo se localizan en arterias tortuosas y superpuestas [2]. Un "signo de cuerda", lesión del 99%, puede ser fácil de identificar, pero lo más frecuente es una estenosis aorto-ostial leve a moderada, cuyas consecuencias hemodinámicas son inciertas. Por consenso de expertos, una EAR angiográfica > 70% de diámetro es grave o significativa y las estenosis de diámetro de 50% a 70% se consideran moderadamente graves, de importancia hemodinámica incierta. Para estenosis moderadamente graves, se recomienda la confirmación de la gravedad hemodinámica de la EAR antes de la colocación de stent (Tabla 4). El gradiente de presión translesional debe medirse utilizando un catéter no obstructivo o un cable de presión de 0,014 pulgadas. La hiperemia puede inducirse con un bolo intrarrenal de papaverina a una dosis de 40 mg o un bolo intrarrenal de 50 mg/kg de dopamina. Es importante tener en cuenta que la papaverina se precipitará en soluciones salinas heparinizadas comúnmente utilizadas para soluciones de lavado de laboratorio para cateterismo. La principal limitación de la angiografía es el riesgo que comporta la utilización de contraste yodado, similar a lo que sucede con la angioTC, sobre todo en pacientes con insuficiencia renal. Si el riesgo es demasiado elevado, se puede utilizar la angiografía con CO2, aunque el gas intestinal y los movimientos pueden comprometer la calidad de la imagen [2].
Tratamiento
El abordaje terapéutico de la EAR puede clasificarse en 3 modalidades: tratamiento médico, angioplastia transluminal percutánea (ATP) con o sin stent (Figura 3) y revascularización quirúrgica.
Tratamiento médico
El tratamiento médico incluye el cese del hábito tabáquico si lo hubiera, la administración de estatinas, el control glucémico en pacientes con diabetes y el tratamiento antihipertensivo, especialmente con IECA o antagonistas de los receptores de angiotensina II (ARA II). Si con ello se consigue el control de la PA deseado manteniendo la función renal estable, no hace falta ninguna acción adicional [5]. Si no se consiguen las cifras de PA deseadas, se pueden añadir otros fármacos antihipertensivos según sea necesario: diurético tiazídico o tiazídico-like (clortalidona o indapamida), calcioantagonista de vida media larga, antagonista de los receptores mineralocorticoides o betabloqueante. El tratamiento médico continúa siendo la piedra angular del manejo de la EAR [1]. Los datos del registro del Reino Unido demuestran que la mayoría de los pacientes con HTA renovascular clínicamente verificada toleran el bloqueo del SRAA, incluso con enfermedad bilateral [10]. Según este registro, algunos pacientes que desarrollaron un aumento brusco de la creatinina fueron después tratados con éxito mediante revascularización. Aun así, si se desarrolla una pérdida de filtrado glomerular > 30%, en particular en condiciones de depleción de volumen, es prudente retirar el bloqueo del SRAA al menos temporalmente. La recuperación de filtrado glomerular en estas condiciones es una pista importante de que el grado de compromiso renovascular ha alcanzado niveles críticos y puede justificar la consideración de revascularización renal.
Angioplastia transluminal percutánea
La ATP con balón, con o sin colocación de stent es el tratamiento indicado en la HTA renovascular debida a displasia fibromuscular, siendo un método no quirúrgico para dilatar las arterias renales estenóticas. Esta técnica suele ser exitosa en > 80% de los pacientes, pudiendo repetirse en caso de reestenosis. A pesar del buen resultado técnico, la curación de la HTA con retirada del tratamiento antihipertensivo únicamente ocurre en 1 de cada 3 casos. Cuando se realiza ATP sin stent en lesiones ostiales, en estenosis secuenciales de una sola arteria o en estenosis en múltiples arterias renales del mismo lado, con frecuencia se desarrollan reestenosis rápidamente después de un éxito inicial. En la ATP con stent, la tasa de éxito se acerca al 100% en la permeabilidad vascular precoz, pero las tasas de reestenosis son todavía del 14% al 25% [5]. El éxito técnico del procedimiento se asocia con el sitio de la lesión: suele ser favorable en lesiones que causan oclusión parcial de la arteria renal principal, pero no en oclusiones totales o lesiones ostiales. El éxito en cuanto al control de la PA debe considerarse unas semanas después del procedimiento, aunque algunas medidas determinadas durante la angiografía contribuyen a una predicción segura del control de la PA con éxito 3-12 meses después de la ATP. Se ha sugerido que la edad más joven, la estenosis más grave, la perfusión renal preservada y la ausencia de diabetes o aterosclerosis generalizada son los predictores para la mejora de la HTA después de la angioplastia [11]. Por otro lado, la isquemia renal global, la disminución rápida de la función renal durante 6-12 meses, la contracción progresiva del riñón afectado, el IR más bajo y la menor albuminuria se han informado como predictores de la mejoría o preservación de la función renal después de la angioplastia [11].
La ATP no está exenta de complicaciones [5], como la nefropatía por contraste, complicaciones hemorrágicas, disección, oclusión o perforación de la arteria renal, daño renal agudo con requerimiento de diálisis o enfermedad ateroembólica (básicamente por fragmentos de colesterol procedentes de placas ateromatosas). La enfermedad ateroembólica puede darse especialmente en el contexto de tratamientos anticoagulantes o trombolíticos o procedimientos que causan un traumatismo mecánico a los vasos ateroscleróticos, como la cirugía vascular o la angiografía convencional.
Los datos de registro del Reino Unido sugieren que los síndromes clínicos específicos de "alto riesgo", incluidos los episodios de edema pulmonar o el rápido deterioro de la función renal con HTA, tienen pronósticos ominosos y se benefician considerablemente de los procedimientos de revascularización a pesar del tratamiento médico [3][10]. A pesar de haber restaurado la permeabilidad del vaso principal, puede desarrollarse reestenosis en hasta el 14-18% de los sujetos seguidos durante un año. Las recomendaciones para el seguimiento incluyen ecografía Doppler de control, así como seguimiento de la PA y función renal. Los informes de estimaciones angiográficas para la reestenosis sugieren que las mediciones de ultrasonido de las velocidades sistólicas máximas aumentan después de la colocación de stent, lo que establece el umbral para identificar la estenosis de "alto grado" unos 100 cm/segundo más alto que sin tener un stent [1]. Para personas con diabetes, ERC 3b o superior o proteinuria significativa ( > 1g/24 h), tamaño renal < 7 cm o hemodiálisis durante más de 3 meses, la probabilidad de beneficio de los procedimientos de colocación de stent en la arteria renal es escasa [1].
En pacientes sometidos a ATP para el tratamiento de EAR la colocación de un stent tiene muchas ventajas, especialmente cuando se lleva a cabo en localizaciones con alto riesgo de reestenosis. La mayoría de los ensayos muestran que con la ATP con stent se obtienen mejores resultados respecto a ATP sola, en concreto en cuanto a tasas más elevadas de éxito inicial y de permeabilidad y una tasa inferior de reestenosis. Las guías vigentes recomiendan que en caso de indicación para angioplastia, se añada stent en la EAR ostial (clase I, nivel de evidencia B). Las otras recomendaciones son clase IIb [12]. Las indicaciones para ATP con o sin stent se muestran en la (Tabla 5).
Los ensayos clínicos aleatorizados que han comparado el tratamiento de la EAR con ATP con stent frente a tratamiento únicamente médico, ASTRAL (Angioplasty and Stenting for Renal Artery Lesions), STAR (Stent Placement and Blood Pressure and Lipid-Lowering for the Prevention of Progression of Renal Dysfunction Caused by Atherosclerotic Ostial Stenosis of the Renal Artery) y CORAL (Cardiovascular Outcomes in Renal Atherosclerotic Lesions) [12][13][14] no han evidenciado beneficios del tratamiento intervencionista frente al tratamiento médico, aunque se han descrito importantes limitaciones, entre ellas el propio diseño y los criterios de exclusión, entre los que se hallan los pacientes que probablemente se podrían beneficiar más de la revascularización de la arteria renal (HTA acelerada, insuficiencia cardíaca inestable o síndrome coronario agudo reciente) [2][3][4] o la evaluación de la EAR anatómica solo con ecografía Doppler, TC y RM, requiriendo una reducción de la luz de > 50-60% para la inclusión, cuando los estudios hemodinámicos muestran que se requiere una estenosis luminal ≥ 70-80% para dar lugar a un descenso sustancial en la perfusión renal. Probablemente la mejor estrategia en el abordaje del tratamiento de la EAR sea identificar qué pacientes tienen mayor probabilidad de beneficiarse de ATP con stent y optimizar la seguridad y durabilidad del procedimiento. Las guías sugieren que se lleve a cabo ATP con stent en pacientes con HTA renovascular y empeoramiento progresivo o agudo de la función renal, edema pulmonar flash o incremento rápido en la necesidad de antihipertensivos en pacientes con HTA previamente bien controlada [15]. Aunque esto debería confirmarse en estudios más amplios y con diseño específico, la evidencia de la que se dispone hasta ahora sugiere algunos de los posibles factores predictores de buena respuesta tanto de la función renal como de la PA tras la ATP (Tabla 6).
Revascularización quirúrgica
La revascularización quirúrgica era la única opción hasta 1990, cuando se introdujeron los procedimientos endovasculares. Aunque algunos pacientes se benefician de forma clara, es una técnica no carente de riesgos, como el desarrollo de enfermedad ateroembólica, disección aórtica o infecciones quirúrgicas [5]. Actualmente sólo se recomienda para pacientes con lesiones anatómicas complejas, como arterias renales múltiples, ramificación primaria precoz de las arterias renales principales, necesidad de reconstrucción aórtica cerca de las arterias renales por otras indicaciones (p.ej. reparación de aneurisma), o para evitar la manipulación de aorta muy patológica o después del fracaso de un procedimiento endovascular. Un metanálisis de 47 estudios [16] comparó los resultados de pacientes sometidos a revascularización quirúrgica con pacientes sometidos a procedimientos endovasculares. A largo plazo, los resultados de la técnica fueron similares; hubo un mejor control de la PA y una mejor función renal pero una mortalidad perioperatoria superior.
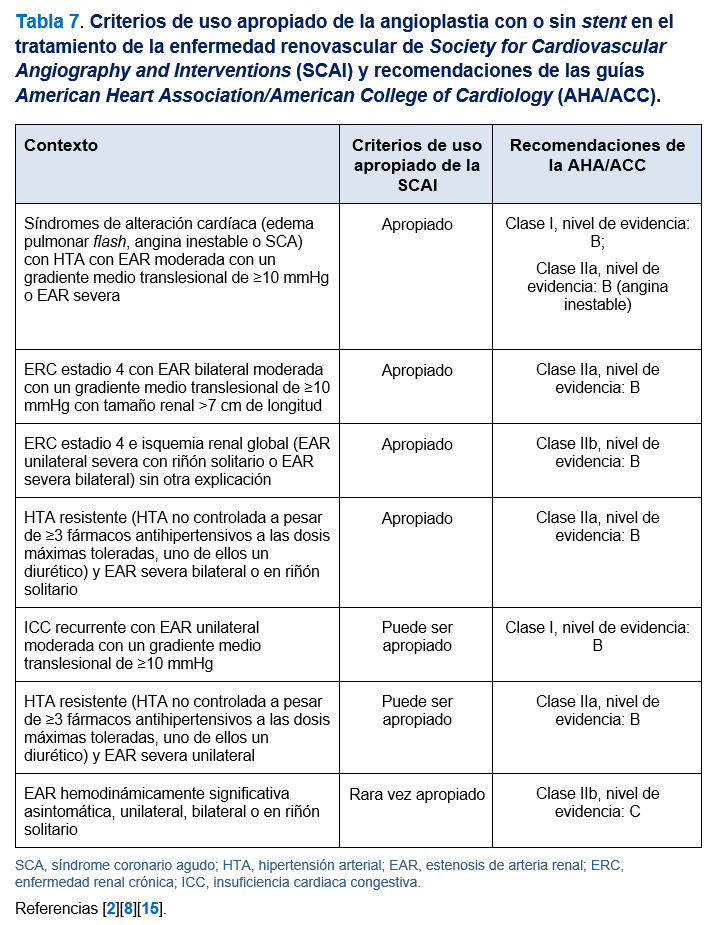
En resumen, en pacientes con EAR de alto riesgo con HTA resistente, edema pulmonar súbito, deterioro rápido de la función renal o incremento rápido en la necesidad de antihipertensivos con HTA previamente bien controlada, la ATP con stent puede constituir la opción principal. Es importante destacar que, a pesar de los resultados desfavorables de los ensayos clínicos aleatorizados, las pautas actuales aún no han cambiado desde 2006. Se recomienda ATP con stent como una opción razonable para pacientes con EAR hemodinámicamente significativa (especialmente ostial), HTA resistente o maligna, insuficiencia cardíaca congestiva recurrente, edema pulmonar inexplicable o angina inestable (Tabla 7). El tratamiento de la EAR hemodinámicamente significativa en pacientes con las indicaciones descritas aquí da como resultado teórico un mejor control de la PA y mejores resultados clínicos. Sin embargo, esta hipótesis no se ha demostrado en ningún ensayo clínico aleatorizado, debido a las limitaciones en el diseño de los ensayos realizados hasta ahora.
Adicionalmente, es importante reseñar el interés y las posibilidades de estrategias recientes destinadas a proteger el parénquima renal con potencial translacional para servir como posibles tratamientos adicionales a los actuales o como terapias independientes. El grado de daño funcional y estructural del parénquima renal distal a la estenosis puede ser crítico, pero a menudo se desatiende su evaluación para la selección de estrategias terapéuticas en la ERC. La evidencia emergente indica que la inflamación renal, la remodelación microvascular y el daño en la mitocondria aceleran la progresión de la lesión renal y son determinantes importantes de la respuesta a la revascularización. Los estudios experimentales han identificado intervenciones capaces de mejorar la inflamación renal (por ejemplo, inhibidores de citoquinas, células madre mesenquimales), la remodelación microvascular (acciones proangiogénicas) y la lesión mitocondrial (fármacos protectores de mitocondrias), solas o combinadas con revascularización renal, para preservar la estructura y función del riñón post-estenótico [6]. Estudios piloto prospectivos recientes en pacientes con EAR demuestran la seguridad y la viabilidad de algunas de estas intervenciones para proteger el riñón. Se necesitan más estudios en cohortes más grandes para confirmar sus efectos renoprotectores y el papel clínico en la ERV humana.
Resumen
En conclusión, la ERV es altamente prevalente y puede dar lugar a síndromes clínicos relevantes, como HTA grave, insuficiencia renal o síndromes de desestabilización cardíaca. Aunque se dispone de un tratamiento técnicamente efectivo, la angioplastia con stent, los resultados clínicos no suelen ir paralelos. Ello implica la necesidad de identificar los pacientes susceptibles de beneficiarse con el tratamiento, así como de profundizar en el conocimiento de los mecanismos de daño renal – inflamatorios, profibróticos y de rarefacción vascular – que podrían ser tributarios de tratamientos específicos. Mientras tanto, ante la ERV aterosclerótica es fundamental optimizar el tratamiento médico, evitando el tabaco, controlando la dislipidemia y bloqueando el SRAA.