Diálisis y Ultrafiltración peritoneal en situaciones especiales: Insuficiencia cardiaca, Ascitis
DP EN EL TRATAMIENTO DE LA INSUFICIENCIA CARDIACA REFRACTARIA
A pesar de los continuos avances en el tratamiento de muchas enfermedades cardiovasculares, la prevalencia de la insuficiencia cardíaca (IC) continúa en aumento y produce una importante morbimortalidad y un consumo creciente de recursos sanitarios [1] [2]. Algunos de los factores que contribuyen a elevar el número de pacientes con IC son el envejecimiento de la población, la mayor supervivencia tras el infarto de miocardio, el tratamiento de la hipertensión arterial que sigue siendo insuficiente y una mejora en el pronóstico de los pacientes con esta patología establecida. De hecho, la extraordinaria mejora que se ha producido en el pronóstico de los pacientes con esta enfermedad ha cambiado la perspectiva que se tenía sobre la misma, pasando de ser similar a una enfermedad maligna a convertirse en una enfermedad crónica. El estudio PRICE [3] elaborado en España subraya la prevalencia creciente de la IC en las personas de más de 45 años, con valores estimados del 6,8% de la población total. Además, ésta aumenta con la edad, hasta alcanzar el 16,1% de las personas de más de 74 años.
El riesgo de muerte por IC es elevado, alrededor del 5-10% anual y se incrementa al 30-40% en pacientes con IC avanzada. Además, la IC es la principal causa de hospitalización en pacientes mayores de 65 años con una tasa elevada de reingresos [4].
La IC es una entidad progresiva y que puede llegar a ser letal, incluso en pacientes bien tratados. Una de las características de la IC es la existencia de un círculo vicioso que magnifica y autoperpetúa el cuadro. La activación de los sistemas neurohumorales a consecuencia de la hipoperfusión renal (sistema renina angiotensina aldosterona y sistema simpático), debido a una disminución del gasto cardíaco en los pacientes con IC, conduce a un fenómeno de vasoconstricción renal y a un aumento en la reabsorción en el túbulo proximal de agua y sodio.
De esta manera, se reduce el aporte de agua y sodio a nivel tubular distal, reduciendo la capacidad de promover diuresis del péptido natriurético atrial y aumentando la sensibilidad a la acción de la aldosterona [5]. Este mecanismo explica, en parte, la resistencia a la acción de los diuréticos que ocurre en los pacientes con IC avanzada. De esta forma, el acúmulo de agua que se produce condiciona un empeoramiento de la IC y reduce el gasto cardíaco, debido a un aumento del volumen diastólico del ventrículo derecho. Además, y a consecuencia de la hipoperfusión, se produce un empeoramiento de la función renal [6], que también puede estar influenciado por la activación de los sistemas neurohumorales (puede producirse glomeruloesclerosis y fibrosis tubulointersticial) [7]. Sin embargo, más del 60% de los pacientes con IC aguda tienen congestión sin hipoperfusión [8].
En estos pacientes, el aumento de la presión venosa central se trasmite a través de las venas renales aumentando la poscarga renal y la presión intrarrenal. El incremento en la presión disminuye la perfusión renal y el flujo intratubular, dando lugar a un descenso del filtrado glomerular y un incremento en la retención de sodio y agua, mediado por la activación del sistema renina-angiotensina aldosterona, junto con el daño tubular mediado por la activación de mecanismos proinflamatorios, entre otros (nefropatía congestiva) [9].
Se describe así el síndrome cardiorrenal (SCR) en sus tipos 1 (deterioro agudo de la función cardíaca que conduce a insuficiencia renal aguda) y 2 (deterioro crónico de la función cardíaca que conduce a insuficiencia renal crónica), según la última clasificación [10] [11]. En ambos casos, el deterioro de la función renal derivado del fallo cardíaco es un predictor independiente de mal pronóstico [12][13]. Ante una situación de sobrecarga de volumen, cualquier actuación encaminada a disminuir el exceso de líquido va a resultar beneficiosa para el paciente. Algunas de las ventajas que vamos a producir con ello son la mejoría del gasto cardíaco (gracias al mecanismo de Frank- Starling), el aumento del llenado del VI y de la capacidad respiratoria [14] [15].
La congestión o sobrecarga hídrica es un factor pronóstico más importante que el deterioro de la función renal en los ingresos por reagudización de la IC. De tal forma que aquellos pacientes que son dados de alta sin sobrecarga reingresan menos y tienen mayor expectativa de vida [16]. La forma tradicional de depleción de volumen en paciente con ICcongestiva ha sido el uso de diuréticos (de asa, antialdosterónicos, tiazidas o combinaciones entre ellos), tanto por vía intravenosa como oral [17]. Sin embargo, un porcentaje nada desdeñable de pacientes (13%) se vuelven refractarios a la acción de los diuréticos. Algunos de los mecanismos de refractariedad son la menor absorción intestinal por el edema de la pared, la disminución de la perfusión renal, la alteración de los mecanismos neurohumorales y en ocasiones el incumplimiento de la dieta e ingesta de líquidos. Estos pacientes condicionan en 50% del gasto empleado en tratar la IC, merced a una media de 4 ingresos anuales, la mayoría en Unidades de Cuidados Intensivos [18].
En esta situación, desde las guías de actuación clínica de cardiología se ha propuesto que la ultrafiltración puede ser una estrategia indicada, al menos como medida paliativa [19].
Los ensayos clínicos que compararon la eficacia de la ultrafiltración mediante circuitos sanguíneos extracorpóreos frente a tratamiento médico con diuréticos no encontraron que la primera aportara ventajas en cuanto a la evolución de la función renal ni de la mortalidad en situaciones de fallo cardiaco agudo. La ultrafiltración aislada consigue reducir los días de hospitalización y el peso frente a la terapia diurética [20] [21]. Por ello, no hay suficientes evidencias que recomienden su uso. Tampoco se han publicado resultados concluyentes en cuanto al uso de este tipo de ultrafiltración en situaciones de fallo cardiaco crónico.
La ultrafiltración peritoneal (UFP) podría aportar notables beneficios para el tratamiento de los pacientes con IC crónica refractaria a diuréticos. Con esta técnica, la ultrafiltración es suave y continua, lo que evita el «aturdimiento miocárdico» que se asocia con la progresión de la disfunción sistólica. Además, existe un menor riesgo de hipotensión e hipoxia tisular que tienen un impacto negativo sobre la función renal, por ello, ésta se preserva mejor. El impacto mínimo de UP sobre la hemodinámica es más probable que no estimule las respuestas neurohumorales de mala adaptación en el corazón y el riñón y es capaz de restaurar, al menos en parte, la respuesta a diuréticos. Otras ventajas son la menor inflamación sistémica producida por su uso (frente a hemodiálisis), el que no sea necesario un acceso vascular ni utilizar anticoagulantes y el mejor aclaramiento de moléculas de mediano tamaño que repercuten negativamente sobre la contractilidad miocárdica (TNF-α, Factor depresor del miocardio, Interleuquinas…), o la eliminación eficaz de solutos (Na+ y K+) que posibilita la utilización de IECAs y agentes antialdosterónicos. Por último, cabe destacar que se trata de una terapia domiciliaria, con las ventajas que esto supone sobre la calidad de vida y el coste sanitario [22] [23] [24].
En los últimos años, han sido numerosas las publicaciones que han tratado sobre la utilidad de la UP en situación de IC refractaria [25][26][27][28][29][30][31][32] [33] [34] [35].
Se ha publicado una revisión sistemática de la literatura a este respecto [36], en la que se realizó una búsqueda exhaustiva de las principales bases de datos, desde 1966 hasta 2017, de estudios que utilizaron DP en la IC resistente a los diuréticos. Los datos fueron extraídos y combinados utilizando un modelo de efectos aleatorios, expresado como odds ratio (OR). Treinta y un estudios (n = 902) fueron identificados a partir de 3195 citas. Los estudios sobre DP en pacientes con IC mostraron varios beneficios. La fracción de eyección del VI (FEVI) mejoró después de la DP (OR 3,76, IC95%: 2,24-5,27; p < 0,001). Siete de nueve estudios observaron un aumento de la FEVI en >10%. Veintiún estudios encontraron mejoría de la clase funcional de la NYHA y el 40-100% de los pacientes mejoraron en un grado. Nueve de 10 estudios informaron reducciones en la frecuencia y/o duración de las hospitalizaciones. Cuando fueron tratados con DP, los pacientes con IC tenían menos síntomas, menos ingresos hospitalarios y menos días de hospitalización en comparación con el tratamiento con diuréticos (Tabla 1).
Mejoría de la clase funcional
Existe unanimidad en todos los estudios publicados que, con el empleo de la UP, los pacientes experimentaron una mejoría de su grado funcional, valorado mediante la escala de la New York Heart Association (NYHA); se produce una reducción de 2 grados en casi 2 tercios de los casos, especialmente aquellos que están en una peor situación clínica previa. En la revisión sistemática de Lu [37], el grado funcional en la clasificación de la NYHA mejora significativamente (3.53 vs 2.17, P< 0.001) Esta mejoría se asocia a una mejoría discreta (en torno al 4%) de la fracción de eyección del VI (medido por ecocardiografía), especialmente en aquellos pacientes que tienen una peor situación basal [34] [35], y con una importante disminución de la presión sistólica en la arteria pulmonar [25]. Finalmente, nuestro grupo ha encontrado también una mejoría en el remodelado del VI, con una disminución manifiesta del volumen telediastólico del VI, que podría ser responsable, al menos en parte, de los beneficios clínicos previamente descritos [38].
Función renal
Si analizamos todos los estudios que incluyen datos sobre la evolución de la función renal [37], comprobamos que existe un leve deterioro (29.93 vs. 24.90 ml/min; p=0.01). Sin embargo, si sólo tenemos en cuenta aquellos estudios que incluyeron a pacientes sin enfermedad renal crónica estadio 5, no se encontraron diferencias en la función renal entre antes y después del tratamiento con UP.
Factores depresores del miocardio y citoquinas proinflamatorias
Algunas citoquinas han sido implicadas en la patogénesis de la IC. Así, se ha visto que moléculas proinflamatorias como TNF-α, IFN-γ, IL-1, IL-6, IL-17 e IL-18 pueden inducir hipertrofia de los miocardiocitos, remodelado ventricular, fibrosis cardiaca y apoptosis [39]. Mediante el uso de la DP se ha visto una disminución en la concentración plasmática de algunos factores inflamatorios y depresores del miocardio, como son IL-1, IL-6 y TNF-α [40]. La eliminación de estas moléculas se realiza a través del propio peritoneo, como se demostró hace ya más de 25 años [41]. Otro hallazgo significativo que se ha demostrado es la reducción en los niveles séricos de NT-pro-BNP lo que refleja la mejoría del fallo cardiaco.
Tasas de hospitalización
Uno de los aspectos más destacados de los pacientes en fases avanzadas de IC es la necesidad de ingresos hospitalarios frecuentes, en ocasiones en unidades de cuidados intensivos. La causa del ingreso en una inmensa mayoría de los casos se debe a sobrecarga hídrica, siendo sólo en el 5% por bajo gasto cardíaco [42]. La utilización de la DP en el tratamiento de la IC refractaria a diuréticos condiciona un descenso muy llamativo en las tasas de hospitalización, que alcanza un 80% de media [43].
Mortalidad
Un dato preocupante en los pacientes con IC refractaria es la alta mortalidad observada. Hay que tener en cuenta que este tipo de estudios se realizaron en pacientes gravemente enfermos con un Índice de Charlson muy elevado. Debido a la confluencia de una mala situación cardíaca y una elevada comorbilidad no era esperable que ninguno de estos pacientes tuviera una supervivencia superior a un año. En pacientes con IC refractaria sometidos a tratamientos conservadores (sólo con distintos regímenes diuréticos) se ha publicado que la supervivencia media a los 6 meses es del 50%, y al año apenas supera el 25% [17]. Ante este oscuro panorama, cualquier medida que podamos tomar para mejorar el pronóstico de los pacientes debe ser bienvenida.
El empleo de la DP en pacientes con IC refractaria supuso una mejoría de la supervivencia hasta alcanzar el 80% a los 12 meses de tratamiento y cercana al 50% a los 2 años. Este dato es de crucial importancia dado que hasta el momento no se encontró mejoría en la supervivencia en estudios realizados con otro tipo de tratamientos para esta enfermedad, como son el empleo de tolvaptán [43], nesitirida [44] o técnicas de ultrafiltración extracorpórea [20].
Uno de los trabajos publicados compara la supervivencia total y libre de ingresos entre dos cohortes: una incluye a un grupo amplio de pacientes en programa de UP y la otra intenta ser una especie de “grupo control” que incluyó a pacientes que desestimaron voluntariamente realizar DP o que tenían alguna contraindicación para la técnica.
Aunque los resultados pueden estar sesgados por las características de los grupos, las diferencias en supervivencia son muy llamativas desde las primeras semanas de seguimiento [27].
Calidad de vida
Pocos son los estudios que han valorado la evolución de la calidad de vida con los distintos tratamientos propuestos para la IC refractaria. En nuestro grupo, valoramos la calidad de vida en los enfermos mediante los cuestionarios Euroquol 5D y SF-36 [25]. El uso de la DP se asoció con una mejoría en el estado de salud percibido por el paciente, dato que se refleja también en la escala visual analógica. En relación con el cuestionario SF-36, la mejoría se produjo en todas las dimensiones (alcanzando significación estadística en todas ellas salvo en salud general, p = 0,079) y en las dos puntuaciones sumarias. La calidad de vida relacionada con la salud (CVRS) antes del inicio del tratamiento estaba muy por debajo de las puntuaciones otorgadas por la población general (puntuaciones inferiores a 45), pero llegó a ser similar a la de la población general a los 6 meses de tratamiento (puntuaciones superiores a 45), excepto en la dimensión de salud general. La prevalencia de depresión, definida como una puntuación sumaria mental menor o igual a 42, llegó a ser del 73% antes del inicio de la técnica y se redujo hasta sólo el 9% sólo tras 6 meses en esta modalidad de UP. Respecto al tamaño del efecto, casi todas las dimensiones del SF-36 los valores del EQ-5D tuvieron un tamaño grande, excepto las dimensiones de salud general, salud mental y el componente sumario mental, cuyo tamaño fue moderado. Todo ello indica una significación muy relevante derivada de esta terapia (cita). Otros grupos han utilizado el Cuestionario de calidad de vida de Minnesota, con resultados similares [33].
Complicaciones
La infección peritoneal es la única complicación reseñable relacionada con la técnica en los diferentes estudios publicados. Sin embargo, las tasas de peritonitis son significativamente bajas en comparación con pacientes en DP por ERC [25], circunstancia en probable relación con el menor número de intercambios que realizan estos pacientes.
Estudios de coste-eficacia
Según los cálculos realizados por nuestro grupo [25], la suma de costes que supone el paciente en programa de DP alcanza los 16.440 €, menor que el coste que supone el tratamiento conservador con diuréticos (27.551 €; p=0,095). Concretando en los gastos, el coste de personal y las hospitalizaciones fueron menores en el grupo de DP. Por el contrario, el coste de materiales fungibles, las pruebas analíticas y de imagen fueron más caras en este grupo. Respecto al análisis de coste-utilidad, la DP se asoció con una mayor utilidad que el tratamiento conservador (0,673 frente a 0,430; p <0,01). Si además tenemos en cuenta el menor coste que supone la DP, el análisis de coste-utilidad refleja que la modalidad de DP tiene un coste de 23.305 €/año de vida ajustado a calidad de vida (AVAC), mientras que el tratamiento conservador tiene un coste de 81.053 €/AVAC. La DP fue, por tanto, la estrategia dominante en términos de coste-utilidad, con una diferencia de DP 46.237 € por AVAC.
Candidatos a ultrafiltración peritoneal
Tras la experiencia clínica acumulada, especialmente en la última década, y con la puesta en marcha de unidades cardiorrenales para la valoración y tratamiento multidisciplinar de estos pacientes, se debería considerar la DP en pacientes con IC avanzada [45] con tratamiento optimizado (farmacológico, marcapasos, DAI etc) en situación congestiva y resistencia al tratamiento diurético [46], que requieren ingresos o visitas frecuentes al hospital de día para administración de diuréticos intravenosos, sin contraindicación para DP y que aceptan el tratamiento.
Un aspecto fundamental es el diagnóstico y caracterización de la congestión. La congestión en IC se define como el acúmulo de líquido en el compartimento intravascular y extravacular como resultado del aumento de las presiones de llenado. La congestión no es sinónimo de sobrecarga de volumen [47], el concepto de redistribución sugiere que el aumento en el tono venoso puede precipitar una rápida redistribución de líquido desde un reservorio venoso periférico a la circulación cardiopulmonar central, aumentando la presión hidrostática intravascular, aunque sin aumento del volumen de agua corporal [48]. La mayoría de los pacientes con IC descompensada presentan una combinación de ambas, por lo que identificar el fenotipo predominante puede determinar la estrategia terapéutica más adecuada
En la actualidad, además de los métodos clínicos, disponemos de biomarcadores, (Antígeno carbohidrato 125 (CA125) y NTproBNP) [49] y de la ecografía realizada a pie de cama “Point-of-Care Ultra Sonography” (PoCUS) [50]. La valoración de la congestión mediante PoCUS cuenta con tres estrategias: La ecografía pulmonar o «LungUltraSound»(LUS) que permite valorar de forma rápida y precisa la congestión tisular, «Venus Excess Ultrasound Grading System» (VExUS) que valora la congestión vascular mediante el doppler pulsado venoso para identificar y graduar la congestión, y el estudio de la morfología y función cardiaca y valvular mediante la ecocardioscopia o «Focused Cardiac Ultra Sound» (FoCUS) [51].
Estas herramientas nos permiten determinar el fenotipo predominante de congestión, de modo que los pacientes con patrón de redistribución se beneficiarían más de vasodilatadoes y en aquellos con predominio de congestión sistémica, el mayor beneficio se obtendrá con diuréticos y con la DP [52].
Modalidades de ultrafiltración peritoneal
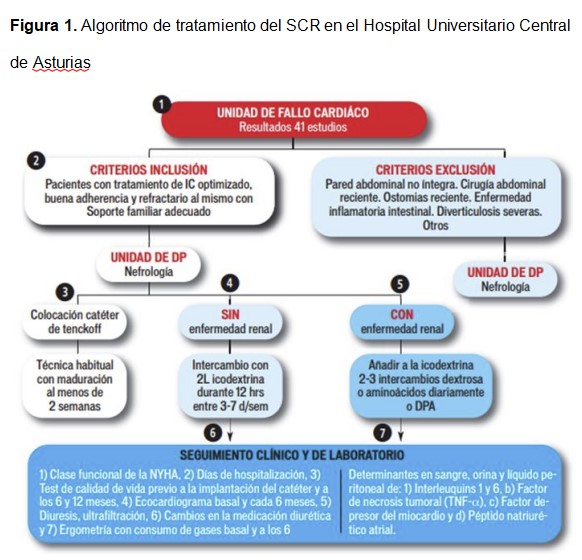
Hasta ahora, no se ha llevado a cabo ningún estudio controlado para analizar que modalidad de UP es la más eficaz. Por ello, cada grupo de trabajo ha utilizado desde la técnica manual con uno o más intercambios diarios, con o sin icodextrina hasta modelos de DP automatizada [34] todos o algunos días de la semana. En nuestra opinión, la modalidad más coste-eficiente y cómoda para el paciente es la realización de un único intercambio diario con icodextrina con permanencias largas (más de 10 horas). Este intercambio suele ser suficiente para que el paciente se desprenda de la sobrecarga de volumen y se depuren moléculas depresoras del miocardio que pueden contribuir a deteriorar su situación clínica (Figura 1).
El sodio es el determinante principal del volumen extracelular, su papel clave en la retención de líquidos y en el desarrollo de la congestión. Por lo tanto, la optimización de la eliminación de sodio con DP debe ser el enfoque principal en el entorno de UFP y SCR [53].
Los diuréticos de asa tienden a generar orina hipotónica que contiene alrededor de 60 mmol/L de sodio, mientras que la concentración de sodio en el ultrafiltrado puede alcanzar 126–134 mmol/L [54] [55].
En pacientes con IC e hiponatremia, el uso de pausas cortas y frecuentes con soluciones de glucosa hipertónica ayudaría a aumentar los niveles séricos de sodio mediante la eliminación peritoneal de agua libre, mientras que con icodextrina se obtiene una eliminación convectiva máxima durante permanencias prolongadas. Un único intercambio de icodextrina de 8 a 16 h puede eliminar hasta 87 mmol de sodio [56].
Por todos estos datos, consideramos que la DP es una opción terapéutica adecuada para el tratamiento de pacientes con IC refractaria a diuréticos dado que produce una mejoría funcional, reduce las tasas de hospitalización y mortalidad, mejora la calidad de vida y todo ello a un coste reducido respecto a los tratamientos convencionales. Se trata además de un tratamiento cómodo para el paciente, que realiza en la inmensa mayoría de los casos un único intercambio nocturno con icodextrina. Las unidades que tratan la IC deben considerar ofrecer esta modalidad de tratamiento a los pacientes adecuados para proporcionarles los beneficios anteriormente reseñados y con un coste sanitario reducido, tal como se ha reflejado en la literatura cardiológica [57].
Los pacientes con SCR y situación de deterioro funcional renal refractario a diuréticos también se benefician de medidas complementarias como la corrección de ferropenia y anemia acompañante [58].
DP EN EL TRATAMIENTO DE LA ASCITIS REFRACTARIA
La ascitis es una complicación muy frecuente en los pacientes con cirrosis hepática avanzada. Su aparición comporta un empeoramiento en el pronóstico, y se asocia con una supervivencia del 50% a los 3 años. La ascitis refractaria es aquella que no puede ser movilizada o que recurre rápidamente (antes de 4 semanas) a pesar de un tratamiento dietético y diurético adecuados (40 mEq/día de sodio en la dieta asociada a 400 mg/día de espironolactona y 160 mg de furosemida). En este grupo, también se incluyen los pacientes que no alcanzan la dosis máxima de diuréticos debido a la aparición de complicaciones asociadas a su uso [59]. En no pocas ocasiones se produce un daño renal concomitante a patología hepática, definiéndose así el Síndrome hepatorrenal. Se han descrito dos formas de Síndrome hepatorrenal. El tipo 1: es la forma más grave, se suele instaurar de forma abrupta, suele haber un incremento de la creatinina en menos de 2 semanas (generalmente se dobla
el valor) y suele cursar con oliguria. El Síndrome hepatorrenal tipo 2 tiene una evolución lenta e insidiosa y en muchas ocasiones desarrollan resistencia a los diuréticos [60].
La prevalencia de ascitis en la situación de enfermedad renal crónica avanzada (ERCA) es muy variable. Según las fuentes, se ha propuesto que entre el 0,7 y 20% de los pacientes la padecen. Las causas de ascitis en la ERCA son numerosas y van desde la existencia de una enfermedad hepática asociada, la enfermedad cardiovascular coexistente, las peritonitis, la depleción grave de proteínas o formas idiopáticas [61].
La utilización de la hemodiálisis en pacientes con daño hepático y renal tiene serias limitaciones. Así, se ha visto como la utilización de esa técnica de diálisis aumenta el riesgo de hipotensión (resistencias vasculares disminuidas) y a la que contribuye el incremento en la síntesis de óxido nítrico, de hemorragia (plaquetopenia, alteración de la coagulación, uso de anticoagulantes) en pacientes con varices esofágicas o gastropatía hipertensiva, de encefalopatía relacionado con los cambios bruscos en la osmolaridad y en el equilibrio hidroelectrolítico y finalmente, de transmisión nosocomial de virus [62].
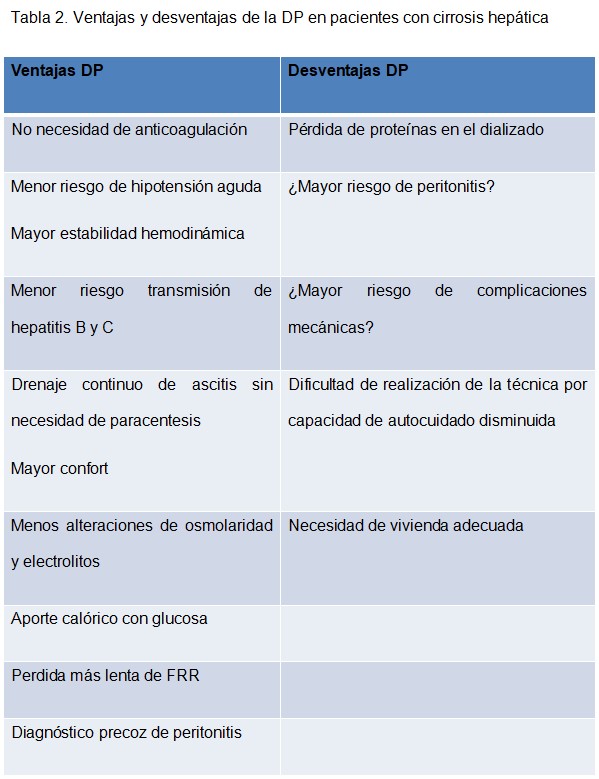
Sin embargo, la DP en este tipo de pacientes aporta notable beneficios como son la mejor tolerancia hemodinámica, el drenaje de líquido dialítico más ascitis (no es necesario hacer paracentesis), el diagnóstico temprano de infecciones (visualización y análisis de efluente peritoneal), el menor riesgo de hemorragia y de anemia (no se usan heparinas), la mejor preservación de la función renal residual, el aporte complementario de glucosa y aminoácidos, el menor riesgo de contagio por virus hepatotropos y todo ello sin las complicaciones derivadas de la colocación y uso de los catéteres intravasculares [63] (Tabla 2).
Entre las posibles desventajas la DP en pacientes cirróticos, está la pérdida de proteínas en el efluente peritoneal que agravaría la hipoalbuminemia presente en estos pacientes. Sin embargo, la mayoría de los datos disponibles no respaldan esta creencia. Los pacientes toleran bien la DP, con cambios mínimos en la albúmina sérica, las pérdidas son inicialmente altas, pero se reducen con el tiempo y los niveles de albúmina sérica se mantienen estables en el tiempo [64].
También en los pacientes cirróticos se observó inicialmente una mayor capacidad de transporte de solutos y agua, que llegó a ser comparable a los controles al final del segundo año de tratamiento, circunstancia que hace innecesario el uso de soluciones hipertónicas en estos casos [65].
Existe la preocupación de que la DP pueda agravar el riesgo de infección peritoneal, añadiendo al riesgo de peritonitis relacionada con la técnica, el
riesgo inherente de peritonitis bacteriana espontánea en estos pacientes, sin embargo, la mayoría de los estudios más recientes no confirman este supuesto. Un estudio observacional de 11 pacientes describe tasas de peritonitis 2,5 veces más altas en pacientes con cirrosis y ascitis en comparación con pacientes no cirróticos en DP [64]. La mayoría de los estudios encuentran tasas similares de infección peritoneal en cirróticos y no cirróticos en DP [65] [66] [67], incluso tasas tan bajas como 0.2 episodios/paciente/año [68].
Por tanto, parece claro que la DP supone una alternativa viable y efectiva, con beneficios potenciales para este grupo de pacientes. También se ha descrito la utilización con éxito de la DP en pacientes con trasplante hepático y ERC [69] [70].
Además, existen ya publicaciones que describen experiencias con el uso de la DP en el tratamiento de la ascitis refractaria a diuréticos, asociada a distintos grados de ERC no avanzada y con buenos resultados [62]. Incluso se ha publicado la utilización del catéter peritoneal para el drenaje ambulatorio de ascitis en pacientes cirróticos sin ERC con buenos resultados [71]. Además, en nuestro centro (datos no publicados), hemos iniciado tratamiento con DP a pacientes con ascitis refractaria con necesidad de paracentesis muy frecuentes (cada 7-15 días) e ingresos frecuentes por descompensaciones hidrópicas. Estos pacientes reciben de 1 a 3 intercambios diarios consiguiéndose una mejoría clínica, reducción en las tasas de frecuentación hospitalaria y hospitalización, normalización de algunos parámetros hepáticos y sin modificaciones en la función renal.