Complejo Esclerosis Tuberosa (CET): una enfermedad multisistémica
INTRODUCCIÓN
El complejo esclerosis tuberosa (CET) es una enfermedad rara, hereditaria y multisistémica, que posee un espectro fenotípico muy amplio.
Es un síndrome caracterizado por el desarrollo de tumores benignos en múltiples órganos. Está causado por mutaciones en TSC1 o TSC2. Estos son genes que codifican la hamartina y la tuberina, proteínas que actúan inhibiendo MTOR (mamalian target of rapamycin) el cual media el crecimiento y proliferación celular. La pérdida de esas proteínas lleva a crecimiento y proliferación celular en diferentes órganos.
Los órganos más frecuentemente afectados son sistema nervioso central (SNC), retina, piel, pulmón, riñón y corazón. Las manifestaciones clínicas son progresivas.
CASO CLÍNICO
Mujer de 33 años derivada a las consultas de nefrología por angiomiolipomas (AML) renales. Presentaba también manchas café con leche cutáneas y crisis comiciales en la infancia (al año y medio de edad), además de un déficit intelectual, con una discapacidad del 35%. En revisión en oftalmología se habían encontrado hamartomas retinianos. Carecía de antecedentes familiares de interés.
Exploración física: Peso 76,2 kg, Talla 1,67 cm. Lesiones características faciales con ausencia de rasgos dismórficos. Normocefalia. Múltiples tuberomas faciales. Mancha hipocrómica en miembro inferior izquierdo. Fibromas subunguales abundantes en dedos de manos y pies. Resto de exploración normal.
Pruebas complementarias de interés:
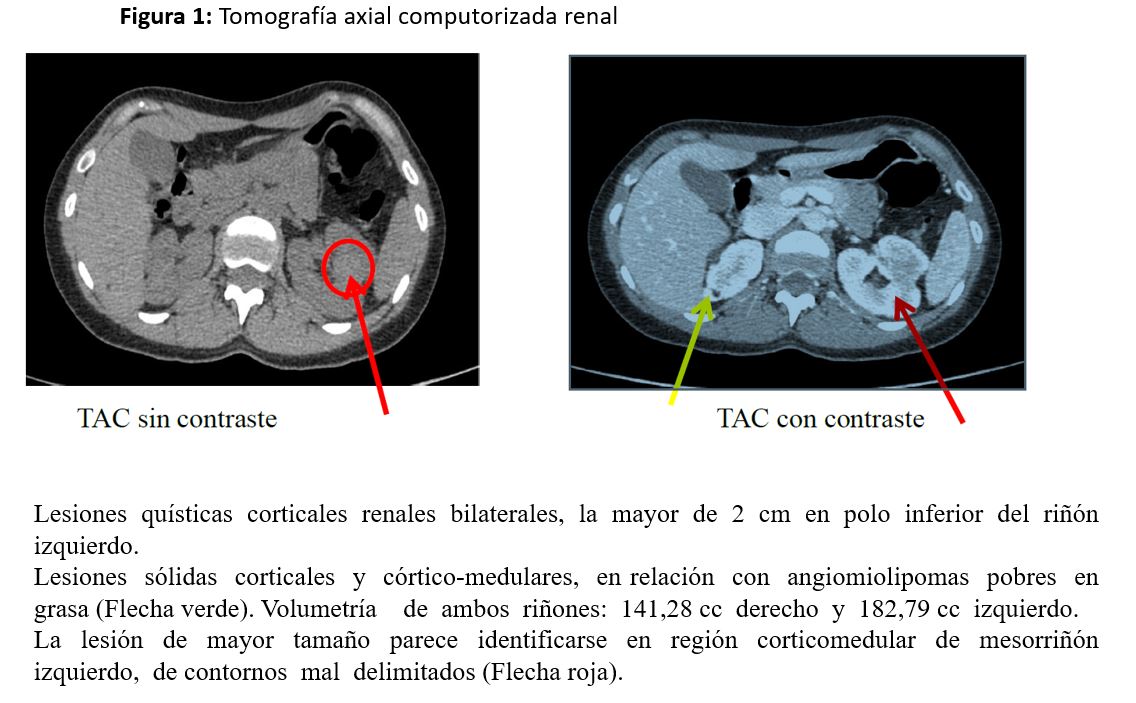
TAC renal (Figura 1): lesiones quísticas corticales bilaterales, la mayor de 2 cm en polo inferior izquierdo. Lesiones sólidas corticales y córtico-medulares, en relación con angiomiolipomas pobres en grasa (Flecha verde). Volumetría de ambos riñones: 141,28 cc derecho y 182,79 cc izquierdo. La lesión de mayor tamaño parece identificarse en región corticomedular de mesorriñón izquierdo, de contornos mal delimitados (Flecha roja).
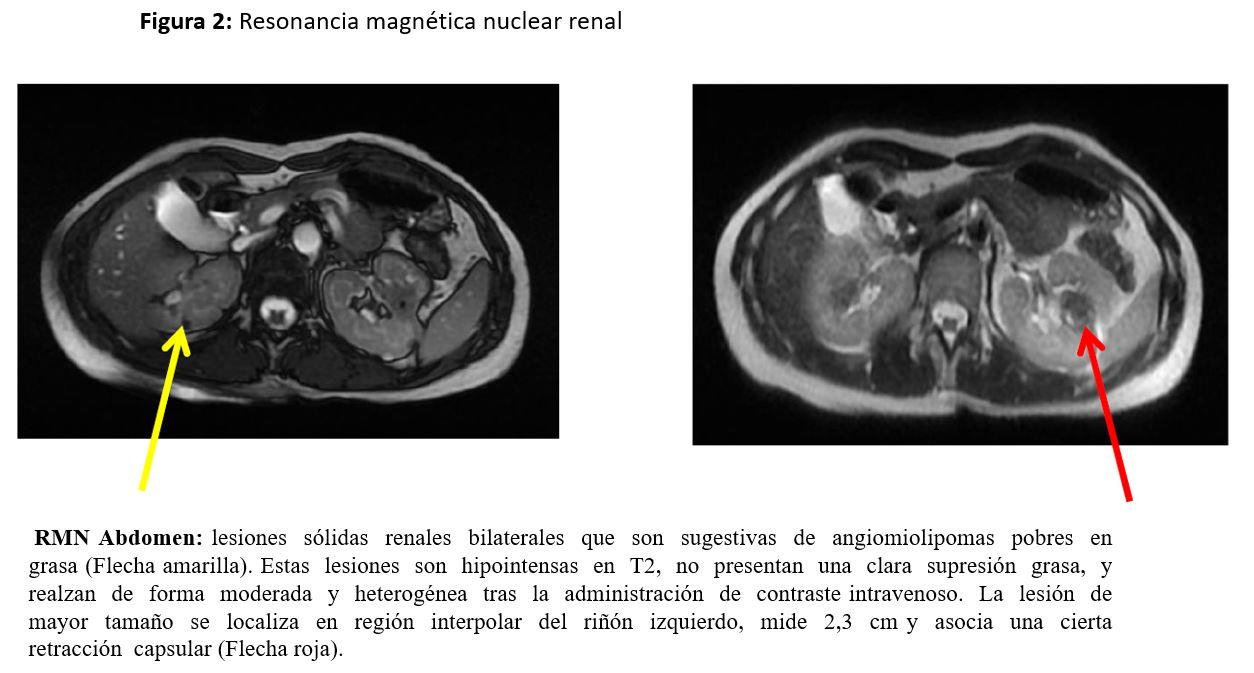
RMN renal (Figura 2): lesiones sólidas renales que son sugestivas de angiomiolipomas pobres en grasa (Flecha amarilla). Estas lesiones son hipointensas en T2, no presentan una clara supresión de grasa, y realzan de forma moderada y heterogénea tras la administración de contraste intravenoso. La lesión de mayor tamaño se localiza en región interpolar del riñón izquierdo, mide 2,3 cm y asocia una cierta retracción capsular (Flecha roja).
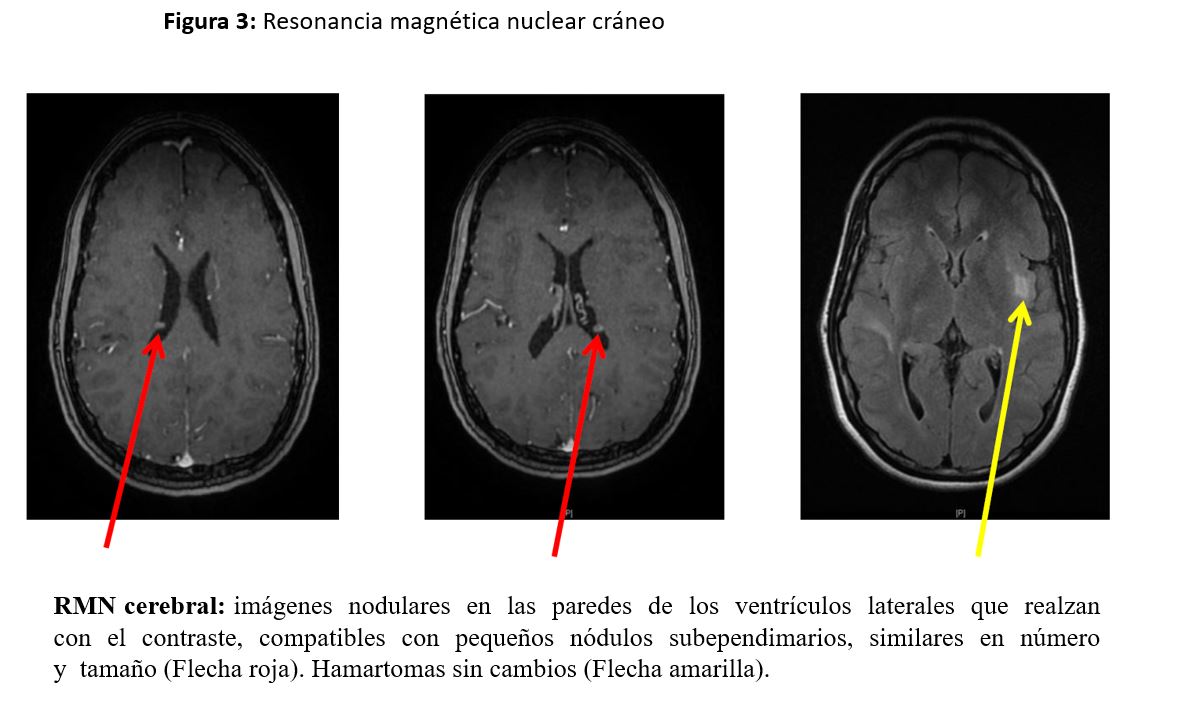
RMN craneal (Figura 3): imágenes nodulares en las paredes de los ventrículos laterales que realzan con el contraste, compatibles con pequeños nódulos subependimarios, similares en número y tamaño (Flecha roja). Hamartomas sin cambios (Flecha amarilla).
TAC Tórax: Incipientes cambios quísticos parenquimatosos pulmonares sugestivos de linfangioleiomiomatosis.
Ecocardiograma: Normal.
Analítica: Hb 11,4 g/dL, Glucosa 104 mg/dL, urea 25 mg/dL, Creatinina 0,76 mg/dL, Na 140 mmoL/L, K 3,8 mmoL/L, Ca 9,2 mg/dL, P 4 mg/dL, Mg 1,6 mg/dL. Cistatina C 0,57 mg/L. Enzimas hepáticas normales. Orina de 24h: Proteínas totales: 55 mg/24 h, microalbuminuria 7,82 mg/24 h.
Estudio genético: Mutación c 4494-IG>C en gen TSC2.
Se confirmó el diagnóstico de esclerosis tuberosa y se inició tratamiento con everólimus con dosis de 10 mg/ 24 h en el inicio, con vigilancia de los niveles de antiepilépticos. Los niiveles de everólimus con esa dosis fueron 4,55 ng/ml.
Evolución
Tras 4 años de seguimiento (inicio 2021) no hubo progresión de las lesiones (SNC y renales) según las pruebas radiológicas de control, con una mejoría clara de lesiones cutáneas y sin crisis epilépticas. Recientemente ha presentado como complicación un absceso renal derecho con buena resolución tras tratamiento antibiótico intravenoso y suspensión de everólimus durante el proceso agudo. Tras ello, se ha reiniciado everólimus con dosis disminuidas a 2 mg en 24 h ajustado a concentración plasmática.
Actualmente, la paciente está en seguimiento protocolizado por nefrología, neurología, oftalmología, cardiología, genética, urología, dermatología, medicina interna (consulta de enfermedades raras) y psicología.
Comentarios.
La paciente presentada se diagnosticó de CET en base a la actualización internacional de criterios diagnósticos en 2012 (1) (Tabla 1), presentando la mutación en gen TSC2, que es la más frecuente.
La afectación clínica más común del CET es el SNC, seguida de la renal, que es potencialmente la de peor pronóstico. Hay una mayor prevalencia de clínica renal en pacientes con mutación en gen TSC2 y es además un predictor de la progresión de pérdida de la función renal. Las patologías renales más comunes del CET son los AML (que son los más frecuentes), los quistes renales y más raramente tumores renales (que se dan más en < 50 años). Los AML asociados a CET varían en tamaño y típicamente son múltiples y bilaterales y su principal complicación es la hemorragia espontánea. En pacientes con CET suelen coexistir, como en nuestra paciente, AML clásicos (buen pronóstico) y AML atípicos epitelioides, que pueden sufrir transformación maligna.
El diagnóstico diferencial de los AML se realiza con tumores retroperitoneales y tumores renales malignos. En casos dudosos se debe realizar una biopsia de la lesión y seguimiento de las mismas. En nuestro caso se optó, en consenso con el Comité de Tumores, por realización de PET-TAC, sin captación de las lesiones renales.
El objetivo del tratamiento de AML es prevenir los eventos agudos y preservar el parénquima y la función renal. En los AML asociados a CET debemos tener en cuenta una tasa de rotura y hemorragia elevada si el tamaño es superior a 4 cm y se asociaría a altas tasas de morbilidad.
De acuerdo con las guías (Véase tratamiento crónico en CET), en paciente adulto con AML asociado con el CET que presentan riesgo de complicaciones (tamaño mayor de 3cm, crecimiento rápido (> 0,25 cm/año) y presencia de tumores múltiples o bilaterales), recomiendan como primera línea de tratamiento iniciar inhibidores de mTOR. La dosis recomendada es de 10 mg de everólimus una vez al día según ficha técnica aunque se podría ajustar la dosis según niveles plasmáticos iniciales de 3-6 ng/ml y aumentar en 2 meses a 6-10 ng/ml. El tratamiento debe continuar mientras haya beneficio clínico o hasta que aparezca una toxicidad inaceptable. Ante reacciones adversas leves, normalmente no se requiere ajuste de la dosis. Si presenta reacciones adversas moderadas, se puede realizar una reducción de la misma. La dosis recomendada en esos casos es un 50% más baja que la dosis diaria administrada previamente (2).
Así ocurrió en nuestra paciente, que requirió ajuste de dosis por efectos adversos como dolor abdominal recurrente, estomatitis y pérdida de peso. Y posteriormente tras infección aguda sistémica, se suspendió el tratamiento y se reinició a mitad de dosis al superar el proceso agudo, con buena tolerancia posterior.
* En cuanto al seguimiento, hay que tener en cuenta :
- Si AML con lesiones atípicas y de crecimiento rápido, se deben realizar controles cada 6 meses, con RMN como técnica de elección. Lo más habitual es valorar el tratamiento mediante volumetrías de las lesiones renales más grandes y el tamaño total del riñón.
- La función renal, debe ser evaluada al diagnóstico y posteriormente de forma anual en pacientes adultos (3).
* Se debe finalizar tratamiento: Si hay fracaso del tratamiento tras 6 meses sin estabilizar AML a dosis máximas toleradas, si hay ERC progresiva y en caso de efectos adversos inaceptables a pesar de ajustar dosis.
* Para concluir, la CET debe llevar una revisión protocolizada de los órganos más frecuentemente afectos para limitar la aparición de complicaciones.
Referencias bibliográficas
1. D. A. Krueger and H. Northrup, Tuberous sclerosis complex surveillance and management: recommendations of the 2012 International Tuberous Sclerosis Complex Consensus Conference.Pediatr. Neurol., vol. 49, no. 4, pp. 255-265, Oct. 2013.
2. J. J. Bissler et al, Effect of everolimus on renal function in patients with tuberous sclerosis complex: evidence from EXIST-1 and EXIST-2., Nephrol. Dial. Transplant, vol. 34, no. 6, pp. 1000-1008, Jun. 2019.
3. J. C. Kingswood et al., Review of the Tuberous Sclerosis Renal Guidelines from the 2012 Consensus Conference: Current Data and Future Study., Nephron, vol. 134, no. 2, pp. 51-58, 2016.