Presentación grave de Poliquistosis Renal Autosómico Dominante por coexistencias de dos variantes en PKD1.
INTRODUCCIÓN
La poliquistosis renal autosómica dominante (PQRAD) es causada principalmente por variantes patogénicas en los genes PKD1 o PKD2 (85% y el 15% de los casos respectivamente) aunque en los últimos años se han descubierto nuevos genes asociados a PQRAD como GANAB, DNAJB11, ALG9, ALG5 y IFT140 [1]. La característica de esta enfermedad es la presencia de múltiples quistes renales bilaterales que provocan nefromegalia, llegando a precisar tratamiento renal sustitutivo hacia la sexta década de la vida [1]. En las enfermedades con herencia autosómica dominante, como la PQRAD, la presencia de una sola copia del gen mutado es suficiente para que la enfermedad se manifieste. Los descendientes tienen una probabilidad del 50% de desarrollar la enfermedad. Mientras que en las enfermedades con herencia autosómica recesiva como la poliquistosis renal autosómica recesiva (PQRAR), causada por variantes en el gen PKHD1 debe existir una variante patogénica en ambas copias del gen para expresar la enfermedad. En estos casos, los progenitores son portadores heterocigotos de la mutación y generalmente son asintomáticos (ocasionalmente presentan algún quiste renal), teniendo los descendientes un 25% de probabilidad de tener la enfermedad, habitualmente con expresión en edad pediátrica.
La PQRAD puede presentarse de forma anecdótica en el periodo neonatal, sin embargo, ante un caso de múltiples quistes renales bilaterales con nefromegalia en el periodo neonatal, la sospecha inicial es una PQRAR. Los casos de PQRAD grave y/o a edades tempranas, pueden desarrollarse debido la coexistencia de variantes patogénicas en otros genes causantes de ciliopatías o bien a la presencia de alelos hipomórficos (variantes que de por sí, no tienen una repercusión fenotípica típica de la enfermedad o es muy leve, porque codifican una proteína suficientemente funcionante).
CASO CLÍNICO
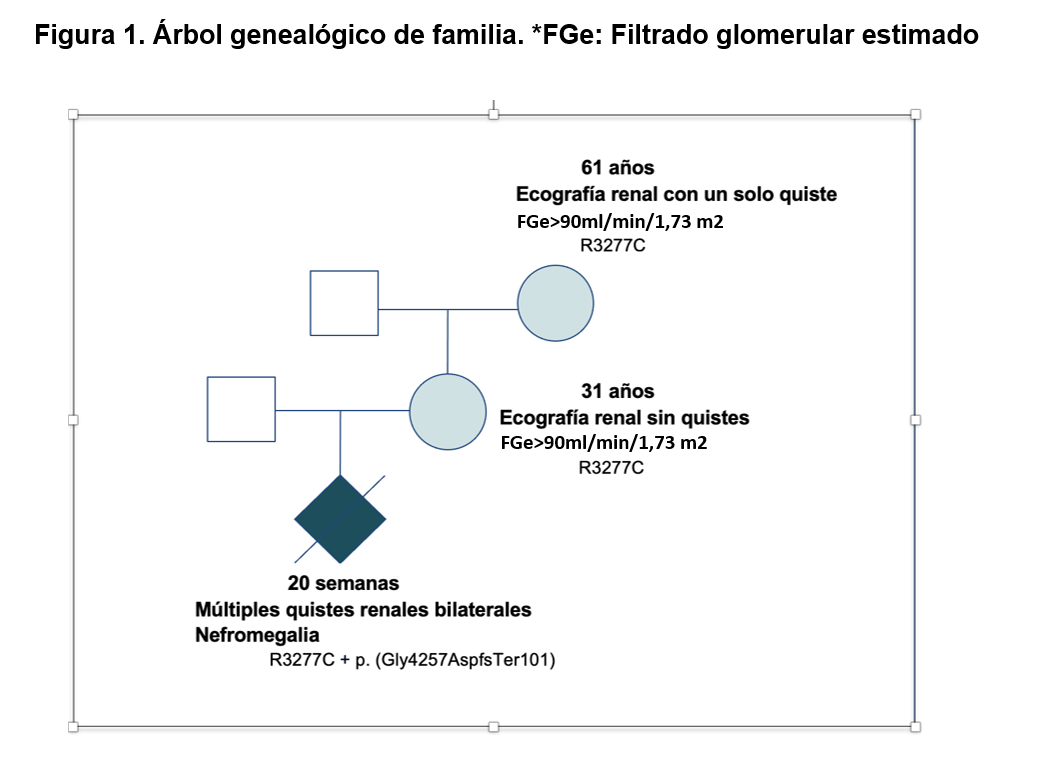
Presentamos el caso de una mujer de 31 años embarazada de 20 semanas, a la cual se tiene que realizar interrupción precoz del embarazo por hallazgo de poliquistosis renal masiva en el feto.
Se realiza estudio genético en el feto, identificándose dos variantes en el gen PKD1 en trans: una variante tipo missense c.9829C>T p.(Arg3277Cys) y una variante patogénica de tipo frameshift c.12768del p.(Gly4257AspfsTer101).
Se realiza análisis de segregación en los padres del feto: La madre presenta la variante tipo missense c.9829C>T p.(Arg3277Cys) y el padre no presenta ninguna de las dos variantes, por tanto la segunda variante patogénica es una variante de novo en el feto. Se completa la segregación, analizando a la abuela del feto por su rama materna y se confirma la presencia de la variante tipo missense encontrada en la hija. Se realiza ecografía a la madre y abuela y la madre no presenta quistes renales mientras que la abuela presenta solamente un quiste renal (Figura 1).
Ante estos hallazgos genéticos se diagnostica al feto de PQRAD grave, posiblemente por la presencia de dos variantes en PKD1: una variante patogénica truncante, asociada a una variante missense hipomórfica.
COMENTARIOS
La variante de secuencia PKD1 c.9829C>T p.(Arg3277Cys) es una variante de tipo missense poco frecuente en la población general (gnomAD frecuencia de 0.02%) y ha sido considerada como un alelo hipomórfico o de penetrancia incompleta. La otra variante presente PKD1 c.12768del p.(Gly4257AspfsTer101) es una variante de tipo frameshift que da lugar a una proteína truncada.
La variante encontrada tanto en el feto como su madre y abuela, al ser un alelo hipomórfico, cuando se hereda solo, da lugar a manifestaciones clínicas muy leves con pocos quistes renales o sin ninguno tal como lo presentan las dos pacientes del caso. Mientras que si se encuentra en trans junto a otra variante patogénica en PKD1 parece que da lugar a una enfermedad de inicio grave a edades tempranas e incluso formas neonatales o prenatales, pudiendo confundir el diagnóstico con PQRAR [2], que es lo que ocurrió en el feto que presentamos en este caso, indicando la interrupción precoz del embarazo.
En la literatura existen casos descritos de familias con PQRAD y presencia de alelos hipomórficos. El artículo Rossetti S. et al [3], describe una familia completa, en la cual tenemos los casos de dos hermanos de 75 y 62 años con enfermedad renal crónica (ERC) asociado a riñones agrandados bilateralmente y múltiples quistes, mientras que seis casos de la familia, como el padre de éstos, con 79 años y el hijo de uno de ellos de 48 años, sin ERC y con pocos o ningún quiste renal. Al realizar el estudio genético en la familia se detecta la presencia de homocigosidad para el alelo R3277C en los casos de los hermanos y en aquellos casos con pocos quistes y sin ERC, la presencia de la misma variante en heterocigosis, sugiriendo que se trata de un alelo de penetrancia incompleta, es decir, un alelo hipomórfico.
Otro caso en el artículo escrito por Vujic M. et al [4], describen otra familia formada por un padre de 41 años y madre de 34 años sin quistes renales ecográficamente. El primer descendiente se diagnostica, por ecografía a las 27 semanas de gestación, de unos riñones agrandados y ecogénicos. Al nacer con 36 semanas, presentó hipertensión arterial e insuficiencia renal que se revirtió. El paciente a los 8 años presenta filtrado glomerular estimado normal (65 ml/min por 1,73 m2) sin quistes hepáticos, pero con riñones agrandados que contienen múltiples quistes pequeños. El paciente presenta dos alelos PKD1 hipomórficos heredados en trans, mientras que los progenitores presentan un alelo hipomórfico en heterocigosis cada uno. En esta familia los alelos hipomórficos eran diferentes (R2220W y R3277C).
En conclusión, la afectación renal quística grave fetal está causado principalmente por variantes patogénicas en PKHD1, aunque es necesario considerar otras enfermedades y mutaciones en otros genes como en PDK1 ya que en algunas circunstancias las manifestaciones clínicas pueden superponerse [5]. El efecto del alelo hipomórfico depende de la co-herencia de éste. Al heredarse solo, da lugar a manifestaciones clínicas leves, aunque si se presenta en trans con otra variante PKD1 da lugar a una enfermedad grave y/o de forma temprana. Los pacientes presentan una probabilidad del 50% de transmitir esta variante PKD1 a cada uno de sus descendientes, independientemente del sexo de éstos.
En nuestro caso clínico, en cuanto a la relevancia de cara al consejo genético, la probabilidad de tener un nuevo descendiente muy afecto es insignificante pues la segunda variante patogénica truncante encontrada en el feto es una variante de novo.