Paciente pediátrico con enfermedad renal terminal secundaria a litiasis y nefrocalcinosis por hiperoxaluria primaria
Introducción
La hiperoxaluria primaria (HOP) es una rara alteración genética del metabolismo del glioxalato heredada de forma autosómica recesiva y que resulta en una producción endógena excesiva de oxalato. Se encuentra habitualmente infradiagnosticada y/o su detección suele ser tardía debido a la variabilidad clínica de expresión (penetrancia incompleta), siendo habitual por ello en el momento de su diagnóstico la presencia de enfermedad renal terminal (ERT) (1-10% de las causas de ERT) [1] [2]. De los 3 tipos de HOP descritos, el tipo 1 es el más común (80%) y de peor pronóstico [3] [4].
Caso Clínico
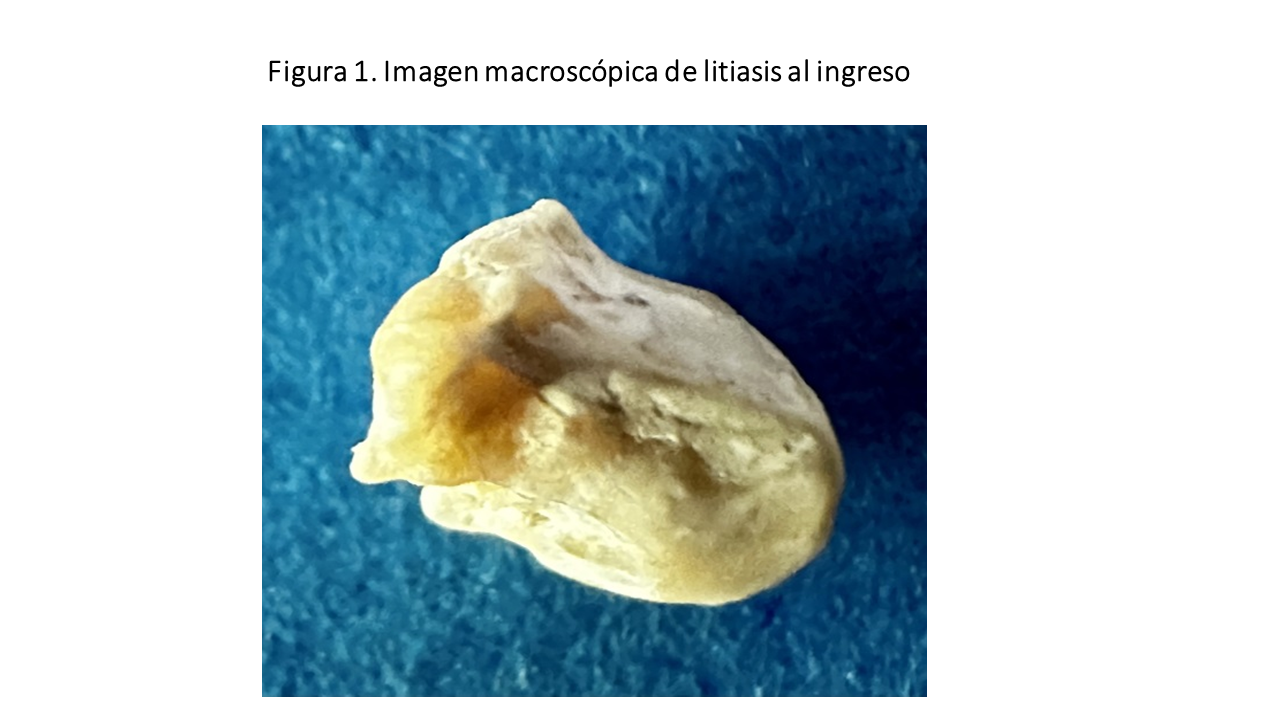
Paciente varón de 8 años procedente de Marruecos sin antecedentes médicos de interés, hijo de padres consanguíneos, aparentemente sanos. Fruto de tercera gestación (2 hermanos mayores sanos y uno fallecido a los 8 meses de causa renal no filiada). Acude a urgencias con historia de hematuria, disuria y lumbalgia de 24 horas de evolución, con expulsión de cálculos en última micción (Figura 1), presentando además fiebre de hasta 39.7°C en las últimas 12 horas. En la exploración física destaca un peso y talla en percentiles <3 para la edad, sin otro hallazgo relevante. A nivel analítico impresiona daño renal (creatinina (Cr) de 3.14 mg/dL –FG estimado por fórmula de Schwartz 2009 –K=0,413- IDMS 16 ml/min/1.73m2-, urea de 105 mg/dL), acidosis metabólica (gasometría venosa: pH 7.35, HCO3- 16.9 mmol/L) y anemia (hemoglobina de 9.4 g/dL) junto a elevación de reactantes de fase aguda (procalcitonina 0.9 ng/mL). A nivel urinario únicamente se objetiva proteinuria (Pr/Cr 1.06 mg/mg) de componente mixto (B2 microglobulina 27,9 ug/ml y Alb/Cr 61,4 mg/mmol). Tras la valoración del paciente se decide ingreso hospitalario para estudio etiológico de la causa de la insuficiencia renal, iniciándose tratamiento antibiótico empírico con amoxicilina/clavulánico a la espera de cultivos.
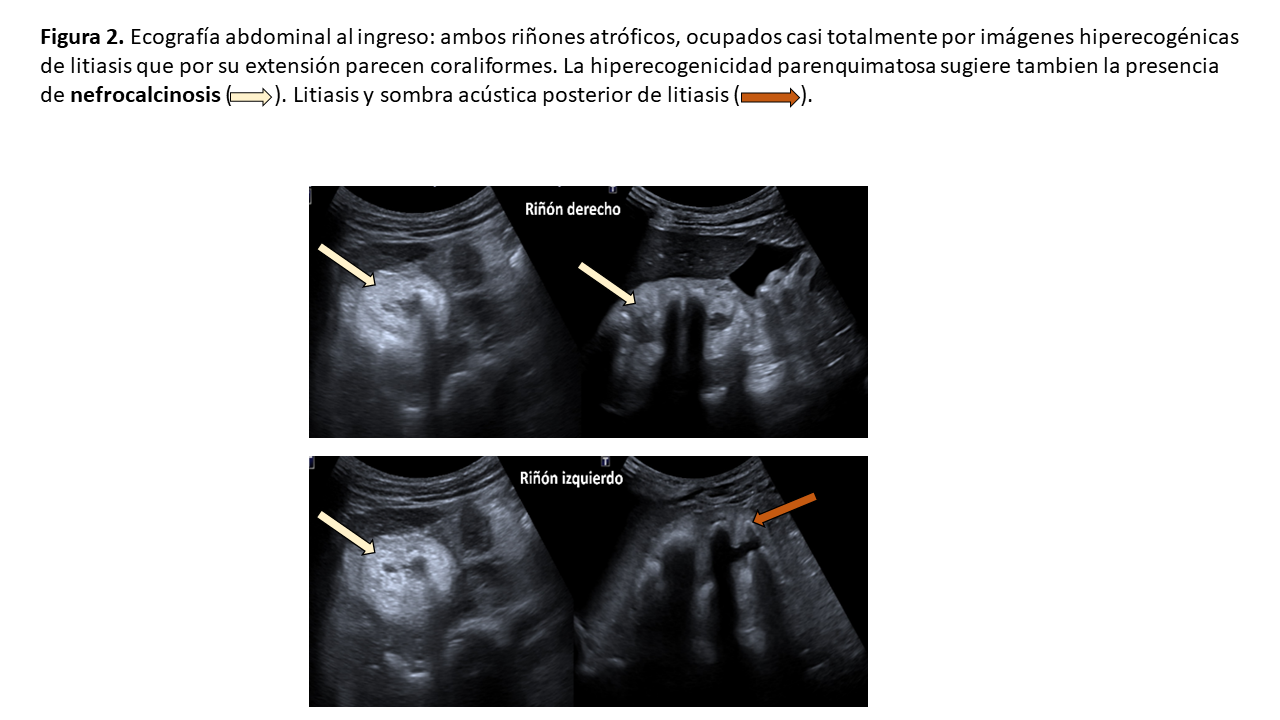
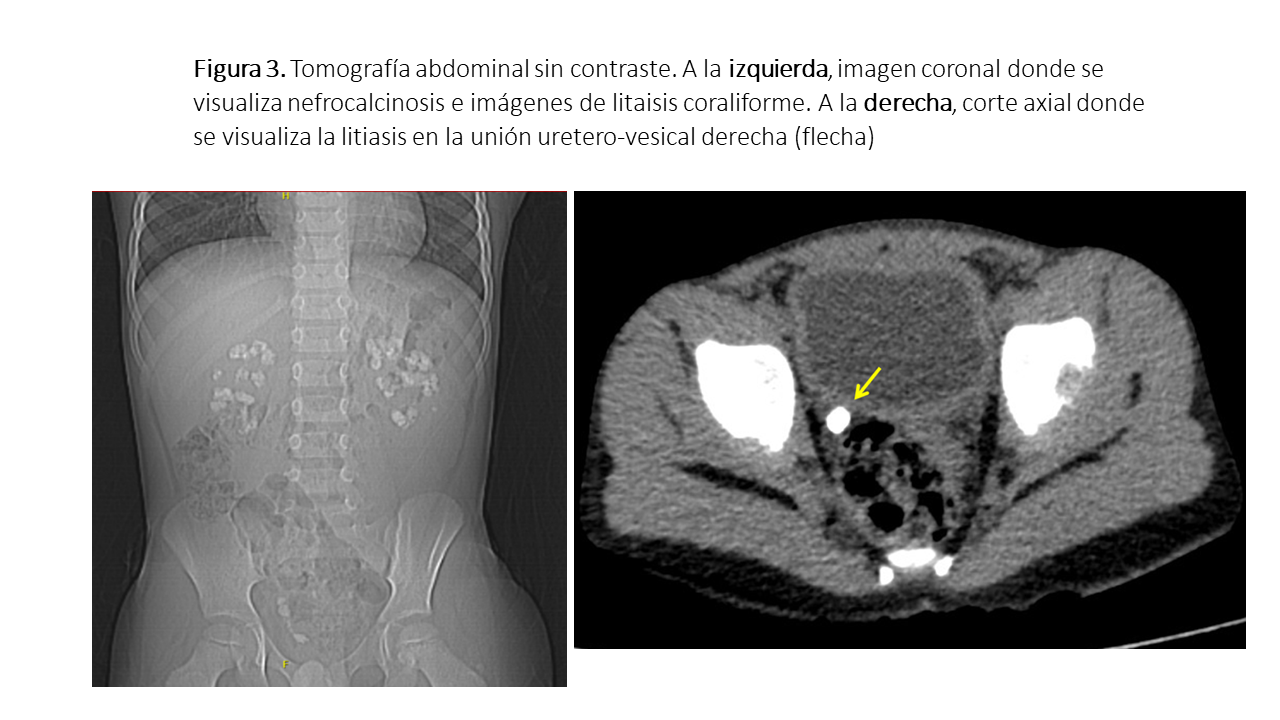
Se realizó ecografía abdominal (Figura 2), en donde llama la atención la presencia de ambos riñones atróficos e hiperecogénicos con presencia de múltiples imágenes cálcicas en médula, cálices y pelvis en relación a cálculos y nefrocalcinosis con confirmación posterior por tomografía abdominal sin contraste, objetivándose además una litiasis en el extremo distal ureteral derecho justo en la unión uretero vesical (Figura 3), sin obstrucción asociada.
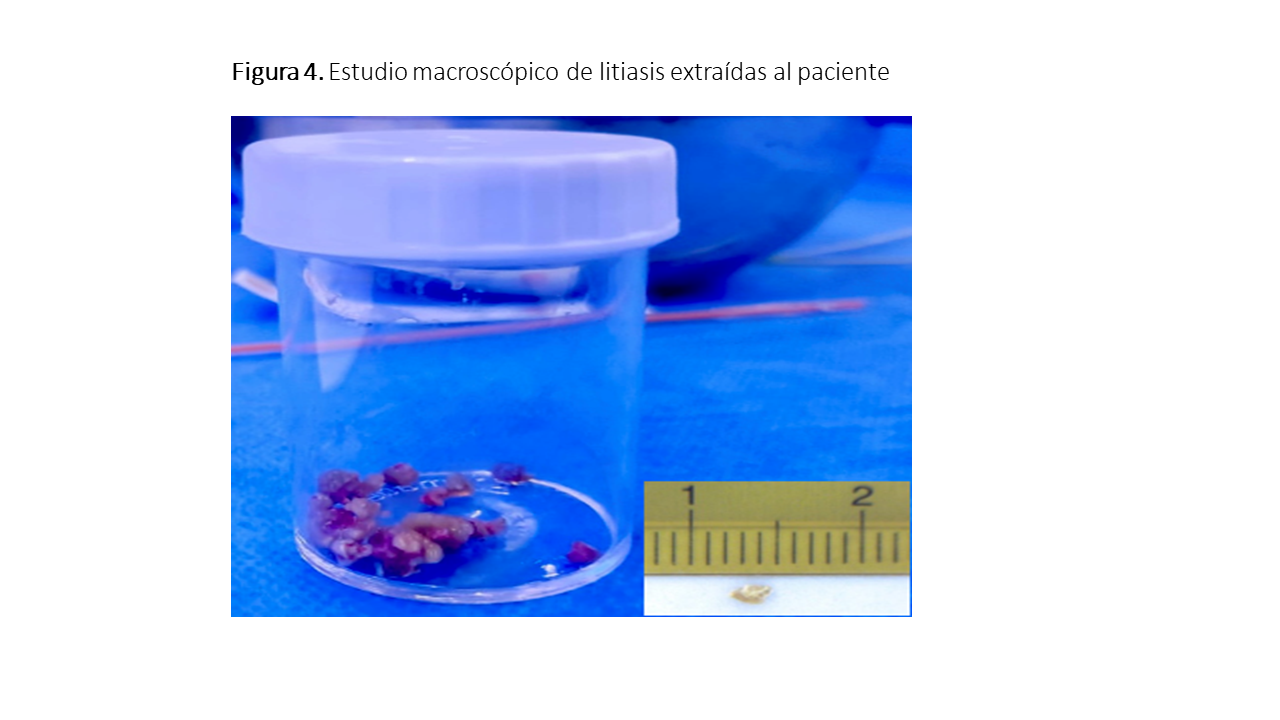
En las primeras 48 horas de ingreso refiere dificultad para la micción, dolor uretral y oliguria progresiva por lo que, ante la sospecha de obstrucción litiásica, se lleva a cabo una cistoscopia con la extracción de múltiples cálculos uretrales y vesicales que fueron enviadas para análisis (Figura 4). El estudio cristalográfico posterior mostró cálculos con componente mayoritario de oxalato cálcico monohidrato (>95% Whewellita). Con dichos datos, se plantea como primera sospecha diagnóstica la HOP, por lo que se decide ampliar el estudio urinario objetivándose niveles de oxaluria por encima del rango de normalidad para la edad del paciente (Ox/Cr 255.7 mmol/mol) e iniciándose tras ello hiperhidratación endovenosa, tratamiento empírico con vitamina B6, citrato potásico y manejo terapéutico con diálisis intensiva (6 días a la semana, 5 horas por sesión) en espera de resultados del estudio genético cursado.
Comentarios
El estudio bioquímico inicial se basa en la determinación de niveles de oxalato en orina de 24 horas corregido por creatinina o superficie corporal y, en caso de no ser posible, se podría realizar el índice oxalato/creatinina en orina aislada (teniendo en cuenta los rangos de normalidad por edad), corroborada en al menos 2 ocasiones (con resultados >0.5 mmol/1.73 m2/día o elevados según rango para la edad del paciente en cocientes urinarios de orina aislada) cuando se tenga una alta sospecha de HOP (descartando siempre antes, por su frecuencia, las causas secundarias). En pacientes con importante alteración de la función renal (FG estimado Schwartz 2009 -K=0,413- <30-40 ml/min/1.73 m2), la eliminación urinaria de oxalatos se ve alterada, pudiendo ser sus niveles falsamente normales. Por lo tanto no podremos valorar con exactitud la situación del paciente hasta su realización. Estos pueden encontrarse elevados (>20 μmol/l) incluso en etapas iniciales de la enfermedad [3] [5].
En el caso anterior, los niveles de oxalato sérico fueron de 27 μmol/L, tras lo cual se inició hiperhidratación (3 litros/1,73 m2/día), terapia alcalinizante (citrato potásico), vitamina B6 empírica y terapia renal sustitutiva, instando del mismo modo al paciente a evitar alimentos con exceso de oxalato [6].
Teniendo en cuenta que la producción diaria de oxalato en pacientes con HOP puede oscilar entre 3.500-7.500 μmol/día, en caso de disminución de la función renal (FG <30 ml/min/1,73 m2) el riñón no será capaz de mantener la oxalemia normal y se superará el umbral de saturación de oxalato cálcico, pudiendo depositarse también en tejidos extrarrenales (oxalosis) como retina, miocardio, vasos sanguíneos, piel, hueso y sistema nervioso [4], por lo que es necesario realizar siempre el estudio de extensión para el despistaje de los mismos. En el caso de nuestro paciente, se completaron las evaluaciones oftalmológicas, cardiológicas, tiroideas y radiográficas, siendo todas ellas normales y presentando únicamente alteración en los resultados de la densitometría ósea (-1.6 DS para la edad).
En todo paciente con sospecha clínica de HOP resulta imprescindible la realización del estudio genético, considerándose el método diagnóstico de elección para los 3 tipos de HOP [1] [3]. Esto es debido no solo a que resulta fundamental para el diagnóstico definitivo y la tipificación de la variante (ayudándonos a determinar el manejo específico y los parámetros bioquímicos a controlar) sino que también ayudará, en el caso de la HOP tipo 1, a valorar la respuesta esperada al tratamiento con piridoxina [1]. Por ello se aconseja que se realice rápidamente y si es posible dentro de los primeros 30 días desde la presentación del paciente. Hoy en día, hay más de 200 variantes patogénicas en el gen que la codifica (AGXT) y habiendo únicamente 1/3 de ellas donde se espera capacidad de respuesta al tratamiento con piridoxina (precursor del fosfato-5-piridoxal, coenzima del AGT) [1]. Es de vital importancia realizar estudio de portadores a los padres para así brindarles consejo genético y detección temprana de otros posibles casos en la familia.
Dos semanas después del ingreso, se recibió el resultado del estudio genético detectándose una variante (c.731T>C) en homocigosis en el gen AGXT considerada en publicaciones previas con respuesta parcial a la piridoxina, por lo que se se decidió continuar con el tratamiento ante la adecuada respuesta a la misma. De detectó el estado de portadora en la madre (variante en heterocigosis para el mismo cambio descrito) sin posibilidad de completarse el estudio en el padre al residir fuera del país (Marruecos).
Las opciones terapéuticas hasta hace un tiempo eran limitadas a hiperhidratación, piridoxina e inhibidores de la cristalización de oxalato cálcico. Los pacientes con enfermedad renal avanzada que ya no son capaces de remover la producción hepática de oxalatos (28-37.7 mmol/semana) deben someterse a sesiones de hemodiálisis diarias (6 días a la semana entre 4,5 horas por sesión, removiendo con ello hasta 24 mmol/1.73m2/semana) [3] [7]. El trasplante hepático cura el defecto metabólico, sin embargo, debido a la frecuente afectación renal al diagnóstico lo más frecuente es la realización de un trasplante combinado hepatorrenal.
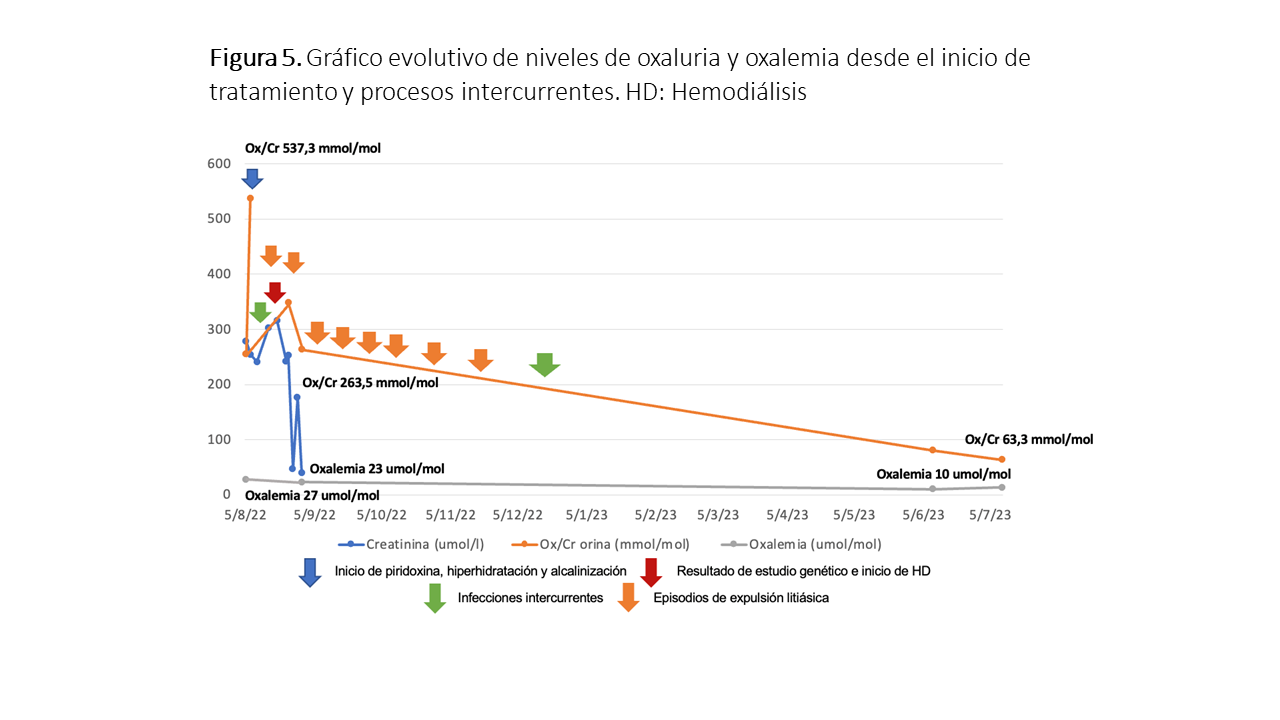
El paciente, además del tratamiento descrito, fue incluido en un ensayo clínico para recibir terapia mensual con ARN interferente (ARNi) subcutáneo, consiguiendo así una reducción progresiva en los niveles de oxalemia (hasta 10 mmol/L) y oxaluria (Ox/Cr 63.3 mmol/mol) tras 11 meses de tratamiento (Figura 5). Este nuevo fármaco es dirigido al ARN mensajero de la glicolato oxidasa (Lumasiran, Oxlumo®), bloqueando la conversión de glicolato en glioxilato, disminuyendo la producción de oxalato hepático [7] [8] [9]. La introducción de estas nuevas modalidades terapéuticas en la HOP confirieren un beneficio clínico a pacientes que anteriormente presentaban opciones limitadas, sobre todo aquellos pacientes portadores de mutaciones no respondedoras a tratamiento con piridoxina, mejorando así su calidad de vida y abriendo la posibilidad de la realización de trasplantes renales aislados.
Durante su evolución, nuestro paciente presentó un nuevo ingreso por cuadro obstructivo de la vía urinaria secundario a litiasis uretral (extracción cistoscópica), sin nuevos episodios desde los 6 primeros meses de tratamiento con ARNi. Actualmente continua con diálisis ambulatoria que ha podido reducirse a una frecuencia de 3 veces por semana, presentando también mejoría a nivel pondo-estatural (talla en percentil 10 y peso en percentil 5), valorándose actualmente la realización de trasplante renal aislado o combinado hepatico y renal, según su evolución.