Síndrome de Alport ligado a X y leiomiomatosis. Integrando hallazgos clínicos y genéticos
Introducción
El síndrome de Alport (SA) es una enfermedad genética causada por alteraciones en la síntesis del colágeno tipo IV, una proteína esencial de la membrana basal glomerular (MBG). Sus principales manifestaciones clínica incluyen microhematuria , proteinuria progresiva, insuficiencia renal crónica, pérdida auditiva neurosensorial bilateral y alteraciones oculares. Puede heredarse de forma autosómica dominante, recesiva o ligada al cromosoma X. El diagnóstico se realiza mediante estudio genético .
Una manifestación extrarenal infrecuente pero relevante es la leiomiomatosis esofágica, asociada a variantes patogénicas en los genes COL4A5 y COL4A6, localizados en el cromosoma Xq22. Esta condición afecta principalmente a mujeres con SA ligado al cromosoma X y se debe a deleciones contiguas en dichos genes, que comprometen la MBG y las fibras musculares lisas del esófago. La leiomiomatosis se caracteriza por proliferación anómala del músculo liso, generando tumores benignos en el esófago que pueden causar dismotilidad, dolor torácico y dilatación esofágica avanzada. También puede afectar otros órganos como pulmón, intestino o tracto genital femenino, manifestándose como hipertrofia del clítoris.
Este cuadro clínico resalta la importancia del diagnóstico temprano para prevenir complicaciones renales y extrarrenales.
Caso clínico:
Presentamos el caso de un mujer de 15 años, derivada a la consulta de Nefrología en un hospital de tercer nivel desde el servicio de atención primaria para el seguimiento nefrológico en la edad adulta. La paciente había estado en seguimiento previo desde los 7 años de edad (2014) en un hospital de referencia de Nefrología Pediátrica debido a episodios recurrentes de hematuria macroscópica.
Antecedentes personales y médicos: Primer ingreso hospitalario en noviembre de 2014 por un episodio de hematuria macroscópica. Desde ese momento, ha estado bajo seguimiento por el servicio de Nefrología Pediátrica, en tratamiento con enalapril 5 mg diarios, hasta el año 2022.
Estudios previos: Se realizó una biopsia renal en el año 2017. El informe anatomopatológico describió glomérulos con morfología normal, con un leve aumento de la matriz mesangial. No se observaron alteraciones en los túbulos ni en el intersticio, y no se evidenciaron infiltrados. Los vasos renales no presentaban particularidades, y la inmunofluorescencia fue negativa. En resumen, el estudio histopatológico no mostró alteraciones microscópicas renales, además, se había realizado despistaje inmunológico y estudio para errores innatos del metabolismo siendo todos ellos negativos.
Evolución en nuestro centro: La paciente fue visitada por primera vez en las Consultas Externas de Nefrología de nuestro hospital en diciembre de 2022. Destacaba función renal dentro de los parámetros normales, con proteinuria menor a 0.5 gr/24 horas. En el sedimento urinario se observaron más de 100 hematíes por campo, de los cuales el 73% eran dismórficos. El estudio inmunológico resultó negativo, y una ecografía abdominal no mostró alteraciones. En abril de 2023, persistía con microhematuria y proteinuria.
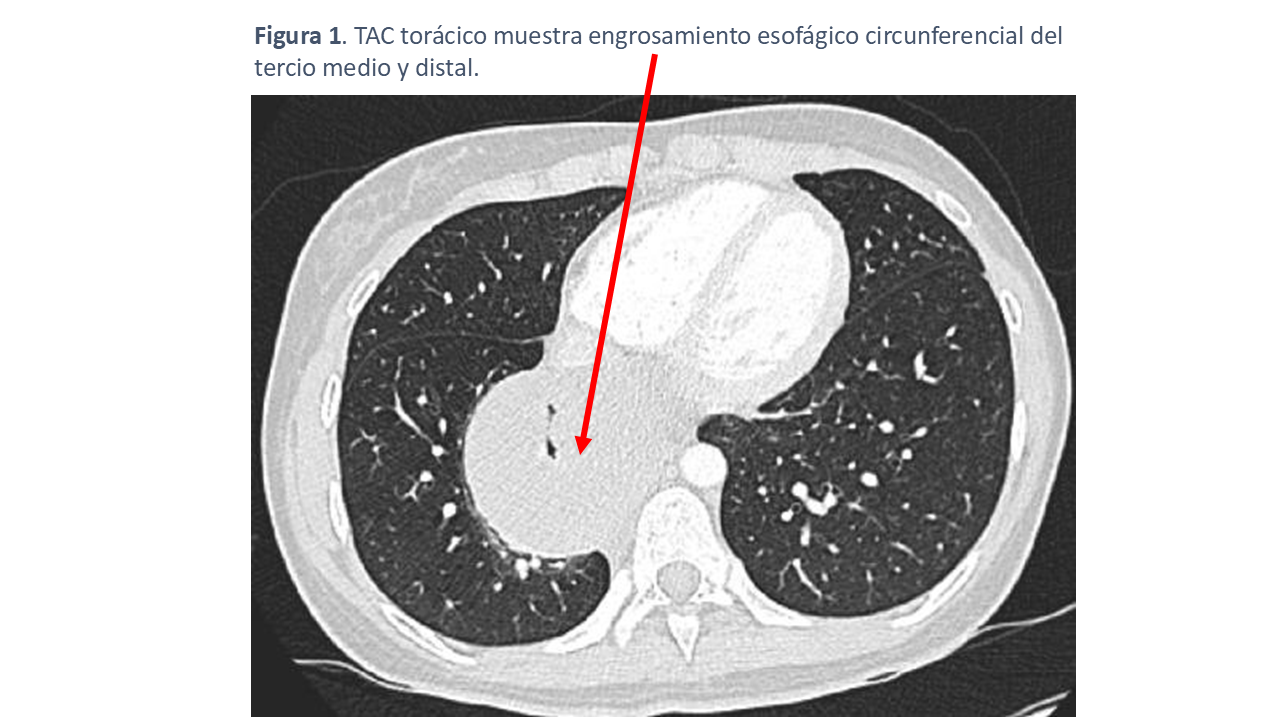
En una radiografía de tórax se evidenció una posible masa en mediastino que se estudió mediante TAC torácico, en el que se detectó una extensa lesión esofágica que se manifestó como un engrosamiento concéntrico y difuso de la pared del esófago (Figura 1), afectando especialmente el tercio medio y distal, donde adquiría la forma de una pseudomasa. La lesión producía una dilatación moderada de la luz del esófago proximal. Ante estos hallazgos, el informe radiológico sugería la posibilidad de leiomiomatosis esofágica.
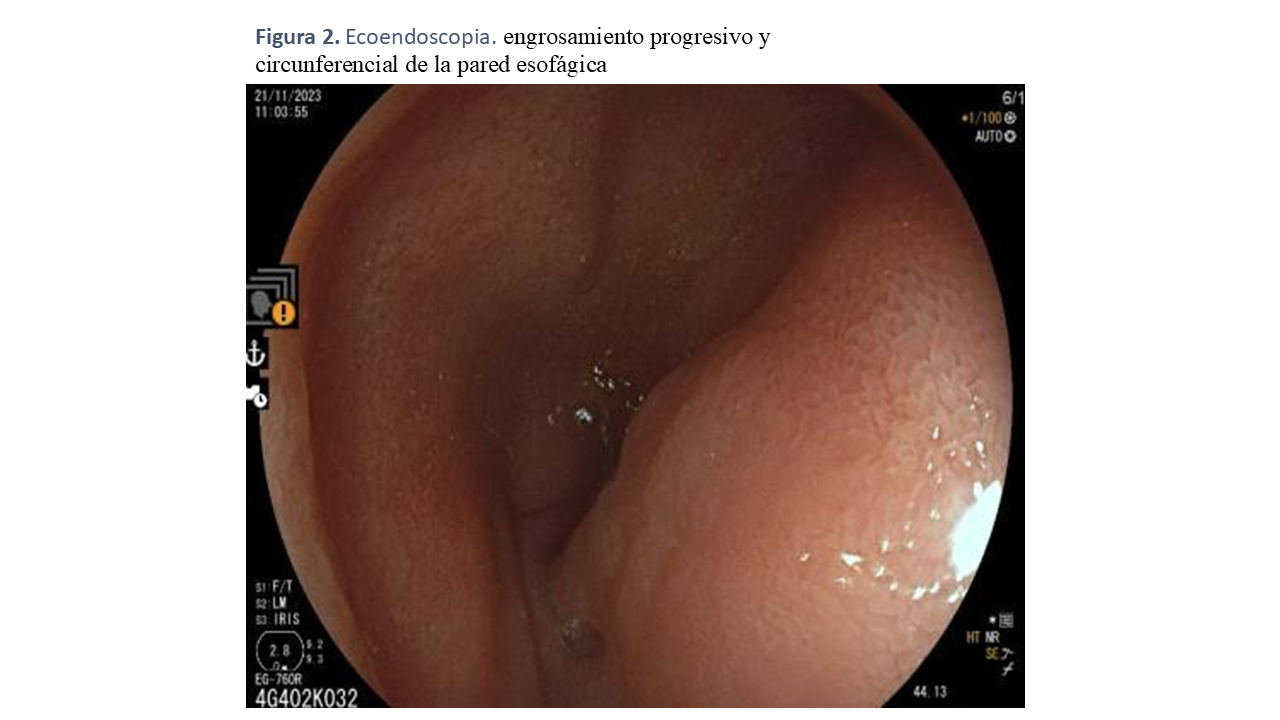
Se realizó una ecoendoscopia donde se identificó un engrosamiento progresivo y circunferencial de la pared esofágica, alcanzando hasta 39 mm de grosor, extendiéndose desde los 20 cm hasta los 47 cm de la arcada dentaria superior, en relación con la capa muscular propia (Figura 2). La citología obtenida mediante PAAF fue compatible con músculo liso, sin evidencias de malignidad.
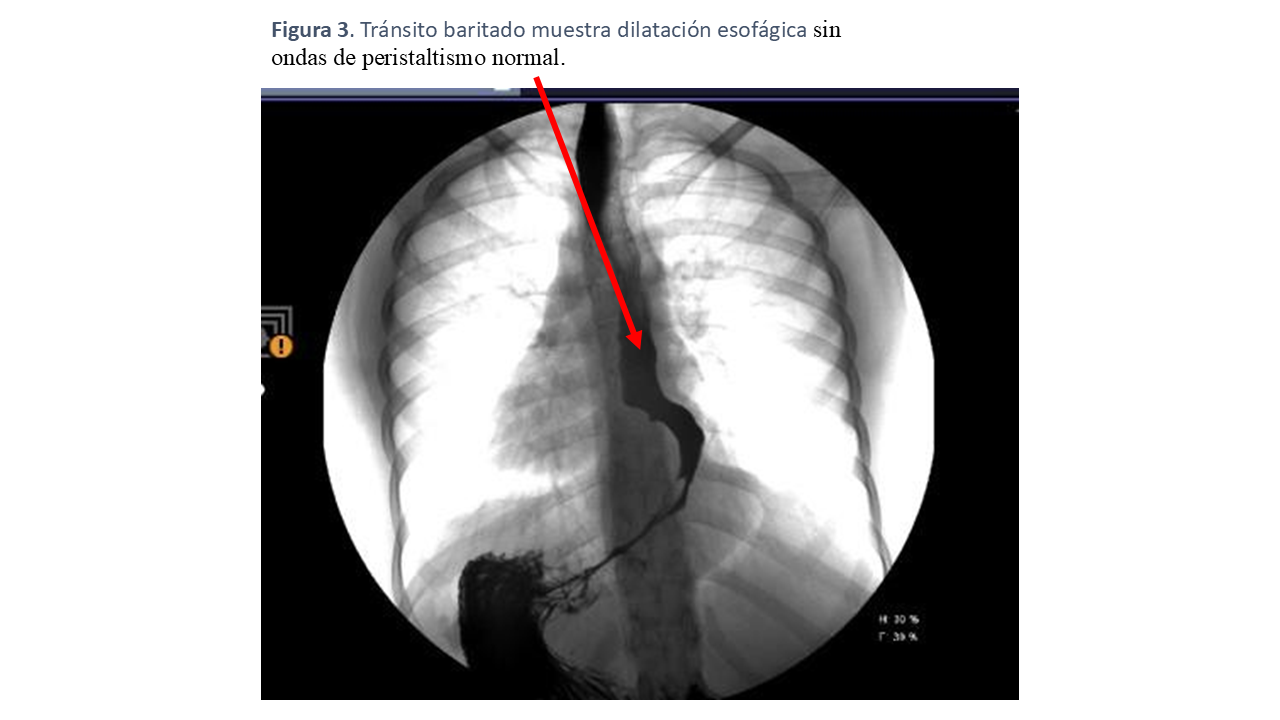
El tránsito baritado confirmó la presencia de un esófago dilatado, sin ondas de peristaltismo normales, evidenciándose solo algunas ondas terciarias. El contraste pasaba lentamente a través del esófago, quedando una cantidad considerable estancada, particularmente en el tercio distal, donde se observaron paredes de márgenes irregulares, lo que podría estar relacionado con una esofagitis previamente identificada en la endoscopia. Tanto en posición bipedestada como en decúbito, el vaciamiento del contenido esofágico era lento (Figura 3).
La paciente fue remitida a la consulta de Cirugía General, donde refirió dolor torácico no irradiado, de varios años de evolución, de corta duración y de resolución espontánea, no relacionado con la ingesta de alimentos. También señaló la necesidad de dormir con el cabecero elevado debido al dolor torácico en decúbito supino. No presentó náuseas ni vómitos y toleraba adecuadamente todas las texturas alimenticias, sin que estos síntomas limitaran su ingesta.
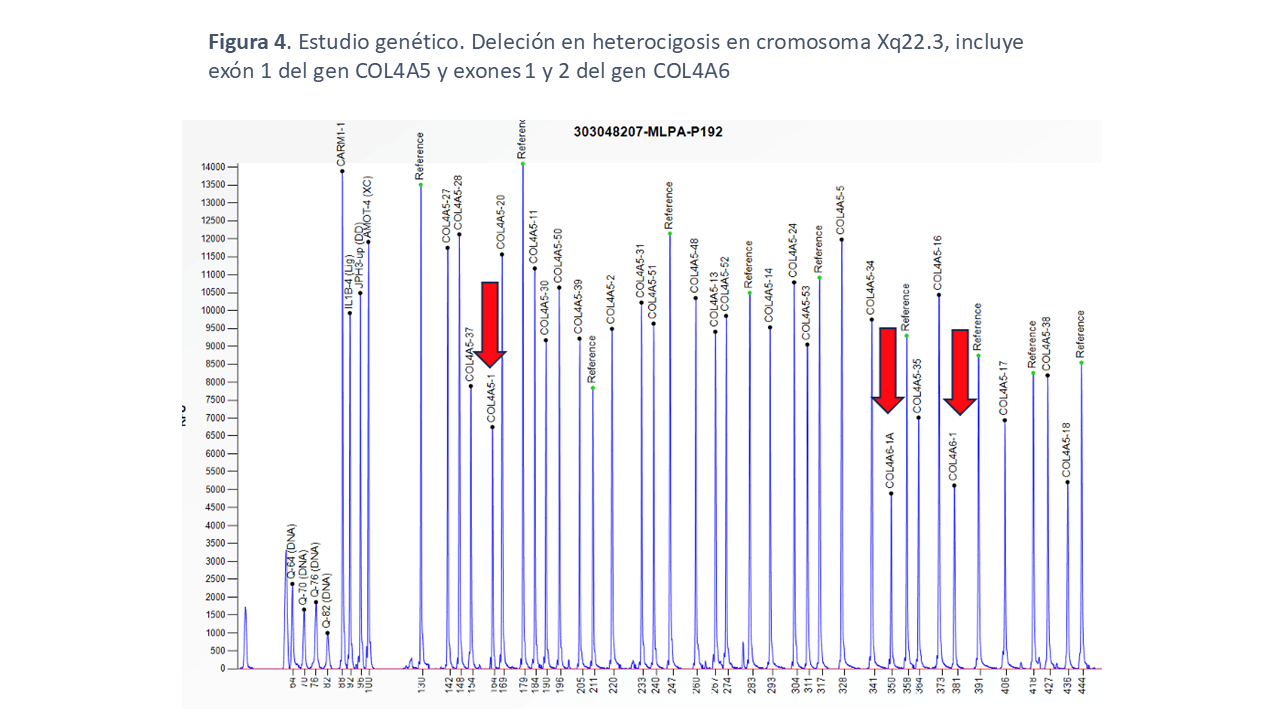
Ante los resultados de la ecoendoscopia y el tránsito baritado, se programó una esofaguectomía. Además, se solicitó un nuevo estudio genético identificando una deleción en heterocigosis en cromosoma Xq22.3, incluye el exón 1 del gen COL4A5 y los exones 1 y 2 del gen COL4A6, compatibles con Síndrome de Alport-Leiomiomatosis (Figura 4). Este hallazgo genético explicó el cuadro clínico y la presencia de la miomatosis esofágica.
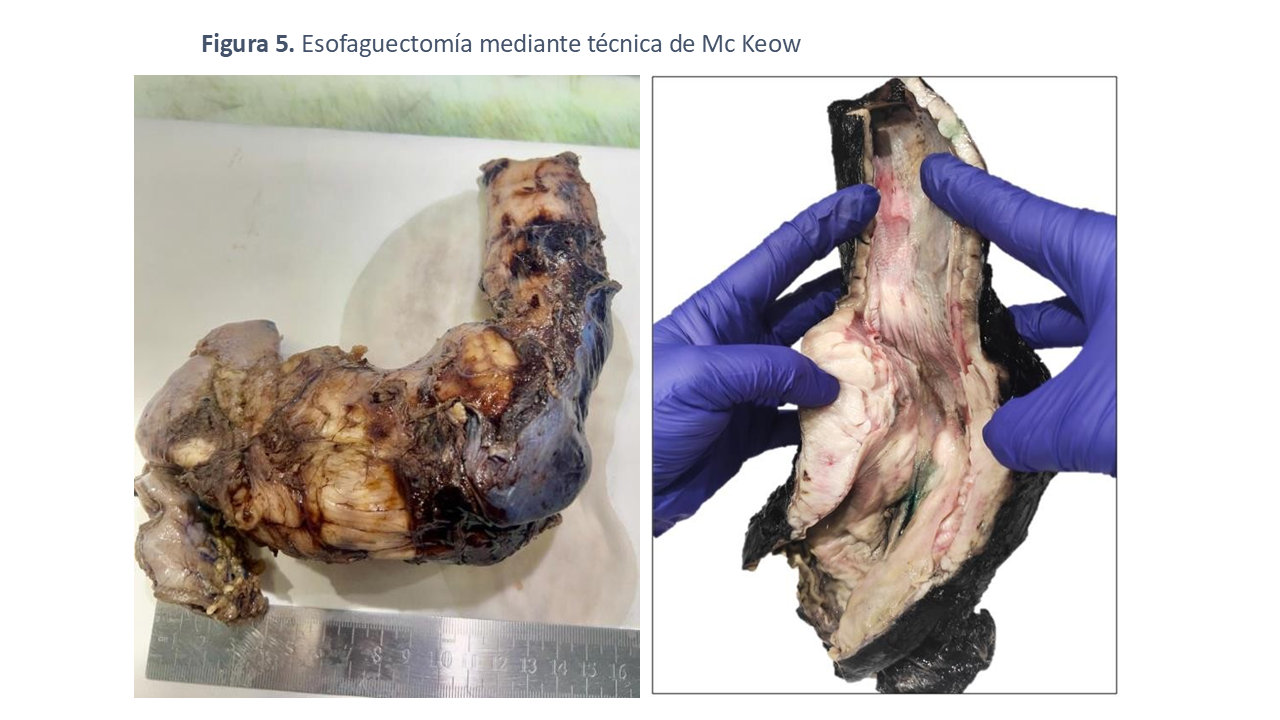
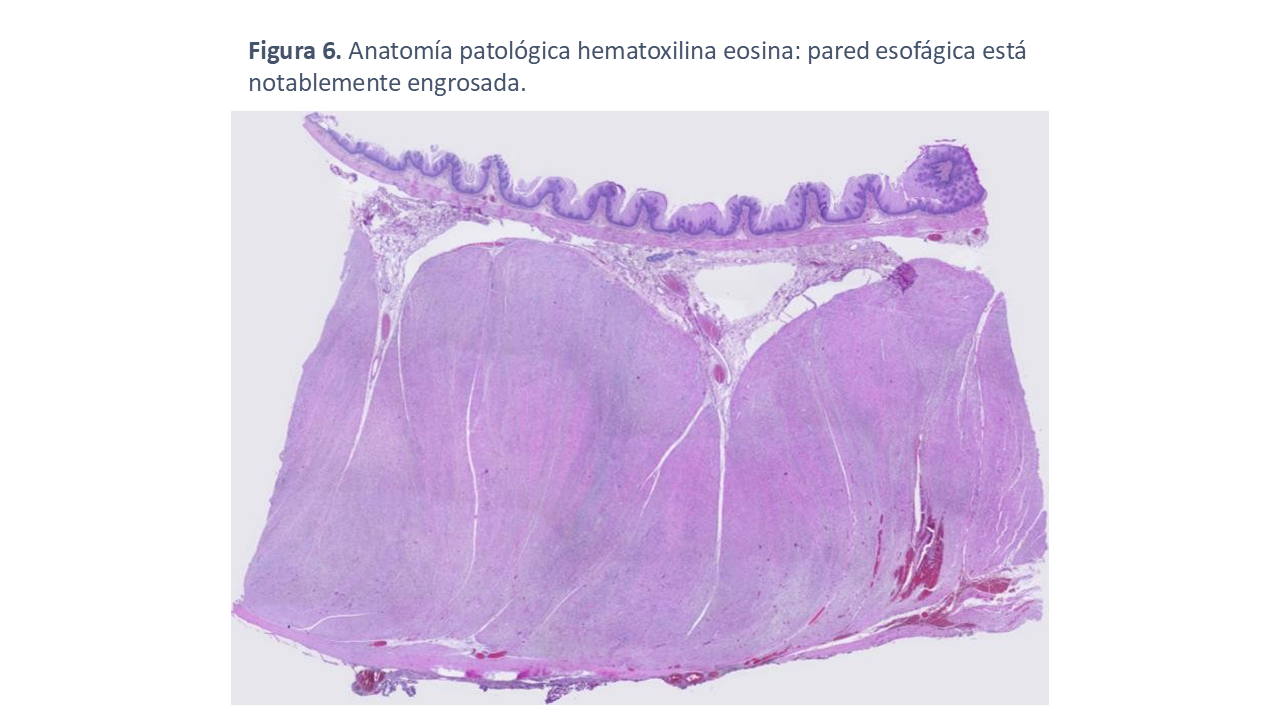
En noviembre de 2023, la paciente fue sometida a una esofaguectomía total mediante técnica de McKeow (Figura 5) sin complicaciones durante el procedimiento. A nivel histológico se observa hiperplasia o hipertrofia de la capa muscular, manteniendose la capa mucosa, submucosa y serosa dentro de los parámetros normales (Figura 6). Posteriormente, se inició un seguimiento multidisciplinario en las consultas externas de Nefrología, Otorrinolaringología, Oftalmología, Cirugía General y nutrición para asegurar un control exhaustivo de su evolución clínica.
Importancia del caso:
La elección de este caso como presentación en la literatura se debe a la singularidad y rareza del síndrome de Alport-Leiomiomatosis y a la importancia de realizar un diagnóstico diferencial exhaustivo en pacientes con hematuria recidivante y síntomas atípicos. Según lo reportado en la literatura, esta variante, predomina en mujeres jóvenes, con inicio de manifestaciones desde la infancia, con presencia de microhematuria y proteinuria además de la presencia de leiomiomas a diferentes niveles (esófago, pulmón, tracto gastrointestinal o genital femenino). En la valoración ginecológica de nuestra paciente también se encontró hipertofia del clítoris como se ha descrito en otras pacientes (6).
Este caso subraya la necesidad de una evaluación integral y multidisciplinaria en pacientes con sospecha de síndrome de Alport, especialmente en aquellos con manifestaciones atípicas, como la leiomiomatosis esofágica, que puede comprometer significativamente su calidad de vida si no es diagnosticada y tratada adecuadamente. La singularidad de este caso radica en la coexistencia de dos entidades clínicas muy poco frecuentes que requieren un enfoque multidisciplinario para mejorar el pronóstico y la calidad de vida de la paciente mediante intervención quirúrgica oportuna.
BIBLIOGRAFÍA
1. Aoyama J, Miyawaki Y, Kato T, Fujiwara N, Sugita H, Sato H, Yasuda M, Sakuramoto S, Yamaguchi S. Alport-leiomyomatosis syndrome requiring subtotal esophagectomy for refractory gastroesophageal reflux disease after childhood partial esophagogastrectomy: a case report. Gen Thorac Cardiovasc Surg. 2020 Feb;68(2):199-203. doi: 10.1007/s11748-019-01255-8. Epub 2019 Nov 22. PMID: 31758390.
2. Delteil C, Macagno N, Daniel L, D'Journo XB, Guisiano S, Garcia S, Secq V. Léiomyomatose œsophagienne diffuse et syndrome d’Alport : rapport d’un cas [Diffuse esophageal leiomyomatosis and Alport's syndrome: A case report and review of the literature]. Ann Pathol. 2019 Feb;39(1):36-39. French. doi: 10.1016/j.annpat.2018.08.007. Epub 2018 Oct 12. PMID: 30322718.
3. Zhou X, Wang J, Mao J, Ye Q. Clinical Manifestations of Alport Syndrome-Diffuse Leiomyomatosis Patients With Contiguous Gene Deletions in COL4A6 and COL4A5. Front Med (Lausanne). 2021 Oct 27;8:766224. doi: 10.3389/fmed.2021.766224. PMID: 34778325; PMCID: PMC8578185.
4. Aoyama J, Miyawaki Y, Kato T, Fujiwara N, Sugita H, Sato H, Yasuda M, Sakuramoto S, Yamaguchi S. Alport-leiomyomatosis syndrome requiring subtotal esophagectomy for refractory gastroesophageal reflux disease after childhood partial esophagogastrectomy: a case report. Gen Thorac Cardiovasc Surg. 2020 Feb;68(2):199-203. doi: 10.1007/s11748-019-01255-8. Epub 2019 Nov 22. PMID: 31758390.
5. Takeda FR, de Meira Junior JD, Sallum RAA. A case report of esophageal leiomyoma in Alport's syndrome treated with robotic-assisted distal myotomy: A surgical technique to avoid esophagectomy. Int J Surg Case Rep. 2023 Jul;108:108433. doi: 10.1016/j.ijscr.2023.108433. Epub 2023 Jun 21. PMID: 37352772; PMCID: PMC10382766.
6. Anker MC, Arnemann J, Neumann K, Ahrens P, Schmidt H, König R. Alport syndrome with diffuse leiomyomatosis. Am J Med Genet A. 2003 Jun 15;119A(3):381-5. doi: 10.1002/ajmg.a.20019. PMID: 12784310.