Ecografía vascular en el paciente renal
La asociación entre enfermedad renal y enfermedad cardiovascular se ha convertido en una clara realidad. Enfermedades cardiovasculares como la ateroesclerosis o la hipertensión arterial pueden causar enfermedad renal, y a su vez, la enfermedad renal juega un papel importante en el desarrollo de lesiones y enfermedades cardiovasculares. Los pacientes con enfermedad renal crónica se consideran pacientes de alto riesgo para desarrollar enfermedades cardiovasculares, como se ha visto en el estudio NEFRONA, el primer estudio que evalua la prevalencia y evolución de la ateromatosis subclínica en pacientes con enfermedad renal crónica [1]. Los pacientes con enfermedad renal crónica deben ser estudiados y tratados para reducir la incidencia enfermedades cardiovasculares y disminuir por lo tanto la morbimortalidad.
En el presente capítulo, abordaremos el estudio ecográfico de los principales territorios vasculares en el manejo del paciente nefrológico: la aorta abdominal, la arteria carótida, la arteria femoral y la vena cava inferior.
Ecografía de la aorta abdominal
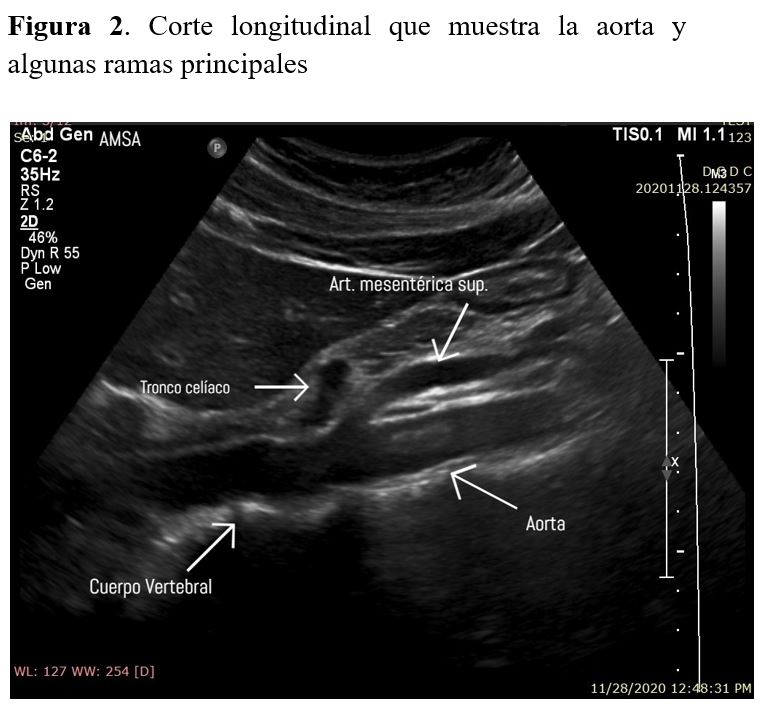
La aorta abdominal comienza a la altura del diafragma a nivel de la undécima o duodécima vertebra dorsal y discurre inmediatamente por detrás del peritoneo y delante de la columna vertebral. En su descenso, se desvía ligeramente a la izquierda de la línea media hasta la altura de la cuarta vértebra lumbar donde se divide en dos arterias ilíacas comunes. A lo largo de su trayecto, va emitiendo ramas que pueden ser identificadas fácilmente en la ecografía como el eje celiaco y la arteria mesentérica, dichas arterias pueden ser usadas como puntos de referencia para determinar las localizaciones patológicas en la aorta. A la derecha de la aorta abdominal, discurre la vena cava que tiene aspecto aplanado en comparación con el aspecto circular de la aorta [2].
Indicaciones para el estudio ecográfico de la aorta abdominal
Indicaciones generales
- Masa abdominal pulsátil
- Dolor en la línea media abdominal
- Alteración de la circulación en los miembros inferiores
- Traumatismo abdominal reciente
- Sospecha de aortitis idiopática
- Screening en pacientes de alto riesgo cardiovascular
- Seguimiento de patología aortica conocida
Indicaciones en nefrología
- Poliquistosis renal autosómica dominante del adulto
- Sospecha de nefropatía isquémica y/o HTA vásculo-renal
Consideraciones para el estudio
- El paciente debe estar en ayunas si es posible.
- El paciente debe estar en decúbito supino con la cabeza apoyada, y en caso de dolor abdominal con las piernas semiflexionadas
- Se debe utilizar transductor convexo de baja frecuencia (2-6 MHz).
Técnica del estudio
Colocar el transductor en la línea media abdominal. El marcador de la sonda debe estar apuntando hacia la cabeza del paciente en los cortes longitudinales, y hacia el lado derecho del paciente en los cortes transversales. Se debe ejercer una presión adecuada para obtener un buen contacto entre la sonda y la superficie corporal, en algunos casos es necesario desplazar el gas intestinal para mejorar la visualización. Las mediciones deben hacerse desde la porción más externa de la pared de la aorta para evitar discrepancias. En pacientes obesos o con mucho gas intestinal, puede ser de ayuda la modificación del ángulo del transductor o la colocación del paciente en decúbito lateral izquierdo [3].
Ecografía de la aorta abdominal normal
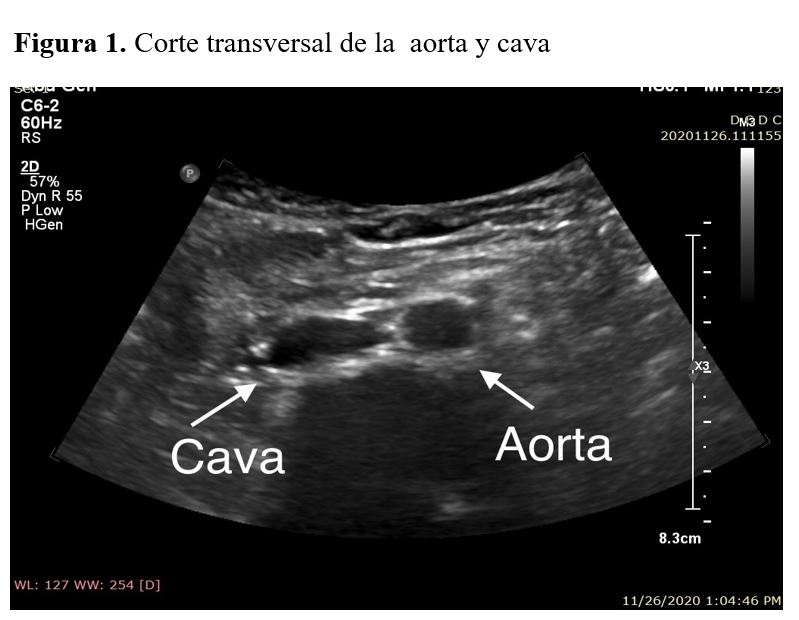
En el corte transversal se toma como referencia el cuerpo vertebral, que aparecerá como una estructura hiperecogénica con sombra acústica posterior. Pegado al cuerpo vertebral se encuentra la aorta, pulsátil y circular y a la derecha de la misma, se puede visualizar la vena cava inferior.
Una vez localizada la aorta en el corte transversal, se debe girar la sonda 90 grados dirigiendo el marcador hacia la cabeza del paciente, para obtener un corte longitudinal. Es preciso asegurarse de que se está cortando la aorta en su diámetro máximo para evitar mediciones discrepantes.
La aorta debe medir menos de 2,5 cm en su diámetro máximo a nivel del ángulo xifoideo. A lo largo de su trayecto, la aorta se hace más estrecha a nivel caudal, teniendo un diámetro máximo de 1,5 cm antes de su bifurcación en las arterias ilíacas comunes [3][4].
Se debe comprobar que la medición en el corte transversal coincide con la medición del corte longitudinal (Figura 1) (Figura 2).
Ecografía de la patología aórtica abdominal
Desplazamiento aórtico: La aorta puede estar desplazada por la presencia de masas retroperitoneales, ganglios linfáticos o simplemente por una morfología anómala de la columna vertebral [5].
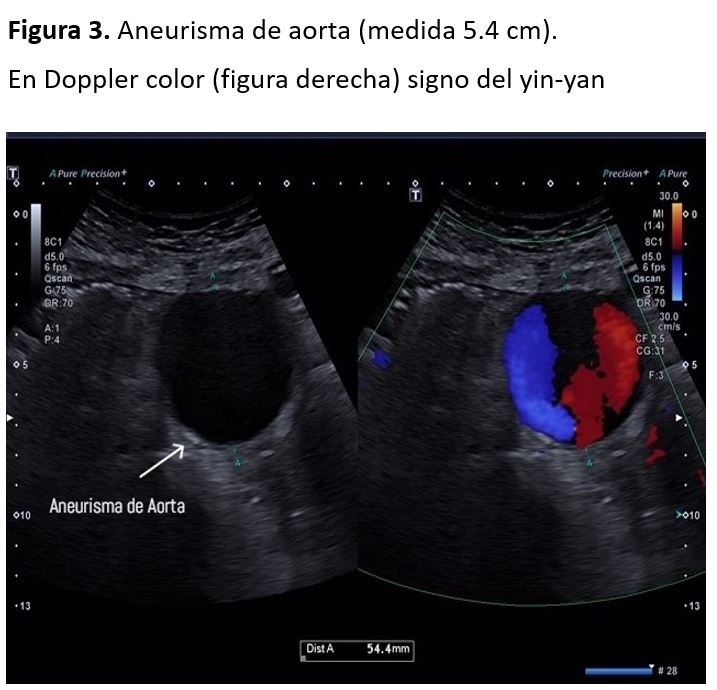
Aneurismas aórticos: Un aneurisma es una dilatación de la pared de la arteria en forma sacular o, más frecuentemente, fusiforme. La dilatación se produce generalmente en la zona más débil de la pared. Aunque pueden desarrollarse en cualquier otro punto de la pared arterial, el 75% aparece en la aorta abdominal, más frecuentemente a nivel infrarrenal.
Un diámetro aórtico mayor o igual a 3 cm e ilíaco mayor de 1,5 cm, se considera aneurisma.
El examinador debe valorar el diámetro máximo de la aorta, la forma y posición del aneurisma, la extensión hacia la bifurcación de la aorta a ilíacas y la presencia o no de trombos [3][4][5]. Además, con el Doppler color podemos ver el característico signo del yin-yan en el segmento aneurismático (Figura 3).
Disección aortica: Es más frecuente en la aorta torácica, pero puede producirse a cualquier otro nivel aórtico. En la ecografía, se visualiza la presencia del colgajo que divide la aorta en dos luces, la verdadera y la falsa. Esta última debe tener un movimiento paradójico, además de existir diferencias en el doppler color entre el flujo del lumen verdadero y el lumen falso.
Estrechamiento aórtico: El diámetro de la aorta abdominal puede estar disminuido por la presencia de calcificaciones ateromatosas a lo largo de todo su trayecto, puede afectar a la bifurcación y a las arterias ilíacas [5].
Ecografía de la arteria carótida
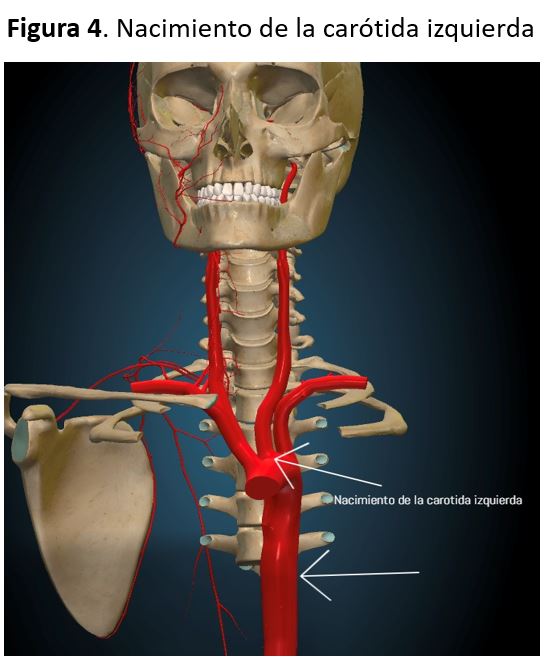
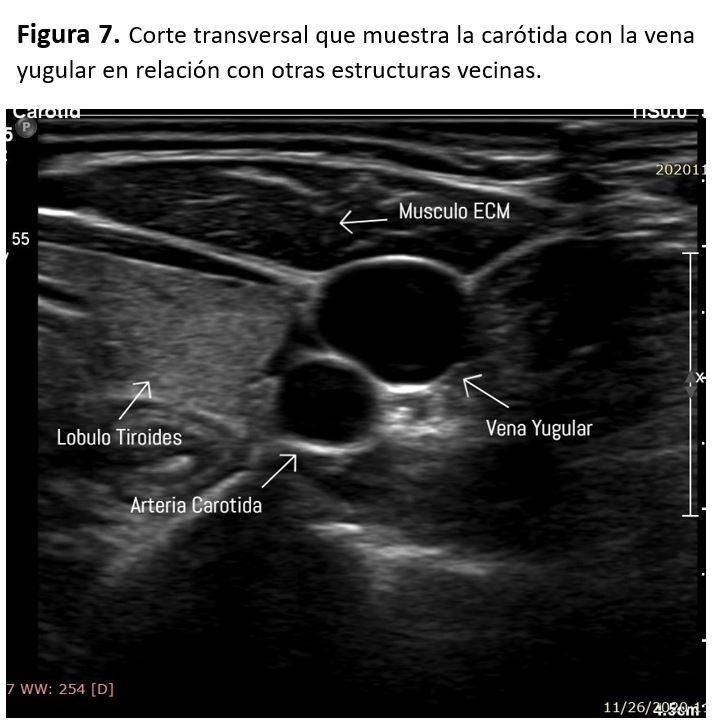
La carótida común entra en la base del cuello por detrás del músculo esternocleidomastoideo y posterior a la articulación esternoclavicular, subiendo por el cuello medial a la vena yugular interna. La bifurcación carotidea suele estar a nivel del borde superior del cartílago tiroideo, a unos 1,5 cm debajo del ángulo mandibular. La carótida externa irriga las estructuras superficiales de la cabeza y cara originando varias ramas y terminando en la rama maxilar y temporal superficial. La carótida interna asciende por el cuello, penetra a través del canal carotideo en la base del cráneo, anterior a la vena yugular. La arteria carótida común derecha nace en la base del cuello a partir de la bifurcación del tronco braquiocefálico, mientras que la izquierda nace del cayado de la aorta. Por este motivo, la carótida común izquierda tiene un trayecto más largo en el tórax, midiendo aproximadamente 3 cm [6] (Figura 4) (Figura 5).
La ecografía de la arteria carotidea permite:
- Estudiar la pared arterial y medir el espesor de la íntima media en estudios de prevención
- Valorar la gravedad de la estenosis
- Valorar la morfología de una placa
Indicaciones para estudio de la carótida:
- Pacientes asintomáticos con signos patológicos en la exploración física (soplos)
- Pacientes sintomáticos con patología vascular establecida
- Pacientes con síntomas no específicos de patología vascular
- Pacientes con alto riesgo cardiovascular (p. ej enfermedad renal crónica)
- Estudio preoperatorio en cirugía cardiovascular
- Estudio pretrasplante en paciente con alto riesgo CV, clínica o exploración física compatible
- Estudios de prevención cardiovascular
- Pacientes en los que se sospecha posible progresión de una obstrucción carotídea
Consideraciones para el estudio
Se debe colocar al paciente en decúbito supino, con el explorador por detrás de su cabeza o bien a su lado. Se utilizará un transductor lineal de alta frecuencia de 7 MHz, de amplio espectro o multifrecuencia (de 5 a 12 MHz ó 3 a 11 MHz). En pacientes con dificultad técnica (cuellos cortos u obesos), se puede, excepcionalmente, emplear un transductor convexo (< 7MHz).
Técnica del estudio:
El cuello del paciente debe estar ligeramente hiperextendido y su cabeza girada hacia el lado opuesto al de la exploración formando un ángulo aproximado de 45°. Para una mejor visualización de la imagen, el transductor se desplaza desde la base del cuello hasta el ángulo mandibular de forma transversal al vaso y posteriormente, se gira unos 90° para obtener el plano longitudinal.
Ecografía carotídea normal
Comenzaremos, como siempre, realizando una ecografía modo B. Posteriormente haremos un Doppler color y un Doppler pulsado para el estudio de las velocidades y de la morfología del registro espectral.
En modo B, se debe explorar la arteria carótida común (ACC) en sección transversal, empezando en la base del cuello. La carótida derecha puede visualizarse desde su origen en el tronco braquiocefálico, el origen de la carótida izquierda en cambio no suele visualizarse debido a su profundidad en el tórax.
La ACC debe examinarse en toda su longitud, en sección transversal, hasta la bifurcación y seguir explorando la carótida interna y externa.
La vena yugular está situada por delante de la ACC y suele comprimirse con facilidad. Sin embargo, no se debe aplicar demasiada presión sobre la carótida durante la exploración porque podría desprenderse un émbolo de la pared del vaso.
Posteriormente se explora la ACC en plano longitudinal con el modo B, empezando en la base del cuello. Para obtener fácilmente la imagen longitudinal de la ACC, en primer lugar, se debe identificar en sección transversal. A continuación, manteniéndola en el centro de la imagen, se gira el transductor para que aparezca primero como una elipse y finalmente en plano longitudinal.
La carótida interna (ACI) es posterolateral o lateral a la carótida externa (ACE) y suele ser de mayor tamaño. En algunos casos la bifurcación tiene forma de diapasón, pero en la mayoría de los casos, las dos arterias no se visualizan en el mismo plano y deben ser exploradas individualmente.
Una vez realizado el estudio en modo B, puede usarse la imagen del Doppler (color y pulsado) para el estudio de la ACC desde su origen hasta la bifurcación, la ACI y la ACE.
El Doppler color puede revelar signos de patología arterial, como cambios en la velocidad o aliasing por la presencia de estenosis, zonas de falta de llenado por la presencia de placas de ateroma, o ausencia de flujo por oclusión.
El Doppler pulsado, mediante el análisis de la morfología onda en el registro espectral proporciona información sobre la presencia de patología proximal o distal como una oclusión o estenosis.
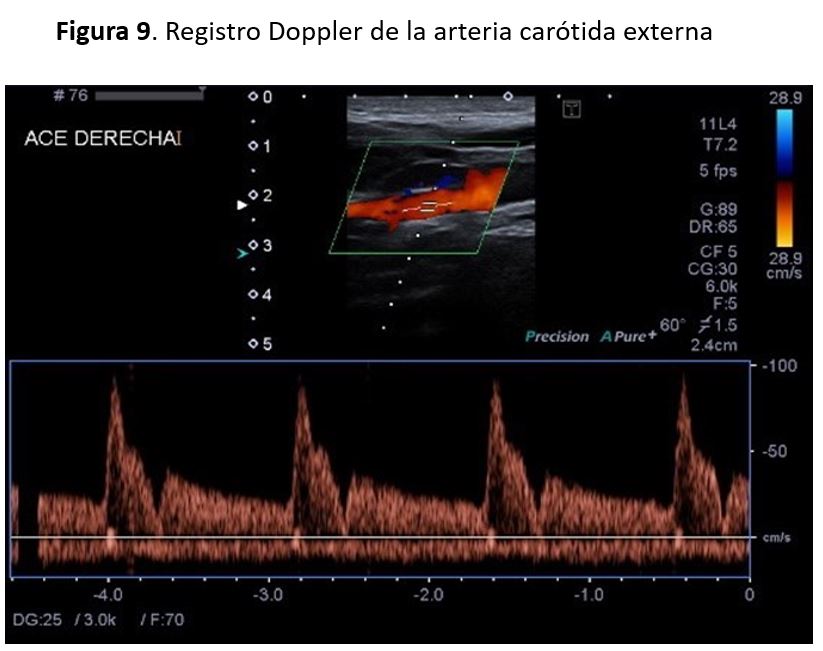
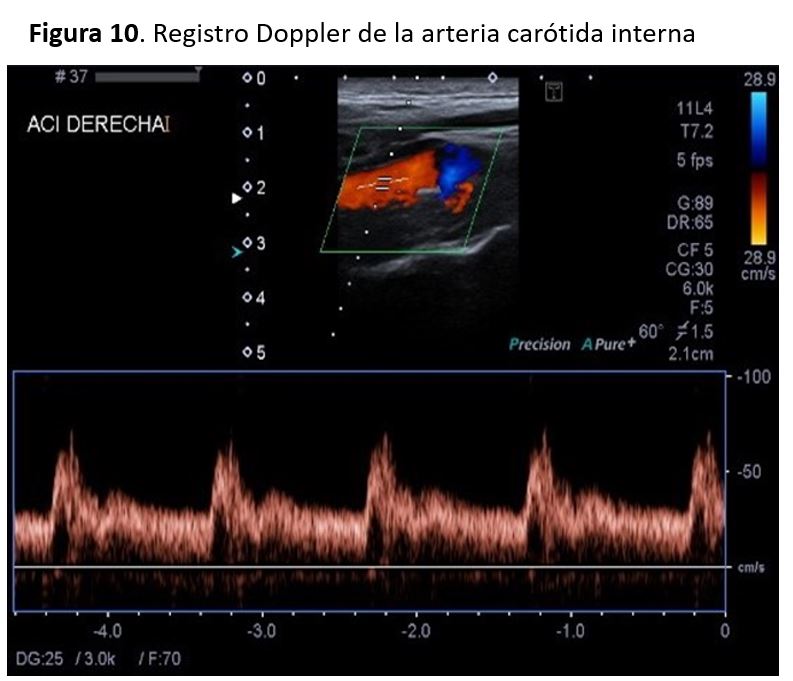
Con el doppler espectral podemos distinguir la ACI y la ACE, ya que la forma de onda de la ACI es más débil y tiene un flujo diastólico más alto que la ACE.
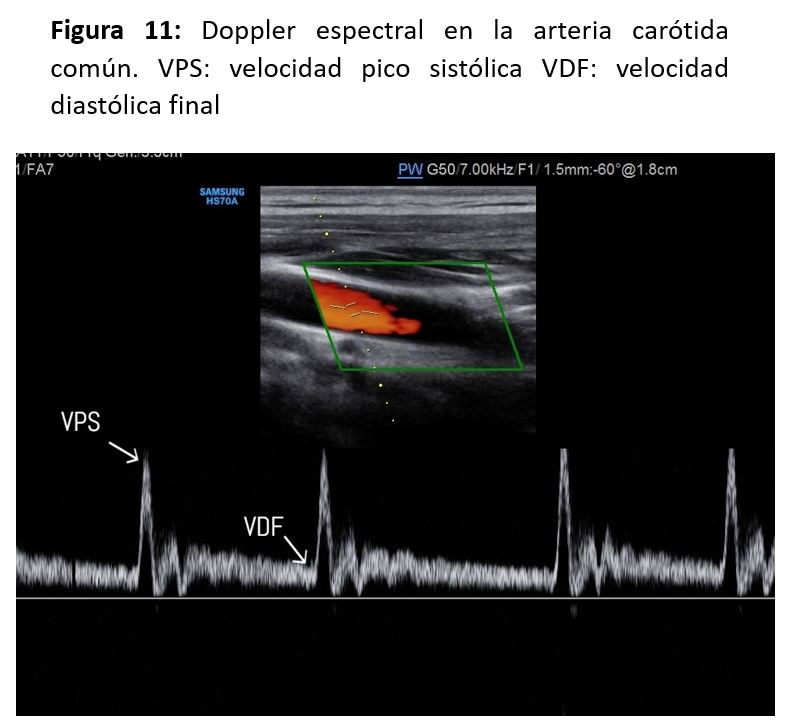
Además, con doppler espectral podemos medir la velocidad sistólica máxima (VSM), también llamada velocidad pico sistólica (VPS) y la velocidad diastólica final (VDF) en la ACC, la ACI y la ACE, y también en el lugar del máximo incremento de velocidad en una estenosis, pudiendo clasificar así el grado de estenosis.
La VSM y VDF deben medirse en la carótida común a 1-2 cm por debajo de la bifurcación, y en el punto de velocidad máxima en una estenosis de la carótida interna. Si no se detecta ninguna estenosis en la ACI, la VSM y la VDF deben medirse en la ACI justo después del bulbo carotideo. Las mediciones de velocidad y los cocientes obtenidos de las mismas pueden usarse para clasificar el grado de estenosis en la bifurcación [6][7][8].
Ecografía de la arteria carótida normal
Imagen modo B
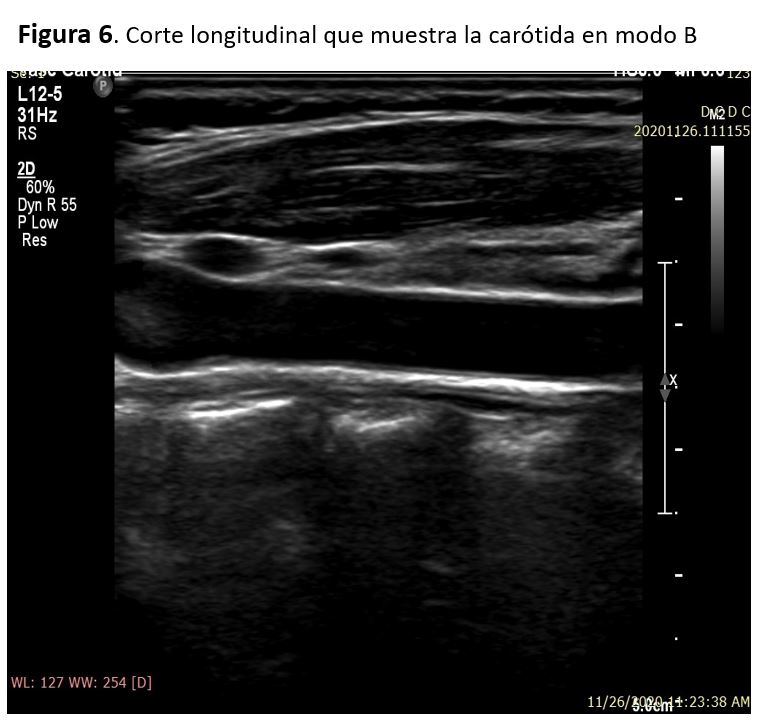
Las paredes de la carótida normal aparecen como una estructura de doble capa en sección longitudinal. Las dos capas representan la capa íntima-media y la adventicia, y se ve con más claridad en la pared posterior de la arteria carótida común. El grosor normal de la capa íntima media por ecografía es de 0,5-0,9 mm. La luz de un vaso normal debe ser anecogénica, la presencia de ecos en su interior puede indicar imagen patológica (una vez ajustada la ganancia) [6] (Figura 6)(Figura 7).
Imagen Doppler Color
El flujo arterial normal es pulsátil y anterógrado durante todo el ciclo cardíaco.
El color debería llenar continuamente la luz del vaso hasta las paredes, y la VSM debería representarse con un color próximo al máximo en la escala de color.
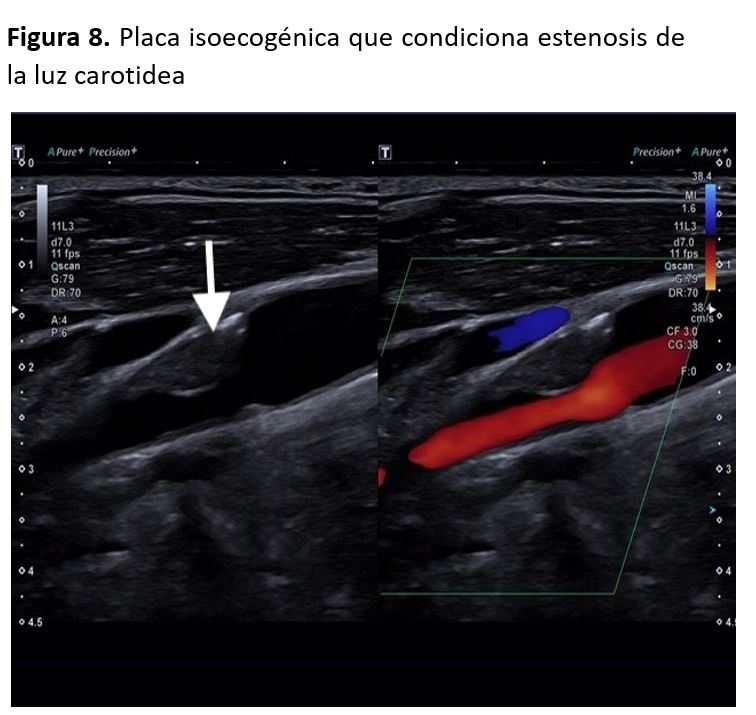
El déficit de llenado de color hasta las paredes del vaso puede indicar la presencia de ateromatosis que, en caso de no haber sido detectada en el modo B, podría tratarse de una placa de ateroma hipoecogénica. Sin embargo, es importante asegurarse de que los defectos de llenado no se deban a una mala posición durante la exploración o ajustes inadecuados en los parámetros, como por ejemplo una frecuencia de repetición de pulsos (FRP, en inglés PRF) inadecuadamente alta.
Además, la presencia de estenosis puede alterar la imagen en color, debido al aumento de la velocidad del flujo, apareciendo el fenómeno de turbulencia o aliasing con mezcla de colores. Esto ayuda a localizar con más facilidad el segmento afectado de la arteria.
La completa ausencia del color podría indicar oclusión del vaso, pero se debe descartar la presencia de una estenosis muy severa en algún punto del vaso. Si la falta de llenado ocurre durante la diástole, podría indicar alta resistencia distal al punto del estudio [6][7] (Figura 8).
Doppler espectral
Los registros del doppler espectral en la ACE muestran un patrón de flujo de resistencia más alta en comparación con la ACI, con una forma de onda pulsátil y un flujo diastólico bajo en comparación con la forma de onda de flujo observada en la ACI (Figura 9)(Figura 10). Las velocidades sistólicas máximas observada en la AC depende del tamaño relativo de la arteria, y suelen ser inferiores a 110 cm/s en la AC normal. Se consideran valores normales de la VSM en las carótidas internas cifras inferiores a 125cm/s y de la VDF inferiores a 40cm/s. Existen algunas alteraciones que afectan al sistema cardiovascular y que pueden alterar los patrones de la onda espectral y los valores de velocidades como son el bajo o alto gasto cardiaco, la HTA, las valvulopatías aórticas y las oclusiones carotídeas bilaterales.
La presencia de estenosis en la arteria carotidea genera incremento de la velocidad en el segmento estenosado, y más allá de la estenosis cuando existe una reducción mayor al 50% del diámetro del vaso. El aumento de la velocidad es proporcional al grado de estenosis y los cambios de velocidad pueden usarse para clasificar el grado de estenosis.
Las ondas de alta resistencia con ausencia de flujo durante la diástole obtenidas en la ACC pueden ser debidas a una estenosis severa o una oclusión de la ACI. Una inversión del flujo durante toda la diástole en las AC puede relacionarse con un problema cardíaco, como insuficiencia de la válvula aórtica y suele verse de forma bilateral.
La ausencia total de flujo en un vaso, demostrado por imagen del flujo en color, puede confirmarse por doppler espectral. Sin embargo, pueden aparecer señales de velocidades bajas, o incluso señales erróneas, por la presencia de otros vasos en la zona estudiada.
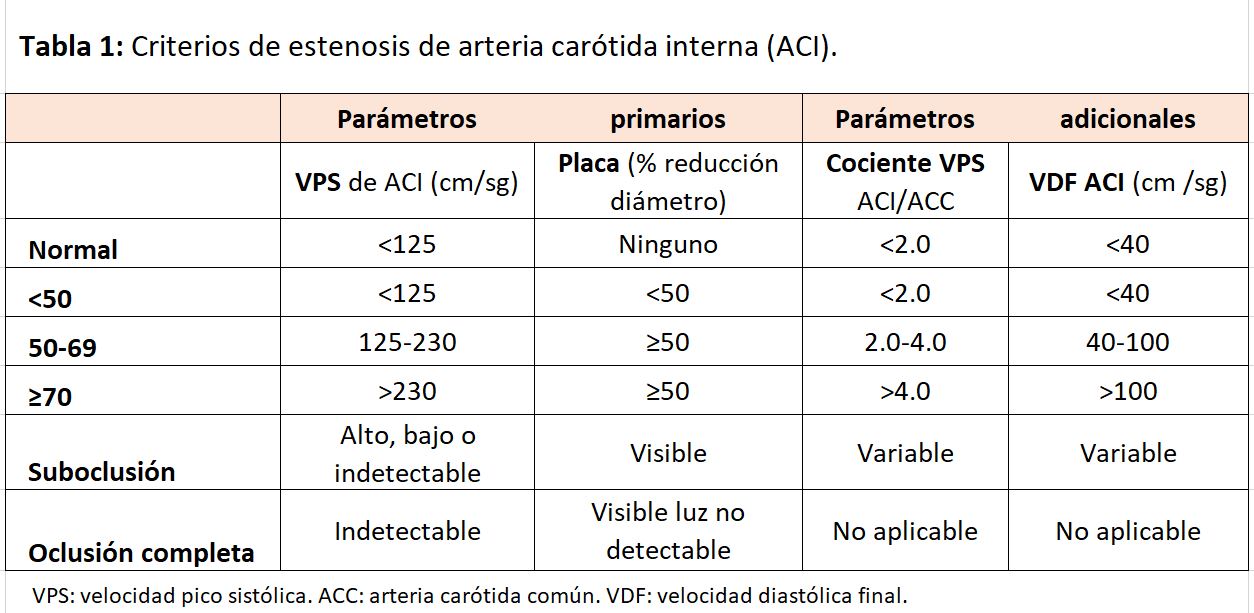
Los criterios para la clasificación de las estenosis carotídeas se basan en la VSM y la VDF en la ACI y en el cociente de la VSM entre la ACI y la ACC (Figura 11). El cociente de la VSM entre la ACI y la ACC depende en parte de las dimensiones de la ACI y la ACC, y esto además se complica por la variable geometría del bulbo carotideo y la presencia de una gran rama como la ACE
El uso combinado de mediciones de velocidad absoluta y cocientes de velocidad evita cometer errores en el cálculo en relación con el uso único de los criterios de velocidad. Por ejemplo, un aumento en la VSM puede deberse a hipertensión o a cambios relacionados con la edad en la distensibilidad de la pared vascular [6][7][8]. En la (Tabla 1), se reflejan los criterios diagnósticos de la estenosis de la ACI con Doppler [9].
Medición del grosor íntima-media (GIM)
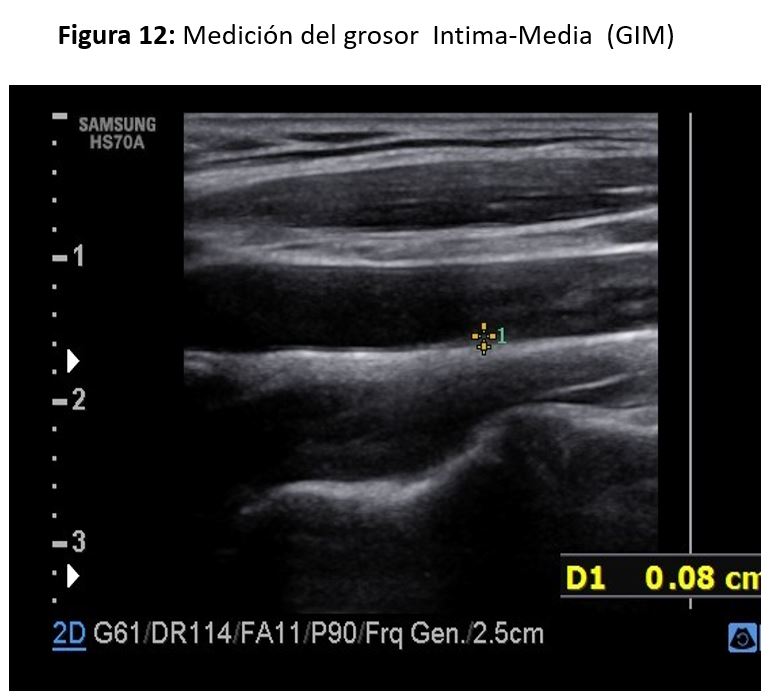
Los valores de espesor íntima-media aumentan con la edad, son mayores en hombres que en mujeres, y lo mismo ocurre en pacientes de raza negra comparados con los de raza blanca. La medición del complejo íntima media puede realizarse de forma automática (software incluido en el equipo de ecografía), o manualmente. Su valor normal se considera de 0,6 a 0,8 mm, entre 0,8 y 1,0 mm se considera indeterminado, y por encima de 1,1 mm es actualmente el valor anormal más aceptado.
La forma más utilizada para determinar el espesor de la íntima-media consiste en medir a lo largo de 1cm en la pared posterior de la carótida ACC, en su segmento distal, a 1 cm de la bifurcación [10] (Figura 12).
Ecografía de la patología de la carótida
Estudio de las placas de la carótida
Las placas de ateroma pueden ser visualizadas con la ecografía en modo B, el estudio de la morfología de las placas ayuda en la predicción de las complicaciones y el pronóstico de los eventos cerebrales independientemente del grado de la estenosis.
Para analizar las morfologías de las placas debemos tener en cuenta las siguientes características:
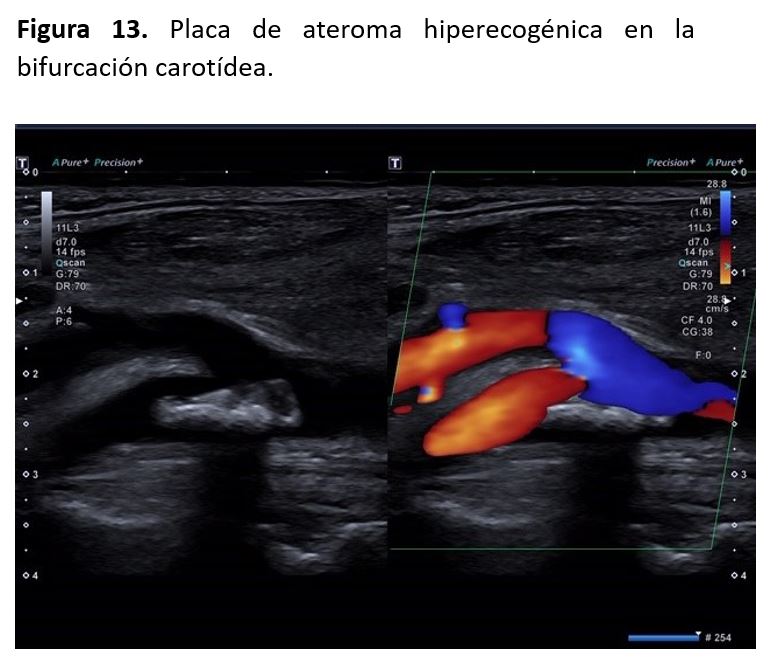
1- Ecogenicidad: las placas anecoicas (placa tipo I) suelen ser inestables. Las de tipo II suelen ser predominantemente hipoecogénicas en más del 50% de su composición. Las de tipo III suelen tener la misma ecogenicidad que la del músculo esternocleidomastoideo, son estables. Las placas de tipo IV son hiperecogénicas y las de tipo V suelen tener una ecogenecidad similar a las vértebras, ya que presentan un componente cálcico.
2- Superficie: las placas pueden ser de superficie regular, irregular o ulceradas. Las ulceradas se asocian a mayor riesgo de eventos vasculares, ya que se consideran embolígenas. Se debe tener en cuenta que el diagnóstico de la presencia de ulceras puede requerir ecografía tridimensional, ya que no es tan sencillo con la ecografía normal.
3- Composición: en base a la imagen ecográfica podemos clasificar las placas en lipídicas (hipoecogénicas), fibrolipídicas (hiperecogénicas), y fibrocálcicas (hiperecogénicas con sombra acústica)
4- Textura: pueden ser homogéneas o heterogéneas [11][12] (Figura 13).
Otras enfermedades de la carótida
Las enfermedades de la carótida que pueden ser estudiadas con la ecografía incluyen los aneurismas, tumores del glomus carotideo y disección arterial, pero son relativamente infrecuentes. La presencia de una masa pulsátil en el cuello puede estudiarse por ecografía para descartar la presencia de un aneurisma.
El glomus carotideo es una pequeña estructura de la pared vascular, situada en la bifurcación carotidea, que se encarga de detectar los gases y el pH en la sangre. Cuando un tumor del glomus carotideo crece adopta una forma muy vascular en el doppler color.
La disección de la carótida, que puede ser causada por traumatismos como un latigazo cervical, puede crear una falsa luz en las arterias carótidas [13].
Ecografía de las arterias femorales
Las placas de ateroma de las arterias femorales son muy frecuentes, incluso pueden aparecer en pacientes sin placas carotídeas; por lo tanto, el estudio ecográfico femoral también debe realizarse para una correcta evaluación del riesgo cardiovascular [1].
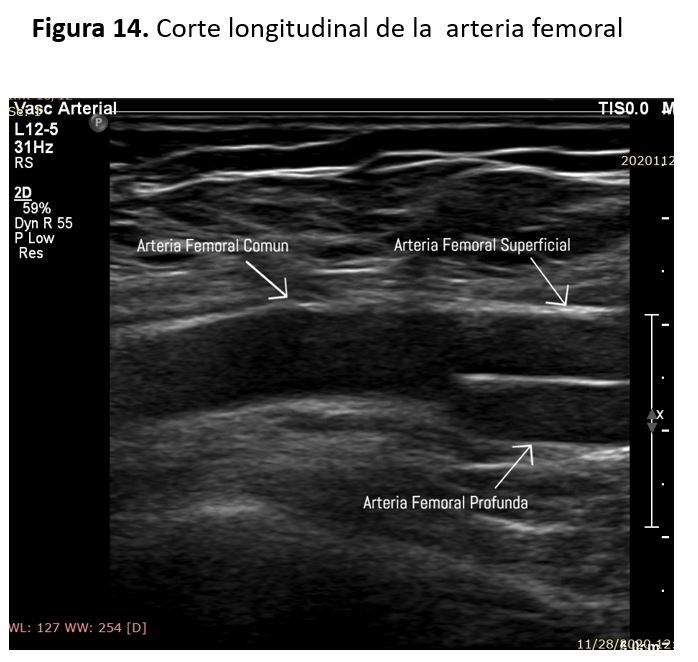
La aorta da origen a las arterias ilíacas comunes que a su vez se dividen en las arterias iliacas externas e internas. La arteria ilíaca externa da origen a la arteria ilíaca circunfleja profunda y a la arteria epigástrica inferior, antes de convertirse en la arteria femoral común (AFC) a nivel del ligamento inguinal (Figura 14).
La arteria femoral común se divide en la arteria femoral profunda (AFP) y la arteria femoral superficial (AFS) en la ingle. La AFP discurre posterolateralmente a la AFS e irriga los músculos y tejidos del muslo. De la AFP salen las arterias circunflejas medial y lateral inmediatamente después de su origen.
La AFS continua medial descendente a lo largo del muslo, y se convierte en la arteria poplítea en el canal aductor, por encima de la rodilla [14].
Consideraciones para el estudio
No se precisa preparación previa para estudiar las arterias femorales, aunque algunos protocolos pueden recomendar preparación intestinal para el estudio de la aorta abdominal y las ilíacas, puesto que la presencia de gas intestinal puede dificultar la obtención de imágenes.
Es imprescindible conocer la anatomía de las arterias y las venas en la ingle y ser capaces de identificar las ramas principales y las bifurcaciones.
Durante el estudio es preciso poder:
- Localizar los lugares de estenosis y valorara su gravedad
- Detectar lesiones en múltiples niveles y, cuando sea posible, identificar las más significativas desde el punto de vista hemodinámico
- Diferenciar las estenosis de las oclusiones
- Identificar la presencia y localización de los aneurismas, calcificaciones, trombos
El transductor recomendado para la exploración de las arterias femorales es un transductor lineal de gama media de frecuencia.
Se debería hacer el estudio con imagen en modo B, imagen de flujo color y determinaciones de doppler espectral [14][15].
Técnica del estudio:
Se coloca al paciente en decúbito supino, con los brazos a los lados y manteniendo relajada la musculatura abdominal.
Se inicia la exploración evaluando la AFC en la ingle, puesto que los patrones de flujo sanguíneo observados a este nivel aportan información acerca del estado de las arterias más proximales como las ilíacas o incluso la aorta.
En primer lugar se identifica la AFC a nivel de la ingle en un plano transversal, donde se encuentra lateralmente la vena femoral común. A continuación se sigue la AFC en sentido proximal en un plano longitudinal hasta que pase debajo del ligamento inguinal. En caso de querer explorar la sección aortoilíaca, se debe emplear un transductor convexo para obtener una mejor imagen [14].
Ecografía de la arteria femoral normal
La luz de una arteria debería aparecer bien definida y las paredes deberían ser uniformes a lo largo de cada uno de los segmentos estudiados. En la arteria femoral normal en ocasiones se ve la capa íntima-media de la pared arterial.
Ecografía de la patología arterial femoral
En el interior de la arteria se pueden identificar las áreas de ateroma, especialmente si están calcificadas. La ateromatosis puede verse extensa y con una distribución difusa, especialmente en la AFS. Las grandes placas de ateroma son más fáciles de identificar en la bifurcación de la arteria femoral común, suelen adquirir un aspecto de «coliflor» y localizarse en la pared posterior.
Las oclusiones agudas de la arteria femoral pueden identificarse en el estudio en modo B en combinación con el doppler color donde pueden visualizarse trombos o defectos de llenado.
La estenosis arterial se muestra como áreas de alteración del flujo color y las formas severas producen un patrón de flujo alterado, esto debe confirmarse con el doppler espectral. La velocidad sistólica máxima en sujetos normales en la arteria femoral superficial normal suele ser de unos 90 cm/s. Las mediciones se realizan proximal al segmento estudiado, en el segmento y distal al segmento.
En las dilataciones aneurismáticas, la velocidad máxima sistólica aparece reducida y se observan alteraciones del patrón de flujo. Las dilataciones anormales o los aneurismas arteriales son fáciles de identificar y medir con la imagen en modo B [14].
Ecografía de la vena cava inferior (VCI)
La VCI recoge la sangre de todas las venas inferior al diafragma y la lleva a la aurícula derecha. Asciende por el abdomen por delante de la columna vertebral, a la derecha de la aorta abdominal y por detrás del hígado.
Indicaciones para estudio de la vena cava inferior
- Dilatación inexplicada de las venas de las extremidades inferior con/sin signos de flebitis
- Embolias pulmonares
- Tumor renal: descartar trombosis de la vena renal y/o cava
- Estado de hidratación del paciente y presión venosa central
Técnica del estudio
El paciente debe estar en ayunas, aunque evitando la deshidratación para lo que podrá ingerir agua. El paciente debe estar en decúbito supino.
Para el examen se utiliza un transductor convexo de baja frecuencia y se hace normalmente en sentido longitudinal y transversal. Si la presencia de gas intestinal impide obtener una buena imagen, se pueden realizar proyecciones oblicuas o laterales para mejorar la visualización.
El transductor se debe colocar con el marcador hacia la cabeza del paciente y ligeramente angulado para visualizar el trayecto de la VCI y su entrada en la aurícula derecha.
La VCI aparece como una estructura tubular a la derecha de la aorta, y realizando la maniobra de Valsalva, la vena cava se distiende y puede verse con más claridad.
Ecografía de la vena cava inferior normal
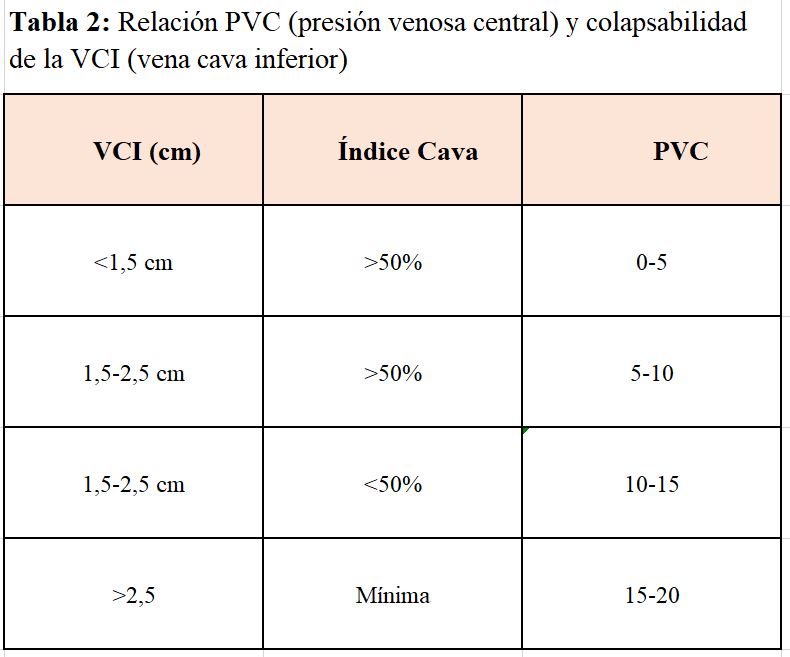
Hay una relación directa entre la medida de la VCI y el índice cava (IC) con la presión venosa central. Varios estudios han demostrado que el diámetro de la vena cava está disminuido y el índice de colapsabilidad (IC) está aumentado en pacientes con depleción de volumen. Estos dos parámetros aportan información sobre la presión venosa central con fiabilidad del 80-90% (Tabla 2).
El IC se calcula midiendo el diámetro máximo espiratorio (VCIe) y el mínimo inspiratorio (VCIi) en un ciclo respiratorio normal de un segundo de duración y a 2 cm de la desembocadura de la cava en la auricular derecha.
El IC se calcula mediante la siguiente fórmula:
IC = (VCIe-VCIi) x 100/VCIe [16][17][18].
Estudio ecográfico arterial y venoso antes de los procedimientos intervencionistas
El estudio morfológico de los vasos cuando se realiza el intervencionismo en nefrología es muy importante, puesto que existen variantes anatómicas notables. Su previo reconocimiento ayuda a evitar serias complicaciones durante los procedimientos.
Además, resulta de gran utilidad descartar la presencia de patología vascular como malformaciones o la presencia de complicaciones como la trombosis y la oclusión.
El estudio de la vena yugular previo al intervencionismo facilita la identificación de la vena y el reconocimiento de las posibles variantes de ubicación en relación a la arteria carótida. Existen localizaciones alternativas a la más frecuente, lateral a la carótida, pudiendo encontrarse medial, anterior, antero lateral, posterior o posteromedial a la carótida. La comprobación de la permeabilidad y el adecuado diámetro de la vena también es importante para garantizar el éxito del procedimiento.