Ecografía de Masas Renales: Quistes, Angiomiolipoma, Esclerosis Tuberosa, Carcinoma renal
Palabras clave
Quistes renales, angiomiolipoma, esclerosis tuberosa, carcinoma de células renales, carcinoma renal, carcinoma urotelial, Oncocitoma
1. INTRODUCCIÓN
Las masas renales son un hallazgo frecuente en los estudios ecográficos. La tipificación lo más precisa posible de las masas renales es imprescindible para poder realizar un correcto diagnóstico diferencial. Mediante la ecografía podremos diferenciar una masa quística (potencialmente benigna) de una masa sólida (potencialmente maligna) [1]. Además de la ecografía bidimensional nos podemos apoyar en el Doppler e incluso en la ecografía con ecopotenciadores (CEUS), también llamada ecografía con contraste, si fuera necesario.
Es preciso saber que:
* Mediante la ecografía no podremos diferenciar con seguridad lesiones sólidas malignas de benignas, ni entre los diferentes tipos de neoplasias epiteliales [2], por lo que se necesitarán estudios complementarios.
* Con la ecografía no podremos realizar el estadiaje del cáncer renal.
* La American College of Radiology (ACR) en sus guías de 2014, recomienda el uso de la ecografía y el Doppler renal para el estudio de masas renales indeterminadas (masas con 20-70 UH en TAC sin contraste o mayor de 20 UH TAC monofásico con contraste) con un grado de recomendación 8 (rango: 1-9) [3], sólo superado por la TAC o RMN cuando se pueda administrar contraste yodado o paramagnético, respectivamente. La unidad Hounsfield (UH) es el número asignado a cada pixel en la imagen final de una tomografía computarizada (TC) y es la expresión de la densidad del objeto irradiado.
En este capítulo revisaremos las características ecográficas de masas renales más frecuentes, tanto benignas (quistes, angiomiolipomas) como malignas (carcinoma renal).
2.-MASAS RENALES BENIGNAS
Las masas renales benignas más frecuentes son los quistes simples y los angiomiolipomas. Los quistes ya fueron desarrollados en el capítulo titulado “Ecografía en la Enfermedad Renal” al que remitimos al lector para un repaso más exhaustivo.
QUISTES RENALES
Véase ENFERMEDADES RENALES QUÍSTICAS NO HEREDITARIAS. NEFROLOGIA AL DÍA
Se trata de masas anecoicas, redondeadas y bien definidas que presentan refuerzo acústico posterior debido a la interfase entre el contenido líquido de su interior y el órgano sólido. Su tamaño es variable y no suelen complicarse, aunque aquellos de gran tamaño pueden romperse y presentar sangrado. Pueden ser simples (anecoicos y sin tabiques) o de complejidad variable, estipulando su potencial malignidad siguiendo la clasificación de Bosniak. Esta clasificación divide las lesiones quísticas en 5 subtipos, requiriendo otras pruebas diagnósticas a partir de Bosniak 2F (quiste con numerosos tabiques finos que pueden presentar realce o circulación de burbujas, discreto engrosamiento de un tabique o de la pared; también incluye los quistes hiperdensos en TC > 3 cm) para descartar posibles carcinomas renales.
ANGIOMIOLIPOMA
Epidemiología y tipos
Los angiomiolipomas (AML) son tumores de células epiteloides perivasculares conocidos también como PEComas (“perivascular epithelioid cell”) [4]. Están compuestos por porciones variables de vasos sanguíneos, células musculares lisas y adipocitos.
El AML es el tumor benigno más frecuente de las masas sólidas del riñón y representa el 1-3 % de los tumores renales [5].
La mayoría de los AMLs diagnosticados son esporádicos (80%), suelen ser unilaterales y de pequeño tamaño. Se descubren casualmente en el curso de un estudio por imagen (ecografía, TAC o RMN) y son identificados sobre todo en adultos, con una media de edad de 45 años y una predilección en mujeres (4:1) [6] [7].
El resto se observan asociados a la facomatosis, en su mayoría a la esclerosis tuberosa (casi el 80 % presentan AML), aunque también se han encontrado en el Síndrome de Von Hippel-Lindau (VHL), la neurofibromatosis tipo 1 (NF1) [8] y se han asociado a linfangioleiomiomatosis [9]. En estos casos se presentan a una edad más temprana que en los casos esporádicos, aproximadamente sobre los 10 años, siendo más grandes, casi siempre bilaterales y más numerosos.
Existen dos tipos histológicos de AML:
1. AML clásicos (con alto contenido graso), habitualmente con buen pronóstico.
2. AML atípicos o hipograsos (pobres en grasa), representando un 1/3 de los casos. Pueden sufrir transformación maligna.
Aunque los AML son tumores benignos, en ocasiones pueden evolucionar hacia malignidad, pero esta transformación es rara [9]. En concreto, existe una variedad muy infrecuente denominada angiomiolipoma epiteloide asociada a una mutación del gen p53. La variante epiteloide es un AML atípico con más del 10 % de células epiteloides (células con abundante citoplasma eosinófilo y granular) que puede sufrir transformación maligna [10]. En los pacientes con Complejo de Esclerosis Tuberosa coexisten los dos tipos de AML. Los que contienen pequeña cantidad de grasa puede confundirse en la ecografía con carcinoma de células renales [9] [11] [12].
Seguimiento y complicaciones del AML
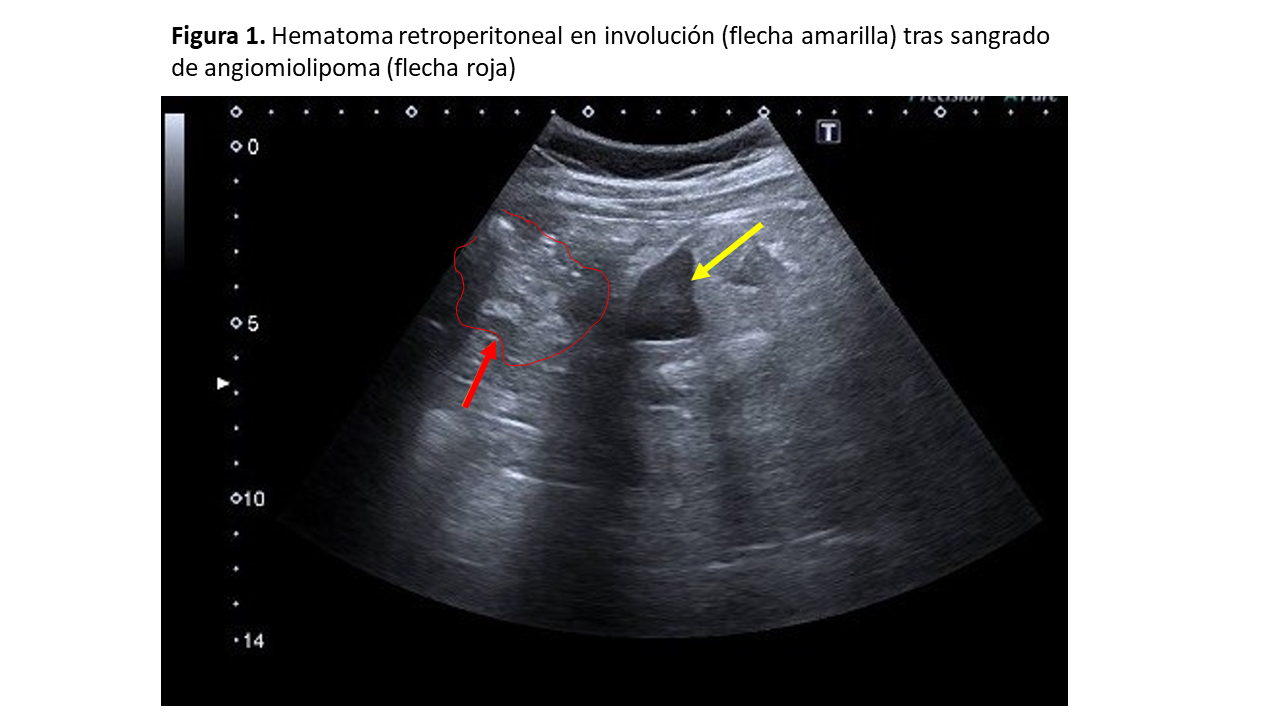
La mayoría de AML son asintomáticos. Cuando el tamaño tumoral es mayor de 4 cm, entre el 68 y el 80 % desarrollan síntomas. Su principal complicación es la rotura, dando lugar a sangrado retroperitoneal. También pueden presentar otros síntomas y signos, como masa palpable, dolor, infecciones del tracto urinario, hematuria, etc, aunque son raros.
El riesgo de hemorragia significativa está relacionado con el grado de vascularización, el tamaño de AML y de los aneurismas de su interior. Hay mayor riesgo de hemorragia por aumento del riesgo de ruptura de AML en las siguientes ocasiones:
* Lesión mayor de 4 cm o microaneurisma mayor de 5 mm.
* Durante el embarazo.
El 17-20 % de los sangrados retroperitoneales espontáneos son ocasionados por AML [10] [13], pudiendo llegar a desarrollar Síndrome de Wunderlich cuando la rotura espontánea del AML ocasiona una hemorragia severa y produce shock hemorrágico (Figura 1).
Ecografía del AML
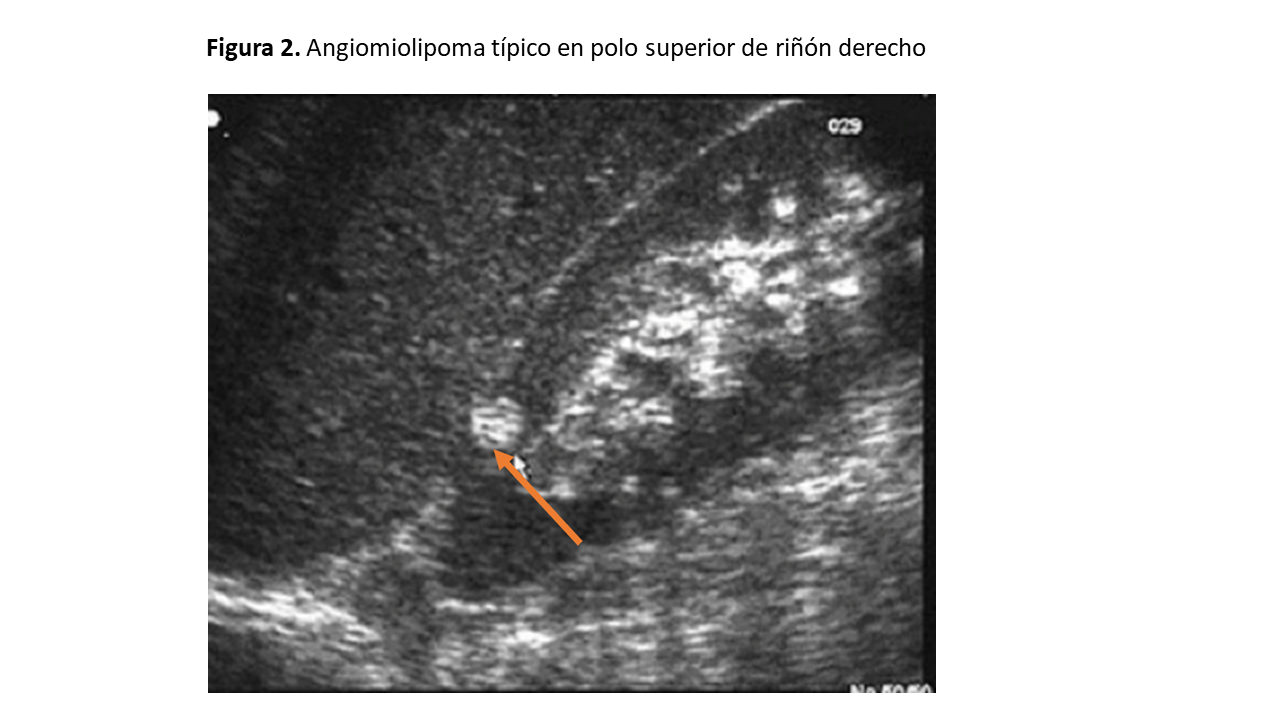
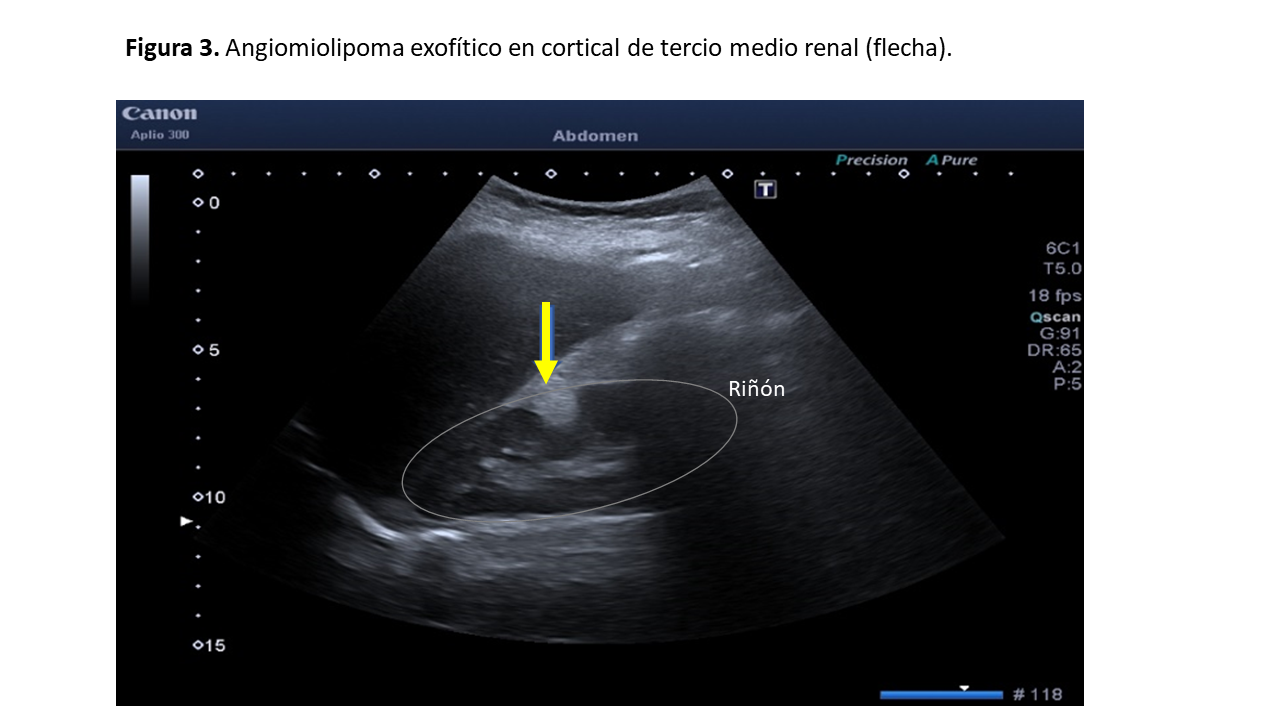
El AML típico tiene un aspecto ecográfico característico debido a su abundante contenido graso, por lo que en la imagen ecográfica veremos una masa hiperecogénica localizada frecuentemente a nivel cortical renal y, hasta en un tercio de los casos, puede dejar sombra acústica posterior. También pueden observarse en ocasiones sobresaliendo de la cortical y/o seno renal, generando protrusiones (exofíticos) (Figura 2) y (Figura 3).
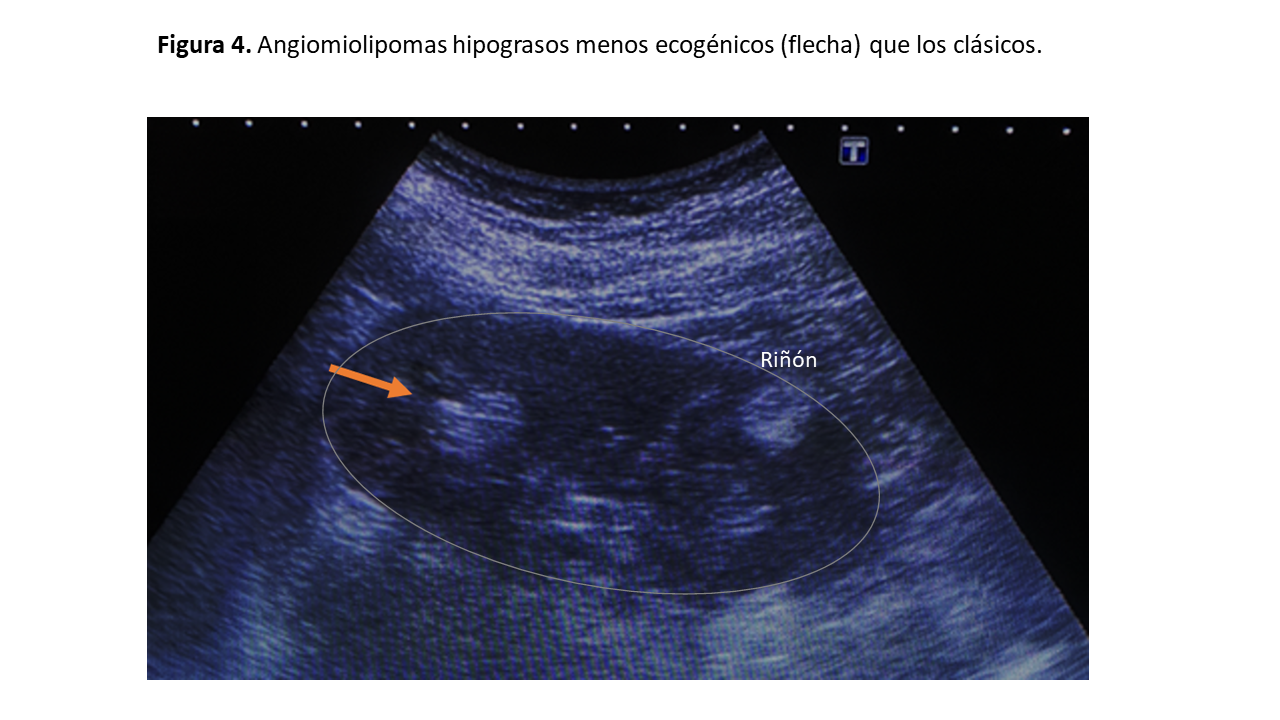
Los angiomiolipomas hipograsos son menos hiperecogénicos por su escaso contenido en grasa, y podrían confundirse con carcinomas de células renales (Figura 4).
La ecografía es útil como primera prueba en la esclerosis tuberosa, pudiendo ser suficiente para el diagnóstico, aunque es poco precisa en AML pequeños y exofíticos, que pueden confundirse con grasa perirrenal. Ante una lesión hiperecogénica con sospecha de AML en un paciente con esclerosis tuberosa hay que confirmarla por TC o RM [14] [15].
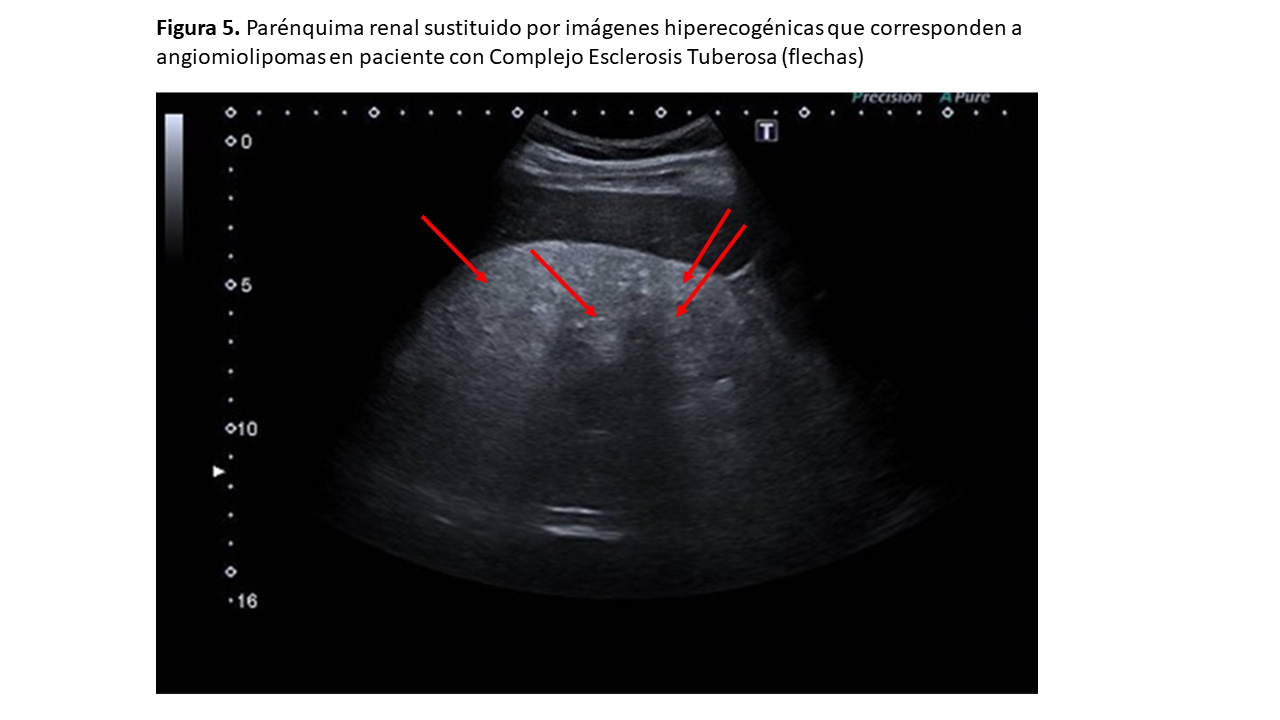
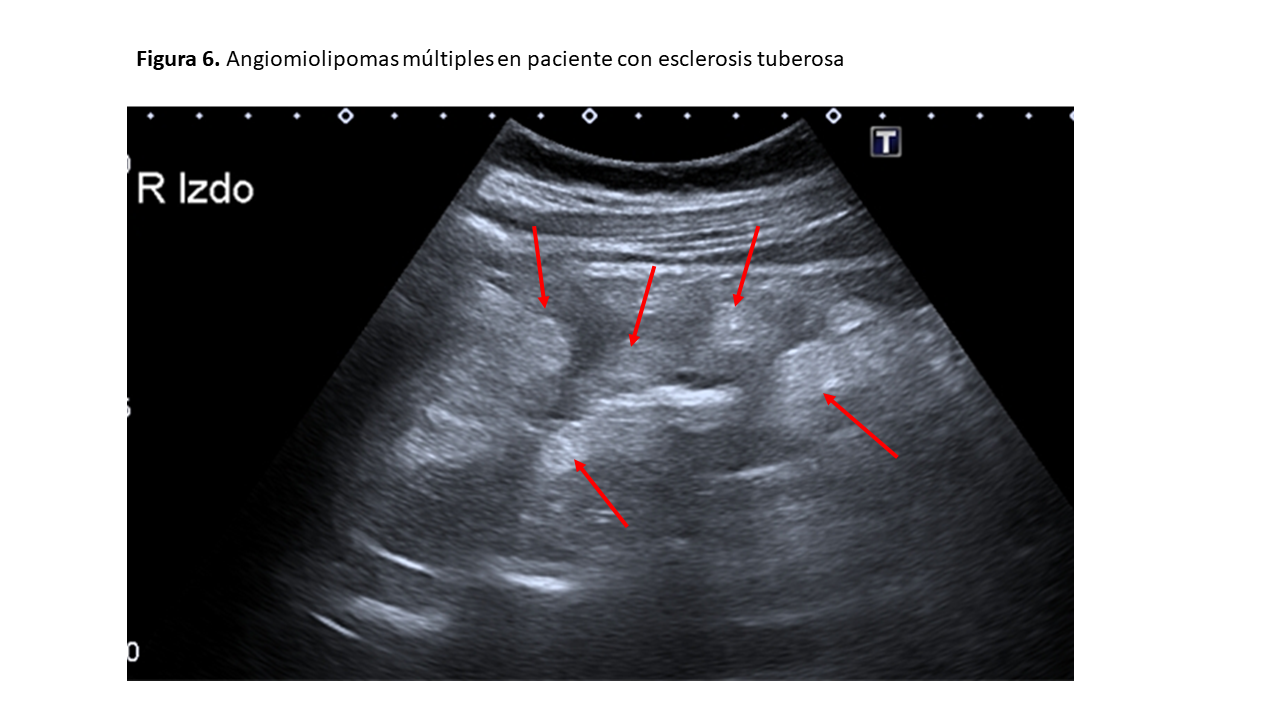
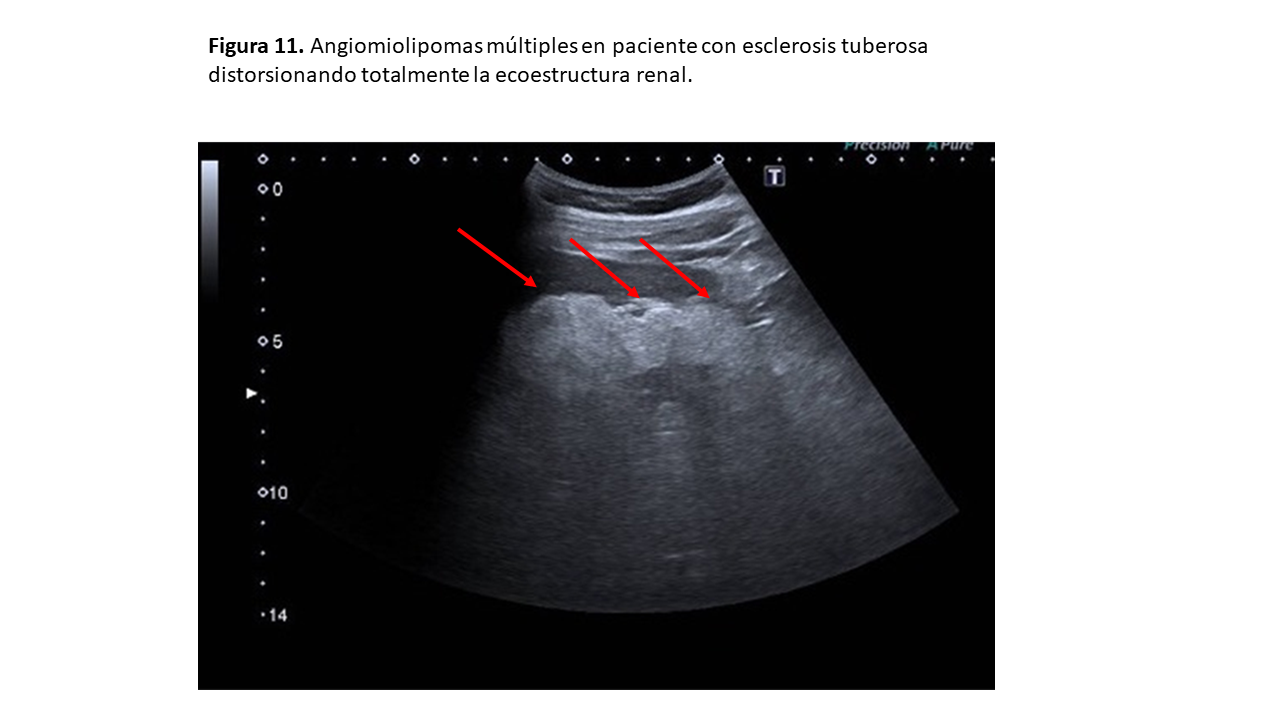
En la esclerosis tuberosa solemos encontrar numerosas masas hiperecogénicas bilaterales, afectando a la estructura renal y ocasionando la pérdida de estructura del riñón y pérdida de diferenciación corticomedular (Figuras 5) y (Figura 6).
Diagnóstico diferencial
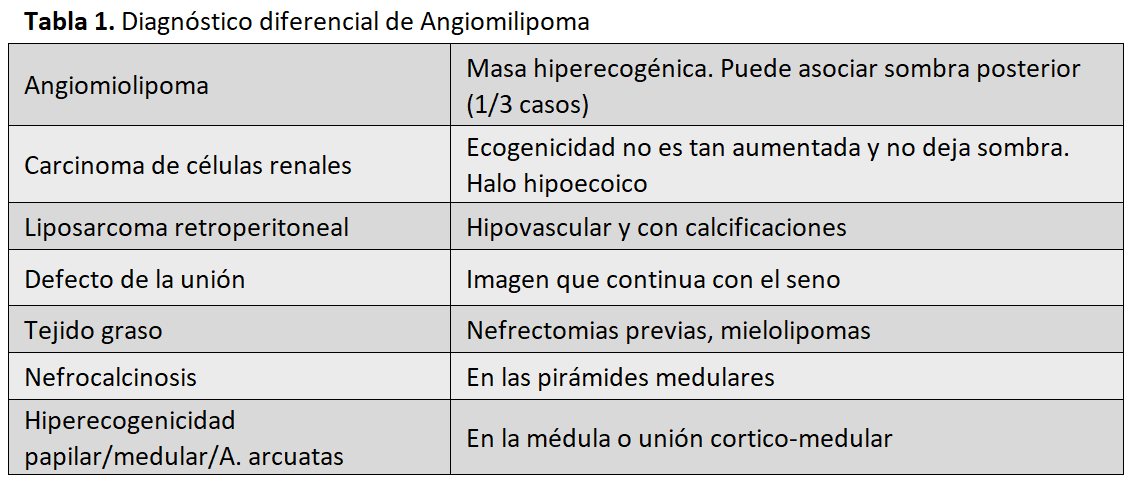
Cuando el AML es típico, no suele generar duda. Si son angiomiolipomas atípicos, pobres en grasa, otras lesiones se deben tener en cuenta en el diagnóstico diferencial (Tabla 1):
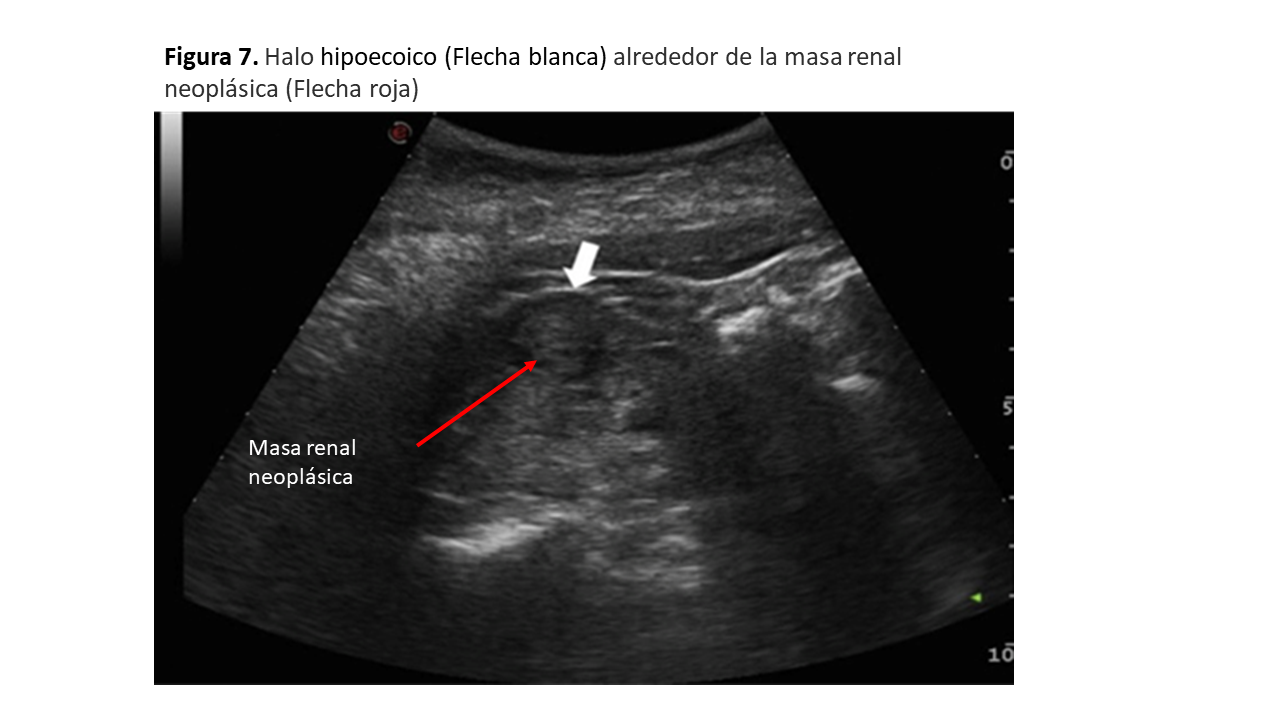
• Carcinoma de células renales: habitualmente la ecogenicidad no está tan aumentada como en los AMLs y no dejan sombra acústica posterior. Los carcinomas de células renales, a veces tiene un halo hipoecoico a su alrededor que no aparece en los AMLs (Figura 7).
• Liposarcoma retroperitoneal. Es un tumor renal con alto potencial infiltrativo y metastásico. El órgano más afectado es el riñón [16]. Se observa como una masa sólida hiperecogénica que se extiende hasta la corteza renal. El liposarcoma es hipovascular y suele contener calcificaciones.
• Oncocitoma: puede contener grasa y una escara central.
• Tumor de Wilms: puede contener grasa.
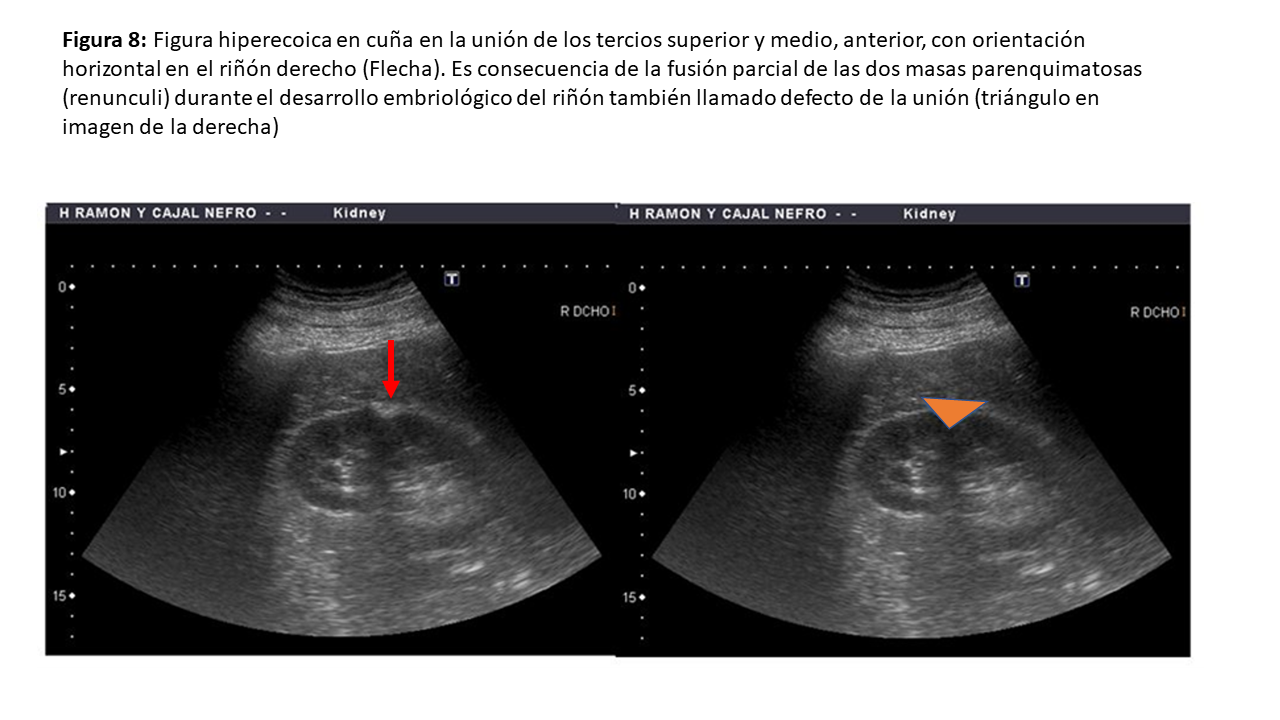
• Defecto del parénquima de la unión renal: suelen continuarse con la grasa del seno renal, pero no tienen aspecto redondo (Figura 8).
• Tejido graso que se emplea para rellenar el espacio en las nefrectomías parciales y mielolipomas y en injerto renal para rellenar el parénquima tras realizar la cuña para la biopsia renal.
• Nefrocalcinosis: imágenes hiperecogénicas alrededor de las pirámides medulares con sombra acústica posterior.
• Hiperecogenicidad papilar, medular y de las arterias arcuatas: pueden simular también falsos angiomiolipomas. La diferencia está en su localización, ya que se sitúan en la médula o en la unión cortico-medular.
Complejo esclerosis tuberosa (CET)
El Complejo Esclerosis Tuberosa (CET) es una enfermedad hereditaria que cursa con trastornos neurológicos, lesiones cutáneas características y tendencia al desarrollo de hamartomas o tumores benignos en el sistema nervioso central, retina, piel, pulmón, riñón y corazón principalmente. Es una enfermedad rara (1/6.000-10.000), multisistémica y con amplio espectro fenotípico [4].
Las manifestaciones renales del CET ocurren con alta frecuencia y con una amplia gama de gravedad. Constituyen la segunda causa de morbimortalidad, después de las manifestaciones neurológicas [5] [6]. El compromiso renal se observa en el 36-99 % de los pacientes cuando es detectado clínicamente y llega al 100 % en los estudios post mortem [8]. La patología renal puede estar presente desde el nacimiento o aparecer durante la evolución, por lo que se recomienda el seguimiento ecográfico periódico [9].
a) AML en CET
Las alteraciones renales más frecuentes son los AMLs en un 50-75 %, los quistes renales simples o múltiples en un 18-35 %, la enfermedad poliquística renal, AMLs malignos epiteloides y con menor frecuencia el carcinoma de células renales, entre un 1-2 % [10]. Los tumores renales malignos suelen aparecer en pacientes más jóvenes (menores de 50 años).
Complicaciones del AML en el CET
Los AML constituyen la mayor causa de morbimortalidad en adultos con CET [11]. Es la lesión tumoral renal más frecuente. Los AML son tumores benignos constituidos por vasos sanguíneos de paredes gruesas, células de músculo liso inmaduro y adipocitos. Generalmente son múltiples y bilaterales, y aumentan en número y tamaño con la edad [6]. Los AML suelen ser asintomáticos pero los mayores de 4 cm pueden ocasionar dolor abdominal, masa palpable, hematuria y hemorragia intrarrenal o retroperitoneal [12], siendo ésta su principal y más severa complicación.
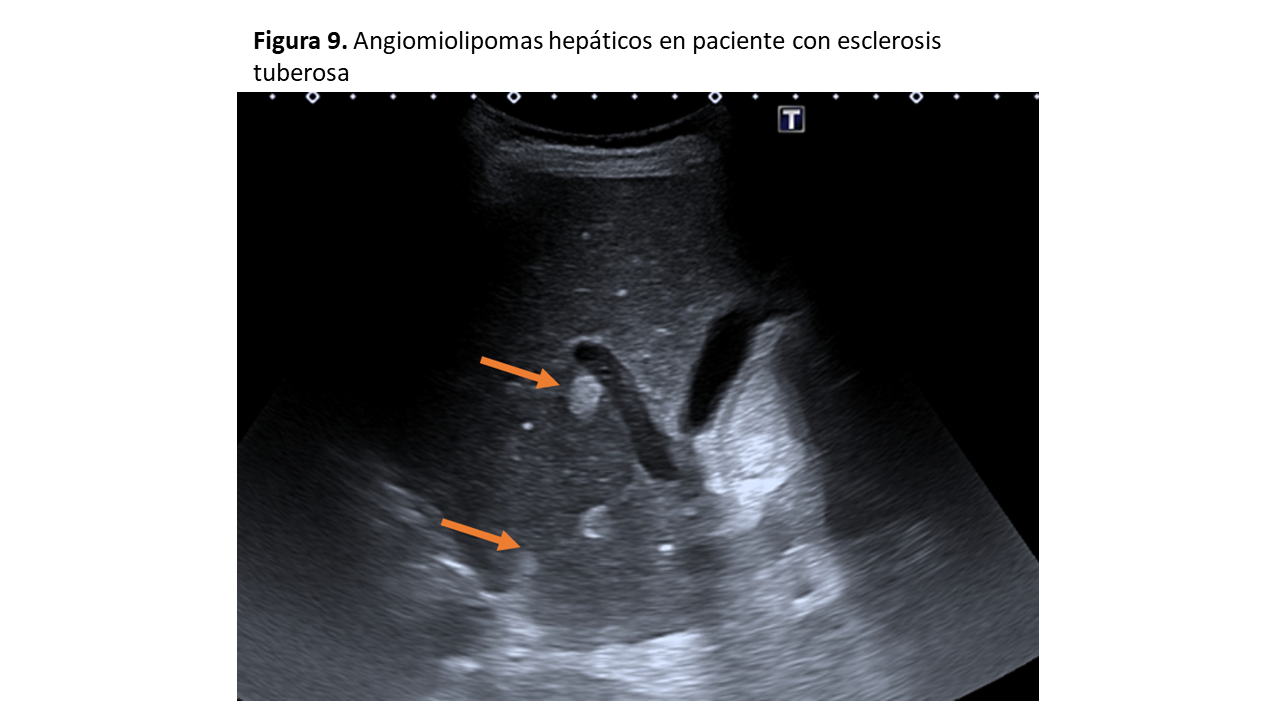
Los AML no se encuentran únicamente a nivel renal y pueden afectar a cualquier órgano, con mayor frecuencia el hígado [12] (Figura 9). Ante una lesión hiperecogénica con sospecha de AML en un paciente con CET hay que confirmarla por TC o RM. [10] [13].
Hallazgos ecográficos del AML en el CET
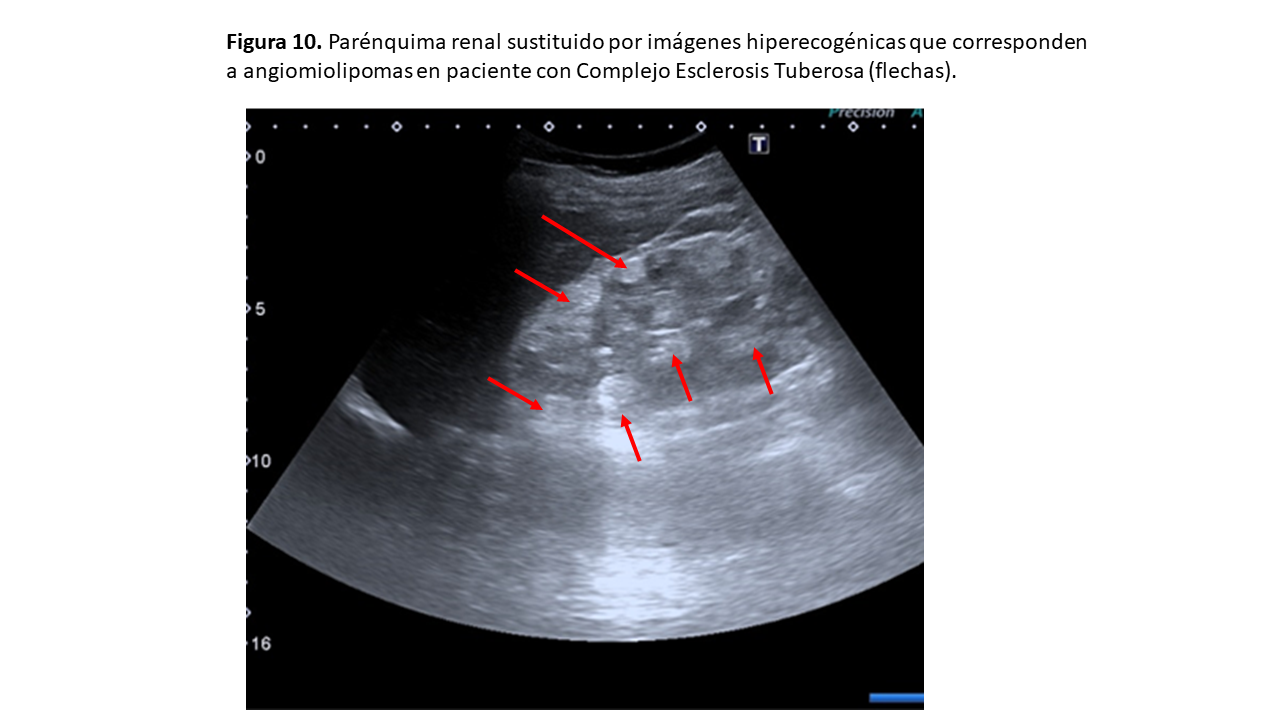
Nos encontraremos una imagen de AML típico (ver apartado de Angiomiolipoma), por lo que veremos masas hiperecogénicas corticales renales bilaterales (Figura 10) que en un tercio de los casos dejan sombra acústica posterior. En casos severos, el parénquima renal puede estar completamente sustituido por angiomiolipomas (Figura 10) y (Figura 11).
b) Quistes renales en CET
Los quistes renales en el CET son la segunda manifestación renal más común en el CET. Su incidencia aproximada es del 50 % [13] y son más frecuentes en pacientes con mutación en el gen TSC2 truncante [11]. Se pueden presentar como quistes simples corticales únicos, múltiples o con nefromegalia quística asociada a poliquistosis renal autosómica dominante. Cuando son bilaterales y múltiples, es difícil diferenciarlos de la poliquistosis renal del adulto [10] y pueden producir dolor abdominal, masa palpable o hematuria [14]. De forma excepcional cuando son de gran tamaño pueden complicarse.
Su detección se realiza mediante ecografía, siendo necesario realizar otras pruebas diagnósticas para el diagnóstico diferencial de los quistes complicados con pólipos renales tipo hamartoma, carcinoma renal y AML renal atípico. En la población general, los quistes simples aislados no requieren seguimiento específico, pero en pacientes con CET y quistes aislados se requiere vigilancia, ya que muchos pueden acabar desarrollando carcinomas renales con la edad.
c) Síndrome de genes contiguos
Se presenta en menos del 5% de los casos. Se debe a delecciones del cromosoma 16 que afectan a los genes contiguos TSC2/PKD1, causante de la poliquistosis renal autosómica dominante (PQRAD) tipo 1 con esclerosis tuberosa. Se expresa con un fenotipo característico de PQRAD grave y de aparición muy precoz, asociado con manifestaciones clínicas sugestivas del CET e implica un peor pronóstico de la enfermedad renal.
Hallazgos ecográficos
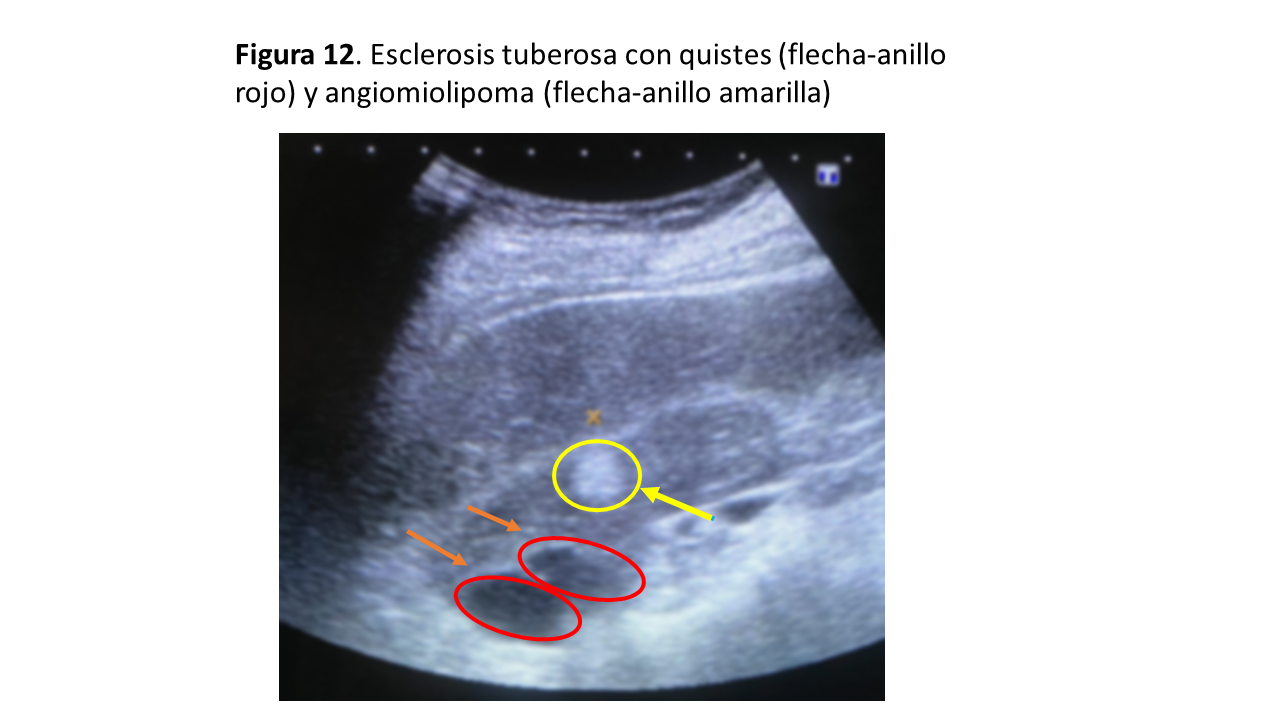
El diagnóstico de sospecha se realiza en la fase prenatal, en el nacimiento o en los primeros meses de vida, visualizándose riñones aumentados de tamaño, con múltiples quistes corticales de tamaño variable, que sugieren un cuadro de PQRAD muy precoz y grave sin historia familiar previa [15]. Los pacientes suelen presentar hipertensión arterial de difícil control y a veces disminución del filtrado glomerular, además de síntomas o signos sugestivos del CET, generalmente neurológicos. Se debe realizar diagnóstico diferencial con la poliquistosis renal autosómica recesiva y la displasia quística. Los pacientes con TSC2/PKD1 tienen mayor riesgo de desarrollo de AML y carcinoma de células renales, por lo que requieren seguimiento cada 1-3 años (Figura 12).
d) Enfermedad renal crónica e Hipertensión Arterial
El 40 % de los pacientes con CET presentan enfermedad renal crónica (ERC) alrededor de los 45-54 años [11] [16], siendo más prevalente en pacientes con mutaciones en TSC2 y con síndrome de genes contiguos TSC2-PKD1. Otros pacientes con CET desarrollan ERC que puede llevar a estadio terminal en ausencia de AML gigantes o enfermedad renal quística. La prevalencia de hipertensión arterial en pacientes con CET es de hasta el 25 % en menores de 25 años, siendo el control de cifras tensionales fundamental para prevenir la progresión de la enfermedad renal crónica en estos pacientes.
Hallazgos ecográficos
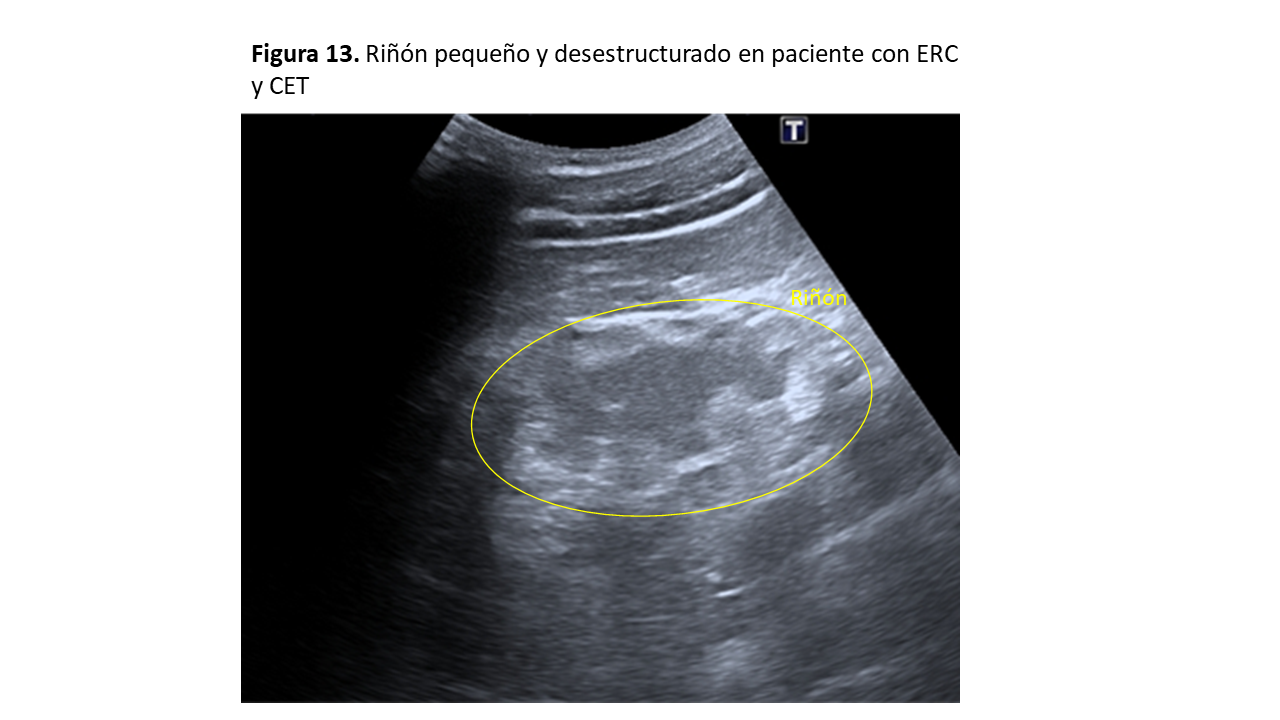
En la ecografía se observan riñones de pequeño tamaño, desdiferenciados e hiperecogénicos, típicos de ERC (Figura 13).
e) Carcinoma renal
Los pacientes con CET podrían tener un riesgo aumentado de desarrollar carcinoma renal, sobre todo carcinoma renal de células claras [17]. El riesgo parece estar aumentado en los pacientes con mutación de TSC2 y en los pacientes con Síndrome de Genes Contiguos. El carcinoma de células claras en los pacientes con TSC es a menudo multifocal y bilateral y se suele desarrollar en edades más tempranas en comparación con la población general [18].
Hallazgos ecográficos
El diagnóstico de carcinoma de células claras debe ser considerado en pacientes con lesiones renales que son pobres en contenido graso. Su imagen se abordará en el apartado siguiente.
3.-MASAS RENALES MALIGNAS
CARCINOMA RENAL
Epidemiología y tipos
El carcinoma de células renales (CCR) es un espectro de enfermedades tumorales que comprende más de 10 subtipos diferentes y supone aproximadamente un 2% de los tumores a nivel mundial. Es la lesión maligna renal más frecuente y de predominio en varones con un pico de edad entre los 50 y 70 años [19]. Debido a que el espectro tumoral del CCR es diverso y varía según subtipo su pronóstico es muy variable, dependiendo de su localización, extensión y características histológicas [20]. Actualmente el diagnóstico de los CCR suele ser un hallazgo casual en una prueba de imagen, aunque previamente solía deberse a la presentación clínica de la tríada clásica: hematuria, masa renal palpable y dolor en flanco, seguido de un síndrome paraneoplásico hormonal o constitucional. Este cambio se debe probablemente al mayor empleo de técnicas de imagen como la ecografía por otras causas. Otro síntoma solía ser la aparición súbita de un varicocele izquierdo, que indica un fallo en el drenaje de la vena testicular en la vena renal izquierda y sugiere trombosis por la presencia de un tumor renal.
Los CCR normalmente son unilaterales y únicos, pudiendo ser multicéntricos y/o bilaterales hasta en un 15 % de los casos. La presentación bilateral y multicéntrica suele observarse en pacientes jóvenes con enfermedad de Von Hipple-Lindau, en la enfermedad quística adquirida de pacientes con terapia renal sustitutiva de larga data y en formas familiares.
Existen más de 5 tipos histopatológicos. El más frecuente es el de células claras, que es el de mayor tamaño y de peor pronóstico. Los otros dos subtipos más frecuentes son el papilar y el cromófobo, siendo el resto de subtipos muy infrecuentes (<1%) como el oncocítico y medular, este último también de mal pronóstico pero el menos frecuente [21].
No pueden ser claramente diferenciados con ninguna prueba de imagen, aunque algunas características pueden orientarnos. La ausencia de necrosis y presencia de calcificación sugieren mejor pronóstico, como ocurre en la variante papilar o cromófoba.
Hallazgos ecográficos
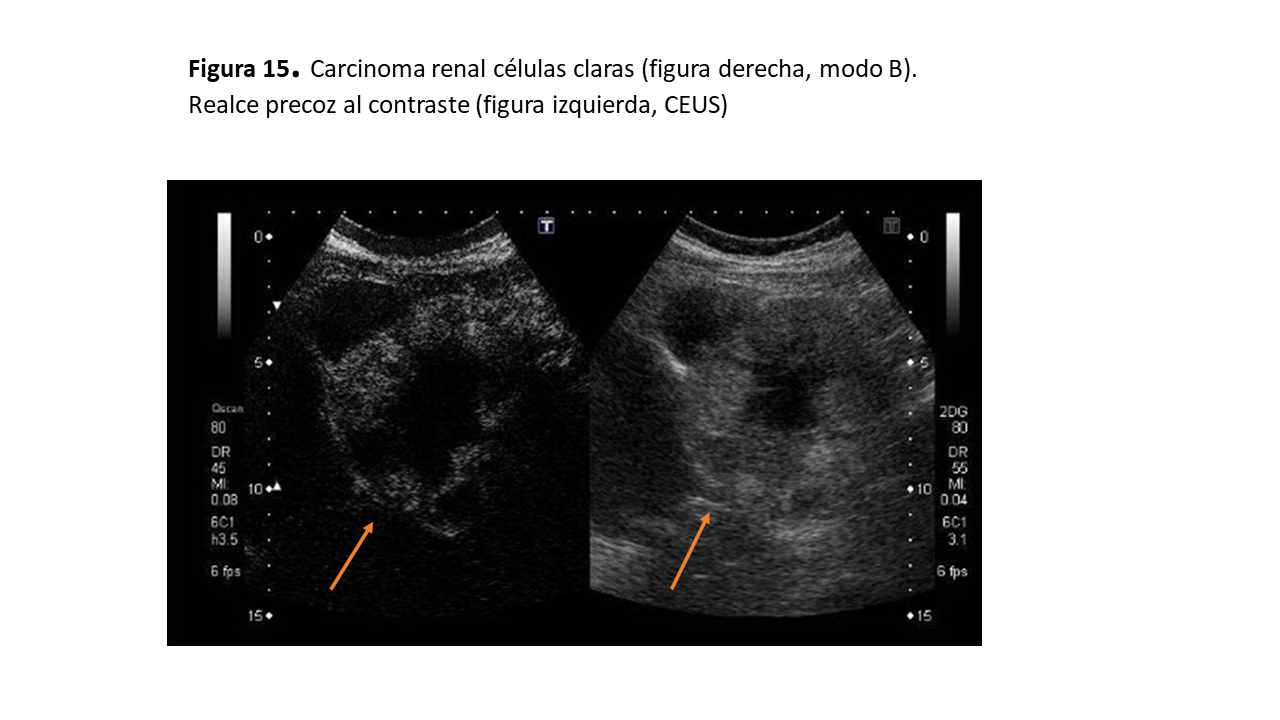
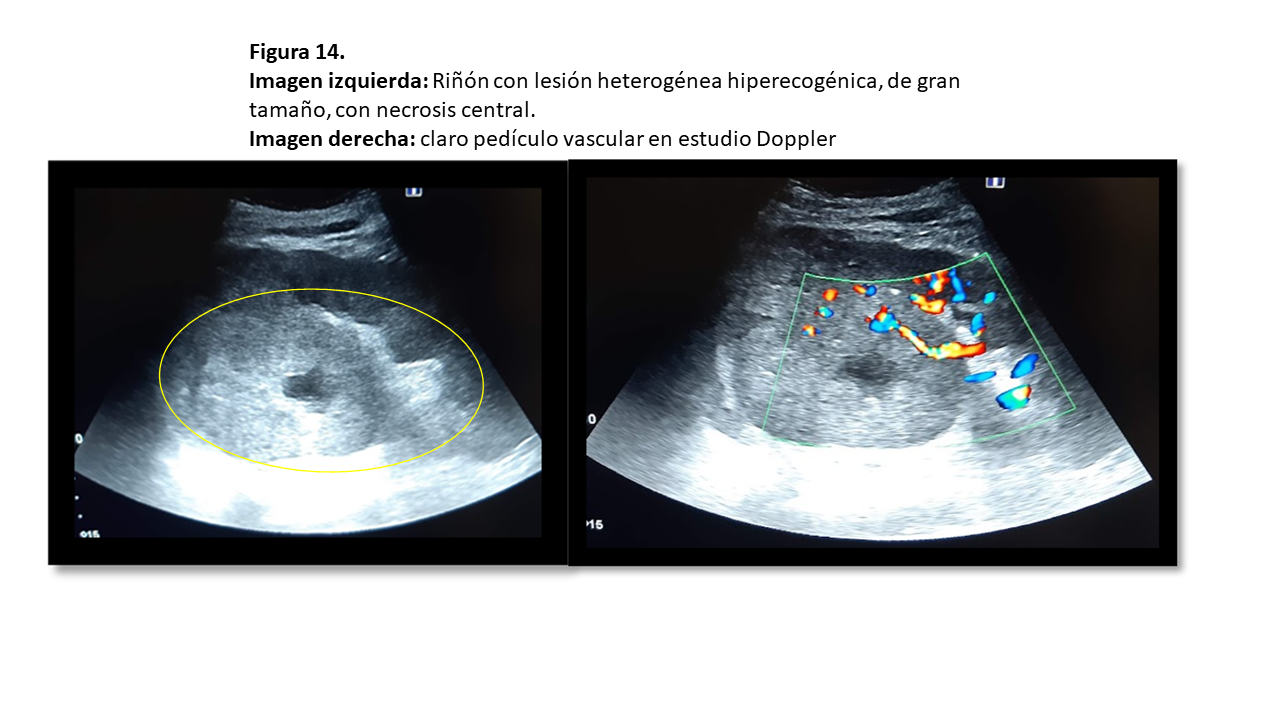
La mayoría son sólidos y se muestran iso o hipoecoicos con respecto al parénquima circundante (Figura 14) y (Figura 15), aunque también pueden ser hiperecogénicos, muy similar al AML, lo que obliga a diferenciarlos mediante eco con contraste, TAC o RMN. Puede presentar un halo hipoecoico a modo de pseudocápsula que lo diferencia del AML. Cualquier lesión sólida renal con flujo Doppler en su interior debe ser considerada un CCR hasta que demostremos lo contrario, debiéndose valorar la permeabilidad de la vena renal, que se trombosa entre un 4% y un 10% de los casos de CCR. Debemos valorar también la vena cava inferior.
Los CCR pueden mostrar calcificación con diversos patrones: punteado, difuso, periférico y central.
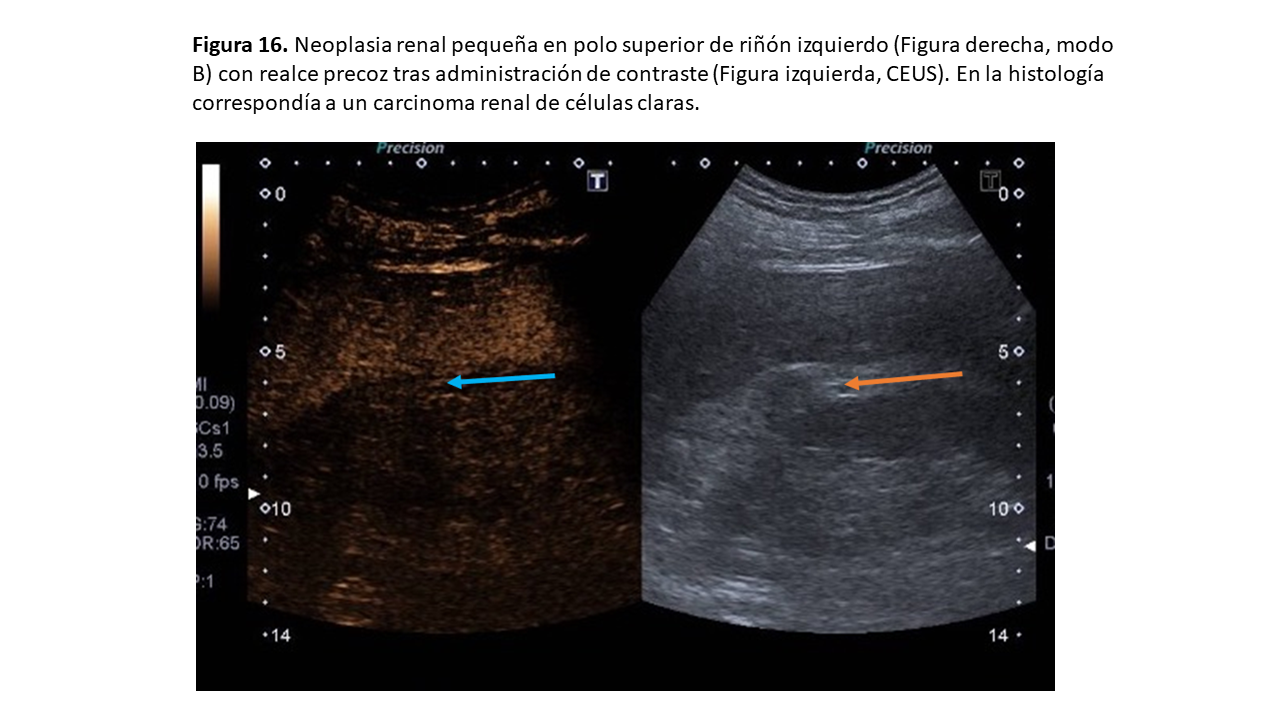
Con el CEUS, el CCR de células claras muestra un fuerte realce inicial en fase arterial y un lavado más rápido en las siguientes fases (Figura 16). El CCR papilar muestra un realce más sutil y tardío, mientras que el subtipo cromófobo puede presentar una imagen en “rueda de carro” con escara central (al igual que el oncocitoma).
Aunque la mayoría son de aspecto sólido, entre un 4% y 15 % presentan un patrón quístico y muestran un crecimiento lento, con baja probabilidad de metástasis y con buenos resultados con cirugía preservadora. Esto son los tipos:
* CCR quístico de células claras: lesiones quísticas de septos engrosados e irregulares y paredes gruesas. Pueden presentar nódulos y calcificaciones, observándose la vascularización mediante estudio Doppler (y de forma más precisa mediante CEUS).
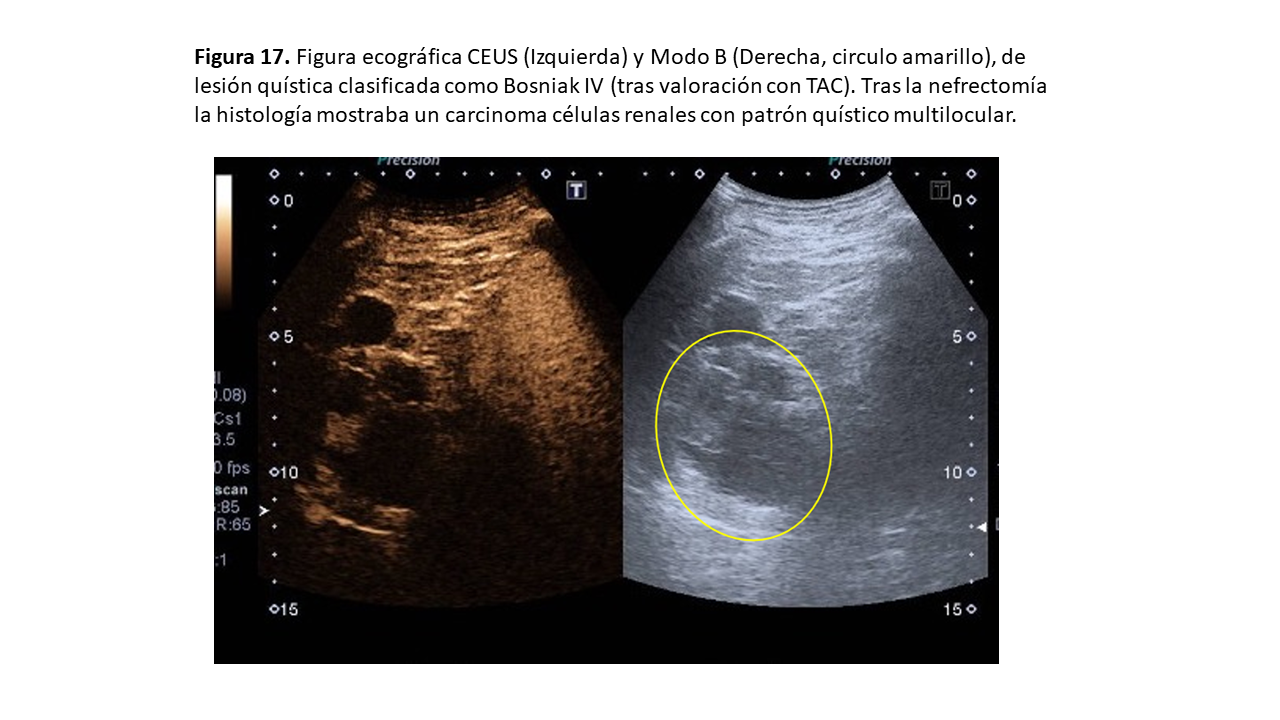
* CCR quístico multilocular: tumores de bajo grado de aspecto quístico variable (Figura 17).
* CCR quístico papilar.
* CCR túbuloquístico recientemente descrito [22], que está compuesto por múltiples espacios quísticos pequeños separados por septos finos múltiples con aspecto de esponja, que le confiere marcada hiperecogenicidad en la ecografía con realce posterior, clave en su diagnóstico.
4. OTRAS MASAS RENALES
a. Carcinoma urotelial (tumor pielocalicial)
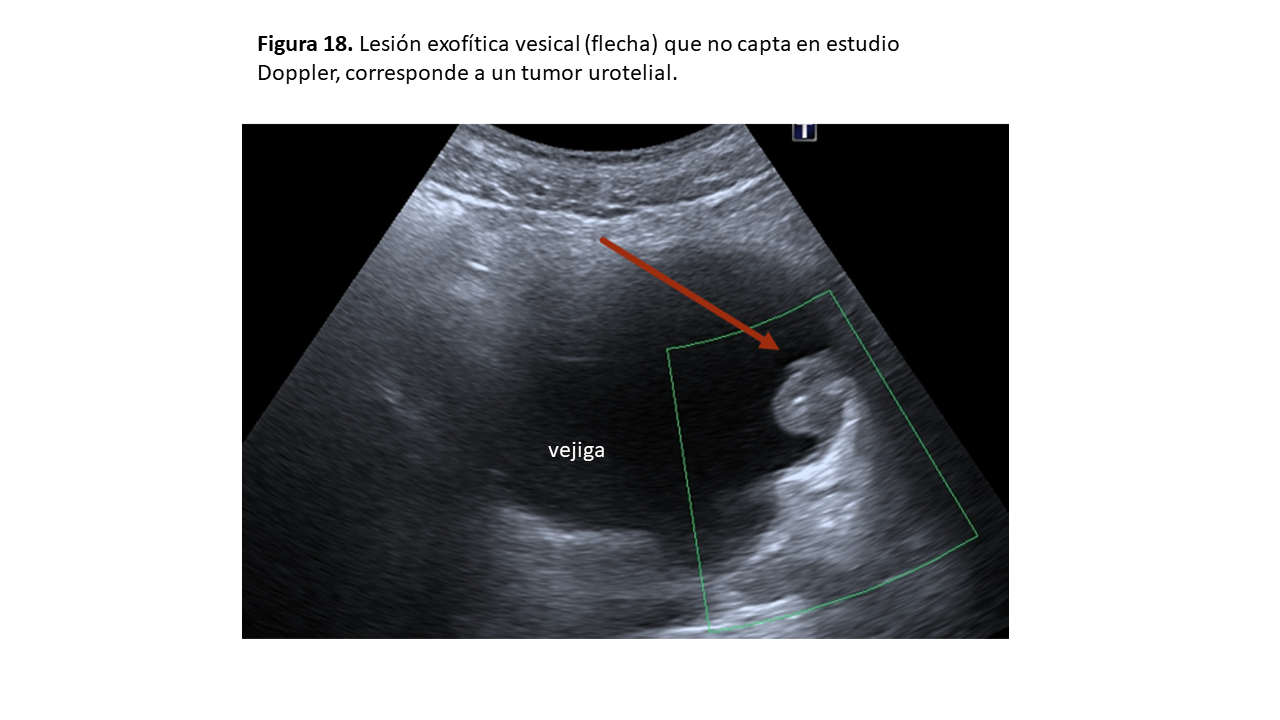
Masa renal sólida habitual en el varón de edad avanzada, que presenta como clínica más habitual hematuria y dolor en flanco. El tipo histológico más frecuente es el de células transicionales y está asociado a exposición de tóxicos (tabaco, pinturas, colorantes) y fármacos (ciclofosfamida, analgésicos). La localización más frecuente es la vesical (Figura 18), seguida de la pélvica y del uréter proximal, pudiendo presentar tumores sincrónicos y metacrónicos [23].
Hallazgos ecográficos
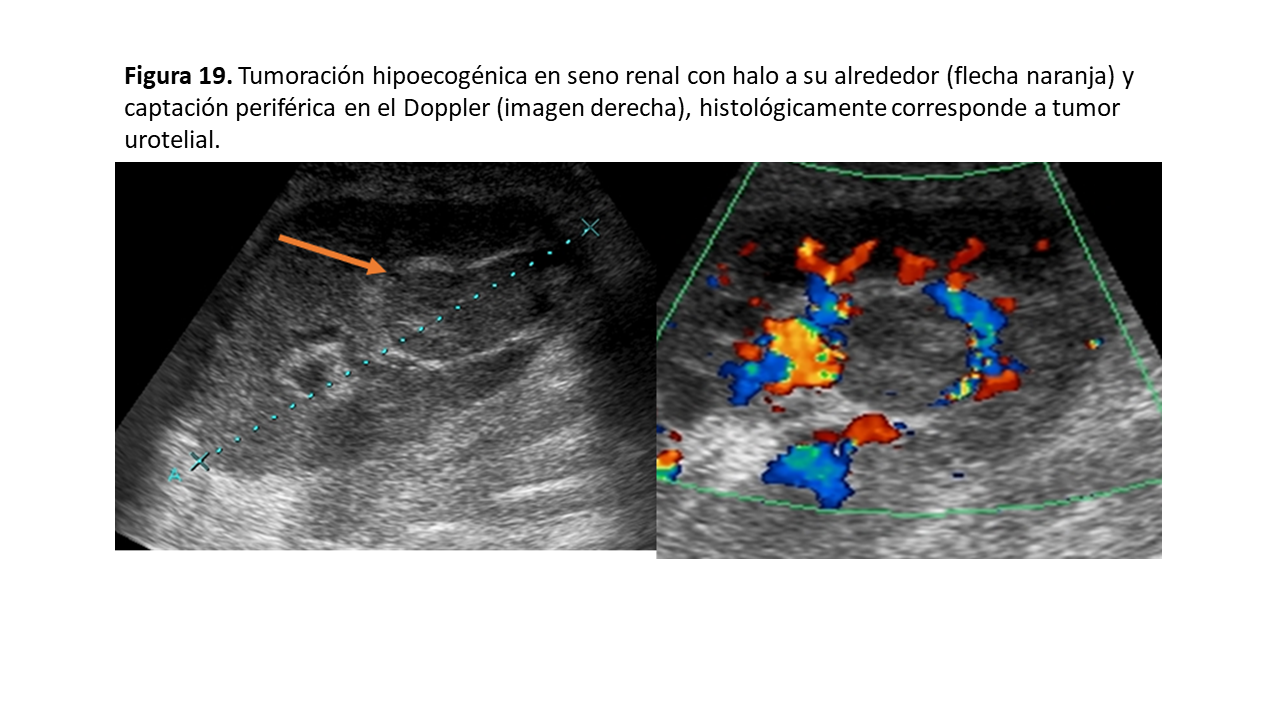
Ecográficamente se muestran como lesiones hipoecoicas en el seno renal (Figura 19) sin refuerzo posterior que lo diferencia de la hidronefrosis o lesión quística. Pueden tener una zona hiperecogénica (metaplasia escamosa) con sombra acústica por lo que deben diferenciarse de una litiasis, y la práctica totalidad de este tipo de tumores realza cuando se administra contraste en el CEUS [24]. A diferencia del CCR, raramente infiltran la vena renal.
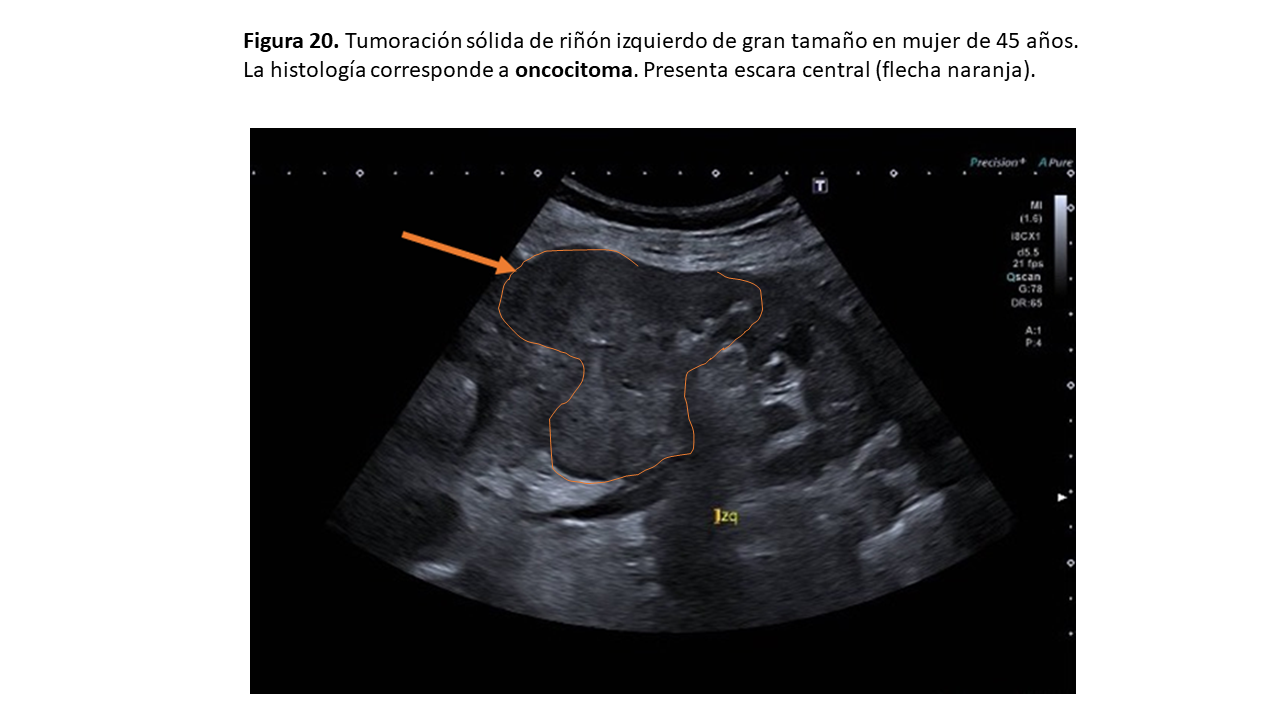
b. Oncocitoma
Lesión benigna renal de localización cortical relativamente poco común, más frecuente en varones de entre 60 y 70 años. De tamaño muy variable, puede presentarse con una escara central única o múltiple debido a hemorragia intratumoral (Figura 20). Aunque es benigno, se han descrito casos malignos a distancia o con invasión tisular local o más raramente con coexistencia de un CCR. Pueden presentar también calcificaciones, quistes y telangiectasias [25]. Normalmente son únicos, pero pueden presentarse multicéntrica o bilateralmente, como en el síndrome de Birt-Hogg-Dube, en el CET o en casos esporádicos.
Hallazgos ecográficos
Ecográficamente se muestra como lesión sólida homogénea iso o hipoecoica, indistinguible del CCR, por lo que en muchas ocasiones es intervenido y diagnosticado por histología posteriormente [25]. Como lesión benigna que es, el CEUS muestra un realce y lavado lento y un patrón en “rueda de carro”, como ocurre en la variante cromófoba del CCR.
c. Linfoma, infiltración leucémica y metástasis.
Normalmente se detectan en el estudio de extensión de la patología oncológica. Suelen manifestarse ecográficamente como riñón agrandado con múltiples masas, normalmente hipoecogénicas, homogéneas y mal delimitadas, o presentarse con un halo hipoecogénico.
En el caso del linfoma, habitualmente de tipo No Hodgkin, la afectación es bilateral. En algunos casos podemos ver un conglomerado adenopático hipoecoico [26][27].
En la infiltración leucémica los riñones son hiperecogénicos y están aumentados de tamaño.
Las lesiones metastásicas suelen encontrarse en la unión corticomedular y son multifocales, siendo el tumor primario causante más frecuente el pulmonar, seguido del carcinoma de mama y del CCR contralateral. Por ecografía no podremos diferenciarlo de tumores renales primarios, como el CCR, pero si se detecta en un contexto oncológico, es más probable que sea una metástasis que un primario renal.
Debemos diferenciarlo de procesos metastásicos sépticos, nefritis intersticial o enfermedades de depósito que cursen con nefromegalia, como la amiloidosis, para lo que la ecografía con contraste resulta útil [28].
d. Artefacto de duplicación
No se trata de una masa en sí, sino de una imagen de rarefacción situada entre polo superior del riñón e hígado/bazo, simulando un tumor sólido.
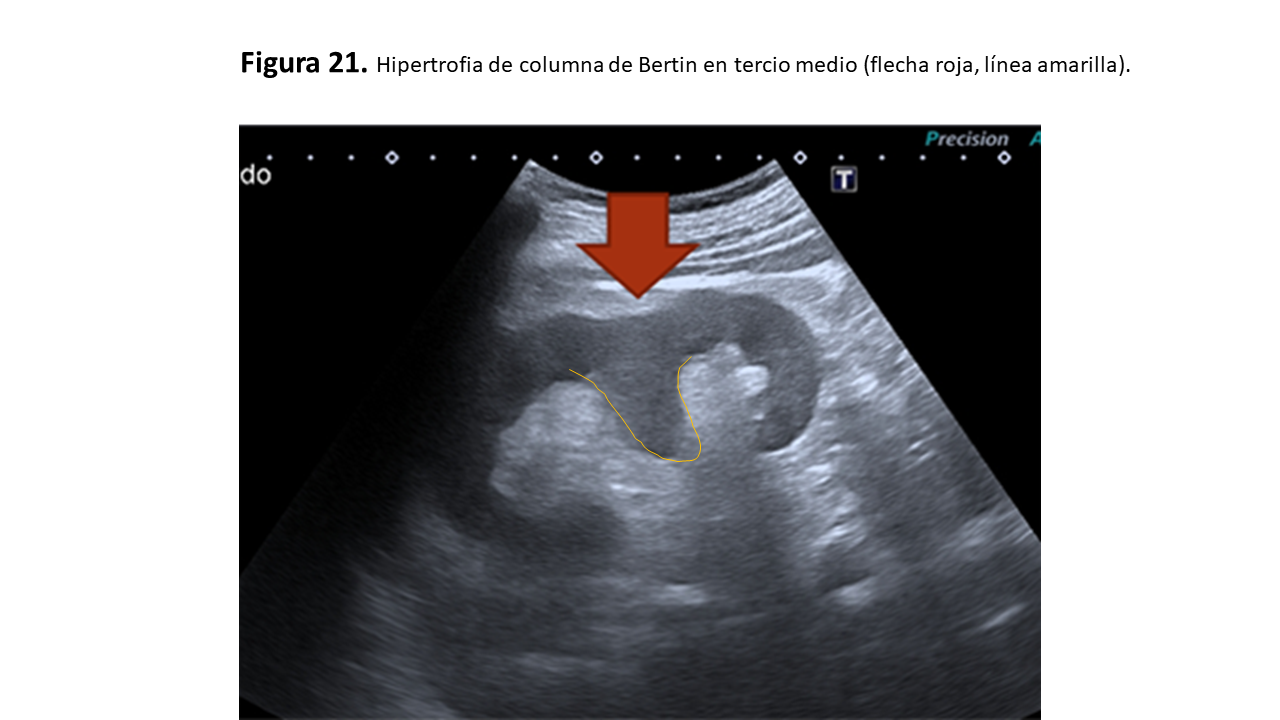
e. Columna de Bertin
Puede confundirse con una masa isoecoica con respecto al parénquima, aunque se trata de tejido cortical normal que protruye hacia el seno y se ubica entre dos pirámides medulares, sin deformar la estructura renal (Figura 21).