Diagnóstico y Tratamiento del Rechazo Mediado por Anticuerpos
RESUMEN
El grupo Prometeo hizo una revisión de la literatura existente sobre diagnóstico y tratamiento del rechazo activo mediado por anticuerpos. Se revisaron los criterios diagnósticos de Banff 2017, que se asientan sobre datos histológicos (biopsia del injerto renal) y serológicos (anticuerpos donante específicos). Así mismo se revisaron las posibilidades de trasplante del paciente con alta sensibilización HLA, ya sea mediante los programas de intercambio de donantes, la desensibilización, o incluso la combinación de ambas estrategias en el caso de que el receptor disponga de un donante vivo HLA incompatible; o bien, mediante los programas de priorización en lista de espera e intercambio renal de donante cadáver (como el español, PATHI) en el caso de que no se disponga de un donante vivo. Se concluyó que la desensibilización debe descansar sobre la combinación del recambio plasmático o inmunoadsorción, las inmunoglobulinas policlonales endovenosas y el rituximab. La inducción de estos pacientes debe incluir siempre un anticuerpo antilinfocitario mono o policlonal potente como alemtuzumab o globulina antitimocítica, siendo opcional la adición de rituximab. El tratamiento del rechazo activo mediado por anticuerpos debe incluir: pulsos de esteroides, recambios plasmáticos, inmunoglobulinas policlonales y rituximab. Solo en caso de que exista un daño vascular significativo se utilizará globulina antitimocítica. El elevado riesgo infeccioso de estos pacientes obliga a la utilización de una profilaxis infecciosa adecuada.
INTRODUCCIÓN
En el campo del trasplante renal a los anticuerpos anti-HLA se les ha ido reconociendo un papel creciente en la literatura en los últimos años [1].
De manera, que hoy sabemos que un porcentaje significativo de los rechazos de injertos renales, tanto agudos como crónicos, están mediados por anticuerpos. Y estos son los que tienen más dificultad de tratamiento y marcan más el pronóstico [1].
Los rechazos mediados por anticuerpos (ABMR, de sus siglas en inglés: antibody mediated rejection) pueden ser, siguiendo las categorías patocrónicas clásicas, agudos o crónicos. Hay que decir, sin embargo, que en la última clasificación de Banff de 2017, estas categorías como tal desaparecen [2].
El presente artículo se sitúa en el contexto de la revisión de la evidencia existente sobre el tema de los anticuerpos anti-HLA y sus consecuencias en forma de rechazo del injerto por parte del grupo Prometeo. Y se enfoca sobre el rechazo “agudo”, que en la terminología actual de Banff denominaremos activo.
MÉTODOS
Como es sabido, el grupo Prometeo está constituido por nefrólogos del campo del trasplante renal, que, a lo largo de un año, revisan la evidencia existente sobre un tema referente a trasplante renal. En la presente edición se han revisado los anticuerpos anti-HLA y sus consecuencias en forma de rechazo activo y crónico, derivado de los mismos, tanto en población adulta como pediátrica.
Nuestro subgrupo ha revisado el rechazo activo (antes “agudo”) mediado por anticuerpos. Para ello se hizo una búsqueda bibliográfica en pubmed fundamentalmente y google scholar a finales del 2018, con entradas como: “anticuerpos anti-HLA”, “rechazo mediado por anticuerpos”, “rechazo agudo mediado por anticuerpos”, “anticuerpos anti-HLA y trasplante renal”, etc, tanto en literatura en lengua inglesa como castellana. Y se seleccionaron los artículos a revisar a partir de la lectura del resumen de los mismos por tema, pertinencia, factor de impacto de la revista, antigüedad (inferior a 10 años como norma general), etc, resultando finalmente 51 artículos que fueron distribuidos para su revisión entre los miembros del grupo, haciendo un resumen crítico y de valoración de la evidencia. De esta revisión se extrajo un primer consenso, que se llevó a la reunión anual presencial del grupo y, en la misma y, enriquecido por la visión de expertos, se discutió éste y se pusieron las bases de la versión definitiva del consenso, que es la base de esta publicación.
ASPECTOS EPIDEMIOLÓGICOS
El ABMR activo afecta a un número bajo de los pacientes trasplantados renales no sensibilizados. Sin embargo, sí que supone un porcentaje mayor en los pacientes con sensibilización HLA y, en especial, en los sometidos a desensibilización HLA (entre 10 y 30% en diferentes series). Es un factor de riesgo de pérdida del injerto en el primer año postrasplante renal. Su incidencia tiende a aumentar por la acumulación de pacientes que se retrasplantan en las listas de espera [1] [3] [4] [5] [6].
El ABMR activo tardío (después de los 3 primeros meses postrasplante) tiene mucho mayor impacto sobre la supervivencia del injerto que el precoz (en los 3 primeros meses postrasplante). En una revisión del grupo de Oslo, la supervivencia del injerto a 1 año fue del 90% en ABMR precoz y 74% en tardío y a 4 años de 75% en precoz y 40% en tardío [4]. En ambos se asocia con gran frecuencia al rechazo mediado por células T (63% en el precoz y 96% en el tardío) [4].
Cualquier episodio de rechazo agudo, clínico o subclínico, incluyendo los estrictamente celulares, favorecen el desarrollo de anticuerpos donante específicos (DSA, de las siglas inglesas) de clase II de novo y, consecuentemente, el ABMR y la reducción de la supervivencia del injerto [7].
Por último, es importante señalar que el ABMR activo (clínico o subclínico) va a ser un factor de riesgo para el futuro desarrollo de ABMR crónico activo (con glomerulopatía). Esta entidad presenta un fenotipo distinto al del ABMR crónico activo por DSA de novo (en general en relación con minimización de la inmunosupresión de mantenimiento o con no adherencia al tratamiento), presentando este último un peor pronóstico.
DIAGNÓSTICO
Criterios diagnósticos de Banff 2017:
Dada su precisión, se presentan en la (Tabla 1) los criterios diagnósticos de ABMR activo (antes “agudo”) de la clasificación de Banff 2017:
Desarrollándola diríamos que se exigen 3 criterios para el diagnóstico [2] [8] [9] [10]:
1. Un criterio demostrativo de lesión tisular aguda a nivel renal: glomerulitis (g), capilaritis peritubular (ptc) o combinación de las mismas, arteritis intimal o transmural, microangiopatía trombótica aguda (MAT) o lesión tubular aguda. Siempre en ausencia de una explicación alternativa, p. ej. glomerulonefritis recurrente o de novo, infección, MAT de otra naturaleza, rechazo agudo mediado por células T puro etc
2. Un criterio demostrativo de interacción de los anticuerpos con el endotelio vascular, actual o reciente: tinción lineal de C4d en capilares peritubulares acusada (por inmunofluorescencia en sección congelada o por inmunohistoquimia en sección de parafina) o demostración de acusada inflamación microvascular (g+ptc = 2 y de preferencia con g = 1) y, como técnica de investigación y de futuro, si se dispone y está validada, expresión aumentada de transcripción de clasificadores de genes en tejido de biopsia.
3. Evidencia serológica de DSA, incluyendo anticuerpos no-HLA, si los anticuerposHLA son negativos (o técnicas moleculares de expresión génica).
Corolarios a los criterios diagnósticos de Banff 2017:
En la presente clasificación, desde el punto de vista histológico, se suprime el término “agudo”, quedando sustituido por el de activo [2].
La presencia de C4d no es un criterio imprescindible para el diagnóstico de ABMR activo. De manera que podemos clasificar los ABMR activos en C4d+ y C4d-. Cuando C4d es negativo, se requiere al menos moderada inflamación microvascular (g+ptc = 2 con g = 1) y la presencia de DSA, que deben buscarse exhaustivamente [2] [10].
El diagnóstico molecular puede acabar supliendo a la determinación de DSA. Pero, en el momento actual, en nuestro medio, es obligada la determinación de DSA. Un artículo sugiere que podría mejorarse el diagnóstico de ABMR activo utilizando los distintos “scores” histológicos en forma de una ecuación-curva de regresión, que nos diera la probabilidad de rechazo, más que con puntos de corte fijos como se hace actualmente [2] [9] [11] [12] [13].
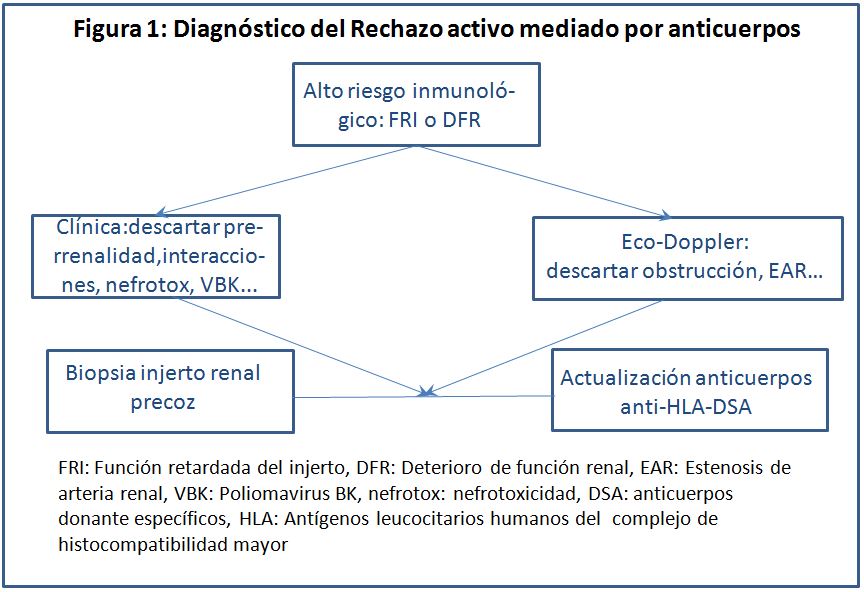
El diagnóstico de ABMR en la práctica clínica:
La presentación clínica más frecuente hoy del ABMR activo es un deterioro de función renal (DFR) o función retardada del injerto (FRI) prolongada, de causa no evidente, en cualquier momento de la evolución postrasplante, aunque más frecuente en los 3-6 primeros meses después del mismo.
La fiebre, malestar, oliguria o molestias sobre el injerto son poco frecuentes hoy, con los inmunosupresores potentes actuales. Puede haber datos poco específicos asociados como hipertensión arterial (HTA) o proteinuria.
Los factores de riesgo para el desarrollo de ABMR activo son: la presencia de anticuerpos anti-HLA preformados y los factores de riesgo sensibilizantes pretrasplante: transfusiones, gestaciones o trasplantes previos. Y, más en concreto, la existencia de una elevada tasa de anticuerpos reactivos frente al panel (PRA) y, frente a un donante concreto, la presencia de DSA en el momento del trasplante o históricos [14].
Las técnicas de imagen, como la ecografía-doppler, sirven para descartar otras causas de deterioro de función renal, pero no aportan datos específicos de ABMR activo.
No hay que olvidar, por otro lado, que el patrón oro para el diagnóstico de ABMR activo es el estudio histológico de la biopsia del injerto renal, con los criterios mencionados anteriormente combinado con el estudio serológico de DSA, anti-HLA u otros (o, en su defecto el estudio transcripcional de genes validados). También la biopsia es el único medio que nos permite diagnosticar el rechazo subclínico [2].
Todo lo dicho anteriormente se resume en un algoritmo de decisiones en la (Figura 1).
PREVENCIÓN
Medidas generales de prevención del ABMR activo precoz:
La prevención del ABMR activo precoz se inicia por unas medidas generales a intentar cumplir en la medida de lo posible:
- Evitar transfusiones de sangre en los pacientes en lista de espera de trasplante renal o que puedan estar en la misma potencialmente en el futuro. Y para ello hacer un uso adecuado de los medios de tratamiento de la anemia renal, en especial el hierro intravenoso y los agentes estimulantes de la eritropoyesis.
- En el momento del trasplante favorecer la compatibilidad HLA. E intentar evitar la incompatibilidad de clase II por su mayor impacto en el ABMR crónico activo.
- Y, sin duda, el factor de riesgo más importante, evitar el trasplante con DSA preformados, actuales o históricos [14]. En los pacientes con ABMR activo de aparición precoz (primer mes) y que no tenían DSA al trasplante ni históricos, debe aceptarse que tenían células B de memoria y, por tanto, la evaluación de esta respuesta B de memoria podría ayudar a estratificar mejor el riesgo [15].
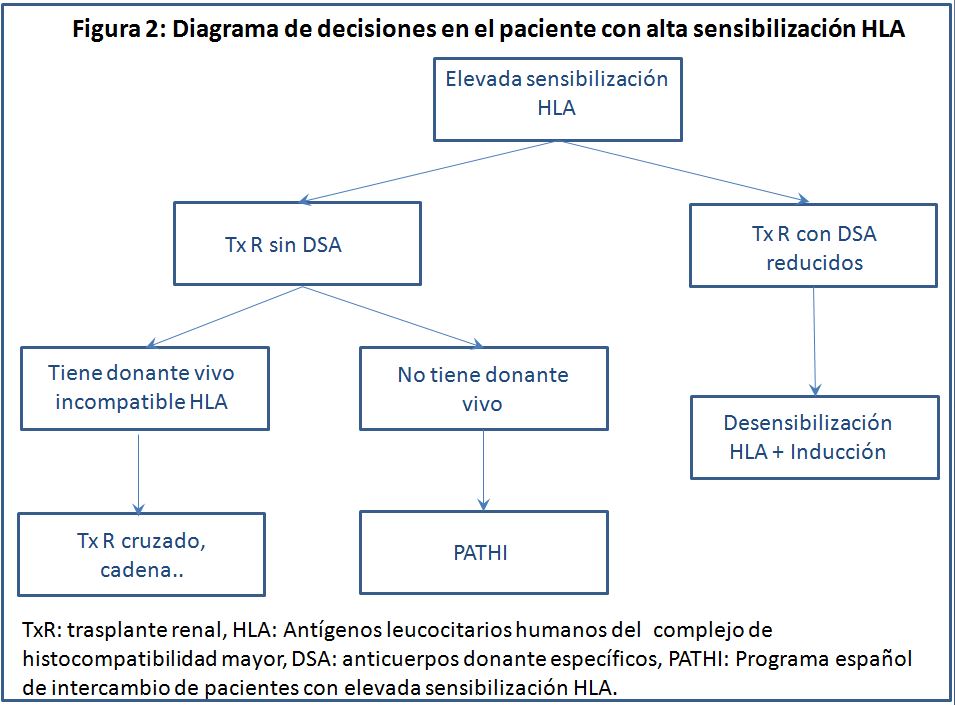
Por otro lado, en pacientes en lista de espera, que ya se les conoce una elevada sensibilización HLA tendremos que hacer una valoración cuidadosa de las posibilidades del paciente o bien para llevarlo a un trasplante sin DSA: trasplante cruzado (si tiene donante vivo incompatible HLA), o, si no tiene donante vivo, donante cadáver con priorización o programas de intercambio especiales para hipersensibilizados (programas PATHI, Eurotransplant acceptable mismatch program, etc). O, en último término, intentar una estrategia de desensibilización para reducir la tasa de los DSA y que el trasplante sea posible [14].
La prueba cruzada por citometría de flujo, según sea positiva o negativa, permite una estratificación del riesgo ligado al trasplante, sin ser un condicionante absoluto.
El algoritmo de decisiones al respecto se resume en la (Figura 2).
Antes de entrar en las medidas concretas que adoptaremos en las técnicas de desensibilización o tratamiento del ABMR activo, se aporta una panorámica de los diferentes medios de que disponemos, según su mecanismo de acción, para luchar contra los anticuerpos anti-HLA16 (Tabla 2). La evidencia disponible que respalda el uso cada uno de estos agentes es variable y se abordará en las siguientes secciones de este capítulo.
Desensibilización como medio de prevención del ABMR activo precoz:
Como se ha visto en el punto anterior, una de las estrategias posibles para conseguir un trasplante con éxito en los pacientes con elevada sensibilización HLA es conseguir, previamente al trasplante, una importante reducción de DSA y practicar el trasplante en estas condiciones y con una inducción adecuada. Al proceso mediante el cual conseguimos reducir la tasa de anticuerpos se le denomina desensibilización. Requieren una programación en el tiempo para, una vez reducido adecuadamente el nivel de DSA, proceder al trasplante. Ello hace que sean prácticamente exclusivas del donante vivo, cuando hay una incompatibilidad HLA entre donante y receptor. Para poder aplicar esta estrategia en donante cadáver, en pacientes con una batería muy amplia de anticuerpos anti-HLA frente a la mayor parte de donantes, se requiere además de la desensibilización, una priorización en la lista de espera, para que en el momento en que el paciente alcance niveles bajos de anticuerpos, le puedan llegar ofertas renales, siendo alguna de ellas compatible y practicarse el trasplante.
La primera pregunta que suscitan estas técnicas es su justificación, es decir si aportan o no una ventaja de supervivencia en comparación a permanecer en lista de espera hasta obtener un trasplante de donante cadáver HLA-compatible (frente al que no tenga DSA preformados). Dos estudios recientes, multicéntricos, retrospectivos, de casos y controles, ambos con un muy elevado número de pacientes (uno con más de 11000 pacientes y el otro con más de 25000) han estudiado el tema y llegaron a conclusiones diferentes sobre si los pacientes con sensibilización HLA que reciben un riñón de un donante vivo incompatible HLA, previa desensibilización, tienen o no un beneficio de supervivencia del paciente en relación a permanecer en lista de espera y ser trasplantado con un riñón de un donante cadáver compatible. En definitiva, podríamos concluir de lo que aportan ambos estudios que la desensibilización es posible y el paciente puede trasplantarse, pero no está claro si ello conlleva un beneficio de supervivencia comparativamente al trasplante de cadáver convencional [17] [18].
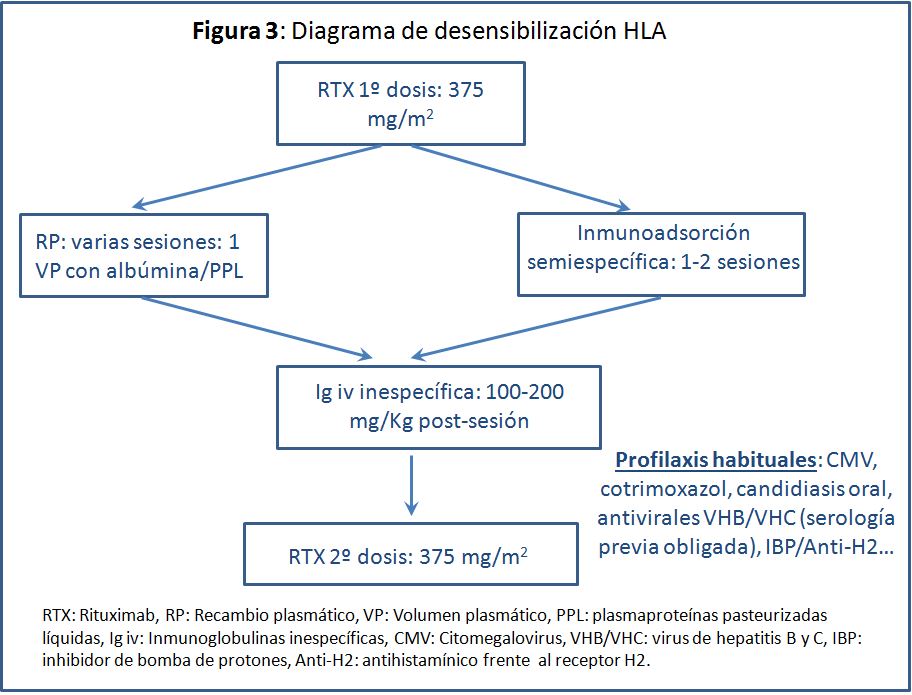
En la desensibilización se combina una técnica para extraer anticuerpos preformados del organismo, plasmaféresis (RP: recambio plasmático) o inmunoadsorción (IA), con inmunoglobulina policlonal (Ig iv) para bloquear los anticuerpos circulantes y frecuentemente con rituximab (RTX), para intentar evitar la síntesis de nuevos anticuerpos. En la variante más empleada se practican recambios plasmáticos (RP) (en número variable de sesiones, según la tasa de DSA) con infusión de Ig iv a dosis bajas (100-200 mg/Kg) después de cada sesión de RP. Algunos autores han utilizado inmunoglobulina hiperinmune frente a citomegalovirus, con similares resultados y sin que existan estudios comparativos entre la policlonal y la CMV-hiperinmune, defendiendo estas últimas sobre todo por su efecto antiviral [19] [20]. Una variante del mismo asocia Rituximab (generalmente 2 dosis de 375 mg/m2 antes de iniciar los recambios plasmáticos y al final de los mismos) al protocolo anterior. Otra variante con la que se están obteniendo buenos resultados es practicando inmunoadsorción semiespecífica (IA SE) en lugar de RP [14] [21] [22] [23] [24] [25].
Un protocolo práctico de desensibilización se esquematiza en la (Figura 3).
Ha habido intentos previos, históricos, de aplicar sólo alguna de las medidas citadas, p.ej. sólo inmunoglobulinas inespecíficas a dosis elevadas, y no ha sido eficaz [25].
Un planteamiento alternativo, prometedor, pero de momento con un solo estudio publicado de 25 pacientes, es la utilización, asociada a otros tratamientos, de la IgG endopeptidasa de Streptococcus pyogenes (IdeS) que se comporta como unas “tijeras químicas” que rompen las inmunoglobulinas y reducen o eliminan de manera significativa los anticuerpos HLA, permitiendo el trasplante. Administrando una sola dosis de IdeS antes del trasplante, inducción con globulina antitimocítica (ATG) de caballo 4 días o alemtuzumab dosis sc de 30 mg 4 días y terapia inmunosupresora convencional, permitió el trasplante en 24 de 25 pacientes altamente sensibilizados (1 única pérdida por rechazo hiperagudo). Opcionalmente recibieron Ig iv y/o RTX postrasplante. En los 24 pacientes en que se consiguió éxito inicial en el trasplante, los resultados a nivel de función renal y supervivencia de injerto y paciente son aceptables. Hubo eventos infecciosos, pero fueron controlables. No obstante, hay que interpretar con precaución estos datos por el bajo número de pacientes del estudio, además de que a partir de 1-2 semanas postrasplante se producía un rebote de la tasa de anticuerpos en la mayoría de pacientes (que parecía ser prevenido en alguna medida en los pacientes que habían recibido Ig iv y RTX), que daba lugar, a su vez, a un porcentaje significativo de rechazos activos mediados por anticuerpos Así, pues, los resultados a medio/largo plazo están por definir [26].
Sobre el posible papel en la desensibilización de otras sustancias como eculizumab o bortezomib hay muy pocos datos y de muy baja calidad de evidencia. En una serie de 26 pacientes altamente sensibilizados frente al donante, eculizumab redujo de manera importante la tasa de ABMR activo (7.7%), reduciendo también la tasa de ABMR en los pacientes que desarrollaron altos niveles de DSA precoces postrasplante [27]. No parece efectivo en la prevención futura de ABMR crónico activo [27]. Sobre bortezomib en desensibilización los datos publicados o comunicados son de calidad muy baja, series con bajo número de casos o casos únicos, existiendo además con frecuencia datos contradictorios o no confirmados en la literatura, o incluso comunicados, pero no publicados [14] [28] [29].
Inducción y mantenimiento en la prevención del ABMR activo:
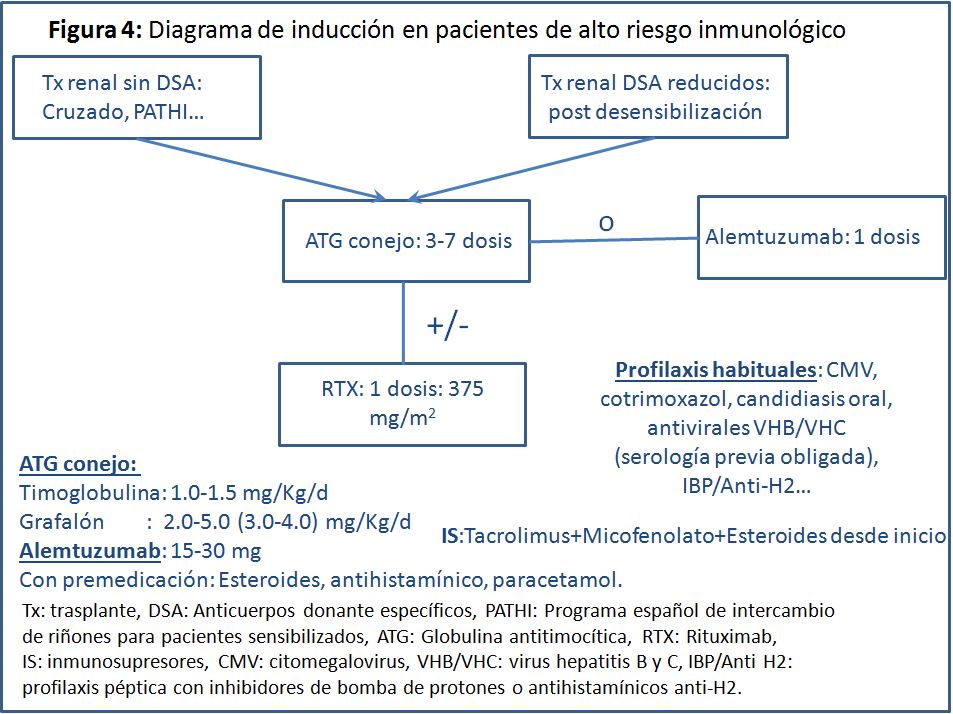
En pacientes de alto riesgo inmunológico, entendiendo por tal, pacientes con sensibilización HLA, una inducción potente ayuda a prevenir el rechazo mediado por anticuerpos. La podemos aplicar tanto a pacientes con sensibilización HLA en que el trasplante se consigue hacer sin DSA, como en pacientes con DSA negativizados o minimizados tras una pauta de desensibilización.
Hay acuerdo en las diferentes publicaciones en realizar la inducción con un anticuerpo antilinfocitario, policlonal o monoclonal potente, siendo los más utilizados habitualmente hoy globulina antitimocítica (ATG) de conejo (anteriormente se utilizó de caballo) y alemtuzumab, un anti-CD52, que se expresa fuertemente en la membrana linfocitaria. Los estudios muestran que esta inducción potente en estos pacientes tiene ventajas tanto sobre placebo como sobre los antagonistas del receptor de la interleucina 2, menos potentes, como basiliximab o daclizumab [14] [30].
En relación a ATG, dos revisiones recientes han mostrado que cinco ensayos clínicos aleatorizados han enfrentado a ATG (de caballo o de conejo) frente a placebo o antagonista del receptor de IL-2 (basiliximab o daclizumab) en inducción en pacientes de alto riesgo inmunológico. De ellos 3 con ATG de conejo, uno frente a placebo y 2 frente a daclizumab. En todos ellos se demostró la reducción de incidencia de rechazo agudo, así como de la gravedad del mismo, en el grupo ATG. Con una mayor incidencia de infecciones en ese mismo grupo, sin repercusión en la supervivencia del paciente. Estos estudios apoyan fuertemente el uso de inducción con ATG en los pacientes de alto riesgo inmunológico [14] [30].
En relación a alemtuzumab, comparativamente con ATG, cinco ensayos clínicos aleatorizados, 3 de ellos con pacientes de alto riesgo inmunológico y los otros 2 incluyendo pacientes de alto y bajo riesgo inmunólógico, han enfrentado una dosis única de alemtuzumab (de 15-30 mg) frente a un número variable de dosis y dosis total acumulada de ATG de conejo (3 a 7 dosis de 1-1.50 mg/Kg). Ninguno de ellos ha mostrado diferencias en tasa de rechazo agudo comprobado por biopsia (RACB), pérdida de injerto, mortalidad de paciente ni infecciones [14] [28] [30] [31].
Hay datos menos claros en relación a si la adición de RTX a las medidas anteriores consigue un beneficio suplementario en inducción en estos pacientes. En un ensayo clínico aleatorizado de 280 trasplantados renales de cualquier riesgo inmunológico, una dosis única de RTX frente a placebo en inducción no reducía la incidencia de RACB del grupo RTX frente al grupo placebo. Pero, cuando se dividía a los pacientes en alto riesgo inmunológico (retrasplante o PRA > 6%) y bajo riesgo inmunológico, los pacientes de alto riesgo inmunológico que no recibían RTX tenían una tasa de RACB muy superior a la de los pacientes de alto riesgo inmunológico que habían recibido RTX y los grupos de bajo riesgo inmunológico, hubieran recibido o no RTX (38.2 % frente a 17,9 %, 16.4 % y 15.7 %). Por otro lado, a 24 meses no aumentaba la incidencia de infecciones ni tumores, aunque sí la de neutropenia (24.3 % frente a 2.2 %) [32]. Todo ello apoyaría el uso de RTX en pacientes con sensibilización HLA, aunque su uso en esta indicación no es generalizado, pues discutiéndose su eficacia sumatoria, aumenta el riesgo de efectos secundarios y los costes [14] [33] [34].
Los diferentes anticuerpos, mono o policlonales, citados arriba no están exentos de efectos secundarios graves en el momento de su administración o posterior. Hay que tener en cuenta que alguno de ellos procede de otra especie animal. Por ello requieren premedicación, habitualmente con esteroide, antihistamínico y paracetamol. Y, evidentemente, aumentan el riesgo infeccioso, por lo que deberán cuidarse las profilaxis habituales frente a citomegalovirus (CMV), candidas y pneumocystis. También será obligado disponer de serología frente a virus de hepatitis B y C (VHB y VHC) para tratar en su caso.
En la (Figura 4) se adjunta un diagrama práctico de inducción en pacientes de alto riesgo inmunológico.
Después de la inducción, en estos pacientes se indicará un protocolo de mantenimiento de triple terapia convencional con tacrolimus, un micofenolato y esteroides, evitando la suspensión de esteroides y evitando que los niveles sanguíneos de tacrolimus o la dosis de micofenolato sean bajas.
Sobre belatacept hay datos contradictorios en relación a la producción de DSA y riesgo de ABMR activo. Si por un lado ha demostrado menor desarrollo de DSA a largo plazo, también ha mostrado mayores tasas de rechazo agudo a corto plazo, y no hay evidencia de su eficacia en pacientes de alto riesgo [14].
En el momento actual no hay evidencia suficiente para recomendar en estos pacientes de alto riesgo inmunológico un protocolo del tipo empleado en el ensayo clínico TRANSFORM [35], que incluyó tacrolimus y everolimus, con exposición reducida a tacrolimus, dado que en este ensayo clínico se excluyeron los pacientes de riesgo inmunológico elevado.
Sin embargo, en un estudio retrospectivo, de cohortes, de centro único, reciente, que comparaba esteroides y tacrolimus en ambos grupos combinados con micofenolato vs inhibidor m-TOR en 71 pacientes de alto riesgo inmunológico, no mostraba diferencias clínicas ni histológicas significativas entre ambos grupos en los primeros 12 meses postrasplante. Es relevante hacer notar que los niveles sanguíneos de tacrolimus en ambos grupos fueron similares a lo largo de todo el primer año, es decir, que no había una exposición reducida a tacrolimus [36].
Si se plantea un cambio de inmunosupresión, por efectos secundarios u otras razones, en estos pacientes de alto riesgo inmunológico (sensibilización HLA o retrasplantes), es obligada previamente la monitorización de anticuerpos anti-HLA (en especial DSA). Y en pacientes de muy alto riesgo inmunológico (sensibilización HLA a tasa elevada o DSA) es recomendable una biopsia del injerto previa.
Uno de los posibles cambios que podría plantearse es la conversión de un inhibidor de la calcineurina (ICN) a un inhibidor m-TOR. Sin embargo, esta conversión, especialmente si es precoz, en los primeros 6 meses postrasplante, se ha visto que favorece la producción de DSA de novo y de ABMR activo. También lo favorecen las estrategias de eliminación o minimización extrema del ICN en general [14] [37].
También deben tenerse en cuenta, evitando si es posible o monitorizando estrechamente las interacciones con los inmunosupresores que pudieran llevar a una inmunosupresión infraterapéutica y riesgo de rechazo activo o formación de DSA (introducción de inductores potentes o suspensión de inhibidores potentes de los enzimas microsomiales).
En definitiva, podría resumirse la inmunosupresión de mantenimiento en pacientes de alto riesgo inmunológico (sensibilización HLA) en mantener un nivel de inmunosupresión elevado, basado en un ICN y evitando estrategias de eliminación o minimización extrema del ICN.
TRATAMIENTO DEL ABMR ACTIVO
Si no se ha conseguido evitar el desarrollo del ABMR activo, dada su gravedad, se ha intentado utilizar frente al mismo, la práctica totalidad de medidas que tenemos frente a los anticuerpos, esquematizadas en la (Tabla 2). Sin embargo, aisladamente, la mayor parte de las mismas han tenido poca eficacia y la mayor eficacia se ha conseguido con una combinación de las mismas.
Pasemos revisión a las evidencias existentes.
En relación a la Inmunoadsorción, en un ensayo clínico aleatorizado y controlado de diseño adecuado, pero con solo 5 pacientes por rama, realizándola con proteína A (9-14 sesiones), contra no hacerla y tratamiento convencional (que no incluía otros tipos de recambio plasmático), se obtuvo una fuerte evidencia a favor de la IA, pues la totalidad de pacientes del grupo IA (5 pacientes) recuperaron función renal, mientras que 4 de los 5 del grupo control permanecieron en diálisis [38].
Por el contrario, los RP, en dos revisiones recientes no han mostrado beneficio como medida aislada. De cuatro ensayos clínicos aleatorizados y controlados con un número de pacientes no elevado que han testado los RP como tratamiento único del ABMR activo, en solo uno de ellos se demostraba un beneficio claro de los mismos en recuperación de función renal. Aunque, algunos estudios observacionales sí encuentran beneficio [39] [40].
Los mejores resultados se han obtenido con la combinación de RP e Ig iv, como ya ocurría con la desensibilización. Un metaanálisis publicado recientemente, que incluyó 2 estudios observacionales retrospectivos de cohortes, incluyendo uno de ellos tanto ABMR agudo como ABMR crónico, mostraba beneficio sobre la supervivencia del injerto en el rechazo agudo, pero no en el crónico. Otro estudio observacional retrospectivo.mostró superioridad clara de la combinación de RP e Ig iv frente a solo RP [14] [39] [41].
A pesar de este nivel de evidencia no muy elevado, múltiples publicaciones consideran a esta pauta el tratamiento estándar del ABMR activo (standard of care) y lo utilizan de grupo control comparador de otros tratamientos, dado su uso generalizado [14] [39] [41].
Sobre RTX se realizó el ensayo clínico aleatorizado doble ciego RITUX-ERAH, que incluyó 40 pacientes, comparó rituximab añadido al tratamiento estándar (RP+Ig iv) con el tratamiento estándar y no demostró beneficio adicional del grupo que llevaba RTX añadido. El número de pacientes era bajo y el tiempo de seguimiento solo de 1 año [42]. Ambas ramas con un protocolo de RP e Ig iv tenían un 95% de supervivencia del injerto, lo cual, indirectamente, probaba la eficacia de un protocolo de RP e Ig iv [43].
Estudios retrospectivos de cohortes publicados previamente al RITUX-ERAH, con muchas limitaciones metodológicas, sí que mostraron beneficio claro en supervivencia del injerto de la adición de RTX a una pauta estándar con plasmaféresis e Ig iv [34] [39] [40] [44]. Del mismo modo estudios piloto con muy bajo número de pacientes han mostrado un beneficio claro en supervivencia del injerto de la adición de RTX a una pauta estándar con plasmaféresis e Ig iv [34] [39] [40] [44].
A pesar de las dudas que el ensayo clínico RITUX-ERAH pueda plantear sobre la eficacia sumatoria del RTX añadido al tratamiento estándar de RP e Ig iv, dado que es un único ensayo, con algunas limitaciones metodológicas, la existencia de otro tipo de estudios, de menor calidad de evidencia, en los que RTX sí que ha mostrado eficacia y el pobre pronóstico del ABMR activo que anima a poner todos los medios que nos ayuden a combatirlo, la tendencia actual de la mayoría de las unidades de trasplante renal es a añadir RTX al tratamiento.
Tiene interés citar que la realización de una sesión de plasmaféresis en las primeras 24-72 horas post-infusión de RTX altera de manera significativa la farmacocinética del mismo, y, como es esperable, cuanto más próximo a la infusión, mayor alteración. Por lo que se aconseja no realizar recambios plasmáticos hasta pasadas 72 horas de la infusión de RTX (mínimo 48 horas) [45].
Dado el importante papel que juega el sistema del complemento en el daño producido por el ABMR activo, también los inhibidores del complemento a diferentes niveles, y, en especial, el eculizumab han sido testados como parte del tratamiento del ABMR activo.
Hay un estudio aleatorizado de inhibición de C1 en ABMR activo con 18 pacientes, enfrentando el inhibidor C1 a placebo y en las 2 ramas tratamiento estándar con RP e Ig iv, sin diferencias en supervivencia del injerto en el día 20, aunque menor glomerulopatía del trasplante a los 6 meses (0/7 frente a 3/7) [46]. Y también sobre el mismo, algunas publicaciones observacionales aisladas [47].
No hay estudios aleatorizados de eculizumab en tratamiento de ABMR activo (sí en ABMR crónico). Hay varios estudios observacionales, con un número bajo de pacientes tratados con eculizumab en ABMR activo, la mayoría en rescate en relación al tratamiento convencional. En general muestran tendencia a cierto beneficio en estos casos en que ha fallado todo el tratamiento convencional [39] [40] [48] [49]. Una observación interesante de uno de ellos es que la combinación de esplenectomía con eculizumab tenía una eficacia total en el rescate, aunque la eficacia de cada uno por separado era muy discreta [50].
Dada la limitación de datos existente, los inhibidores del complemento no suelen utilizarse en primera línea en el tratamiento del ABMR activo. Su utilización se limita a rescate en pacientes que no han respondido al tratamiento estándar.
También la experiencia es muy limitada con bortezomib. En un ensayo clínico aleatorizado publicado con 29 pacientes y 3 ramas: (bortezomib, ATG, plasmaféresis vs RTX, ATG, plasmaféresis vs ATG, plasmaféresis) no hubo diferencias entre las 3 ramas en supervivencia del injerto a 3 años [39]. Otro estudio observacional con 51 pacientes y 56 episodios de ABMR activo y un seguimiento prolongado sí que mostró beneficio tanto en reversión del ABMR activo histológico como en reducción de niveles de DSA [40].
De manera que sobre el posible uso de bortezomib en tratamiento de ABMR activo se puede decir algo muy similar a lo dicho de los inhibidores del complemento, su empleo queda reducido básicamente a rescate.
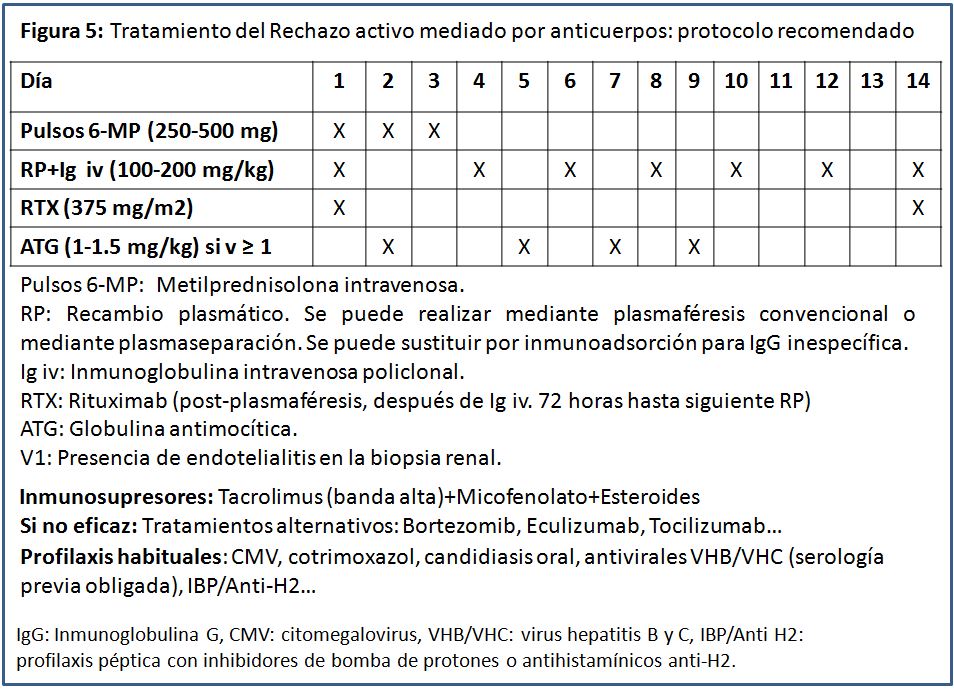
Dadas las interacciones existentes entre inmunidad celular y humoral en el tratamiento del ABMR activo, se incluyen siempre pulsos de 6-metilprednisolona y, caso de objetivarse daño vascular en la biopsia, ATG.
Dado que todos estos potentes tratamientos favorecen el desarrollo de todo tipo de infecciones, en especial oportunistas, habrá que añadir las profilaxis habituales, como ya se ha desarrollado en un punto anterior.
En la (Figura 5) se muestra un diagrama práctico del tratamiento del ABMR activo.
Finalmente añadir que un grupo francés ha desarrollado y validado un índice pronóstico para predecir la supervivencia del injerto después de un episodio de ABMR activo. Incluye la tasa de filtración glomerular (TFG) en el momento del diagnóstico de ABMR agudo, así como los índices de fibrosis intersticial y atrofia tubular en la biopsia en el momento del diagnóstico de ABMR agudo, además el cambio relativo de TFG después del tratamiento, el cambio en capilaritis peritubular antes y después del tratamiento y el cambio en intensidad de fluorescencia media (MFI) de los DSA antes y después del tratamiento. Podría utilizarse para comprobar de manera precisa la eficacia de diferentes tratamientos en ensayos clínicos o para tomar decisiones clínicas con una base más precisa. Permite clasificar a los pacientes en 3 grupos: de alto riesgo (supervivencia del injerto a 6 años 6%, índice > 6.76), riesgo medio (supervivencia del injerto a 6 años 44.9%, índice 5.96-6.76), bajo riesgo (supervivencia del injerto a 6 años 84.4%, índice < 5.96) [51].
CONCLUSIONES Y RECOMENDACIONES DEL GRUPO PROMETEO:
El diagnóstico del ABMR activo se basa en los criterios de Banff 2017 e incluye la biopsia del injerto renal con datos de lesión tisular aguda y de interacción de los anticuerpos con el endotelio vascular. También debe incluir la evidencia serológica de DSA.
Las soluciones posibles para facilitar el trasplante renal en los pacientes con alta sensibilización HLA incluyen: en el caso de que el receptor disponga de un donante vivo incompatible puede optar a los programas de intercambio de donantes, la desensibilización, o incluso la combinación de ambas estrategias; en el caso de que no se disponga de un donante vivo, los programas de priorización en lista de espera e intercambio renal (como el español, PATHI) son la mejor opción para el paciente. Aunque sea más complejo, también pueden acoplarse estrategias de desensibilización a los programas de priorización con donante cadáver.
La desensibilización HLA a día de hoy se asienta sobre una pauta combinada de RP o IA, Ig iv y RTX.
La inducción en pacientes de alto riesgo inmunológico debe incluir siempre un anticuerpo antilinfocitario, mono o policlonal, potente, como ATG o alemtuzumab. Sería opcional la adición de RTX.
El tratamiento del ABMR activo debe incluir pulsos de esteroides, RP, Ig iv y RTX. Y, sólo si hay daño vascular significativo, ATG. En terapias de rescate cualquier medida es legítima.
En estos pacientes debe evitarse una inmunosupresión de mantenimiento de baja intensidad, y ésta debe incluir siempre un ICN.
Considerando los tratamientos potentes que reciben estos pacientes y su elevado riesgo infeccioso, se debe emplear una profilaxis infecciosa adaptada al perfil clínico del paciente y a la intensidad de la pauta inmunosupresora empleada.
Conflicto de intereses: Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.