Anticuerpos AntiHLA, Epidemiología y Factores de Riesgo
INTRODUCCIÓN
La presencia de anticuerpos anti-HLA donante específico (DSA) ha sido ampliamente descrita como factor de riesgo (FR) para el desarrollo del rechazo mediado por anticuerpos (ABMR) y, como consecuencia, para la disminución de la supervivencia del injerto [1]. Actualmente el ABMR es una de las principales causas reconocidas de pérdida tardía del injerto renal [2].
En los últimos años, la incidencia del ABMR se ha visto incrementada, en parte por el mayor número de trasplantes inmunológicamente complejos que se realizan (retrasplantes, trasplantes AB0 incompatibles…) y en parte por el avance en el diagnóstico de la presencia de DSA por medio del desarrollo de las técnicas de fase sólida [3].
Actualmente la investigación sobre la dinámica de los DSA, su impacto en la función del injerto y el desarrollo de terapias eficaces para su control representan uno de los campos en mayor expansión en el ámbito del trasplante renal (TR).
Conocer las circunstancias más favorables para el desarrollo de DSA, identificar cuales son los pacientes en riesgo y distinguir aquellas características que confieren mayor patogenicidad a estos anticuerpos, es crucial en el adecuado seguimiento del paciente portador de TR. Por tanto, el objetivo del siguiente documento de consenso es definir la epidemiologia y factores de riesgo de los DSA, así como su implicación en el desarrollo de ABMR.
EPIDEMIOLOGÍA
PREVALENCIA DE ANTICUERPOS ANTI-HLA
La sensibilización frente antígenos HLA precisa de la exposición a tejido humano. Las causas más frecuentes son, en orden de relevancia, los trasplantes previos, el embarazo y las transfusiones [4] (EVIDENCIA ALTA).
Existen situaciones en las que pacientes, sin factores sensibilizantes conocidos, presentan prueba cruzada por linfocitotoxicidad positiva. Esto sucede, principalmente, en las enfermedades de origen autoinmune (lupus eritematoso sistémico, artritis reumatoide, etc) como consecuencia de la polirreactividad de los anticuerpos existentes en cada una de estas patologías.
Prevalencia de la sensibilización pre-trasplante
Los últimos datos publicados en 2016 establecen más de un 20% de pacientes hipersensibilizados (PRA calculado >95%) en lista de espera de TR en España [5]. Este porcentaje es incluso superior en otros programas de trasplante en los que el porcentaje de pacientes con PRA calculado >95% representa el 30-40% del total de la lista de espera.
Epidemiología de los DSA
• preformados: presentes en el momento del trasplante. Los porcentajes reflejados en la literatura presentan una amplia variabilidad dependiendo de la política de trasplante de cada centro (realización de TR con o sin DSA, TR con DSA “permitidos”) y la técnica utilizada para su detección.
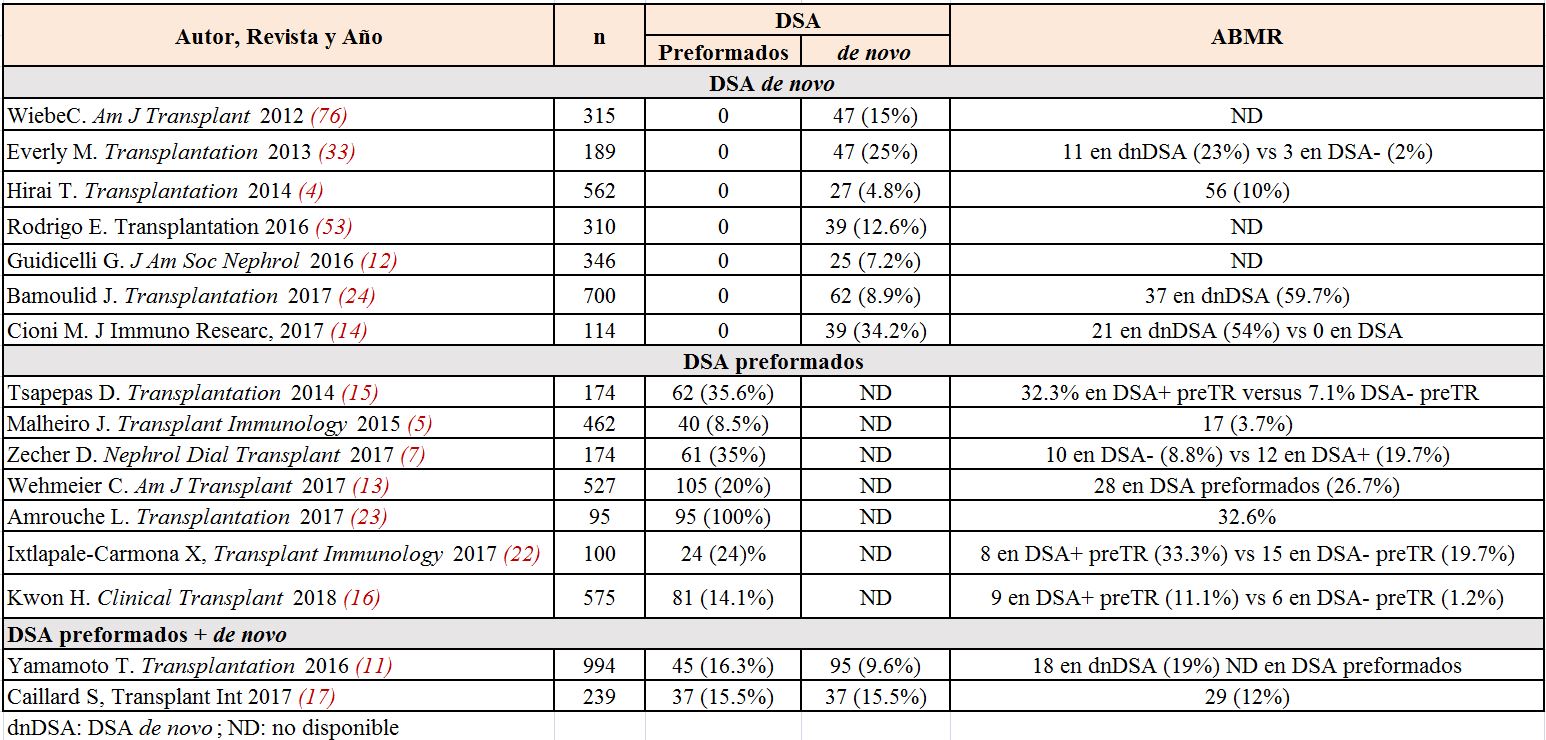
• de novo (DSAdn): aquellos que se desarrollan posteriormente a la realización del TR. También presentan incidencias muy variables (5-35%) dependiendo del riesgo inmunológico del paciente, del tipo de inmunosupresión recibida, la técnica de detección empleada, el punto de corte MFI y el momento post-TR en el que se realiza su determinación [6][7][8][9][10][11][12][13][14]. Aunque la cinética de aparición es variable, aparecen con mayor frecuencia en los primeros dos años post-TR con una incidencia anual a partir del segundo año del 1-5% [11][15] siendo preferentemente clase II.
INCIDENCIA ABMR
Es ampliamente reconocido que los pacientes con DSA tienen una mayor incidencia de cualquier tipo de rechazo agudo (celular, ABMR o mixto) en comparación con los pacientes sin DSA (EVIDENCIA ALTA).
Respecto al ABMR, según el tipo de DSA se pueden establecer diferentes fenotipos de rechazo:
• DSA preformados: rechazo subclínico y agudo precoz.
• DSAdn: rechazo subclínico, agudo tardío y crónico activo.
En la población trasplantada no sensibilizada pre-TR la incidencia reportada de ABMR a los dos años es del 1-1.5% [9] [16] teniendo a más largo plazo (>5 años) una incidencia global de un 3.5-5% [17] (EVIDENCIA MODERADA).
En los pacientes con DSA preformados distinguimos: (EVIDENCIA MODERADA).
• ABMR agudo: el riesgo es significativamente más elevado, alcanzando el 20-40% en los primeros 2 años post-TR [18] [19] [20] [21] [22] [23] [24]. Esta incidencia se mantiene incluso en pacientes sometidos a protocolos de desensibilización.
• ABMR crónico: la incidencia aumenta hasta el 40% en el 12º mes post-TR cuando se aceptan DSA con MFI elevado (>3000) pre-TR [20].
Sin embargo, algunos grupos han publicado incidencias mucho menores de ABMR agudo y crónico (hasta <5% en los primeros 24 meses post-TR) cuando se realizan estrategias que solo permiten DSA seleccionados según la clase y el MFI [16].
Por último, en los pacientes que desarrollan DSAdn, el riesgo de ABMR agudo y crónico está significativamente aumentado [7] [8] [11] [12] [15][25] comparado con los pacientes sin DSA (EVIDENCIA ALTA).
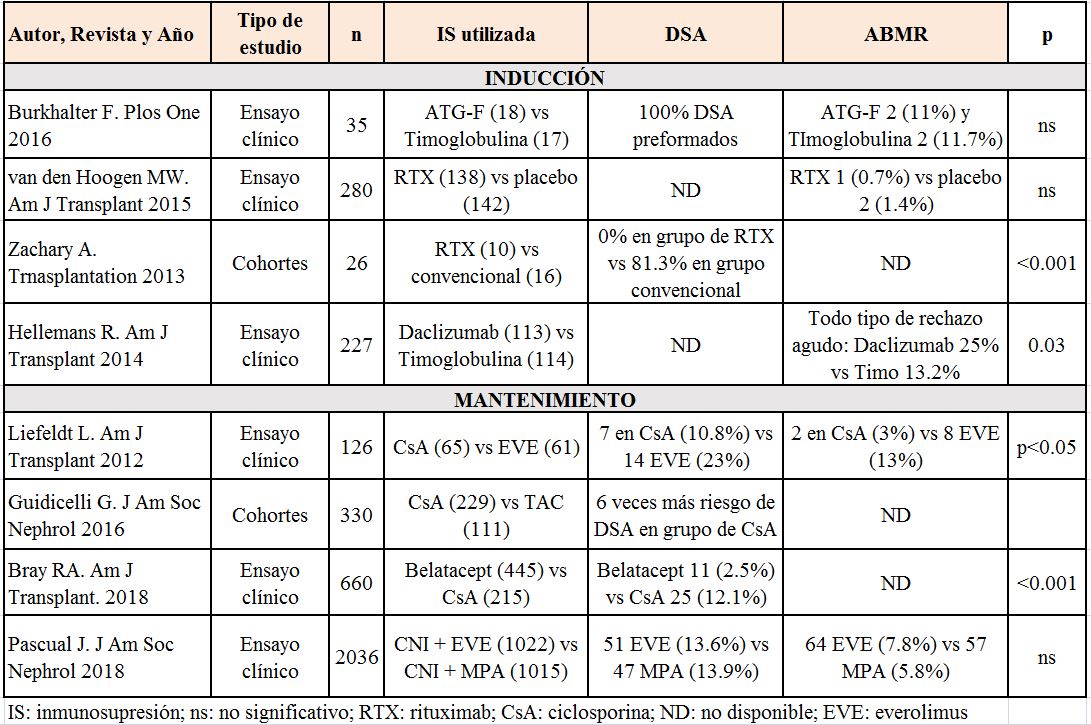
En la (Tabla 1) se recogen los datos epidemiológicos tanto de desarrollo de DSA como de ABMR de algunos de los artículos revisados.
FACTORES DE RIESGO
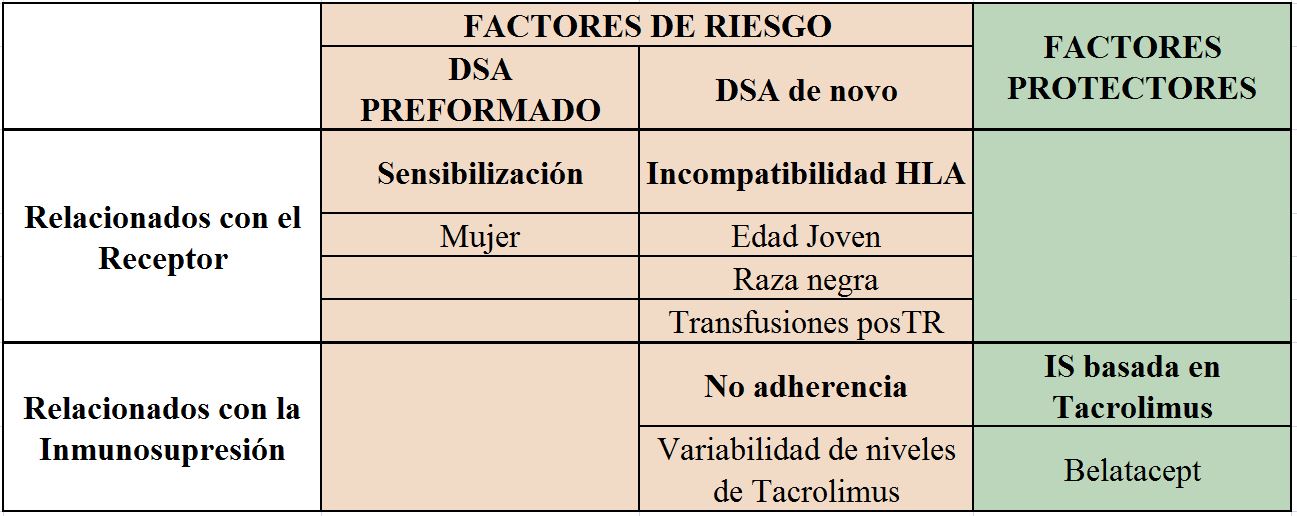
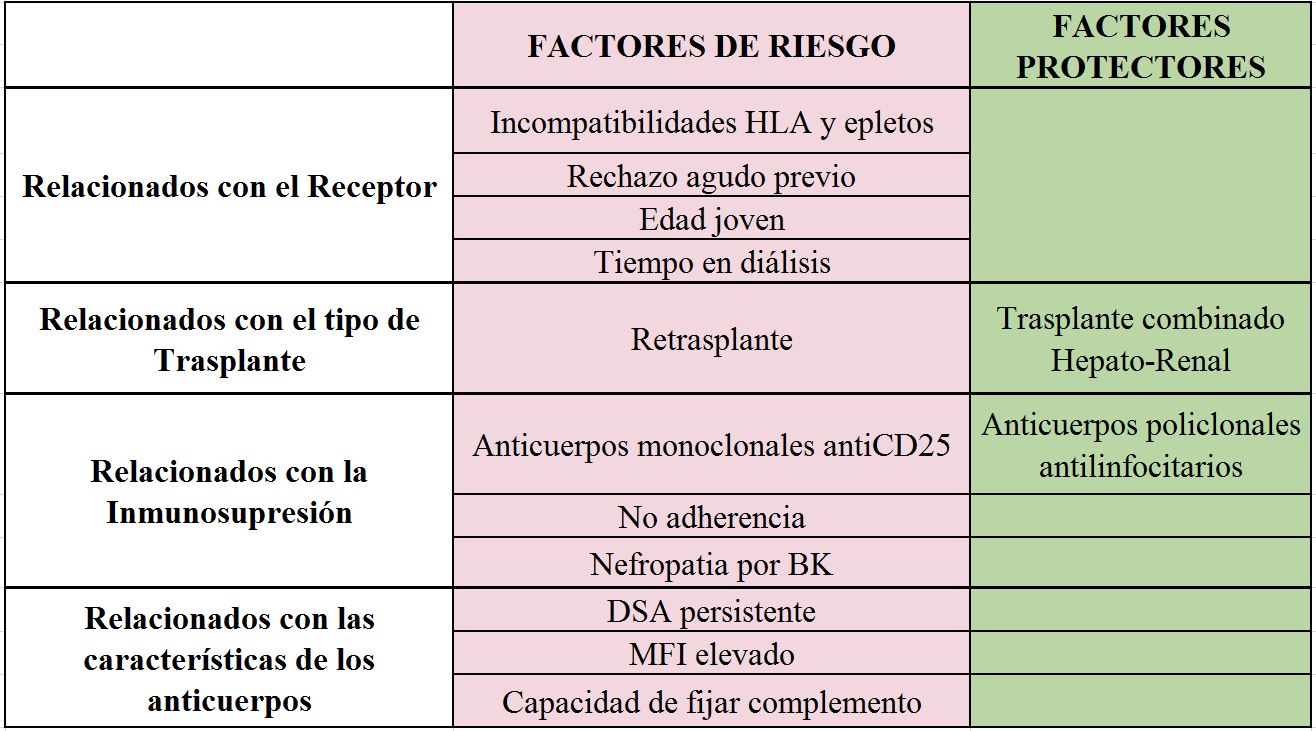
En las (Tabla 2) y (Tabla 3) se resumen los FR descritos tanto para el desarrollo de DSA como para la aparición de ABMR.
RELACIONADOS CON EL RECEPTOR
FR PARA LA PRESENCIA DE DSA PREFORMADOS:
El FR más relevante y necesario para la presencia de DSA pre-TR es, como decíamos previamente, la exposición a tejido humano (trasplante previo >> Embarazo > Transfusiones). Algunos artículos han descrito un mayor riesgo de DSA pre-TR en mujeres, incluso como factor independiente de gestaciones previas [26] (EVIDENCIA MODERADA-ALTA).
FR PARA EL DESARROLLO DE DSA DE NOVO:
A pesar de la mejora en los fármacos inmunosupresores, el mayor número de incompatibilidades HLA, especialmente DR y DQ es el FR principalmente reconocido para el desarrollo de DSAdn post-TR [6] [9] [11] [13][27] (EVIDENCIA ALTA).
Otros factores descritos en la literatura han sido la edad joven [8] [11] [21], la raza negra (en estudios realizados en EE. UU.), el antecedente de rechazo celular [28], y la realización de transfusiones post-TR [29] (EVIDENCIA MODERADA).
FR PARA LA APARICIÓN DE RECHAZO MEDIADO POR ANTICUERPOS:
Existe una asociación directa entre el grado de incompatibilidad, especialmente de clase II, y la incidencia de ABMR [30] [31]. Así mismo, el antecedente de un rechazo celular, clínico o subclínico, aumenta el riesgo de un posterior ABMR [28] [32]. Ambos factores, incompatibilidades HLA y el antecedente de rechazo celular, son los FR más reconocidos para el ABMR (EVIDENCIA MODERADA). Se han descrito otros factores asociados como la edad joven o el tiempo en diálisis, pero con un nivel de evidencia bajo.
RELACIONADOS CON EL TIPO DE TRASPLANTE/DONANTE
RETRASPLANTE
La historia de trasplantes previos es uno de los FR más determinantes para el desarrollo de DSA preformados [3]. Como consecuencia, el número de TR previos se relaciona con un mayor riesgo de desarrollar cualquier tipo de rechazo en general y ABMR en particular [34]. En un trabajo retrospectivo analizando los factores predictores para el ABMR en dos cohortes de pacientes hiperinmunizados, la existencia de TR previos fue un factor diferenciador que se asoció con un riesgo significativamente más elevado de sufrir un ABMR [21] (EVIDENCIA MODERADA).
DONANTE CADAVER/VIVO:
Tradicionalmente el TR de donante fallecido se ha relacionado con un mayor riesgo inmunológico en comparación con el TR de donante vivo. Sin embargo, diferentes estudios en la última década no han encontrado diferencias estadísticamente significativas en el porcentaje de ABMR entre ambos grupos [13] [31], aunque la presencia de DSA parece ser más deletérea en los TR de donante fallecido en comparación con el TR de vivo [35]. Por otro lado, en un metanálisis recientemente publicado, el porcentaje de TR de donante vivo/fallecido fue descrito como factor de confusión para la aparición de ABMR, dado que los estudios con mayor porcentaje de TR de donante vivo presentaban una incidencia significativamente menor de ABMR en comparación con los estudios que incluían una mayoría de TR de donante fallecido [1]. Por tanto, con los datos disponibles en el momento actual, el mayor riesgo de desarrollo de ABMR y DSA en el receptor de donante fallecido es controvertido (EVIDENCIA BAJA)
DONANTE DE ASISTOLIA/MUERTE ENCEFÁLICA:
El daño por isquemia y la inflamación del injerto se han descrito como un FR para el desarrollo de DSA. Sin embargo, en un estudio reciente no se encontraron diferencias en la incidencia de ABMR entre dos grupos comparables de donante de muerte encefálica versus donante de asistolia no controlada [17] (EVIDENCIA BAJA).
AB0 INCOMPATIBLE:
El trasplante renal de donante vivo con incompatibilidad de grupo sanguíneo representa una alternativa eficaz y segura en determinados pacientes en lista de espera de TR, habiéndose descrito excelentes resultados de supervivencia tanto de paciente como de injerto con escasa incidencia de rechazo [36]. Algunos estudios han estudiado específicamente la relación entre la incompatibilidad de grupo y el riesgo de ABMR, sin encontrarse un riesgo significativamente aumentado ni de ABMR agudo [37] ni crónico [38]. Incluso un título más elevado de anticuerpos anti-A/B tampoco implica un mayor riesgo de ABMR (EVIDENCIA MODERADA).
TRASPLANTE COMBINADO HEPATO-RENAL:
El riesgo de desarrollar ABMR tanto agudo como crónico es significativamente menor en pacientes con DSA portadores de trasplante combinado hepato-renal en comparación con pacientes con DSA con TR aislado. En pacientes con DSA preformados que reciben un trasplante combinado hepato-renal se ha observado una desaparición de los anticuerpos tras el trasplante en caso de los DSA de clase I; los clase II, especialmente los anticuerpos antiDQ, suelen sin embargo persistir tras el trasplante [39] (EVIDENCIA BAJA).
RELACIONADOS CON EL TRATAMIENTO INMUNOSUPRESOR
INDUCCIÓN:
ANTICUERPOS POLICLONALES ANTILINFOCITARIOS:
La inducción con anticuerpos policlonales antilinfocítarios, comparada con anticuerpos monoclonales antiCD25, en pacientes sensibilizados, se asocia a un menor riesgo de DSAdn, rechazo celular y ABMR [34] [40]. Cuando se han analizado los resultados con los diferentes tipos de inmunoglobulinas antitimocitos más utilizadas en la actualidad (Timoglobulina? y Grafalón?), no se encontraron diferencias en la incidencia ni de rechazo celular ni de ABMR (estudio prospectivo con biopsias de protocolo) [41] (EVIDENCIA MODERADA)
RITUXIMAB (RTX):
El RTX induce depleción a largo plazo de los linfocitos B en sangre periférica con escasa toxicidad. Su uso en el TR está especialmente focalizado en los protocolos de desensibilización, así como en el TR AB0 incompatible. En cuanto a su uso como tratamiento de inducción en TR existen datos controvertidos en estudios retrospectivos respecto a la menor incidencia de desarrollo de DSAdn en pacientes que reciben Rituximab [6] [23]. En un estudio prospectivo randomizado publicado en 2015, el tratamiento con una sola dosis de RTX en la inducción no demostró un descenso en la incidencia de ABMR en el total de los pacientes incluidos, aunque sí se objetivó una menor incidencia e ABMR en el subgrupo de pacientes con mayor riesgo inmunológico [42] (EVIDENCIA MODERADA).
MANTENIMIENTO:
La minimización en la inmunosupresión (IS) de mantenimiento ha sido descrita como uno de los FR determinantes para el desarrollo de DSAdn [32]. En este sentido la no adherencia es uno de los FR más reconocidos para el desarrollo tanto de DSA de novo como de ABMR, y de pérdida precoz del injerto [2][3][4][27] (EVIDENCIA ALTA-MODERADA). En particular, en aquellos pacientes con antecedente de rechazo celular, clínico o subclínico, está incrementado el riesgo tanto de DSAdn como de ABMR, por tanto, en este subgrupo de pacientes la minimización de la IS no debería realizarse salvo indicación, analizando riesgo/beneficio en cada caso particular [28][32]. (EVIDENCIA MODERADA).
En este sentido también se ha relacionado la Nefropatía por BK con un mayor riesgo de desarrollo de DSA [27]. Probablemente este hecho se relaciona nuevamente con una mayor minimización de la IS de mantenimiento, aunque se especula sobre el papel de la inflamación secundaria a la NBK en el desarrollo de los DSA (EVIDENCIA BAJA).
• Esteroides: existen datos controvertidos sobre la influencia de la suspensión precoz de Esteroides en la incidencia tanto de rechazo agudo como de progresión de la fibrosis del injerto [43] [44]. De forma más específica recientemente se reportó que la suspensión de esteroides, en una población seleccionada de bajo riesgo inmunológico, no se relacionaba con un incremento en el riesgo de aparición de DSAdn (Alonso J, SET2018) (EVIDENCIA BAJA).
• Anticalcineurínicos (ICN): desde los años 90 diferentes trabajos abordaron el tema de la nefrotoxicidad secundaria a los ICN planteando como alternativa terapéutica la minimización o incluso la retirada de estos fármacos. Sin embargo, aunque la nefrotoxicidad por ICN podría ser parcialmente evitada, el mayor riesgo de rechazo del injerto se hizo evidente [45]. Cuando se han analizado las diferencias entre los dos tipos de ICN disponibles, el Tacrolimus parece inhibir de forma más potente la respuesta aloinmune. En un trabajo observacional analizando los FR para la aparición de DSAdn la IS basada en Ciclosporina, versus Tacrolimus, se describió como un FR independiente para el desarrollo de DSA de novo [9]. Por otro lado, está reconocida la relevancia de la alta variabilidad de los niveles plasmáticos de Tacrolimus en la progresión de lesiones crónicas en el TR [46], siendo también descrita como un fuerte FR tanto para el desarrollo de DSAdn como de reducción de la supervivencia del injerto [33] (EVIDENCIA MODERADA).
• imTOR: estudios previos de baja calidad (unicéntricos y retrospectivos) señalaban un mayor riesgo de DSAdn en pacientes tratados con un régimen IS libre de ICN y basado en imTOR en el primer año post-TR [47][48][49]. Esto adquiría mayor relevancia en los estudios que mantenían niveles bajos de imTOR. Sin embargo, no se establecía una clara asociación entre el uso de imTOR y la incidencia de ABMR [48]. Recientemente el estudio TRANSFORM (Tacrolimus+Everolimus versus Tacrolimus+MPA) no mostró diferencias en el desarrollo de DSAdn entre los grupos analizados a 12 y 24 meses [50] [51]. (EVIDENCIA ALTA)
• Belatacept: fármaco inmunosupresor que actúa bloqueando de forma selectiva la coestimulación del linfocito T. En un subanálisis del estudio BENEFIT (ensayo clínico prospectivo, randomizado y multicéntrico), el tratamiento inmunupresor basado en Belatacept protegía de forma más eficaz frente a la síntesis de DSAdn en comparación con Ciclosporina [52] (EVIDENCIA MODERADA)
En la (Tabla 4) se resumen los principales estudios publicados en relación con el tratamiento inmunosupresor y la incidencia de DSA y ABMR.
RELACIONADOS CON LAS CARACTERÍSTICAS DE LOS ANTICUERPOS ANTI-HLA
La llegada de las técnicas de detección de anticuerpos antiHLA por medio de citometría de fase sólida (Luminex®) han incrementado significativamente la sensibilidad en el diagnóstico y detección de los DSA. Actualmente la tecnología Luminex® se ha consolidado como un procedimiento de rutina en los laboratorios de histocompatibilidad, siendo considerada la técnica de elección [53].
Con el uso más generalizado de estos métodos diagnósticos se han podido establecer dos escenarios diferentes. El ABMR agudo principalmente relevante en los pacientes con DSA preformados y el ABMR crónico, de aparición más insidiosa, observado de forma más habitual en los pacientes que desarrollan DSAdn. De cualquier forma, la existencia de DSA (preformados o de novo) está ampliamente reconocido como el biomarcador definitivo asociado con el riesgo de ABMR [10] [54], disminuyendo a largo plazo (>5 años) la supervivencia del injerto [9][11] (EVIDENCIA ALTA)
DSA preformados:
La relevancia de los DSA pre-TR se evidenció hace ya 50 años con los trabajos de Patel y Terasaki en los que establecían la relación directa entre la prueba cruzada positiva por linfocitotoxicidad y la pérdida precoz del injerto [55]. Desde entonces numerosos trabajos han demostrado la asociación entre la presencia de DSA preformados y el riesgo de ABMR agudo en el primer año post-TR [3][19][20][26][31][56][57][58]. De la misma forma, a largo plazo (>24 meses posTR), los pacientes con DSA preformados se correlacionan con una peor función renal en comparación con los pacientes sin DSA pre-TR [18] [20] [21] [24] [31] [58] (EVIDENCIA ALTA).
Estos DSA preformados adquieren especial relevancia cuando persisten en el periodo post-TR. Varios trabajos han analizado este hecho encontrando que la incidencia de ABMR está incrementada de forma más significativa en caso de que los DSA preformados se mantengan detectables a medio-largo plazo (>1 año post-TR), estableciéndose también esta persistencia como un FR independiente para la pérdida del injerto [20] [26] [59]. Esta capacidad de persistir a largo plazo parece relacionarse con el MFI, lo cual podría explicar como algunos autores han publicado resultados muy positivos, en cuanto a incidencia de ABMR, en pacientes con DSA preformados cuando se realizan estrategias que solo permiten DSA seleccionados según la clase y el MFI [16]. (EVIDENCIA MODERADA).
DSA de novo:
El ABMR en contexto de la aparición de DSAdn ha sido ampliamente estudiado en la reciente literatura. Numerosos trabajos han establecido que, comparados con los receptores sin DSA, la presencia de DSAdn se asocia con un riesgo incrementado de ABMR agudo tardío y crónico [3] [6] [10] [11] [26] [31] [32]. Más difícil ha sido establecer su relación con el riesgo de pérdida tardía del injerto, mientras algunos estudios sí establecen una relación directa entre la presencia de DSAdn y la supervivencia del injerto, otros trabajos no han conseguido desvincular el impacto de la presencia del DSA del propio rechazo, de manera que la influencia de los anticuerpos no parecía tan relevante en aquellos pacientes que no habían tenido rechazo [11] [31] [32].
De cualquier manera, la relevancia de los DSAdn parece indiscutible y, como consecuencia, se debe realizar una adecuada monitorización post-TR. El grupo Prometeo revisó este punto en 2016 estableciendo una serie de recomendaciones sobre cómo, cuando y a quién realizar dicha monitorización [14].
Es importante destacar que, pese a su importancia en el seguimiento del paciente trasplantado, los DSAdn presentan, sin embargo, un escaso valor predictivo positivo para el diagnóstico de ABMR (35%), por lo que es necesaria la realización de biopsia para confirmar/descartar el diagnóstico [53] [60] (EVIDENCIA ALTA)
CARACTERÍSTICAS DE LOS DSA QUE PREDICEN EL RECHAZO HUMORAL:
Cinética de aparición:
Se ha sugerido que el momento post-TR en el que se desarrollan los DSA es una variable que podría tener cierto impacto clínico, asociándose la aparición precoz (
Clase DSA:
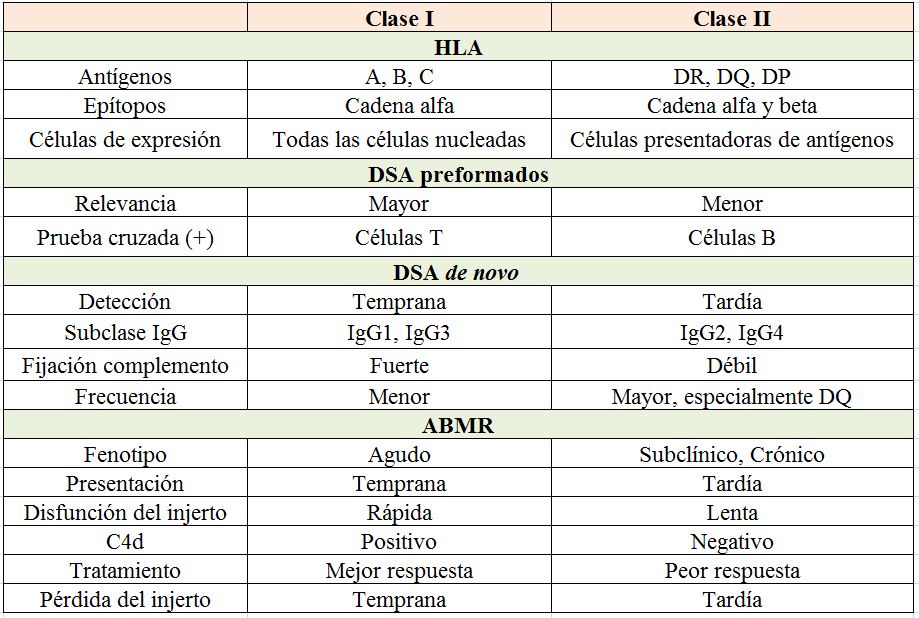
Los DSA se dirigen a epítopos específicos localizados en las regiones polimórficas de los antígenos HLA. En el caso de los anticuerpos clase I estos epítopos se localizan en las cadenas alfa, mientras que los clase II tienen dos cadenas, alfa y beta, ambas polimórficas.
Los DSA pre-TR pueden ser clase I, II o ambos y están más asociados con ABMR temprano (< 3 meses) [26]. Los DSAdn clase I son menos frecuentes, suelen desarrollarse de forma más precoz y se relacionan con ABMR agudo. Los DSAdn clase II, especialmente DR y DQ, son los más habitualmente detectados y tienen mayor riesgo de ABMR tardío y crónico [8] [19] [62].
Por su menor expresión en las células endoteliales renales los antígenos HLA-C y HLA-DP han sido postulados como menos deletéreos considerándose que, en consecuencia, los DSA anti-C y anti-DP no tienen un papel patogénico. Sin embargo, dos trabajos analizando la incidencia de ABMR en pacientes con DSA preformados frente a los antígenos C o DP mostraron que estos DSA no están exentos de riesgo [63] [64] (EVIDENCIA BAJA-MODERADA).
En la (Tabla 5) quedan recogidas las principales características diferenciadoras entre los DSA de clase I y los de clase II.
MFI:
La intensidad de los DSA se expresa habitualmente con el MFI. Estudios previos han mostrado una correlación clínica entre el MFI elevado (máximo o sumatorio de todos los DSA) y el riesgo de ABMR [7] [8] [19] [22] [54]. Teóricamente un mayor MFI confiere un número suficiente de moléculas IgG que pueden unirse a los antígenos HLA de manera que forman complejos hexamétricos que activan el complemento de forma más efectiva. Sin embargo, la correlación entre el MFI y la evolución clínica dista mucho de ser perfecta y DSAs de similar intensidad no siempre activan la cascada del complemento. Más aún, nos encontramos pacientes con DSA con MFI elevados que no desarrollan ABMR. Sumado a esto, actualmente no existe consenso sobre el punto de corte de MFI para establecer su positividad, que debe ser determinado por cada laboratorio.
En este sentido, algunos autores han intentado establecer la fiabilidad de la cifra semicuantitativa de los MFI [65] [66] distinguiendo dos situaciones:
• MFI bajos-moderados: alta fiabilidad de la técnica
• MFI altos: menor fiabilidad, sugiriéndose realizar titulaciones para obtener un resultado más seguro (EVIDENCIA BAJA)
Capacidad de fijar complemento:
Los avances recientes de la técnica de Luminex® para analizar la capacidad de fijar complemento, han mejorado significativamente nuestra capacidad para predecir el riesgo de ABMR. Varios estudios han demostrado que, comparados con los DSA no fijadores de complementos, los pacientes con DSA con capacidad de fijar complemento tienen un mayor riesgo de ABMR, tanto agudo como crónico [8] [15] [67] [68] [69], así como un daño histológico más severo y mayor riesgo de pérdida del injerto [9] [15] [67] [70]. Existe, sin embargo, controversia en los resultados de correlación con el MFI [7] [67] [71] [72]. La mayor capacidad de discriminación parece encontrarse en los DSA con MFI elevados en los que existe diferencia entre DSA fijadores o no de complemento. Los DSA con MFI bajo habitualmente no fijan complemento, aunque algunos trabajos han descrito DSA fijadores del complemento independientemente del MFI.
Aunque algunos autores han descrito una mejor correlación de la fijación de complemento con el riesgo de pérdida del injerto cuando se utilizaba el C3d en comparación con el C1q, en el momento actual no existe evidencia para establecer qué método (C1q o C3d) es más sensible o específico [70] [71]. (EVIDENCIA MODERADA)
Subclase de IgG:
IgG tiene varias subclases (IgG1, 2, 3 y 4) con diferentes capacidades para activar el complemento y reclutar células efectoras a través del receptor Fc. A lo largo del curso de la respuesta inmune y la producción de anticuerpos, se produce un cambio secuencial de subclase de IgG, generalmente de IgG3 a IgG1 a IgG2 a IgG4. Basándose en su capacidad de fijar complemento se han establecido diferentes fenotipos con relación a la subclase de IgG del DSA [10] [12] [53]:
• DSA IgG3 es la que fija C1q de forma más eficaz activando la cascada del complemento. Se asocia con ABMR agudo, daño renal más severo y pérdida renal precoz.
• DSA IgG4, prácticamente no fija C1q pero puede reclutar células efectoras a través del receptor Fc. Se ha señalado como un marcador de respuesta aloinmune más tardía asociándose con el ABMR subclínico o crónico y un riesgo aumentado de pérdida tardía del injerto.
Por tanto, aunque aún se necesitan más estudios para establecer de forma más definitiva el impacto clínico de estos hallazgos, tanto la determinación del subtipo de IgG como la capacidad de fijar complemento pueden ayudar a definir el riesgo inmunológico del paciente, predecir el fenotipo clínico del ABMR y ayudar a definir la estrategia terapéutica [10][12][73] (EVIDENCIA BAJA-MODERADA).
NUEVOS MÉTODOS DE EVALUACIÓN DEL RIESGO INMUNOLÓGICO
Dadas las limitaciones conocidas de las técnicas diagnósticas de los DSA en relación con la estratificación del riesgo inmunológico, se plantea la necesidad de nuevos métodos de evaluación del riesgo inmunológico. Existen diferentes líneas de investigación en este sentido aunque a día de hoy, su uso en la práctica clínica está muy poco extendido.
LINFOCITOS B MEMORIA DONANTE-REACTIVAS (ELISpot)
Se ha descrito una fuerte asociación entre el recuento de células B memoria donante-reactivas y las lesiones histológicas de ABMR y el riesgo de pérdida del injerto. La monitorización de las células B memoria adquiere una mayor relevancia en aquellos casos con ABMR en los que no se detectan DSA [74].
LINFOCITOS T MEMORIA DONANTE-REACTIVAS (ELISpot)
La cuantificación postrasplante de las células T memoria donante-reactivas mediante ELISpot puede discriminar pacientes en riesgo de rechazo agudo celular subclínico en TR con IS basada en ICN y función renal estable de aquellos con riesgo mínimo, lo que podría utilizarse como marcador previo a la minimización de la IS [75].
LINFOCITOS T COLABORADORES (Th)
Los linfocitos Th participan en la inmunidad humoral y se correlacionan con el desarrollo de anticuerpos antiHLA y el riesgo de rechazo agudo [76].
DNA LIBRE DEL DONANTE
En un subanálisis del estudio DART [77] se observó que los pacientes que cumplieron criterio de ABMR (agudo o crónico activo) presentaban unos niveles de DNA libre significativamente mayores que el grupo con DSA positivos sin ABMR y que el grupo de pacientes sin DSA [78].