Diagnóstico y Tratamiento del Rechazo Crónico Mediado por Anticuerpos
Introducción
El rechazo crónico mediado por anticuerpos es una causa importante de disfunción crónica del injerto. Generalmente los pacientes se presentan con una disfunción subaguda y/o proteinuria, junto con aparición de anticuerpos HLA donante-específicos (DSA) de novo, casi siempre de clase II [1] [2] [3]. El rechazo crónico mediado por anticuerpos aparece habitualmente de forma tardía, con frecuencia más allá del año del trasplante, y está frecuentemente asociado a una mala adherencia al tratamiento inmunosupresor [4] [5]. Todo ello condiciona que en la mayoría de los casos se establezca el diagnóstico de forma tardía, y esta situación se encuentra agravada por el hecho de que a día de hoy no disponemos de ningún tratamiento específico que modifique la historia natural de la enfermedad [6], lo que convierte el rechazo humoral crónico en una de las causas más frecuentes de pérdida del injerto a largo plazo [4] [7] [8]. Conocer los mecanismos fisiopatológicos del rechazo mediado por anticuerpos es crucial para poder desarrollar opciones terapéuticas reales para estos pacientes y ello debe ser una prioridad en los próximos años en el campo del trasplante renal.
Perspectiva histórica en el diagnóstico del rechazo crónico mediado por anticuerpos.
Un paso importante hacia el diagnóstico del rechazo mediado por anticuerpos se sitúa en 1991, cuando Feucht et al. [9] [10] describieron por primera vez la asociación entre el depósito de la fracción de complemento C4d en capilares peritubulares y el rechazo agudo mediado por anticuerpos, una demostración in situ de la respuesta humoral a través de la activación de la vía clásica del complemento mediante la interacción anticuerpo-endotelio. La presencia de depósito de C4d se convertiría, más tarde, en parte de la tríada clásica necesaria para poder realizar su diagnóstico [11]. No obstante, no fue hasta el año 2001 cuando se estableció una asociación directa entre el depósito de C4d y el rechazo crónico [12] y posteriormente con la glomerulopatía del trasplante (TG), lesión característica del rechazo crónico mediado por anticuerpos [13]. Finalmente, en la reunión de Banff del año 2005 [14], y tras la eliminación del término inespecífico “nefropatía crónica del trasplante”, el rechazo crónico mediado por anticuerpos se incorporó como una categoría diagnóstica más. A partir de ese momento quedan establecidas dos formas de rechazo mediado por anticuerpos: agudo y crónico. Por consiguiente, los criterios diagnósticos ambas formas de rechazo humoral hasta ese momento requieren (a) la presencia de DSA; (b) depósito de C4d en capilares peritubulares y (c) evidencia morfológica de lesión tisular [15].
No es hasta años después que surgen las primeras evidencias en estudios moleculares publicados por el grupo de Halloran [16] y en estudios de biopsias de protocolo por Loupy et al. [17], demostrando que los anticuerpos podrían producir estas lesiones sin la necesidad de que se encuentre depósito de complemento en la biopsia. Así mismo, en los últimos años se produce un refinamiento en cuanto su diagnóstico a nivel molecular mediante grupos de genes o clasificadores específicos para el rechazo humoral. Por otro lado, también surgen estudios que sugieren que no solo la presencia de necrosis fibrinoide es sugestiva de rechazo mediado por anticuerpos, sino que formas menos severas de arteritis también pueden ser causadas por la respuesta humoral aloinmune [18]. En consecuencia a todos estos hallazgos, en la reunión de Banff del año 2013 [19] y 2017 [20] se producen cambios relevantes en cuanto a los criterios diagnósticos del rechazo mediado por anticuerpos que veremos a continuación.
Cambios relevantes en el diagnóstico de rechazo mediado por anticuerpos en la clasificación de Banff 2013 y Banff 2017.
• No se requiere la presencia de depósito de C4d en capilares peritubulares para el diagnóstico de rechazo mediado por anticuerpos y se reemplaza por evidencia adicional (histológica y/o molecular) de la interacción anticuerpo-endotelio (que incluye el depósito de C4d pero no es exclusivo).
• Se aumenta el umbral de la presencia de inflamación en la microcirculación a grado moderado (g+ptc = 2) en ausencia de depósito de C4d para limitar el diagnóstico de falsos positivos.
• Se introduce por primera vez en los criterios diagnósticos el concepto de rechazo molecular mediado por anticuerpos. Se requiere demostrar la activación de genes indicativos de daño endotelial correctamente validados en casos de rechazo mediado por anticuerpos C4d negativo y sin inflamación en la microcirculación [16].
• Se establece un descenso en el umbral tinción C4d en capilares peritubulares por inmunofluorescencia (IF), de manera que la presencia de C4d focal (C4d2: positividad de C4d 10-50% de capilares peritubulares) pasa a ser positivo.
• Inclusión de arteritis de la intima (v1,v2) como criterio diagnóstico del rechazo mediado por anticuerpos activo, que además conlleva en si mismo un peor pronóstico. De esta manera, estas lesiones ya no son exclusivas del rechazo celular agudo únicamente. No obstante, cabe destacar que una gran parte de pacientes con arteritis y DSA probablemente representen rechazo mixto [18].
• Inclusión como criterio diagnóstico la presencia de glomerulopatía del trasplante precoz sólo detectada mediante evaluación con el microscopio electrónico (cg1a o cg1b) [22] [23].
Estudios que validan diferentes aspectos de la clasificación de Banff 2013 en relación a los criterios diagnósticos del rechazo crónico mediado por anticuerpos
De Serres et al. [24] comparó la evolución clínica en 123 pacientes con TG y/o severa multilaminación en la membrana basal de los capilares peritubulares, comparando la clasificación de Banff 2007 y la de Banff 2013, y utilizando como variables de resultado la pérdida injerto o duplicación de creatinina. Según la clasificación de Banff 2007 sólo el 18% cumplían criterios de rechazo crónico mediado por anticuerpos versus el 36% según Banff 2013. Se encontró una asociación en cuanto a la supervivencia del injerto/evolución clínica con los criterios de 2013 (p=.001), pero no con los del 2007. Además, el criterio con un umbral mas bajo de C4d positivo mostró una fuerte asociación con los resultados , a diferencia de g+ptc=2, que no fue predictor. En otro un estudio dónde también se comparó la clasificación del 2007 y la del 2013 en relación al diagnóstico de rechazo humoral crónico [25], se concluyó que ésta última identificaba más casos (40% vs. 74%, p=.006), disminuyendo la incertidumbre (menos casos bajo la categoría de “sospechosos”), y aumentando la precisión diagnóstica.
Gupta et al. [26] realizó una aproximación molecular con microarrays (mediante los pathogenesis based transcripts sets (PBTs) [27]) sobre 356 biopsias realizadas por indicación clínica para validar el umbral de g+ptc =2. En las biopsias sin inflamación o con inflamación leve (g+ptc = 1) no se encontró correlación asociación con los PBTs asociados a rechazo humoral, pero sí en aquellas biopsias con inflamación en grado moderado – severo g+ptc =2, sugiriendo que este umbral es adecuado para el diagnóstico.
Banff 2017 [20]
Criterios diagnósticos actuales según la última clasificación de Banff disponible, 2017 [20] (Tabla 1)
• Se produce un progreso notable en el diagnóstico molecular respecto al 2013, con inclusión de distintos grupos de genes/clasificadores con mayor especificidad para el rechazo humoral.
• Se proponen alternativas al criterio de presencia de DSA para su diagnóstico. No obstante, siempre se recomienda su determinación, tanto para fines diagnósticos como pronósticos [28], y en caso de ser negativos se recomienda realizar la determinación de anticuerpos no-HLA.
• Eliminación de la categoría “sospechoso” de rechazo mediado por anticuerpos.
Alternativas al criterio de anticuerpos donante específicos para el diagnóstico de rechazo mediado por anticuerpos
1) Depósito de C4d capilares peritubulares : aunque es conocida la sensibilidad limitada para el diagnóstico de rechazo humoral, éste es a su vez un marcador altamente específico de la interacción anticuerpo – endotelio, por lo que su presencia en ausencia de DSA será suficiente para hacer el diagnóstico.
2) Marcadores moleculares : aceptación de combinaciones de genes / clasificadores moleculares con alta especificidad para el diagnóstico de rechazo humoral [29] [30] [31] [32] [33] [34], por lo que su presencia en ausencia de DSA será suficiente para hacer el diagnóstico.
Aunque actualmente la práctica de realizar estudios moleculares no está extendida y solo se realizan en un número limitado de centros, es probable que en el futuro tenga más relevancia a medida que sea más factible des del punto de vista técnico y económico. El diagnóstico a nivel molecular puede ser útil en situaciones en que los criterios histológicos, inmunohistológicos y/o serológicos son equívocos para realizar el diagnostico de rechazo humoral y también como herramienta para estratificar el riesgo del paciente [20] [35].
RECOMENDACIONES :
- Criterios de Banff 2017 para el diagnóstico de rechazo crónico activo mediado por anticuerpos (Tabla 1)
1. Presencia de daño histológico compatible.
2. Evidencia de reciente interacción del anticuerpo con el endotelio vascular.
3. Presencia de anticuerpos donante específicos (no es obligatorio, criterio que se puede sustituir por depósito C4d en capilares peritubulares o rechazo humoral molecular).
- Se recomienda realizar una determinación de anticuerpos no-HLA en caso de anticuerpos donante específicos HLA negativos (B).
- Siempre se recomienda realizar una determinación de anticuerpos donante específicos, aún cumpliendo los criterios uno y dos, no solo con fines diagnósticos, sino también para estratificar el riesgo, así como para evaluar la respuesta a un posible tratamiento y poder hacer una monitorización del paciente (B).
TRATAMIENTO DEL RECHAZO CRÓNICO MEDIADO POR ANTICUERPOS
No se ha demostrado que ningún tratamiento resulte eficaz frente al rechazo humoral crónico en ensayos clínicos aleatorizados. La gran mayoría de los estudios existentes son de naturaleza retrospectiva y presentan resultados controvertidos, reportando beneficio, perjuicio o simplemente ausencia de efecto en los tratamientos analizados, como veremos a continuación. Por este motivo, a día de hoy la mejor manera de hacer frente al rechazo humoral crónico es mediante la prevención del mismo: evitar incompatibilidades HLA (especialmente clase II) [36], promover la adherencia [37], y evitar estrategias de minimización manteniendo tratamiento con inhibidores de la calcineurina (tacrolimus) siempre que sea posible [38] [36].
Rituximab e inmunoglobulinas endovenosas (IVIG)
Clásicamente se ha utilizado la estrategia de tratar el rechazo humoral crónico con rituximab e IVIG, con o sin otros tratamientos añadidos (por ejemplo plasmaféresis). Si bien es cierto que existen estudios retrospectivos que sugieren que este esquema puede frenar la progresión de la enfermedad, en general el grado de evidencia que existe es bajo y la heterogeneidad de los estudios hace que sea difícil compararlos entre si y sacar conclusiones fehacientes [39]. Sólo existe un ensayo clínico randomizado publicado hasta el momento que trata de contestar a esta pregunta y concluye que no es de utilidad [40], por lo que a día de hoy no existe evidencia de calidad suficiente para apoyar este esquema de tratamiento de forma generalizada (Tabla 2).
Estudios observacionales que sugieren efecto beneficioso
Fehr et al. describieron cuatro pacientes con rechazo humoral crónico en los que el tratamiento con IVIG + rituximab se asoció a una reducción significativa de DSA y una mejoría de la función renal tras 6 meses de tratamiento [41]. Estos resultados que parecían prometedores fueron confirmados por otro estudio en población pediátrica en donde se incluyeron 20 pacientes de manera prospectiva que recibieron tratamiento con IVIG + rituximab y con seguimiento a 2 años. El tratamiento se asoció a una disminución del DSA-MFI (mean flourescense intensity) y a una mejoría de la función renal en el 70% de ellos, aunque fue diferente en función de si los pacientes tenían TG o no en la biopsia (45% vs. 100% de respuesta al tratamiento en pacientes sin TG) [42].
En un estudio de cohortes retrospectivo unicéntrico coreano en el que se incluyeron 54 pacientes, de los cuales 29 recibieron corticoides únicamente y 25 recibieron corticoides + IVIG + rituximab, existió una mejoría en la función renal en el grupo rituximab (aunque a los 6 meses se perdió el efecto) y una mejor supervivencia del injerto al año y a los 3 años de seguimiento (p=.03) [43].
En otro estudio de cohortes retrospectivo de Parajuli et al. se incluyeron 78 pacientes con rechazo humoral crónico a los que se les trató con dosis altas de corticoides + IVIG o con corticoides + IVIG + rituximab [44]. En los dos grupos se produjo un descenso de DSA-MFI, una mejoría de la inflamación en la microcirculación (g+ptc) en las biopsias de seguimiento a las 6 semanas, y no se reportaron diferencias en cuanto al filtrado glomerular. No obstante, el grupo que recibió rituximab tuvo una tasa más baja de pérdida del injerto al año (32% vs. 15%, p=.0.02), efecto que se mantuvo en el análisis multivariante.
En la serie de casos de Muller et al. en la que se incluyeron 12 pacientes tratados con corticoides y rituximab, no se apreciaron mejorías en cuanto a la función renal o la proteinuria al año de seguimiento, pero se objetivó un descenso de los DSA y en biopsias de seguimiento una inflamación de la microcirculación de menor grado en la mayoría de ellos [45]. En otro estudio en el que se incluyeron 45 pacientes tratados con IVIG + rituximab, los autores describieron una estabilización del filtrado glomerular tras el tratamiento en un período de seguimiento de 3 años [46].
Existen también series de casos en los que se describe un efecto beneficioso en algunos de ellos, dividiendo a los pacientes en respondedores y no respondedores, siendo éstos últimos generalmente los que tienen peor función renal, mayor proteinuria y con TG al inicio del tratamiento [47] [48]. En la serie de Smith et al. donde se incluyeron 31 pacientes que recibieron rituximab (± corticoides, plasmaféresis, IVIG, timoglobulina) vs. no rituximab (otros tratamientos o nada), los autores identifican un subgrupo de respondedores en el grupo de rituximab, pero que no es identificable previo al tratamiento ya que fenotípicamente no se diferencia de los otros grupos [49]. Kahwaji et al. describieron una serie de 33 pacientes, en donde los que recibieron tratamiento con rituximab + IVIG + corticoides y tenían TG y inflamación en la microcirculación moderada – severa presentaron una tendencia estabilización en la función renal (p=.05) [50].
Estudios con ausencia de efecto
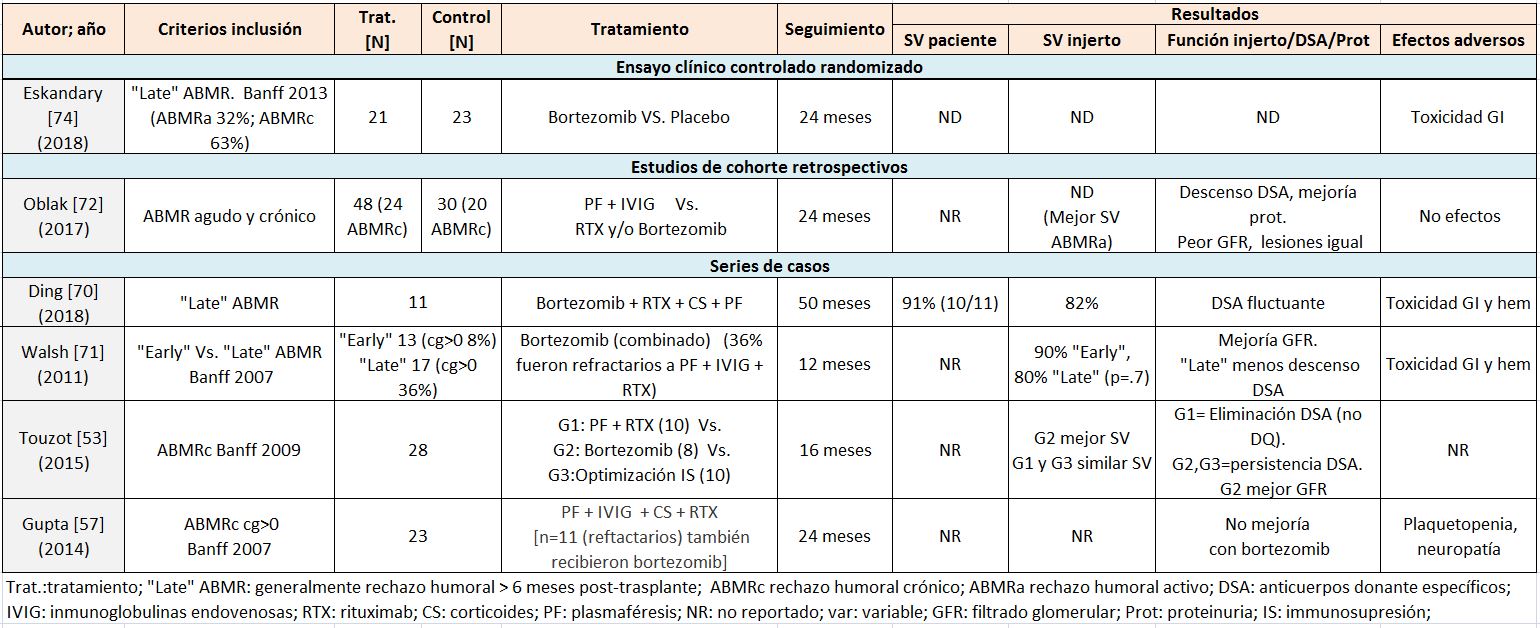
El estudio multicéntrico español TRITON es el único ensayo clínico randomizado a doble ciego con placebo publicado que evaluó el efecto del tratamiento con IVIG (4 dosis 0.5 g/kg) + rituximab (375 mg /m2) en pacientes con rechazo crónico mediado por anticuerpos (cg >0) [40]. Se incluyeron un total de 25 pacientes, y no hubo diferencias en cuanto a función renal, proteinuria o MFI del DSA inmunodominante. Tampoco hubo diferencias en cuanto a las lesiones histológicas en las biopsias de seguimiento al año o en la supervivencia del injerto (hubo una pérdida del injerto en cada grupo). Así mismo, no se encontraron diferencias en cuanto a efectos adversos. Aunque la limitación principal de este estudio es la baja potencia estadística, sus resultados ponen en duda que haya efecto terapéutico alguno de IVIG + rituximab en pacientes con rechazo humoral crónico y TG.
Redfield et al. describieron una cohorte de 123 pacientes con rechazo humoral crónico que recibieron distintos tratamientos : corticoides (93%), corticoides + IVIG (87%), rituximab (30%), plasmaféresis (13%), timoglobulina (10%). En esta serie, la combinación corticoides + IVIG fue la única que mostró un menor riesgo de pérdida del injerto (p=.03) [51].
En una serie pediátrica de 32 pacientes, Chaparro et al. [52] no encontró diferencias en cuanto a la función del injerto en pacientes tratados con IVIG + rituximab vs. IVIG con seguimiento a 5 años.
Touzot el al. [53] describieron 28 pacientes con rechazo humoral crónico que fueron tratados con plasmaféresis + rituximab (n=10), bortezomib (n=8) o optimización de la inmunosupresión (n=10). El grupo de bortezomib tuvo mejor filtrado glomerular y mejor supervivencia a los 16 meses en comparación con el resto de grupos. El grupo rituximab tuvo similar supervivencia del injerto que el grupo de optimización de la inmunosupresión.
Estudios que sugieren efecto perjudicial
Bachelet et al. analizaron 21 pacientes que recibieron IVIG + rituximab vs. 10 controles y no encontraron diferencias en cuanto a supervivencia del injerto o función renal. No obstante, el grupo rituximab se asoció a un mayor número de efectos adversos (p=.03) [54]
Anwar et al. [55] revisaron retrospectivamente 39 casos de rechazo humoral crónico en un periodo de seguimiento de 10 años en donde 9 pacientes recibieron rituximab + terapia estándar y 30 terapia estándar (no definida). La tasa de pérdida del injerto fue superior en el grupo de rituximab (70% vs. 30% en el grupo estándar, p=.001), pero los pacientes en este grupo tenían una función renal y proteinuria significativamente peores al iniciar el tratamiento.
Ghouti-Terki et al. [56] reportaron que en 8 pacientes que recibieron IVIG + rituximab + plasmaféresis comparados con 14 pacientes tratados con pulsos de corticoides, se objetivó un deterioro significativo de la función renal al año y progresión de las lesiones crónicas. No hubo efecto en cuanto a reducción de DSA ni diferencias en la supervivencia del injerto.
Gupta et al. [57] describieron una serie de 23 casos que recibieron varios tratamientos, y en 11 de ellos se administró rituximab, y aunque inicialmente describieron una mejoría de la función renal, esto no se mantuvo durante todo el estudio, pero sí describieron complicaciones infecciosas importantes en el 22% de los pacientes.
Más recientemente, Pineiro et al. [58] analizaron 62 pacientes con rechazo crónico humoral (cg > 0 y g+ptc >1), de los cuales 23 recibieron IVIG + rituximab + plasmaféresis y 39 no recibieron tratamiento. No encontraron diferencias entre grupos (función renal, supervivencia injerto, DSA) salvo en las infecciones, que fueron más frecuentes en el grupo de rituximab (OR= 4.22, p=.01). De manera similar, en la serie italiana de Mella et al. [59] en donde 9 pacientes recibieron IVIG + rituximab + plasmaféresis y 12 no recibieron tratamiento, únicamente encontraron menos inflamación en la microcirculación en el grupo tratamiento, pero con igual función del injerto, proteinuria y supervivencia a 24 meses de seguimiento, y describieron más infecciones en el grupo rituximab (p=.03).
Bortezomib
Es un fármaco aprobado para el tratamiento del mieloma múltiple [60]. Su mecanismo de acción consiste en la inhibición del proteosoma, promoviendo la apoptosis de las células plasmáticas y evitando así la producción de anticuerpos [61]. Sus efectos adversos son bien conocidos e incluyen toxicidad gastrointestinal, hematológica y neuropatía periférica [62].
La primera publicación en trasplante renal es del año 2008 en donde describen una serie de 6 pacientes con rechazo mixto refractarios a tratamiento convencional en los que tras la administración de bortezomib se produce un descenso >50% del DSA inmunodominante, mejora/estabilización función renal y resolución lesiones histológicas [63].
Bortezomib ha sido utilizado en el tratamiento de rechazo humoral agudo y crónico, de rescate en casos refractarios y en tratamiento desensibilizador [64] [65] [66] [67] [68] [69]. En los estudios que incluyen pacientes con rechazo humoral crónico (Tabla 3), bortezomib es más eficaz reduciendo anticuerpos HLA clase I que clase II y existen series que sugieren que su uso en monoterapia no es efectivo para reducir los anticuerpos donante específicos, aunque en algún estudio publicado describen un efecto positivo en la supervivencia del injerto [53]. No obstante, es un fármaco que mayoritariamente ha sido utilizado en terapia combinada (± plasmaféresis, IVIG, rituximab), por lo que resulta difícil interpretar el efecto real del bortezomib [64] [70]. En las series publicadas es más efectivo en el rechazo humoral agudo que en el crónico o tardío, donde parece tener escaso efecto [71] [72] [73].
El estudio BORTEJECT [74] es un ensayo clínico randomizado a doble ciego con placebo publicado recientemente que evaluó el efecto del tratamiento con bortezomib en monoterapia en pacientes con rechazo humoral tardío (> 6 meses post-trasplante), entre los que se incluyeron 14 pacientes con rechazo humoral agudo y 28 con rechazo humoral crónico. No se detectaron diferencias en cuanto a función renal, DSA-MFI, lesiones histológicas en biopsias de seguimiento a los 24 meses o análisis a nivel molecular. No obstante, hubo más efectos adversos gastrointestinales en el grupo tratamiento.
Existen datos experimentales que sugieren que el escaso efecto del Bortezomib en monoterapia puede ser debido a una compensación humoral tras el tratamiento [75], y que esto podría ser solventado por el uso de terapia combinada [76]. En este sentido, existe un ensayo clínico que se está llevando a cabo que podría respuesta a esta pregunta [77].
Inhibidores del complemento
Los aloanticuerpos pueden producir daño tisular tanto por mecanismos mediados por complemento como por mecanismos independientes de complemento [78].??Existe evidencia suficiente que demuestra la activación del complemento en el rechazo humoral crónico [28]. Los pacientes con anticuerpos donante específicos capaces de fijar complemento presentan a un patrón histológico con más inflamación, sobretodo a nivel de la microcirculación, y también desarrollan con mayor frecuencia una glomerulopatía del trasplante, resultando en un peor pronóstico y mayor tasa pérdida del injerto si los comparamos con pacientes con presencia de anticuerpos donante específicos no fijadores de complemento [28].
Todo esto sugiere que el bloqueo de la vía clásica del complemento podría ser una estrategia adecuada, o como mínimo a explorar con más profundidad, para el tratamiento del rechazo humoral crónico.
Eculizimab
El eculizumab es un anticuerpo monoclonal que bloquea la vía terminal del complemento [79]. Cabe destacar que el uso de eculizumab en pacientes hipersensibilizados como prevención de rechazo humoral agudo, no evitó que dichos pacientes desarrollaran más tarde un rechazo humoral crónico con TG [80] [82].
El uso de este fármaco en el tratamiento del rechazo humoral crónico ha sido explorado únicamente en un estudio piloto publicado en 2016 [83], en donde 15 pacientes fueron randomizados a ser tratados con eculizumab (n=10) o placebo (n=5). No hubo diferencias entre los dos grupos ni a nivel histológico en biopsias de seguimiento ni a nivel molecular analizando la activación endotelial mediante la expresión de los ENDATs [16]. Los autores destacan una discreta mejoría en el filtrado glomerular en el grupo eculizumab a los 6 meses, pero ésta resulta estadísticamente no significativa (p=0.09). Es difícil sacar conclusiones de este estudio debido a la baja potencia estadística.
Inhinibidor de C1 esterasa (C1-INH)
No existe experiencia directa con este fármaco para el tratamiento del rechazo humoral crónico. No obstante, un ensayo clínico randomizado con C1-INH para el tratamiento del rechazo agudo mediado por anticuerpos mostró menos glomerulopatía del trasplante a los 6 meses del rechazo agudo en los pacientes tratados con C1-INH [84], por lo que los autores sugirieron que este fármaco podría ser útil en prevenir el desarrollo de daño crónico mediado por anticuerpos. En este momento se está llevando a cabo un ensayo clínico multicentrico con C1-INH en pacientes con rechazo humoral agudo que ya han sido tratados con terapia estándar [85].
Anticuerpo Anti-C1s
En un estudio piloto con anticuerpo monoclonal Anti C1s [86] en rechazo humoral tardío/crónico (N=10) mostró una negativización del depósito de C4d en capilares peritubulares en 7/8 pacientes, pero no se produjo un descenso significativo de los DSA, ni mejoría de la inflamación en la microcirculación o cambios a nivel molecular. Tampoco se objetivó una mejoría del filtrado glomerular durante el tiempo de estudio.
Bloqueo IL6 / IL6-R
La IL-6 es una citoquina pleiotrópica que está presente tanto en la inmunidad innata como en la adaptativa. Algunas de sus funciones están directamente relacionadas con la fisiopatología del rechazo mediado por anticuerpos. Concretamente, promueve la maduración y diferenciación de células B en células plasmáticas secretoras de anticuerpos (donante-específicos) y también participa en la respuesta T, favoreciendo la presencia de células T efectoras e inhibiendo las células T reguladoras [87].
El tocilizumab (anticuerpo monoclonal que bloquea el receptor de la IL-6 (IL6-R)) tiene indicación para la artritis reumatoide severa desde el año 2010 [88] y en el trasplante renal se ha utilizado de forma exploratoria en dos contextos: protocolos de desensibilación HLA tras fracaso del régimen estándar [89], y en el tratamiento del rechazo humoral crónico con glomerulopatía del trasplante refractario a inmunoglobulinas endovenosas y rituximab, con o sin plasmaféresis [90]. En este estudio se incluyeron 36 pacientes que recibieron tocilizumab a dosis de 8 mg/kg de forma mensual durante un mínimo de 6 meses (6-25 meses) y con un seguimiento máximo de 8 años. Cabe destacar que el perfil de tolerabilidad fue bueno y no se reportaron efectos adversos significativos. Los autores demostraron una buena supervivencia del paciente y del injerto a 6 años (91% y 80% respectivamente), así como una estabilización del filtrado glomerular durante el periodo de estudio. Así mismo, los pacientes presentaron un descenso de los niveles de anticuerpos donante – específicos y una disminución de la inflamación en la microcirculación (g+ptc) y del depósito de C4d en capilares peritubulares en biopsias de seguimiento.
Otro fármaco interesante que se está explorando en el tratamiento del rechazo humoral crónico es el clazakizumab, un anticuerpo monoclonal que bloquea la IL-6. Existen dos estudios piloto con clazakizumab que se estan llevando a cabo para evaluar la tolerabilidad y eficacia en pacientes con rechazo humoral crónico [91] [92].
Los estudios realizados hasta el momento en trasplante renal son exploratorios, pero sugieren que el bloqueo de la IL-6 o de su receptor podría ser de utilidad en el tratamiento del rechazo crónico mediado por anticuerpos. No obstante, aunque son resultados prometedores, se necesitan nuevos estudios que validen la eficacia y seguridad del fármaco con grupos control. En este sentido, se esta llevando a cabo un ensayo clinico multicéntrico fase 3 con clazakizumab para el tratamiento del rechazo humoral crónico (N estimada=350; Clazakizumab vs. Placebo) [93].
CONCLUSIONES
• No existe un tratamiento específico para el rechazo humoral crónico y ello conlleva un mal pronóstico y peor supervivencia del injerto.
• No existe evidencia suficiente que apoye el uso de rituximab para el tratamiento del rechazo humoral crónico. Los estudios que sugieren beneficio son de baja calidad y con un nivel de evidencia bajo.
• Bortezomib en monoterapia no parece efectivo y además presenta efectos secundarios significativos.
• Se debe explorar con ensayos clínicos randomizados el uso de bortezomib en terapia combinada.
• Los fármacos que bloquean IL6 / IL6-R parecen prometedores y habrá que esperar los resultados de los ensayos clínicos que se están llevando a cabo con clazakizumab.
• Los fármacos inhibidores del complemento pueden tener cabida en el tratamiento del rechazo humoral crónico, pero se necesitan ensayos clínicos que evalúen su eficacia.
RECOMENDACIONES
- No se recomienda el uso de rituximab + IVIG en el tratamiento del rechazo humoral crónico cuando existe glomerulopatía del trasplante (A).
- No se recomienda el uso de bortezomib en monoterapia por ausencia de efecto en el rechazo humoral crónico y efectos adversos significativos (A).
- No existe evidencia que el tratamiento con bortezomib tanto en terapia combinada como de rescate en aquellos casos de rechazo humoral crónico refractarios con glomerulopatía del trasplante sea de alguna utilidad, por lo que no recomendamos su uso (B).
- Recomendamos optimizar el tratamiento inmunosupresor y utilizar inhibidores de la calcineurina (tacrolimus) siempre que sea posible (A).
- Dado que no existe un tratamiento efectivo para el rechazo humoral crónico, se recomienda promover estrategias para prevenir su aparición; evitando incompatiblidades HLA en el momento del trasplante (C), promover la adherencia (A), y no eliminar el inhibidor de la calcineurina siempre que sea posible (A).