Evaluación Ecográfica del Estado Nutricional del paciente Renal
INTRODUCCIÓN
La Enfermedad Renal Crónica (ERC) es un estado patológico de acumulación de productos del metabolismo celular acompañado de un aumento del catabolismo, que ocasionan alteraciones nutricionales e inflamación sistémica, lo que incrementa la morbimortalidad de nuestros pacientes. El término de ¨malnutrición¨ abarca tanto las complicaciones asociadas a la carencia, como al exceso de nutrientes. En el contexto de la ERC, estas alteraciones nutricionales se presentan bajo diversas formas, que van desde la malnutrición y sarcopenia, hasta la caquexia o el síndrome de malnutrición-inflamación-aterosclerosis, términos que han generado confusión y cuya descripción clara en la literatura es insuficiente. Sin embargo, estas terminologías solo explican una parte del problema, sin englobar los múltiples mecanismos que las ocasiona en el paciente con ERC.
En 2008, la Sociedad Internacional de Nutrición Renal y Metabolismo (ISRNM) propuso la adopción del término protein-energy wasting (PEW), traducido al español como síndrome de desgaste proteico-energético (DPE)[1]. Sin embargo, desde el punto de vista clínico, las herramientas que tenemos son limitadas, y en teoría las técnicas más especializadas como la tomografía axial computarizada (TAC) y la absorciometría de Rayos X de doble energía corporal total (DEXA) (“patrón oro” para la determinación de la composición corporal y validada para la población con ERC y diálisis) están fuera del alcance del día a día. Es aquí donde los expertos en nutrición acuñan el concepto de valoración morfofuncional de la desnutrición relacionado con la enfermedad (DRE)[2]. Dentro de este grupo de medidas diagnósticas se describen los parámetros bioquímicos, antropométricos, dinamometría, bioimpedancia eléctrica (BIA), valoración de la ingesta, y surge la Ecografía para la evaluación ecográfica del estado Nutricional (EN).
A pesar de reconocer la malnutrición como un factor de riesgo clave para la morbi-mortalidad en pacientes con ERC, especialmente aquellos en pre-diálisis o en tratamiento renal sustitutivo (TRS), incluyendo hemodiálisis (HD) y Diálisis Peritoneal (DP), aún persiste la ausencia de un consenso sobre criterios diagnósticos en la práctica médica rutinaria. Se utilizan diferentes pruebas de cribado de riesgo de desnutrición, como la valoración global subjetiva (SNGA Subjective Nutritional Global Assessment) [3], Escala de Desnutrición para Pacientes en Diálisis (DMS Dialysis Malnutrition Score)[4] y la Escala de Malnutrición-inflamación (MIS Malnutrition Inflamation Score) [5]. Recientemente, han surgido los criterios GLIM (Global Leadership Initiative on Malnutrition) [6], avalados por distintas sociedades clínicas para estandarizar y unificar los criterios diagnósticos, pero aún no se han validado en población renal. Además, existen otros métodos para hacer esta evaluación, desde los más complejos, y limitados solo a la investigación por su difícil acceso y realización, como la pletismografía de desplazamiento de aires, el análisis de activación in vivo de neutrones, la dilución de isótopos y el recuento total de K corporal. Otras técnicas como TAC y DEXA, aunque están disponibles en los hospitales no se emplean por dificultades técnicas. Hasta los más usados en la práctica clínica como la antropometría clásica y la BIA (bioimpedancia). Recientemente, la EN ha demostrado ser una nueva alternativa dinámica, innovadora y herramienta invaluable que está ganando terreno. A través del uso de ultrasonidos, se puede evaluar la composición corporal del paciente, de forma cuanti-cualitativa y no invasiva de la masa magra, grasa, además de poder valorar el tejido conectivo, vascular y óseo.
Este artículo tiene como objetivo proporcionar una visión actualizada de la ecografía nutricional con un enfoque emergente y explorar las implicaciones de su aplicación en la mejoría de los resultados clínicos en la ERC.
A- ECOGRAFÍA MUSCULAR DEL CUÁDRICEPS FEMORAL
1. Principios básicos
La ecografía nutricional muscular (ENM) constituye un método innovador consolidado para la cuantificación muscular, identificación de atrofia muscular y la evaluación de la calidad del tejido. Se realiza mediante la exploración de diversas zonas musculares en cortes transversales y longitudinales, permitiendo valorar volumen, área muscular, longitud de fascículos, ecogenicidad y ángulo de penación [7]. Estos parámetros están directamente relacionados con la masa libre de grasa (MLG) metabólicamente activa [8]. El cuádriceps femoral, particularmente el cuádriceps recto femoral (CRF), es el músculo más frecuentemente evaluado, aunque otros grupos musculares como el bíceps y gastrocnemio también pueden ser estudiados siguiendo protocolos específicos [9].
2. Utilidad Clínica:
La ENM destaca por su habilidad para reflejar no solo la cantidad sino también la calidad de la masa muscular, evidenciada por cambios en la ecogenicidad que indican aumento del tejido no contráctil. Su capacidad para detectar modificaciones en el grosor muscular y el área de sección transversal (AST) en cortos periodos de tiempo sugiere su aplicabilidad en el seguimiento clínico. Comparativamente, ha demostrado validez frente a métodos como la DEXA, la resonancia magnética (RM) y TAC.
3. Consideraciones especiales y futura Investigación:
En el contexto de pacientes con ERC avanzada (ERCA) en TRS, es crítico tener en cuenta factores como el estado de hidratación principalmente. No es lo mismo medir la masa muscular antes del inicio de la sesión de hemodiálisis que después tras la ultrafiltración (UF), ya que la sobrecarga hídrica del musculo alteraría los resultados. La EN presenta una oportunidad para la evaluación objetiva, aunque requiere más investigación clínica para adaptar las ecuaciones de predicción a diferentes estados de salud y condiciones funcionales [10].
4. Equipamiento
Para la realización de la ecografía del CRF necesitaremos un equipo de ecografía convencional con un transductor de matriz lineal multifrecuencia de banda ancha (5-10 MHz) adaptado a las necesidades de penetración y resolución axial. Se debe seleccionar la frecuencia adecuada para la exploración, recordar que, a mayor frecuencia, menor será la penetración en los tejidos y mayor resolución. Los transductores de alta frecuencia utilizados en esta técnica alcanzan una resolución axial de hasta 0,1 mm y una resolución lateral de 0,2 mm. La imagen armónica, la ganancia y el rango dinámico son los principales ajustes necesarios para la correcta visualización de la ENM del CRF [8]. Algunos equipos pueden contar con software específicos para la valoración muscular, pero esto no es completamente necesario para su realización.
5. Sistemática de realización
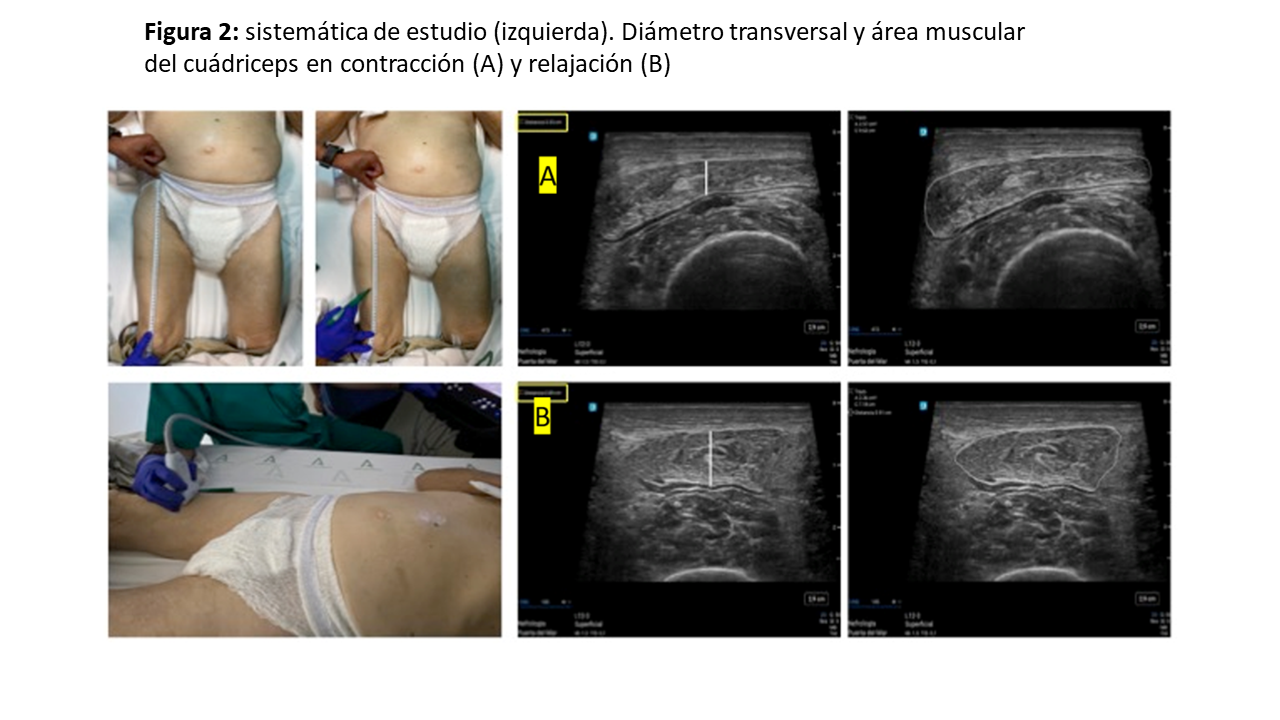
Para realizar una correcta valoración del CRF en la ENM, es importante estandarizar una serie de mecanismos similares en las valoraciones seriadas, como la posición del paciente, localización de estructuras anatómicas y sistematización de cortes de medidas. Colocaremos al paciente en decúbito supino con cabecero a 0º y con las piernas extendidas y relajadas. Idealmente se valorará la pierna derecha, pero si esto no es posible, se hará en la izquierda (generalmente usar la pierna dominante). En caso de pacientes en programa de HD periódica, es recomendable que se realice post-HD después de la UF.
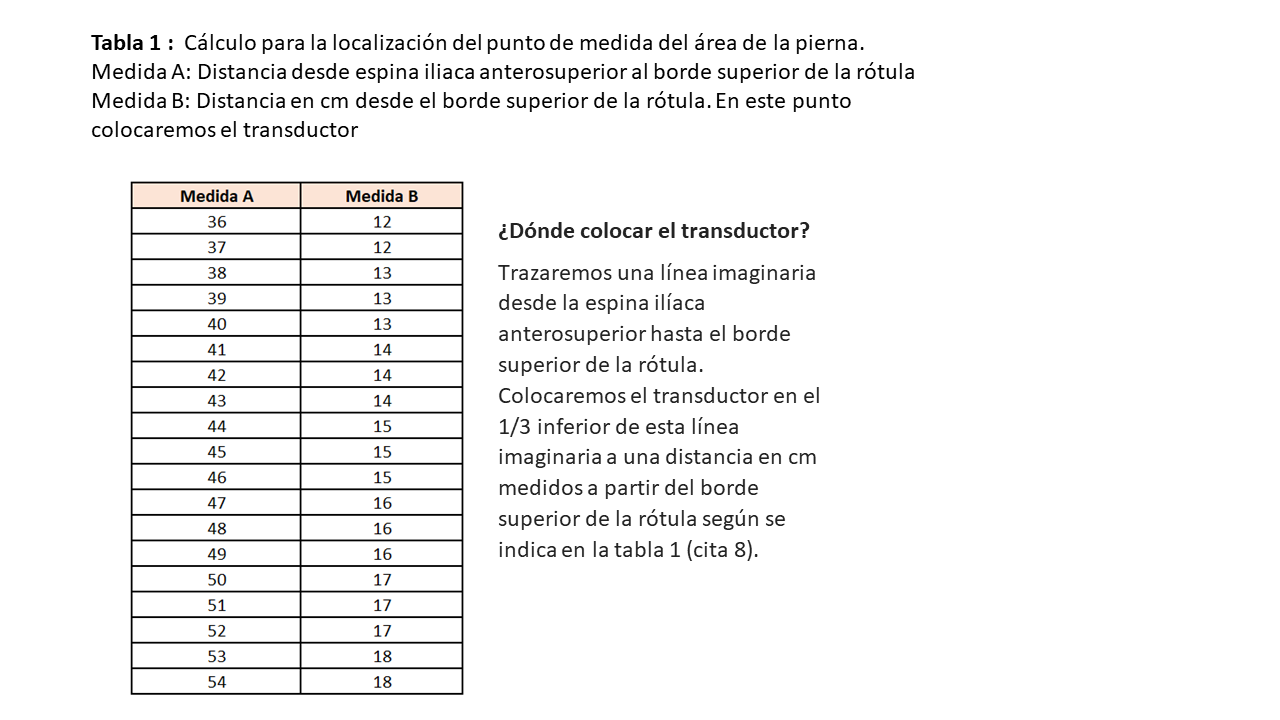
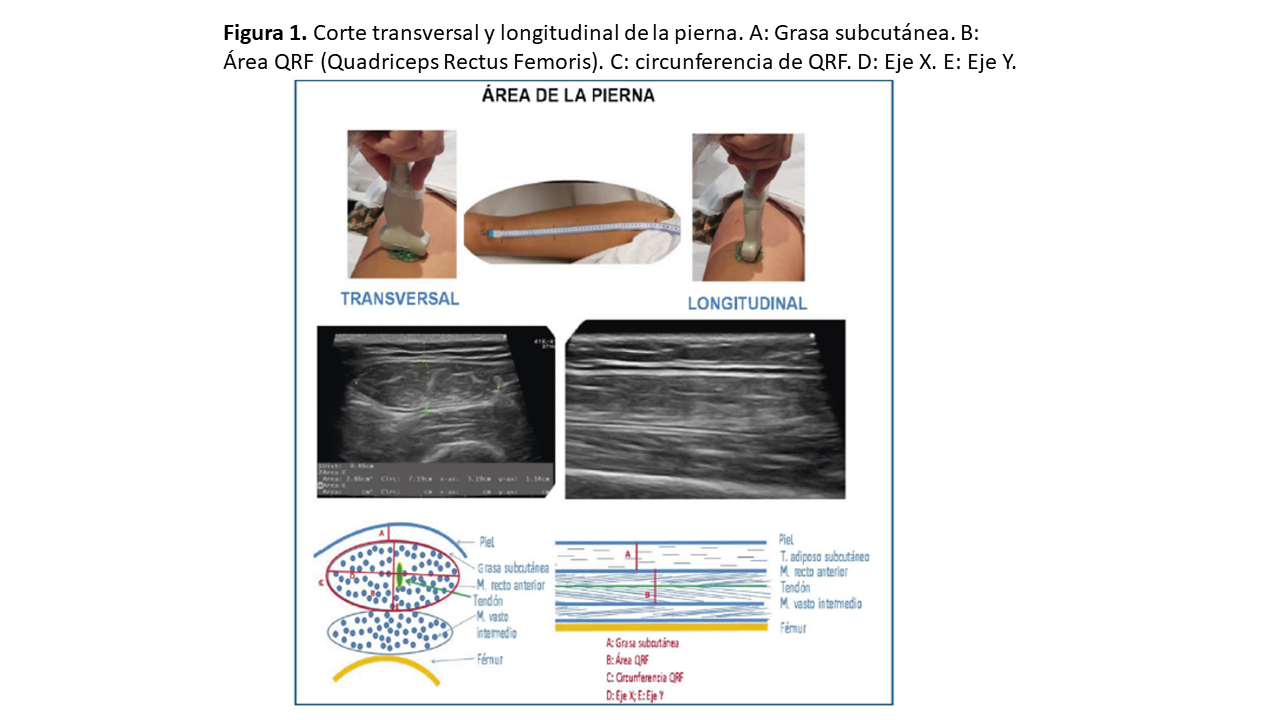
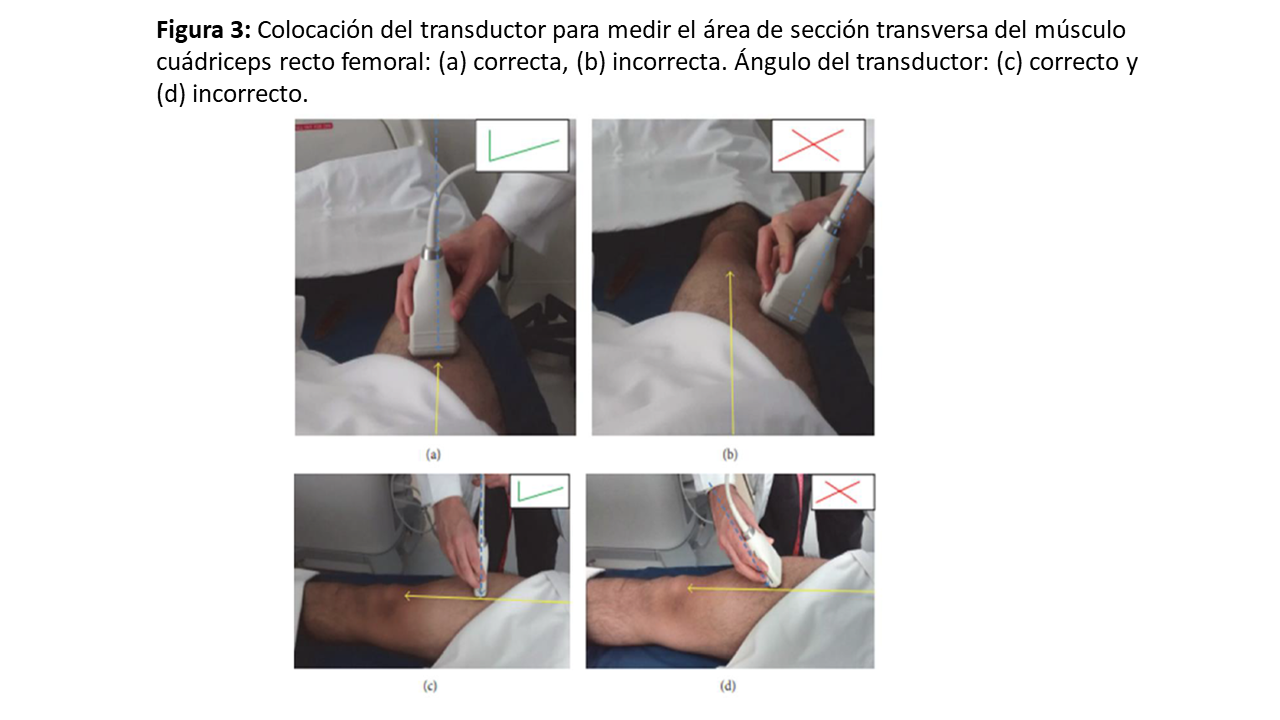
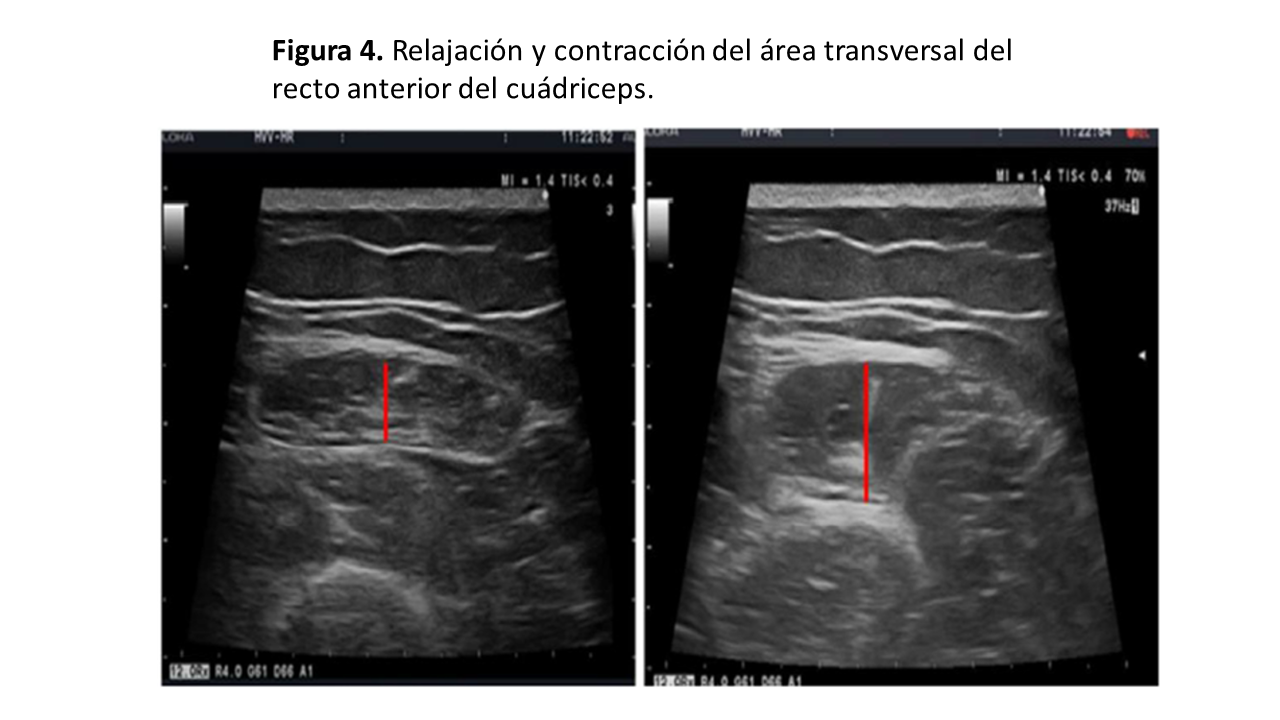
Para conocer el lugar de la exploración, deberemos medir la distancia, trazando una línea imaginaria, entre la cresta ilíaca anterosuperior (CIAS) y el borde superior de la rótula, y en el 1/3 inferior colocaremos el transductor en posición transversal o longitudinal al eje de la pierna (Figura 1) y (Figura 2) [8]. Para una mayor reproducibilidad, podemos utilizar tablas de referencia (Tabla 1). Es importante aplicar abundante gel conductor, para evitar hacer alta presión y deformar las estructuras (Figura 3). En el corte transversal, la corona del CRF se situará en el plano dorsal como una imagen hiperecoica (línea brillante) en forma de arco con sombra acústica posterior, y la epidermis en el plano ventral, de aspecto hiperecogénico. Mientras que, en el corte longitudinal, se identifican las mismas estructuras con el límite inferior en la corona del fémur y el límite superior en la epidermis (Figura 1) y (Figura 2). También se puede realizar la ENM del CRF en contracción, esto nos proporciona diferentes ejes y puede ser útil para evaluar el tono y los cambios funcionales en la masa muscular (Figura 2) y (Figura 4).
4. Consideraciones técnicas y patrón de normalidad
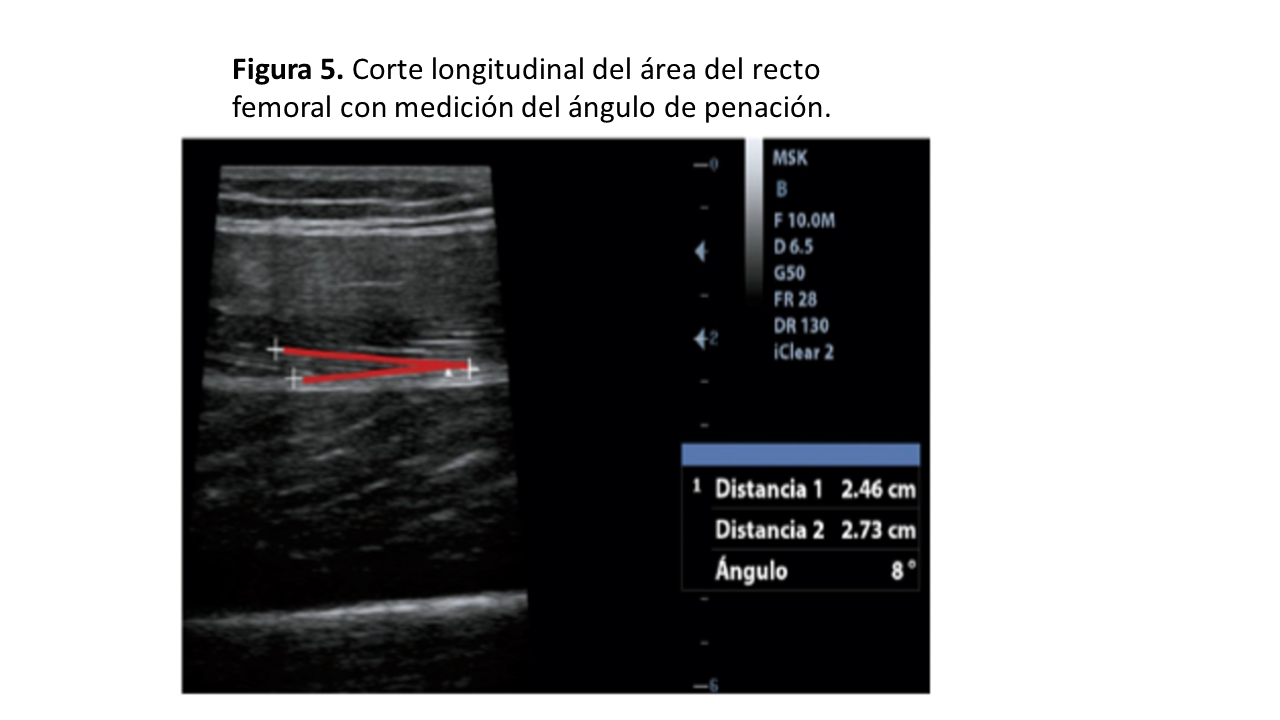
La ENM de alta resolución permite valorar los tejidos musculoesqueléticos, desde la parte externa a la interna, comenzando por la epidermis y la dermis, las cuales se visualizan como una capa lineal altamente hiperecogénica, por debajo de ella, encontramos el tejido celular subcutáneo (TCSC), el cual se visualiza como una capa hipoecogénica. En el corte transversal de la ENM del CRF, los ejes X e Y corresponden a la medición lineal de la distancia entre los límites musculares lateral y anteroposterior, respectivamente. El área y la circunferencia muscular se evalúan mediante mediciones elipsoidales o por trazado manual alrededor del borde de la aponeurosis del CRF (Figura 2). En el corte longitudinal, las imágenes obtenidas nos permiten medir de forma líneas el tejido adiposo. En este corte, podemos evaluar la longitud del fascículo y el ángulo de penación (PA) formado por las fibras musculares con el eje mayor contráctil o la aponeurosis muscular (Figura 4). EL tejido muscular sano en una vista axial se muestra como imágenes de áreas ecolúcidas (oscuras) intercaladas con pequeños ecos brillantes y curvos. Estas finas líneas hiperecogénicas intramusculares representan el epimisio y perimisio. Las líneas más gruesas representan el septo y la fascia de revestimiento. Sin embargo, en el plano sagital, estos ecos representan el tejido fibroso que rodea las fibras musculares. En el musculo CRF, el tendón central puede identificarse como una zona de tejido fibroso hiperecogénico engrosado (Figura 2) y (Figura 4). La ENM del CRF también nos permite evaluar los cambios en la calidad del musculo, reflejados como un aumento de la ecogenicidad. Para ello, podemos valorar la eco-intensidad en una región de interés de 50 x 50 pixeles, donde el software nos ofrece a través de un histograma los valores de intensidad ecográfica que van desde 0 (negro) a 255 (blanco) [8].
En algunos casos, cuando se altera la arquitectura muscular normal debido al aumento del contenido graso, fibrosis, ó pérdida de músculo sano e inflamación, esto provoca un aumento de los reflejos acústicos tisulares. Como, por ejemplo, en la zona muscular del CRF, el aumento de la ecogenicidad se asocia a la mío-esteatosis debida a la infiltración de tejido adiposo o a la esclerosis relacionada con los cambios de la edad avanzada. La disminución de la ecogenicidad muscular se asocia a edema y mío-necrosis. Es importante identificar las alteraciones patológicas como lesiones musculares, edema, ó colecciones, que pueden alterar las mediciones. Otra manera de evaluar los cambios dinámicos del músculo es la visualización de las fasciculaciones, que pueden diagnosticar enfermedades como la esclerosis lateral amiotrófica. Estas contracciones espontáneas pueden medirse principalmente en el modo M.
5.- Evidencia clínica para la estandarización de la EN en la ERC
La correlación de la masa y la fuerza muscular con otros parámetros clínicos es de creciente interés en la literatura médica. Es conocida la relación de la masa muscular en pacientes con ERCA y mortalidad, a menor masa muscular mayor mortalidad [11]. Sin embargo, existen pruebas contradictorias en población con ERCA no en diálisis, en función del método utilizado para determinar la masa muscular [12]. Por otro lado, algunos estudios como el de Vogt et al [13]e Isoyama et al [14], en paciente con ERCA en diálisis demuestran una mayor asociación con la fuerza muscular y la mortalidad, que con la masa muscular. En una revisión sistemática y metaanálisis en pacientes con ERC con y sin TRS publicado por Ribeiro et al[15], investigaron la asociación entre la sarcopenia y sus características con la mortalidad y la hospitalización. De 4922 estudios obtenidos de cinco bases de datos electrónicas, incluidas MEDLINE y Embase, se incluyeron 50 estudios (72347 pacientes) para la revisión y de estos 38 estudios (59,070 pacientes) para el metaanálisis. Los rasgos de sarcopenia evaluados fueron baja fuerza muscular, baja masa muscular y bajo rendimiento físico, así como sarcopenia diagnosticada (baja masa muscular combinada y baja resistencia/rendimiento). Los autores concluyen que la baja fuerza muscular, la baja masa muscular y el bajo rendimiento físico se asociaron con mayor mortalidad en pacientes con ERC sin TRS, y en pacientes en diálisis, la sarcopenia diagnosticada también representó mayor riesgo de mortalidad.
En estudios recientes, la EN ha demostrado ser un método efectivo para medir la masa muscular mediante el área del CRF, la cual se correlaciona con la MLG medida por BIA, la fuerza de prensión de la mano por dinamometría y la capacidad del ejercicio [16]. Sin embargo, existe escasa evidencian sobre la validez y fiabilidad de la ENM, en población con ERC, ERCA con ó sin TRS, que nos permitan evaluar patrones de anormalidad y puntos de corte para esta población. Watson E. y colaboradores [12], realizaron un estudio en una cohorte prospectivo de 89 pacientes con ERC en estadios 3b-5 sin TRS, con un periodo medio de seguimiento de 3,3 años, en el que se investigó la contribución de los factores predictivos del tamaño del músculo CRF, la fuerza muscular y la capacidad de ejercicio a las tasas de mortalidad por todas las causas, la progresión a ERCA y el tiempo transcurrido hasta la primera hospitalización. El análisis no ajustado sugirió que cada aumento de 1 cm2 en el tamaño del músculo CRF (medido mediante ultrasonografía del AST) se asociaba con una reducción del 38% en el riesgo de muerte (p = 0,006), y que una mejora de 10 metros en la prueba incremental de la marcha se asociaba con una reducción del 3% en el riesgo de muerte (p = 0,04). Sin embargo, esta relación no se observó en los análisis ajustados por edad, sexo y tasa de filtrado glomerular estimado (TFGe). No se observó asociación entre ningún factor para el desarrollo de ERCA o el tiempo hasta la primera hospitalización. Por lo tanto, estos autores concluyen que el tamaño muscular y la capacidad de ejercicio están asociados con la mortalidad cuando se consideran por sí solos, pero esta relación no estuvo presente en los análisis ajustados. Yang Qinbo et al[17], realizaron una revisión sistemática de artículos publicados hasta junio del 2023, de las bases de datos de Cochrane, PubMed y Embase, para evaluar la precisión de la prueba diagnóstica de la ENM para la sarcopenia en pacientes con ERCA sin TRS. Incluyeron cinco artículos con 428 participantes en diversas etapas de la ERC. Tres estudios diagnosticaron la sarcopenia a través de la medida del AST del CRF, mientras que otros dos por el espesor del músculo (EM) y la onda de corte de elastografía (OCE) del mismo músculo, por separado. En general, AST y OCE del CRF tuvieron una sensibilidad y especificidad combinada de 0,95 (95% IC; 0,80-1,00), y 0,73 (95 % lC; 0,55-0,88) para diagnosticar sarcopenia en pacientes con ERC, respectivamente. En población en HD, recientemente Nagy et al [18], realizaron un estudio transversal incluyendo 41 pacientes egipcios, 24 pacientes con sarcopenia y 17 sin sarcopenia. La sarcopenia fue diagnosticada según los criterios del Grupo de Trabajo sobre Sarcopenia en Personas Mayores (por sus siglas en inglés, EWGSOP). El índice de masa esquelética se midió por BIA y la fuerza muscular mediante la prueba de prensión manual. Utilizaron la ENM para medir el AST del CRF y del bíceps. La media de edad fue de 44,18 años (desviación estándar-DE: 13,11) y un tiempo medio en HD de 48 meses. Diagnosticaron sarcopenia en el 58,5% de los pacientes. Los pacientes con sarcopenia tenían un AST del CRF significativamente menor que aquellos sin sarcopenia 2,23 (1,36-4,5) vs 3.49 (1,89-5,5) cm2, respetivamente (p=0.001). Los cortes óptimos del AST del CRF en el 1/3 distal del fémur para hombres y mujeres para el diagnóstico de sarcopenia fueron de 2,96 y 2,92 cm2, respectivamente. Concluyendo que la EN del CRF podría utilizarse para el diagnóstico de sarcopenia en esta población con ERCA en TRS tipo HD. Matsuzawa y colaboradores [19]examinaron la validez de la técnica de ultrasonido que evalúa la masa y la fuerza muscular que refleja, con el rendimiento físico, y su aplicabilidad clínica como herramienta diagnóstica de sarcopenia en pacientes en HD. El estudio incluyo 58 pacientes en HD convencional de mantenimiento con 3 sesiones a la semana. Evaluaron la masa muscular, la fuerza muscular y el rendimiento físico en el momento de la visita de los pacientes. Se utilizó la técnica de ultrasonido y el análisis de BIA para estimar la masa muscular. El AST del CRF se correlaciono fuertemente con las mediciones derivadas de BIA y se asoció de forma independiente con el test de fuerza de prensión manual (beta = 4,22, intervalo de confianza [IC] del 95% = 2.23-6.20, p< 0,001), velocidad de la marcha (beta = 0,15, IC del 95% = 0.05-0.26, p= 0,006), tiempo de reposo en silla (beta = 4,33, IC del 95% = 7.34-1.31, p= 0,006), y el score de batería de rendimiento físico corto (beta = 1,81; IC del 95 % = 0,46e3,15; p= 0,010) incluso después del ajuste de las características del paciente. Los puntos de corte para que AST del CRF en el 1/3 distal del fémur discrimine a aquellos pacientes en HD con pérdida de músculo esquelético según el índice de Youden fueron valores menores de 1,88 cm2 y 1,43 cm2 para los hombres y mujeres, respectivamente. Los criterios basados en EN de baja masa muscular arrojaron una sensibilidad de 0,74, una especificidad de 0,94, un valor predictivo positivo de 0,96, un valor predictivo negativo de 0,63 y una precisión diagnóstica de 0,80. De los pacientes que fueron diagnosticados con sarcopenia según los criterios basados en ecografía, el 96% cumplió con los criterios basados en BIA. Además, un estudio multicéntrico publicado por Sahathevan et al [20], evidencio que el área muscular del CRF en el punto medio del fémur menor de 6 cm2 y 4,47 cm2 en mujeres y hombres, respectivamente, se asoció a una probabilidad ocho veces mayor para diagnosticar el síndrome de DPE en paciente en HD.
Por otro lado, otro aspecto que también puede ser valorado mediante la ENM en pacientes con ERC, es la infiltración de grasa muscular (IGM), también conocida como mío-esteatosis, el cual se refiere a cualquier depósito de lípidos que se encuentra en el músculo esquelético. La IGM es preferentemente evaluado mediante métodos basados en imágenes (TAC, RMN y ultrasonido), normalmente de grupos musculares ubicados en las piernas, brazos y en el tronco. Recientemente, Avesani C. et al[21], realizo un artículo de revisión empoderando a la IGM como un marcador de la calidad del musculo. A mayor depósito de grasa en el músculo, menor poder de contracción y capacidad para producir fuerza por unidad de masa muscular. Este concepto apoya la hipótesis de que una disminución de la fuerza muscular no siempre se explica por una disminución en la masa muscular, sino también por otros factores, incluido el depósito de lípidos en el músculo. En la población general, la IGM se asocia con la edad avanzada, la inactividad física, la resistencia a la insulina y la inflamación. En la ERC, el IGM se ha asociado con una disminución de la fuerza muscular y un deterioro de la calidad muscular, así como con anomalías metabólicas, enfermedades cardiovasculares y aumento de la mortalidad. Las intervenciones encaminadas a reducir el IGM en la ERC son incipientes, pero parece que el ejercicio guiado puede mejorar la calidad muscular en pacientes en hemodiálisis. El objetivo de esta revisión narrativa sobre el IGM pretende hacer una llamada de atención para que los ensayos clínicos destinados a la valoración de la masa muscular, no solo se basen en la cantidad, morfología sino también en la calidad del musculo en pacientes con ERC.
Con la colaboración multidisciplinar, se podría mejorar la utilidad clínica de la ENM en el manejo de la desnutrición de la ERC, fomentando la implementación de criterios estandarizados y la realización de estudios más amplios para validar puntos de corte específicos AST y la ecogenicidad del musculo CRF y correlacionarlos con medidas de resultados clínicos. Finalmente, es crucial considerar la variabilidad inter e intra-observador en la práctica clínica, asegurando que el personal de salud esté adecuadamente entrenado en la realización de la EN. De esta manera, podremos garantizar la reproducibilidad y fiabilidad de las mediciones, para así consolidar la EN como un estándar en la evaluación nutricional y funcional de la población renal (Anexo 1).
B- ECOGRAFIA DE LA GRASA SUBCUTÁNEA ABDOMINAL
1. Principios básicos
En la actualidad la forma más precisa para estimar la grasa intraabdominal, siendo considerada el patrón oro, la TAC o RM, sin embargo, ambas están limitadas por su alto coste, escasa disponibilidad y radiación. Por otro lado, la EN puede estimar la adiposidad regional con precisión, siendo una herramienta fácilmente disponible, segura y rentable. La grasa visceral abdominal juega un papel fundamental en la patogenia del síndrome metabólico, que es un factor de riesgo de enfermedad coronaria. La EN cuantifica de manera distintiva la grasa visceral y la grasa subcutánea (capa superficial y profunda).
2.- Equipamiento
Al igual que en la ecografía muscular, se necesitará un equipo de ecografía convencional con un transductor de matriz lineal multifrecuencia de banda ancha (5-10 MHz) adaptado a las necesidades de penetración y resolución axial.
3.- Sistema de realización
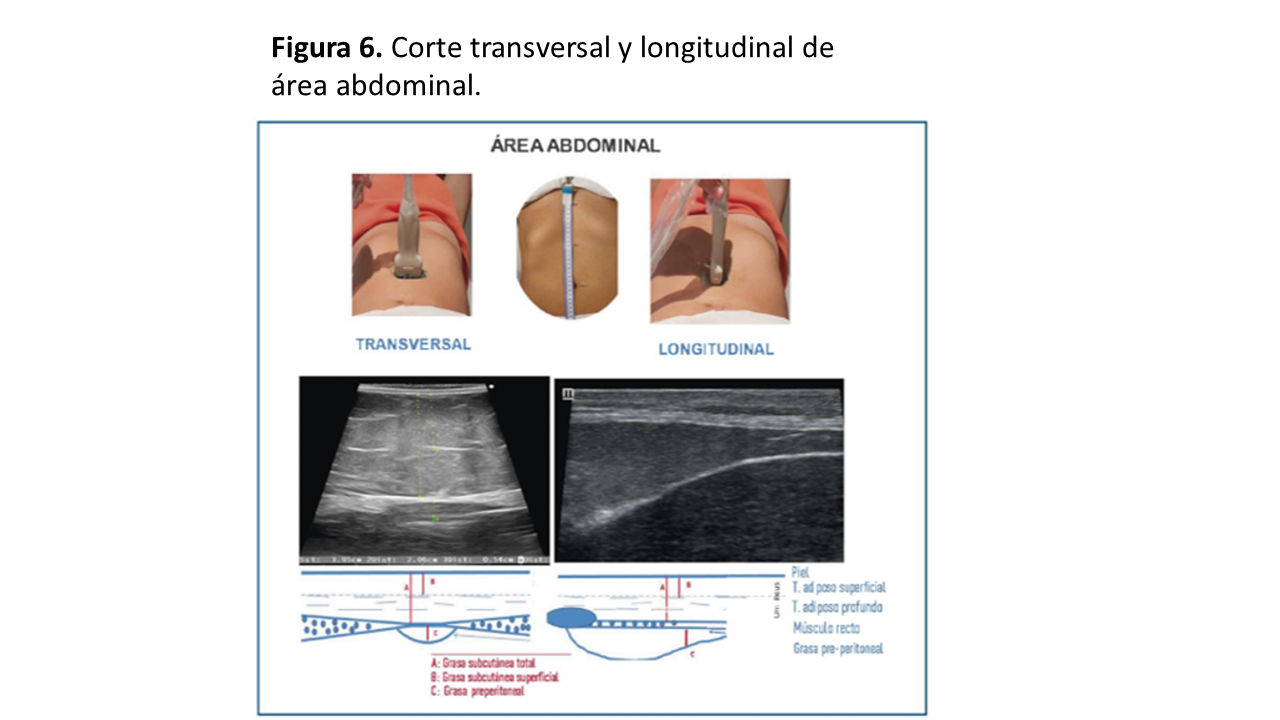
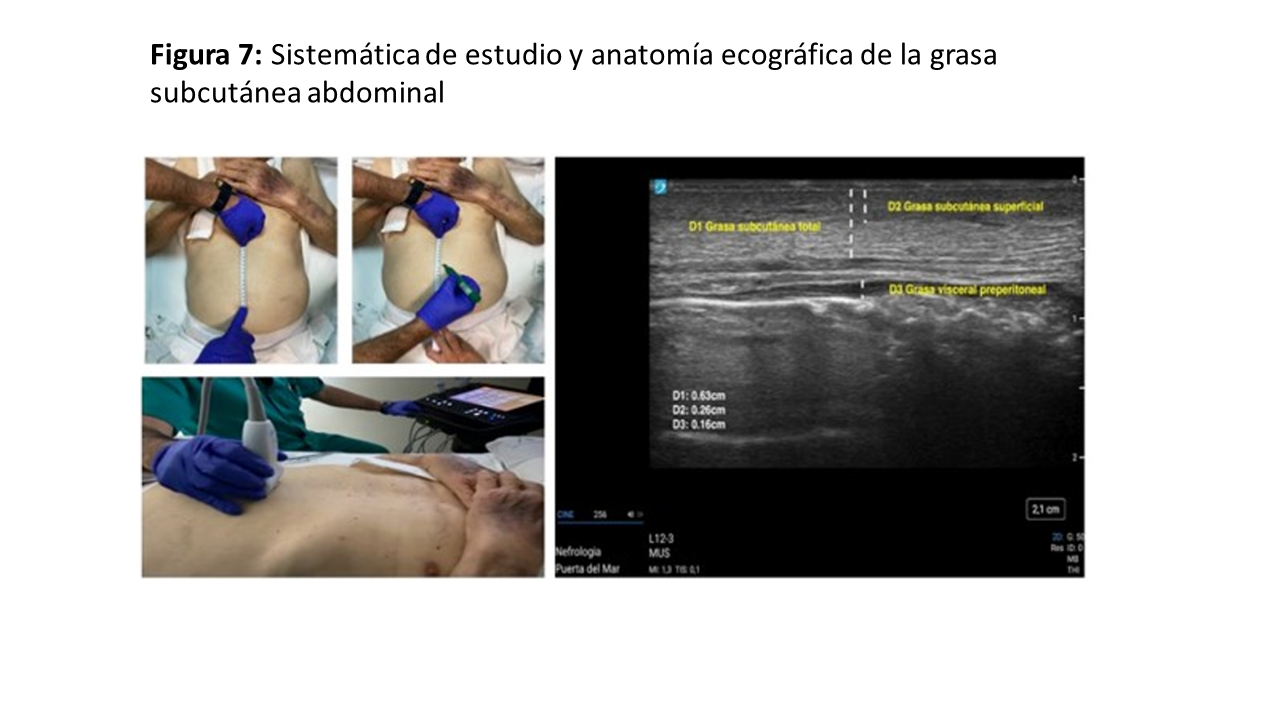
Con el paciente en decúbito supino, colocaremos el transductor en el punto medio de la línea imaginaria situada entre el apéndice xifoides y el ombligo, perpendicular a la piel. Las imágenes se tomarán durante la espiración, con una profundidad de sonda variable de 4-10 cm. Con el transductor en plano axial (transversal), procederemos primero a medir los tejidos adiposos subcutáneos (TAS). Así de esta manera se diferencian las capas del TAS superficial (TASs) y profunda (TASp). Estas capas están separadas por una fina línea hiperecogénica denominada fascia superficialis. Dorsalmente a esta estructura, encontramos el músculo recto anterior del abdomen (RAA) y en su zona central, la unión de los dos músculos rectos, denominada línea alba (Figura 3). Por debajo, en la zona central, veremos la grasa visceral pre-peritoneal (PPT), e inmediatamente por debajo de esta y del RAA, visualizaremos el peritoneo parietal (PP). Realizaremos mediciones del TASs, TASp y de la grasa visceral PPT. Para reducir la variabilidad en la medida, se recomienda repetir la medición tres veces y tomar como resultado el valor medio [8]. Si queremos hacer una valoración más profunda, y si el gas intestinal nos lo permite, con una sonda convexa podremos ver la grasa perirrenal y retroperitoneal (Figura 4).
En el plano longitudinal, sagital para ser más preciso, situaremos el testigo del transductor en posición craneal, más cerca del apéndice xifoides. En esta imagen ecográfica veremos las mismas estructuras en el mismo orden. El grosor de la grasa PPT será mayor, cerca del xifoides, reduciéndose conforme nos acercamos al ombligo (Figura 6) y (Figura 7). Además de los datos morfométricos, podemos obtener datos funcionales (p.ej. fasciculaciones) y metabólicos (p.ej. mío-esteatosis, edema, esclerosis, necrosis).
Por otro lado, la medición del tejido adiposo visceral (equivalente de esteatosis hepática), se realizará en posición transversal, de esta manera se medirá la distancia entre el límite del PP hasta la línea alba en la cara interna en la unión de los dos músculos rectos abdominales.
4. Utilidad clínica
En el sobrepeso y obesidad, con la ecografía de tejido adiposo es de interés, determinar la distribución de la grasa y correlacionarla con las variables clínicas y distinguir los tipos de tejido adiposo, con sus diversas funciones:
- Tejido adiposo subcutáneo superficial (TASs): reserva energética.
- Tejido adiposo subcutáneo profundo (TASp): regulación neuroendocrina.
En un estudio realizado por Cuatrecasas G. et al [10], se correlaciono las mediciones de la grasa abdominal mediante EN con algunas variables metabólicos en pacientes obesos, los autores recomiendan la utilización de la EN para medir los diferentes tipos de tejidos grasos. Por otro lado, la determinación del aumento del área de la grasa PPT medida por RMN ha servido para predecir la esteatohepatitis en pacientes con diabetes mellitus tipo 2 (DM2) [22]. Además, un aumento del tejido adiposo visceral se ha asociado a inflamación en situación de malnutrición y con ello peores resultados clínicos, con una mayor morbimortalidad. Es por ello, que la EN podría ser considerada una técnica para el seguimiento del exceso de adiposidad [8].
FORTALEZAS DE LA ECOGRAFÍA NUTRICIONAL:
Debido a sus características técnicas y los estudios descritos, la EN presenta las siguientes fortalezas:
- Portabilidad
- Económica
- Segura, no emite radiaciones ionizantes y se puede usar en niños y gestantes.
- Entrenamiento técnico relativamente fácil.
- Posibilidad de uso a pie de cama, en paciente encamado, tras la sesión de HD ó en consulta externa.
- Aporta imagen a tiempo renal
- Tiempo de realización corto.
- Método de mediciones corporales no mediado por ecuaciones de regresión o teóricas.
- Aporta información cuantitativa y cualitativa.
- Útil en el seguimiento.
- Emergente.
LIMITACIONES DE LA ECOGRAFIA NUTRICIONAL:
La ecografía nutricional (EN), aunque es una herramienta valiosa en la valoración morfofuncional de pacientes con enfermedad renal crónica (ERC), presenta limitaciones intrínsecas que deben considerarse para su aplicación en la práctica clínica.
- Equipamiento y Técnico:
La calidad de la imagen ecográfica depende críticamente de la tecnología del transductor y de los ajustes del equipo, incluyendo la frecuencia, el rango dinámico, la ganancia, la profundidad y el enfoque. La habilidad del técnico en el manejo y configuración del dispositivo es esencial para identificar con precisión estructuras musculares y tejido adiposo.
- Técnicas de Medición:
La estandarización de los puntos de medición y la técnica de aplicación de la sonda son desafíos claves. Una colocación incorrecta y una presión variable pueden afectar la visualización y las mediciones, y pueden surgir artefactos como refracción, reverberación, y sombras acústicas.
- Variabilidad Inter e Intraobservador:
La variabilidad en las mediciones entre diferentes observadores, y en ocasiones del mismo observador, puede comprometer la consistencia y fiabilidad de la EN. Esta variabilidad puede mitigarse mediante la realización de múltiples mediciones y un entrenamiento riguroso.
- Estándares de Normalidad:
Actualmente, no existen patrones de normalidad establecidos para la ERC que consideren las distintas etapas de la enfermedad, lo que limita la capacidad de interpretar medidas ecográficas nutricionales en términos absolutos.
- Necesidad de Investigación Clínica:
Para integrar la EN eficazmente en la nefrología, se requieren estudios clínicos que definan patrones de evaluación, establezcan puntos de corte específicos para diferentes estadios de ERC, y que relacionen estas medidas con resultados clínicos relevantes.
- Formación y Desarrollo de Habilidades:
Es imperativo que los nefrólogos adquieran la formación y desarrollen las habilidades necesarias para realizar e interpretar la ecografía de manera competente, para así estandarizar su uso en la evaluación de la malnutrición y el estado morfofuncional de la desnutrición asociado a la enfermedad.
- Integración con Herramientas Establecidas:
Un desafío es incorporar la EN junto con herramientas ya establecidas como la antropometría, marcadores bioquímicos, BIA, pruebas funcionales, dinamometría y evaluaciones de calidad de vida, para obtener una comprensión más completa del estado nutricional del paciente con ERC, tanto en TRS como fuera de él.
Por lo tanto, como resumen de las limitaciones, tendríamos las siguientes:
• Alteración inducida por el impacto mecánico de la presión aplicada.
• No existen medidas de normalidad, por patologías ni poblaciones específicas en la ERC según sus diferentes estadios.
• Se necesitan estudios clínicos que ayuden a establecer unos patrones de evaluación.
CONCLUSIONES
1. La EN surge como una técnica emergente en el campo de la nutrición, que valora el compartimento muscular y el tejido adiposo.
2. Presenta importantes ventajas como su portabilidad, seguridad, accesibilidad y medición directa de estructuras a tiempo real.
3. Como limitaciones importantes presenta la falta de estandarización de técnica y de toma de medidas, así como la falta de valores de normalidad y de punto de corte en población con ERC.
4. Es importante la formación de profesionales en EN para integrar los hallazgos ecográficos, junto a otros datos clínicos y analíticos para una valoración integral en la nutrición.
Anexo: Plantilla para informe de EN (Figura 8)
Referencias bibliográficas
1
.
Carrero JJ, Stenvinkel P, Cuppari L, Ikizler TA, Kalantar-Zadeh K, Kaysen G, et al. Etiology of the protein-energy wasting syndrome in chronic kidney disease: a consensus statement from the International Society of Renal Nutrition and Metabolism (ISRNM). J Ren Nutr [Internet]. 2013 Mar [cited 2024 May 5];23(2):77¿90. Available from: https://pubmed.ncbi.nlm.nih.gov/23428357/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F23428357%2F
2
.
Jensen GL, Mirtallo J, Compher C, Dhaliwal R, Forbes A, Figueredo Grijalba R, et al. Adult starvation and disease-related malnutrition: a proposal for etiology-based diagnosis in the clinical practice setting from the International Consensus Guideline Committee. JPEN J Parenter Enteral Nutr [Internet]. 2010 Mar [cited 2024 May 5];34(2):156¿9. Available from: https://pubmed.ncbi.nlm.nih.gov/20375423/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F20375423%2F
3
.
Cooper BA, Bartlett LH, Aslani A, Allen BJ, Ibels LS, Pollock CA. Validity of subjective global assessment as a nutritional marker in end-stage renal disease. Am J Kidney Dis [Internet]. 2002 [cited 2024 May 5];40(1):126¿32. Available from: https://pubmed.ncbi.nlm.nih.gov/12087570/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F12087570%2F
4
.
Kalantar-Zadeh K, Kleiner M, Dunne E, Lee GH, Luft FC. A modified quantitative subjective global assessment of nutrition for dialysis patients. Nephrol Dial Transplant [Internet]. 1999 [cited 2024 May 5];14(7):1732¿8. Available from: https://pubmed.ncbi.nlm.nih.gov/10435884/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F10435884%2F
5
.
Steiber A, Leon JB, Secker D, McCarthy M, McCann L, Serra M, et al. Multicenter Study of the Validity and Reliability of Subjective Global Assessment in the Hemodialysis Population. Journal of Renal Nutrition. 2007 Sep;17(5):336¿42.
http://www.ncbi.nlm.nih.gov/pubmed/?term=2007+Sep%3B17%285%29%3A336%E2%80%9342
6
.
Cederholm T, Jensen GL, Correia MITD, Gonzalez MC, Fukushima R, Higashiguchi T, et al. GLIM criteria for the diagnosis of malnutrition - A consensus report from the global clinical nutrition community. Clin Nutr [Internet]. 2019 Feb 1 [cited 2024 May 5];38(1):1¿9. Available from: https://pubmed.ncbi.nlm.nih.gov/30181091/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F30181091%2F
7
.
Ticinesi A, Narici M V., Lauretani F, Nouvenne A, Colizzi E, Mantovani M, et al. Assessing sarcopenia with vastus lateralis muscle ultrasound: an operative protocol. Aging Clin Exp Res [Internet]. 2018 Dec 1 [cited 2024 May 5];30(12):1437¿43. Available from: https://pubmed.ncbi.nlm.nih.gov/29700758/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F29700758%2F
8
.
García-Almeida JM, García-García C, Vegas-Aguilar IM, Ballesteros Pomar MD, Cornejo-Pareja IM, Fernández Medina B, et al. Nutritional ultrasound®: Conceptualisation, technical considerations and standardisation. Endocrinol Diabetes Nutr [Internet]. 2023 Mar [cited 2024 May 5];70 Suppl 1:74¿84. Available from: https://pubmed.ncbi.nlm.nih.gov/36935167/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F36935167%2F
9
.
Perkisas S, Bastijns S, Baudry S, Bauer J, Beaudart C, Beckwée D, et al. Application of ultrasound for muscle assessment in sarcopenia: 2020 SARCUS update. Eur Geriatr Med [Internet]. 2021 Feb 1 [cited 2024 May 5];12(1):45¿59. Available from: https://pubmed.ncbi.nlm.nih.gov/33387359/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F33387359%2F
10
.
Cuatrecasas G, de Cabo F, Coves MJ, Patrascioiu I, Aguilar G, March S, et al. Ultrasound measures of abdominal fat layers correlate with metabolic syndrome features in patients with obesity. Obes Sci Pract [Internet]. 2020 Dec 1 [cited 2024 May 5];6(6):660¿7. Available from: https://pubmed.ncbi.nlm.nih.gov/33354344/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F33354344%2F
11
.
Carrero JJ, Chmielewski M, Axelsson J, Snaedal S, Heimbürger O, Bárány P, et al. Muscle atrophy, inflammation and clinical outcome in incident and prevalent dialysis patients. Clin Nutr [Internet]. 2008 Aug [cited 2024 May 5];27(4):557¿64. Available from: https://pubmed.ncbi.nlm.nih.gov/18538898/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F18538898%2F
12
.
Watson EL, Major RW, Wilkinson TJ, Greening NJ, Gould DW, Barratt J, et al. The association of muscle size, strength and exercise capacity with all-cause mortality in non-dialysis-dependent CKD patients. Clin Physiol Funct Imaging [Internet]. 2020 Nov 1 [cited 2024 May 5];40(6):399¿406. Available from: https://pubmed.ncbi.nlm.nih.gov/32772507/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F32772507%2F
13
.
Vogt BP, Borges MCC, Goés CR de, Caramori JCT. Handgrip strength is an independent predictor of all-cause mortality in maintenance dialysis patients. Clin Nutr [Internet]. 2016 Dec 1 [cited 2024 May 5];35(6):1429¿33. Available from: https://pubmed.ncbi.nlm.nih.gov/27083497/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F27083497%2F
14
.
Isoyama N, Qureshi AR, Avesani CM, Lindholm B, Bárány P, Heimbürger O, et al. Comparative associations of muscle mass and muscle strength with mortality in dialysis patients. Clin J Am Soc Nephrol [Internet]. 2014 [cited 2024 May 5];9(10):1720¿8. Available from: https://pubmed.ncbi.nlm.nih.gov/25074839/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F25074839%2F
15
.
Ribeiro HS, Neri SGR, Oliveira JS, Bennett PN, Viana JL, Lima RM. Association between sarcopenia and clinical outcomes in chronic kidney disease patients: A systematic review and meta-analysis. Clin Nutr [Internet]. 2022 May 1 [cited 2024 May 5];41(5):1131¿40. Available from: https://pubmed.ncbi.nlm.nih.gov/35430544/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F35430544%2F
16
.
Nijholt W, Beek L ter, Hobbelen JSM, van der Vaart H, Wempe JB, van der Schans CP, et al. The added value of ultrasound muscle measurements in patients with COPD: An exploratory study. Clin Nutr ESPEN [Internet]. 2019 Apr 1 [cited 2024 May 5];30:152¿8. Available from: https://pubmed.ncbi.nlm.nih.gov/30904216/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F30904216%2F
17
.
Yang Q, Zhang C, Zhang Z, Su B. Muscle ultrasound to diagnose sarcopenia in chronic kidney disease: a systematic review and bayesian bivariate meta-analysis. BMC Nephrol [Internet]. 2024 Dec 1 [cited 2024 May 5];25(1). Available from: https://pubmed.ncbi.nlm.nih.gov/38178026/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F38178026%2F
18
.
Nagy E, Samaan E, El-Gamal M, Shamsuddin M, Tharwat S. Concordance between muscle mass assessed by bioelectrical impedance analysis and by muscle ultrasound: a cross-sectional study in a cohort of patients on chronic hemodialysis. BMC Nephrol [Internet]. 2024 Dec 1 [cited 2024 May 5];25(1). Available from: https://pubmed.ncbi.nlm.nih.gov/38321408/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F38321408%2F
19
.
Matsuzawa R, Yamamoto S, Suzuki Y, Imamura K, Harada M, Matsunaga A, et al. The clinical applicability of ultrasound technique for diagnosis of sarcopenia in hemodialysis patients. Clin Nutr [Internet]. 2021 Mar 1 [cited 2024 May 5];40(3):1161¿7. Available from: https://pubmed.ncbi.nlm.nih.gov/32798065/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F32798065%2F
20
.
Sahathevan S, Khor BH, Singh BKS, Sabatino A, Fiaccadori E, Daud ZAM, et al. Association of Ultrasound-Derived Metrics of the Quadriceps Muscle with Protein Energy Wasting in Hemodialysis Patients: A Multicenter Cross-Sectional Study. Nutrients [Internet]. 2020 Nov 1 [cited 2024 May 5];12(11):1¿16. Available from: https://pubmed.ncbi.nlm.nih.gov/33238633/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F33238633%2F
21
.
Avesani CM, de Abreu AM, Ribeiro HS, Brismar TB, Stenvinkel P, Sabatino A, et al. Muscle fat infiltration in chronic kidney disease: a marker related to muscle quality, muscle strength and sarcopenia. J Nephrol [Internet]. 2023 Apr 1 [cited 2024 May 5];36(3):895. Available from: /pmc/articles/PMC10090035/
http://www.ncbi.nlm.nih.gov/pubmed/?term=Available+from%3A+%2Fpmc%2Farticles%2FPMC10090035%2F
22
.
Parente DB, Oliveira Neto JA, Brasil PEAA, Paiva FF, Ravani JPR, Gomes MB, et al. Preperitoneal fat as a non-invasive marker of increased risk of severe non-alcoholic fatty liver disease in patients with type 2 diabetes. J Gastroenterol Hepatol [Internet]. 2018 Feb 1 [cited 2024 May 5];33(2):511¿7. Available from: https://pubmed.ncbi.nlm.nih.gov/28726335/
http://www.ncbi.nlm.nih.gov/pubmed/?term=gov%2F28726335%2F