Trasplante Renal de Donante Vivo ABO Incompatible
AUTORES
David Ramos Escorihuela, Hospital General Universitario de Castellón
Paloma Martin, Clínica Universitaria de Navarra.
Anna Manonelles, Hospital Universitari de Bellvitge, Barcelona
Leo Cruzado, Hospital General de Elche
Ernesto Fernández Tarrago, Hospital Insular de Canarias, Las Palmas
Ángela García Rojas, Hospital Virgen del Rocío, Sevilla
Maria Pilar Fraile, Hospital General de Salamanca
Cristina Galeano, Hospital Ramón y Cajal, Madrid
Pilar Galindo, Hospital Virgen de las Nieves, Granada
Nuria Garra, Hospital de Manresa
Santiago Llorente, Hospital Virgen de la Arrixaca, Murcia
Elena González, Hospital Universitario La Paz, Madrid
Leonardo Calle, Hospital General de Segovia
Marina Muñoz, Hospital Vall d’Hebrón, Barcelona
Rosa Sanchez, Hospital General de Villalba
Nuria Serra, Fundación Puigvert, Barcelona
Maria Luisa Suárez, Hospital Central de Asturias, Oviedo
Maria Isabel Sáenz, Hospital Universitario de Burgos
Natalia Polanco, Hospital 12 de Octubre, Madrid
INTRODUCCIÓN
El trasplante renal con donante vivo ABO incompatible es una alternativa más dentro de las opciones de tratamiento que existen para el manejo de la insuficiencia renal avanzada, que puede beneficiar a determinados pacientes. Incluso puede ser la mejor opción de tratamiento para algunos de ellos. Supone un aumento de la cantidad de donantes disponible, y un incremento del número de trasplantes que se pueden realizar. Para llevar a cabo este tipo de trasplantes con éxito es necesario un tratamiento de acondicionamiento para reducir las isoaglutininas circulantes por debajo de un nivel determinado. Los protocolos de acondicionamiento incluyen técnicas de eliminación extracorpórea de las isoaglutininas, tratamientos dirigidos contra los linfocitos B como el rituximab, y modulación de la respuesta inmunológica con inmunoglobulinas intravenosas. Con el desarrollo de estos protocolos este tipo de trasplante se ha convertido en una opción consolidada, realizándose anualmente a nivel internacional y con buenos resultados un número considerable de procedimientos.
En España se realizan más de 30 trasplantes de este tipo anuales en los últimos años [1], lo que supone aproximadamente un 10% de la actividad global de trasplante renal de donante vivo.
El objeto de esta revisión es analizar las diferencias en los protocolos de acondicionamiento y las controversias que existen en este tipo de trasplantes.
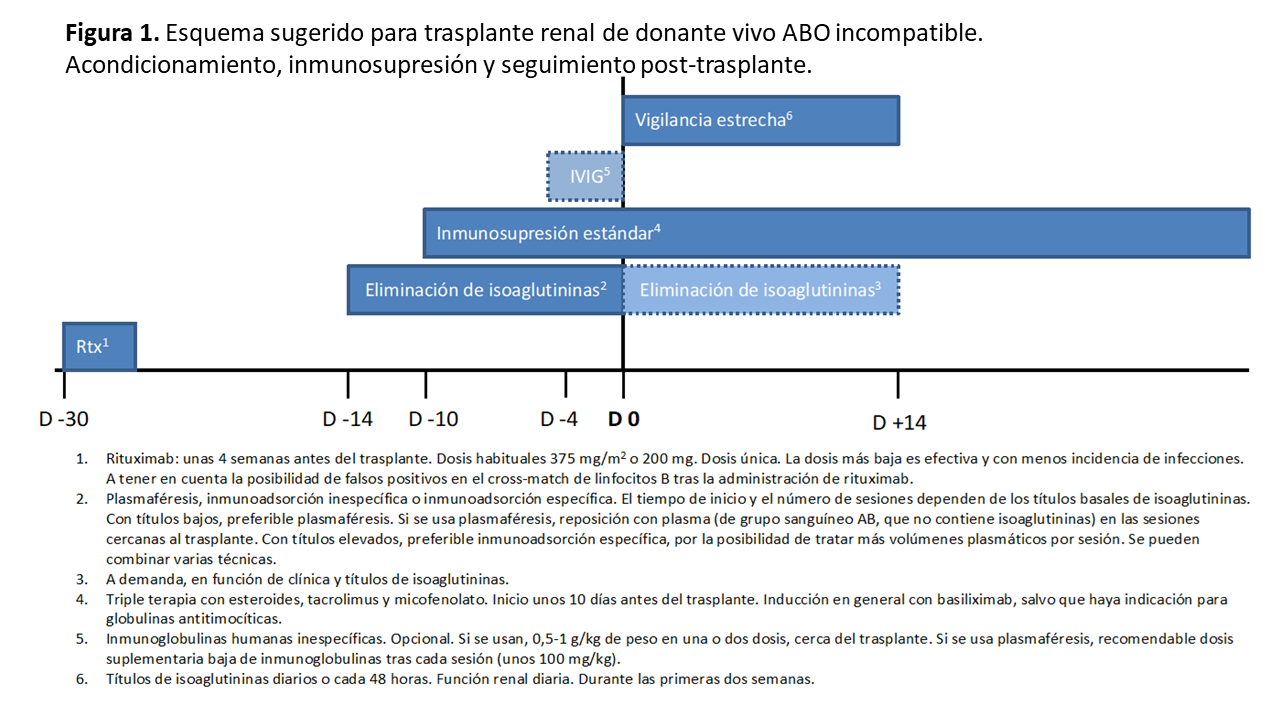
En la (Figura 1) se sugiere un esquema resumen para trasplante renal de donante vivo ABO incompatible, incluyendo el acondicionamiento, inmunosupresión y seguimiento postrasplante.
¿ES NECESARIO EL TRASPLANTE ABO INCOMPATIBLE DE DONANTE VIVO?
La probabilidad de incompatibilidad ABO frente a potenciales donantes vivos de un receptor es aproximadamente un 30% [2] [3], por lo que este tipo de procedimiento puede suponer un incremento significativo en el número de trasplantes que se pueden realizar.
Para responder adecuadamente a la pregunta sobre la justificación de este tipo de trasplantes, el comparador adecuado para evaluar los resultados debe ser el mismo tipo de paciente que espera hasta conseguir un trasplante de donante vivo ABO compatible en el programa de trasplante cruzado, o que espera hasta conseguir un trasplante de donante cadáver ABO compatible. Sin embargo, la gran mayoría de trabajos se centran en comparar los resultados del trasplante de donante vivo ABO incompatible con los del donante vivo ABO compatible.
Hay dos estudios que comparan la evolución de los trasplantes de donante vivo ABO incompatible con la de pacientes no trasplantados que permanecen en diálisis, o trasplantados con donantes compatibles. Un estudio retrospectivo [4], con datos de registro, y con unos tres mil pacientes analizados, muestra mejor supervivencia del paciente en los trasplantes de donante vivo ABO incompatibles comparada con los pacientes que esperan a un trasplante de donante cadáver o de donante vivo ABO compatible (mortalidad para ABOi HR 0,67 (IC 95% 0,53-0,84). Otro estudio, también retrospectivo y con datos de registro [2], que analiza unos 1500 pacientes, muestra mejor supervivencia del paciente y una tendencia a mejor supervivencia del injerto en el trasplante renal de donante vivo ABO incompatible comparadas con el trasplante renal de donante cadáver (mortalidad para ABOi frente a donante cadáver HR 0,69 (95%CI 0,49-0,96), pérdida de injerto (muerte censurada) HR 0,77 (95%CI 0,54-1,11).
Conclusiones y recomendaciones:
* La supervivencia del paciente y del injerto son mejores en el trasplante de donante vivo ABO incompatible comparadas con permanecer en lista de espera de donante cadáver y recibir eventualmente un trasplante compatible. Por lo tanto, el trasplante de donante vivo ABO incompatible es necesario (Grado de recomendación fuerte. Calidad de la evidencia baja).
* Comparado con el trasplante de donante vivo cruzado, la ventaja del trasplante de donante vivo ABO incompatible dependerá del tiempo que transcurra hasta encontrar un donante compatible (Opinión).
* Circunstancias a favor del trasplante renal ABO incompatible de donante vivo frente a otras opciones:
o No disponer de trasplante ABO compatible de donante vivo.
o Receptor grupo O.
o Títulos de isoaglutininas basales bajos.
o Identidad HLA entre donante y receptor.
o Preferencia de los pacientes.
¿LA SUPERVIVENCIA DEL PACIENTE ES COMPARABLE A LA DEL TRASPLANTE RENAL DE DONANTE VIVO ABO COMPATIBLE?
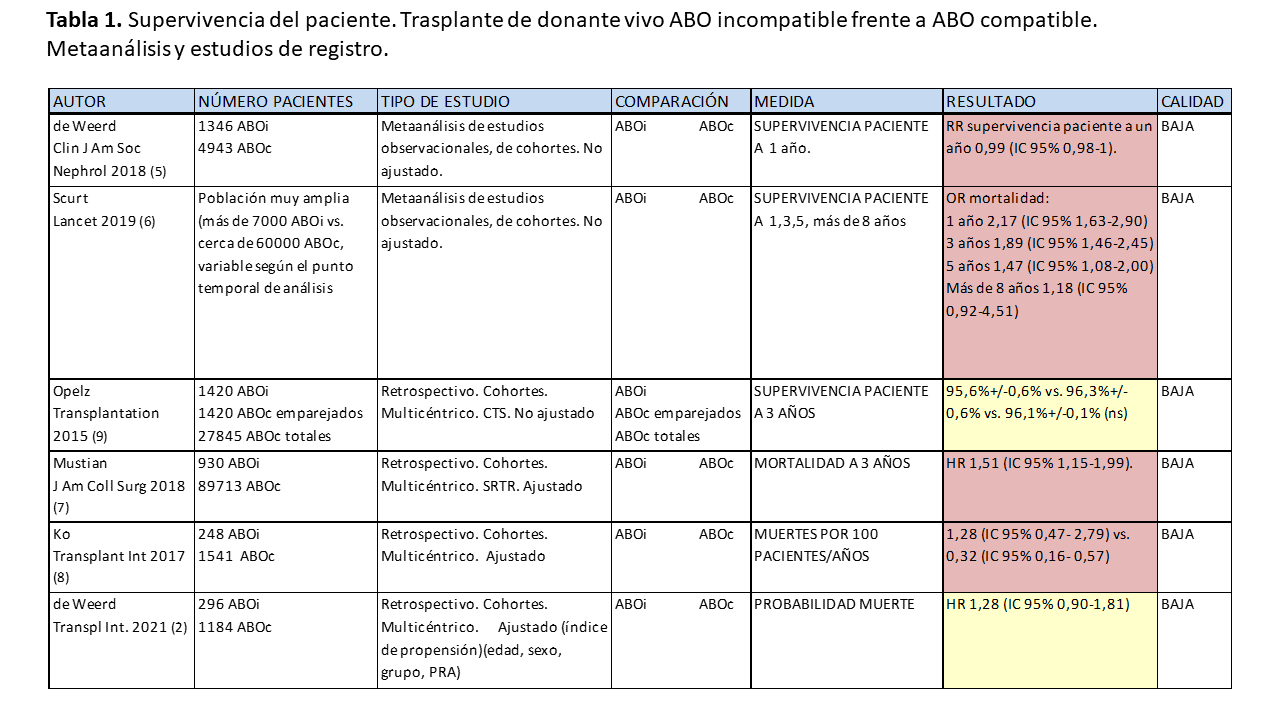
Los datos comparativos de supervivencia del paciente entre los trasplantes de donante vivo ABO incompatible y ABO compatible apoyan la realización de este tipo de trasplantes. Existen dos metaanálisis de estudios observacionales retrospectivos que muestran mejor supervivencia del paciente en los trasplantes de donante vivo ABO compatibles, sobre todo en los primeros años postrasplante, aunque la diferencia es pequeña [5] [6]. La mayoría de estudios de registros muestran las mismas conclusiones [7] [8], excepto alguno de ellos, que no detectan diferencias [2] [9].
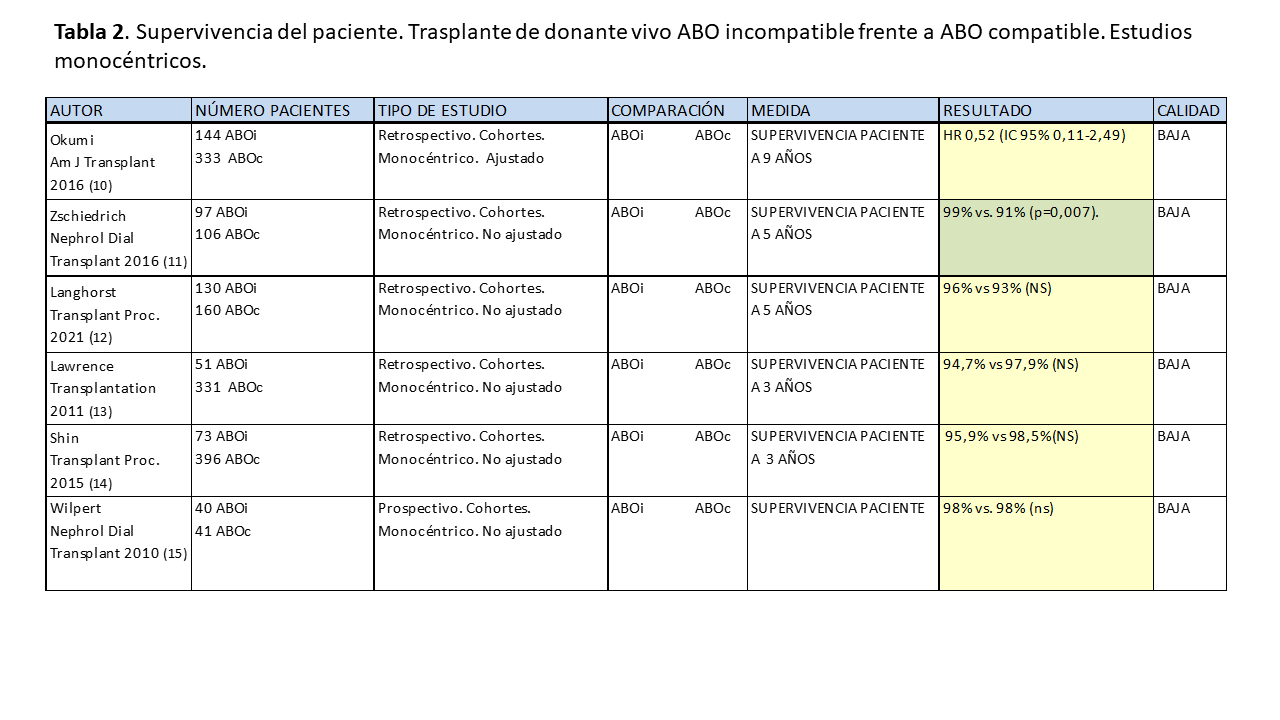
Los datos de los estudios unicéntricos más relevantes no muestran, sin embargo, diferencias en la supervivencia del paciente. Estos estudios tienen un menor número de pacientes, pero las pautas de acondicionamiento e inmunosupresión están mejor definidas y son más uniformes [10] [15].
En las (Tabla 1) y (Tabla 2) se muestran las características y resultados más relevantes de los estudios citados.
Conclusiones y recomendaciones:
* En los metaanálisis de estudios retrospectivos y en los estudios de registro, la supervivencia del paciente tras el trasplante de donante vivo ABO incompatible parece ser algo menor que tras el trasplante de donante vivo ABO compatible. La diferencia se observa sobre todo en los primeros años postrasplante, y a largo plazo parece que desaparece (Calidad de la evidencia baja).
* Estos hallazgos no se confirman en todos los estudios. Algunos de ellos no detectan diferencias en la supervivencia del paciente (Calidad de la evidencia baja).
* La gran mayoría de estudios monocéntricos, con menor número de pacientes, pero con pautas de tratamiento mejor definidas y más uniformes, no detectan diferencias en la supervivencia del paciente (Calidad de la evidencia baja).
* Globalmente estos datos apoyan la realización de trasplantes de donante vivo ABO incompatibles (Grado de recomendación fuerte. Calidad de la evidencia baja).
¿LA SUPERVIVENCIA DEL INJERTO ES TAMBIÉN COMPARABLE?
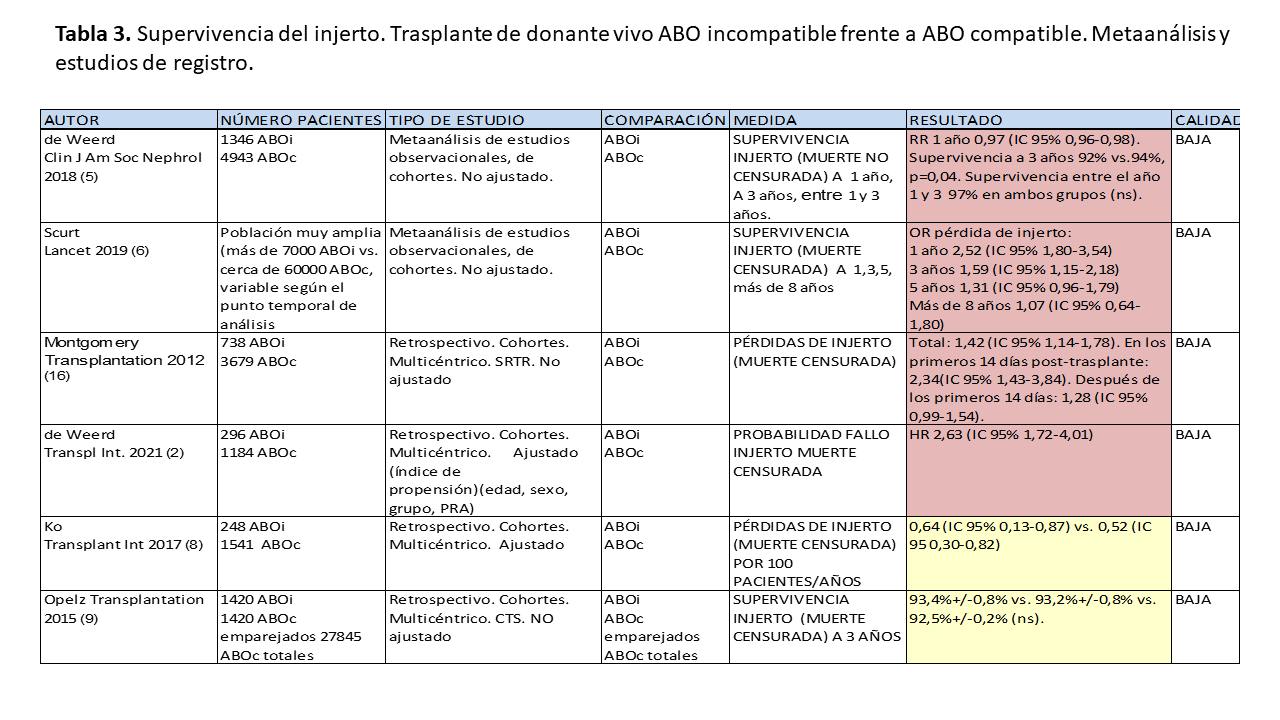
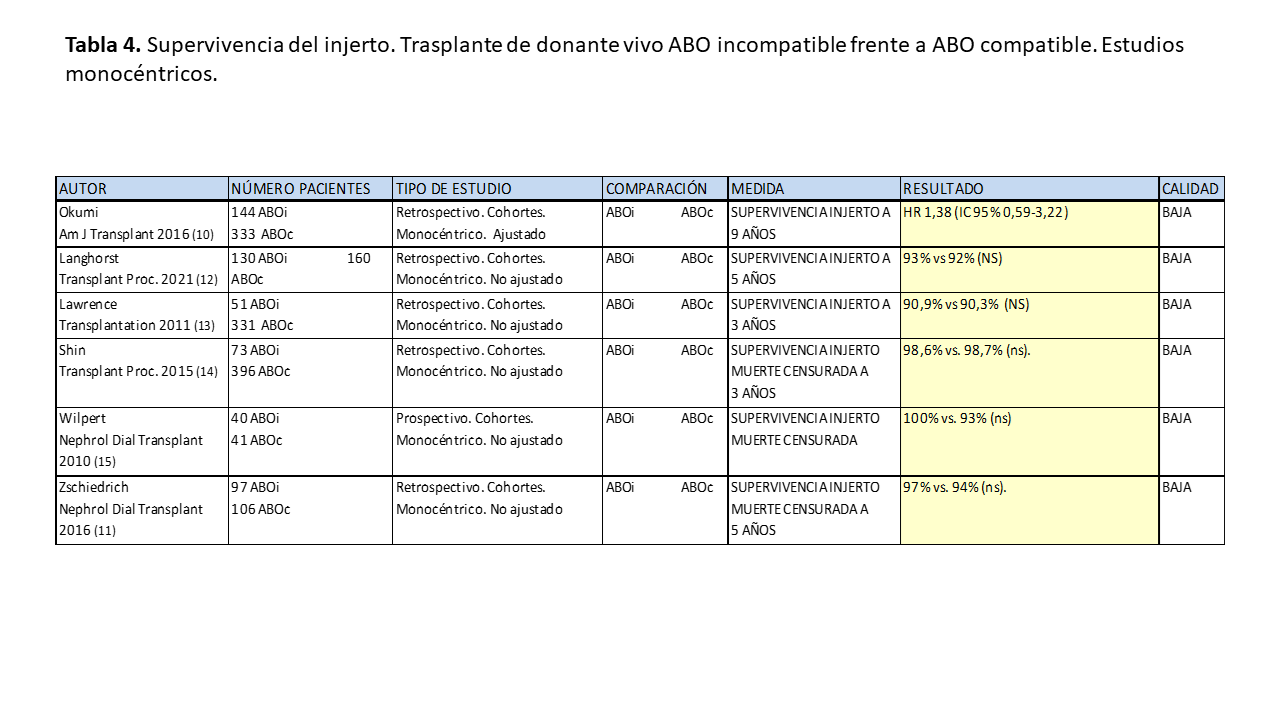
El escenario respecto a la supervivencia del injerto es similar al de la supervivencia del paciente. Al igual que en el caso anterior, los datos apoyan la realización de este tipo de trasplantes. Los datos de los metaanálisis de estudios observacionales [5] [6] y la mayoría de estudios de registro [2] [16] muestran mejor supervivencia del injerto en el trasplante de donante vivo ABO compatible respecto al incompatible, aunque de nuevo con diferencias pequeñas y en la primera época tras el trasplante. También hay algunos estudios de registro que no muestran diferencias [8] [9]. Y de nuevo en los estudios monocéntricos muestran resultados comparables entre ambos tipos de trasplantes [10] [15].
En las (Tabla 3) y (Tabla 4) se muestran las características y resultados más relevantes de los estudios citados.
Conclusiones y recomendaciones:
* La supervivencia del injerto tras el trasplante de donante vivo ABO incompatible parece ser algo inferior al trasplante de donante vivo ABO compatible. Esto se detecta en la mayoría de los metaanálisis de estudios observacionales y en los registros multicéntricos (Calidad de la evidencia baja).
* La reducción de la supervivencia del injerto parece detectarse en las fases iniciales del trasplante. Posteriormente, parece ser similar a la del trasplante ABO compatible (Calidad de la evidencia baja).
* En algunos estudios de registro no se detectan diferencias en la supervivencia del injerto entre ambos tipos de trasplante (Calidad de la evidencia baja).
* La gran mayoría de estudios unicéntricos, con menor número de pacientes, pero con pautas de tratamiento mejor definidas y más uniformes, no detectan diferencias en la supervivencia del injerto (Calidad de la evidencia baja)
* Globalmente estos datos apoyan la realización de trasplantes de donante vivo ABO incompatibles (Grado de recomendación fuerte. Calidad de la evidencia baja).
¿ES MAYOR LA INCIDENCIA DE RECHAZO AGUDO?
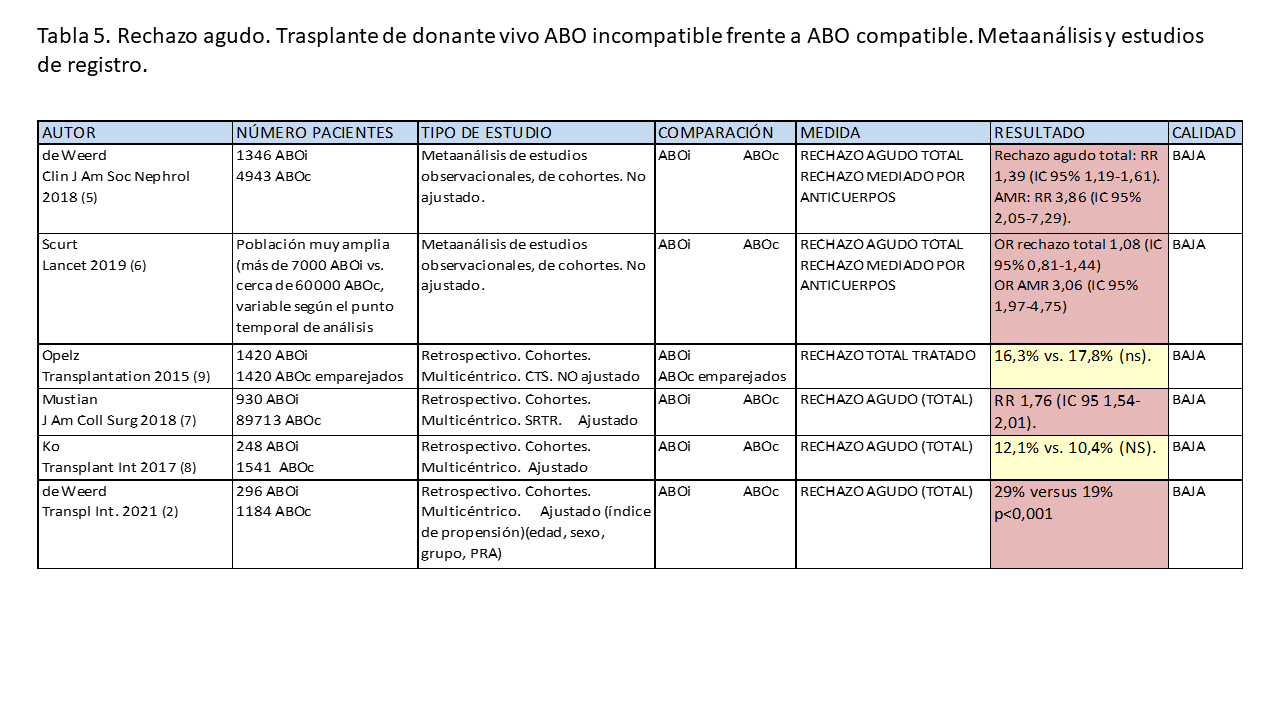
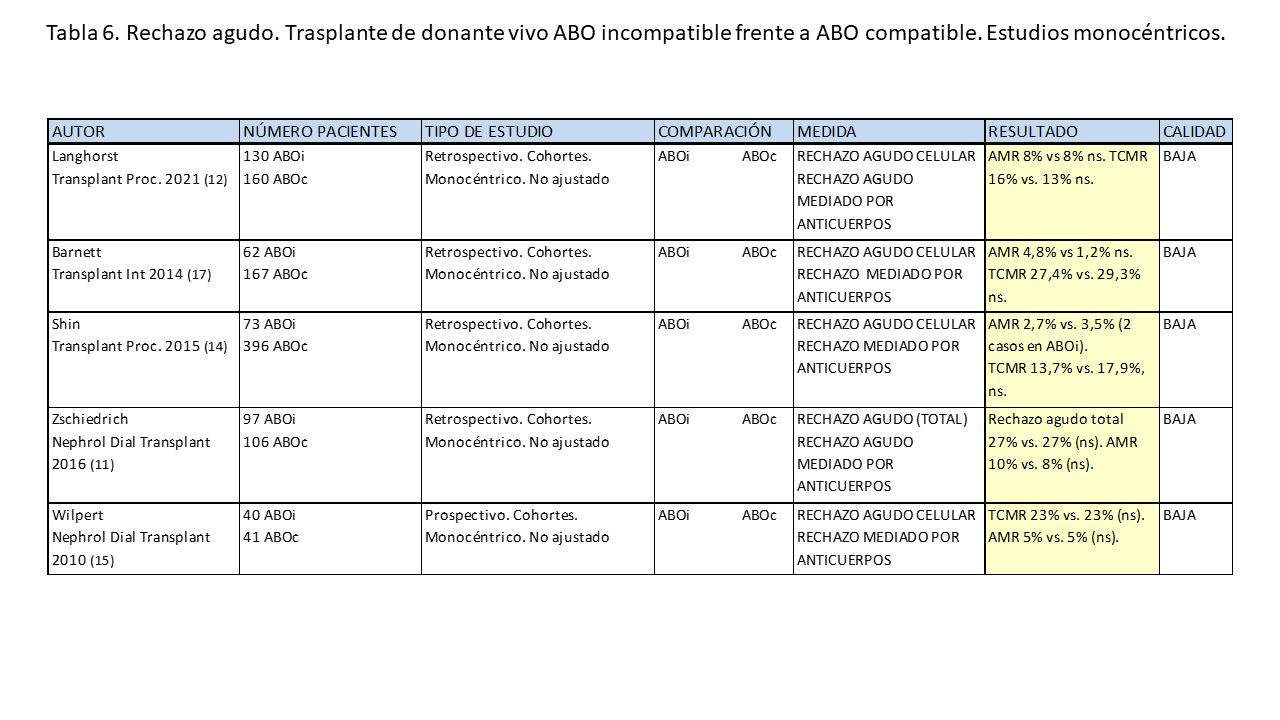
La incidencia de rechazo agudo, fundamentalmente a expensas del rechazo mediado por anticuerpos, parece ser mayor en el trasplante de donante vivo ABO incompatible comparada con el trasplante compatible. De nuevo, esta diferencia sólo se detecta en los metaanálisis de estudios observacionales [5] [6] y en los estudios de registro de mejor calidad [2] [7], aunque no en todos [8] [9], y no se detecta en los estudios monocéntricos [11] [12] [14] [15] [17].
En las (Tabla 5) y (Tabla 6) se muestran las características y resultados más relevantes de los estudios citados.
Conclusiones y recomendaciones:
* El trasplante de donante vivo ABO incompatible se asocia a una mayor tasa de rechazo agudo, total y mediado por anticuerpos, comparado con el trasplante de donante vivo ABO compatible. Esta diferencia se detecta en los metaanálisis de estudios observacionales y en los estudios de registro de mejor calidad (Calidad de la evidencia baja).
* En los estudios unicéntricos, al igual que sucede con la supervivencia del paciente y del injerto, no se detectan estas diferencias (Calidad de la evidencia baja).
¿HAY MÁS COMPLICACIONES INFECCIOSAS Y NEOPLÁSICAS RESPECTO AL TRASPLANTE COMPATIBLE?
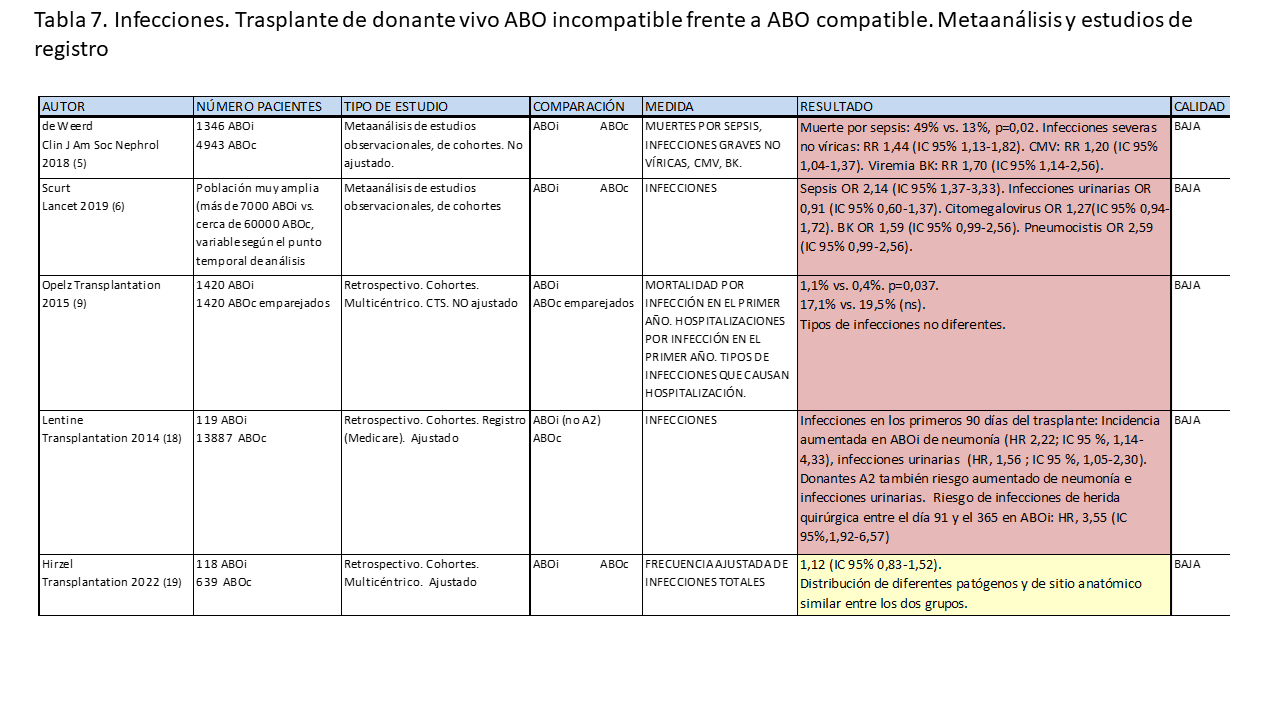
Aunque la incidencia global de infecciones parece similar en ambos tipos de trasplante, en el incompatible parece haber mayor incidencia de infecciones graves y de infección como causa de muerte. Al igual que en los casos anteriores, estos resultados se observan en los metaanálisis de estudios observacionales y en los estudios de registro [5] [6] [9] [18], excepto en uno [19], y no en los estudios monocéntricos [10] [11] [12] [14] [15]. En las (Tabla 7) y (Tabla 8) se muestran los datos de estos estudios.
La incidencia de neoplasias se aborda en escasos estudios, con calidad de la evidencia baja, los cuales no encuentran diferencias entre los dos tipos de trasplante. En un estudio de registro europeo, con más de 1400 pacientes por grupo, la tasa de neoplasias a 3 años no muestra diferencias [9]. Otro estudio de registro, norteamericano, muestra un riesgo relativo de neoplasias a 2 años similar [20]. Y, por último, un tercer estudio monocéntrico, con número bajo de pacientes y seguimiento medio de 3 años, encuentra pocos casos de neoplasias en ambos grupos [15].
Conclusiones y recomendaciones:
* El trasplante de donante vivo ABO incompatible se asocia a mayor incidencia de muerte por causas infecciosas e infecciones graves respecto al trasplante de donante vivo ABO compatible. Esto se observa en los metaanálisis de estudios observacionales y en la mayoría de los estudios de registro (Calidad de la evidencia baja).
* De nuevo en los estudios monocéntricos no se detectan diferencias en la incidencia de infecciones entre los dos tipos de trasplante (Calidad de la evidencia baja).
* Hay muy pocos estudios que analicen la incidencia de neoplasias en el trasplante de donante vivo ABO incompatible comparado con el trasplante de donante vivo ABO compatible. No muestran diferencias entre los dos tipos (Calidad de la evidencia baja).
¿HAY MAYOR RIESGO DE HEMORRAGIA RESPECTO AL TRASPLANTE COMPATIBLE?
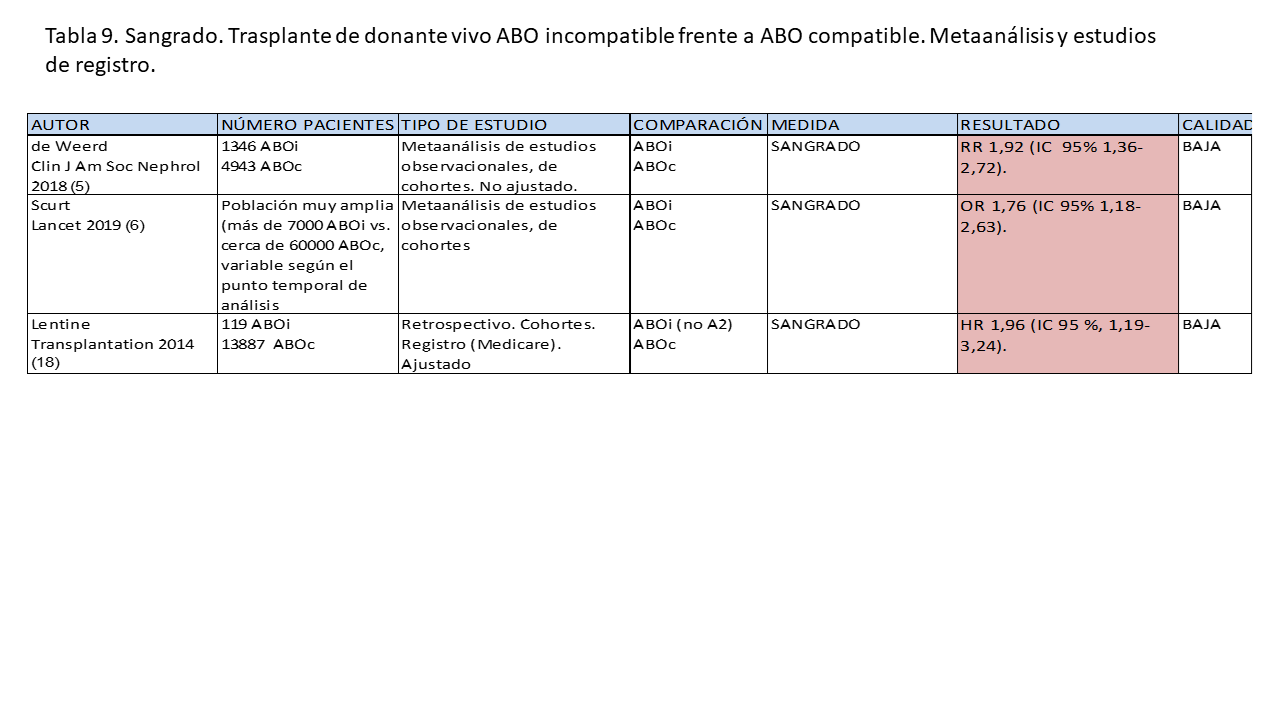
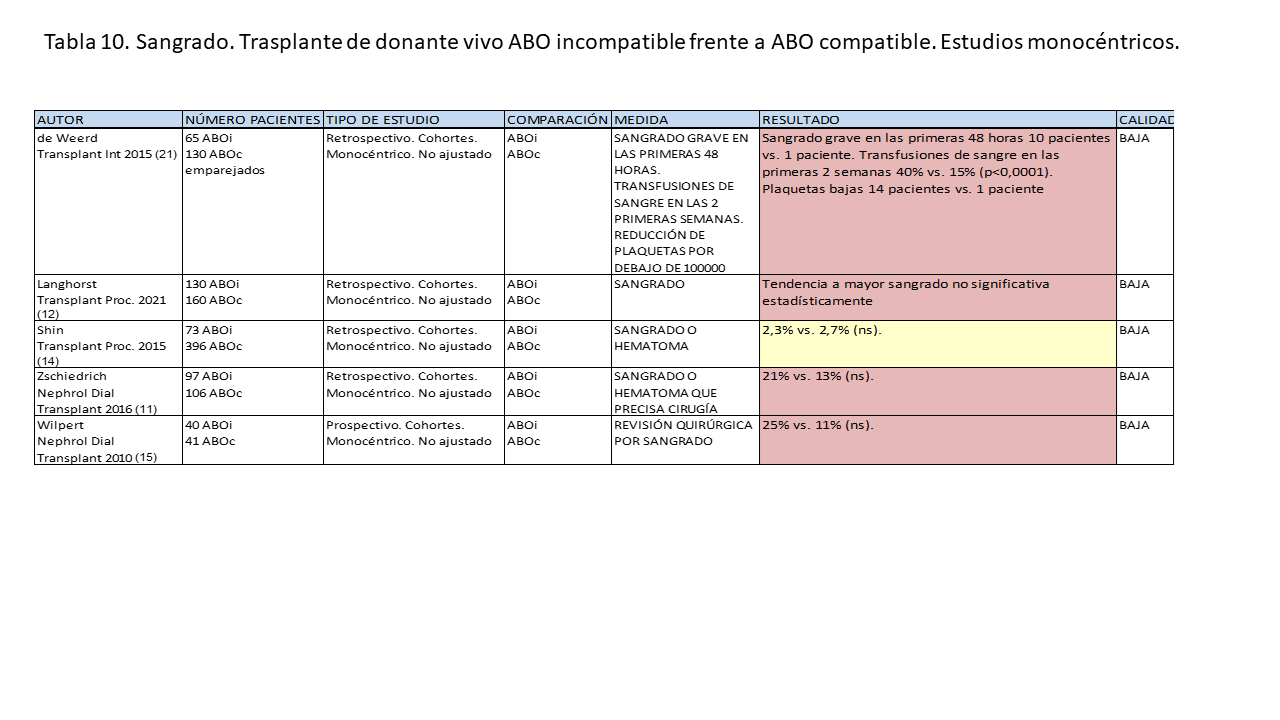
En el caso del sangrado relacionado con el tipo de trasplante, en la gran mayoría de los estudios relevantes se detecta mayor riesgo en el ABO incompatible [5] [6] [11] [12] [15] [18] [21]. Sólo hay un estudio monocéntrico que no encuentra diferencias [14]. No hay estudios de calidad que analicen la influencia de la técnica de reducción de isoaglutininas; la diferencia se observa con todas las técnicas utilizadas. En las (Tabla 9) y (Tabla 10) se muestran los datos más importantes de los estudios citados.
Conclusiones y recomendaciones:
* El trasplante de donante vivo ABO incompatible se asocia a mayor riesgo de sangrado que el trasplante ABO compatible.
* Esto se detecta tanto en los metaanálisis de estudios observacionales y estudios de registro como en la mayoría de los estudios monocéntricos (Calidad de la evidencia baja)
* La diferencia se observa con todas las técnicas usadas para reducir isoaglutininas, aunque no hay ningún estudio de calidad aceptable que compare directamente entre ellas.
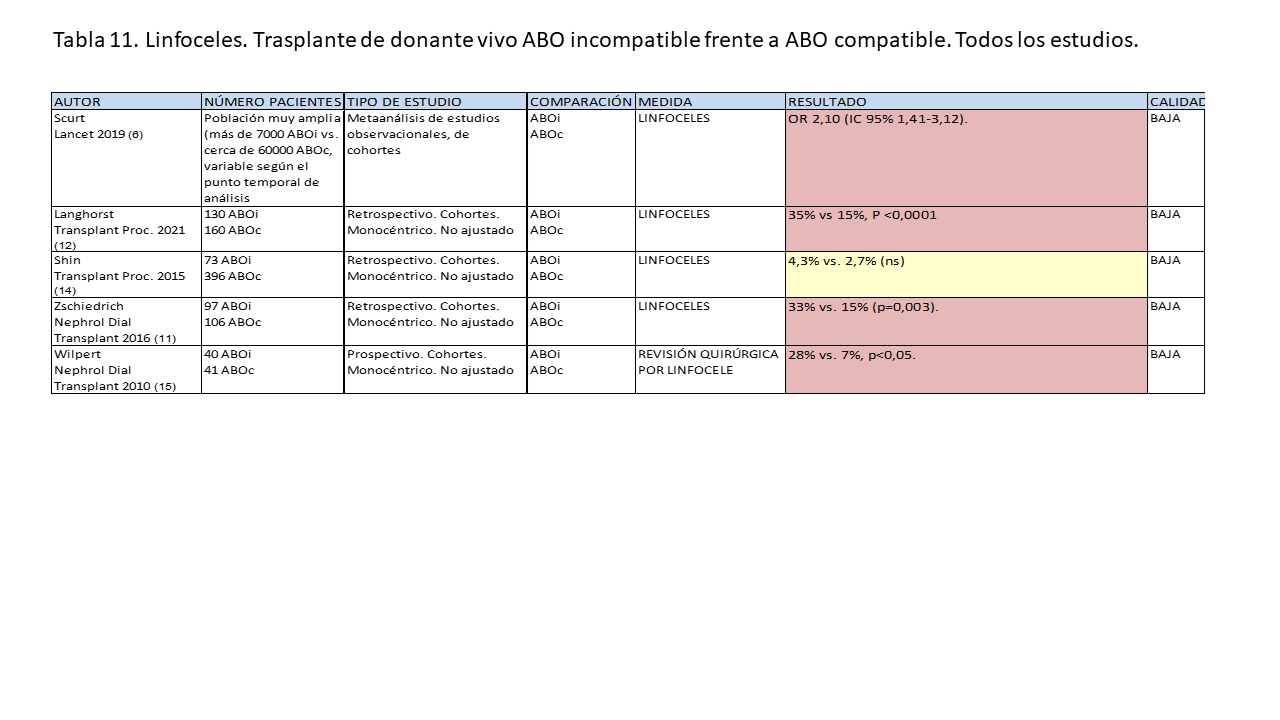
¿HAY MAYOR RIESGO DE LINFOCELES RESPECTO AL TRASPLANTE COMPATIBLE?
En los estudios que abordan la incidencia de linfoceles en función del tipo de trasplante, tanto en un metaanálisis de estudios observacionales [6], como en la mayoría de estudios monocéntricos [11] [12] [15], se observan con más frecuencia en el trasplante ABO incompatible. Sólo hay un estudio significativo monocéntrico [6] que no detecta diferencias [14]. En la (Tabla 11) se pueden ver las características y resultados de estos estudios.
Conclusiones y recomendaciones:
* La incidencia de linfoceles es mayor en el trasplante de donante vivo ABO incompatible que el trasplante de donante vivo ABO compatible (Calidad de la evidencia baja).
¿ES UN TRATAMIENTO COSTE/EFECTIVO COMPARADO CON OTRAS OPCIONES?
En un estudio observacional retrospectivo monocéntrico [22], el coste del episodio de hospitalización del trasplante es significativamente mayor en el trasplante incompatible. Cuando se añade el coste del seguimiento y las complicaciones y se amplia el seguimiento a 2 años, las cantidades se igualan. Otro trabajo, también observacional retrospectivo, que analiza datos de un registro norteamericano [23], que compara trasplantes ABO incompatibles durante un periodo largo con trasplantes compatibles (incluyendo pacientes con esplenectomía como tratamiento de acomodación), detecta mayor coste económico en el trasplante ABO incompatible en el periodo pretrasplante, durante la hospitalización, y anualmente, aunque el coste económico de permanecer en hemodiálisis parece mayor. Por último, otro estudio que compara el coste económico del trasplante ABO incompatible con el de la diálisis [24], con un modelo de decisión analítica que determina el coste por año de vida ajustado por calidad, usando una simulación a 10 años, con datos obtenidos de diversas fuentes, detecta menor coste por año de vida ajustado por calidad para el trasplante ABO incompatible, aunque el coste económico global es mayor. Concluyen que el trasplante ABO incompatible es un tratamiento coste-efectivo.
Conclusiones y recomendaciones:
* Hay pocos estudios que analicen el coste económico que conlleva el trasplante de donante vivo ABO incompatible.
* El trasplante de donante vivo ABO incompatible supone un coste económico mayor que el trasplante de donante vivo ABO compatible, sobre todo en las fases iniciales del proceso (Calidad de la evidencia baja).
* Comparado con la diálisis, el trasplante de donante vivo ABO incompatible es un tratamiento coste-efectivo, con un menor coste por año de vida ajustado por calidad (Calidad de la evidencia muy baja).
¿TIENE CABIDA EL TRASPLANTE AB0 INCOMPATIBLE CON DONANTE CADÁVER EN ALGÚN CASO?
Un artículo de revisión analiza las características y los resultados de los trasplantes ABO incompatibles con donante cadáver desde la implementación en 2014 de un nuevo sistema de asignación de órganos en Estados Unidos [25], que permite asignar donantes de grupo A2 o A2B a receptores de grupo B, en un intento de mejorar el acceso al trasplante de estos pacientes. Los requisitos para el trasplante varían según centros, pero en general exigen títulos basales de isoaglutininas anti-A bajos. Los resultados parecen satisfactorios.
Un informe de registro, retrospectivo, también norteamericano [26], que analiza la evolución de los trasplantes de donante cadáver de grupo A2 o A2B para receptores grupo B, con títulos de isoaglutininas basales bajos, muestra resultados similares a los trasplantes de donante cadáver de grupo B para receptores B. Con esta estrategia se incrementa en un 10% la cantidad de trasplantes para receptores de este grupo.
Un estudio monocéntrico, retrospectivo observacional, con pautas de actuación uniformes [27], compara la evolución de los trasplantes de donante cadáver A2 para receptores de grupo B, también con títulos de isoaglutininas bajos, con los de donante B para receptores B. No encuentra diferencias entre ambos.
Está por explorar la implementación de este tipo de trasplantes en nuestro medio, y de ampliarlo a otros grupos de pacientes (donantes grupo A1, receptores grupo 0 con títulos bajos de isoaglutininas) y definir protocolos de tratamiento.
Conclusiones y recomendaciones:
* El trasplante ABO incompatible de donante cadáver se ha desarrollado sobre todo en Estados Unidos, con un sistema de distribución de órganos que permite asignar donantes A2 o A2B a receptores B.
* Los receptores deben cumplir el requisito de tener títulos basales de isoaglutininas bajos.
* Con estas condiciones, los resultados parecen similares que los trasplantes de donante cadáver de grupo B a receptores grupo B (Calidad de la evidencia baja). Se aumenta la tasa de trasplantes en receptores de grupo B en aproximadamente un 10%.
* No hay datos de calidad de trasplantes de donante cadáver de grupo A2 a grupo 0, ni de grupo A1 a grupo B o O.
* El trasplante renal de donante cadáver ABO incompatible tiene cabida en casos de donantes de grupo A2 o A2B para receptores grupo B con títulos de isoaglutininas basales bajos (Grado de recomendación fuerte. Calidad de la evidencia baja).
* Está por explorar la posibilidad de trasplante de donante cadáver en casos de:
o Donante grupo A2 o A2B a receptores de grupo 0 con títulos de isoaglutininas bajos.
o Donante grupo A1 o A1B a receptores de grupo B o 0 con títulos de isoaglutininas bajos.
¿CUÁL ES EL MEJOR MÉTODO PARA DETERMINAR LAS ISOAGLUTININAS?
Una encuesta online a centros mayoritariamente australianos [28] muestra una gran variabilidad en muchos aspectos técnicos entre diferentes laboratorios, con resultados muy dispares en función de la plataforma y los diluyentes utilizados. Un estudio multicéntrico, de centros británicos [29], con análisis centralizado de títulos de isoaglutininas con las mismas muestras que se analizan en cada centro, muestra una gran variabilidad en los métodos de determinación de los distintos centros, y diferencias importantes en más del 40% de las determinaciones en el análisis de títulos centralizados, que hubieran cambiado las decisiones respecto a la idoneidad del trasplante en cada centro. Otros trabajos corroboran la gran variabilidad de los títulos en función del método de determinación y la falta de estandarización [30] [34].
Dos trabajos recomiendan que el mejor método para avanzar en la estandarización es el basado en tarjetas de gel con microcolumnas [31] [32].
En las células endoteliales renales, los antígenos ABO se unen mayoritariamente a la proteína CD31, a diferencia de lo que ocurre en los eritrocitos. Se ha desarrollado un método para determinar isoaglutininas usando un microarray de CD31 recombinante unida a antígenos ABO. En un estudio [35], este método muestra mejor precisión para el diagnóstico de rechazo mediado por anticuerpos que la determinación de isoaglutininas. Este método promete ser un avance en la estandarización y en la precisión de la determinación de los títulos de anticuerpos, detectando específicamente los que están unidos a las células endoteliales.
Conclusiones y recomendaciones:
* Existe gran variabilidad en los métodos para determinar las isoaglutininas entre diferentes laboratorios. También hay mucha variabilidad en los resultados, en función del centro, de la plataforma y los diluyentes utilizados.
* Las técnicas no están estandarizadas y los resultados son difícilmente comparables entre centros.
* El método prácticamente universal de determinación de isoaglutininas es el basado en las reacciones de hemaglutinación.
* Las técnicas más comunes para determinarlas son la dilución en tubo y las técnicas de aglutinación en columnas (tarjetas de gel con microcolumnas). Las técnicas de tarjetas de gel parecen el mejor método para una posible estandarización de la técnica (Grado de recomendación débil. Calidad de la evidencia moderada)
Recientemente se ha desarrollado para la detección de isoaglutininas específicas contra los antígenos de las células endoteliales, un microarray de CD31 recombinante unido a antígenos ABO que parece ser mejor predictor del rechazo mediado por anticuerpos que las determinaciones tradicionales de las isoaglutininas [35]. Esta técnica promete ser un avance en la reducción de la variabilidad, en la estandarización y en una cuantificación más precisa en la determinación de las isoaglutininas.
¿CUÁL ES LA MEJOR FORMA DE INTERPRETAR LAS ISOAGLUTININAS?
En una encuesta a centros que realizan isoaglutininas, mayoritariamente australianos, se reportó mucha variabilidad en el punto de corte semicuantitativo para considerar la reacción positiva (1+ versus 2+) [28]. La mayoría de centros consideraban positiva una reacción 1+, pero un número considerable consideraban positiva sólo una reacción 2+. Algunos centros consideraban positiva 1+, pero en el caso de trasplante renal ABO incompatible consideraban positiva sólo 2+.
Conclusiones y recomendaciones:
* La interpretación de las pruebas que miden las isoaglutininas es variable entre los diferentes centros. Estas diferencias tienen un impacto muy importante en la interpretación de los resultados y en las decisiones clínicas.
* Cada centro debe definir la forma de interpretar los resultados de estas pruebas según su experiencia (Opinión).
¿HAY QUE TOMAR EN CONSIDERACIÓN LAS IGG, LAS IGM O AMBAS?
En un estudio retrospectivo observacional, de cohortes [36], se tuvo en cuenta para la decisión del trasplante el título de isoaglutininas IgM, sin considerar el título de IgG. Aproximadamente un tercio de los pacientes tenían un título de IgG considerado alto en el momento del trasplante. Los compararon con los pacientes con título de IgG considerado bajo en el momento del trasplante. Los resultados fueron similares en ambos grupos
En la mayoría de los trabajos, sin embargo, se tienen en cuenta tanto las IgG como las IgM para tomar decisiones clínicas.
Conclusiones y recomendaciones:
* En la mayoría de los estudios se tienen en cuenta tanto las isoaglutininas IgG como las IgM para tomar decisiones clínicas.
* Hay algún estudio con calidad de la evidencia baja que sugiere que se deberían considerar sólo los títulos de IgM [36]. No hay estudios que comparen directamente las dos estrategias.
* Parece razonable tener en cuenta tanto las IgG como las IgM (Opinión).
¿ES NECESARIO MEDIR LAS ISOAGLUTININAS FRENTE A LOS HEMATÍES DEL DONANTE?
* En los estudios en los que se reporta este dato, hay gran variabilidad para la determinación de isoaglutininas con hematíes del donante, con hematíes de pool (kits comerciales), o con ambos en función de las características del paciente.
* El uso de hematíes del donante se basa en que hipotéticamente reflejarían mejor la reactividad del receptor en ese caso concreto.
* No hay ninguna comparación entre estos enfoques que permita hacer recomendaciones al respecto.
* Cada centro debe seleccionar entre estas opciones en función de su disponibilidad y su experiencia (Opinión).
* Una vez elegido un método, se debe mantener el mismo en el seguimiento de los pacientes para que los resultados sean comparables (Opinión).
¿EL GRUPO SANGUÍNEO A2 EN EL DONANTE SUPONE UN RIESGO DIFERENTE FRENTE AL A1?
Aproximadamente un 20% de individuos de grupo sanguíneo A son de grupo A2. La expresión de las isoaglutininas en los hematíes y en los tejidos es menor para el grupo sanguíneo A2, aproximadamente un 15% respecto al A1. Hay también diferencias en el reconocimiento antigénico entre los dos grupos (en el grupo A2 hay menos tipos de cadenas unidas al oligosacárido). Aunque no se determinan habitualmente, los títulos de isoaglutininas frente a A2 son más bajos en general en un mismo individuo que frente a A1 [25] [37] [38].
No hay trabajos que comparen directamente los resultados de los trasplantes ABO incompatibles frente a grupo sanguíneo A1 y A2.
Conclusiones y recomendaciones:
* Parece que el grupo sanguíneo A2 respecto al A1 conlleva diferencias cuantitativas y cualitativas en la unión antígeno-anticuerpo que podrían suponer un riesgo inmunológico menor para la incompatibilidad A2.
* No se determinan habitualmente los títulos anti-A2, que son al parecer menores en general que los anti-A1, aunque es un aspecto no bien estudiado.
No hay comparaciones a nivel clínico entre la incompatibilidad A1 y A2 en trasplante renal de donante vivo que permita extraer conclusiones.
¿HAY UN TÍTULO LÍMITE SUPERIOR DE ISOAGLUTININAS QUE IMPIDA LA DESENSIBILIZACIÓN Y EL TRASPLANTE?
En un estudio con 56 pacientes, retrospectivo, la probabilidad de trasplante fue del 96% con títulos basales de isoaglutininas de 1/256 o menores, y del 33% con títulos superiores a 1/256 [13].
Un trabajo compara pacientes con títulos de 1/64 o menores con pacientes con títulos más altos. Los pacientes con títulos más altos necesitaron un 50% más de sesiones de plasmaféresis [39]. Otro estudio establece el punto de corte para la comparación en 1/128. Con títulos más altos se necesitan más del doble de sesiones de inmunoadsorción (específica y no específica) y un porcentaje mucho mayor de pacientes precisa asociar plasmaféresis [11]. Otro trabajo retrospectivo muestra correlación entre los títulos iniciales de isoaglutininas y las sesiones de plasmaféresis necesarias para conseguir los títulos objetivo [13]. Dos estudios del mismo grupo muestran una necesidad incremental del número de plasmaféresis con títulos de 1/16, entre 1/32 y 1/256, y superiores a 1/256 (aproximadamente el doble para cada grupo de títulos más elevados respecto al anterior), con necesidad de asociar inmunoadsorción (específica y no específica) en un porcentaje mayor de casos en los grupos de isoaglutininas más altas [40]; y estableciendo el punto de corte en títulos de 1/128, observan más del doble de sesiones de reducción de anticuerpos en el grupo de títulos más altos [41].
Conclusiones y recomendaciones:
* Hay pocos estudios que analicen si existe un título por encima del cual no deba intentarse la desensibilización por riesgo elevado de no conseguir el objetivo de isoaglutininas antes del trasplante.
* El límite superior depende en general del centro trasplantador, de la experiencia y de los métodos que se utilizan para reducir las isoaglutininas.
* No hay evidencia de calidad suficiente para recomendar un límite superior en el título de isoaglutininas que impida el trasplante de donante vivo ABO incompatible. Cada centro debe definir el suyo en función de sus circunstancias (Grado de recomendación débil. Calidad de la evidencia baja).
* Los títulos basales de isoaglutininas más elevados conllevan en general la necesidad de más intensidad del tratamiento para reducirlas, y una mayor probabilidad de fracaso de la desensibilización (Grado de recomendación fuerte. Calidad de la evidencia baja).
¿LOS RESULTADOS POSTRASPLANTE DEPENDEN DEL TÍTULO BASAL DE ISOAGLUTININAS?
Un estudio muestra mayor rebote de isoaglutininas tras el trasplante en el grupo con títulos basales superiores a 1/64, sin diferencias en cuanto a rechazo o supervivencia de injerto o paciente, tanto en función de los títulos basales como de la magnitud del rebote [39]. Otro trabajo, que establece el punto de corte en 1/128, no muestra diferencias en cuanto a rechazo, infecciones o supervivencia de injerto o paciente [11].
Conclusiones y recomendaciones:
* Los resultados del trasplante de donante vivo ABO incompatible no parecen depender de los títulos basales de isoaglutininas (Calidad de la evidencia baja).
¿CUÁL ES EL TÍTULO DE ISOAGLUTININAS LÍMITE ADECUADO PARA PROCEDER CON EL TRASPLANTE CON SEGURIDAD?
No hay ningún estudio comparativo que aborde el título máximo seguro de isoaglutininas para proceder con el trasplante de donante vivo ABO incompatible.
Conclusiones y recomendaciones:
* El título límite máximo seguro de isoaglutininas para proceder con el trasplante de donante vivo ABO incompatible se define a priori por cada centro, y la variabilidad reportada es enorme.
* En general se consideran tanto los títulos de IgG como de IgM.
* No hay evidencia de calidad para recomendar un título de isoaglutininas máximo seguro antes del trasplante de donante vivo ABO incompatible.
* La elección del título objetivo debe hacerla cada centro basándose en la metodología de la determinación y de la interpretación de los títulos, y la experiencia previa (Opinión).
* Los títulos límite más habituales en nuestro medio son 1/8, tanto de IgG como de IgM.
ACONDICIONAMIENTO PRETRASPLANTE
El tratamiento de acondicionamiento para el trasplante de donante vivo ABO incompatible consiste básicamente en:
* Técnicas extracorpóreas para la reducción de las isoaglutininas circulantes (plasmaféresis, inmunoadsorción inespecífica, inmunoadsorción específica).
* Depleción de linfocitos B (rituximab).
* Inmunomodulación (inmunoglobulinas intravenosas).
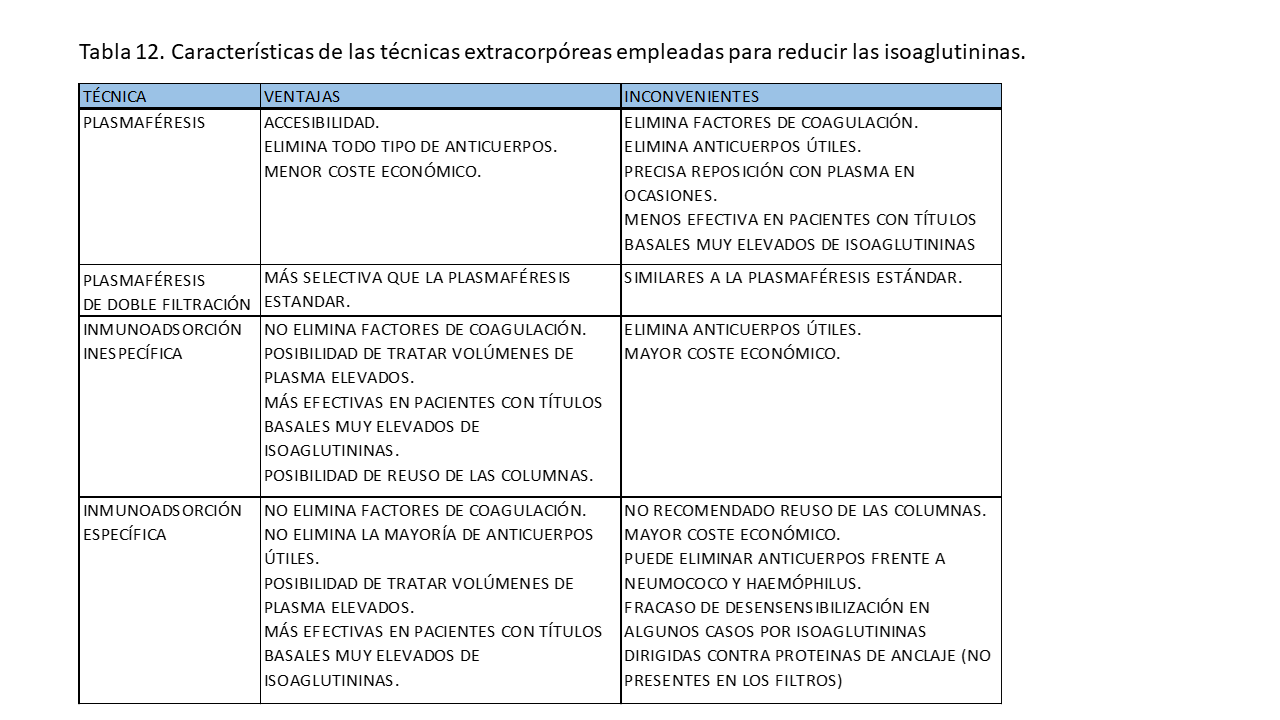
¿CUÁL ES EL MEJOR MÉTODO PARA REDUCIR LAS ISOAGLUTININAS?
No hay evidencia suficiente que muestre superioridad de ninguna de las técnicas de depuración extracorpórea empleadas para reducir el título de isoaglutininas para permitir el trasplante ABO incompatible. La elección de la técnica la hace cada centro en función de su experiencia, de la disponibilidad y del coste económico, y en muchos casos del título basal de isoaglutininas.
En un metaanálisis de estudios retrospectivos (muy heterogéneos, con calidad de la evidencia en general muy baja), que incluye más de 4000 pacientes, todas las técnicas empleadas muestran reducción efectiva de las isoaglutininas (de títulos basales de media 1/64 a títulos de 1/4) [42]. En la (Tabla 12) se muestran las ventajas, inconvenientes y diferencias de las diferentes técnicas.
En un metaanálisis de estudios observacionales de cohortes, que incluye 26 trabajos con más de 5000 pacientes en total, se realiza un subanálisis de resultados según se emplee plasmaféresis o inmunoadsorción de forma preferente. Los resultados de supervivencia de paciente e injerto de los trasplantes ABO incompatibles frente a los compatibles son similares para ambas técnicas. También es similar el riesgo de sangrado [5]. Otro estudio, multicéntrico de registro, que incluye unos 700 pacientes, no muestra diferencias en la supervivencia del injerto (con muerte censurada) a 3 años según la técnica para reducir isoaglutininas reportada [9]. El mismo metaanálisis de estudios retrospectivos descrito en un párrafo anterior, con calidad de la evidencia muy baja, muestra una tendencia sin significación estadística a una mejor supervivencia del paciente y del injerto con la inmunoadsorción frente a la plasmaféresis [42].
Conclusiones y recomendaciones:
* Las técnicas más habituales para reducir las isoaglutininas a un nivel que permita el trasplante renal de donante vivo ABO incompatible son la plasmaféresis (con su variante plasmaféresis con doble filtración), la inmunoadsorción inespecífica y la inmunoadsorción específica.
* Los diferentes centros utilizan alguna de ellas o combinaciones de varias en función de aspectos como disponibilidad, coste, experiencia, títulos basales de isoaglutininas.
* En los estudios publicados, todas las estrategias se han mostrado efectivas para reducir las isoaglutininas en un número grande de pacientes.
* Existen diferencias entre ellas que les confieren ventajas e inconvenientes respecto a las otras.
* No existen estudios de comparación directa entre las técnicas.
* En los estudios retrospectivos no parece haber diferencias significativas respecto a la supervivencia del paciente o del injerto entre ellas (Calidad de la evidencia baja).
¿ES NECESARIO REDUCIR LAS ISOAGLUTININAS CUANDO LOS TÍTULOS BASALES ESTÁN POR DEBAJO DEL OBJETIVO DE SEGURIDAD?
Un grupo británico describe en su trabajo una estrategia de acondicionamiento para el trasplante ABO incompatible ajustada a los títulos basales de isoaglutininas [17]. Desde el año 2008, si los títulos basales de isoaglutininas son 1/8 o menos, no emplean tratamientos adicionales para reducirlas. Describen con estas características 7 pacientes, en los que no se observan pérdidas de injertos ni rechazo mediado por anticuerpos. Otro trabajo reporta que no se usó ninguna técnica para reducir isoaglutininas si los títulos basales eran 1/16 o menos (11 pacientes con estas características) [43]. No observaron pérdidas de injerto ni rechazo mediado por anticuerpos, y tampoco rebote tras el trasplante. Un estudio descriptivo con 20 pacientes con isoaglutininas basales de 1/16 o menos, reporta no usar técnicas para reducirlas, sin pérdidas de injerto ni muerte de pacientes, con un episodio de rechazo mediado por anticuerpos, y sin rebote postrasplante [33]. Por último, un trabajo con pacientes con isoaglutininas basales de 1/8 o menos (10 casos), descriptivo, reporta no usar técnicas para reducir isoaglutininas en 3 pacientes, con buenos resultados [44].
Conclusiones y recomendaciones:
* Algunos estudios reportan no utilizar técnica de reducción de isoaglutininas en caso de títulos basales por debajo del objetivo, sin especificar resultados. Otros estudios reportan sí usar técnicas de reducción de isoaglutininas en todos los casos. No hay estudios que comparen directamente ambas estrategias.
* Hay algunos estudios con calidad de la evidencia muy baja que reportan resultados comparables si no se usa técnica de reducción de anticuerpos por debajo de un determinado título de isoaglutininas.
* Con estas consideraciones, no se puede dar una recomendación a favor o en contra de esta estrategia.
¿ES NECESARIO EL RITUXIMAB? ¿CUÁL ES LA DOSIS ADECUADA?
En un metaanálisis de estudios observacionales de cohortes que incluye 40 trabajos, la supervivencia del paciente en el trasplante ABO incompatible es menor respecto al trasplante ABO compatible en los primeros 5 años tras el trasplante6, y la diferencia se mantiene si se comparan los pacientes a los que se administra rituximab con los que no lo reciben (aunque a la mayoría de estos últimos se les hace esplenectomía). Sin embargo, las diferencias en la supervivencia del injerto desfavorables para el ABO incompatible observadas en los primeros años tras el trasplante desaparecen cuando se tienen en cuenta sólo los pacientes tratados con rituximab. También se observa un menor riesgo de rechazo mediado por anticuerpos. En el trabajo del grupo británico descrito previamente [17], desde 2009 si los títulos basales de isoaglutininas son 1/4 o menos, no emplean tratamientos adicionales para reducirlas. Describen con estas características 7 pacientes, en los que tampoco observan pérdidas de injerto ni rechazos. El estudio descriptivo con 20 pacientes comentado antes [33] reporta que tampoco administran rituximab con isoaglutininas basales de 1/16 o menos, sin pérdidas de injerto ni muerte de pacientes, con un episodio de rechazo mediado por anticuerpos, y sin rebote postrasplante de isoaglutininas. Un estudio monocéntrico de cohortes, ajustado para otras variables, con unos 600 pacientes, pero con inmunosupresión muy variable (que incluye ciclofosfamida, mizobirina y everolimus en algunos casos) [45], reporta no usar rituximab en 53 pacientes con isoaglutininas basales bajas; comparados con los pacientes a los que se administra rituximab, no se observan diferencias significativas en la supervivencia del injerto ni en la tasa de rechazo agudo mediado por anticuerpos, y sí se detecta un mayor riesgo de infecciones asociado a la administración de rituximab.
En un metaanálisis de estudios observacionales que incluye 21 trabajos, muy heterogéneos entre ellos, con cerca de 5000 pacientes [46], se comparan trasplantes ABO incompatibles en los que se usan diferentes dosis de rituximab y esplenectomía frente a trasplantes ABO compatibles; en todos los grupos se observa aumento de mortalidad respecto al trasplante compatible excepto en el que la dosis de rituximab es de 200 mg., sin incremento de las pérdidas de injerto o del rechazo mediado por anticuerpos, y con menor incidencia de infección por poliomavirus BK. Una revisión sistemática de estudios observacionales, con gran heterogenicidad, que incluye cerca de 400 pacientes, compara el uso de rituximab a dosis de 200 mg. frente a dosis de 375 mg. por metro cuadrado; no observa diferencias en cuanto a supervivencia del paciente o del injerto, y tampoco en cuanto a incidencia de rechazo agudo, pero si una reducción de aproximadamente el 50% del riesgo de infecciones con la dosis baja respecto a la más elevada [47]. Un estudio observacional de un centro compara diferentes dosis de rituximab (375 mg. por metro cuadrado frente a 200 mg) con trasplantes ABO compatibles sin rituximab. Las dosis más elevadas son un factor de riesgo para infecciones graves, a diferencia de las dosis bajas, sin repercusión sobre la supervivencia del paciente o del injerto ni sobre la incidencia de rechazo agudo entre los dos grupos tratados con rituximab [48].
Conclusiones y recomendaciones:
* No hay estudios que comparen directamente las estrategias de administrar o no rituximab en el tratamiento de acondicionamiento para el trasplante ABO incompatible de donante vivo.
* Los estudios más relevantes parecen mostrar un efecto beneficioso de usar rituximab en el tratamiento de acondicionamiento.
* Parece adecuado administrar rituximab en la mayoría de pacientes receptores de un trasplante renal de donante vivo ABO incompatible (Grado de recomendación débil. Calidad de la evidencia baja).
* Es posible que pueda obviarse la administración de rituximab en algún subgrupo determinado de pacientes, sobre todo los que tienen títulos basales bajos de isoaglutininas (Grado de recomendación débil. Calidad de la evidencia muy baja).
* Las dosis de rituximab más frecuentes en los estudios publicados son dosis única de 375 mg/m2, y dosis única de 200 mg.
* El momento temporal más frecuente en su administración es entre 4 y 3 semanas antes del trasplante.
* Los estudios que comparan dosis diferentes de rituximab muestran que las dosis más bajas tienen resultados comparables con menor frecuencia de complicaciones infecciosas.
* Es posible usar dosis reducidas de rituximab (una dosis única de 200 mg.) en el tratamiento de acondicionamiento para el trasplante renal de donante vivo ABO incompatible (Grado de recomendación débil. Calidad de la evidencia baja)
¿SON NECESARIAS LAS INMUNOGLOBULINAS INTRAVENOSAS?
Un grupo reporta no usar inmunoglobulinas intravenosas en el protocolo de acondicionamiento de los trasplantes de donante vivo ABO incompatibles [17]. No observan pérdidas de injerto ni rechazo mediado por anticuerpos. Otro estudio describe el tratamiento de acondicionamiento de pacientes con títulos basales de isoaglutininas bajos [33]. No usan inmunoglobulinas intravenosas. No observan muertes ni pérdidas de injerto, y sólo un episodio de rechazo mediado por anticuerpos.
Un trabajo analiza la presencia de isoaglutininas en los preparados de inmunoglobulinas intravenosas [49]; las concentraciones son variables en función de la marca comercial. Esto puede interferir en las determinaciones de los títulos de isoaglutininas. El significado clínico es desconocido.
Conclusiones y recomendaciones:
* Las inmunoglobulinas intravenosas se usan en muchos de los protocolos de acondicionamiento descritos en los estudios, aunque hay bastantes grupos que las omiten. No hay estudios que comparen directamente estas estrategias.
* Es posible que en algunos subgrupos de pacientes se puedan omitir las inmunoglobulinas intravenosas (Grado de recomendación débil. Calidad de la evidencia muy baja).
* Esto no se aplica a las dosis de inmunoglobulinas que se administran como suplemento tras cada plasmaféresis con reposición con albúmina, que deben mantenerse siempre (Opinión)
* Los preparados de inmunoglobulinas intravenosas pueden contener isoaglutininas, lo que puede artefactar las determinaciones de los títulos antes del trasplante. No conocemos el impacto clínico de este hecho (Calidad de la evidencia muy baja).
¿LA INMUNOSUPRESIÓN ADECUADA DIFIERE DE LA DE LOS TRASPLANTES COMPATIBLES?
En la gran mayoría de estudios publicados, la inmunosupresión administrada para los trasplantes de donante vivo ABO incompatible es similar a la de los compatibles, y no hay estudios que comparen otras estrategias de tratamiento frente a la inmunosupresión estándar. Por lo tanto, no se puede recomendar una pauta de tratamiento distinta de la que se usaría para los trasplantes compatibles.
Aunque no hay ninguna evidencia al respecto, hay precaución respecto a la retirada de esteroides en estos pacientes, por lo que no se recomienda.
Conclusiones y recomendaciones:
* La gran mayoría de los estudios publicados utilizan un tratamiento inmunosupresor en el trasplante de donante vivo ABO incompatible similar al trasplante ABO compatible.
* No hay estudios que comparen directamente otras estrategias de inmunosupresión.
* El tratamiento inmunosupresor en el trasplante de donante vivo ABO incompatible debe ser similar al del trasplante ABO compatible (Opinión)
* No se recomienda retirar los esteroides en este tipo de trasplantes (Opinión).
¿CUÁL ES EL PERIODO DE RIESGO Y DE VIGILANCIA ESTRECHA DE LOS TÍTULOS DE ISOAGLUTININAS?
A falta de trabajos que consideren este aspecto, la opinión general es que el periodo de riesgo mayor comprende las dos primeras semanas tras el trasplante. Durante este tiempo se recomienda monitorizar las isoaglutininas y tomar medidas en caso de variaciones significativas de los títulos
Conclusiones y recomendaciones:
* No hay ningún estudio que aborde directamente este aspecto.
* El periodo de vigilancia estrecha debe ser probablemente las primeras semanas postrasplante, sobre todo los primeros 15 días (Opinión).
* Un aumento significativo de isoaglutininas (2 o más títulos) en este periodo debe conducir a tomar medidas preventivas rápidas (como técnicas de reducción de isoaglutininas) para prevenir la trombosis del injerto causada por isoaglutininas (Opinión).
¿LAS TÉCNICAS PARA ELIMINAR ISOAGLUTININAS SE HAN DE USAR DE FORMA PROGRAMADA O EN FUNCIÓN DEL CAMBIO EN LOS TÍTULOS?
Más allá de una tendencia global en los estudios publicados, no hay comparaciones de calidad en cuanto a diferentes estrategias del uso de técnicas para reducir las isoaglutininas después del trasplante para prevenir el rebote y el rechazo agudo.
Un estudio observacional retrospectivo, compara dos cohortes de pacientes, una más antigua en la que se usaba inmunoadsorción específica postrasplante en todos los pacientes con una pauta prefijada, y otra más reciente en la que sólo se usaba inmunoadsorción específica en caso de rebote de isoaglutininas [50]. Los resultados son comparables con las dos estrategias.
Conclusiones y recomendaciones:
* La tendencia en los estudios publicados en fechas más recientes es usar las técnicas de reducción de isoaglutininas postrasplante a demanda (en función de la evolución clínica y/o los títulos de isoaglutininas), y no de forma programada.
* Hay pocos estudios que comparen directamente las dos estrategias.
* Es posible usar las técnicas de reducción de isoaglutininas tras el trasplante a demanda en función de la evolución, con resultados comparables al uso de forma programada (Grado de recomendación débil. Calidad de la evidencia muy baja).
¿LOS TÍTULOS DE ISOAGLUTININAS POSTRASPLANTE SIRVEN PARA PREDECIR LA PROBABILIDAD DE RECHAZO?
Hay cuatro trabajos en los que se analiza la relación de los títulos de isoaglutininas tras el trasplante ABO incompatible de donante vivo con la ocurrencia de rechazo agudo mediado por anticuerpos. No observan ninguna asociación [11] [17] [50] [51].
Conclusiones y recomendaciones:
* Hay pocos estudios que analicen directamente la relación con los títulos de isoaglutininas postrasplante y la aparición de rechazo agudo.
* No hay relación evidente entre los títulos de isoaglutininas postrasplante y la aparición de rechazo agudo en el trasplante ABO incompatible (Calidad de la evidencia baja).
¿SON RECOMENDABLES LAS BIOPSIAS DE PROTOCOLO? ¿CUÁL ES EL SIGNIFICADO DE LA POSITIVIDAD DE C4D EN LAS BIOPSIAS EN AUSENCIA DE OTRAS ALTERACIONES? ¿EXISTE UN FENÓMENO DE ACOMODACIÓN EN ESTE TIPO DE TRASPLANTES?
Parece que, tras un periodo de riesgo inicial, probablemente de unas semanas, la persistencia de isoaglutininas no es nociva para el injerto renal en este tipo de trasplantes, lo que reflejaría un fenómeno de acomodación.
Respecto a las biopsias de protocolo en este tipo de trasplantes, aunque en algunos grupos su uso es generalizado, no se puede hacer una recomendación sobre su utilidad dada la falta de evidencia.
En un estudio observacional de cohortes con unos 300 pacientes, que compara trasplantes ABO incompatibles de donante vivo con trasplantes compatibles [52], se realizan biopsias de protocolo a los 3 y 12 meses. En los trasplantes incompatibles se detecta C4d positivo en más de un 75% de los pacientes. Sin embargo, en el 90% de los pacientes no se detecta glomerulitis, ni capilaritis peritubular. Otro trabajo, también observacional de cohortes, con unos 170 pacientes, analiza los resultados de las biopsias de protocolo al año en los trasplantes ABO incompatibles de donante vivo frente a los compatibles [53]. Detectan C4d positivo en más del 90% de los casos (frente a un 10% aproximadamente en los compatibles). En las biopsias positivas para C4d observan capilaritis peritubular en aproximadamente un tercio de los trasplantes incompatibles frente a tres cuartos en los compatibles. Sucede algo similar con la glomerulitis. Más de la mitad de los trasplantes incompatibles con C4d positivo no tienen otras alteraciones histológicas asociadas. En los pacientes que tienen biopsias secuenciales, aproximadamente dos tercios los cambios se mantienen, pero en el resto la positividad C4d cambia de intensidad o desaparece. Un estudio analiza unos 30 pacientes con trasplantes ABO incompatibles de donante vivo con biopsias de protocolo a los 3 y a los 6-12 meses [54]. Dos tercios de los pacientes tienen C4d positivo en la biopsia inicial, ninguno con signos de rechazo. De ellos, en un tercio la intensidad de C4d disminuye en la siguiente biopsia. El tercio de pacientes con C4d negativo inicial tampoco tiene signos de rechazo, y la negatividad se mantiene en la biopsia más tardía. Los pacientes con C4d positivo en la biopsia inicial (frente a los negativos) tienen menos datos de daño crónico y menos progresión de las lesiones. El mismo grupo reporta datos comparativos de biopsias (de protocolo o por indicación) y compara trasplantes ABO incompatibles con HLA incompatibles [55]. En los ABO incompatibles, el 80% de las biopsias de protocolo son C4d positivo; de ellas, un número muy reducido tiene capilaritis peritubular. En las biopsias por indicación, la positividad C4d es de un 60%, y tiene capilaritis un 30% de ellas. En los trasplantes HLA incompatibles, por el contrario, la positividad C4d de las biopsias de protocolo es de un 20%, con capilaritis peritubular en un 40% de ellas, y en las biopsias por indicación la positividad es de un 60% con capilaritis peritubular en tres cuartas partes de casos. Esto remarca la frecuencia de positividad de la tinción para C4d en los trasplantes ABO incompatibles con pocas lesiones histológicas significativas asociadas.
La acomodación parece ser un proceso dinámico, que se puede adquirir o perder evolutivamente en función de ciertas condiciones asociadas. Parece que el daño tisular por isquemia-reperfusión, por infecciones o por enfermedades intercurrentes puede alterar los mecanismos que permiten la acomodación y hacer que se pierda, promoviéndose la aparición de daño tisular causado por las isoaglutininas [56].
Conclusiones y recomendaciones:
* La acomodación se podría definir como ausencia de alteraciones funcionales y de daño histológico en el injerto en presencia de isoaglutininas circulantes y de evidencia de unión de las isoaglutininas al endotelio.
* La realización de biopsias de protocolo en los estudios revisados es muy variable según grupos.
* No hay estudios que comparen la evolución de los pacientes en función de si se realizan o no biopsias de protocolo. Por lo tanto, no se puede establecer una recomendación respecto a la oportunidad de realizar biopsias de protocolo.
* La positividad de la tinción C4d en capilares peritubulares es frecuente, en más de 2/3 de los pacientes.
* La mayoría de pacientes no tienen otras alteraciones histológicas (más de un 50%). Esto parece reflejar un fenómeno de acomodación.
* La positividad de C4d puede cambiar a lo largo del tiempo en las biopsias evolutivas.
* La positividad C4d parece asociarse a menos lesiones de daño crónico evolutivo (Calidad de la evidencia baja).
* El daño isquemia-reperfusión o ciertas condiciones (infecciones, enfermedades intercurrentes) pueden impedir la acomodación. Esto puede suponer un riesgo mayor en trasplantes ABO incompatibles de donante cadáver.