Trasplante con Desensibilización HLA
Carlos Arias Cabrales, Hospital del Mar, Barcelona
Beatriz Sánchez Sobrino, Hospital Puerta del Hierro, Madrid
Vanessa Becerra Mosquera, Hospital de Santiago
Gabriel Bernal Blanco, Hospital Virgen del Rocío, Sevilla
Irina Torres Rodríguez, Hospital Vall d’Hebron, Barcelona
Joana Sellarés Roig, Hospital Vall d’Hebron, Barcelona
Olalla Álvarez Blanco, Hospital Gregorio Marañón, Madrid
Laura Salanova, Hospital Universitario de la Princesa, Madrid
María Luisa Rodríguez Ferrero, Hospital Gregorio Marañón, Madrid
Alberto Rodríguez Benot, Hospital Reina Sofia, Córdoba
Mireia Aguirre, Hospital de Cruces, Bilbao
Isidoro García Escribano, Hospital Universitario Miguel Servet, Zaragoza
Roberto Gallego Samper, Hospital Dr. Negrin, Las Palmas
Elena Monfá Guix, Complejo Asistencial de León
M. Luisa Martín Conde, Hospital Arnau de Vilanova, Lleida
Domingo Marrero Miranda, Hospital Universitario de Canarias
Manuel Macía Heras , H . Ntra. Sra. Candelaria, Santa Cruz de Tenerife
Verónica López Jiménez, Hospital Regional de Málaga
Ahinoa Inza San Salvador del Valle, Hospital de Cruces, Bilbao
Natividad Calvo Romero, Hospital Clínico San Carlos, Madrid
INTRODUCCIÓN
La sensibilización anti-HLA (antígenos leucocitarios humanos) es una de las principales limitaciones para el acceso al trasplante renal (TR) y un claro factor de riesgo para la pérdida del injerto renal [1] [2]. A pesar de esto último, algunos autores han demostrado beneficios en términos de supervivencia entre recibir un trasplante renal incompatible o permanecer en lista de espera de trasplante renal [3] [4].
En este contexto las terapias de desensibilización se han utilizado durante los últimos años con el fin de incrementar el acceso al TR al disminuir los anticuerpos anti-HLA y la cantidad de antígenos inaceptables para su inclusión en la lista de espera (reducción del PRAc, calculated panel reactive antibodies) y por otra parte para disminuir los anticuerpos donante específicos (DSA), por sus siglas en inglés) conocidos antes de un trasplante programado con prueba cruzada positiva, con el fin de reducir el riesgo de pérdida inmediata del injerto debido a un rechazo hiperagudo catastrófico [5].
El propósito de esta revisión es examinar la evidencia actual en torno a las técnicas de desensibilización HLA y, a partir de ello, establecer recomendaciones consensuadas que faciliten la valoración y manejo de los pacientes con restricciones para acceder al trasplante renal debido a la presencia de anticuerpos anti-HLA.
1. EVALUACIÓN DEL RIESGO INMUNOLÓGICO
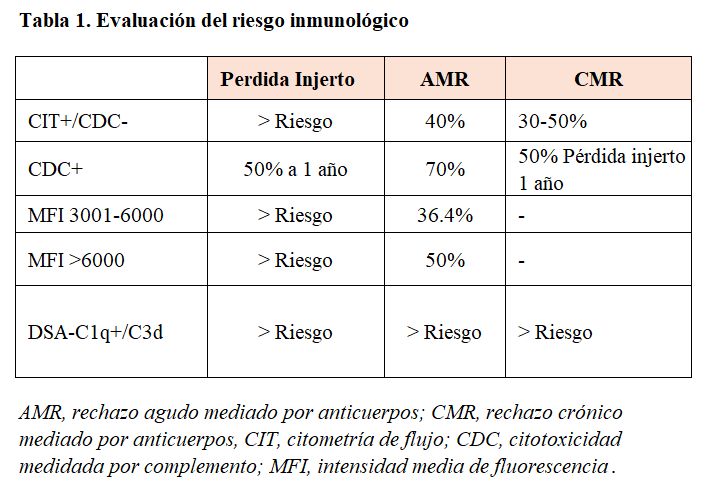
El primer paso en el abordaje de los pacientes con sensibilización HLA es evaluar y estratificar el riesgo inmunológico de cada paciente, utilizando todas las herramientas disponibles para una óptima preparación y minimizar complicaciones. La (Tabla 1) muestra las pruebas de las que disponemos en la actualidad para dicha evaluación y como los diferentes resultados que arrojan se relacionan con el riesgo de pérdida del injerto y de rechazo mediado por anticuerpos agudo y crónico [2] [6] [7].
Esta información es relevante a la hora de realizar la evaluación de los pacientes previo a plantear la desensibilización HLA, por lo que recomendamos que, para una evaluación precisa del riesgo inmunológico, se deben emplear todas las herramientas disponibles, como DSA-MFI (Donor Specific Antibody, Intensidad media de fluorescencia), CIT (citometría de flujo), CDC (Citotoxicidad Dependiente de Complemento) y fijación de complemento. (GRADO DE RECOMENDACIÓN FUERTE; CALIDAD DE LA EVIDENCIA BAJA)
2. EFICACIA Y SEGURIDAD DE LA DESENSIBILIZACIÓN HLA EN RECEPTORES DE DONANTE VIVO HLA INCOMPATIBLES
El trasplante renal sigue siendo una intervención vital para muchos pacientes, pero la incompatibilidad HLA presenta un desafío significativo. Las técnicas de desensibilización han surgido como estrategias prometedoras para abordar este obstáculo y mejorar los resultados del trasplante.
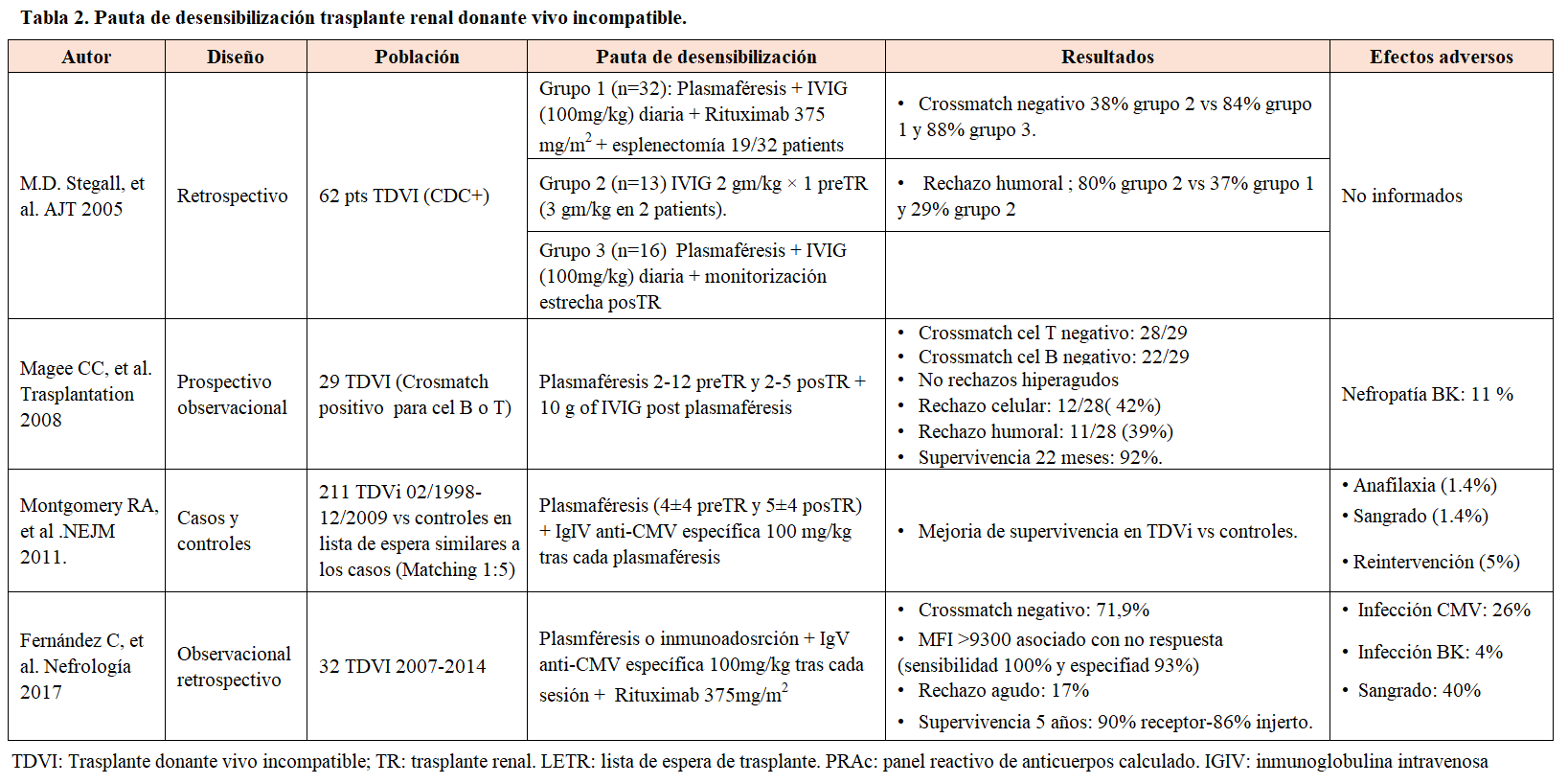
En este sentido diversos estudios han evaluado diversas pautas para este tipo de pacientes. Stegall, et al. (AJT, 2006) [8] en un estudio con 62 TDVI (Trasplante donante vivo incompatible) demostró que las combinaciones de plasmaféresis, IVIG (Inmunoglobulina Intravenosa) y rituximab lograron un prueba cruzada negativa en hasta el 84% de los pacientes. Magee CC, et al. (Transplantation, 2008) [9] con 29 TDVI obtuvo resultados similares, pero con rechazos notables. Montgomery RA, et al. (NEJM, 2011) [4] evidenció mejor supervivencia del trasplante usando plasmaféresis (PF) e IVIG anti-CMV. Fernández C, et al. (Nefrología, 2017) [10], con 32 TDVI, reportó un 72% de prueba cruzada negativa usando protocolos similares. La (Tabla 2) ofrece un resumen detallado de estos estudios.
Conclusiones:
• En paciente donante vivo incompatible, la pauta que ha mostrado mejores resultados en términos de negativización de la prueba cruzada y prevención de rechazo hiperagudo/agudo es la que combinación de recambios plasmáticos, IGIV, y anti-CD20. CALIDAD DE EVIDENCIA MODERADA.
• A pesar de este tratamiento los pacientes con TDVI presentan tasas de rechazo mediado por anticuerpos entre un 30-40%, pero con una supervivencia del injerto aceptable 90% (1er año), 60-70% (4-5 años). CALIDAD DE EVIDENCIA MODERADA.
• Los resultados con inmunoadsorción (IA) y PF son similares, no hay evidencia clara que indique cuando elegir una técnica u otra. CALIDAD DE EVIDENCIA BAJA
• Si bien estas técnicas pueden mejorar la supervivencia del injerto y del receptor, no están exentas de riesgos. Los efectos adversos como anafilaxia, sangrado y complicaciones infecciosas (por ejemplo, CMV y BK) se han reportado y deben ser cuidadosamente monitorizados. CALIDAD DE EVIDENCIA MODERADA.
• Es esencial una valoración individualizada de cada paciente, sopesando los beneficios potenciales de la desensibilización contra los riesgos asociados, para determinar la estrategia más adecuada. CALIDAD DE EVIDENCIA MODERADA.
3. EFICACIA Y SEGURIDAD DE LA DESENSIBILIZACIÓN HLA EN PACIENTES EN LISTA DE ESPERA PARA TRASPLANTE RENAL
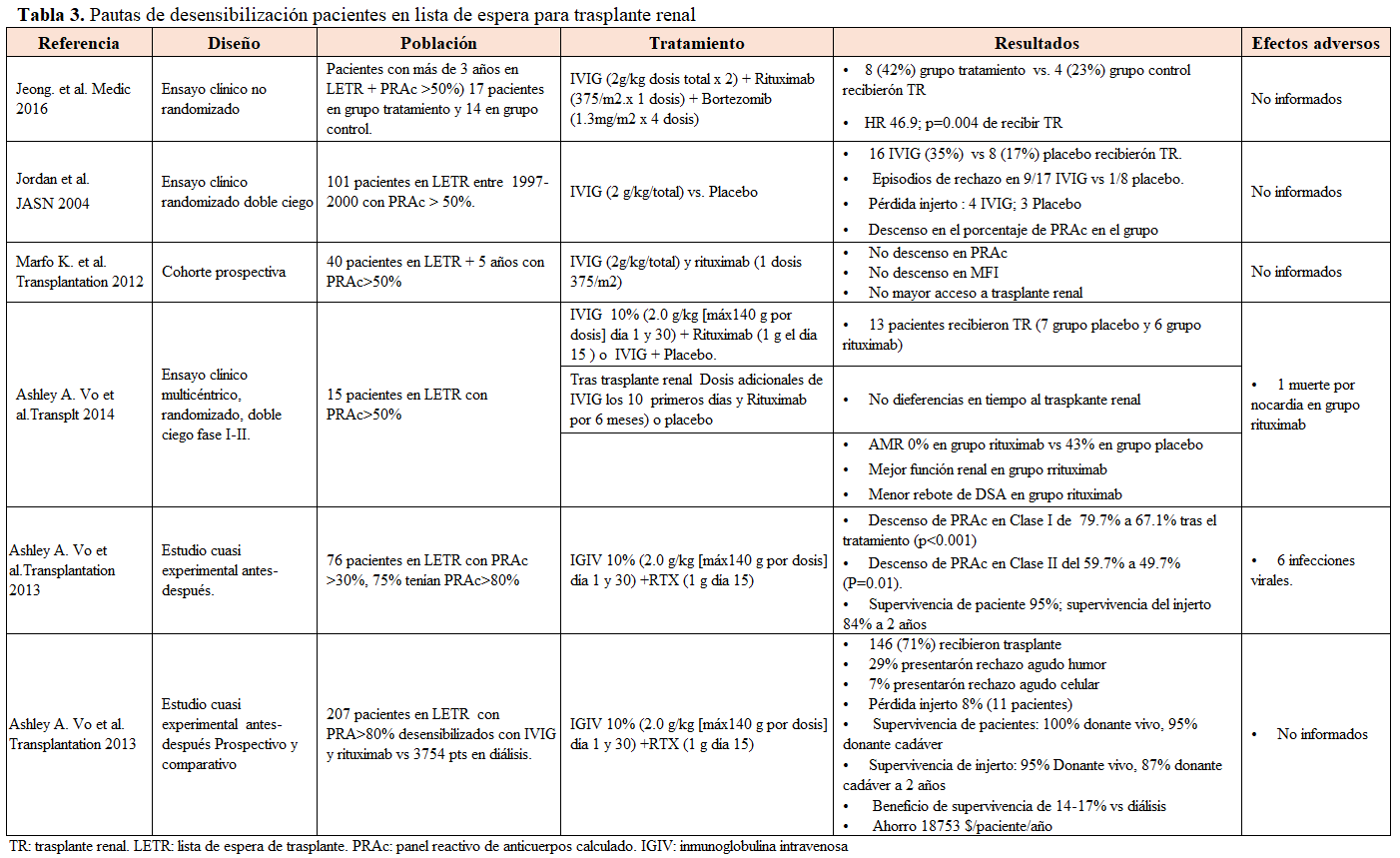
Numerosos estudios han explorado la eficacia de estrategias de desensibilización en pacientes en lista de espera para trasplante renal (LETR) con altos niveles de anticuerpos anti-HLA preformados (PRAc >50%). Estas estrategias, centradas principalmente en el uso de IVIG y anti-CD20, han mostrado resultados variados. Por ejemplo, el estudio de Jeong et al. (Medicine 2016) [11] reveló que el 42% de los pacientes tratados recibió trasplante renal frente al 23% del grupo control. Jordan et al. (Trasplantation Rev 2003) [12] mostró que el 35% de los pacientes tratados con IVIG obtuvo un trasplante, en contraste con el 17% del grupo placebo. Marfo K. et al. (Trasplantation 2012) [13] no observó descenso significativo en PRAc ni aumento en el acceso al trasplante. Los estudios de Ashley A. Vo et al. (Trasplantation 2013 y 2014) [14] [15] presentaron variaciones en el descenso de PRAc, acceso al trasplante y otros indicadores clínicos. Detalles adicionales de estos y otros estudios están consolidados en la (Tabla 3).
Basados en esta información podemos concluir:
* La pauta de desensibilización utilizando IGIV 2 gr/kg + Rituximab 375 mg/kg se ha reportado como efectiva y segura. CALIDAD DE EVIDENCIA BAJA.
* Las pautas de desensibilización en pacientes en lista de espera parecen ser efectivas para facilitar el acceso al trasplante en pacientes con PRA del 50-80%. CALIDAD DE EVIDENCIA BAJA.
* No existe evidencia clara sobre la efectividad de estas pautas en pacientes altamente sensibilizados.
* Existe escasa evidencia sobre la evolución a medio y largo plazo de los pacientes sometidos a estas pautas.
* A la luz de la evidencia actual, se recomienda promover la implementación de programas de priorización e intercambio de órganos para pacientes altamente sensibilizados. Sin embargo, es importante considerar que aquellos pacientes con PRAc del 99-100% y un período en LETR superior a dos años pueden requerir medidas adicionales, como estas pautas, para poder acceder al trasplante renal. RECOMENDACIÓN
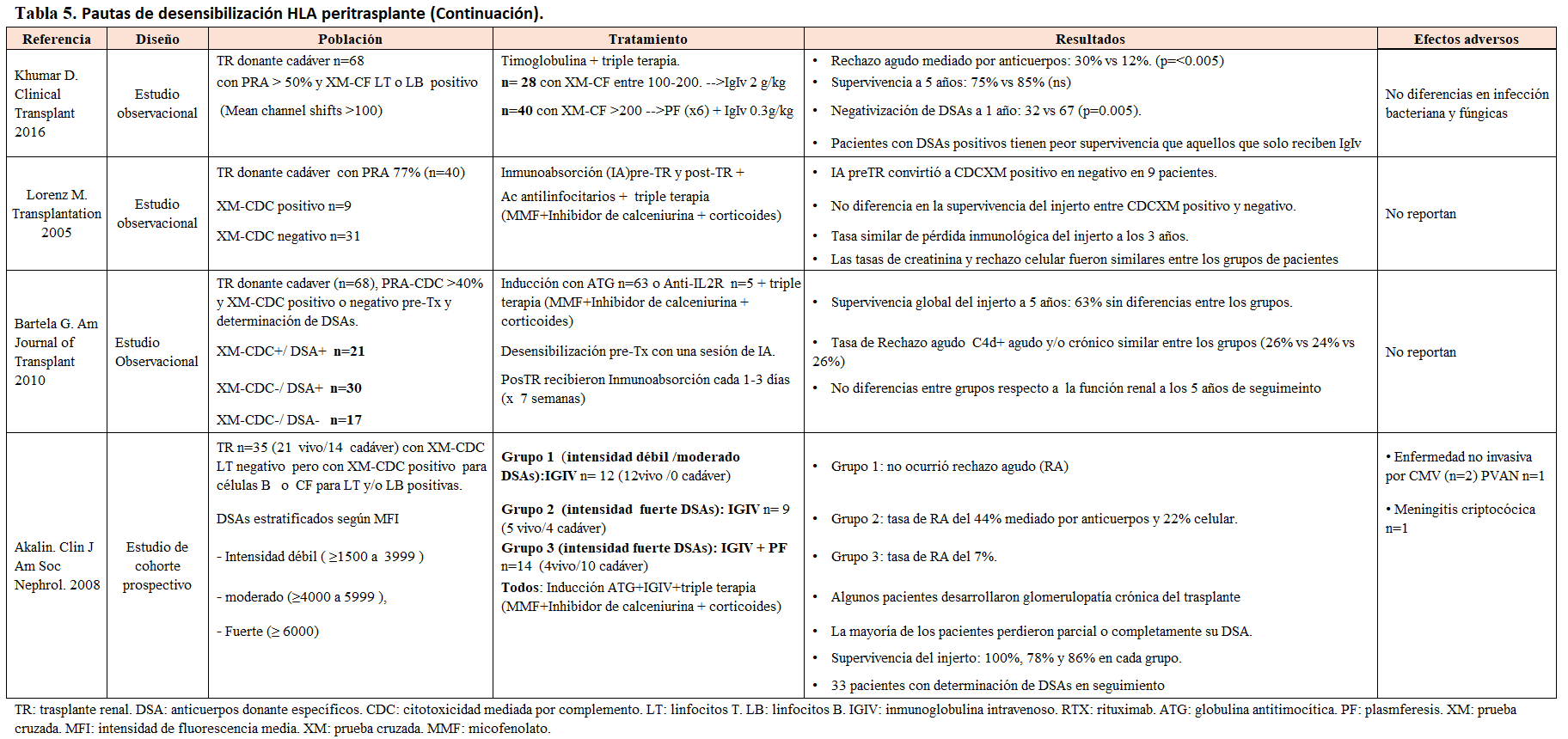
4. EFICACIA Y SEGURIDAD DE PAUTAS PERITRASPLANTE
La gestión de pacientes con altos niveles de anticuerpos anti-HLA en la lista de espera para trasplante renal es un reto considerable en la práctica clínica. Estos pacientes tienen mayor probabilidad de rechazo, lo que ha llevado a la investigación de pautas de desensibilización para mejorar los resultados post-trasplante.
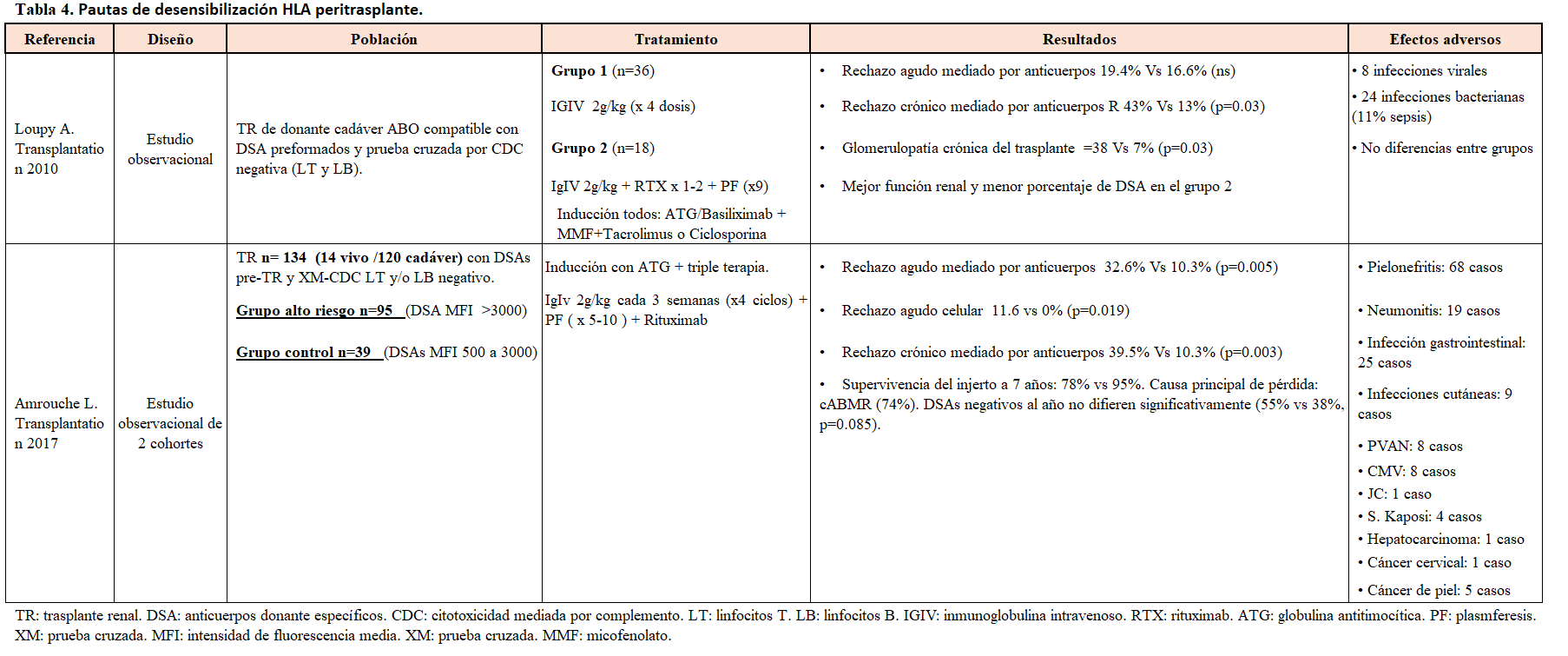
Loupy A, et al. (Transplantation 2010) [16] compararon dos protocolos basados en IGIV, encontrando que el grupo que añadió rituximab y PF tuvo mejor función renal y un menor porcentaje de DSA. Amrouche L, et al. (Transplantation 2017) [17] identificaron que, en pacientes con DSA de alto riesgo, había un 32.6% de incidencia de rechazo agudo mediado por anticuerpos en comparación con el 10.3% en el grupo control.
Kumar D, et al. (Clinical Transplant 2016) [18] estudiaron pacientes con pruebas cruzadas positivas, describiendo que aquellos tratados con IGIV y PF tenían mayores tasas de negativización de DSAs a 1 año. Lorenz M, et al. (Transplantation 2005) [19] y Bartel G et al. (Am J Transplant 2010) [20] informaron que, después de la IA, hubo una negativización significativa de la prueba cruzada pretrasplante en muchos pacientes. A pesar de esto, no observaron diferencias notables en la supervivencia del injerto entre aquellos con pruebas cruzadas positivas y aquellos sin ellas después de aplicar la IA. Akalin (Clin J Am Soc Nephrol. 2008) [21] categorizó pacientes según la intensidad de DSAs. En sus hallazgos, el grupo con DSAs de intensidad fuerte que recibió IGIV + PF tuvo una tasa de rechazo agudo del 7%. En contraste, los grupos con DSAs de intensidad débil o moderado que recibieron IGIV tuvieron tasas de rechazo del 0% y 44% respectivamente.
La información de estos estudios, sumado a otros datos clínicos y efectos adversos, se detalla en la (Tabla 4) y (Tabla 5).
Conclusiones:
* En pacientes altamente sensibilizados con baja probabilidad de recibir un injerto HLA compatible se puede realizar una estrategia de desensibilización basada en la combinación de técnicas de aféresis (PF o IA) más administración de IGIV. CALIDAD DE LA EVIDENCIA MODERADA
* En los pacientes con prueba cruzada por citotoxicidad y por citometría negativa con intensidad baja del DSA (MFI <3000) se podría realizar la desensibilización con IGIV a altas dosis sin necesidad de técnicas de aféresis. CALIDAD DE LA EVIDENCIA BAJA
* No existen evidencias que demuestren los beneficios de la adición de Rituximab a las pautas de desensibilización. Sin embargo, recomendamos su administración en pautas de desensibilización. CALIDAD DE LA EVIDENCIA MODERADO
* El tratamiento con IA pre-trasplante permite el acceso al trasplante a algunos pacientes con prueba cruzada por CDC positiva. CALIDAD DE LA EVIDENCIA BAJA.
* Se debe informar al receptor del elevado riesgo de rechazo mediado por anticuerpos agudo a corto plazo y del elevado riesgo de rechazo crónico mediado por anticuerpos y pérdida del injerto a medio plazo. RECOMENDACIÓN.
5. NUEVOS TRATAMIENTOS DE DESENSIBILIZACIÓN HLA
En los últimos años, el campo del trasplante renal ha presenciado el desarrollo de nuevas pautas y estrategias dirigidas a superar los desafíos asociados con la presencia de anticuerpos anti-HLA. A continuación, describiremos estas novedosas aproximaciones, analizando su aplicación y los resultados obtenidos, proporcionando una perspectiva actualizada sobre los avances en este crucial aspecto del trasplante renal.
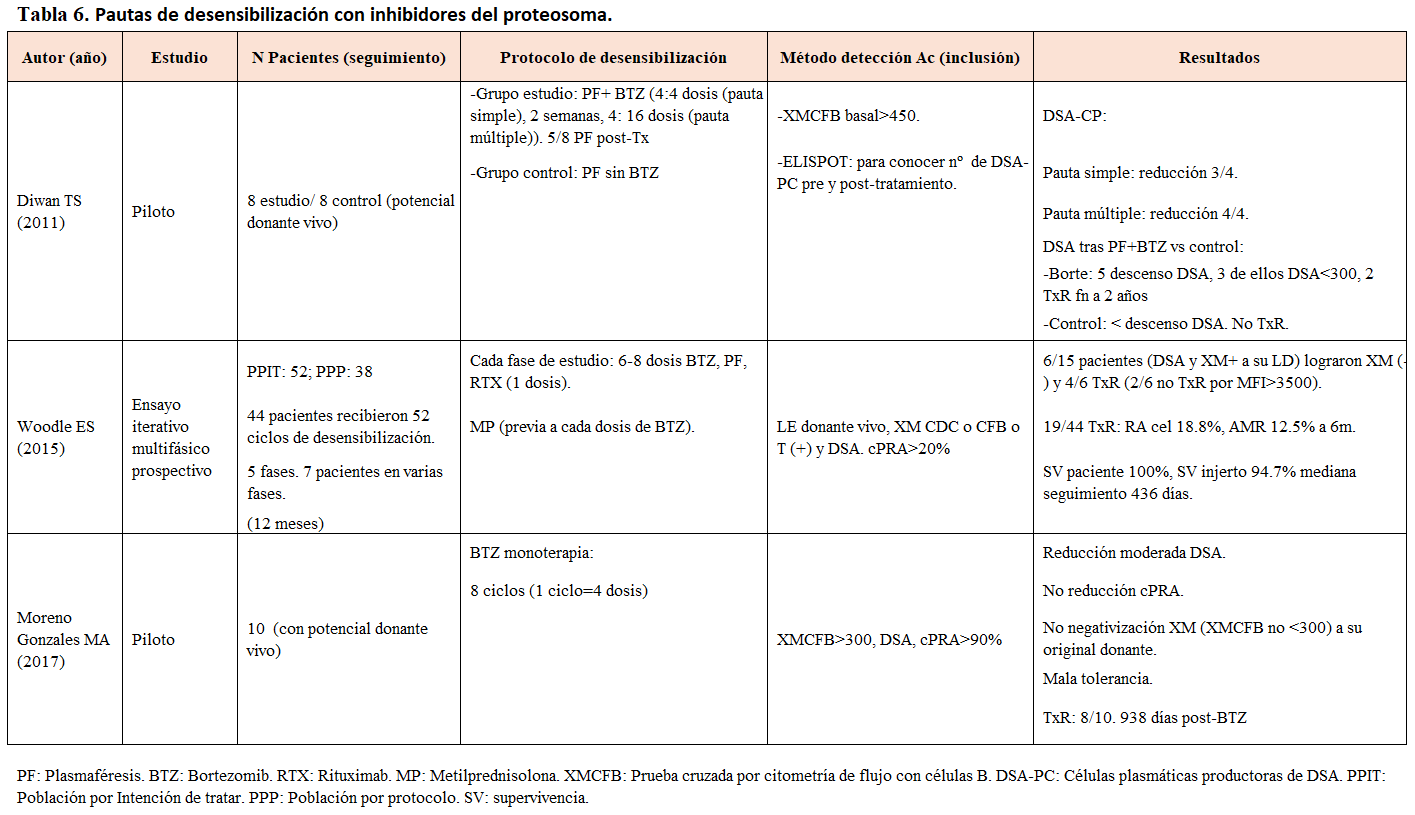
5.1 Inhibidores del proteasoma.
Durante la última década, se han explorado protocolos incluyendo este grupo de fármacos para la desensibilización HLA en trasplantes renales. Diwan TS, et al. (Transplantation 2011) [22] en su estudio piloto con 16 pacientes evidenció que la combinación de PF y Bortezomib (BTZ) generó una reducción significativa de los DSA en la mayoría de los pacientes del grupo de estudio, resultando en un exitoso trasplante renal en 2 de ellos al cabo de 2 años. Por su parte, Woodle ES, et al. (Am J Transplantation 2015) [23] trató a 44 pacientes en un ensayo multifásico con protocolos que incluían BTZ, PF y Rituximab, y logró que 6 de 15 pacientes con DSA negativizaran su prueba cruzada, de los cuales 4 fueron trasplantados con éxito. Sin embargo, Moreno Gonzales MA, et al (Transplanation 2017) [24] observó resultados mixtos con la monoterapia de BTZ: aunque hubo una reducción moderada de DSA, no se logró negativizar la prueba cruzada. A pesar de los avances, es crucial mencionar que no todos los pacientes toleraron bien las pautas; en particular, el estudio de Moreno Gonzales reportó una mala tolerancia al tratamiento. Estos hallazgos reflejan la complejidad y la necesidad de personalizar las estrategias de desensibilización HLA, siempre considerando la eficacia y la seguridad de los tratamientos. La (Tabla 6) detalla el diseño y resultados de los estudios mencionados.
5.2 Imlifidasa
La Imlifidasa es una cisteína-proteasa derivada de una enzima sintetizada por el Streptococo Pyógenes que degrada la IgG humana, producida mediante técnicas de ADN recombinante en células de E. Coli. Su principal función es hidrolizar los anticuerpos IgG. Gracias a su mecanismo de acción específico y selectivo, puede dividir las regiones constantes de las inmunoglobulinas IgG humanas, resultando en una disminución rápida y completa de los anticuerpos anti-HLA. Tras la infusión de Imlifidasa, se ha registrado una notable reducción del total de IgG, incluyendo los anticuerpos anti-HLA y C1q-binding anti-HLA, según pruebas ELISA. Desde una perspectiva farmacocinética y farmacodinámica, a las 6 horas posteriores a la infusión, las moléculas de IgG se descomponen completamente. Sin embargo, se ha observado un incremento repentino en los niveles de anticuerpos anti-HLA entre los días 3 y 14 postratamiento, siendo más pronunciado en aquellos pacientes que no reciben rituximab durante la inducción. Este fenómeno se asocia a la formación de anticuerpos contra la Imlifidasa.
En términos clínicos, se ha reportado la negativización de la prueba cruzada en aproximadamente el 90% de los pacientes con alta sensibilización (PRAc ? 99%). Sin embargo, la tasa de rechazo agudo oscila entre el 40% y el 48%. A los tres años postratamiento, la supervivencia de los pacientes es del 90%, y la del injerto del 85%, con un GFR medio de 55 ml/min. Entre los efectos adversos más comunes se encuentran infecciones y una viremia BK persistente [25] [26] [27].
Respecto a su administración, la dosis recomendada es de 0,25 mg/kg, preferentemente 24 horas antes del trasplante. Es importante tener precaución con posibles interacciones. La Imlifidasa puede inactivar anticuerpos monoclonales como el alentuzumab, los antiCD20 y la timoglobulina. Se sugiere un intervalo de al menos 4 días entre la administración de medicamentos como basiliximab, rituximab y timoglobulina; y de una semana para el belatacept. Hasta ahora, no se han identificado interacciones con el eculizumab. Si se utiliza globulina antihumana tras la administración de Imlifidasa, puede resultar en falsos positivos en las pruebas cruzadas debido a la detección de anticuerpos degradados por la enzima. Por ello, es recomendable administrar globulina antitimocito equino simultáneamente para prevenir estas interacciones.
5.3 Inhibidores del Complemento.
En el ámbito de los tratamientos emergentes para la desensibilización antiHLA en trasplante renal, se destaca el papel de los inhibidores del complemento. Eculizumab, uno de los principales representantes de esta categoría, ha sido objeto de diversos estudios para evaluar su eficacia. Estos estudios sugieren que su uso reduce la incidencia de rechazo agudo mediado por anticuerpos, especialmente en aquellos receptores con prueba cruzada positiva y presencia de depósitos C4d+ en biopsias. A pesar de que se observa un descenso significativo de los DSA durante el primer año post-trasplante, el rechazo mediado por anticuerpos de tipo crónico (ABMR) sigue siendo la principal causa de pérdida del injerto en estos pacientes hiperinmunizados. Adicionalmente, un estudio multicéntrico mostró que eculizumab no sólo se asoció con una disminución en la incidencia de rechazo agudo, sino que también mostró un perfil de seguridad favorable, con un porcentaje reducido de efectos secundarios graves, en su mayoría relacionados con infecciones. A largo plazo, se observó que la supervivencia de injertos a los 5 años en receptores con prueba cruzada positiva tratados con eculizumab se mantenía alentadoramente alta. Sin embargo, es importante destacar que, en algunos contextos, eculizumab no ofreció protección contra glomerulopatía del trasplante en receptores con DSA de clase II y prueba cruzada por citometría de flujo para células B positiva (BFXM) en valores elevados [28] [29] [30].
Por otro lado, respecto a los inhibidores de C1-q, el estudio más prominente hasta la fecha involucró a 20 pacientes, mostrando un potencial en la prevención del rechazo mediado por anticuerpos. La administración de C1-INH evidenció un aumento en los niveles de C1-INH, C3 y C4, y una reducción de los anticuerpos específicos del donante C1q+ [31]. Aunque estos hallazgos son prometedores, es esencial contar con más estudios controlados para confirmar la eficacia y seguridad de estos tratamientos en el ámbito del trasplante renal.
5.4 Inhibidores de Inteleukina-6
En la investigación de tratamientos efectivos para pacientes pretrasplante renal altamente sensibilizados, los inhibidores de Interleukina-6 (IL-6) han emergido como una opción de interés. Dos agentes de esta categoría, clazakizumab y tocilizumab, han sido evaluados en estudios recientes con resultados positivos.
El estudio de clazakizumab, incluyó a 20 pacientes con un alto nivel de sensibilización, manifestado por un PRAc ?50%. El tratamiento con clazakizumab demostró reducir significativamente los niveles de DSA. Un 92% de los pacientes tratados alcanzó una disminución en los niveles de DSA que permitió avanzar hacia el trasplante renal. Adicionalmente, clazakizumab presentó un perfil de seguridad adecuado, con una baja incidencia de complicaciones y sin eventos adversos graves asociados con el medicamento. En cuanto a los resultados clínicos, los pacientes que recibieron clazakizumab tuvieron una tasa de éxito en el trasplante del 91%, en comparación con el 75% en el grupo control, y mostraron una supervivencia del injerto a largo plazo favorable [32].
El segundo estudio evaluó el uso de tocilizumab en combinación IVIG. Los participantes del estudio, todos con un alto nivel de sensibilización y con DSA que prohibían el trasplante, también mostraron resultados positivos con esta combinación. La administración conjunta de tocilizumab e IVIG logró una reducción notable de los niveles de DSA, con un 90% de los pacientes alcanzando los niveles adecuados para el trasplante. En términos de seguridad, tocilizumab, en combinación con IVIG, tuvo una baja incidencia de eventos adversos graves, y aquellos pacientes tratados no solo tuvieron una mayor tasa de éxito en el trasplante, sino también una supervivencia del injerto a largo plazo mejorada en comparación con el grupo control [33].
Estos hallazgos respaldan el potencial de los inhibidores de IL-6 como una estrategia efectiva para la desensibilización en candidatos a trasplante renal, pero son necesarios estudios adicionales para su uso en la práctica clínica.
Conclusiones:
* La administración de un inhibidor del proteasoma, Bortezomib, reduce la formación de células plasmáticas productoras de DSA en pacientes sensibilizados. Esta reducción podría favorecer una menor producción de DSA y con ello favorecer el efecto de la plasmaféresis sobre el nivel de anticuerpos. CALIDAD DE LA EVIDENCIA BAJA.
* La desensibilización basada en inhibidor del proteasoma reduce de forma importante y mantenida los niveles de DSA, lo que puede ser una alternativa a la desensibilización basada en Inmunoglobulina intravenosa. CALIDAD DE LA EVIDENCIA BAJA.
* Bortezomib en monoterapia en pacientes hipersensibilizados produce una reducción moderada de DSA sin lograr negativizar la prueba cruzada por citometría de flujo para células B, y con una mala tolerancia. CALIDAD DE LA EVIDENCIA BAJA.
* En base a los datos disponibles no se recomienda el uso de bortezomib como tratamiento desensibilizador. RECOMENDACIÓN.
* El tratamiento combinado de Imlifidasa e inmunosupresores permite el trasplante renal en pacientes altamente sensibilizados o con prueba cruzada positiva. Aunque el tratamiento con Imlifidasa es prometedor, LA CALIDAD ACTUAL DE LA EVIDENCIA ES BAJA, por lo que no se puede recomendar en este momento como tratamiento desensibilizador.
* No se recomienda el uso de eculizumab por tratamiento desensibilizador. CALIDAD DE LA EVIDENCIA MODERADO.
* No hay evidencia suficiente para recomendar el uso de inhibidores de C1q como tratamiento desensibilizador.
* A pesar de los resultados prometedores con el uso de fármacos inhibidores de IL-6, actualmente no hay evidencia suficiente para recomendar el uso de inhibidores de IL-6 como tratamiento desensibilizador
6. DESENSIBILIZACIÓN HLA EN TRASPLANTE PEDIATRICO
El trasplante renal pediátrico presenta desafíos únicos, y la desensibilización es un área que ha sido tradicionalmente menos estudiada en esta población. A menudo, se ha asumido que las pautas de desensibilización utilizadas en adultos son aplicables a pacientes pediátricos. Sin embargo, en esta revisión, nos centramos específicamente en algunos estudios que abordaron la desensibilización HLA en el ámbito pediátrico.
Un estudio de 2016 incluyó a 4 pacientes pediátricos con anticuerpos anti-HLA positivos, con resultados de prueba cruzada tanto positivos como negativos. Estos pacientes fueron tratados con un régimen que incluía Bortezomib, Rituximab, IGIV y/o plasmaféresis. Durante el seguimiento, no se registró rechazo mediado por anticuerpos en ningún paciente [34].
En 2017, otro estudio evaluó a 2 pacientes que recibieron un protocolo de desensibilización con plasmaféresis e IGIV antes del trasplante. En un seguimiento de 1 a 2 años postrasplante, ninguno de estos pacientes mostró signos de rechazo mediado por anticuerpos [35].
Finalmente, un estudio de 2023 comparó la supervivencia del injerto entre 6 pacientes sometidos a desensibilización y 711 pacientes que no recibieron este tratamiento. Aunque todos los pacientes se sometieron a trasplantes renales de donantes vivos o fallecidos, los pacientes desensibilizados tuvieron una tasa de supervivencia del injerto del 100%, en contraste con una tasa del 96% en aquellos que no fueron desensibilizados [36].
Estos estudios reflejan la relevancia de considerar las especificidades de la población pediátrica en el contexto del trasplante renal y la desensibilización.
Conclusiones:
* La decisión de proceder a la terapia de desensibilización requiere la evaluación del riesgo inmunológico de la pareja receptor-donante. RECOMENDACIÓN.
* El uso de PF + IVIG parece ser eficaz en este tipo de pacientes. CALIDAD DE EVIDENCIA BAJO.
* Se debe intentar la realización de trasplante renal cruzado en niños sensibilizados. RECOMENDACIÓN.
* Si no es posible el trasplante cruzado se debería recurrir a un programa de desensibilización. RECOMENDACIÓN.
* Es necesario seguir investigando estrategias que eviten la sensibilización en los niños. RECOMENDACIÓN.
* Se necesitan estudios controlados para establecer el régimen o los regímenes de desensibilización más adecuados. RECOMENDACIÓN.