Trasplante cruzado y programas de priorización para pacientes hipersensibilizados. Programa PATHI
AUTORES
Sheila Cabello Pelegrín, Hospital Son Espases. Palma
Ángel Alonso Melgar, Hospital Universitario La Paz
Marta Artamendi Larrañaga, Hospital San Pedro de Logroño
Yolanda Calzada Baños, Hospital Sant Joan de Déu
Constantino Fernández Rivera, Complexo Hospitalario Universitario A Coruña
Antonio Franco Esteve, Hospital General de Alicante
Teresa García Álvarez, Hospital Puerta del Mar, Cádiz
Marina González de Rivera Utrera, Fundación Jiménez Díaz. Madrid
Román Hernández Gallego, Hospital Universitario de Badajoz
MªJosé Izquierdo Ortiz, Hospital de Burgos
Thaïs López Alba, Hospital Universitari Parc Taulí
Inmaculada Lorenzo González, Complejo Hospitalario Universitario de Albacete
Miguel Ángel Muñoz Cepeda, Hospital Virgen de la Salud, Toledo
Mercedes Navarro, Hospital Reina Sofía, Córdoba
Pedro Ortega, Hospital Universitario La Fe, Valencia
Pilar Pascual Núñez, Hospital Clínico Universitario de Valladolid
Emilio Rodrigo Calabia, Hospital Universitario Marqués de Valdecilla, Santander
Asunción Sancho Calabuig, Hospital Universitari Dr Peset, Valencia
INTRODUCCIÓN
La sensibilización a los antígenos del sistema leucocitario humano (HLA) es una barrera importante para el trasplante de órganos sólidos y sigue siendo uno de los principales desafíos clínicos. Esta sensibilización se produce cuando el receptor se expone a antígenos HLA extraños [1].
Los factores sensibilizadores son la existencia de embarazos (o abortos) previos a la inclusión en lista, las transfusiones sanguíneas (o de derivados) y, sobre todo, trasplantes previos fracasados con incompatibilidades HLA [2].
La realidad es que el paciente sensibilizado tiene una menor accesibilidad al trasplante [3], menores tasas de trasplante anual y mayor tiempo en lista de espera por la imposibilidad de lograr un donante con una prueba cruzada negativa (correlación directa con el nivel de sensibilización) [4]. Todo ello confiriere a este grupo de pacientes una mayor mortalidad en lista de espera [5] y unos peores resultados en términos de supervivencia y calidad de vida [6].
El grado de sensibilización en un receptor se expresa mediante la tasa calculada de anticuerpos reactivos frente al panel (PRAc) o equivalente, estimando el porcentaje de donantes en una población para quienes un receptor tiene anticuerpos donante específicos (DSA) [7].
La definición clásica del paciente hipersensibilizado (HS) se realiza con PRAc>85% [8]. En nuestra revisión centraremos el foco en aquellos que presentan una tasa de PRAc superior al 95% que presentan mayor dificultad para acceder al trasplante. Estos pacientes, deben tener prioridad en esquemas de asignación de órganos y se debe llevar a cabo una política activa para tratar de trasplantar a este subgrupo de pacientes.
En esta revisión nos centraremos en examinar la evidencia actual en torno al acceso de los pacientes hipersensibilizados al trasplante y establecer recomendaciones consensuadas que faciliten la valoración y el manejo de este tipo de pacientes.
SENSIBILIZACIÓN HLA EN EL TRASPLANTE
La contribución de los distintos fenómenos a la sensibilización total del paciente difiere mucho en las series publicadas pero el trasplante es el que produce más y mayor intensidad de anticuerpos circulantes [9] y si se revisa la supervivencia, se ha publicado una peor supervivencia del injerto en receptores sensibilizados por trasplantes previos.
Así, debemos minimizar el impacto negativo de la sensibilización con actuaciones como mejorar la compatibilidad HLA entre donante y receptor en los primeros trasplantes para disminuir la probabilidad de desarrollar anticuerpos donante específicos en próximos trasplantes (con especial énfasis en los pacientes jóvenes) [10]; asegurar la adherencia al tratamiento inmunosupresor y evitar las trasfusiones sanguíneas.
Es imperativa la necesidad de hacer una monitorización periódica de los anticuerpos antiHLA cada tres meses mientras el paciente permanece en lista de espera y un seguimiento más estrecho, entre dos y cuatro semanas, tras un evento sensibilizador para tener identificada la situación inmunológica [11].
Hoy en día estamos viviendo un aumento progresivo del número de pacientes hipersensibilizados en nuestras listas de espera coincidiendo con el avance de las técnicas basadas en Luminex (SAB Single Antigen Bed) extendidas a la mayoría de los centros que realizan trasplante de órgano sólido [12]; este ensayo parece ser mucho más sensible que las anteriores técnicas, tanto la CDC (citotoxicidad dependiente de complemento) como la FCM (citometría de flujo) para detectar anticuerpos HLA y DSA. Desde su implantación en el 2010 hemos pasado a tener un porcentaje de pacientes en lista de espera con PRAc de >50% de un 40-50% y un porcentaje de pacientes con PRAc>95% de más de 20% en España [13]. Este efecto hace que cobre vital importante el comprender la historia inmunológica detallada de los pacientes en LE.
Para la medición del PRA se utiliza un parámetro basado en métodos virtuales que reflejan las frecuencias HLA de la población real de donantes de órganos, como vPRA, cPRA o cRF, para estimar la probabilidad de que un paciente sensibilizado pueda ser trasplantado con un donante compatible sin necesidad de ningún tratamiento adicional.
El PRA calculado (PRAc) que usamos en nuestro medio está basado en un pool definido de donantes; en España disponemos de la calculadora PATHI en base a los donantes que se han ido ofertando en nuestro país a lo largo de los años [14]. Ésta ha sido validada y comparada con otras calculadoras (Eurotransplant (EUTR), United Network for Organ Sharing (UNOS), Canadian Transplant Registry (CTR)). Cada zona geográfica define en base a qué pool lo calcula puesto que hay distintas frecuencias alélicas en distintos grupos de población.
La importancia de calcular el porcentaje de PRA de nuestros pacientes radica también en proporcionar una información más real de la posibilidad del acceso al trasplante, así la probabilidad entre un PRAc 99.5% y uno de 99.9% difiere mucho, para el primero deberíamos de tener teóricamente unos 600 donantes para tener una posibilidad real de cruce y en el segundo 3000. Si añadimos los máximos decimales posibles disponemos de una mejor aproximación; un 99.99% precisa de 30.000 donantes efectivos para tener un cruce y un 99.999 precisa de 300.000. Con estos datos ya publicados hace unos años y la relación que tiene éste con la tasa de trasplante, a día de hoy con los métodos que disponemos debemos de proporcionar los datos del PRAc con los máximos decimales posibles [15].
¿Cómo aumentamos la probabilidad de acceso al trasplante en este subgrupo de pacientes?
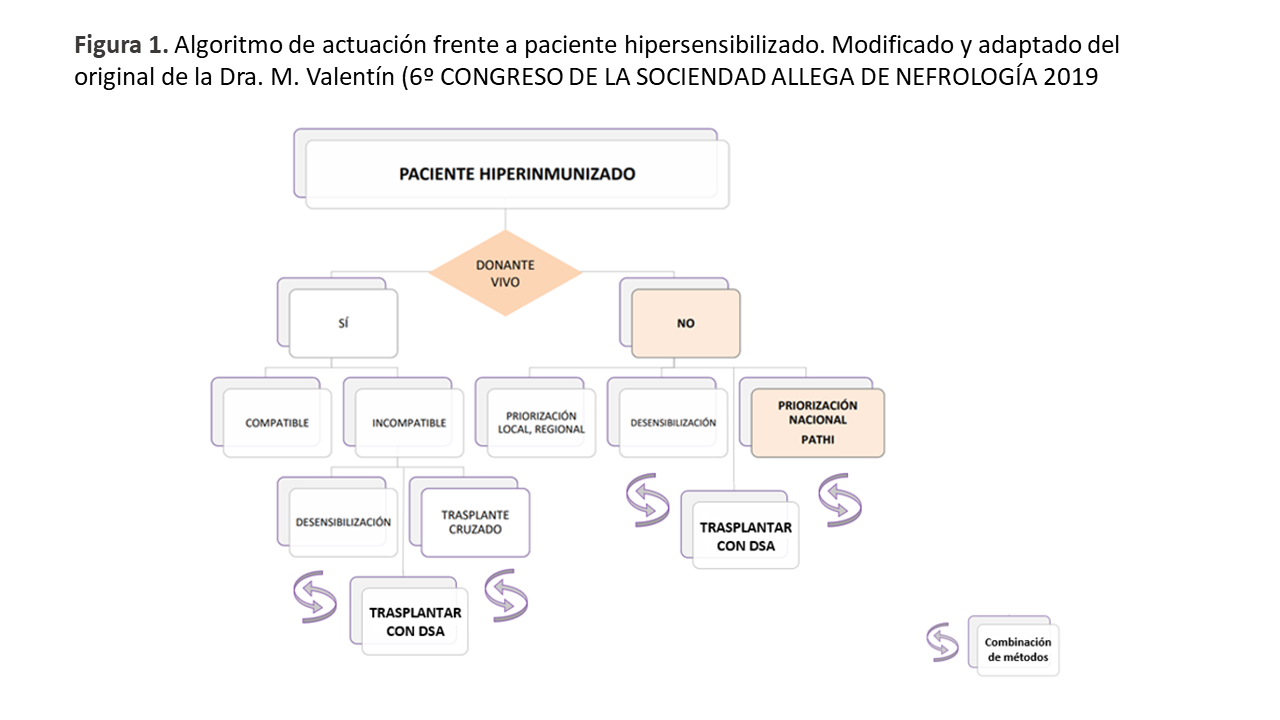
Las opciones de trasplante para pacientes hiperinmunizados varían en función de la existencia de un donante vivo o no. Si tiene y no existe incompatibilidad, se procedería al trasplante; si, por el contrario, existe incompatibilidad entre donante y receptor, las opciones van hacia la incorporación en listas de trasplante renal cruzado (TRC), realizar tratamiento de desensibilización (DS) o incorporación a listas de donante fallecido específicas para pacientes hipersensibilizados. En nuestro caso y ajustándonos al tema que nos compete desarrollar analizaremos con más detalle las opciones del trasplante con donante fallecido y el trasplante renal cruzado siguiendo el algoritmo que ya propuso en 2015 por la Dra. Valentín y modificado por el grupo para ajustarse a las nuevas propuestas (Figura 1).
OPCIONES DE TRASPLANTE DEL PACIENTE HIPERSENSIBILIZADO DE DONANTE FALLECIDO
* Primer escalón los programas locales: prioridad en la lista del centro con una escasa probabilidad de trasplantarse con tasas que no alcanzan el 5% [16].
* Segundo escalón los programas autonómicos: prioridad dentro de la comunidad autónoma o dentro de una región definida intentando aumentar la tasa de trasplante, aunque nunca se han publicado tasas mayores de un 15%; como ejemplos de estos programas en nuestro país tenemos el programa de Andalucía [24] y el programa de Catalunya (Hipercat).
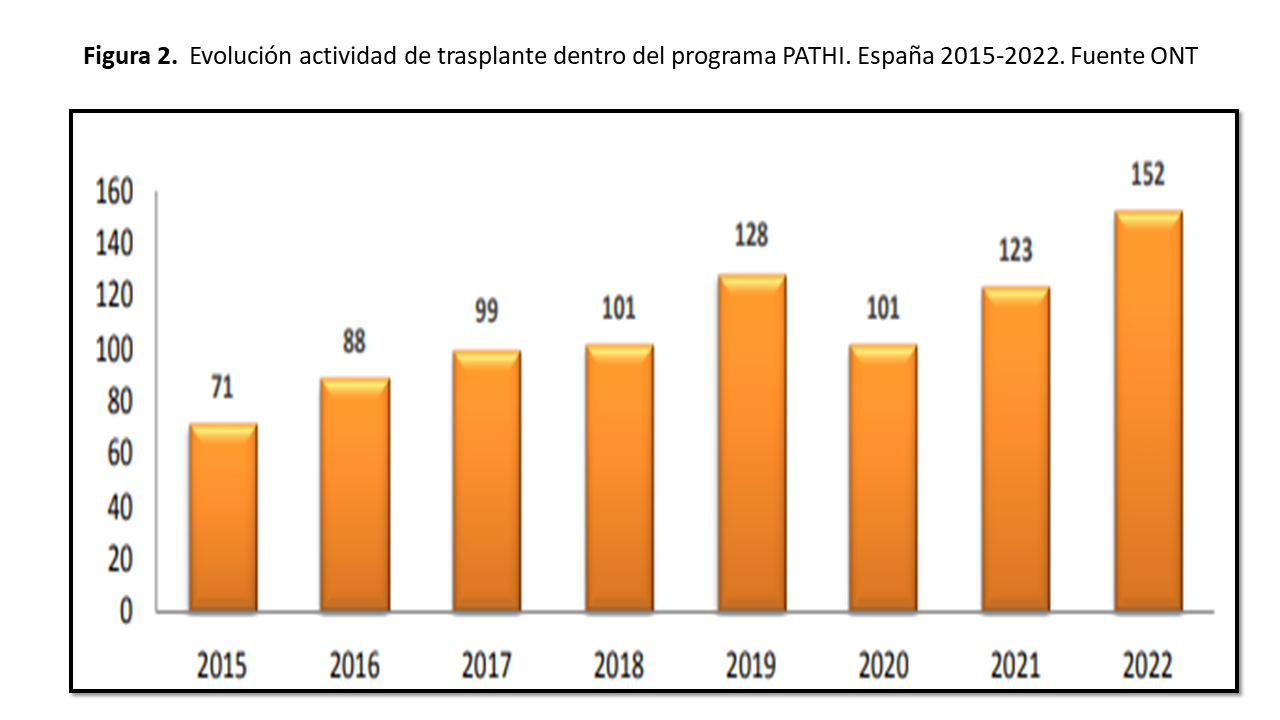
* Tercer escalón los programas nacionales: en nuestro entorno tenemos el programa PATHI (programa de acceso al trasplante en el paciente hiperinmunizado) en el que se da una prioridad nacional a los pacientes HS con PRAc ? 98% y que en el primer año de implantación en 2015 se consiguió una tasa de trasplante del 24.9% y se ha mantenido en los siguientes años en aproximadamente un 12% [13] (Figura 2). Actualmente existen programas comparables en muchos otros países que tienen como finalidad la priorización para este subgrupo de pacientes.
* Cuarto escalón los programas internacionales: se ampliará la población de otros países para tener una proporción mayor de potenciales donantes y aumentar la tasa de trasplante.
Métodos de asignación de órganos en los programas de priorización para pacientes hipersensibilizados
Al incluir a los pacientes en programas de priorización debemos definir muy bien el método de asignación de órganos que vamos a seguir para garantizar la máxima equidad y transparencia. Los sistemas de asignación conocidos son básicamente dos:
-. Sistema de las incompatibilidades aceptables (The Acceptable Mismatch (AM) program) usado en la zona Eurotransplant [18](Austria, Bélgica, Croacia, Alemania, Hungría, Luxemburgo, Holanda y Eslovenia) desde 1989 y en los países escandinavos [19]. La base del programa es realizar un análisis exhaustivo de anticuerpos HLA para identificar antígenos HLA contra los cuales los pacientes HS no han producido anticuerpos (verificación con Luminuex SAB mediante un único laboratorio central). Estas incompatibilidades se enumeran como “AM” y, junto con los antígenos HLA del propio paciente crean un fenotipo HLA extendido que se utiliza para la asignación de órganos. Para ser incluido en el programa los pacientes deben tener una tasa de PRAc superior al 85% y permanecer dos años en terapia renal sustitutiva.
Posteriormente se prioriza a los pacientes con otros ítems para la asignación de los órganos en los que se tiene especial interés en la compatibilidad ABO, el HLA matchmaker para epítopes de clase I y la compatibilidad HLA (se precisa una mínima compatibilidad HLA de dos DR o de un DR y un B) [20]. Este programa ha demostrado ser una herramienta eficaz para mejorar el acceso al trasplante en el paciente HS con buenos resultados
-. Sistema de antígenos prohibidos (“unacceptable antigen”) usado en la mayoría de los países que tienen sistema de priorización y se basa en la prueba cruzada virtual (España, Francia, Canadá, Estados Unidos): El dintel mínimo de PRAc para ser incluido en el programa lo decide cada país (mínimo de PRAc>85%) y el tiempo de permanencia en terapia renal sustitutiva. Se debe de disponer de dos mediciones de los anticuerpos HLA A; B; Cw; DRB1; DRB3; DRB4; DRB5 y DQB1 separadas por un plazo mínimo de tres meses (Luminex). Los resultados deben actualizarse anualmente y siempre que se dé un acontecimiento sensibilizador.
PROGRAMA PATHI (PLAN NACIONAL DE ACCESO AL TRASPLANTE RENAL PARA PACIENTES HIPERINMUNIZADOS)
Este programa liderado por la ONT (organización nacional de trasplantes) se puso en marcha en junio de 2015 con el objetivo de aumentar las posibilidades de trasplante renal en pacientes hiperinmunizados; en él participan 27 hospitales de 15 Comunidades Autónomas.
El programa se sustenta en un programa informático que detecta la posible compatibilidad entre un donante y un grupo seleccionado de pacientes sensibilizados (prueba cruzada virtual mediante técnica de Luminex) para elegir rápidamente entre todos los receptores hipersensibilizados incluidos en el registro Nacional del programa PATHI, aquel que es compatible con un donante determinado [21].
Para que un paciente pueda ser incluido en el programa debe de cumplir una serie de requisitos indispensables:
· PRA calculado ?98% en dos determinaciones de anticuerpos (por técnicas de antígeno aislado) tanto clase I como clase II, separadas un plazo de al menos 3 meses.
· Permanencia mínima de 1 año en TRS, excepto el fallo de donante vivo (1 año desde el Tx). Los receptores infantiles (menores de 16 años) tienen prioridad sobre el resto.
· La medida de anticuerpos debe ser actualizada anualmente o tras cada evento sensibilizador.
Se utilizan donantes de hasta 70 años en muerte encefálica (ME), desde 2019, hasta 65 años para donantes en asistolia controlada (AC), y desde 2024 se aceptan donantes de AC también hasta los 70 años. Los centros participantes que, al extraer órganos, generen 2 riñones válidos para el trasplante, se ofertará uno de ellos obligatoriamente al programa PATHI. Para la asignación de los órganos se realiza una selección basada en grupo sanguíneo (GS), ausencia de especificidades prohibidas, diferencia de edad y situación geográfica respecto al centro donde se genera el órgano.
El esquema de priorización del programaPATHI se establece en base a grupo sanguíneo, diferencia de edad, tiempo en diálisis, localización geográfica entre centro donante/receptor. Además, tiene unos puntos especiales que se han ido ajustando en función de las necesidades:
* Prioriza PRAc 100% (2018/2019)
* Permite retirar especificidades prohibidas (“delisting”) que se consideren oportunas en pacientes con PRAc 100% si han pasado dos años sin recibir un cruce (2019/2020)
* Se da una priorización extra si el paciente ha iniciado en su centro tratamiento de desensibilización HLA (sin retirar filtro de PRA)
Con este programa nacional en este subgrupo de pacientes se ha conseguido aumentar la tasa de trasplante anual global consiguiendo los tres primeros años hasta 26% y actualmente se mantiene entre un 15-18%.
Así en el primer año de creación del programa se trasplantaron 71 pacientes y se ha mantenido la actividad aproximadamente en unos 100 trasplantes por año; en 2022 se consiguió la cifra máxima de trasplante llegando a un total de 152 pacientes (Figura 2).
La gran mayoría de estos trasplantes se han realizado dentro del programa (>85%) y algunos de ellos fuera de programa; es decir, se han conseguido trasplantar en base a sus donantes de los programas locales.
Se ha disminuido el tiempo en lista de espera tanto los que se trasplantan dentro del programa con una mediana de tiempo de 9 meses (rango entre 3-23 meses) como los que lo que se realizan fuera del programa que es de 11 meses (rango entre 4-22 meses). [22].
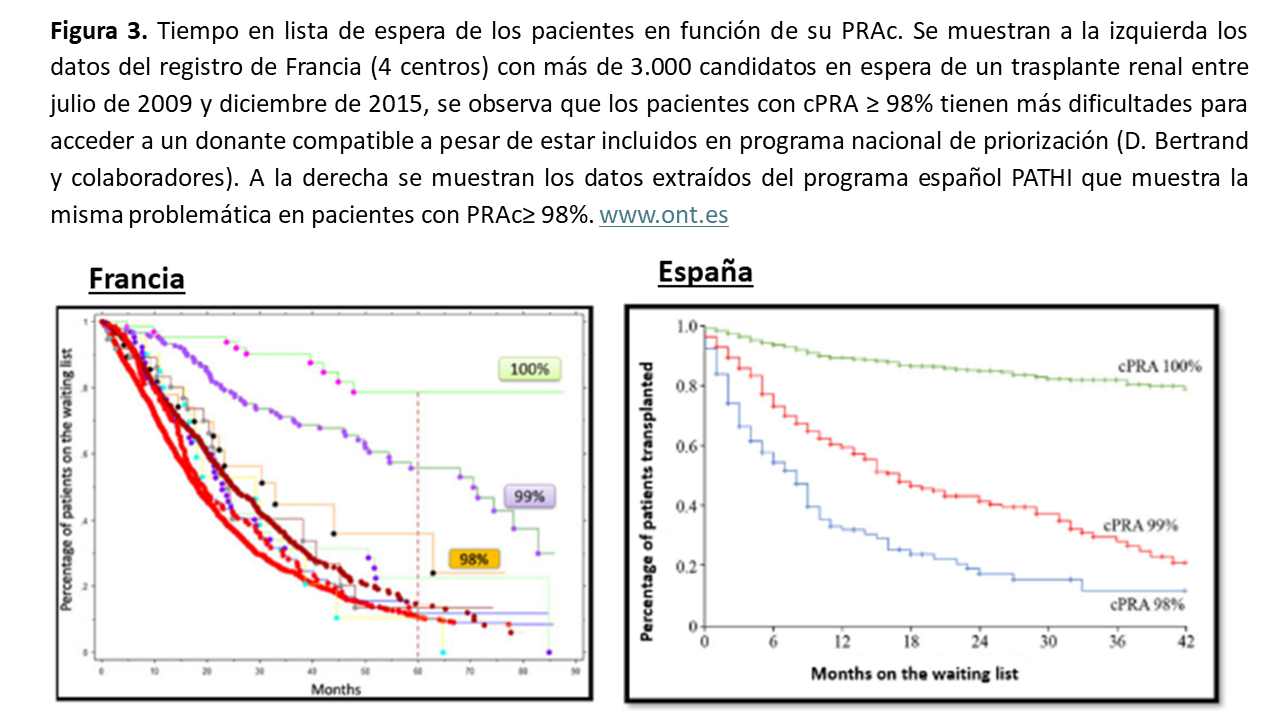
Pese a todos estos datos favorables, no todos los pacientes consiguen un adecuado acceso al trasplante en el programa PATHI. Los pacientes con PRAc 100% tienen una tasa de trasplante muy baja y permanecen mucho tiempo en lista de espera, por lo que en estos pacientes, el programa no resulta suficientemente eficaz (Figura 3).
Los resultados clínicos son prometedores consiguiendo datos de 258 pacientes de los 295 primeros trasplantes desde la creación hasta marzo de 2018 con una supervivencia al año de paciente 94% y supervivencia de injerto 88,7%. Se reportaron una baja tasa de rechazo agudo; un 19% de los cuales la tasa de rechazo mediado por anticuerpos fue del 11,6% [22].
Se ha publicado resultados satisfactorios tanto en pacientes hipersensibilizados que reciben un donante en ME como el que lo hace con uno procedente de AC; es cierto que la función renal hasta los dos primeros años tiene mejores resultados la ME pero esa diferencia se pierde a partir del tercer año. No hay diferencias ni en supervivencia del paciente ni en supervivencia del injerto; aunque en el estudio no se han introducido ciertas variables (DSA, isquemia caliente, método de preservación...) que podrían modificar en cierta manera los resultados obtenidos [23].
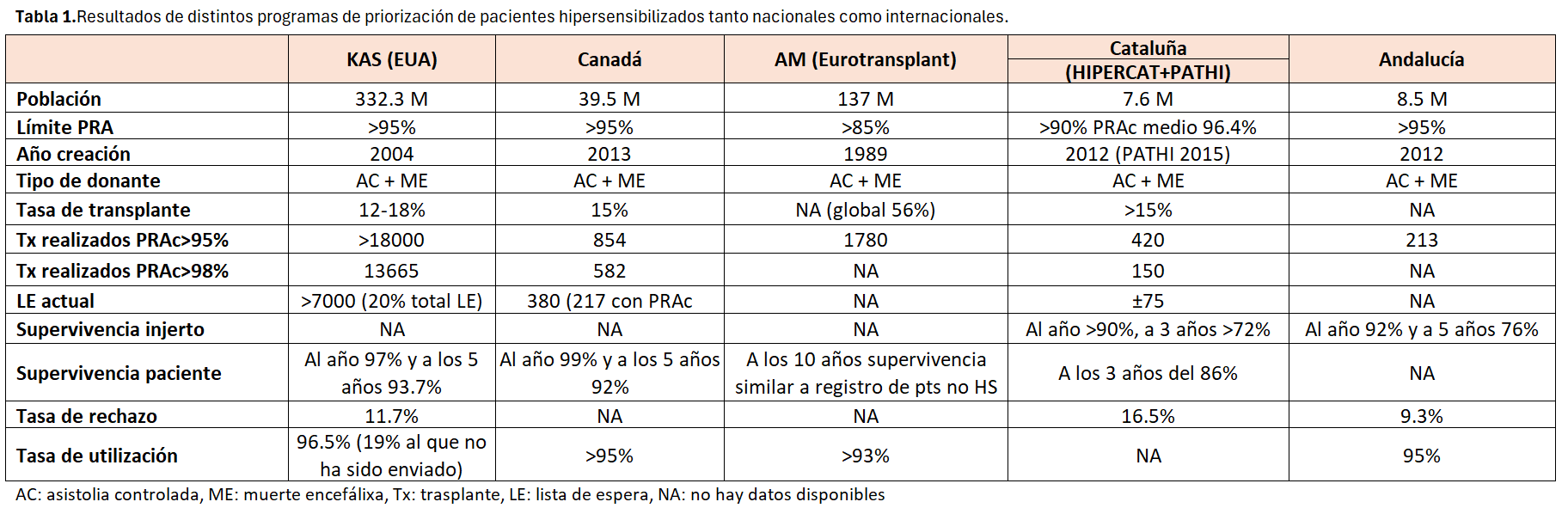
Si comparamos los resultados del programa español con otros países como EEUU, Canadá o la Zona Eurotransplant vemos que hay diferencias significativas (Tabla 1).
En Estados Unidos, tras la creación del KAS (Kidney allocation system) en 2014 [24] en los que dan prioridad absoluta en todos los grupos de KDPI (Kidney Donor Profile Index ) a los pacientes HS han conseguido trasplantar a casi 5000 pacientes con PRAc?99% y a más de 18000 pacientes con PRAc>95% según las últimas publicaciones.
De esta manera la proporción de pacientes con un porcentaje superior al 98% de cPRA ha disminuido en 2019, desde el 9,4% en 2013 hasta el 7,2% en 2017 y el tiempo en lista de espera de los pacientes altamente sensibilizados (98-100%) disminuyó de 19 a 3,2 años. Aun así, se tiene una lista de espera actual de más de 7000 pacientes HS que corresponde a un 20% del total de la lista de espera.
Los pacientes que llegan al trasplante tienen una edad media de 49 años, más jóvenes que los trasplantes realizados a pacientes con menor PRAc, el 40% son hombres y tienen una media de tiempo en diálisis de 4.4 años. El 64.3% de ellos son retrasplantes y reciben mejores riñones con la clasificación de KPDI con una media de 35 (17-56) [25].
No hay publicaciones de resultados de estos pacientes en términos de supervivencia tanto de paciente como de injerto ni de tasas de rechazo por lo que se hace imposible comparar ambos sistemas de asignación.
En Canada se inició el programa de priorización en 2014 con un mínimo de PRAc de 95% y ya han realizado más de 13300 trasplante dentro del programa con muy bueno resultados en términos de supervivencia del paciente, aunque no hay datos de supervivencia del injerto. La tasa de trasplante se sitúa en un 15% pero siguen teniendo un elevado porcentaje de paciente con PRAc de 100% en lista de espera [26].
En la zona de Eurotransplant el límite de PRAc para incluirlo como HS se ha establecido en >85%. Con un recorrido en tiempo mucho más largo, iniciado el programa en 1989 ha conseguido trasplantar a casi 2000 pacientes con un PRAc >95%. El programa ha ido sufriendo cambios y adaptándose a las nuevas situaciones y a los nuevos retos, pero han conseguido una tasa de trasplante global en estos 25 años del 56% [27]. De los pacientes incluidos en el programa la mitad de ellos consiguen llegar al trasplante a los 20 meses de media.
La dificultad al acceso al trasplante en este método de asignación (AM) viene dada en los pacientes con tipajes HLA muy distintos de la zona que al no conseguir compatibilidad HLA tiene pocas posibilidades de trasplantarse [28].
A su vez, sólo destinan al programa AM el 3,3% de todos los donantes cadavéricos que se generan en la zona Eurotransplant por lo que queda margen para aumentar la tasa de trasplantes en este subgrupo de pacientes.
Los datos publicados en términos de supervivencia del paciente son similares a lo registrado en los pacientes no HS [29]. Si nos centramos en los resultados de los HS comparados con otros métodos de asignación previos, los pacientes trasplantados con el programa AM han presentado mejores resultados en cuanto a supervivencia del injerto [30].
En resumen, los tres programas internacionales que más actividad han generado tienen el mismo problema que el programa español PATHI, la baja tasa de trasplante en paciente en LE con PRAc 100%.
En España, tenemos actualmente más de 450 pacientes con PRAc 100% activos que no han recibido ninguna oferta; es decir siguen en lista de espera desde el inicio del programa (6/2015). En otras palabras, de todo el grupo de PRAc de 100% incluidos en el programa, a los 60 meses de programa sólo se han conseguido trasplantar el 10% de ellos.
Asís pues, debemos de aumentar el pool de donantes que se oferten o bien buscar alternativas para que el acceso al trasplante de estos pacientes sea una realidad.
OPCIONES DE TRASPLANTE RENAL NO CONVENCIONAL EN EL PACIENTE HIPERSENSIBILIZADO
I. Trasplantar tras realizar un tratamiento de desensibilización (DS)
Llegar al trasplante sin DSA ofrece mejores resultados, pero si no ha habido opción de cruce dentro de las LE con la priorización de la que disponemos debemos de realizar la desensibilización para aumentar la posibilidad de acceder al trasplante [31]; los resultados que vamos a obtener variarán en función de muchos aspectos, pero sobre todo del tratamiento utilizado y de las características inmunológicas del paciente [32].
Algoritmo de desensibilización (DS)
-. Proponer la DS a los pacientes que se mantienen en LE sin recibir oferta desde el inicio de programa (6/2015) independientemente del porcentaje de PRAc
-. Considerar realizar DS a los pacientes con PRAc>99% sin recibir oferta en 2 años.
Realizar este tipo de tratamiento para acceder al trasplante va a ofrecer mejores resultados si comparamos con seguir en LE o quedarse en diálisis [33].
Para homogeneizar los tratamientos realizados debemos tener protocolos nacionales de desensibilización que se usen en todo el territorio para poder analizar los resultados y sacar mejores conclusiones.
La monitorización inmunológica debe ser muy estrecha tras inicio de un tratamiento de DS. Cuando se decide realizar esta terapia el paciente debe tener prioridad dentro del programa al que esté incluido y se deberá repetir el esquema de tratamiento si durante un tiempo prefijado el paciente no recibe ningún cruce estando en LE.
En un tiempo veremos publicados los resultados de la DS dentro del programa PATHI (actualmente sólo se requiere la notificación a la ONT para asignar mayor puntuación) pero se irán añadiendo datos al registro para ver que tasa de trasplante se ha conseguido y que porcentaje de pacientes se ha conseguido trasplantar tras la DS.
II. Trasplantar con DSA (con la presencia de anticuerpos donante específicos)
Esta estrategia debe contemplarse como una opción plausible para pacientes hiperinmunizados; se asume mayor riesgo inmunológico y el realizar o no el trasplante con DSA va a depender del centro y de su experiencia en este campo.
Algoritmo de trasplante con DSA
Para ello debemos de tener claros unos puntos determinados para estratificar el riesgo y asegurar resultados:
-. Categorizar mejor los anticuerpos
-. Definir el MFI (intensidad media de fluorescencia) del anticuerpo aceptable por cada centro. En las últimas publicaciones se recomienda que el título de MFI por SAFB sea inferior a 5000 tras una dilución de 1:10.
-. Aceptar el anticuerpo DSA siempre que no fijen complemento
-. Intentar realizar el trasplante con prueba cruzada por citotoxicidad negativa (tasa de supervivencia de injerto mucho menores con +XM)
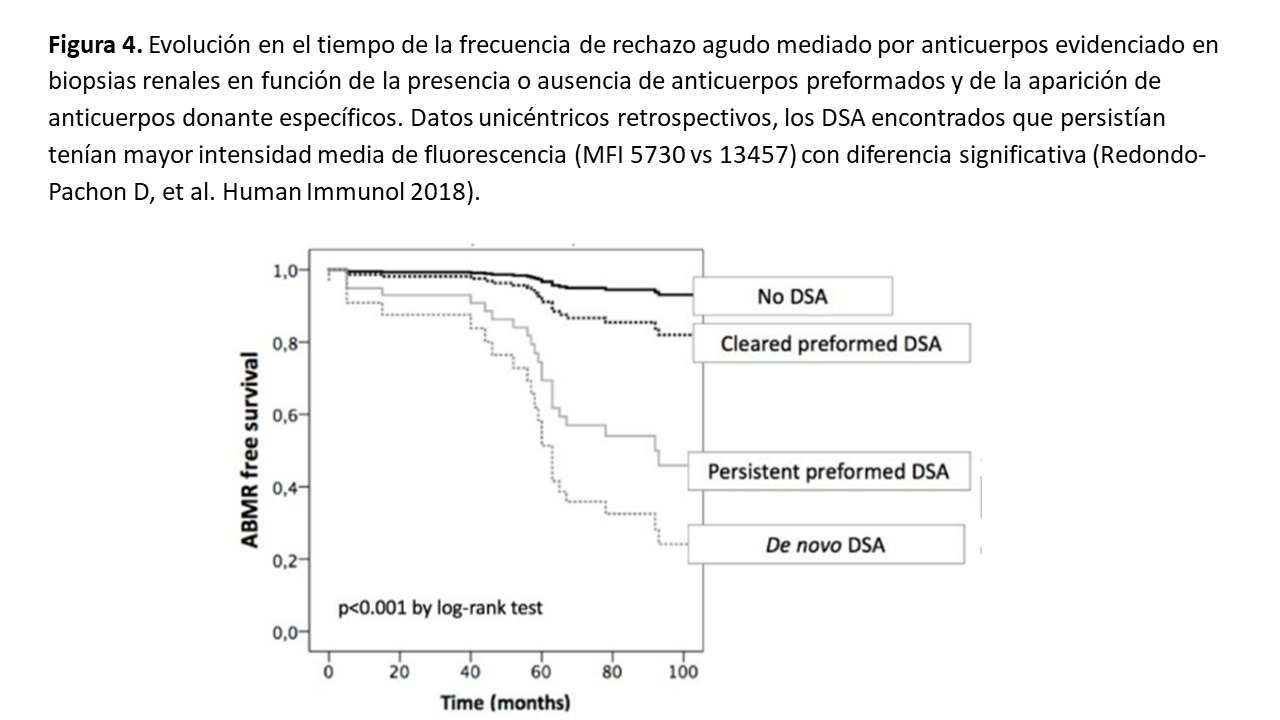
Si llevamos a cabo esta estrategia obtendremos peores resultados si los DSA son anti-HLA de clase I (existan o no de clase II) pero tendremos mejores resultados que cuando los DSA aparecen tras el trasplante [34] (Figura 4).
Sabemos que los resultados esperables serán mejores realizando trasplante HLA compatibles que con HLA incompatibles, pero en términos de supervivencia realizar el trasplante HLAi ofrece mejores resultados que permanecer en lista de espera [35] [36] [37].
Delante de este escenario podemos combinar estrategias, mantener al paciente en lista de espera del programa PATHI y realizar un “delisting”, es decir quitando antígenos con especificidades prohibidas con un intento de disminuir el PRAc y así tener mayor acceso al trasplante. Sabemos que ese anticuerpo está presente, y será el criterio del centro el que establezca dicho anticuerpo como aceptable. Al tener un cruce, tendremos la opción de trasplantarlo, aunque sea con prueba cruzada positiva (evitar trasplantar con prueba cruzada por CDC positivo, y valorar la posibilidad de hacerlo con prueba cruzada positiva por citometría de flujo) y reajustando la inmunosupresión incluyendo al arsenal terapéutico las nuevas herramientas aceptadas para este grupo de pacientes [38], [39].
CONCLUSIONES y RECOMENDACIONES
-. El número de pacientes hipersensibilizados está creciendo progresivamente en las listas de espera por lo que debemos priorizarlos para asignarles donantes, preferiblemente, frente a los que no tengan anticuerpos antiHLA (grado de recomendación A)
· Aporta mejores resultados y es más coste-efectiva
· Se debe insistir en la búsqueda de un donante vivo compatible
-. Debemos incentivar la donación de vivo en nuestros programas de trasplante con todas sus variedades (ABOi y trasplante renal cruzado) (grado de recomendación A)
-. Se recomienda en pacientes con PRAc >99% disponer del mayor número de decimales posible en la estimación de dicho PRA (grado de recomendación B)
-. Se sugiere incluir en programas autonómicos los pacientes con PRAc>90% para aumentar las posibilidades de trasplantes (grado de recomendación A)
· Idealmente deberían de ser por proximidad en zona geográfica
-. Considerar ofertar dentro de programa PATHI el segundo riñón si se detecta un posible cruce para el subgrupo de PRAc 100% y a los de grupo O (opinión de grupo).
-. En pacientes HS debemos de plantear la desensibilización en (grado de recomendación B):
• aquellos con PRAc 100% que actualmente siguen en lista de PATHI sin cruce.
• aquellos con PRAc >99% si pasados dos años en LE no han recibido un cruce.
-. Definir protocolos en función de situación inmunológica y disponer de protocolos nacionales identificados (grado de recomendación A)
-. Tras realización tratamientos de desensibilización las tasas de trasplante aumentan en función de los tratamientos administrados y de la sensibilidad previa del paciente. Si no se consigue el trasplante tras la desensibilización puede intentarse el trasplante con DSA (grado de recomendación A)
• Con prueba cruzada por CDC negativo, y
• DSAs no fijadores de complemento
-. En función de las características de los receptores podemos realizar el trasplante directamente con DSA (grado de recomendación B)
-. Estudiar detenidamente al receptor y reevaluar si podemos hacer delisting de algunos antígenos definidos como prohibidos con título bajo de anticuerpos (grado de recomendación B)
TRASPLANTE CRUZADO
INTRODUCCIÓN
La donación cruzada nace de intercambiar los donantes de distintas parejas donante/receptor, que por incompatibilidad biológica u otro motivo (ganancia de edad, mejorar compatibilidad…) decide no realizarse directamente, para dar lugar a nuevas parejas entre las que se efectúa un trasplante indirecto. Se estima que alrededor de un 35% de los pacientes son incompatibles con su potencial donante vivo [40].
En el programa de cruzado más de la mitad de los receptores incluidos lo han hecho por incompatibilidad HLA y dentro de ellos, algunos con HLAi y ABOi.
El trasplante cruzado ofrece resultados similares en supervivencia del injerto y paciente con respecto a los trasplantes renales de donante vivo directo compatible y mejores respecto al trasplante de vivo directo HLAi y ABO incompatible [41].
TIPOS DE TRASPLANTE CRUZADO
Los tipos de intercambios que se han descrito y los que se han puesto en práctica desde que se realizó el primer trasplante cruzado en 1986 documentado por Rapaport son:
-. Ciclos de mínimo 2 trasplantes; ciclos de 3, 4, 5, “n” trasplantes
-. Cadena de trasplantes con donante altruista
-. Cadena de trasplante con donante puente
-. Trasplante cruzado con pareja compatible (mejorar compatibilidad, ganancia de edad, tamaño renal...)
-. Intercambio internacional
-. Trasplante cruzado de grupo sanguíneo A2 para grupo O
Actualmente muchos de los países occidentales tienen un programa consolidado de trasplante cruzado. Llegados los años 2000 se iniciaron programas en muchos países; en Europa el primero fue en Suiza en el 1999 y el que no tardó en consolidarse en el 2000 fue el programa en Estados Unidos [42]; de él depende la cifra de la cadena realizada más larga hasta la fecha consiguiendo 15 ciclos consecutivos.
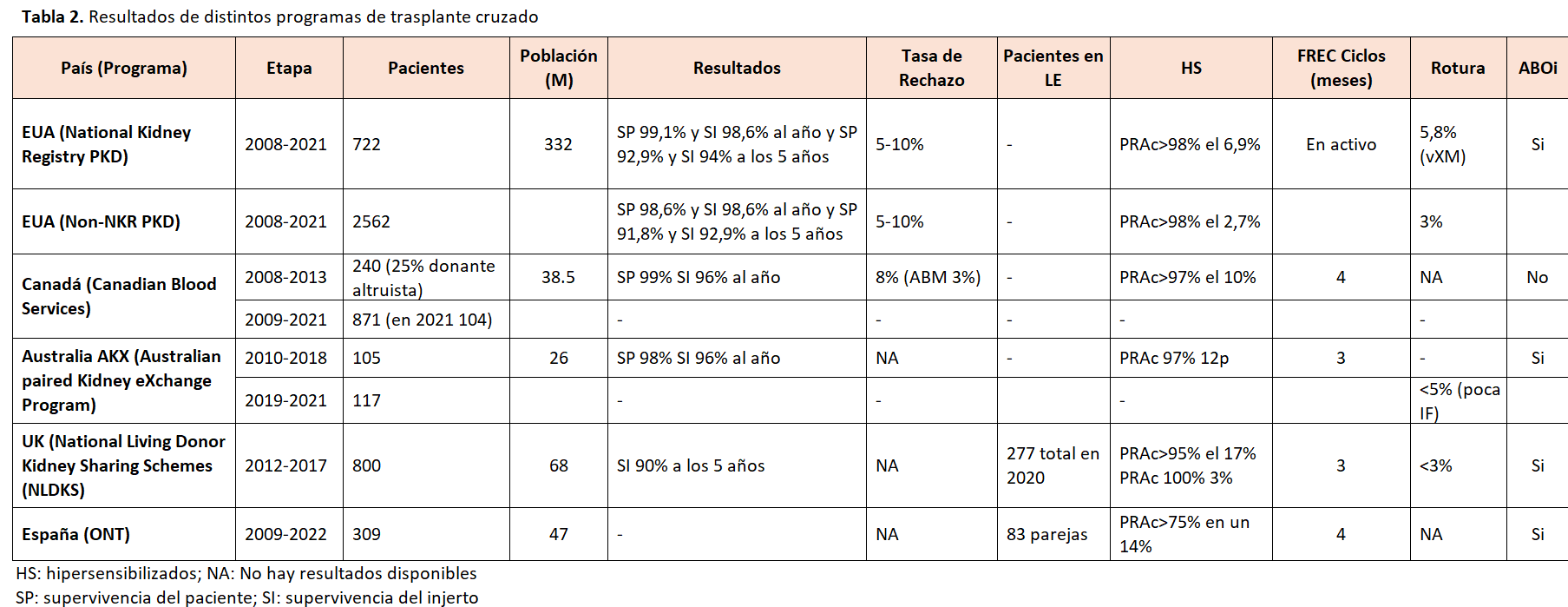
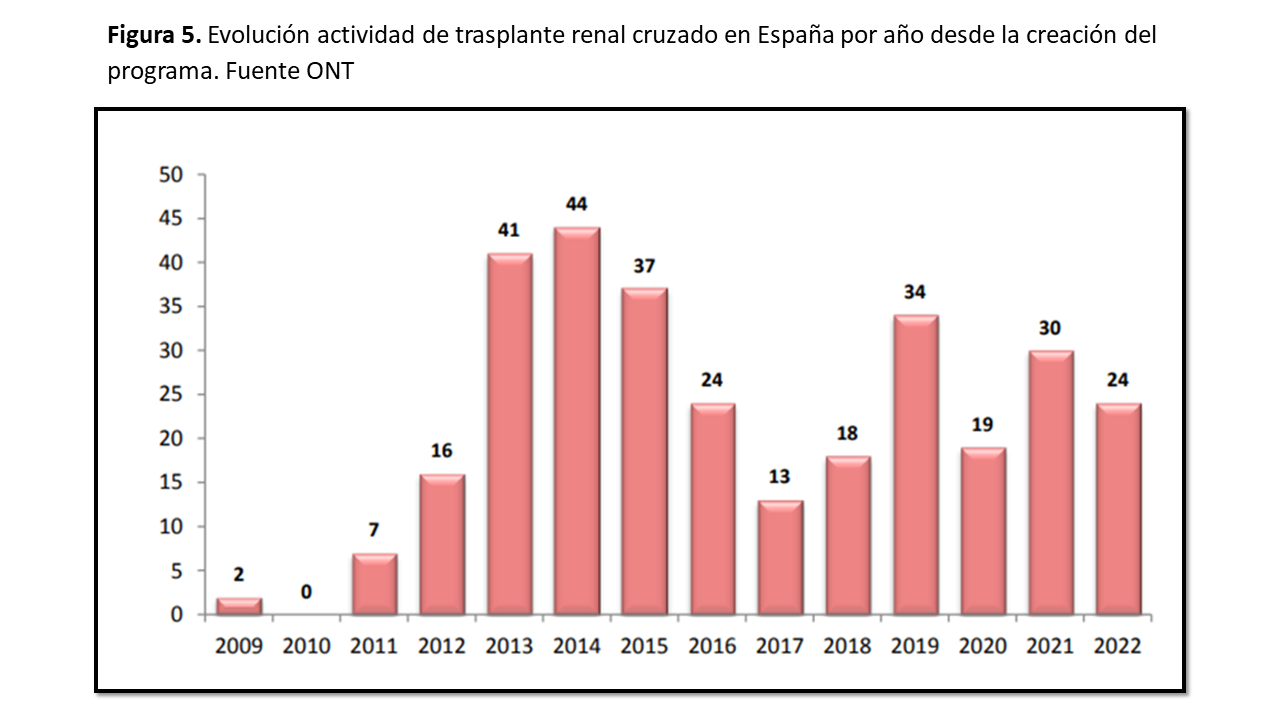
Entre el 2004 y el 2010 se iniciaron la mayoría de los programas europeos que a día de hoy tienen vigencia y con actividad creciente de trasplante consolidando intercambios entre países integrantes [43]. En España el programa se inició en 2009 con dos trasplantes realizados y se mantiene con los mismos 25 equipos integrantes de trasplante renal y 18 laboratorios de histocompatibilidad desde su creación. En los últimos años se concentra casi la totalidad de la actividad nacional en 7 centros. En estos últimos años nos mantenemos en una media de 25 trasplantes realizados (Figura 5) y nos consolidamos como el segundo país europeo en actividad de donación cruzada tras el Reino Unido. Los resultados publicados con el trasplante cruzado son excelentes y se muestra en la tabla 2, comparables con los buenos resultados de la donación de vivo directa [42].
Un punto importante para considerar es que la entrada a un programa de cruzado a veces no es la solución definitiva. Los resultados publicados por el Reino Unido (www.odt.nhs.uk) muestran que la probabilidad incremental de compatibilidad desde de 6 o 7 cruces es baja (<5%), y por lo tanto si llegamos a esta etapa sin conseguir un cruce debemos de considerar otras alternativas. Se entiende entonces que la donación cruzada y la desensibilización HLA o la realización del acomodamiento ABO no son iniciativas competitivas, sino complementarias [44].
TRASPLANTE CRUZADO VS TRASPLANTE ABOi
Ante la situación de pacientes que pueden tener un donante para un trasplante cruzado y/o para ABOi la propuesta sería clara en cuanto a intentar siempre la primera opción; realizar el trasplante ABO compatible por ser la modalidad más coste-efectiva y por haber demostrado mejores resultados en supervivencia del injerto que se mantiene hasta los 5 años [45].
Si no conseguimos trasplantarlo (sobre todo en grupo sanguíneo 0 o cuando tenemos un escaso número de parejas para generar cruce) según los estudios publicados, deberíamos de seguir el proceso inicial de incluir la pareja ABOi en programa de cruzado y mantenerla en lista de espera hasta 2 cruces. Si en este tiempo no se consigue un donante compatible iríamos al siguiente paso; realizar el trasplante ABO incompatible de su donante vivo (incluyendo al paciente en LE en situación anticipada para optimizar los resultados) [46].
Sabemos que el tiempo va en contra; si incluimos al paciente en lista de espera en situación pre-diálisis y tenemos margen ya que el deterioro de función renal es lento y continuo podemos aceptar la propuesta, pero si no disponemos de tiempo no deberíamos de iniciar terapia renal sustitutiva a la espera del cruce y en este caso realizar un trasplante ABOi.
Así, en base a la frecuencia y distribución de grupos sanguíneo en nuestro medio, si tenemos un donante A, B o O para un receptor B debemos de mantenernos en cruzado por la elevada probabilidad de encontrar donante compatible. Si el donante es A o B para receptor O inicialmente lo incluiríamos en el programa de trasplante cruzado para aumentar el pool de parejas, pero una vez realizados dos cruces sin posibilidad de llegar al trasplante pasaríamos al trasplante ABOi.
PROBLEMÁTICA DEL PACIENTE HIPERSENSIBILIZADO EN EL TRASPLANTE CRUZADO
esafortunadamente, los receptores de grupo sanguíneo O y elevado PRAc tienen un tiempo de espera y unas probabilidades de trasplantarse mucho menores que los de otros grupos sanguíneos y menor tasa de PRA [42]. Con PRAc>98% en programas de cruzado se consigue una tasa de trasplante de entre 4-10% y depende en gran medida del pool de parejas existente [45]. La opción de iniciar una cadena con un donante altruista puede dar salida a este subgrupo de pacientes [44] facilitando la realización de cadenas cruzadas no simultáneas, pero ni está aceptado en todos los países ni aporta una gran proporción de donantes.
El paciente HS debe tener priorización en los algoritmos de selección; dentro del programa español se realiza el algoritmo cada 4 meses (de forma automatizada) mediante prueba cruzada virtual. La selección se hace en base al grupo sanguíneo compatible y a la ausencia de anticuerpos frente a HLA del donante (no se tienen en consideración los DQA1, los DPA1 y el DRB3/4/5). Para esta selección no hay límite de edad del donante salvo en la edad pediátrica que se limita a los 55 años [22].
En cuanto a la priorización para la asignación se ajusta en función de:
-. Grupo sanguíneo (grupo O puntuación extra)
-. Nivel de sensibilización (PRAc)
-. Diferencia de edad
-. Permanencia en diálisis
-. Tiempo incluido en el programa
-. Criterios geográficos
En general no hay muchos datos publicados en términos de tasas de rechazo, supervivencia de paciente y de injerto en el subgrupo de HS en programas de trasplante cruzado, normalmente se publican con carácter global con resultados excelentes.
Datos de grandes registros como el británico [48], canadiense [49], americano [50] tienen algunas publicaciones que se recogen en la tabla 2 pero difieren en tiempo de seguimiento, en el dintel de PRAc para el análisis y faltan datos en cuanto a tasas de rechazo.
Los datos de la cohorte española en HS, hasta noviembre de 2022 se habían realizado 297 trasplantes y de ellos los que tenían un PRAc>75% correspondían al 14%. No queda bien registrado cuántos de ellos tienen un PRAc>98% pero restan actualmente en lista de espera unas 85 parejas.
El algoritmo que deberíamos seguir para abordar pacientes hipersensibilizados sería el descrito anteriormente; incluir en cruzado y esperar a que llegue el cruce un tiempo prudencial en función del grupo sanguíneo (esperar un máximo de tres cruces) o realizar el trasplante ABOi si es factible [51].
Sabemos que estas opciones no dan respuesta a muchos de los pacientes HS y que tras consensuar e individualizar cada caso podemos optar por añadir alguna de estas estrategias:
-. Desensibilización: realizar el procedimiento antes del trasplante con el fin de disminuir la tasa de anticuerpos circulantes para llegar al trasplante con una prueba cruzada negativa. Si no lo conseguimos con un primer cruce, esta terapia permite ampliar las opciones de llegar al trasplante con otro donante de un siguiente cruce.
-. Trasplantar con DSA: de la misma manera que haríamos en un paciente HS que se mantiene en lista de espera de cadáver y no recibe ningún cruce en programas de priorización. En el contexto del trasplante cruzado si sabemos que tenemos una posibilidad de cruce en la que tenemos un DSA, podemos intentar previamente desensibilizar frente su donante o si no lo conseguimos realizar el trasplante con un título bajos de DSA si la prueba cruzada por CDC resulta negativa. Será después criterio de cada centro definir en qué situaciones y con qué características y asumir el riesgo en base a su experiencia.
La entrada a un programa de intercambio renal debe ser la opción preferida frente a la desensibilización o trasplantar con DSA [32], dados los mejores resultados del trasplante y la rentabilidad, salvo necesidad expresa de realizar un tratamiento de desensibilización, exista urgencia clínica o una baja probabilidad de realizar un trasplante.
Con el fin de aumentar el número de parejas para aumentar las posibilidades de acceso al trasplante a todos los incluidos y en especial a los HS; se proponen ciertas ideas que deberíamos de analizar en profundidad
-. Iniciar la cadena con un donante cadáver [52]
En Estados Unidos, basados en modelos predictivos, se publicaron datos muy interesantes [53] en los que afirmaban que asignar un pequeño porcentage (<5%) de los donantes cadavéricos para iniciar cadenas de cruzado podría aumentar considerablemente la cantidad de trasplantes al año (casi 300 trasplantes/año) y así beneficiar a los pacientes altamente sensibilizados y a los candidatos de grupo sanguíneo O.
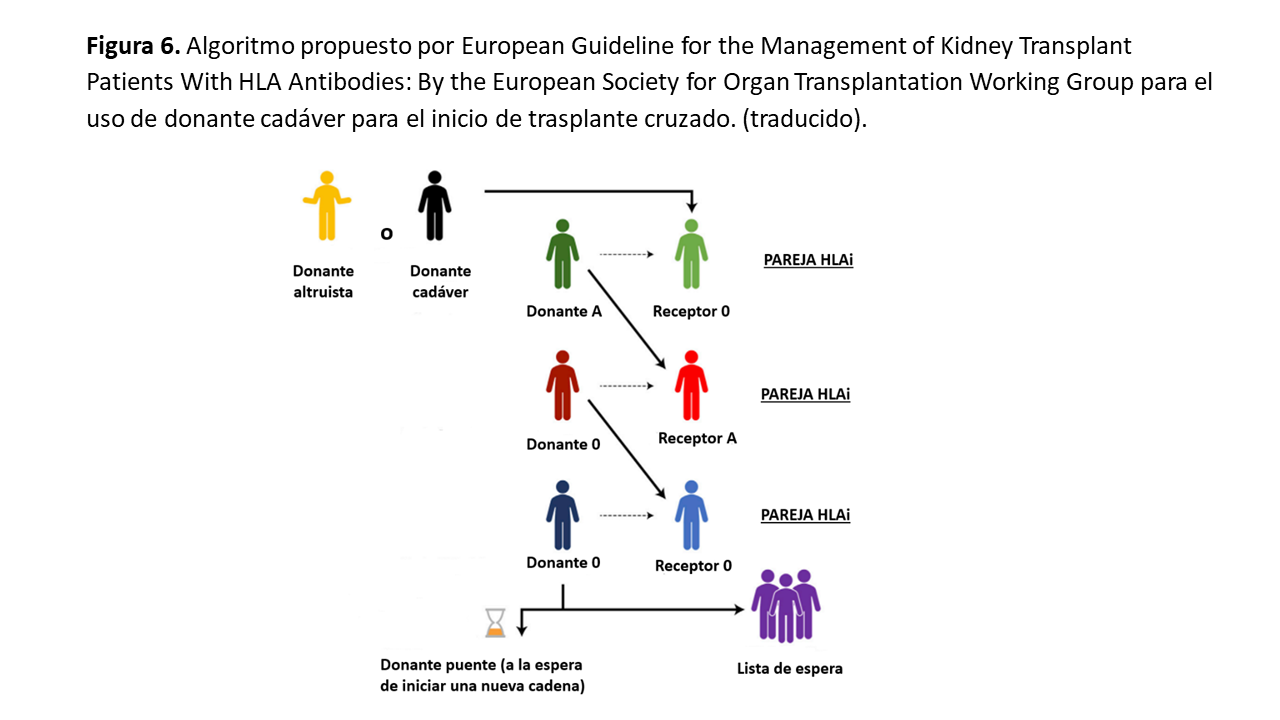
La metodología propuesta sería iniciar la cadena de cruzado con un donante de cadáver [54] y el donante de la pareja de cruzado fuera para la lista de espera de cadáver; se realizaría de la misma manera generando una o varias cadenas con el último donante generado que fuera para la lista de espera de cadáver (Figura 6).
Esta misma teoría podría generarse mediante una cadena puente en 30, 90 días o en la fecha que se asignara previamente. El grupo sanguíneo del donante de cadáver es importante para poder generar cadenas en cruzado por eso deberíamos de priorizar un donante cadáver de grupo 0 para iniciar la cadena.
La manera propuesta no discrimina ni penaliza a los pacientes en lista de espera de cadáver, pero sí que es verdad que debemos tener mucha confianza en el método y tener bien montada la estructura para que no se caigan donantes de la pareja de cruzado para la lista de espera de trasplante de cadáver. Desde el grupo europeo de la ESOT se está trabajando en esta idea para hacer una propuesta firme y ya se han publicado resultados de trasplantes realizados con esta modalidad en Italia [55].
-. Programas internacionales: Aumentar el número de parejas incluyéndonos en programas internacionales e incorporar nuevos países en el algoritmo, cuanto mayor sea el número de parejas para intercambiar más oportunidades tendrán los pacientes HS para recibir un cruce [56]. Aumentaremos la probabilidad, pero probablemente habrá un tamaño máximo más allá del cual no habrá ventaja incremental.
CONCLUSIONES Y RECOMENDACIONES
-. Los excelentes resultados con el trasplante cruzado justifican que deba ofrecerse a las parejas D/R en las que existe una incompatibilidad de grupo sanguíneo o una prueba cruzada positiva como primera opción (grado de recomendación A)
-. Cada centro trasplantador debe incluir más pacientes y así aumentar el pool de parejas donante/receptor (grado de recomendación A)
-. Considerar la utilización del programa cruzado con la idea de ganar edad (grado de recomendación A)
-. Incorporar con mayor proporción los programas de trasplante cruzado multicéntricos a nivel internacional (grado de recomendación B)
-. El trasplante cruzado ofrece mejores resultados que el trasplante HLAi y el ABOi y no precisa tratamientos agresivos adicionales (grado de recomendación A)
-. Si el paciente no está en terapia renal sustitutiva y no tiene anticuerpos (sin DSA frente a su donante)
• Incluir en programa de trasplante cruzado independientemente del grupo sanguíneo (grado de recomendación A)
-. Si el paciente está en terapia renal sustitutiva y no tiene anticuerpos (sin DSA frente a su donante) según su grupo sanguíneo deberíamos (grado de recomendación A):
• Mantener en programa cruzado (esperar dos cruces)
– A para B
– B para A
• Incluir en programa de ABOi si la terapia de desensibilización es factible
– A para O
– B para O
– AB para cualquier grupo
-. Considerar al paciente sensibilizado frente a su donante para un trasplante HLAc y ABOi (grado de recomendación A)
-. El paciente HS debemos mantenerle dentro de cruzado y si tras máximo de tres cruces podemos optar por
· Iniciar un tratamiento de desensibilización (grado de recomendación A)
· Asumir mayor riesgo inmunológicos, trasplantar con DSA (Si el Cross match por CDC es negativo y tenemos Ac que no fijan complemento) (grado de recomendación B)
-. Explorar nuevos abordajes en el trasplante cruzado como la incorporación del donante cadáver para iniciar una cadena (opinión de grupo).
-. Aumentar el número de parejas en los programas internacionales e incorporar nuevos países (grado de recomendación B)
PACIENTE HIPERSENSIBILIZADO EN POBLACIÓN PEDIÁTRICA
La sensibilización a HLA es un problema creciente en los niños que esperan un trasplante renal; nos encontramos en un escenario actual con una población pediátrica con tasas cada vez mayores de retrasplantes [57]. Debemos encontrar un donante inicialmente ABO compatible y con el que no tenga anticuerpos preformados para asegurar mejores resultados; en algunos casos, disponer de un donante inmunológicamente compatible implica contemplar la opción de un trasplante ABO incompatible o incluirlo en trasplante cruzado [58].
Los trasplantes de donante vivo son la mejor opción para este grupo de población, aunque los extremos de la edad pediátrica (lactantes y adolescentes) son los que presentan mayores dificultades y constituyen grupos de riesgo especial [59]. En España hay 7 centros que realizan trasplante renal pediátrico con una media de 73 trasplantes al año en las distintas modalidades.
Realizar el trasplante anticipado que permita evitar el paso transitorio por diálisis ofrece mejores resultados [60] y hoy en día, esta situación se consigue en el 35-40% del total de los trasplantes pediátricos realizados.
En este grupo de población es primordial encontrar buena compatibilidad HLA por ello el donante genéticamente emparentado y especialmente de padres a hijos, es una práctica habitual en los programas de trasplante en el mundo y casi exclusiva en algunos países frente a la de donante fallecido. Es importarte a su vez para minimizar la sensibilización a largo plazo que nos permitirá controlar la carga de inmunosupresión y mejorar las opciones para un retrasplante si fuera necesario.
Es mandatorio controlar diferencias de edad entre donante y receptor para garantizar mejores resultados [61]; así en el donante vivo no hay diferencias en resultados en cuanto a la diferencia de edad, pero en los donantes de cadáver la supervivencia a largo plazo del injerto es peor a medida que aumenta la edad del donante por encima de los 50 años, pero aun así ofrece buenos resultados. Con estos datos, aumentar la edad con la que aceptamos a un donante cadáver para la población pediátrica puede ser una estrategia para seguir con la idea de disminuir los tiempos de espera y conseguir realizar el trasplante.
En España se generan unos 40 donantes/año de donante cadáver de edad pediátrica que puede suplir en parte, la necesidad de trasplante en pacientes que precisan retrasplante y que uno de los progenitores ya ha sido donante, en los pacientes en los que haya una contraindicación para la donación de vivo (enfermedad genética, riesgo de recidiva de la enfermedad primaria), con la intención de ganar edad o en algunas ocasiones trasplantar sin DSA aun teniendo menor histocompatibilidad [22].
El paciente hipersensibilizado en edad pediátrica debe de entrar en prioridad nacional en todas las regiones y países e intentar realizar, como ya se ha comentado, un trasplante anticipado.
Con este imperativo de la prioridad hay un número bajo de pacientes hipersensibilizados en lista de espera; pero debemos de buscar en ellos un donante vivo compatible como primera opción. Si no lo hay debemos optar por otras estrategias en función de la situación para evitar prolongar el tiempo en lista de espera como serían:
-. Trasplante ABO incompatible [62] [63]
· Sigue siendo infrecuente en la edad pediátrica, la mayor serie de casos publicados es de 11 pacientes con resultados excelentes comparables con el ABOc
-. Realizar desensibilización [64] [65]
· En la literatura publicados únicamente series de casos con un máximo de 6 pacientes; consiguen buenos resultados en términos de supervivencia aplicando distintas pautas usadas en la población adulta.
-. Realizar desensibilización e incluir al paciente en un programa de trasplante cruzado [66]
· Si el paciente está incluido en programa cruzado, da margen para realizar tratamientos previos y asegurar mejores resultados.
-. Inclusión simultánea en programa de donante cadáver
· Para aumentar las posibilidades de acceder al trasplante y encontrar una alternativa cuando no se puede donar vivo. la donación de vivo
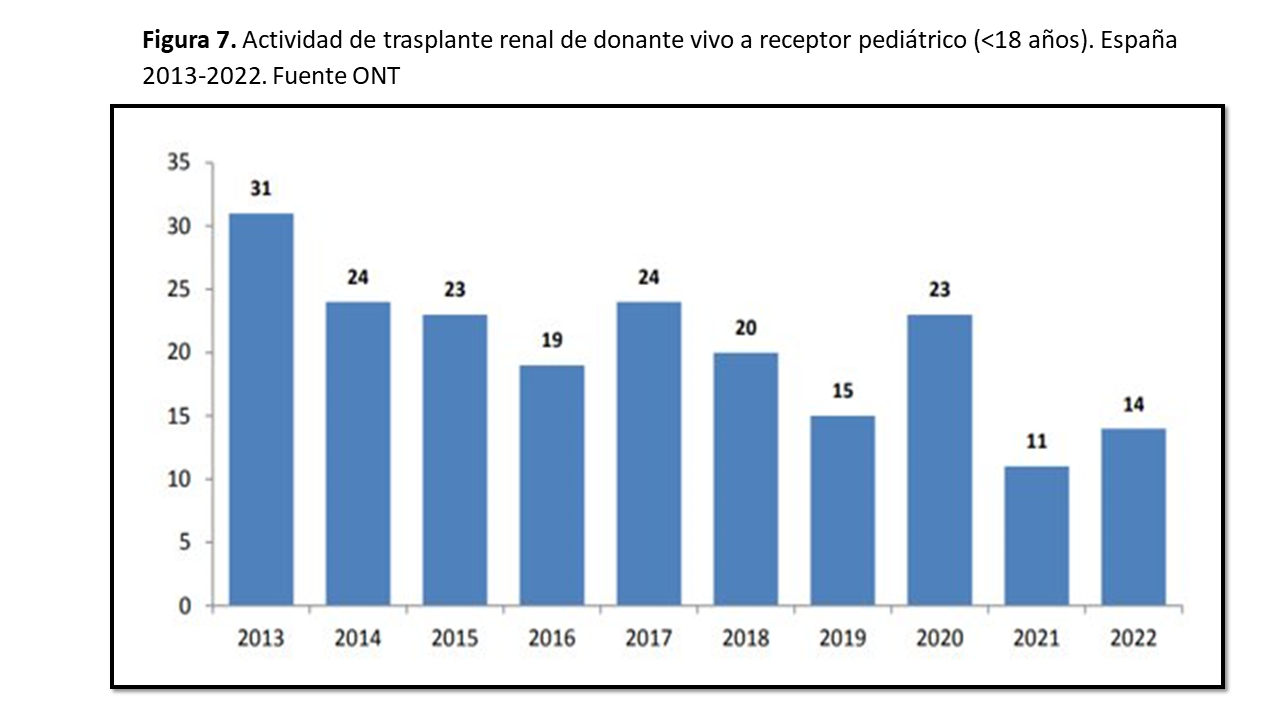
En España hemos vivido una caída progresiva de la actividad de donación en población pediátrica en estos últimos años situándose alrededor del 20% del total de trasplantes (Figura 7). En 2022 ha habido 81 trasplantes/año y 14 han sido donantes vivos. En este contexto el registro de trasplante pediátrico hipersensibilizado por modalidades es anecdótico realizándose un único trasplante en cruzado (que a su vez es el primero cruzado y ABOi) [67] y un total de 6 trasplantes realizados dentro del programa PATHI desde sus inicios.
Los resultados obtenidos en el paciente HS van en la línea de los de adultos con buenos resultados en supervivencia tanto de injerto como de paciente ya sea en trasplante dentro de programa PATHI, en trasplante cruzado, realizando desensibilización o en ABOi.