Insuficiencia Renal Aguda en la Infección por Coronavirus Sar-Cov2 (COVID-19)
Palabras clave
Sars-Cov2, Coronavirus, COVID 19, Covid-19, Pandemia, PCR, Test antígenos
VIDEO LOCUTADO 15 min (abrir enlace)
Insuficiencia renal aguda en la infección por Coronavirus Sars-Cov2 (COVID-19).
Prof Angel LM de Francisco
Prof Claudio Ronco
ANTECEDENTES
Desde el siglo XIX, los brotes de virus patógenos y sus complejas interacciones con humanos y animales (salto de especies) han provocado la transmisión entre especies, lo que representa una gran amenaza para la salud y la seguridad humanas. Con la rápida globalización, la transmisión de patógenos a través de los continentes se ha intensificado y ha dado lugar a varias pandemias, especialmente pandemias virales. Durante las últimas dos décadas, ha habido un aumento en los coronavirus como el coronavirus del síndrome respiratorio agudo severo coronavirus (SARS-CoV1)[1] y el síndrome respiratorio de Oriente Medio (MERS-CoV) en Arabia Saudita [2], los virus de la fiebre hemorrágica (Lassa, Ébola) en África Occidental y la gripe altamente patógena (influenza aviar A H7N9, pandemia H1N1) en China [3]. Estas pandemias virales han provocado un número considerable de muertes. Por ejemplo, el SARS-CoV1 se originó en los murciélagos y se traspasó a los humanos a través de civetas (huésped) en la provincia de Guangdong, China; se notificaron 8422 casos, incluidas 916 muertes (tasa de mortalidad del 11%) en 26 países [1]. MERS-CoV también se originó en murciélagos, con dromedarios como huésped intermedio; se notificaron 2494 casos, incluidas 858 muertes (tasa de mortalidad del 34%) en 27 países [2]. Del mismo modo, se notificaron 28.637 casos de infección por Ébola, incluidas 11.315 muertes (tasa de mortalidad 40%) [3]. Estas situaciones de pandemia han causado una mortalidad significativa y pérdidas económicas importantes.
COVID-19: INFECCION POR SARS-COV-2
En diciembre de 2019, en Wuhan, la capital de la provincia de Hubei en China, comenzaron a aparecer casos de pacientes con neumonía grave de causa desconocida [4]. Algunos de los casos iniciales tenían una exposición común al mercado mayorista de productos del mar de Huanan, que también comerciaba con animales vivos. El 31 de diciembre de 2019, China notificó el brote a la Organización Mundial de la Salud. El 7 de enero se identificó el virus como un coronavirus que tenía > 95% de homología con el coronavirus de murciélago y > 70% de similitud con el SARS-CoV1 [5]. El número de casos comenzó a aumentar exponencialmente, algunos de los cuales no tenían exposición al mercado de animales vivos, lo que sugiere el hecho de que se estaba produciendo una transmisión de persona a persona.
La enfermedad denominada COVID19 se extendió por el mundo siendo calificada de Pandemia por la OMS. Desde entonces, a finales de septiembre de 2020 se han reconocido 33 millones de casos en el mundo y un millón de muertos. La infección obligó a un confinamiento general, una crisis económica sin precedentes y una carrera acelerada en la búsqueda de vacunas y tratamientos [6].
COVID-19: aspectos clínicos generales
La enfermedad Covid-19 se expresa de formas muy variables, desde un estado asintomático hasta un síndrome de dificultad respiratoria aguda y disfunción multiorgánica. Las características clínicas comunes incluyen fiebre (no siempre), tos, dolor de garganta, dolor de cabeza, fatiga, mialgia conjuntivitis y dificultad para respirar. Por lo tanto, son indistinguibles de otras infecciones respiratorias. En algunos pacientes, al final de la primera semana, la enfermedad puede progresar a neumonía, insuficiencia respiratoria y muerte. Esta progresión se asocia con una tormenta de citoquinas inflamatorias. La mediana de tiempo desde el inicio de los síntomas hasta la disnea es de 5 días, la hospitalización de 7 días y el síndrome de dificultad respiratoria aguda (SDRA) de 8 días. La necesidad de ingreso en cuidados intensivos fue en el 5-30% de los pacientes afectados en las series publicadas. Las complicaciones observadas incluyeron lesión pulmonar aguda, SDRA, shock y lesión renal aguda. La recuperación comenzó en la segunda o tercera semana. La duración media de la estancia hospitalaria en los que se recuperaron fue de 10 días. Los resultados adversos y la muerte son más comunes en los ancianos y en aquellos con comorbilidades subyacentes (50 a 75% de los casos fatales). La tasa de mortalidad en pacientes adultos hospitalizados osciló entre el 4 y el 11%. Se estima que la tasa global de letalidad oscila entre el 2 y el 3% aunque ha descendido al 0.7% en la llamada segunda ola del finales de agosto al mejorar la detección de pacientes presintomáticos y asintomáticos
El SARS-CoV-2 es más conocido por causar enfermedades respiratorias agudas, con neumonía intersticial y alveolar, pero puede afectar a múltiples órganos y sistemas, incluido el sistema cardiovascular, tracto gastrointestinal, sangre, sistema nervioso y riñones [6].
EPIDEMIOLOGÍA DE LA INSUFICIENCIA RENAL AGUDA (IRA ó AKI) EN COVID-19
La incidencia de IRA en pacientes Covid-19 es muy variable dependiendo de la población estudiada. En las publicaciones iniciales con pocos pacientes, se reportó una incidencia de IRA en pacientes con infección por Covid-19 relativamente baja (3-9%) pero en series más avanzadas, es común entre los pacientes críticamente enfermos con COVID-19, afectando aproximadamente al 20-40% de los pacientes ingresados en cuidados intensivos y se considera un marcador de gravedad de la enfermedad y un factor pronóstico negativo para la supervivencia.
Cheng y col. [7] en un estudio retrospectivo de 1392 pacientes y utilizando definiciones basadas en creatinina, encontraron que aproximadamente el 7% de los pacientes desarrollaron IRA, con aproximadamente el 3%, 2% y 3% en etapas 1, 2 y 3 de IRA, respectivamente. La mayoría estaban gravemente enfermos y el 15% recibió diálisis.
En un estudio en la ciudad de Nueva York sobre 1150 adultos de mediana de edad 62 años, hospitalizados, con 257(22%) en estadio crítico, el 29% de estos (75/257) requirieron tratamiento sustitutivo de la función renal [8].
En otro estudio también en Nueva York, observacional y retrospectivo el 34% de los 815 pacientes que ingresaron en la unidad de cuidados intensivos (UCI) requirieron soporte renal extracorpóreo, generalmente tratamiento con técnicas continuas. En general, se estima que el 9% de 3235 pacientes ingresados con COVID-19 requirieron este tratamiento. La IRA se asoció con una mortalidad hospitalaria del 45% en comparación con una mortalidad del 7% entre los que no tenían IRA [9]. Por otra parte, en los 11 centros UCIs que aportaron datos, la incidencia de IRA grado 2-3 fue del 33% en Pittsburgh y del 35% en Londres, pero varió del 8% en Montreal al 72% en Gante. El uso de tratamiento renal sustitutivo varió del 0% al 37% y algunos centros, especialmente en el Reino Unido, tenían del 25% al 30% de pacientes con diálisis [10].
En el estudio de Hirsh et al, sobre 5.449 pacientes ingresados con COVID-19, se desarrolló IRA en 1.993 (36,6%). Los grados de IRA fueron grado 1 en 46,5%, grado 2 en 22,4% y grado 3 en 31,1%. De estos, el 14,3% requirió tratamiento de sustitución renal. La IRA se observó principalmente en pacientes con insuficiencia respiratoria Covid-19, de suerte que el 89,7% de los pacientes con respiración mecánica desarrollaron IRA en comparación con el 21,7% de los pacientes sin respirador. 276/285 (96.8%) de los pacientes que requirieron tratamiento sustitutivo renal estaban con respiradores. De los pacientes que requirieron ventilación y desarrollaron IRA, el 52,2% desarrolló la IRA dentro de las 24 horas posteriores a la intubación. Los factores de riesgo para IRA incluyeron edad avanzada, diabetes mellitus, enfermedad cardiovascular, raza negra, hipertensión y necesidad de ventilación y medicamentos vasopresores. Entre los pacientes con IRA, 694 fallecieron (35%), 519 (26%) fueron dados de alta y 780 (39%) aún estaban hospitalizados. Así pues, encuentran que la IRA está fuertemente asociada a la insuficiencia respiratoria y raramente es grave en aquellos que no precisan ventilación asistida. El desarrollo de Insuficiencia renal aguda en pacientes hospitalizado por COVID-19 confirió un mal pronóstico [11].
Kellum y cols [12] revisan las tasas de IRA en Covid-19 publicadas. En pacientes hospitalizados, en general, oscilan entre el 0,5% y el 27% en los estudios de China y entre el 28% y el 43% en los estudios fuera de China. Las tasas en la UCI son comprensiblemente más altas: 29% en pacientes chinos y 19-78% en pacientes estadounidenses. La mayoría de los casos de IRA son de leves a moderados con necesidad de diálisis en el 5-39% de los pacientes críticos.
DATOS DEL REGISTRO DE LA SOCIEDAD ESPAÑOLA DE NEFROLOGIA (SEN) SOBRE IRA en COVID-19 [13]
Un estudio evolutivo de la SEN continúa recogiendo datos desde el inicio de la pandemia y de momento, los datos encontrados son los siguientes en 300 pacientes
* La mayoría de los pacientes registrados con IRA eran varones (69,9%), con una edad media de 69 años. Requirieron ingreso en UCI 182 pacientes, frente a 118 que desarrollaron IRA en la planta de hospitalización. Tal y como se recoge en las series publicadas, Hipertensión Arterial (71%), Diabetes Mellitus (36%), Enfermedad Cardiovascular (31%) y Enfermedad Renal Crónica (31%) son circunstancias comórbidas que se encuentran presentes en estos pacientes que desarrollan IRA en el contexto de la infección.
* 56% de los casos requirió tratamiento renal sustitutivo (TRS).
* Los pacientes que desarrollaron IRA ingresados en UCI eran 15 años más jóvenes de media, y presentaban una menor carga de afectación del sistema cardiovascular, con una prevalencia significativamente menor de Hipertensión Arterial, Diabetes Mellitus, Enfermedad Cardiovascular o Enfermedad Renal Crónica. Es posible que estos datos en nuestra opinión tengan cierto sesgo de selección
* Más del 80% de los pacientes que desarrollaron IRA en UCI partían de función renal normal. Prácticamente la totalidad de estos pacientes había desarrollado neumonía, precisando soporte ventilatorio, y un 84,9% precisó TRS (vs el 12% en el grupo que permaneció hospitalizado en planta). Los parámetros inflamatorios estaban significativamente más elevados y la linfopenia era más marcada en los pacientes críticos, sugiriendo todo ello una mayor gravedad de la Covid-19.
* La mortalidad fue cercana al 50% en ambos grupos, discretamente superior en el grupo de pacientes ingresados en UCI, pero sin encontrar diferencias significativas.
* Lo verdaderamente llamativo es la evolución en el grupo de supervivientes: mientras en el grupo ingresado en planta, la práctica totalidad recupera función renal y tan solo un 3,5% permanece en TRS, en el grupo ingresado en UCI prácticamente la mitad de los supervivientes permanece en TRS.
Parece, por tanto, que existen dos patrones claramente diferenciados en la IRA asociada a la Covid-19:
- El primero acontece en pacientes más jóvenes y con menos comorbilidad, en el contexto de un cuadro clínico de Covid-19 más severo. Este paciente desarrolla un IRA de evolución más tórpida, que previsiblemente aparece en el tiempo relacionado con la necesidad de ingreso en UCI. El tiempo medio de recuperación de función renal es largo (tres semanas de media) y, a pesar de partir en más de un 80% de los casos de función renal normal al ingreso, tienen menor tasa de recuperación, permaneciendo en TRS un 22% del grupo.
- El otro patrón aparece en pacientes mayores, con 15 años de diferencia en edad media, con mayor carga de comorbilidad cardiovascular previa (Hipertensión Arterial, Diabetes Mellitus, Enfermedad cardiovascular y Enfermedad Renal Crónica). En este grupo, el cuadro clínico de Covid-19 es menos grave (menos necesidad de soporte ventilatorio, no ingresan en UCI, parámetros inflamatorios significativamente menos aumentados), y el cuadro de IRA aparece antes en el curso de la enfermedad (tiempo medio de aparición desde el inicio de los síntomas de 6 días). Estos pacientes precisan TRS en un pequeño porcentaje de casos (12,3 %), y el tiempo medio de recuperación de función renal es más corto (una semana). Prácticamente la totalidad de los supervivientes en este grupo recupera función renal, a pesar de partir en un 50% de una situación de Enfermedad Renal Crónica. Sugieren que este grupo de pacientes mayores y comórbidos, con enfermedad renal de base, son un grupo frágil y especialmente vulnerable a desarrollar IRA por hipoperfusión renal en el contexto de la fiebre, taquipnea, hipoxemia o cuadro digestivo, síntomas que acompañan a la Covid-19, y que predispondrían a una IRA más precoz en relación con el inicio de los síntomas.
La mortalidad es similar en ambos grupos y cercana al 50%, confirmando el hecho ya reportado de que la aparición de IRA es un factor de mal pronóstico vital en el curso de la Covid-19.
DATOS HISTOLOGICOS RENALES EN LAS AUTOPSIAS (Tabla 1)
Una de las primeras publicaciones [14] estudia los datos histológicos renales de 26 pacientes fallecidos por COVID-19, con una edad media de 69 años. Nueve de los 26 mostraron signos clínicos de lesión renal que incluyó un aumento de la creatinina sérica y/o proteinuria. Lo más destacado además de la necrosis tubular, es que no había evidencia de vasculitis, ni nefritis intersticial, ni hemorragia. Se vieron algunos agregados de eritrocitos que obstruyen la luz de los capilares, pero sin plaquetas o material fibrinoide. El examen por microscopía electrónica mostró partículas de coronavirus en el epitelio tubular y en los podocitos. Además se encontró aumento del receptor de COVID-19, el ACE2. La inmunotinción con el anticuerpo de nucleoproteína SARS fue positiva en túbulos, concluyendo que existe una invasión de COVID-19 en el tejido renal.
Después de esta publicación, han aparecido algunos más que son bastante coincidentes. En un estudio necrópsico de 12 pacientes fallecidos por COVID-19 con mediana de edad de 73 años (rango 52-87 años), la autopsia reveló que al igual que en los pacientes con SARS, se detectó ARN viral con títulos altos en otros órganos (hígado, riñón y corazón) en 5 pacientes. Estos datos sugieren que el COVID-19 puede propagarse a través del torrente sanguíneo e infectar otros órganos. No detallan datos histológicos renales salvo aquellos derivados de daño por mala perfusión [15].
Otra interesante publicación [16] de datos necrópsicos refiere como hallazgos renales en 18 pacientes de 76 años (rango 53-96), una lesión tubular aguda difusa con epitelio tubular aplanado y edema intersticial. Tres de estos 18 pacientes mostraron signos de coagulación intravascular diseminada con pequeños trombos de fibrina en capilares glomerulares. Uno de estos casos también se presentó con un infarto renal. No se observaron trombos en otros vasos o cambios vasculíticos. Un infiltrado inflamatorio crónico focal y escaso estuvo presente en algunos casos en áreas con fibrosis intersticial y atrofia tubular. Los cambios crónicos preexistentes, como la arteriolosclerosis, la fibrosis intimal de las arterias y la cicatrización vascular relacionada con la hipertensión y/o el envejecimiento estuvieron presentes en la mayoría de los casos. La microscopía electrónica se realizó en dos casos con un período posmortem corto (< 12 horas). En ambos casos, observaron una activación prominente de podocitos y células endoteliales. El citoplasma de los podocitos contenía múltiples vesículas, algunas con ribosomas unidos y membranas dobles. Ocasionalmente, se detectaron partículas similares a virus (70-110 nm) con gránulos densos en electrones dentro de estas vesículas. Esporádicamente, estas partículas estaban presentes en células endoteliales y células epiteliales tubulares proximales
Tres de los 18 casos investigados contenían microtrombos en capilares glomerulares, típicamente observados en el contexto de coagulación intravascular diseminada y generalmente atribuibles al shock generalizado. Sin embargo, la replicación renal de COVID-19 podría haber contribuido a la lesión renal aguda en esta cohorte, pues a juicio de los autores se detectaron grandes cantidades de ARN viral en muestras de riñón; también por la presencia de esas partículas similares a virus y porque los pacientes desarrollaron microtrombos a pesar de la anticoagulación oportuna. Detectaron partículas similares a virus dentro de las vesículas y no en el citoplasma, de acuerdo con el ciclo de replicación del coronavirus y los estudios ultraestructurales de cultivos celulares infectados.
Fisiopatología del daño renal en el COVID-19
En líneas generales la infección por COVID-19 tiene fundamentalmente cuatro aspectos que en su conjunto van a definir su fisiopatología [6]: infección pulmonar con alveolitis predominantemente, daño endotelial generalizado con presencia de microtrombos, hipercoagulabilidad con fenómenos tromboembólicos y respuesta hiperinflamatoria citocínica en algunos casos extremos.
Estos cuatro aspectos se sincronizan de la siguiente forma: el virus entra en el alveolo, infecta los macrófagos, los neumocitos tipo 2 y el endotelio y así, se genera un efecto llamada con liberación de citoquinas de las células inflamatorias que están en el torrente circulatorio. Llegan monocitos activados, neutrófilos, a defender contra el virus en el alveolo pulmonar y liberan en grandes cantidades de enzimas que dañan todavía mucho más las células del epitelio alveolar. El endotelio, al estar dañado, les permite más fácilmente el paso y el líquido intravascular pasa al alveolo y se produce un edema, que es el mecanismo del distress respiratorio. El alveolo está lleno de líquido y células inflamatorias que dañan el pulmón, necesitando asistencia respiratoria.
Además, con el daño endotelial, las plaquetas se activan y el sistema de la coagulación también, lo que da lugar a la producción microtrombos. Así pues como hemos comentado, hay cuatro componentes esenciales: la tormenta de citoquinas, el síndrome de distress respiratorio, la activación de la coagulación y la microtrombosis.
La lesión renal por Sars-Cov2 tiene múltiples causas y expresiones. Puede relacionarse con agresión directa del virus o por las consecuencias de la hiperinflamación y daño vascular
Daño renal asociado al virus
El ACE2 humano se expresa altamente en múltiples órganos, incluido el riñón, específicamente en túbulos en lugar de glomérulos, lo que sugiere una lesión tubular como la principal consecuencia de la infección por COVID-19 en el riñón, aunque como hemos visto, también se han visto partículas virales en los podocitos [17].
Esta presencia viral se ha relacionado con el frecuente hallazgo de proteinuria (30-60%) y hematuria (20-40%) en fases iniciales y también con dos patologías específicas [18].
- Daño tubular. Síndrome de Fanconi: Se han observado proteinuria no nefrótica en 88%, fosfaturia en 55%, hiperuricosuria en 55% y glucosuria normoglicémica en 30% y se ha relacionado con el eventual desarrollo posterior de IRA. Estos hallazgos desaparecen en la fase de recuperación [19].
- Lesión glomerular: Glomeruloesclerosis segmentaria y focal colapsante: Se trata de una lesión como la observada en pacientes HIV, que se ha observado en afroamericanos con infección COVID19 portadores de alelos de riesgo APOL1.
Parece más evidente el efecto del virus en el riñón en casos graves, pero no lo conocemos tanto en casos leves moderados o asintomáticos. Es importante realizar estudios sobre la presencia de virus en orina (donde hay resultados muy discordantes) no solo para conocer los efectos sobre el riñón sino asimismo por control epidemiológico de posibles contagios.
Daño renal asociado a la respuesta a la infección por Covid-19: Insuficiencia renal aguda
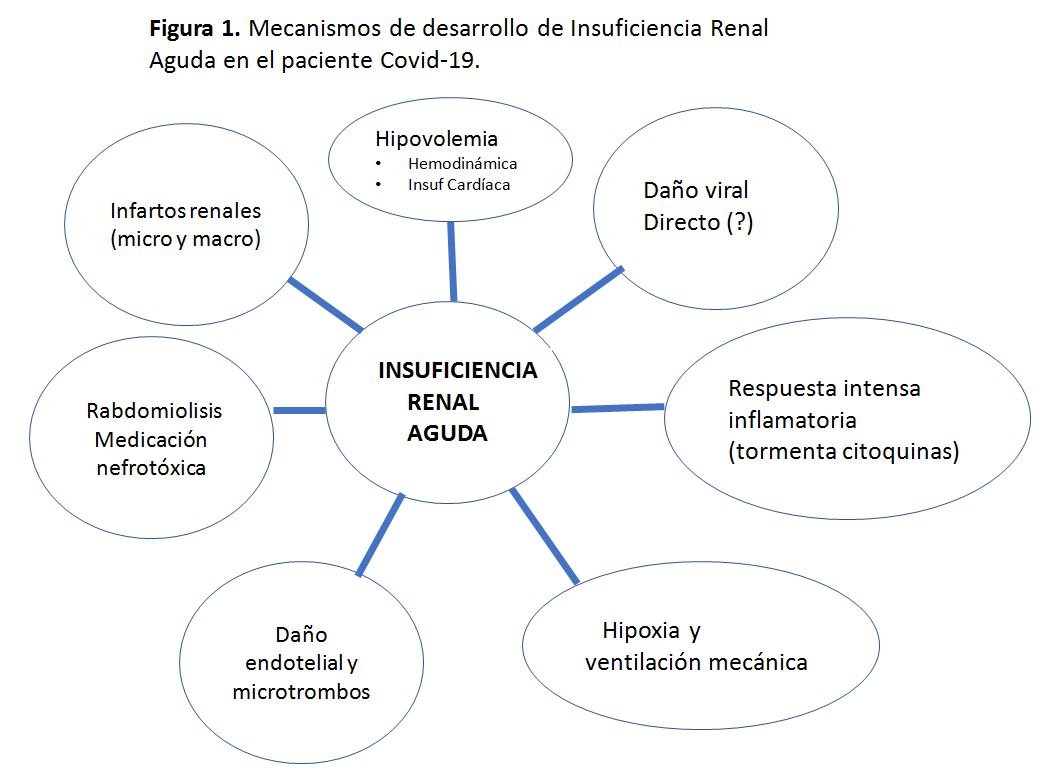
Además de esta lesión directa del virus, la lesión renal puede resultar de la respuesta a la infección o al daño multiorgánico, expresándose como IRA. Los mecanismos para el desarrollo de IRA en el paciente Covid-19 son muy complejos e interasociados (Figura 1).
1.- Hipovolemia: la reducción del volumen efectivo circulante se produce por múltiples causas posibles.
- Factores hemodinámicos que producen mala perfusión renal por reducción del volumen efectivo: fiebre, sepsis viral y vasoplejia.
- Insuficiencia cardiaca derecha por neumonía y microtrombos que producen cor pulmonale agudo con hiperpresión venosa renal y caída del filtrado glomerular
- Insuficiencia cardiaca izquierda por daño viral directo o tormenta citoquínica.
2.- Daño viral directo: La IRA podría ser causada por COVID-19, que ingresa en las células a través de ACE2 que se expresan altamente en el riñón produciendo una lesión tubular aguda por infección viral de las células del túbulo proximal con descamación del epitelio tubular y obstrucción tubular. Pero si la IRA del Covid-19 es causada por un efecto citopático inducido por coronavirus o por la respuesta inflamatoria sistémica inducida es algo aún por determinar. Da Xu y cols [20] encontraron que los podocitos y las células del túbulo proximal eran células huésped potenciales para el COVID-19, lo que apoya la IRA causada por efecto citopático inducido por virus, pero, aunque muy posible, se precisan más estudios
3.-Respuesta inflamatoria excesiva. Tormenta citoquínica: el síndrome de liberación de citoquinas [21] puede ocurrir en diversas circunstancias como sepsis, síndrome hemofagocítico o en el tratamiento con células T del receptor (CarT cells). La aparición de la tormenta de citoquinas se ha documentado desde el inicio del Covid19 y se produce al activarse los macrófagos por el virus con liberación de IL-6, IL-1, TNF-alfa, Interferon-gamma...etc. Ello conlleva a inflamación intrarrenal, aumento de la permeabilidad vascular, depleción de volumen, miocardiopatía y eventualmente a un sindrome cardiorrenal (SCR). El síndrome incluye lesión endotelial sistémica, que se manifiesta clínicamente como derrames pleurales, edema, hipertensión intraabdominal, pérdida de líquido en el tercer espacio, depleción de líquido intravascular e hipotensión.
La IL-6 proinflamatoria se considera la citoquina causante importante en el SCR. Entre pacientes con COVID-19, la concentración plasmática de IL-6 está elevada en pacientes con SDRA y desde el inicio se han empleado anticuerpos monoclonales anti IL-6 (Tocilizumab) en el tratamiento de la infección por Covid-19. Hay una interrelación pulmón-riñón relacionada con el exceso de citoquinas. El epitelio tubular renal lesionado promueve la regulación positiva de IL-6 y la IRA se ha asociado con mayor permeabilidad.
4.- Hipoxia y ventilación mecánica: El SDRA también puede causar hipoxia medular renal, que es un insulto a las células tubulares. Según los datos obtenidos en el área metropolitana de Nueva York, en la mayoría de los casos, la IRA ocurrió coincidiendo con insuficiencia respiratoria grave que requería ventilación mecánica, con el 89,7% de los pacientes en ventilación mecánica desarrollando IRA en comparación con el 21,7% de los pacientes no ventilados [11]. Casi todos los pacientes con IRA que requirieron tratamiento sustitutivo renal estaban en ventilación mecánica. Estos datos sugieren que la hipoxia severa, la tormenta de citoquinas o la combinación de ambas podrían dañar gravemente el riñón.
5.- Daño endotelial y microtrombos Como ya hemos comentado, en datos obtenidos de necropsias en pacientes fallecidos por COVID-19, se han encontrado lesiones de micoangiopatía trombótica (MAT), si bien es cierto que no se observan en general ni trombopenia (esto es variable) ni hemólisis. Una teoría podría ser que el SARS-Cov-2 entraría a la célula endotelial por el receptor ACE-2 y además de aumentar la replicación viral induciría un aumento de la expresión de citoquinas, factores de transmisión y moléculas de adhesión. Todo ello va a favorecer la quimiotaxis de células inflamatorias, que contribuirán a la lisis de la célula endotelial y a la activación plaquetaria y de la coagulación, con la consecuente formación de trombos en la microvasculatura [14] [15] [16].
6.- Otros En relación con lo anterior podemos encontrar rabdomiolisis, medicación nefrotóxica (antibióticos, contrastes...etc) y microembolismos e infartos renales.
CLINICA DE LA INSUFICIENCIA RENAL AGUDA ASOCIADA AL COVID-19
La clínica general del Covid-19 es muy variable, con un porcentaje importante de asintomáticos (30-60%) en la segunda ola del otoño de 2020. En España, los síntomas más frecuentes fueron: fiebre o reciente historia de fiebre (68,7%), tos (68,1%), dolor de garganta (24,1%), disnea (31%), escalofríos (27%), vómitos (6%), diarrea (14%) y otros síntomas respiratorios (4,5%). En pacientes hospitalizados los síntomas más frecuentes en el momento del ingreso en todas las series son la fiebre, la astenia y la tos. El patrón radiológico más frecuente en todas las series fue el infiltrado alveolar. Para el diagnóstico por imagen, el TAC es mucho más sensible (86%) que la placa de tórax (59%) para la detección de imágenes con patrón de vidrio deslustrado, a veces en parches, siendo infrecuente el patrón intersticial. En los hallazgos de laboratorio, el marcador de inflamación fue la proteína C reactiva. Las alteraciones en la coagulación, especialmente del dímero-D y del tiempo de protrombina fueron más frecuentes en pacientes con mayor gravedad. Alrededor de un tercio de los casos también tuvieron marcadores positivos de citolisis hepática. La linfopenia grave fue el hallazgo hematológico más frecuente en los pacientes críticos (mediana 630/mm3) [6].
Pero respecto a la lesión renal, no tenemos datos clínicos y de laboratorio que caractericen la IRA en pacientes con Covid-19. Ya hemos visto que se trata de un proceso complejo impulsado por lesión mediada por virus, tormenta citoquínica, activación vía angiotensina II, disregulación del complemento, microangiopatía con o sin disregulación del complemento, hipercoagulación, y todo ello asociado a factores conocidos de IRA.
Por eso es necesario avanzar en el conocimiento del curso clínico de la IRA COVID19 que incluyan índices apropiados de función renal y diagnóstico, incluyendo marcadores de lesión renal, microscopia urinaria, proteinuria cuantificada y electrolitos en orina. Asimismo, marcadores de activación de macrófagos, datos de coagulación y microangiopatía, activación del complemento, datos de imagen e información detallada de la necesidad de tratamiento dialítico, formas de reemplazo de la función renal. También es necesario mejorar nuestro conocimiento de los efectos a largo plazo de la IRA asociada al Covid-19, eventual desarrollo de enfermedad renal crónica, tasas de reversibilidad o mejora parcial y resultados de la biopsia renal (incluida la inmunofluorescencia y microscopía electrónica) [22].
PREVENCION DE LA LESION RENAL AGUDA ASOCIADA AL COVID-19
Ronco y cols [23] indican la importancia de las recomendaciones KDIGO, aún por validar, tales como evitar agentes nefrotóxicos, control regular de los niveles de creatinina y diuresis junto a considerar la monitorización hemodinámica. Asimismo, el control del volutrauma y barotrauma mediante ventilación con protección pulmonar que reduce el riesgo de empeoramiento de la IRA al limitar los efectos hemodinámicos inducidos por la ventilación y la carga de citoquinas en el riñón [24].
Es de gran trascendencia para la prevención del daño renal el correcto balance de líquidos según la capacidad de respuesta y la evaluación del volumen. Esta estrategia tiene como objetivo restaurar el volumen normal para evitar la sobrecarga de volumen y reducir el riesgo de edema pulmonar, sobrecarga ventricular derecha, congestión y posterior IRA. En sentido contrario, cuando los pacientes ingresan, la depleción de volumen puede ser común en pacientes Covid-19 ya que presentan fiebre y la reanimación con líquidos no se realiza habitualmente hasta que llegan al hospital. Y más aún si se utilizan estrategias de PEEP (presión positiva al final de la espiración) que pudieran comprometer el gasto cardiaco en presencia de hipovolemia. Ya hemos comentado la importancia de incorporar nuevos biomarcadores de daño tubular en futuros ensayos clínicos aleatorizados, para investigar su valor en la predicción y el manejo de la IRA.
SUSTITUCION DE LA FUNCIÓN RENAL: TECNICAS EXTRACORPOREAS
Cuando fracasa el tratamiento conservador, hay que considerar las técnicas de reemplazamiento de la función renal en pacientes con sobrecarga de volumen y especialmente en aquellos con hipoxemia refractaria. En pacientes con IRA y Covid-19 es preciso un inicio temprano del soporte extracorpóreo para prevenir la progresión de la enfermedad a etapas más severas, aunque es necesario demostrar que este inicio temprano es una clara indicación. En pacientes con Covid-19 termodinámicamente inestables, las técnicas continuas de sustitución de la función renal son las de mayor indicación y preferencia.
Ronco y cols recomiendan algunos aspectos relacionados con las técnicas continuas en el tratamiento de la IRA asociada a Covid-19 [23]:
- Colocar el catéter en vena yugular derecha de manera que no se doble en la posición prono.
- Cuando coincidan diálisis con oxigenación de membrana (ECMO), el acceso vascular de la técnica dialítica debe ser independiente del circuito de ECMO para evitar la formación de coágulos. Si no fuera posible por imposibilidad de acceso vascular, entonces el flujo de salida del sistema de diálisis debe ser conectado a la rama preoxigenador del circuito ECMO, ya que el oxigenador puede servir como barrera protectora y minimizar el riesgo de embolia gaseosa sistémica en los pulmones.
- La anticoagulación que es necesaria también puede ser un problema por sangrado. En las terapias continuas, la anticoagulación regional con citrato es más recomendable para mantener la duración del circuito extracorpóreo y reducir el riesgo de sangrado. En la experiencia de Ronco y cols, la reducción de la concentración postfiltro de calcio ionizado a 0·25-0·35 mmol/L (concentración habitual 0·30-0·45 mmol/L) es una viable opción para prolongar la funcionalidad del filtro.
Reducción de Citoquinas
También se han propuesto terapias extracorpóreas como enfoques para eliminar las citoquinas en pacientes con sepsis y podría ser potencialmente beneficioso en pacientes con COVID-19 críticamente enfermos [26]. La justificación del uso de estas terapias es que la eliminación podría prevenir el daño orgánico inducido por citoquinas.
Existen cuatro técnicas diferentes para disminuir la carga de citoquinas:
- Hemoperfusión directa usando un sorbente neutro-macroporoso
- Adsorción de plasma en una resina después de la separación del plasma
- Técnica continua con filtros de fibra hueca con propiedades adsorbentes
- Técnica continua de dosis alta con membrana de cut-off medio (MCO) o membranas de cut-off alto (HCO)
La eliminación de citoquinas se realiza principalmente mediante un sorbente neutro-macroporoso. La hemoperfusión debe utilizarse durante 2 horas en 3 días consecutivos. Anticoagulación con heparina o citrato durante el procedimiento junto con un flujo sanguíneo > 120 ml / min para prevenir coagulación prematura del circuito. La capacidad de adsorción del cartucho generalmente se agota después de 4 horas y se termina el tratamiento. Los filtros de terapia continua con membranas especiales (acrilonitrilo y sulfonato de metalil sodio más polietilenimina o polimetilmetacrilato) también adsorben citoquinas. Estos filtros deben cambiarse cada 24 horas debido a la saturación de sus propiedades adsorptivas [25].
En caso de infecciones superimpuestas con sepsis y entotoxemia, de nuevo el uso de hemoperfusión con filtros de fibras de poliestireno con Polimixina B puede ser eficaz como terapia adsorptiva, de forma similar a lo comentado en la adsorción de citoquinas.
Otras técnicas extracorpóreas [26]
Las terapias extracorpóreas pueden resultar útiles en pacientes con Covid-19 graves para ayudar a diferentes órganos, además de los riñones, como los pulmones, el corazón, y el hígado, mediante la aplicación de dispositivos específicos. La ECMO venosa es un soporte complejo y sofisticado para el tratamiento de las formas más graves de insuficiencia respiratoria hipoxémica aguda; se realiza en centros de referencia especializados y con experiencia que se organizan comúnmente en redes, sirviendo a grandes regiones o países enteros.
La eliminación extracorpórea de CO2 ( ECCO2R ) es una técnica que se puede realizar en más UCIs debido a que el nivel de complejidad mucho menor que el requerido para la ECMO, pero la ECCO2R no es realmente útil para los pacientes con hipoxemia grave que realmente necesitan un tratamiento con ECMO completo.
La disfunción hepática también puede ocurrir raramente en pacientes con infección viral grave y puede requerir técnicas de purificación de sangre extracorpórea para apoyar al paciente hasta que se produzca la recuperación de los hepatocitos.
RESUMEN
* La mayoría de los casos de IRA en pacientes Covid19 son de leves a moderados con necesidad de diálisis en el 5-39% de los pacientes críticos.
* La IRA en el paciente con Covid19 está fuertemente asociada a la insuficiencia respiratoria. Casi todos los pacientes con IRA que requirieron tratamiento sustitutivo renal estaban en ventilación mecánica.
* El desarrollo de IRA en pacientes hospitalizados por COVID-19 confiere un mal pronóstico.
* En el grupo ingresado en UCI, prácticamente la mitad de los supervivientes permanece en diálisis.
* Los hallazgos histológicos más frecuentemente observados en el paciente Covid-19 con IRA son: necrosis tubular, daño endotelial, agregados eritroides capilares, trombos de fibrina intracapilares glomerulares y signos inflamatorios.
* En casos graves, se han visto partículas virales en los túbulos pero también se han visto en los podocitos. Junto a la necrosis tubular aguda se han detectado sindrome de Fanconi y glomeruloesclerosis segmentaria y focal colapsante.
* Es importante realizar estudios sobre la presencia de virus en orina no solo para conocer los efectos sobre el riñón sino asimismo por control epidemiológico de posibles contagios.
* Además de una lesión directa del virus, la lesión renal puede resultar de la respuesta a la infección o al daño multiorgánico expresándose como IRA. La hipoxia severa, la tormenta de citoquinas o la combinación de ambas podrían dañar gravemente el riñón.
* Es necesario avanzar en el conocimiento del curso clínico de la IRA-COVID19 que incluyan índices apropiados de función renal y diagnóstico, incluyendo marcadores de lesión renal, microscopia urinaria, proteinuria cuantificada y electrolitos en orina. Asimismo, marcadores de activación de macrófagos, datos de coagulación y microangoiopatía, activación del complemento, datos de imagen e información detallada de la necesidad de tratamiento dialítico, y formas de reemplazo de la función renal.
* También es necesario mejorar nuestro conocimiento de los efectos a largo plazo de la lesión renal aguda asociada al Covid-19, eventual desarrollo de enfermedad renal crónica, tasas de reversibilidad o mejora parcial y resultados de la biopsia renal (incluida la inmunofluorescencia y microscopía electrónica).
* La prevención de la lesión renal en el Covid-19 incluye medidas generales como evitar agentes nefrotóxicos, control regular de los niveles de creatinina y diuresis junto a considerar la monitorización hemodinámica y control adecuado de volumen. Asimismo, el control del volutrauma y barotrauma mediante ventilación con protección pulmonar.
* En pacientes con Covid-19 termodinámicamente inestables, las técnicas continuas de sustitución de la función renal son las de mayor indicación y preferencia.
* Las terapias extracorpóreas para eliminar las citoquinas en pacientes con sepsis podrían asimismo ser potencialmente beneficiosas en pacientes con COVID-19 críticamente enfermos.