SARS-CoV-2 (Covid-19) en el trasplante renal. Tratamiento
Introducción
La enfermedad por coronavirus 2019 (COVID-19) causada por el virus SARS-CoV-2 ha originado una pandemia con más de 80 millones de casos en el mundo y con una expansión logarítmica que se ha traducido en cerca de 2.5 millones de muertes [1]. Según un reciente estudio, se estima que globalmente los individuos con riesgo aumentado de COVID-19 grave son 1.7 billones, de los cuales 349 millones requerirían ingreso hospitalario, emergiendo como el factor de riesgo más prevalente la enfermedad renal crónica [2]. Por otro lado, es bien conocido que los receptores de trasplantes de órgano sólido tienen intrínsecamente un riesgo mayor de infecciones virales y bacterianas como consecuencia de una disminución de la inmunidad celular dependiente de linfocitos T (LT), incluyendo menores niveles de CD3+, CD4+ y CD8+ [3]. Se entiende por tanto, que la población trasplantada renal haya sufrido sensiblemente los efectos de la pandemia, evidenciándose un riesgo de morir 92 veces superior en aquellos pacientes que sufrieron la COVID-19 respecto a aquellos trasplantados que no se infectaron, de acuerdo a los datos del registro europeo [4]. El riesgo de mortalidad fue un 28% más alto en los pacientes portadores de un trasplante renal que en los enfermos en diálisis y el 44% de los trasplantados renales mayores de 75 años no sobrevivió a la infección. Por otro lado, diversas series han reflejado que la mortalidad de los pacientes trasplantados renales hospitalizados por neumonía secundaria a SARS-CoV-2 es de aproximadamente el 20-30% [3] [5] [6] [7] [8] [9], aunque en algunas descripciones la tasa ha sido aún mayor [10].
A pesar del importante avance en el conocimiento genético, epidemiológico, fisiopatológico y terapéutico de la infección por SARS-CoV-2, quedan aún múltiples interrogantes por dilucidar. Dentro del ámbito del trasplante renal, a día de hoy, no se conoce cuál es el manejo óptimo de la inmunosupresión durante la infección, si las respuestas humorales y celulares tras haber pasado la COVID-19 se comportan igual que en la población general, ni si la vacunación tendrá el mismo impacto que en los pacientes inmunocompetentes. El objetivo de la presente revisión es actualizar la evidencia más reciente sobre la infección por SARS-CoV-2 en los pacientes portadores de un trasplante renal.
Respuesta humoral y celular
Pocos estudios han analizado la prevalencia de la COVID-19 en los trasplantados renales. En un trabajo americano que incluyó 912 trasplantados renales, se examinó la presencia de anticuerpos IgG frente al SARS-CoV-2 en consultas de seguimiento, siendo positivo en el 16.6% de los casos. De éstos, 36% habían tenido previamente un exudado nasofaríngeo positivo por reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR), mientras que el 63% no presentó síntomas significativos y no habían sido analizados anteriormente por RT-PCR. La prevalencia global de infección por SARS-CoV-2 en 975 pacientes evaluados por RT-PCR o prueba serológica (IgG) fue del 23.4%. En el seguimiento posterior, se realizaron pruebas serológicas a 69 casos diagnosticados previamente mediante RT-PCR y el 80% presentaban IgG positiva tras una mediana de 44 días tras el diagnóstico de COVID-19 [10]. En otro estudio con 21 receptores de trasplante renal, se contabilizaron los LT CD4+ y CD8+ productores de interferón-γ específico del SARS-CoV-2 a los 4 y 6 meses del diagnóstico de COVID-19; encontrando una respuesta detectable de LT CD4+ específicos en el 57% y el 47% de los pacientes respectivamente. Las tasas correspondientes de LT CD8+ fueron del 19% y 42% a los mismos tiempos. Es de destacar que 4 de cada 10 pacientes con alguna respuesta detectable en el mes 4 habían perdido la inmunidad celular específica en el mes 6, mientras que 5 de cada 9 desarrollaron dicha respuesta en el mismo período. Como dato de interés, en aquellos casos que carecieron de una respuesta CD4+ específica al sexto mes, se objetivó que un porcentaje elevado habían recibido tratamiento con tocilizumab durante el episodio de COVID-19 [11].
Inmunouspresión y Covid-19
En general, la mayoría de los pacientes con COVID-19 cursa con un cuadro clínico leve-moderado, sin embargo, hasta un 20% aproximadamente presenta una enfermedad grave con elevada mortalidad [12]. A pesar de que algunos estudios han rechazado la hipótesis de una respuesta citoquínica desproporcionada [13], la evidencia acumulada sugiere que los casos más graves son secundarios a un desequilibrio de la respuesta inmune innata a expensas de la inmunidad adaptativa efectiva, que apuntala la progresión de la enfermedad [12]. Dentro de los mecanismos propuestos destacan un estado de hiperactivación de los LT CD4+ y CD8+ así como una concentración aumentada del CCR6+ Th17 en LT CD4+ con alto poder pro-inflamatorio [14]. Por tanto, la sobreactuación del LT puede ser, en parte, culpable de la severidad de la lesión inmune. Incluso, al inicio de la pandemia, algunos autores propusieron que el uso de inmunosupresores en la población trasplantada podría disminuir la expresión clínica de la enfermedad [15].
Manejo de la inmunosupresión
Los inhibidores de calcineurina (tacrolimus [TAC] y ciclosporina A [CsA]) reducen la expresión de la interleucina-2, cuyo papel es regular la proliferación, supervivencia y maduración del LT [14]. Asimismo, el TAC y el micofenolato mofetil (MMF) inhiben la producción de interleucina-17 que se traduce en un efecto inhibitorio sobre las células Th17 [16]. Por otra parte, se ha observado en estudios preclínicos que el tratamiento con CsA y TAC inhibe la replicación in vitro de otros coronavirus como el SARS-CoV [17] [18]. Sin embargo, también hay que considerar que los inhibidores de calcineurina comprometen la respuesta adaptativa del LT en mucho mayor medida que la inmunidad innata. Por ende, existe mayor riesgo de propagación e invasión viral descontrolada [19].
En realidad, la evidencia respecto al manejo óptimo de la inmunosupresión en los pacientes trasplantados renales durante la presente pandemia sigue siendo limitada. Prácticamente en todas las series que se han publicado hasta la fecha se ha realizado alguna estrategia de reducción de los fármacos inmunosupresores, siendo la más frecuente la retirada de los antimetabolitos (p. ej. MMF) o los inhibidores de mTOR (mammalian target of rapamycin del inglés), manteniendo la dosis basal de prednisona y niveles reducidos o habituales de TAC [20] [9]. Considerando el probable beneficio previamente comentado de la CsA (efecto antiviral e inmunomodulador), un pequeño estudio retrospectivo español comparó dos estrategias terapéuticas: minimización de los inhibidores de calcineurina (n = 6) vs. terapia basada en CsA (n = 23; 65% de los casos previamente con TAC). Los autores encontraron que la mortalidad en el grupo de minimización fue del 50% mientras que en el grupo de CsA fue del 12.5%, sugiriendo que el tratamiento inmunosupresor a base de CsA podría ser seguro y eficaz en pacientes trasplantados renales ingresados por COVID-19 [21]. Estos resultados se basan en estudios experimentales que demuestran que los metabolitos de la CsA disminuyen la expresión de la proteína N del coronavirus humano 229E, proteína necesaria para la replicación viral [22]. Datos similares en otros modelos experimentales han demostrado también que los derivados o metabolitos del TAC podrían exhibir una actividad in vitro parecida [23] [24].
Si bien es razonable asumir que la disminución de la inmunosupresión podría ser clave para el manejo de la enfermedad, al igual que en otras infecciones en esta población, no está claro el momento óptimo ni el grado de reducción que se requiere para permitir la contención del SARS-CoV-2. De hecho, en un estudio retrospectivo multicéntrico del Consorcio Internacional de Trasplantes (TANGO) donde se incluyeron 144 receptores de trasplante renal hospitalizados por COVID-19, no se identificó una asociación significativa entre la retirada de la inmunosupresión y la mortalidad [25], mientras que en otro estudio similar, sí se observó menor mortalidad en aquellos sujetos a los que se les suspendió el antimetabolito [26]. Finalmente, al enfrentarnos a la disyuntiva de minimizar la inmunosupresión en un paciente trasplantado renal con infección por SARS-CoV-2, es importante considerar que actualmente el uso de dexametasona a dosis moderadas representa la única alternativa que ha demostrado disminuir la mortalidad en población general con COVID-19 [27].
Consecuencias de minimizar la inmunosupresión
Hasta donde sabemos, únicamente un estudio ha valorado las consecuencias a mediano plazo de disminuir los fármacos inmunosupresores en los sujetos trasplantados renales que han cursado un ingreso hospitalario en contexto de infección por SARS-CoV-2. Dicho estudio, que incluyó 47 pacientes, encontró que a pesar de disminuir el numero de agentes inmunosupresores (en 17% de los casos incluso retirada total) durante una mediana de 17 días, no se observaron episodios de rechazo agudo ni aparición de anticuerpos (de novo) donante específico hasta 3 meses después del alta, y tampoco se produjeron cambios significativos en el porcentaje calculado de reactividad contra panel (calculated Panel Reactive Activity [cPRA]) [28]. Pese a que un 55% de los pacientes presentaron fracaso renal agudo (FRA) durante el ingreso, todos los pacientes recuperaron la función basal del injerto a los 3 meses del evento infeccioso. Alternativamente, se han publicado algunos casos aislados de rechazo humoral en el contexto de COVID-19. Sin embargo, uno de los pacientes tenía una biopsia renal con signos histológicos de rechazo humoral crónico, mientras que el otro presentaba lesiones de microangiopatía. En ambos casos, la biopsia se realizó a posteriori y los pacientes tenían antecedentes de daño aloinmune con anticuerpos donante específico. Considerando esto, en nuestra opinión, la posibilidad de que la infección por SARS-CoV-2 sea un factor desencadenante para el desarrollo de rechazo continúa siendo especulativa [28] [29].
Tratamiento específico frente a SARS-CoV-2 en el trasplante renal
Generalidades
Los datos disponibles sobre el empleo de tratamiento específico frente al SARS-CoV-2 en los pacientes portadores de un trasplante renal continúan siendo escasos y en ocasiones inconsistentes. La mayoría de los ensayos clínicos con los diferentes tratamientos utilizados no han incluido a este grupo poblacional. La información existente, hasta el momento, se basa en series de casos y estudios retrospectivos. El tratamiento de la enfermedad por Covid-19 en los pacientes portadores de un trasplante renal no difiere, por tanto, del utilizado en población general.
El empleo de hidroxicloroquina, lopinavir/ritonavir, interferón y azitromicina no aporta ningún beneficio en el tratamiento de la enfermedad pudiendo ejercer aún más efectos deletéreos en estos pacientes por sus potenciales interacciones con los fármacos inmunosupresores.
El abordaje terapéutico debe tener muy en cuenta la fisipatogenia de la enfermedad considerando los diferentes mecanismos implicados: alteración inmunológica, daño endotelial generalizado, coagulopatía asociada a complemento con fenómenos de microangiopatía sistémica, predisposición genética y factores biológicos individuales. De esta manera, el tratamiento debe basarse en los múltiples pilares reflejados en lo que se ha venido a denominar terapia “multitarget”. Los principales tratamientos se han focalizado en neutralizar la respuesta viral a través de inmunidad pasiva (plasma convalescente, anticuerpos monoclonales…), inhibir la replicación viral (remdesivir) o silenciar la respuesta inmunitaria para prevenir manifestaciones como la “tormenta” de citoquinas, el síndrome de distrés respiratorio agudo y el fallo multiorgánico (glucocorticoides, inhibidores de interleuquina-6 (IL-6)…). No obstante, el uso óptimo de estos agentes puede depender del momento correcto de administración (“timing”) en el curso evolutivo de la enfermedad y en especial de la cascada inflamatoria.
Actualmente se desconoce si la suspensión de la inmunosupresión puede exacerbar la respuesta inflamatoria al SARS-CoV-2 y, por lo tanto, ejercer un efecto perjudicial. Sí parece exisitir un acuerdo general sobre la esterilidad de una profilaxis antibiótica universal así como en no modificar o suspender la inmunosupresión en pacientes con formas leves o asintomáticas de la enfermedad. Como ha quedado expuesto en la primera parte del texto, se ha convertido en práctica clínica habitual – en ausencia de datos consistentes – que la inmunosupresión pueda ser reducida o modificada de acuerdo a la gravedad de la enfermedad sin recomendarse de forma general su suspensión completa. Por consiguiente, en la actualidad no hay una evidencia firme sobre cuál es el manejo más adecuado de la inmunosupresión asumiéndose un abordaje similar al empleado en otras infecciones virales severas en pacientes trasplantados (retirada del antimetabolito y reducción de la dosis de calcineurínico). Esta aproximación terapéutica podría ser una opción segura, más si tenemos en cuenta que esta opción no se ha asociado con un incremento en la tasa de rechazo agudo ni con el desarrollo de anticuerpos donante específico [28]. Aún así, no se debe olvidar que en los estudios publicados hasta el momento, la reducción de la inmunosupresión no se ha asociado con una disminución de la mortalidad [25].
La inmunidad celular es un punto clave para determinar el curso y evolución de la infección por SARS-CoV-2. Esta inmunidad puede encontrarse comprometida en pacientes inmunosuprimidos. Un elevado porcentaje de pacientes, sobre todo si hay afección respiratoria, se presentan con linfopenia; circunstancia que se ha correlacionado negativamente con la evolución [30]. Esta linfopenia es aún más profunda en los pacientes portadores de un trasplante renal, situación que podría estar favorecida por la inmunosupresión crónica [31]. Se ha descrito una respuesta protectora humoral y celular (LT) específica frente a SARS-CoV-2 en pacientes inmunocompetentes que han desarrollado infección por Covid-19. En un elegante y necesario trabajo de Bestard et al. se ha estudiado la respuesta serológica y celular de 28 pacientes portadores de un trasplante de órgano sólido frente a 16 pacientes inmunocompetentes tras desarrollar una infección por Covid-19. Los resultados del mismo ponen de manifiesto que la respuesta serológica (IgM/IgG) y la respuesta celular frente a SARS-CoV-2 fue de las mismas características en ambos grupos de población [32]. La principal diferencia se apreció al debut de la infección debido a que en la población trasplantada la tasa de seroconversión de IgG fue más baja (77% vs 100%). Estos hallazgos son muy importantes puesto que los pacientes portadores de un trasplante reciben inmunosupresión crónica dirigida predominantemente a la respuesta inmune adaptativa (LT) [33]. Sin embargo, en este relevante trabajo no se observó correlación entre el número total de linfoctios y la respuesta mediada por LT frente al SARS-CoV-2; lo que ilustra la importancia de no medir únicamente el número total de células sino su función antígeno específica. Por lo tanto, los datos de este estudio reflejan que los pacientes portadores de un trasplante de órgano sólido pueden desarrollar una respuesta inmune adaptativa óptima y sostenida a pesar de recibir inmunosupresión crónica.
TRATAMIENTOS DIRIGIDOS A LA RESPUESTA INFLAMATORIA
Corticoesteroides
El tratamiento precoz con esteroides puede ser crucial para controlar los estadios tempranos del daño pulmonar inmunomediado en la enfermedad por Covid-19. Las experiencias acumuladas con los coronavirus previos no recomiendan altas dosis de corticoesteroides por incrementar el riesgo de infecciones, por sus potenciales complicaciones a largo plazo y en especial por prolongar la replicación viral [34] .
El uso de dexametasona a dosis moderadas representa la única alternativa que ha demostrado disminuir la mortalidad en población general con Covid-19. El potencial beneficio de los esteroides a dosis altas no se ha confirmado aún en el paciente renal y tampoco en población general [35]. El ensayo RECOVERY (Randomized Evaluation of Covid-19 Therapy) demostró que el tratamiento con dexametasona reducía la mortalidad a los 28 días entre los pacientes que precisaban oxigenoterapia o ventilación mecánica (VM) sin evidenciarse beneficio sobre los pacientes que no necesitaban soporte respiratorio [36]. En la población que recibió dexametasona (2014 pacientes), se evidenció una mortalidad global a los 28 días del 22.9% frente al 25.7% en los 4321 pacientes con tratamiento habitual (RR: 0.83; p<0.001). Sin embargo, el mayor beneficio se apreció en los pacientes sometidos a VM con una reducción en la mortalidad de un 12.1% frente a los pacientes que no recibieron dexametasona.
En líneas generales se recomienda el empleo de dexametasona en los pacientes que necesiten oxigenoterapia para mantener una saturación de oxígeno (SatO2) superior al 93%. La dosis recomendada es 6 mg diarios por vía oral (7.2 mg por vía intravenosa) durante un máximo de 10 días (equivalente a 40 mg/día de prednisona y 32 mg/día de 6-metilprednisolona). Se pueden ensayar otras pautas alternativas de 6-metilprednisolona (0.5 mg/kg/12 horas) intravenosa desaconsejándose el empleo de dosis más altas de esteroides.
En resumen, la dexametasona ha demostrado reducir la mortalidad en pacientes hospitalizados con enfermedad pulmonar por Covid-19 y necesidad de oxigenoterapia aunque sigue sin existir una evidencia robusta sobre su beneficio en población trasplantada sometida a inmunosupresión crónica con un potencial incremento de los efectos secundarios asociados a los mismos. Por lo tanto, la decisión final se debe basar en un adecuado equilibrio entre la evolución de la infección por SARS-CoV-2 y el riesgo de infección bacteriana o de otros gérmenes oportunistas.
En consonancia con el potencial beneficio del empleo de esta familia de fármacos, se ha publicado una experiencia muy interesante con la utilización precoz de budesonida inhalada. El estudio se basa en la hipótesis sobre que el uso crónico de esteroides inhalados podría controlar la respuesta inflamatoria excesiva que acontece en los pacientes afectos por SARS-CoV-2. En este ensayo prospectivo y randomizado (1:1) se evidenció que en 146 pacientes con formas leves de la enfermedad el empleo de 1.600 mcg (2 inhalaciones de 400 mcg cada 12 horas) en los primeros 7 días desde el comienzo de la infección redujo la necesidad de atención médica urgente (disminución del RR del 91%) y del tiempo hasta la recuperación [37].
Inhibidores de IL-6
La patogénesis de la enfermedad severa por Covid-19 y su asociación con el síndrome de deficiencia respiratoria aguda (SDRA) se imbrica con un estado hiperinflamatorio que remeda el síndrome de “tormenta citoquímica” observado en pacientes con infección por el virus influenza o en enfermedades inmunomediadas. La IL-6 ejerce un papel protagonista en el estado de hiperinflamación. Es un citoquina con efectos pleiotrópicos secretada por un número abundante de células entre las que destacan los linfocitos, monocitos y fibroblastos. En las formas severas de enfermedad por Covid-19 que desarrollan SDRA las células epiteliales bronquiales segregan IL-6 de manera dosis-dependiente.
Ante la ausencia de tratamientos antivirales que modifiquen claramente el curso evolutivo de la enfermedad, la inmunomodulación ha emergido como el abordaje terapeútico más prometedor en el tratamiento de la enfermedad por Covid-19 [38]. Numerosas terapias inmunomoduladoras se han ensayado para contener esta respuesta inflamatoria deletérea. Una de las aproximaciones más máduras, hasta el momento, incluye el uso fuera de ficha técnica (“off-label”) del anticuerpo monoclonal humanizado frente al receptor de IL-6 denominado tocilizumab; basados en las experiencias previas con pacientes que recibieron terapia quimérica frente al antígeno de la célula T (CART-cells). Estudios no randomizados han mostrado que el tratamiento con tocilizumab en pacientes críticos, tanto en población general como en trasplantada, puede ofrecer algún beneficio [25][39][40][41]. Sin embargo, los estudios randomizados en pacientes hospitalizados con neumonía por SARS-CoV-2 han demostrado que el tocilizumab puede disminuir la progresión de los enfermos hacia la ventilación mecánica pero sin mejorar la supervivencia [42][43][44].
No obstante, dos de los ensayos con mayor número de pacientes como REMAP-CAP (Randomised, Embedded, Multifactorial Adaptive Platform Trial for Community-Adquired Pneumonia) y RECOVERY han comunicado un beneficio sobre la mortalidad del empleo de tocilizumab en determinados grupos de pacientes, incluyendo aquellos que presentaban un rápido deterioro respiratorio asociado al estado hiperinflamatorio. Hay que reseñar que en estos ensayos los enfermos habían recibido con anterioridad tratamiento con dexametasona [45][46].
En general, el empleo de tocilizumab ha quedado reservado como tratamiento de “rescate” en pacientes sin mejoría clínica a pesar de tratamiento con esteroides. En líneas generales se recomienda una única dosis de 8 mg/Kg (máximo 800 mg) aunque se puede realizar un ajuste según el peso total: 800 mg para peso > 90 Kg; 600 mg para 65-90 Kg; 400 mg para 40-65 Kg y 8 mg/Kg para peso < 40 Kg. Hasta el momento, no existe evidencia sobre el potencial beneficio de administrar una segunda dosis de tocilizumab.
Probablemente sea necesario identificar subgrupos de pacientes en los que el tocilizumab pueda ser más beneficioso, entre los que destacan los pacientes más gravemente enfermos.
Son escasos los estudios que han comparado el empleo de tocilizumab frente a esteroides. El beneficio adicional de añadir tocilizumab a los pacientes que están con esteroides o que los hayan recibido con anterioridad ha sido descrito recientemente [47]. Esta cuestión cobra especial relevancia en pacientes de edad avanzada en los que se ha descrito una elevada mortalidad y en los que la terapia inmunomoduladora se podría asociar, por otro lado, con complicaciones graves en forma de superinfecciones. Para responder a este pregunta un reciente y pertinente estudio de López-Medrano et al. pone de manifiesto que el mayor beneficio de la combinación se evidenció en la población con edad igual o superior a 65 años [48]. En dicho estudio retrospectivo se evaluó la mortalidad en el día 14 y 28 de evolución de un grupo de 181 pacientes que recibieron sólo esteroides frente a un grupo de 80 pacientes que recibió la combinación de esteroides con tocilizumab. La combinación se asoció con una disminución significativa de la mortalidad sin apreciarse un incremento de infecciones bacterianas o fúngicas.
Lo que sí se ha objetivado en todos los estudios prospectivos y retrospectivos publicados es que el tocilizumab es un fármaco seguro con pocos efectos secundarios.
En general, se debe evitar el empleo de tocilizumab en pacientes profrundamente inmunodeprimidos, en especial si han recibido otras terapias biológicas inmunomoduladoras. Tampoco debe ser utilizado en pacientes con alteración del perfil hepático (cifras de transaminasas 5 veces sobre el balor basal), en enfermos con alto riesgo de perforación intestinal, en aquellos con infecciones bacterianas, fúngicas o virales no SARS-CoV-2 no controladas y en situaciones de neutropenia (neutrófilos < 500/µL) o trombopenia severas (plaquetas < 50.000/μL).
El empleo de otros anticuerpos monoclonales inhibidores del receptor de IL-6 como sarilumab ha sido también ensayado. En el ensayo REMAP-CAP, 48 pacientes recibieron 400 mg de sarilumab con buenos resultados aunque la escasa evidencia acumulada no recomienda, por el momento, su utilización.
Siltuximab es un anticuerpo monclonal quimérico recombinante de origen murino humanizado, que se une directamente a IL-6. Se ha ensayado con éxito en la enfermedad de Castleman sin que existan aún datos sólidos para su empleo en la infección por SARS-COV-2.
INHIBIR LA REPLICACIÓN VIRAL
La replicación viral puede ser especialmente activa en las fases iniciales de la enfermedad por Covid-19 por lo que el tratamiento antiviral temprano podría ser de gran importancia para evitar la progresión hacia fases hiperinflamatorias que desencadenen un enfermedad crítica y severa. Los fármacos antivirales evitan la entrada del virus a la célula mediante la inhibición del receptor de la enzima convertidora de angiotensina 2 y la proteasa transmembrana serina 2, interfiriendo en la fusión y endocitosis de la membrana viral sobre la célula huesped y mediante su efecto directo sobre la polimerasa viral dependiente de ARN.
Remdesivir
Los resultados del ensayo Solidarity, patrocinado por la Organización Mundial de la Salud (OMS), sobre el empleo de remdesivir frente a placebo en los pacientes con enfermedad por Covid-19 no ha demostrado beneficios en la reducción de la mortalidad [49]. El estudio fue llevado a cabo en 405 hospitales de 30 países por lo que ha sido objeto de críticas por adolecer de un riguroso desarrollo metodológico. El ensayo incluyó 5.451 pacientes (1:1) sin especificar sobre la participación de pacientes portadores de trasplante renal.
El empleo de remdesivir ha demostrado reducir el tiempo hasta la recuperación (11 vs 15 días en el grupo placebo; HR: 1.3; p<0.001) sin ejercer un efecto beneficioso significativo sobre la reducción de la mortalidad (8 vs 11.6%, p= 0.59). Como es conocido, los pacientes con FRA y/o enfermedad renal crónica (ERC) fueron excluidos de estos ensayos por lo que la OMS se ha posicionado recientemente sobre la necesidad de incluir a estos grupos de enfermos [50]. Sin embargo, no se debe menoscabar el hecho de que en las formas severas de Covid-19 se ha descrito una tasa de FRA del 20-40% y que los enfermos con ERC están altamente expuestos con un riesgo incrementado de infección severa con una elevada tasa de mortalidad [51]. En este grupo poblacional el papel del nefrólogo es fundamental para encontrar un equilibrio entre los beneficios y potenciales perjuicios de los tratamientos disponibles sin caer en el nihilismo terapéutico.
El remdesivir es un análogo nucleótido que inhibe la polimerasa del ARN (ácido ribonucleico) viral. Originalmente se desarrolló con la investigación del Ébola. Remdesivir es realmente un profármaco que es metabolizado a nivel hepático a trifosfato de remdesivir por enzimas con actividad hidrolasa. Tras este paso hepático actúa como un análogo de ATP (adenosín trifosfato) que interfiere con la replicación viral de ARN. La vida media plasmática del remdesivir es corta (1-2 horas) mientras que su metabolito activo puede alcanzar las 24 horas con una amplia distribución por la mayoría de los tejidos [52]. Remdesivir trifosfato es un inhibidor débil de las polimerasas de ARN de mamíferos por lo que se considera que tiene un bajo potencial de toxicidad mitocondrial. La solubilidad del remdesivir en agua es limitada de ahí que su administración sea por vía parenteral. Remdesivir y su metabolito activo se aclaran fundamentalmente por vía renal (74%). La farmacocinética del remdesivir no ha sido evaluada en pacientes con deterioro de función renal no recomendádose su uso en pacientes con un filtrado glomerular estimado inferior a 30 ml/min por ausencia de datos de seguridad. Pese a ello, en los ensayos clínicos con remdesivir no se han descrito efectos nefrotóxicos reseñables [53]. El remdesivir intravenoso contiene un oligosacárido cíclico (sulfobutil éter-b-ciclodextrina) que es eliminado fundmentalmente mediante filtrado glomerular. Estudios en animales han demostrado necrosis hepática y daño tubular por injuria mitocondrial directa sobre las células tubulares así como por obstrucción intratubular pero con dosis 50-100 veces superiores a las empleadas en la práctica clínica y con tiempos de exposición de al menos 5-10 días [54].
Este metabolito es efizcamente eliminado mediante técnicas de sustitución renal continuas y con una sesión de hemodiálisis de 4 horas se elimina aproximadamente el 50% del metabolito, situación que se considera segura [55]. Por lo tanto, en los pacientes en hemodiálisis se suele considerar que el beneficio de la terapia es superior a sus riesgos.
El empleo de remdesivir debe ser lo más tempranamente posible desde el inicio de los síntomas (< 7 días). Por sus características farmacocinéticas se emplea por vía parenteral a una dosis de 200 mg el primer día para continuar con 100 mg al día durante 5-10 días (> 40 Kg). Se indica fundamentalmente a pacientes con SatO2 < 94%, en pacientes con necesidad de oxigenoterapia, ventilación mecánica (VM) o membrana de oxigenación extracorpórea.
INMUNIDAD PASIVA
La inmunidad humoral es una pieza clave en la respuesta inmune frente a SARS-CoV-2 y su maduración suele acontecer algunas semanas tras la infección. Los anticuerpos pueden modular la enfermedad aguda viral mediante un efecto viral directo (unión y neutralización del virus libre) y mediante mecanismos antivirales indirectos a través de la cascada del complemento, la fagocitosis y la citotoxicidad celular [56].
Plasma convalescente
El plasma convalescente ha sido utilizado hace ya más de un siglo como inmunoterapia pasiva para el virus influenza y más recientemente para el SARS-CoV [57].
Desde un punto de vista fisiopatológico, el empleo de plasma convalescente procedente de donantes que se han recuperado de la enfermedad por Covid-19, podría ser una de las terapias con una lógica más sólida y consistente. Este plasma puede contener títulos diferentes de anticuerpos frente a SARS-CoV-2 que impidan la replicación viral y por ende modifiquen la respuesta inflamatoria [58]. Sin embargo, los resultados de los ensayos clínicos han sido muy dispares abriendo un debate sobre en qué grupos poblaciones se deben emplear, en qué momento evolutivo de la enfermedad y sobre todo qué caracteríosticas debe tener el plasma para conseguir una mayor respuesta. En este sentido, estudios recientes han demostrado que el título de anticuerpos frente a SARS-CoV-2 es fundamental para obtener una respuesta satisfactoria [59]. De esta manera, el empleo de plasma convalescente con títulos bajos de anticuerpos está contraindicado. El empleo de plasma convalescente con títulos altos de anticuerpos no está autorizado en pacientes hospitalizados con necesidad de VM y en los enfermos sin necesidad de VM sólo se podrían emplear dentro de un ensayo clínico. En pacientes no hospitalizados tampoco estaría autorizado el uso de plasma. Los resultados del reciente estudio RECOVERY llevado a cabo en 11.558 pacientes (5.763 pacientes con terapia habitual vs 5.795 pacientes con plasma convalescente a títulos altos) han demostrado que la mortalidad al día 28, analizado bajo la intención de tratar, fue del 24% en ambos grupos. En el análisis secundario, en el que se incluyó un objetivo secundario compuesto constituido por la necesidad de VM más la mortalidad, tampoco arrojó diferencias significativas (29% en ambos grupos) [60].
En pacientes con inmunodeficiencias humorales primarias o secundarias, entre los que se incluyen los enfermos con un trasplante renal; se han descrito casos clínicos, series de casos y estudios retrospectivos casos-control en los que se sugiere un benificio del empleo de plasma convalescente [61]. Sin embargo, se necesitan ensayos clínicos bien diseñados, randomizados y con un alto poder estadístico para generar evidencia específica sobre el papel del plasma convalescente en estos grupos de población. Pese a todo, y ante la dificultad del desarrollo de estos ensayos, el empleo de plasma convalescente con títulos elevados está autorizado para pacientes hospitalizados con alteración de la inmunidad.
Inmunoglobulinas
- Específicas frente a SARS-CoV-2
El empleo de inmunoglobulinas específicas frente a virus, como en el caso del citomegalovirus, ha demostrado eficacia y seguridad aunque su utilización ha decaído sustancialmente en paralelo al desarrollo de fármacos antivirales más específicos y eficaces. En el momento actual no existen datos suficientes para poder recomendar el uso de inmunoglobulinas específicas frente a SARS-CoV-2 en la enfermedad por Covid-19 aunque sí hay ensayos clínicos en desarrollo que pueden aportar información relevante en un futuro próximo.
- No específicas frente SARS-CoV-2
Las inmunoglobulinas humanas inespecífica (IGIV) presentan, en líneas generales, un buen perfil de seguridad con un potencial efecto modulador de la respuesta inflamatoria. Su mecanismo de acción en la Covid-19 no se ha esclarecido y no hay datos suficientes sobre su empleo. En un estudio retrospectivo llevado a cabo en 8 hospitales de China durante la primera ola, se comparó la mortalidad al día 28 entre un grupo de 174 pacientes que recibieron IGIV frente a otro grupo de 151 pacientes que no fueron tratados, sin encontrarse diferencias significativas entre ambos grupos aunque el grupo tratado cumplía criterios de mayor gravedad clínica [62].
En pacientes portadores de un trasplante renal se han comunicado experiencias positivas en casos clínicos aislados [63][64].
En este grupo poblacional podría ser una alternativa terapéutica interesante para poder disminuir el tratamiento inmunosupresor con mayor seguridad pero su eficacia real no ha sido demostrada.
Vacunas
De acuerdo a los datos de la OMS, actualmente existen al menos 56 vacunas frente al SARS-CoV-2 en desarrollo clínico y 166 en desarrollo preclínico [65]. En España ya han sido aprobadas tres de ellas para su aplicación en la población general: BNT162b2 (Pfizer-BioNTech®), mRNA-1273 (Moderna®) y ChAdOx1 nCoV-19 (AstraZeneca®). Es importante destacar, que ninguno de los ensayos clínicos donde se han probado dichas vacunas han incluido pacientes trasplantados renales ni inmunodeprimidos en general, por tanto, la evidencia sobre su eficacia y seguridad en estas poblaciones es muy limitada. Un estudio que incluyó 187 trasplantados de órgano sólido (52% riñón/3% páncreas-riñón), que recibieron la primera dosis del esquema de vacunación contra el SARS-CoV-2 (50% Pfizer-BioNTech®/50% Moderna®), encontró que a la semana de la vacunación no había problemas graves de seguridad, infecciones por SARS-CoV-2 ni episodios de rechazo [66]. Los principales efectos adversos comunicados fueron dolor leve en el sitio de inoculación (61%), astenia (38%) y cefalea (32%), mientras que las reacciones sistémicas (fiebre, escalofríos) se observaron en pocos casos (4%-9%). Otro estudio reciente en 436 receptores de trasplante de órgano sólido (50% riñón) estudió la respuesta humoral tras haber recibido la primera dosis de la vacuna (52% Pfizer-BioNTech®/48% Moderna®). Después de una mediana de seguimiento de 20 días, solamente el 17% de los pacientes presentaba anticuerpos (anti-S1 o anti-dominio de unión al receptor) detectables [67]. Los pacientes de edad más avanzada, los que recibían tratamiento de mantenimiento con antimetabolitos y aquellos que recibieron la vacuna Pfizer-BioNTech® fueron menos propensos a desarrollar respuesta. Tras una mediana de seguimiento de 29 días, el 54% de los pacientes desarrollaron anticuerpos. Es importante considerar que en ambos estudios el tiempo de seguimiento fue corto y no se evaluó en ningún caso la respuesta inmune celular.
En otros dos trabajos se ha estudiado también la respuesta humoral de 308 y 136 pacientes portadores de un trasplante renal tras recibir las dos dosis de la vacuna BNT162b2 [68][69]. En el primero de ellos, un 36.4% de los pacientes desarrollaron anticuerpos anti-S (“spike”) tras 2-4 semanas de seguimiento siendo una edad menor, un filtrado glomerular mayor y una inmunosupresión más moderada (menores niveles de calcineurínicos y de antimetabolitos) los factores favorecedores de su desarrollo. En el segundo estudio Grupper et al. demostraron que tan solo el 37.5% de los 136 pacientes trasplantados vacunados desarrollaron anticuerpos siendo la edad avanzada, las dosis elevadas de esteroides y el mantenimiento de la triple terapia inmunosupresora los factores relacionados con el no desarrollo de respuesta humoral específica.
En un nuevo estudio desarrollado en el Hospital Clinic de Barcelona se ahonda más aún analizando la respuesta humoral y celular en un grupo de 148 trasplantados renales (133 trasplantes renales y 15 transplantes combinados páncreás-riñón) que han recibido las dos dosis de la vacuna mRNA-1273 (Moderna) [70]. De estos 148 pacientes, 117 no habían tenido contacto previo con el SARS-CoV-2. En este grupo de enfermos se estudió la respuesta humoral mediante el desarrollo de anticuerpos frente a la proteína S (IgG/IgM) y la respuesta celular frente a la proteína S y N (nucleocápside) mediante la técnica de ELISpot. La respuesta humoral (anticuerpos frente a proteína S) se observó en tan sólo el 29.9% de los pacientes estudiados aunque el porcentaje de pacientes que desarrollaron respuesta humoral y/o celular ascendió al 65%. En 23 pacientes (19.6%) se pudo constatar una adecuada respuesta humoral y celular. Sin embargo, en 41 pacientes no se evidenció ni respuesta humoral ni celular considerándose enfermos “no-respondedores” a la vacuna. En el estudio multivariable que analizó la ausencia de respuesta a la vacuna, la presencia de diabetes y el haber recibido anticuerpos anti-linfocito durante el último año fueron los factores asociados significativamente con la variable principal de estudio. Pese a que la tasa de respuesta a la vacunación en población trasplantada sigue siendo pobre, en este estudio se resalta que el desarrollo de respuesta celular en ausencia de anticuerpos frente a la proteína S puede significar que los pacientes se encuentren protegidos frente a SARS-CoV-2. Los factores asociados a la ausencia de respuesta celular fueron nuevamente la diabetes, la presencia de linfopenia y un filtrado glomerular reducido (< 60 ml/min/1.73 m2) mientras que la falta de respuesta humoral se relacionó solamente con la inmunosupresión basal.
En una reciente serie francesa, se han descrito 55 pacientes trasplantados renales (3 con trasplante combinado páncreas-riñón) que han desarrollado enfermedad por Covid-19 pese a haber recibido las dos dosis de vacunas de ARN mensajero [71]. La mediana de la edad de los pacientes fue de 60 años con el inicio de los síntomas a los 22 días de la vacunación. El 27% (15 pacientes) requirieron hospitalización falleciendo el 5.5% (3 pacientes) de los ingresados. En 25 pacientes se realizó estudio serológico observando que solamente un paciente desarrolló anticuerpos contra la proteína S a títulos muy bajos mientras que en los 24 restantes no se identificó el desarrollo de los mismos. Este inquietante estudio abre un nuevo debate sobre la pobre respuesta humoral y una probable insuficiente respuesta celular en los pacientes portadores de un trasplante renal tras haber recibido un esquema de vacunación correcta. El debate, por lo tanto, debe ir encaminado hacia la necesidad de un seguimiento serológico estricto en este grupo de población, continuar manteniendo medidas rigurosas de protección y la búsqueda de esquemas de vacunación más eficaces.
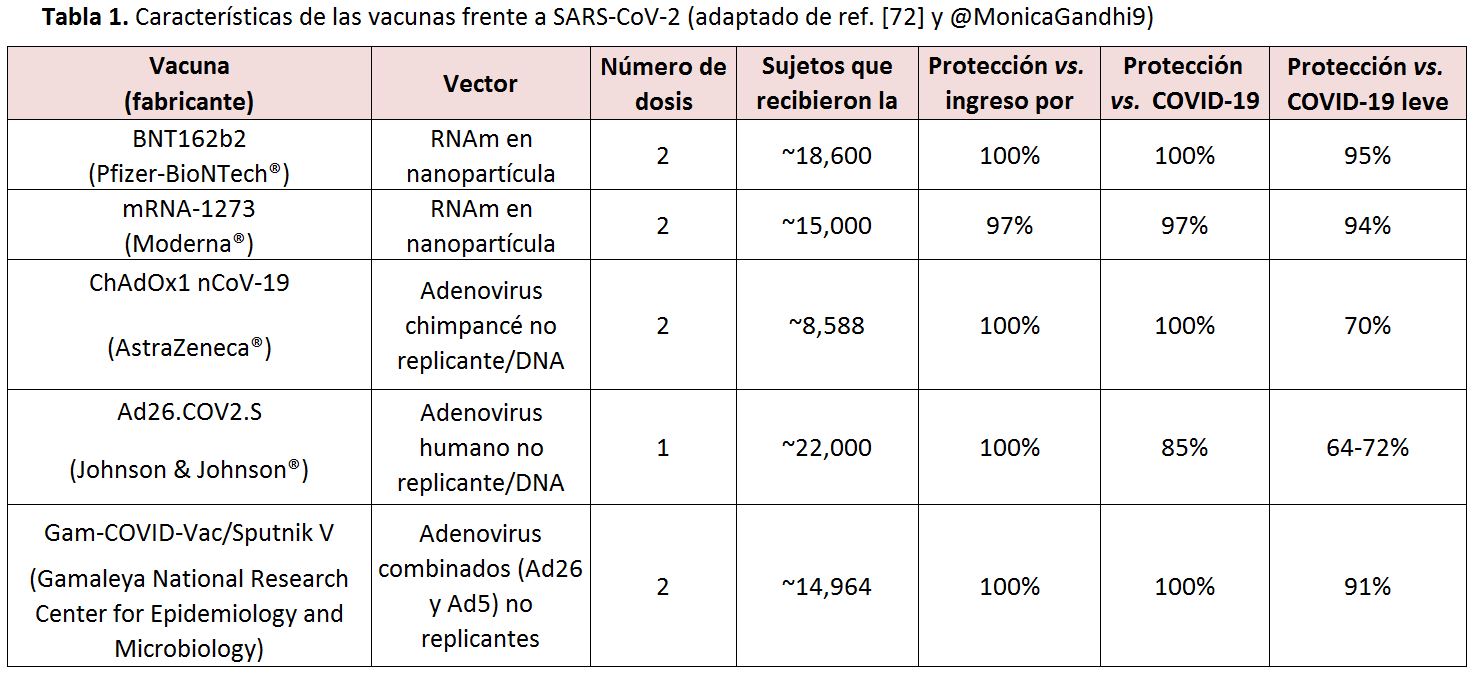
En la (Tabla 1) se presentan las principales características de las vacunas disponibles contra SARS-CoV-2 (o cercanas a ser aprobadas para su uso en Europa) [72].
Epílogo
A pesar de los importantes avances realizdos en los últimos 15 meses, aún quedan muchas preguntas e incógnitas por resolver. Un conocimiento aún más profundo de la patogenia de la enfermedad permitirá tratamientos más dirigidos. El desarrollo de antivirales específicos puede ser la esperanza para conseguir la curación completa de la enfermedad. El impresionante desarrollo tecnológico de las vacunas ha permitido la contención de la pandemia pero los trasplantados renales continúan siendo una población muy vulnerable en la que hay que seguir estimulando el desarrollo de estudios prospectivos randomizados rigurosos. Las tasas de inmunizacion comunicadas hasta el momento en este grupo de población, abren nuevas líneas de debate y de investigación.
En esta revisión hemos intentado exponer los tratamientos disponibles y ensayados hasta el momento, haciendo hincapié en que en muchas ocasiones no se han estudiado sobre la población objeto de este trabajo. Aún así, es muy probable que todos ellos constituyan el telar sobre el que se tejerán e hilvanarán los tratamientos venideros.