Vacunas SARS-COV2 marzo 2021
Todavía estamos en medio de una pandemia mortal y por el momento, hay escasez de vacunas autorizadas. Pero algo comienza lentamente a moverse con resultados espectaculares, pues todas las vacunas autorizadas previenen la hospitalización por Covid en el 100% de los casos. En la prevención de la enfermedad leve hay que considerar que las diferencias pudieran estar en relación a estudios realizados con nuevas variantes porque no es comparable un ensayo clínico que se lleva a cabo durante el pico de la tercera ola actual, con uno que reclutó a pacientes a mediados de julio del año pasado.
En una carrera sin precedentes, se han conseguido vacunas efectivas que protegen contra el Covid-19. Nunca antes se había desarrollado una vacuna con tanta rapidez, y mucho menos preparada para un uso generalizado. Hay por el momento 255 vacunas en desarrollo, de las que 73 están en fase de ensayos clínicos. Varias han sido aprobadas por los reguladores para uso de emergencia y ya se ha demostrado que estas vacunas pueden proteger contra Covid-19 tanto en EE. UU., Reino Unido, Israel Alemania, China Rusia y empezamos a observarlo en España.
La verdad es que no sabemos aún si el virus se volverá endémico, recurrente año tras año o finalmente se controlará. Tampoco si previene, además de la enfermedad, también la infección. Y además, el ritmo de vacunación es lento, con intereses económicos y distribución irregular. Esta lentitud da paso a la aparición de nuevas olas (estamos esperando a principios de Abril la cuarta ola) y a la aparición de mutaciones (Reino Unido, Sudáfrica y Brasil, entre otras) que pudieran dificultar la eficacia de las actuales vacunas.
Tipos de vacunas según su mecanismo de acción
Se están desarrollando diversos tipos de posibles vacunas contra la Covid-19, entre ellas:
Vacunas con ARN y ADN: un enfoque pionero que utiliza ARN o ADN genéticamente modificados para generar una proteína que por sí sola desencadena una respuesta inmunitaria.
Vacunas con vectores víricos: utilizan un virus genéticamente modificado que no causa la enfermedad, pero da lugar a proteínas coronavíricas que inducen una respuesta inmunitaria.
Vacunas basadas en proteínas: utilizan fragmentos inocuos de proteínas o estructuras proteínicas que imitan el virus causante de la Covid-19 con el fin de generar una respuesta inmunitaria.
Vacunas con virus inactivados o atenuados: utilizan un virus previamente inactivado o atenuado, de modo que no provoca la enfermedad, pero aun así genera una respuesta inmunitaria.
Vacunas contra Covid-19 en la práctica clínica actual
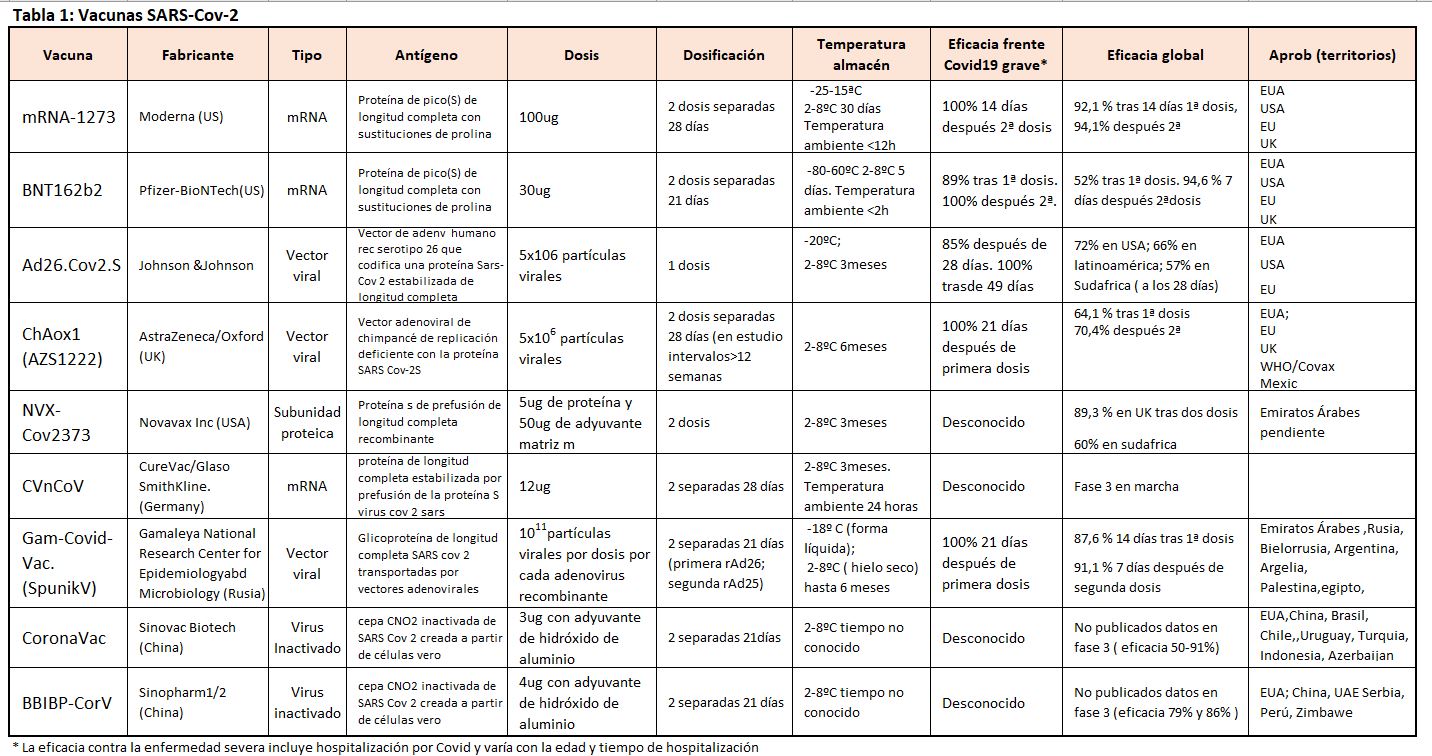
Una lista de estas vacunas puede verse en la (Tabla 1) [1]. Vamos a explicar aquellas que se aplican o lo harán próximamente
Moderna
Se trata de una vacuna de ARN. Las instrucciones genéticas para la proteína de pico de coronavirus están codificadas en ARNm, entregado a través de nanopartículas lipídicas. Dentro de la célula, es en el ribosoma donde se codifica la proteína de pico que llega a la superficie celular para producir la respuesta inmunitaria. Ese ARN mensajero desaparece en horas.
La vacuna pasó de ser un diseño por computadora en enero a un estudio en humanos en solo tres meses, lo que convirtió a Moderna en la primera compañía estadounidense en llegar a ese punto.
El estudio de Fase 3 en mayores de 18 años arrojó resultados muy positivos que indicaron que la vacuna tenía un 94% de efectividad en la prevención de Covid-19, con 100% para enfermedad severa, y era segura y sin efectos secundarios [2]. El 18 de diciembre, la FDA otorgó la autorización para su administración. Ya se han administrado varios millones de vacunas con eficacia y seguridad demostradas y comienza a verse un efecto de control de la enfermedad.
Los científicos relacionados con Moderna han podido establecer en pruebas de laboratorio que las mutaciones en la variante del Reino Unido tienen poco o ningún efecto. Pero la variante de Sudáfrica tuvo una respuesta inmune más débil. Sin embargo, aún no está claro si ello comprometerá la protección. Moderna planea estudiar si una segunda inyección de refuerzo podría mejorar la eficacia y ya está desarrollando una vacuna específica para diferentes variantes.
BioNTech, Pfizer
También es de RNA mensajero. Es el resultado de un proyecto de investigación en Mainz, Alemania. BioNTech comenzó a trabajar en una vacuna de ARNm para el coronavirus desde el principio y acordó asociarse con Pfizer a mediados de marzo. Los estudios en fase 3 demostraron seguridad y eficacia (95% para enfermedad y 100% para enfermedad grave) similares a Moderna [3] y fue aprobada por la FDA el 11 de diciembre y por la EMA diez días después.
Ahora, visto que la variedad sudafricana no es tan sensible, también se está evaluando una segunda inyección de refuerzo y una vacuna específica para nuevas variantes.
Con la finalidad de aumentar su producción, Pfizer y BioNTech han asegurado la ayuda de Sanofi, Novartis y Merck KGaA para producir y llenar viales de su inyección.
Universidad de Oxford, AstraZeneca
Se basa en un Vector viral no replicante, secuencia de ADN para la proteína de pico de coronavirus, transportada a través de un vector viral de chimpancé.
Los investigadores ingleses llevaban años trabajando en el MERS y rápidamente iniciaron los estudios para Sars-Cov 2. Es cierto que tuvieron que interrumpir el trabajo porque un participante en el estudio del Reino Unido se enfermó con una mielitis transversa, una enfermedad neurológica inexplicable. Tras revisiones, prosiguió con los estudios . Pero hubo algunos problemas añadidos a la hora de la interpretación de los resultados. A fines de noviembre, AstraZeneca compartió datos preliminares de estudios en el Reino Unido y Brasil [4] que muestran que su vacuna podría proteger contra Covid-19. Sin embargo, los resultados positivos fueron confusos, mostrando tasas de protección dramáticamente diferentes entre un grupo más grande que recibió dos dosis completas de la inyección y un grupo más pequeño que recibió media dosis y luego una dosis completa. Además, la mitad de la dosis fue el resultado de un error de fabricación, reconoció AstraZeneca más tarde
No obstante, el regulador de medicamentos del Reino Unido aprobó la inyección aproximadamente un mes después, autorizando el régimen de dos dosis completas administrado a la mayoría de los participantes en los estudios realizados en el Reino Unido y Brasil. La Agencia Europea de Medicamentos siguió a finales de enero con una autorización condicional.
No ha sido aprobada aún por la FDA pendiente de más estudios. Mientras tanto, AstraZeneca y Oxford han compartido otros resultados. Un análisis preliminar indicó que la inyección puede ralentizar la transmisión del virus, aunque no está claro hasta qué punto. Otro descubrió que la vacuna era protectora, aunque un poco menos efectiva, contra la variante contagiosa del Reino Unido. También, se ha visto una inmunización mucho más intensa 3 meses después de la primera inyección, mejor que si se recibe a las 4 semanas. Un estudio escoces en vida real de la vacuna de AstraZeneca, ChAdOx1, reduce en un 94% la hospitalización por Covid-19 en los 28-34 días posteriores a la vacunación.
Los resultados de los un análisis combinado de los ensayos clínicos en fase II/III en Reino Unido, Brasil y Sudáfrica publicados el pasado 19 de febrero en The Lancet [5] muestran que:
Tras la primera dosis (> 22 días), se muestra una eficacia de la vacuna del 76% manteniendo la protección hasta la segunda dosis.
La eficacia tras la segunda dosis aumenta hasta un 82% cuando la segunda dosis se administra con un intervalo entre dosis de 12 semanas o más.
La vacuna de AstraZeneca y Oxford se considera importante para los esfuerzos de inmunización mundial, ya que se puede distribuir y almacenar más fácilmente. AstraZeneca también se ha comprometido a vender dosis más baratas que otras farmacéuticas y espera producir una mayor cantidad de dosis, si bien hay un conflicto en este momento con la Unión Europea por falta en su compromiso de entrega de las vacunas acordadas. Inicialmente, varios países europeos entre los que se encuentran Alemania y España, consideraron su autorización para pacientes de edades inferior a 65 y 55 años respectivamente. Datos de práctica real en Escocia demuestran su efectividad y seguridad en pacientes mayores de 65 años.
Johnson y Johnson (J&J)
Se basa en un Vector viral no replicante, secuencia de ADN para la proteína de pico de coronavirus, entregada a través del vector de adenovirus tipo 26.
A finales de enero de 2020, la farmacéutica anunció planes para desarrollar una vacuna utilizando la misma tecnología que sustenta otras vacunas experimentales de la farmacéutica. Tuvo ayuda económica del gobierno de EE. UU a través de la Operación Warp Speed. El estudio inicial comenzó a fines de julio y dos meses después, el 23 de septiembre, J&J inició un estudio global de fase 3 que ha sido publicado [6] y aprobado a finales de febrero 2021 por la FDA con autorización de emergencia. Cuando escribimos esto está pendiente en unos días de su aprobación en Europa.
El estudio en fase 3 mostró que una sola dosis de la vacuna de J&J tenía un 66% de efectividad para prevenir el Covid-19. La eficacia fue mayor entre los participantes reclutados en los EE. UU, pero menor en los voluntarios en América Latina y Sudáfrica, donde prevalecen las variantes nuevas y más virulentas del SARS-CoV-2. La eficacia contra el Covid severo fue del 85% a los 28 días y 100% después de 49 días
La ventaja de esta vacuna es que puede administrarse mediante una sola inyección y enviarse a la temperatura normal del refrigerador.
Novavax
Basada en una proteína derivada de coronavirus producida en líneas celulares de insectos, extraída y administrada junto con un adyuvante.
El 28 de enero, la empresa de biotecnología con sede en Maryland informó los resultados de un ensayo de 15.000 voluntarios en el Reino Unido, que indicaba que su vacuna contra el coronavirus era aproximadamente un 90% efectiva para prevenir el Covid-19 sintomático en comparación con el placebo. Los datos formarán parte de las solicitudes de aprobación en varios países. Las revisiones continuas en los EE. UU., Reino Unido, Europa, Canadá y otros lugares comenzaron a principios de febrero. La menor eficacia, aunque de un número menor de casos, sugiere que la protección de la vacuna es más débil contra la variante que se encontró por primera vez en Sudáfrica.
CureVac, Glaxo SmithKline (Alemania)
Basada en ARN mensajero. Las instrucciones genéticas para la proteína de pico de coronavirus están codificadas en ARNm, entregado a través de nanopartículas lipídicas.
Los estudios de Fase 2b / 3 están programados para inscribir a 36,500 voluntarios en Europa y América del Sur. El ensayo probará un régimen de dos dosis, con un intervalo de cuatro semanas. Se espera tener datos iniciales para fines del primer trimestre de 2021.
El programa de CureVac ha recibido el apoyo, además del gobierno alemán, de dos grandes farmacéuticas. Primero, la biotecnología se asoció con Bayer para un mayor desarrollo y, si los ensayos tienen éxito, el suministro de su vacuna. Luego, GlaxoSmithKline acordó ayudar a producir 100 millones de dosis más de la inyección en 2021, así como desarrollar conjuntamente versiones de segunda generación para combatir futuras variantes del coronavirus.
Sputnik5, Instituto de Investigaciones Gamaleya (Rusia)
Basada en un vector viral no replicante. Secuencia de ADN para la proteína de pico de coronavirus entregada a través de vectores de adenovirus tipo 5 y tipo 26.
La vacuna rusa se aprobó muy precipitadamente con solo dos pequeños ensayos, en solo 76 voluntarios. Los datos se publicaron el 4 de septiembre en The Lancet, y muestran que la vacuna de Gamaleya estimuló una respuesta inmune igual a la de los pacientes que se han recuperado de infecciones por coronavirus. El ensayo en fase 3 se inició después de comenzar la distribución de la inyección. El 14 de diciembre, Gamaleya publicó datos detallados de ese estudio, con 22.714 voluntarios que recibieron la inyección o un placebo. Hubo 62 casos de Covid-19 en pacientes que recibieron la inyección simulada y 16 en los que recibieron la vacuna. La eficacia de la vacuna reportada fue del 91,6% [8].
Los datos provisionales del ensayo de fase 3 de Sputnik V sugieren que un régimen de dos dosis induce los mismos niveles altos de eficacia observados en las vacunas de ARNm desarrolladas por Pfizer / BioNTech y Moderna, y es igualmente eficaz para brindar protección a las personas mayores de 60 años.
Synovac (China)
Vacuna por Virus inactivado. El SARS-CoV-2 se aísla, se expande y luego se hace no infeccioso mediante un tratamiento químico.
Los informes iniciales de datos de un estudio en Brasil sugirieron una gran eficacia, pero los anuncios posteriores pusieron la eficacia general de la inyección en poco más del 50%, apenas superando el listón establecido por los reguladores de todo el mundo. Las revelaciones incompletas aumentaron la confusión sobre la vacuna de Sinovac, particularmente porque los investigadores que estaban realizando estudios en Turquía e Indonesia también informaron resultados diferentes.
Según los informes, la inyección fue aprobada en China a fines de agosto para uso de emergencia en personas con alto riesgo de infección por coronavirus. El 8 de febrero, Sinovac dijo que había obtenido la aprobación de marketing condicional en el país. La vacuna también ha sido autorizada para uso de emergencia en Indonesia, Brasil, Turquía y Chile.
Vacunas y transmisión del virus
Hay estudios previos que han demostrado que la carga viral se ha asociado con las tasas de transmisión y la gravedad de la enfermedad Covid-19. Estudios en Israel con una primera dosis de la vacuna BioNTech/Pfizer BNT162b2 muestran que la cantidad de carga viral del virus Covid-19 en el cuerpo de una persona es significativamente menor si alguien se infecta después de haber sido vacunado, en comparación con las personas que se habían infectado sin recibir la vacuna. Y es posible que con la segunda dosis aun fuera inferior. Una carga viral más baja significa muchas menos posibilidades de transmitir el virus a otra persona.
Variantes virales
Es probable que las variantes de la proteína S que aumentan la cantidad de virus excretado por una persona infectada o que aumentan su afinidad por el receptor ACE2 aumenten la transmisión del virus, un problema importante en el contexto de una pandemia. Además, las mismas alteraciones o similares pueden cambiar la forma de la proteína S y alterar o incluso destruir los sitios de unión de los anticuerpos neutralizantes. Por tanto, por extrapolación, la eficacia de la vacuna podría verse comprometida. Estas "mutaciones de escape" normalmente surgen cuando el virus es sometido a una presión selectiva por anticuerpos que limitan pero no eliminan la replicación viral. En estas condiciones, el virus podría encontrar una manera de escapar de esta presión y restaurar su capacidad para reproducirse de manera más eficiente [10].
La primera variante fue la D614 G que aumentó la eficiencia de replicación y la transmisibilidad del virus. Pero, no escapó al reconocimiento de anticuerpos. En agosto de 2020, otra variante comenzó a extenderse en el Reino Unido, más formalmente conocida como B.1.1.7. Esta variante ahora se ha detectado en muchos países, incluido EE. UU. El cambio de secuencia clave en la proteína S se llama N501Y, que nuevamente parece aumentar la transmisibilidad del SARS-CoV-2. Estudios recientes de personas que recibieron vacunas mRNA han demostrado que su suero es efectivo para neutralizar el virus.
Pero hay otra variante más preocupante identificada en Sudáfrica, la variante N501Y.V2 (o B.1.351) muy similar a otra identificada en Brasil (P.1). La cepa N501Y.V2 tiene muchos más cambios de secuencia que las variantes D614G y B.1.1.7 y esos cambios de secuencia son más preocupantes porque afectan a dianas de los anticuerpos neutralizantes. De hecho, se ha demostrado que los anticuerpos neutralizantes inducidos por la vacuna de ARNm de Moderna son aproximadamente 6 veces menos activos contra la cepa N501Y.V2 (B1.351) [9]. Pero no obstante, la formación de anticuerpos con estas vacunas mRNA es muy intensa, así como la respuesta celular, y pueden ser menos sensibles a los anticuerpos neutralizantes, pero no en una medida que cause un fracaso generalizado de la vacuna. Tendremos información importante cuando se completen varios ensayos de eficacia de la vacuna de fase 3 que se están llevando a cabo en Sudáfrica.
No obstante, los diseños del ARNm y las vacunas de adenovirus pueden ajustarse para adaptarse a los cambios de secuencia clave presentes en las nuevas variantes. Las etapas iniciales de este proceso son bastante sencillas y se pueden lograr rápidamente. Estas nuevas variantes no se propagan por aerosolización, por lo que el uso de mascarillas, el distanciamiento físico y la aplicación del sentido común pueden prevenir su propagación.
Efecto de la vacunación Covid-19 en la vida real
Aunque los efectos de la inmunización tardarán en evidenciarse, ya estamos observando los primeros datos positivos, concretamente en Israel, el país más avanzado del mundo con esta práctica. Unos primeros datos sugieren que las personas vacunadas allí tenían alrededor de un tercio menos de probabilidades de dar positivo en la prueba del SARS-CoV-2 que las personas que no habían recibido una inyección. En un análisis preliminar de 200.000 personas mayores de 60 años que recibieron la vacuna Pfizer-BioNTech, en comparación con un grupo de 200.000 que no la recibieron, los investigadores encontraron que las posibilidades de dar positivo en la prueba del virus eran un 33% más bajas. dos semanas después de la primera inyección [11].
A la hora que escribimos este artículo, aparecen en el NEJM los primeros resultados en Israel de los efectos de la vacuna Pfizer en dos grupos de la vida real [12]. Cada grupo de estudio incluyó a 596.618 personas. La efectividad estimada de la vacuna para los resultados del estudio en los días 14 a 20 después de la primera dosis y a los 7 o más días después de la segunda dosis fue la siguiente:
Infección documentada, 46% (intervalo de confianza [IC] del 95%, 40 a 51) y 92% (IC del 95%, 88 a 95).
Covid-19 sintomático, 57% (IC del 95%, 50 a 63) y 94% (IC del 95%, 87 a 98)
Hospitalización, 74% (IC del 95%, 56 a 86) y 87% (IC del 95%, 55 a 100)
Enfermedad grave, 62% (IC del 95%, 39 a 80) y 92% (IC del 95%, 75 a 100), respectivamente.
Prevenir la muerte por Covid-19 fue del 72% (IC del 95%, 19 a 100) durante los días 14 a 20 después de la primera dosis.
La efectividad estimada en subpoblaciones específicas evaluadas para infección documentada y Covid-19 sintomático fue consistente en todos los grupos de edad.
Todo va cambiando en tiempo real y falta tiempo para saber si las vacunas son comparables, si serán eficaces ante las nuevas mutaciones, si controlaran la pandemia y si nos ayudarán con las medidas sanitarias a volver a la vida anterior a Enero de 2020. Mientras tanto, como la vacunación va más lenta que lo deseado, las medidas sanitarias de mascarillas, distancias, ventilación e higiene de manos han demostrado su eficacia.
Webs y artículos de revisión recomendados:
CDC COVID-19 Vaccination https://www.cdc.gov/vaccines/covid-19/index.html
OMS Enfermedad por el coronavirus (COVID-19): Vacunas https://www.who.int/es/news-room/q-a-detail/coronavirus-disease-(covid19)vaccines?adgroupsurvey={adgroupsurvey}&gclid=Cj0KCQiAhP2BBhDdARIsAJEzXlFQFyDlX5VUPjIQsHhQybDG37AKPqzQe6LNKzRbKBpl5NbF66sUOsaAgfsEALw_wcB
Vacuna Covid-19 Ministerio de Sanidad España https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/vacunaCovid19.htm
The race for coronavirus vaccine. Nature https://media.nature.com/original/magazine-assets/d41586-020-01221-y/d41586-020-01221-y.pdf
Aída Edith Sterin Prync Vacunas para SARS-CoV-2, diferentes estrategias de los desarrollos en curso Rev. Hosp. Ital. B.Aires 2020; 40(1): 1-12. https://www1.hospitalitaliano.org.ar/multimedia/archivos/noticias_attachs/47/documentos/107082_HI13-9-20-Sterin-B.pdf